-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Biologické účinky ionizujícího záření
Biological effects of ionizing radiation
Ionizing radiation refers to the flow of material particles or photons of electromagnetic radiation that can ionize atoms of the environment through which it passes. At the cellular level, damage can be manifested by cell death or changing their cytogenetic information. These events can lead to adverse tissue reactions (deterministic effects) in which manifestations depend on exceeding the dose threshold, or to the stochastic effects, when the probability of damage increases with the dose. This article briefly summarizes these effects on the human body.
Keywords:
Ionizing radiation – biological effect – DNA damage – tissue reaction – stochastic effect
Autoři: Renata Havránková 1,2
Působiště autorů: Katedra zdravotnických oborů a ochrany obyvatelstva Fakulty biomedicínského inženýrství ČVUT v Praze 1; Ústav radiologie, toxikologie a ochrany obyvatelstva Zdravotně sociální fakulty JU v Českých Budějovicích 2
Vyšlo v časopise: Čas. Lék. čes. 2020; 159: 258-260
Kategorie: Přehledový článek
Souhrn
Ionizujícím zářením označujeme tok hmotných částic nebo fotonů elektromagnetického záření, jež mají schopnost ionizovat atomy prostředí, kterým procházejí. Na buněčné úrovni se poškození může projevit smrtí buňky či změnou její cytogenetické informace. Tyto děje mohou vést k nepříznivých tkáňovým reakcím (deterministickým účinkům), u kterých jsou projevy závislé na překročení dávkového prahu, nebo ke vzniku stochastických účinků, u nichž s dávkou stoupá pravděpodobnost poškození. Článek krátce shrnuje tyto účinky na lidský organismus.
Klíčová slova:
ionizující záření – biologický účinek – poškození DNA – tkáňová reakce – stochastický účinek
ÚVOD
Interakce ionizujícího záření s živým organismem se řídí stejnými fyzikálními zákony jako u hmoty neživé, tj. přenosem energie záření na atomy a molekuly biologického systému. I v ozářených buňkách tedy nejprve dochází k ionizaci a excitaci atomů. Specifikem živých organismů je jejich biochemická a biologická odpověď. Již samotný pojem „ionizující záření“ napovídá, že jde o záření, jehož kvanta mají dostatečnou energii k ionizaci atomů, tj. odtržení elektronů z jejich elektronového obalu. Ve vodném prostředí (cytoplazmě) je k tomu zapotřebí minimálně 33 eV, což odpovídá vlnovým délkám kratším, než přísluší ultrafialovému záření (přibližně tedy < 40 nm) (1).
PŮSOBENÍ IONIZUJÍCÍHO ZÁŘENÍ NA MOLEKULÁRNÍ ÚROVNI
Poškození způsobené ionizujícím zářením je vícestupňový proces. Výchozím bodem je přímé či nepřímé působení ionizujícího záření na molekuly v průběhu fyzikální fáze, která trvá velmi krátkou dobu, 10–24 až 10–14 sekundy. Jedná se o období, kdy atomy a molekuly organismu absorbují energii záření. Následně, ve fyzikálně-chemické fázi (10–12 sekundy do 10–10), vznikají volné radikály a další reaktivní agens. Ionty vzniklé během chemické fáze, radikály a další produkty reagují s biologicky důležitými molekulami (DNA, RNA, proteiny), mění jejich složení a funkci. Následně přecházejí do fáze biologické, kdy molekulární změny v biologicky důležitých látkách (chromatinu, enzymech) mohou vyústit ve funkční a morfologické změny v buňkách, v orgánech, organismu jako celku. Tyto změny mohou nastat během několika minut, ale i za desítky let (2).
Ionizuje-li záření přímo biomolekuly, čímž je poškozuje, mluvíme o tzv. přímém účinku ionizujícího záření. Biomolekuly mohou být v tomto případě ionizovány samotným primárním zářením nebo sekundárními produkty jeho interakce s hmotou, zejména tzv. delta elektrony vyraženými z okolních molekul. Přijetí kvanta záření biomolekulou a její ionizace vede následně k chemické změně a případně i ovlivnění biologické aktivity této biomolekuly (1). Biologické systémy obvykle obsahují vysoké procento vody, a značná část energie záření se proto absorbuje ve vodě. Radiolýzou vody vznikají vysoce reaktivní produkty, jako hydroxylový radikál OH●, vodíkový radikál H●, hydratovaný elektron eaq a v přítomnosti kyslíku také značné množství peroxidu vodíku H2O2. Všechny tyto produkty mohou vyvolávat další sekundární reakce s biologickými molekulami, a mluvíme proto o nepřímém účinku záření (3).
V přítomnosti kyslíku se účinek radikálů na biomolekuly zvyšuje. Ukazuje se, že kyslík reaguje s těmi místy, která byla zasažena radikály, a tím zvyšuje míru poškození. Tento jev označujeme jako kyslíkový efekt. Je důležitý pro radioterapii, protože nádory často obsahují oblasti, které jsou hypoxické (mají nízkou koncentraci kyslíku) následkem sníženého zásobování krví. Napadení biomolekul radikály lze rovněž uměle potlačit, například látkami obsahujícími skupiny SH (thiolové skupiny) – příkladem může být aminokyselina cystein. Působí jako látky zachycující radikály a snižují biologické působení na polovinu až třetinu, podobně jako nepřítomnost kyslíku. Některé z těchto látek byly navrženy jako radioprotektivní látky pro osoby ohrožené radiační expozicí, avšak všechny jsou ve větší či menší míře toxické (4).
Ačkoliv ionizující záření poškozuje téměř všechny buněčné organely, klíčovou strukturou určující osud ozářené buňky zůstává jaderná DNA. Záření působí zlomy dvoušroubovice DNA, a to jak jednoduché, tak zlomy dvojité, postihující obě vlákna. Zatímco jednoduché zlomy si buňka jednoduše opraví, reparace dvojitých zlomů je podstatně složitější, a čím více dvojitých zlomů záření způsobí, tím větší je pravděpodobnost zničení buňky. Dvojité zlomy působí především záření s vysokým lineárním přenosem energie (neutrony, těžké ionty), ale i fotonové či elektronové záření (5). Kromě jednoduchých a dvojných zlomů vznikají po ozáření také poškození bazí, cross-linky uvnitř DNA nebo DNA-protein, lokální denaturace či další. Při ozáření dochází k poškození i jiných molekul (např. proteinů, lipidů). Tyto molekuly jsou však v buňce obsaženy v mnoha kopiích, a proto lze pozorovatelný účinek záření očekávat až při poškození dostatečně velkého procenta kopií (3).
PŮSOBENÍ IONIZUJÍCÍHO ZÁŘENÍ NA BUNĚČNÉ ÚROVNI
Pozměněná funkce biomolekul, zejména DNA, se projeví ve fungování vyšších biologických organizačních celků, a nakonec i na stavu celého organismu.
Na buněčné úrovni se uvedené poruchy manifestují smrtí buňky nebo změnou genetické informace. Buňka může být usmrcena v klidovém období (interfázi). Tento účinek však předpokládá povšechnou denaturaci buněčných složek, tedy relativně vysokou dávku. Významnějším typem buněčné smrti je zánik vázaný na mitózu, buněčné dělení. Poškození se neprojeví okamžitě, ale tím, že buňka není schopna se dále dělit. Tato tzv. mitotická smrt buňky je pozorována při menších dávkách, které nestačí na vyvolání smrti v interfázi (6, 7). V důsledku ozáření dochází k inhibici buněčného dělení. I když buňka nezaniká, není již schopna průchodu mitózou, která klade vysoké nároky na přeskupení subcelulárních struktur. Pokud je poškození menšího stupně, buňka projde jednou či dvěma mitózami, než ztratí schopnost dalšího dělení. Nejnižší dávky vedou k tzv. bloku v určité fázi buněčného cyklu, buňky se nedělí a je jim poskytnut čas pro reparaci poškození. V případě ireparabilního poškození je iniciována apoptóza (8, 9). Odtud lze odvodit, že smrtící účinek záření na buňky se nejsnáze projeví ve tkáních, ve kterých probíhá rychlé buněčné dělení (krvetvorných orgánech, výstelce střev, vyvíjejícím se zárodku) (7).
K indukci změn dochází i v buňkách, které nejsou ozářené – tyto změny označujeme jako bystander efekt. Experimenty prokázaly, že stejně jako u buněk ozářených probíhají i u neozářených chromosomové aberace, dochází k jejich mutaci a onkogenní transformaci, případně až ke smrti. Předpokládá se, že v tomto ději hrají významnou roli cytokiny a konexony. Dopad bystander efektu je vyšší u buněk bližších ozářené buňce. Pokud se jedná o sousední buňky, mluvíme někdy o komunikaci mezi stěnami (1).
Konečný výsledek působení ionizujícího záření na buňku a tkáně není určen pouze výše uvedenými mechanismy, ale je spoluurčován i uplatněním reparačních mechanismů. Lze odlišit tzv. časnou reparaci, to znamená obnovu schopnosti dalšího dělení na úrovni postižené buňky (trvá několik hodin), a proliferaci, jež vychází ze zachované schopnosti dělit se u přeživších buněk (trvá dny až týdny). Zcela jinou biologickou odezvu má ozáření lokální, při němž jsou postiženy jen určité tkáně. Stíněním části těla se uchová určitá část tzv. kmenových buněk, ze kterých může vzejít regenerace tkáně (7).
DETERMINISTICKÉ A STOCHASTICKÉ ÚČINKY IONIZUJÍCÍHO ZÁŘENÍ
Většina nepříznivých zdravotních účinků radiační expozice může být zařazena do dvou souhrnných kategorií označovaných jako deterministické účinky (nepříznivé tkáňové reakce), vznikající zejména v důsledku zabití či poškození buněk po vysokých dávkách ionizujícího záření, a stochastické účinky, k nimž patří rozvoj maligního bujení u exponovaných jedinců v důsledku mutací somatických buněk nebo dědičné choroby u jejich potomků v důsledku mutací reprodukčních (zárodečných) buněk (ICRP 103) (tab. 1).
Tab. 1. Hlavní účinky ionizujícího záření na člověka (7) 
Časné tkáňové reakce mohou vznikat v časovém rozmezí několika hodin až týdnů a mohou být zánětlivého typu jako důsledek změněné propustnosti membrán buněk a uvolňování histaminu nebo to mohou být následné reakce po buněčných ztrátách (10). Hlavním faktorem určujícím míru poškození je absorbovaná dávka. Průběh a stupeň patologického procesu dále ovlivňují druh ionizujícího záření (beta, gama, neutronové), časová distribuce ozáření (frakcionované, jednorázové, prolongované, chronické), prostorová distribuce v organismu aj. (1).Vyvolání deterministických účinků (nepříznivých tkáňových reakcí) je obecně charakterizováno prahovou dávkou. Důvodem pro existenci prahu je skutečnost, že kritická buněčná populace v dané tkáni musí doznat poškození (vážné funkční selhání nebo smrt) a to se následně projeví příslušným klinickým obrazem, který je do značné míry charakteristický, nekopíruje stavy u běžných nemocí, odlišuje se zejména časovým průběhem, prostorovou distribucí postižení a svéráznou kombinací jednotlivých příznaků. Nad prahovou dávkou závažnost poškození, včetně narušené schopnosti k zotavení tkáně, stoupá s dávkou záření (3, 10). Esovitý tvar křivky a existence dávkového prahu jsou odrazem skutečnosti, že v terčové populaci je poměrně značná funkční rezerva, tj. pokles buněčnosti se stoupající dávkou zprvu nezpůsobí žádné funkční důsledky a hodnocený efekt nastane až při překročení dávek prahových (obr. 1). Většina tkání v těle požadavek funkční rezervy splňuje (3).
Stochastické účinky jsou účinky vyvolané již zmíněnými mutacemi (změnami v genetické informaci buněk). Z pohledu radiační ochrany se předpokládá převážně lineární bezprahový model závislosti dávky na efektu. S dávkou tedy roste pravděpodobnost poškození (obr. 1). Vztah dávky a účinku je odvozován z epidemiologických studií. Klinický obraz těchto účinků není typický, neodlišuje se od „spontánně“ vzniklých případů (3).
Obr. 1. Vztah dávky a účinku pro projevy deterministické a stochastické (3) 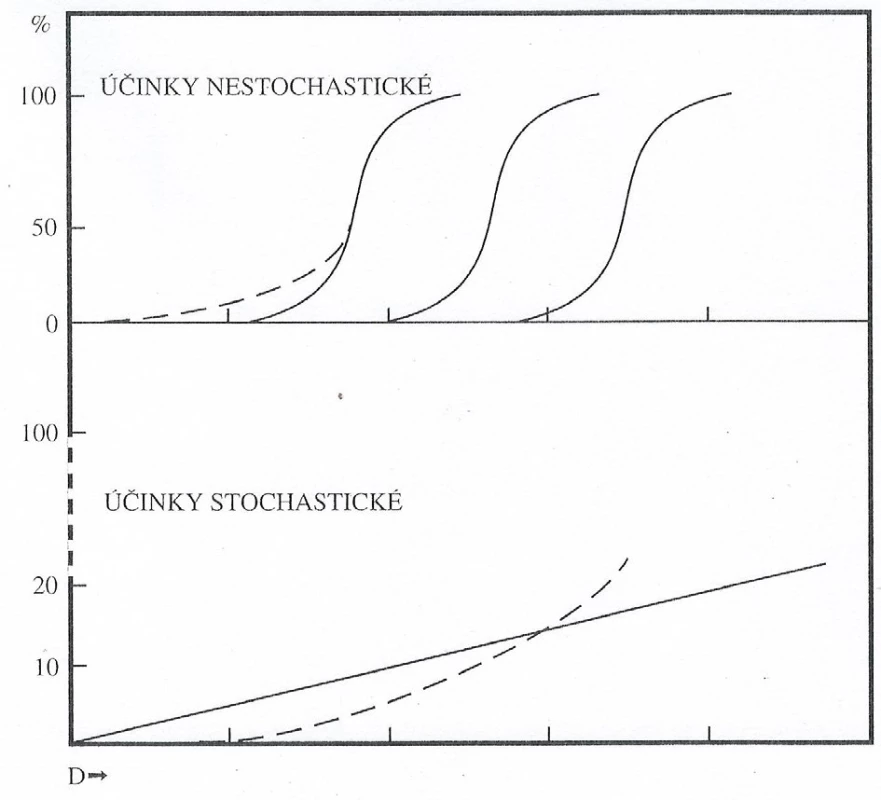
Při obdržení malých dávek ionizujícího záření je vysoká pravděpodobnost, že organismus poškození buňky zvládne pomocí reparačních procesů bez následků. Existuje však určité riziko, že se u jednotlivých buněk chybu nepodaří opravit nebo bude opravena pouze částečně a dojde ke vzniku tzv. poradiační nestability genetického materiálu, která může vyústit ve změnu buněčné DNA, jejímž důsledkem bývá rozvoj stochastických následků. Jde o proces, který je vyvolán poškozením jedné či několika málo buněk. Buňka, která má vlivem ionizujícího záření takto změněnou DNA, je potom za stochastické účinky zodpovědná (7).
Jednotlivé tkáně a orgány jsou ke vzniku nádorů po ozáření rozdílně vnímavé. Mezi nejvnímavější patří kostní dřeň, žaludek, tlusté střevo, plíce či mléčná žláza. Hodnota, která charakterizuje celoživotní riziko úmrtí na zářením vyvolanou malignitu (zahrnuje různou radiosenzitivitu, ale i léčitelnost jednotlivých nádorů), se nazývá koeficient rizika. Celkový koeficient rizika úmrtí na zářením vyvolané zhoubné nádory byl stanoven pro pracovníky 4,1 × 10–2 Sv–1 (to znamená, že ze 100 pracovníků ozářených efektivní dávkou 1 Sv bude pravděpodobně u 4 osob příčinou smrti zhoubný nádor). Koeficient rizika smrti pro celkovou populaci je vyšší 5,5 × 10-2 Sv-1, neboť jsou do ní zahrnuty i děti, u nichž existuje vyšší radiosenzitivita (7).
Důležitou charakteristikou je časový průběh výskytu zhoubných nádorů po ozáření. Leukémie, nádory štítné žlázy a nádory kostí se mohou projevovat už za několik let po expozici záření, zatímco většina ostatních malignit se projeví nejdříve za 10 let, někdy až za několik desetiletí po expozici. Přitom žádný jednotlivý typ nádorů není typickým projevem vlivu záření, takže je nemožné odlišit zářením vyvolané nádory od těch, které jsou vyvolány působením jiných možných činitelů (11).
Významnou skupinou pozdních účinků záření je postižení potomstva ozářených osob. Podkladem genetických změn je mutace, tj. změna v genetické informaci buňky. Za dědičné účinky je odpovědná tzv. gametická mutace, což je mutace v jádře zárodečných buněk (vajíčka, spermie) pohlavních žláz. Genetický účinek záření spočívá ve zvýšené frekvenci mutací v porovnání s mutacemi vznikajícími spontánně (7).
ZÁVĚR
Biologické účinky po ozáření se mohou projevit bezprostředně po ozáření, ale i s latencí několika desítek let. I když zářením mohou být zasaženy všechny biomolekuly, z hlediska poškození je nejdůležitější DNA vzhledem k možnosti narušení či ztráty genetické informace. Ke změnám může docházet jak v buňkách ozářených, tak neozářených mechanismem bystander efektu.
Čestné prohlášení
Autorka práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Adresa pro korespondenci:
Mgr. Renata Havránková, Ph.D.
Katedra zdravotnických oborů a ochrany obyvatelstva FBMI ČVUT
Sportovců 2311, 272 01 Kladno
Tel.: 604 678 719
e-mail: renata.havrankova@fbmi.cvut.cz
Zdroje
- Havránková R (ed.). Klinická radiobiologie. Grada, Praha, 2020.
- Gudkov IM, Vinichuk MM. Radiobiology & Radioecology. National Agricultural University of Ukraine, Kyjev, 2006.
- Klener P et al. Principy a praxe radiační ochrany. Azin, Praha, 2000.
- Havránková R a kol. Základy radiobiologie. ZSF JU, České Budějovice, 2018.
- Feltl D, Cvek J. Klinická radiobiologie. Tobiáš, Havlíčkův Brod, 2008.
- Podzimek F. Radiologická fyzika. Fyzika ionizujícího záření. ČVUT, Praha, 2015.
- SÚJB. Stručný přehled biologických účinků záření. Dostupné na: www.sujb.cz/radiacni-ochrana/oznameni-a-informace/strucny-prehled-biologickych-ucinku-zareni
- Kuna P, Navrátil L. Klinická radiobiologie. Manus, Praha, 2005.
- Österreicher J, Vávrová J. Přednášky z radiobiologie. Manus, Praha, 2003.
- ICRP. Doporučení Mezinárodní komise radiologické ochrany 2007. ICRP, 2007; 37 : 2–4.
- UNEP. Ionizující záření. Účinky a Zdroje. Program OSN pro ochranu životního prostředí. UNEP, 2016.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Úvodem
- Editorial
- Klíčové momenty v historii československé radiobiologie
- Biologické účinky ionizujícího záření
- Moderní trendy v radioterapii
- Reparace DNA v buňkách nádorů hlavy a krku a možnosti využití monitorování tohoto procesu pro odhad radiorezistence jednotlivých nádorů a výběr optimální primární léčby
- Trendy ve farmakologické stimulaci regenerace ionizujícím zářením poškozeného savčího organismu
- Biologická dozimetrie a moderní (-omické) metody
- Pokroky ve výzkumu poškození a reparace DNA v buňkách vystavených různým druhům ionizujícího záření v éře superrozlišovací optické mikroskopie
- Principy a výhledy vakcinace proti viru SARS-CoV-2
- Stáří není nemoc: Vývoj hladiny ochranných protilátek proti koronaviru SARS-CoV-2 u seniorů z Domova Břevnice
- Roční období, vitamin D a COVID-19
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Principy a výhledy vakcinace proti viru SARS-CoV-2
- Roční období, vitamin D a COVID-19
- Stáří není nemoc: Vývoj hladiny ochranných protilátek proti koronaviru SARS-CoV-2 u seniorů z Domova Břevnice
- Biologické účinky ionizujícího záření
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



