-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Arteficiální náhrady kosti
Artificial bone substitutes
Bone tissue substitutes are divided into basic classification with its pros and cons described. Arteficial bone grafts are especially pointed out in article, publishing our own experience with two specific synthetic preps. Finally there is a blink in the near future of bone tissue augmentation.
Keywords:
bone substitute, bone graft, synthetic bone graft, arteficial bone graft
Autoři: Petr Koníček
Působiště autorů: Klinika dětské a dospělé ortopedie a traumatologie 2. LF UK a FN Motol
Vyšlo v časopise: Čas. Lék. čes. 2016; 155: 438-441
Kategorie: Přehledové články
Souhrn
Uvádíme základní členění náhrad kostní tkáně s jejich klady a zápory, s důrazem na arteficiální náhrady; dále vlastní zkušenosti se dvěma typy náhrad používanými na našem pracovišti a také výhledy biologické augmentace kostní tkáně.
Klíčová slova:
kostní náhrada, kostní štěp, syntetická náhrada kosti, arteficiální náhrada kostiÚvod
Substituce kostní tkáně má své nezastupitelné místo v mnoha subspecializacích ortopedie, zejména v onkoortopedii, endoprotetice a také v traumatologii. Ve srovnání s transplantacemi jiných tkání zaujímají v četnosti celosvětově 2. místo po krevních transfuzích (1−4). Za posledních 50 let prošly kostní náhrady velkým vývojem, ačkoliv autogenní štěp zůstává stále zlatým standardem (5, 6). Kostní štěpy, anorganický materiál a růstové faktory jsou třemi hlavními kategoriemi v klasifikaci kostních náhrad.
Společným znakem všech je augmentace vlastních hojivých procesů osteoindukčními, osteokondukčními a osteogenními mechanismy (7). Osteoindukce je termín označující proces, kdy exogenní faktory ze substituentu potencují diferenciaci chondroblastů a osteoblastů, jež formují novou kostní tkáň. Naproti tomu osteokondukce je vlastnost štěpu umožňující integraci buněk, tkáně a cévního zásobení příjemce do štěpu. Osteogeneze je syntéza nové kosti z buněk dárcovského štěpu (8). Ideální náhrada by neměla stimulovat žádnou vedlejší zánětlivou odpověď příjemce, měla by být lehce implantovatelná, sterilizovatelná a samozřejmě cenově dostupná (9).
Druhy náhrad
Kostní štěpy se dělí na autogenní, alogenní a xenogenní. Největší význam, jak již bylo zmíněno v úvodu, mají štěpy autogenní. Nejčastějším odběrovým místem je lopata kosti kyčelní nebo lýtková kost. Hlavní výhodou, vedle nulových imunitních a infekčních rizik, je přítomnost všech tří augmentujících hojivých procesů: osteoindukce, osteokondukce a osteogeneze. Nevýhodou je omezená dostupnost štěpu např. u dětí či seniorů plynoucí z obecných chirurgických rizik z nové operační rány při odběru (10). Alogenní náhrady jsou získávány v drtivé většině jako kadavery z kostních bank a jsou využívány zejména při náhradách po radikálních resekcích v onkoortopedii. Jejich výhodou je zejména osteokondukce a dobrá dostupnost. Nevýhodou je riziko infekce i přes sterilizaci gama zářením, dále velmi nízká osteoindukce a nízká mechanická odolnost; ztráta těchto vlastností je dána právě ozářením a hlubokým zamrazením pro skladování. Tyto procedury se promítají i do konečné vyšší ceny preparátu (11). Xenogenní materiály se používají jen velmi okrajově, s dobrými výsledky ve stomatologii, nikoli však v ortopedii (12).
Anorganické arteficiální (syntetické) minerální náhrady kostní tkáně jsou složeny ze dvou hlavních složek, hydroxyapatitu a trikalciumfosfátu, a to v různém zastoupení, přičemž jsou k těmto dvěma látkám přidávány další složky, např. magnezium (13), silikát (14), alginát (15) či stroncium (16) pro lepší bioaktivitu – osteokondukci. Hydroxyapatit je biologicky inertní látka s omezenou degradací in vivo, vynikající svou vysokou mechanickou pevností. Na druhé straně porózní trikalciumfosfát, nepříliš mechanicky odolný, podléhá degradaci do 6 týdnů od implantace. Obě dvě složky se ve svých vlastnostech navzájem kombinují, proto jsou zastoupeny v podílech 40−60 % (17).
Anorganické náhrady jsou považovány za bezpečné a efektivní. V klinických studiích (fáze II, IV), které porovnávaly syntetické náhrady se štěpy z pánve, byly popsány výhody v menší bolestivosti, menších krevních ztrátách a kratším operačním čase (18). Jejich hlavní nevýhodou je nízká mechanická pevnost, jež je při maximální koncentraci hydroxyapatitu zhruba 4× nižší než u kortikální kosti. Spolu s aditivními ionty zlepšujícími biologickou aktivitu jsou syntetické náhrady považovány za nejslibnější oblast výzkumu v problematice náhrad kosti. Okrajově se také používají organické polymery jako kyselina polymléčná-glykolová nebo kolagen, které jsou známé z náhrad chrupavky. Kompozit kolagen-hyproxyapatit se pro svoji odolnost a tvarovou přizpůsobivost používá ve spondylochirurgii (19).
Vliv růstových faktorů na augmentaci růstu kostní tkáně a jejich aplikace in vivo byly zkoumány ve studiích s demineralizovanou kostní matrix (DBM), ve které byly nalezeny růstové faktory stimulující růst kosti: kostní morfogenetický protein (BMP), inzulinu podobný růstový faktor (IGF), transformující růstový faktor (TGF) a fibroblastový růstový faktor (FGF). DBM však nebyla pro svoji nízkou mechanickou pevnost příliš používána (20). V klinických studiích nebyl potvrzen účinek plazmy bohaté na trombocyty (PRP) na biologickou augmentaci kostní tkáně (21). Přístup k stimulaci růstu kostní tkáně na bázi kmenových buněk, konkrétně mezenchymových kmenových buněk (MSC), je zatím ve fázi několika in vitro studií (22).
Využití na našem pracovišti
K náhradě kostní tkáně používáme kromě autogenních a alogenních štěpů dva syntetické preparáty: Actifuse ABX (ApaTech) a PerOssal (AAP Bio Implants).
Prvně jmenovaný je složen z porózního kalciumfosfátu substituovaného 0,8 % silikátu, tedy stejným množstvím jako v přirozeně rostoucí kosti, což potencuje jeho osteoindukční vlastnosti. Je dodáván v podobě 1−2mm porózních granulí v gelovém nosiči, sterilních v injekčním aplikátoru. Používáme ho od roku 2010, dosud byl implantován v 33 případech, přičemž je používán nejvíce v kostních defektech při operacích v rámci revizní endoprotetiky (viz obr. 1, 2). Indikace a počty použitých preparátů jsou uvedeny v tab. 1.
Tab. 1. Použití preparátu Actifuse na naší klinice v období 2010–2016. 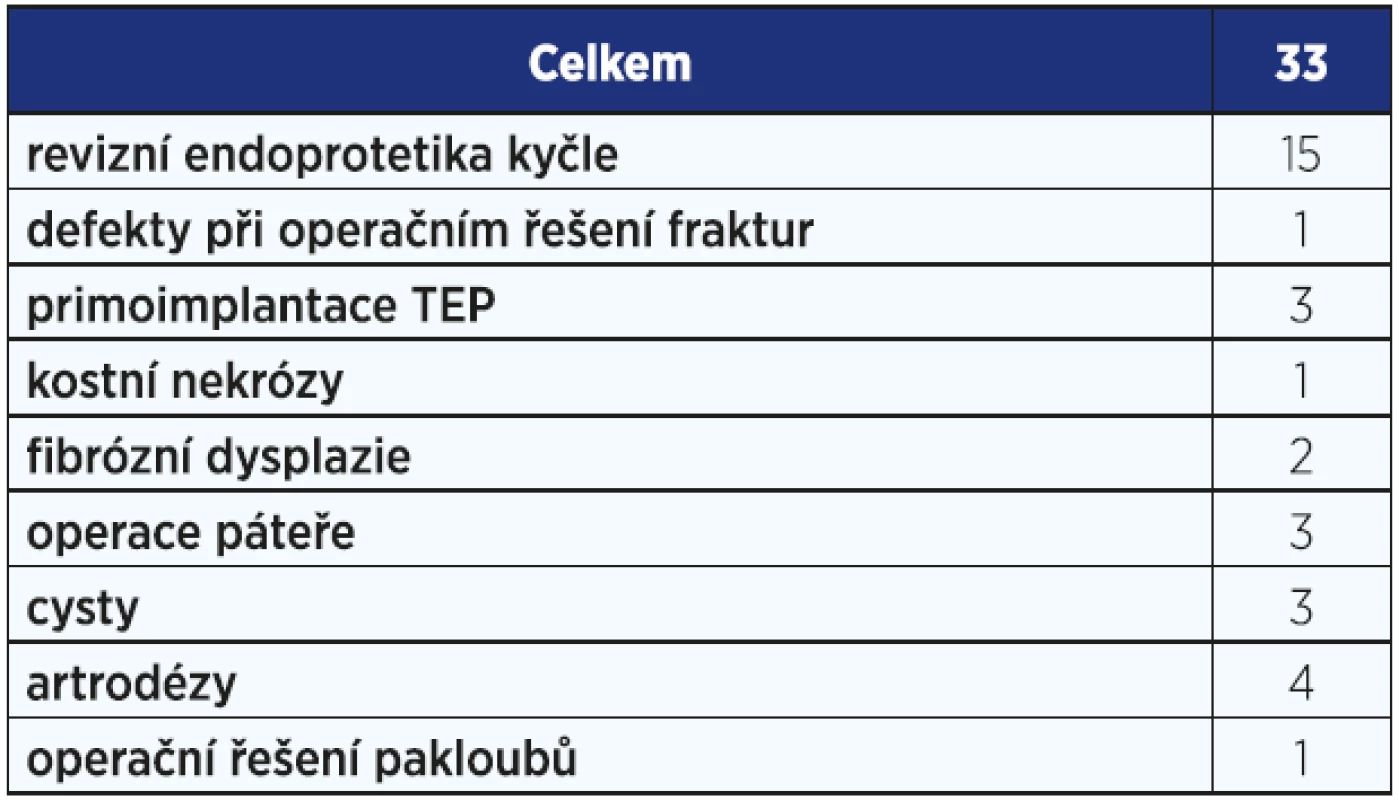
Obr. 1 33letá pacientka 12 let po implantaci TEP levé kyčle, vlevo rtg snímek s uvolněním jamky a supraacetabulární cystou. Následně byla provedena reimplantace jamky s výplní cysty pomocí Actifuse ABX 
Obr. 2 Snímek téže pacientky 5 měsíců po operaci s vyplněnou cystou. 
PerOssal se používá v širších indikacích – vrozených či získaných kostních defektech, výplních po resekci tumorů či cyst, při řešení pseudoartróz (obr. 3 a 4) a osteomyelitických defektů. Je složen z nanokrystalovéhu hydroxyapatitu (51,8 %) a kalciumsulfátu (48,5 %).
Velkou výhodou je možnost přidání různých antibiotik do krystalové mřížky preparátu, což PerOssal dělá výjimečným právě při řešení kostních infektů. Preparát jsme od roku 2012 použili celkem v 249 případech, tj. cca 3−4× týdně. Množství použitého materiálu v příslušných indikacích je uvedeno v tab. 2.
Tab. 2. Použití preparátu PerOssal na naší klinice v období 2012–2016. 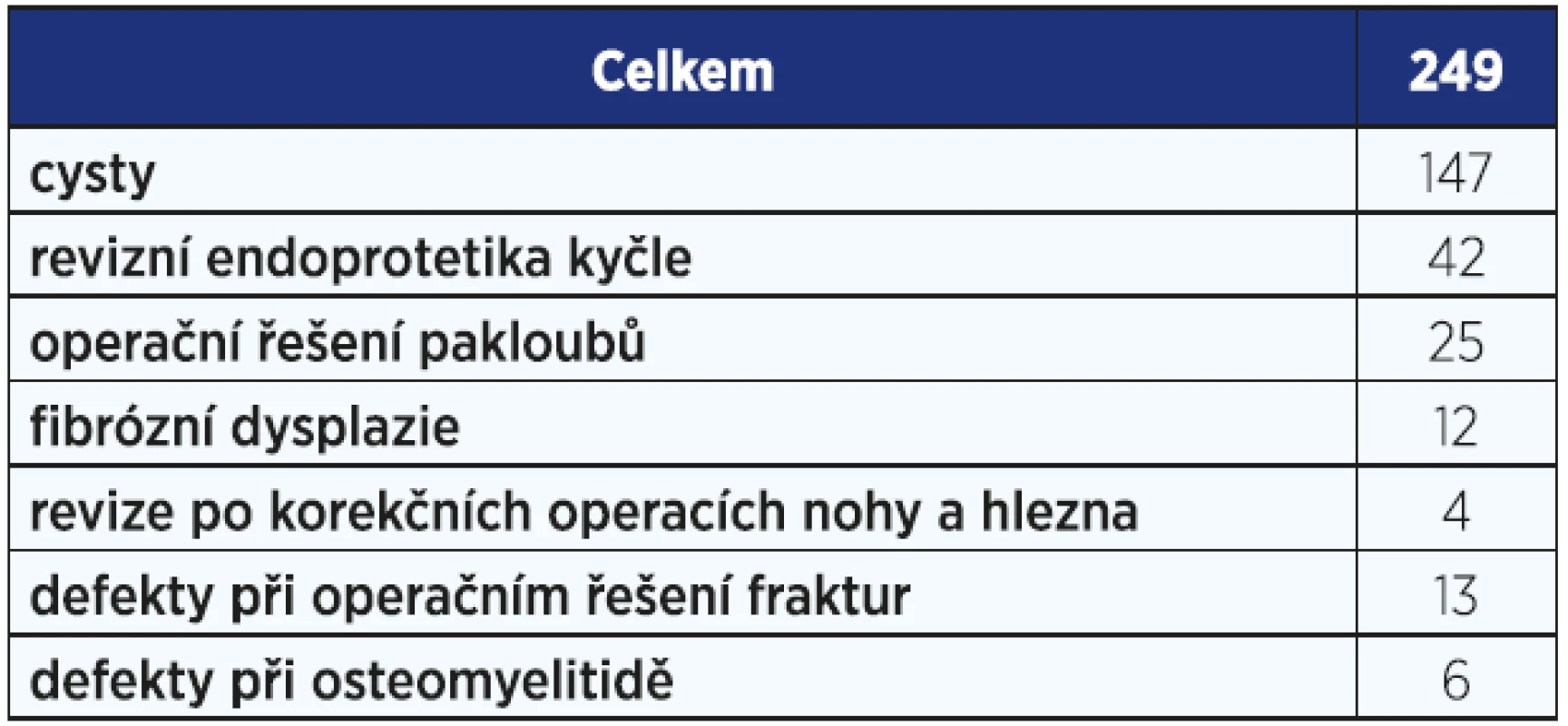
Od výrobce je PerOssal dodáván ve formě 5×3mm granulových peletů nebo prášku. Jednou z nejčastějších indikací byla výplň defektu po foráži juvenilní kostní cysty u 31 dětských pacientů. Úspěšnost prohojení cysty dosáhla 68,8 % (11 ze 16 pacientů − obr. 5 a 6).
Obr. 3 60letá pacientka po revizi a OS pakloubu diafýzy klíčku na horním snímku 1,5 roku po operaci. 
Obr. 4 Klíček po extrakci dlahy ve stejném časovém odstupu u téže pacientky 
Obr. 5 14letá pacientka s juvelnilní kostní cystou v proximálním humeru vlevo 
Obr. 6 Snímek téže pacientky 2 roky po operaci po exkochleaci a výplni cysty PerOssalem. 
Závěr
Efektivita kostního hojení závisí na několika základních faktorech: nutričním zásobení, mechanicky stabilním prostředí, dostupnosti progenitorových buněk a různých růstových faktorů. Porozumění potenciálu místa hojení je důležité pro rozhodování o typu kostní náhrady pro augmentaci. Zatím je standardem autogenní štěp. Použití syntetických materiálů umožňuje odstranit riziko přenosu infekce (které nelze u alogenního štěpu vyloučit), rejekčních imunopatologických reakcí a v neposlední řadě nutnost dalšího operačního zákroku – odběru štěpu.
Seznam použitých zkratek
BMP kostní morfogenetický protein
DBM demineralizovaná kostní matrix
FGF fibroblastový růstový faktor
IGF inzulinu podobný růstový faktor
OS osteosyntéza
PRP plazma bohatá na trombocyty
TEP totální endoprotéza
TGF transformující růstový faktor
Adresa pro korespondenci:
MUDr. Petr Koníček
Klinika dětské a dospělé ortopedie a traumatologie 2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
Tel.: 732 644 572
e-mail: konicekp@gmail.com
Zdroje
1. Greenwald AS, Boden SD, Goldberg VM et al. Bone-graft substitutes: facts, fictions and applications. J Bone Joint Surg Am 2001; 83 : 98–103.
2. Finkemeier CG. Bone-grafting and bone-graft substitutes. J Bone Joint Surg Am 2002; 84(3): 454–464.
3. Van Heest A, Swiontkowsi M. Bone-graft substitutes. Lancet 1999; 353(Suppl. 1): S28–29.
4. Faour O, Dimitriou R, Cousins CA, Giannoudis PV. The use of bone graft substitutes in large cancellous voids: any specific needs? Injury 2011; 42(Suppl 2): S87–90.
5. Rawlinson JN. Morbidity after anterior cervical decompression and fusion. The influence of the donor site on recovery, and the results of a trial of surgibone compared to autologous bone. Acta Neurochir 1994; 131(1–2): 106–118.
6. Blokhuis TJ, Calori GM, Schmidmaier G. Autograft versus BMP for the treatment of non-unions: what is the evidence? Injury 2013; 44(Suppl 1): S40–S42.
7. Bhatt RA, Rozental TD. Bone graft substitutes. Hand Clin 2012; 28(4): 457–468.
8. Khan SN, Cammisa FPJ, Sandhu HS et al. The biology of bone grafting. J Am Acad Orthop Surg 2005; 13(1): 77–86.
9. Pryor LS, Gage E, Langevin CJ, et al. Review of bone substitutes. Craniomaxillofac Trauma Reconstr 2009; 2(3): 151–160.
10. Boden SD. Overview of the biology of lumbar spine fusion and principles for selecting a bone graft substitute. Spine 2002; 27(16 Suppl. 1): S26–S31.
11. Calvo R, Figueroa D, Díaz-Ledezma C et al. Bone allografts and the functions of bone banks. Rev Med Chil 2011; 139(5): 660–666.
12. Laurencin CT, El-Amin SF. Xenotransplantation in orthopaedic surgery. J Am Acad Orthop Surg 2008; 16(1): 4–8.
13. Sprio S, Tampieri A, Landi E et al. Physico-chemical properties and solubility behaviour of multi-substituted hydroxyapatite powders containing silicon. Mater Sci Eng 2008; 28(1): 179–187.
14. Landi E, Tampieri A, Celotti G et al. Sr-substituted hydroxyapatites for osteoporotic bone replacement. Acta Biomater 2007; 3(6): 961–969.
15. Chae T, Yang H, Leung V et al. Novel biomimetic hydroxyapatite/alginate nanocomposite fibrous scaffolds for bone tissue regeneration. J Mater Sci Mater Med. 2013; 24(8): 1885–1894.
16. Landi E, Tampieri A, Celotti G et al. Synthetic biomimetic nanostructured hydroxyapatite. Key Eng Mater 2005; 284 : 949–952.
17. Boyan BD, McMillan J, Lohmann CH et al. Basic information for successful clinical use with special focus on synthetic graft substitutes. Bone graft substitutes. ASTM Int., Philadelphia, 2002 : 231–259.
18. Lerner T, Bullmann V, Schulte TL et al. A level-1 pilot study to evaluate of ultraporous beta-tricalcium phosphate as a graft extender in the posterior correction of adolescent idiopathic scoliosis. Eur Spine J 2009; 18(2): 170–179.
19. Campana V, Milano G, Pagano E et al. Bone substitutes in orthopaedic surgery: from basic science to clinical practice. J Mater Sci Mater Med 2014; 25 : 2445–2461.
20. Kinney RC, Ziran BH, Hirshorn K et al. Demineralized bone matrix for fracture healing: fact or fiction? J Orthop Trauma. 2010; 24(Suppl. 1): S52–S55.
21. Tsai CH, Hsu HC, Chen YJ et al. Using the growth factors-enriched platelet glue in spinal fusion and its efficiency. J Spinal Disord Tech 2009; 22(4): 246–250.
22. Lattanzi W, Bernardini C. Genes and molecular pathways of the osteogenic process. Osteogenesis. Intech, Rijeka, 2011 : 21–56.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
-
Všechny články tohoto čísla
- Jubilanti
- Devadesátiny prof. MUDr. Vladislava Klenera, CSc.
- Úvodem
- Milníky rozvoje ortopedie a traumatologie
- Jak postupovat při léčení idiopatické skoliózy
- Primární maligní nádory kostí u dětí − možnosti záchovné chirurgie s využitím aloštěpů
- Dekompresivní kraniektomie
- Femoroacetabulární impingement a možnosti jeho řešení
- Zkrácení kosti jako operační řešení diference délek končetin
- Avaskulární nekróza hlavice femuru
- Rehabilitace po totální náhradě kyčelního a kolenního kloubu
- UHMWPE – polyethylen pro artikulační povrchy kloubních náhrad
- Arteficiální náhrady kosti
- První zkušenosti s podáním antidota dabigatran etexilátu ve FN Plzeň
- Paliativní péče v ČR v roce 2016
- Torsten Nils Wiesel (1924–)
- Tajemné busty z hloubi Lékařského domu
- Přednáškové večery Spolku českých lékařů v Praze (únor – březen 2017)
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Avaskulární nekróza hlavice femuru
- Femoroacetabulární impingement a možnosti jeho řešení
- Rehabilitace po totální náhradě kyčelního a kolenního kloubu
- Zkrácení kosti jako operační řešení diference délek končetin
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



