-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Maligní melanom: standardy a inovace v diagnostice a terapii
Malignant melanoma: standards and innovation in diagnostics and therapy
Cutaneous malignant melanoma originates from neoplastic proliferation of melanocytes. Due to its early lymphogenic and haematogenic metastazing, melanoma belongs to the most malignant tumours. The disease occurs quite early; one quarter of patients with melanoma is younger than 40 years and the mean age of a melanoma patient is 54 years. The incidence of this tumour is growing constantly, about 4% per year. In the central Europe the current incidence is approximately 14 cases per 100.000 inhabitants per year, in the USA it represents 10 to 25 cases and the highest incidence of 50–60 new cases is reported from Australia.
The patient’s prognosis depends on the tumour thickness and the early diagnostics is therefore essential for the favourable disease outcome. The accuracy of the melanoma clinical diagnostics has been enhanced by introduction of dermoscopy, particularly by its digital form. For the trained dermatologist it improves the accuracy of the clinical decision from usual 70 to more than 95%. The malignant melanoma mortality rate remains constant since the eighties of the 20th century. Exploration of new substances which should be able to prolong the patient’s survival in metastatic stage is therefore in progress.Key words:
malignant melanoma, incidence, dermoscopy, circulating cells, sentinel lymph node, immunotherapy, chemotherapy, follow up.
Autoři: P. Arenberger 1; M. Arenbergerová 1; T. Vedral 2
Působiště autorů: Univerzita Karlova v Praze, 3. lékařská fakulta, Dermatovenerologická klinika FNKV 1; Univerzita Karlova v Praze, 3. lékařská fakulta, Chirurgická klinika FNKV 2
Vyšlo v časopise: Čas. Lék. čes. 2009; 148: 151-157
Kategorie: Přehledový článek
Souhrn
Maligní melanom kůže vzniká neoplastickou proliferací melanocytů. Tendence k časnému lymfogennímu a hematogennímu metastázování řadí melanom k vysoce zhoubným nádorům. Onemocnění se objevuje poměrně brzy, a tak je čtvrtina pacientů s melanomem mladší 40 let a průměrný věk melanomového pacienta je 54 let. Incidence tohoto tumoru konstantně stoupá, ročně zhruba o 5 %. Ve střední Evropě se v současnosti pohybuje incidence kolem 14 případů na 100 000 obyvatel za rok, v USA mezi 10–25 a nejvyšší incidence 50–60 nových případů je zaznamenávána v Austrálii.
Prognóza pacienta je významně závislá na tloušťce tumoru, proto je včasná diagnostika nezbytným předpokladem příznivého průběhu onemocnění. Zvýšení přesnosti klinické diagnózy melanomu přinesla dermatoskopie, především pak ve své digitální podobě, která zlepší školenému dermatologovi přesnost klinické diagnózy ze 70 na více než 95 %. Mortalita na maligní melanom zůstává od osmdesátých let 20. století konstantní, a proto je velký tlak na objevení nových látek, které by prodloužily přežívání pacientů v metastatickém stadiu.Klíčová slova:
maligní melanom, incidence, dermatoskopie, cirkulující buňky, sentinelová uzlina, imunoterapie, chemoterapie, dispenzarizace.ÚVOD
Melanom je odpovědný za 90 % úmrtí na kožní nádory. Jeho incidence stoupá převážně u populace s nízkým fototypem vystavené intenzIvní sluneční expozici. U silně pigmentovaných ras, jako jsou Afričané nebo Asiati se melanom vyskytuje zřídka, a to zejména na dlaních a ploskách nebo na sliznicích.
Ohroženi tímto nádorem jsou zejména jedinci s vysokým počtem pigmentových névů, lidé s velkým kongenitálním névem (obr. 1) nebo mnohočetnými atypickými (dysplastickými) névy. Přítomnost 50–90 běžných pigmentových névů zvyšuje riziko vzniku melanomu 2×, přítomnost 10 a více dysplastických névů zvyšuje riziko až 12×. Polygenní dědičnost je odpovědná za častý rodinný výskyt, a tak se nachází 5–10 % melanomů v rodinách s pozitivní anamnézou (1).
Obr. 1. Velké kongenitální névy představují zvýšené riziko vzniku melanomu 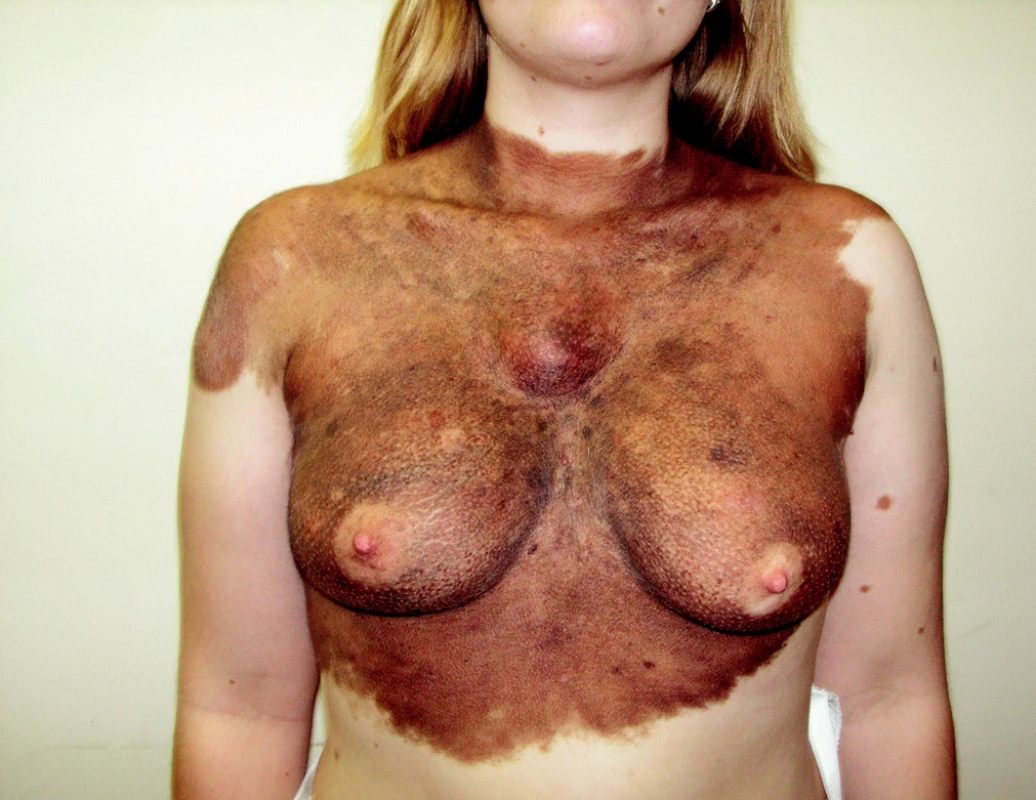
Kromě těchto konstitučních faktorů hraje významnou roli i UV záření, a to zejména jeho UVB složka. UVB záření indukuje v kůži řadu patologických procesů, jako je imunosupresivní účinek, vznik volných kyslíkových radikálů a postižení DNA melanocytů vznikem pyrimidinových dimerů (2). Názory na vliv toxických, lékových nebo endokrinních (gravidita, hormonální léčba) faktorů na vznik tohoto tumoru jsou rozporuplné. Častá spontánní remise a agresivní průběh onemocnění u imunosuprimovaných svědčí pro významnou roli imunitního systému u této neoplazie (3).
Klinicky a histologicky rozlišujeme 4 typy maligního melanomu. Některé melanomy se obtížně klasifikují, někdy se vyskytují smíšené varianty. Mezi klinicky atypické formy patří amelanotické melanomy, slizniční nebo jiné extrakutánní formy, které dohromady tvoří 5 % všech melanomů.
Povrchově se šířící melanom (SSM)
SSM reprezentuje až 70 % všech maligních melanomů. U mužů jej obvykle najdeme v horních partiích trupu a u žen na bércích nebo stehnech. Je charakterizován horizontální fází, která klinicky imponuje jako makula. V pozdější fázi se elevuje, dochází k heterogenitě barev, regresi nebo k sekundárnímu vývoji papuly nebo tuberu (obr. 2).
Obr. 2. Superficiálně se šířící melanom s vertikálním růstem na boltci 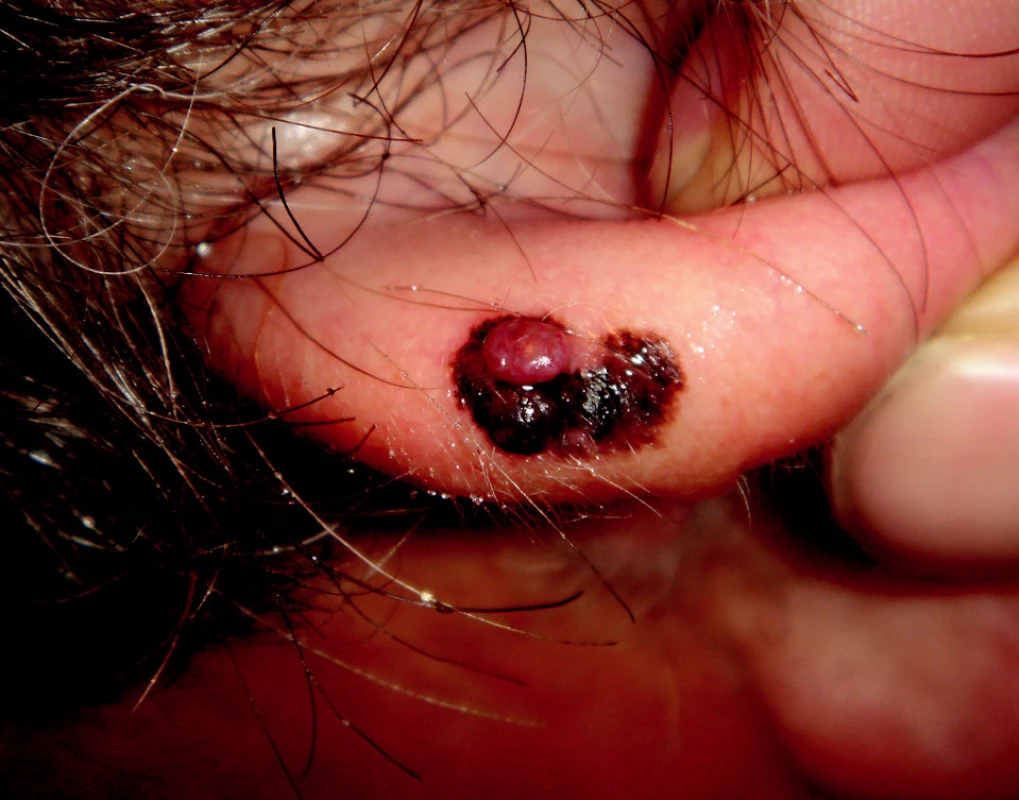
Nodulární melanom (NM)
NM tvoří až 20 % všech melanomů, a řadí se tak na druhé místo v četnosti tohoto nádoru. Primárně se vyskytuje jako exofyticky rostoucí hrbol. Barva je převážně hnědočerná, často s erodovaným krvácejícím povrchem. Vzhledem k iniciálně horizontální fázi je časná diagnóza obtížná.
Lentigo maligna melanom (LMM)
LMM se vytváří často až po několika letech na podkladě lentigo maligna. Vyskytuje se obvykle na obličeji starších osob. Projev může dosahovat v průměru až 10 cm a k vertikálnímu růstu dochází až po mnoha letech.
Akrolentiginózní melanom (ALM)
ALM je lokalizován převážně palmoplantárně, ale i sub - nebo periunguálně. V intraepidermální časné fázi imponuje jako neostře ohraničená makula, elevace signalizuje invazivní růst projevu. Prognosticky je tento typ nejrizikovější vzhledem k pokročilému stadiu, ve kterém se pacienti dostavují poprvé k lékaři.
Ve velkých retrospektivních studiích se ukázalo, že pouze 1/3 melanomů vzniká na podkladě pigmentového névu. V 54 % se melanom vyvinul z névu dysplastického (atypického), ve 36 % z velkého kongenitálního névu a v 10 % z běžného melanocytárního névu. Ve 2/3 případů vznikne melanom de novo, tedy na zdravé kůži (4).
Prognostické faktory u primárního maligního melanomu (bez vzdálených metastáz) jsou:
- vertikální tloušťka tumoru (histologické měření maximální tloušťky nádoru podle Breslowa udávané v mm),
- přítomnost ulcerace primárního tumoru (histologicky verifikovaná),
- invaze tumoru do kůže podle Clarka (zejména rozlišení Clark level II/III a IV/V u tenkých melanomů),
- pohlaví (horší prognóza u mužů),
- lokalizace tumoru (méně příznivá prognóza u melanomů na hlavě a krku, trupu).
Maligní melanom může metastázovat primárně lymfogenně, ale i hematogenně. Zhruba 2/3 primárních metastáz je omezeno na regionální lymfatickou oblast. Manifestuje se potom jako:
- satelitní metastáza (do 2 cm od primárního tumoru) nebo lokálními recidivami při neprovedení radikálního zákroku,
- in-transitní metastáza (postihuje kůži nebo podkoží dále než 2 cm od primárního tumoru, ale ne až za regionálními lymfatickými uzlinami),
- mikro - nebo makrometastáza do regionálních lymfatických uzlin.
Pro maligní melanom byla světově akceptována klasifikace American Joint Commission on Cancer AJCC 2003 (tab. 1) (5). Nová TNM klasifikace je současnosti v rozpracování.
Tab. 1A. Klasifikace American Joint Commission on Cancer (AJCC 2003) (Nová TNM klasifikace je současnosti v rozpracování.) 
*mikrometastázy – detekovány na základě elektivní či sentinelové biopsie lymfatických uzlin **makrometastázy – zjištěny klinicky/potvrzeny sonograficky a verifikovány histologicky po lymfadenektomii nebo metastázy do lymfatických uzlin s velkým extrakapsulárním šířením Prognóza pacientů se zhoršuje s pokročilostí stadia, a tak se desetileté přežití u melanomů s tloušťkou do 1 mm pohybuje kolem 90 % a klesá na 47 % u melanomů nad 4 mm. Přežívání 1 rok v metastatickém stadiu IV je 8–10 %. Desetileté přežívání celého kolektivu pacientů se pohybuje od 75 do 80 % (6).
Diagnostika
V diferenciální diagnostice pigmentových projevů má velký význam dermatoskopie. Podle proběhlých studií vzrůstá počet správně diagnostikovaných melanomů za pomoci dermatoskopu, a to zejména v jeho digitální podobě až o 25 % oproti vyšetření pouhým okem (7).
Tato metoda využívá zvláštním způsobem upravenou osvětlenou lupu, na jejíž spodní části je ještě jedno průhledné sklo, které se přímo dotýká kůže při vyšetření. Navíc, štěrbina mezi kůží a tímto sklem je vyplněna olejem, gelem nebo tekutinou. Toto vlhké prostředí vyplní veškeré kožní nerovnosti pod sklem, čímž se zruší běžný lom světla z kožního povrchu, a to umožní posuzovat kožní struktury (obvykle pigmentové) v hlubších partiích kůže. Digitalizace tohoto obrazu, která probíhá buď tak, že analyzujeme obraz z připojeného digitálního fotoaparátu, nebo se přímo jedná o online vyhodnocení obrazu z dermatoskopického zařízení tvořeného výše popsanou optikou a videokamerou, umožňuje expertní analýzu. Speciální software posuzuje pigmentovou změnu podle ABCD kritérií (asymmetry – asymetrie, border –ohraničení, colour – barva, diameter – rozměr) (8). Data zpracuje, zhodnotí a zároveň porovnává strukturu obrazu s několika tisíci fotografiemi, které má uloženy v paměti, a propočítá riziko. Výhodami tedy jsou: zvětšení projevu až 50×, archivace snímku a posouzení vývoje změn v různých časových odstupech, expertní analýza přístroje nebo možnost přeposlání snímku elektronicky pacientovi. Tato analýza tak pomáhá odborníkovi zjednodušit otázku, zda pigmentovou změnu ponechat a sledovat, či odstranit.
Histopatologické určení primárního nádoru se stanovením hlavních rizikových prognostických faktorů (Breslow index, přítomnost ulcerace), ale i ostatní rizikové prognostické faktory (přítomnost regrese, mikrosatelitů, angioinvaze, lymfangioinvaze, vysoká mitotická aktivita).
Biopsie sentinelové uzliny u melanomů s Breslowem > 1 mm, u tenčích melanomů v případě, kdy je hodnota Clarka IV/V nebo s přítomností ulcerace.
Stanovení TNM stadia (platná AJCC klasifikace).
Vyšetření krve: krevní obraz, jaterní testy, CRP, ALP, a dle možnosti i S100 u melanomů s Breslowem > 1 mm. Relevance hladiny LDH jako prognostického faktoru v metastatickém stadiu, je parametrem, který bere v úvahu klasifikace AJCC.
Klinické vyšetření integumenta k odhalení kožních či podkožních metastáz, duplicity melanomu nebo definování rizikových projevů. Palpace spádových lymfatických uzlin může odhalit lokoregionální metastázy.
Detekce melanomových buněk z periferní krve je další slibnou zatím pouze experimentální metodou k monitoringu diseminace nádorových buněk krevní cestou, a tedy k včasnému rozpoznání metastáz. Za specifickou se popisuje multimarkerová real-time RT-PCR, kdy bylo kvantitativně z periferní krve stanoveno 5 markerů melanomových buněk: Melan-A/MART-1, gp 100, MAGE-3, MIA a tyrozináza. V této prospektivní studii byl proveden screening 65 pacientů po resekci rizikového kožního melanomu (9). Krevní odběry od pacientů k průkazu cirkulujících buněk a stagingová vyšetření byla prováděna každé 3 měsíce po dobu 15 měsíců. Během studie došlo k progresi u 18 pacientů. U všech těchto pacientů byla zaznamenána statisticky signifikantní elevace nádorových markerů v období od 0 do 9 měsíců od progrese onemocnění (obr. 3). Tato metoda se v budoucnu může uplatnit při screeningu rizikových pacientů a k monitoringu úspěšnosti terapie.
Obr. 3. Pomocí multimarkerové real-time RT-PCR lze zaznamenat elevaci markerů melanomových buněk u části pacientů již 9 měsíců před progresí onemocnění 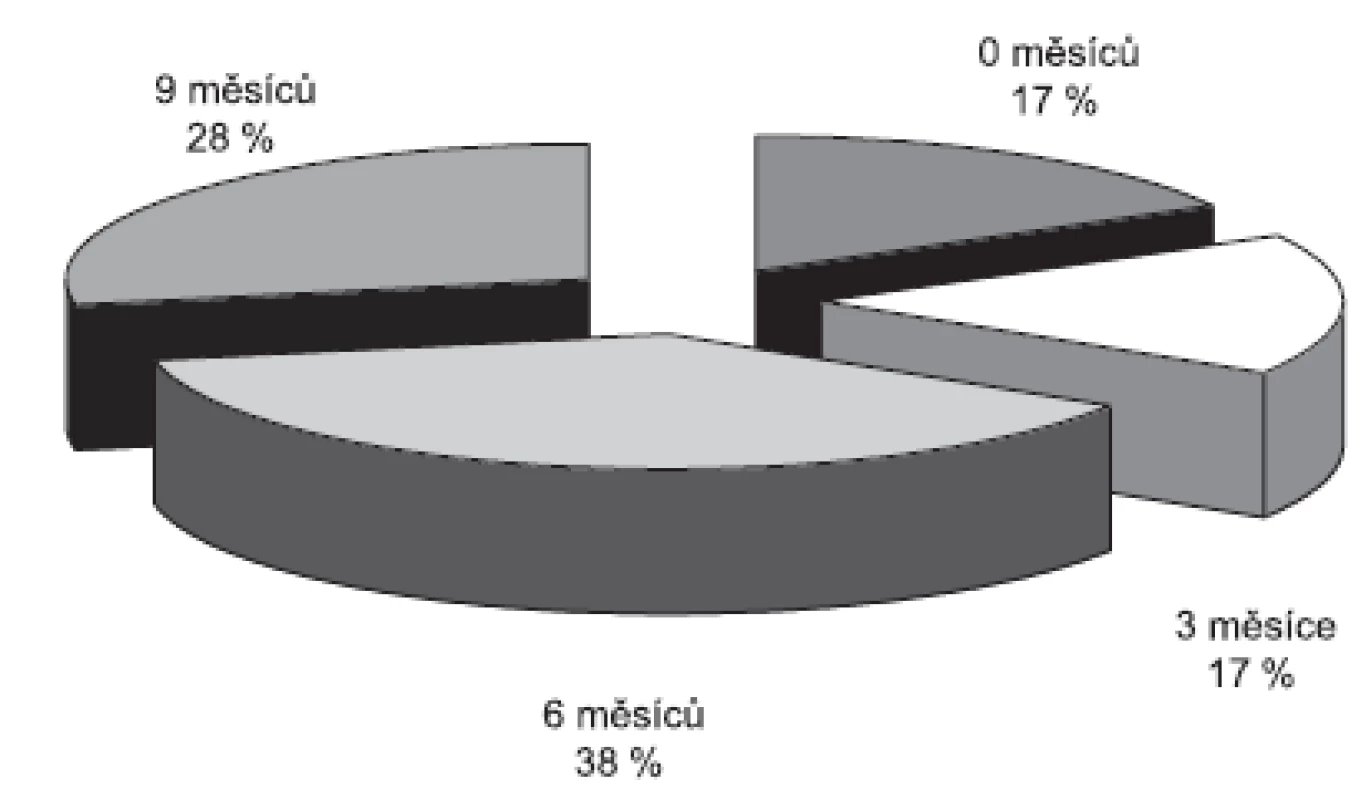
Provedení zobrazovacích vyšetření v rámci vstupního stagingového vyšetření u pacientů s melanomem hodnoty Breslow > 1mm (sonografické vyšetření regionálních lymfatických uzlin, sonografické vyšetření břicha včetně abdominálních lymfatických uzlin a RTG plic). Vstupní stagingové vyšetření má význam zejména pro pozdější srovnávání nálezů. U pacientů ve stadiu III by měla být tato vyšetření doplněna o CT či magnetickou rezonanci mozku, případně scintigrafii skeletu. U rizikových pacientů je ke zvážení indikace PET-CT vyšetření.
Léčba
Chirurgická léčba primárního tumoru
- Zásadní význam pro pacienta s melanomem má včasná chirurgická excize nádoru.
- Suspektní pigmentové projevy by měly být odstraňovány in toto, aby bylo možné provést co nejpřesnější histopatologické vyšetření celého projevu.
- Probatorní excizi lze provést při podezření na lentigo maligna melanom v obličeji, výjimečně při podezření na akrolentiginózní melanom palmoplantárně a ze slizničních projevů. Nevýhodou tohoto postupu je obtížnější nebo dokonce méně přesné histopatologické vyhodnocení. Bylo prokázáno, že probatorní excize z projevu nezhoršuje prognózu pacientů ve srovnání s pacienty s primárně in toto excizemi (10).
- Rozsah excize by měl být v souladu se stávajícím doporučením pro bezpečnostní okraj okolo nádoru uvedený v tabulce 2.
- Pokud nádor nebyl excidován in toto nebo nebyl dodržen dostatečný bezpečnostní lem, provádí se v druhé etapě reexcize jizvy v takovém rozsahu, aby byl dosažen doporučený bezpečnostní okraj. Reexcize by měla proběhnout do 4 týdnů od primární excize.
Tab. 1. Současná doporučení pro dodržení ochranného bezpečnostního lemu při excizi kožního melanomu 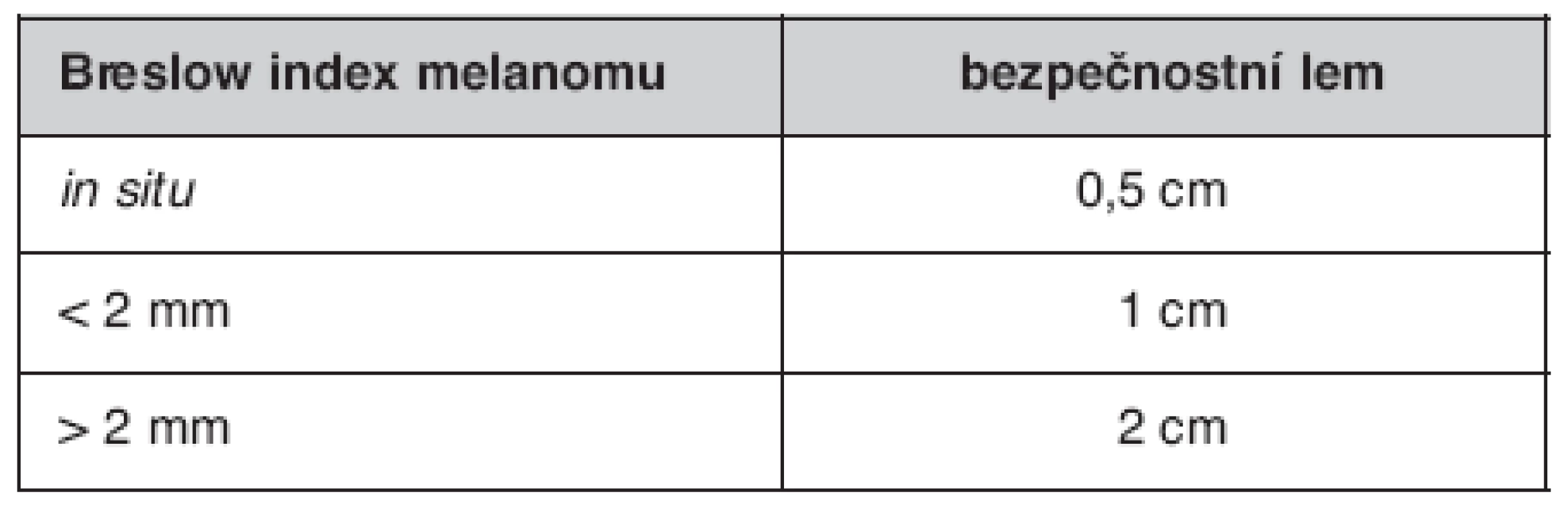
Biopsie sentinelové uzliny
- U melanomů s Breslowem > 1mm nebo u nádorů s tloušťkou pod 1 mm při Clark IV/V nebo za přítomnosti ulcerace se odstraňuje tzv. sentinelová uzlina (první spádová uzlina pro oblast tumoru).
- Biopsie sentinelové uzliny se provádí:
- současně s excizí primárního tumoru (optimální případ),
- ve druhé etapě s časovým odstupem; jako ještě přípustná se uvádí doba do jednoho měsíce po operaci nádoru. Výkon ve dvou dobách není ideální, protože při radikální primární excizi nádoru může dojít k narušení lymfatických poměrů v místě tumoru, a tím ke ztížení nebo znemožnění identifikace správné lymfatické uzliny.
- Značení sentinelové uzliny se provádí duplicitně: patentní modří a koloidem značeným radionuklidem Tc99m.
- Sentinelová uzlina (SLN) se vyšetřuje histopatologicky barvením hematoxylinem-eosinem doplněným o imunohistochemické vyšetření. Nutné je uzlinu vyšetřit v celém rozsahu dle protokolu pro vyšetřování SLN.
- Pokud je sentinelová uzlina negativní, předpokládá se, že i ostatní regionální lymfatické uzliny nejsou postiženy nádorovým procesem. Pokud je pozitivní, je pacient indikován k provedení radikální lymfadenektomie postižené oblasti.
- Biopsie sentinelové uzliny dle studie Multicenter sentinel lymphadenectomy trial (MSLT-1) nemá vliv na celkové přežívání pacientů a zatím nebyl prokázán její terapeutický význam. Jedná se o miniinvazivní stagingové vyšetření, které prodlužuje bezpříznakové období pacienta a umožňuje definovat vhodné pacienty – kandidáty pro adjuvantní imunoterapii (11).
Chirurgická léčba metastáz melanomu
U solitárních nebo ojedinělých satelitních/intranzitních metastáz se za nejbezpečnější a nejúčinnější metodu považuje chirurgické řešení. Excize by se měla provádět s 0,5–1 cm bezpečnostním lemem. Při průkazu metastáz v regionálních lymfatických uzlinách se rovněž za základní léčebnou metodu považuje radikální lymfadenektomie. Nedoporučuje se extirpace pouze postižené lymfatické uzliny, protože hrozí riziko, že se ponechají uzliny, které nejsou makroskopicky postižené, ale obsahují mikrometastázu. I operabilní orgánová metastáza ve stadiu IV je indikována k operaci. Jedná se například o solitární metastázu v plicích či játrech. Tento postup je však nutno vždy zvážit interdisciplinárně.
Radikální lymfadenektomie lymfatických uzlin
Pokud se v sentinelové uzlině prokáže přítomnost mikro - či makrometastáz, je pacient indikován k radikální lymfadenektomii této oblasti. Tento zákrok je indikován i v případě, pokud je klinicky či sonograficky patrná přítomnost jedné či více suspektně nádorově infiltrovaných lymfatických uzlin.
Na rozdíl od lymfadenektomie, například u karcinomu mammy, kde se jedná o lymfadenektomii diagnostickou, která určuje především další terapeutickou taktiku, je radikální odstranění spádových lymfatických uzlin u maligního melanomu výkonem kurativním. V souvislosti s tímto faktem je požadavek, aby byl chirurgický výkon co nejvíce radikální. Týká se podle lokalizace primárního nádoru především oblasti lymfatických skupin axily a třísla.
S ohledem na anatomické uložení těchto skupin lymfatik především v blízkosti nervově-cévních svazků a s požadavkem rozsáhlého a radikálního výkonu je potřeba, aby byl výkon prováděn v celkové anestezii a aby jej prováděl chirurg, který má zkušenosti s operacemi v této oblasti.
V oblasti axily vedeme řez podél úponu m. pectoralis major a postupně pronikáme do axilárního prostoru, kde odstraňujeme kompletně axilární tukové těleso, lymfatické uzliny z prostoru zadní axily, uložené intrapektorálně a uzliny podél cévního svazku. Osvědčuje se preparace pomocí harmonického skalpelu, která se jeví jako šetrná vůči okolním strukturám, především drobným nervovým větvím. Do rány vkládáme Redonův dren s aktivním odsáváním, který odstraňujeme podle množství odpadu většinou 3. pooperační den. Po extrakci drenu je možno pacienta propustit do domácího ošetření. Stehy většinou odstraňujeme 7.–9. pooperační den.
V oblasti třísla postupujeme obdobně. Řez je veden podélně od úrovně tříselného vazu směrem dolů k lymfatické skupině lymphonodi clocgueti uložené mediálně od cévního svazku. Opět radikálně odstraňujeme veškeré uzliny z této oblasti, které hmatem a zrakem identifikujeme. Operační prostor opět zajišťujeme Redonovým dranem. Následná pooperační péče je identická jako u exenterace axily.
V pooperační péči je pacient zajištěn běžnými analgetiky a nevyžaduje zvláštních opatření.
Z možných operačních komplikací se můžeme setkat s krvácením při poranění cév. Dochází k němu buď při vlastní operaci, které ošetříme ligaturou nebo cévním stehem, nebo v pooperačním období, které se projeví rozsáhlejším hematomem a v krajním případě může vést až k nutnosti operační revize.
Další z možných brzkých pooperačních komplikací je výraznější lymforea, která se projeví větším odpadem do Redonova drenu a otokem axily či třísla v pooperačním období. Většinou se vyřeší jednorázovou punkcí a v brzké době ustává.
Mezi pozdní pooperační komplikace patří lymfedém příslušné končetiny, se kterým se setkáváme méně často než u pacientů s jinou diagnózou, kde se na jeho vzniku podílí i pooperační ozařování. Řešení tohoto problému spočívá v manuálních lymfodrenážích, užívání elastických kompresivních pomůcek či preparátů zlepšujících odtok lymfy.
Po zhojení je pacient nadále dispenzarizován ošetřujícím lékařem – dermatologem a je vhodné oblast předchozí lymfadenektomie pravidelně sledovat pomocí ultrasonografie.
Adjuvantní terapie
- Jedná se o terapii, která se nasazuje co nejdříve po chirurgické excizi nádoru u pacientů bez klinicky patrných metastáz tumoru či po jejich odstranění.
- Imunologické léčebné postupy jako vakcíny nebo cytokiny interferon gama, TNF-α, IL-2, IL-12 nebo GM-CSF nepřinesly v proběhlých klinických studiích očekávaný výsledek v adjuvantní terapii.
- Interferon alfa je první látkou v adjuvantní terapii, která v prospektivních randomizovaných studiích přinesla výrazný efekt pro pacienta. Interferon alfa je využíván pro své významné imunomodulační a antitumorózní vlastnosti a s tím souvisejícím prodloužením bezpříznakového období (12, 13).
- K léčbě interferonem alfa jsou indikováni pacienti s vysoce rizikovým melanomem stadia IIB, IIC a III (dle AJCC 2003).
- Dle současných doporučení se interferon alfa v České republice dávkuje:
vysoká dávka: 9/10 MIU s.c./den 5× týdně po 4 týdny v rámci indukce, následná pokračovací léčba 9/10 MIU 3× týdně po dobu 1 roku.
V současné době lze v adjuvantní imunoterapii využívat i pegylované formy interferonu alfa, které mají prodloužený biologický poločas,a protose aplikují pouze jedenkrát týdně. Prospektivní randomizovaná studie s pegylovaným interferonem alfa potvrdila prodloužení bezpříznakového období u pacientů s metastatickým postižením lymfatických uzlin. Z terapie profitovali zejména pacienti s mikrometastázami, u kterých se prodloužil i interval do vzniku prvních vzdálených metastáz (14).
Cytokiny, jako je interferon alfa nebo interleukin-2 lze využít i v intralezionální aplikaci při řešení recidivujících inoperabilních kožních metastáz bez přítomnosti vzdálených orgánových metastáz. Předpokládá se, že jsou schopné vyvolat nejen lokální, ale i systémovou protinádorovou imunitní odpověď.
Radioterapie
Radioterapie se v léčbě maligního melanomu používá jako primární přístup spíše výjimečně. Je to pouze v těch případech, u kterých není operační výkon možný nebo nemá význam. U makroskopicky viditelných nádorů je potřeba při ozařování vytvořit od všech okrajů nádoru bezpečnostní lem 3 cm. Ozařuje se dávkou 70 Gy při frakcionaci 5× 2 Gy týdně. U mikroskopické přítomnosti nádoru se doporučuje aplikace 60 Gy. Pro optimální rozložení dávky v oblasti nádoru a nepoškozování zdravé tkáně se doporučují rychlé elektrony.
Intranzitní metastázy, které nejsou řešitelné chirurgicky nebo u kterých nejde použít izolovanou cytostatickou perfuzi končetiny, lze použít samostatné ozáření rychlými elektrony o energii mezi 6 a 8 MeV. Při běžném ozařování se pracuje opět s dávkami mezi 50–60 Gy (obr. 4).
Obr. 4. Hematogenní rozsev kožních a podkožních metastáz melanomu bez orgánového postižení 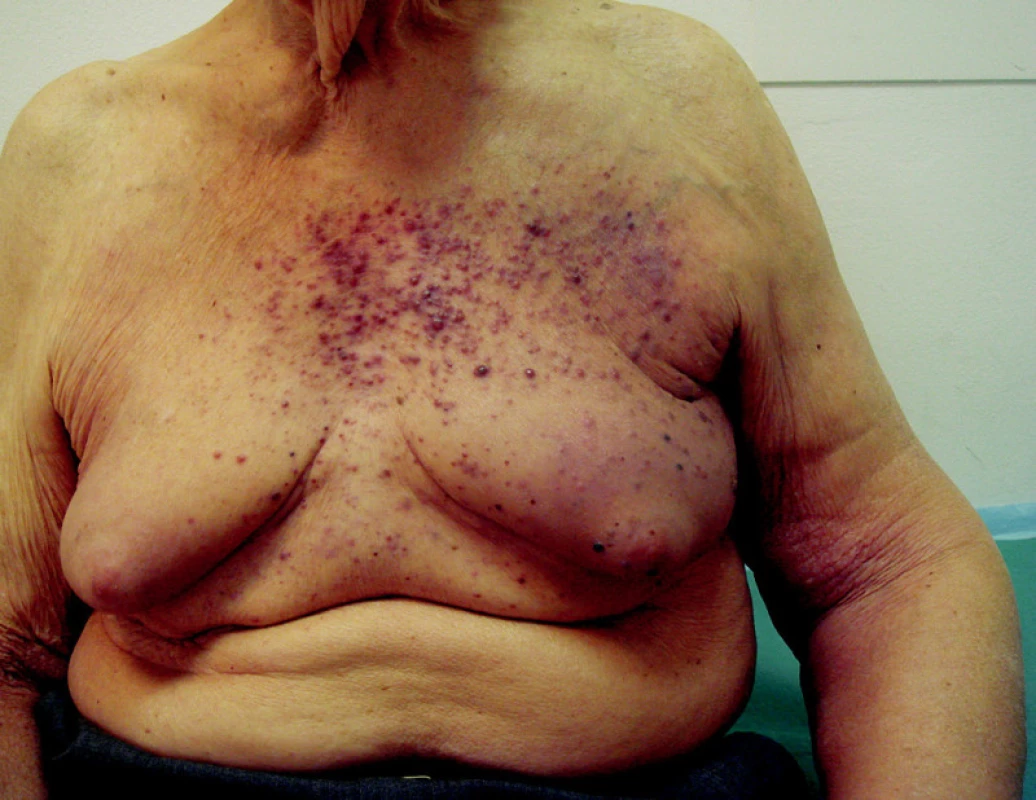
Při metastatickém postižení mízních uzlin, které jsou inoperabilní, se běžně indikuje lokální ozáření. Používají se jednotlivé dávky mezi 1,8 a 2 Gy s celkovou dávkou mezi 50–54 Gy. Jako časnou komplikaci aktinoterapie zde můžeme pozorovat vznik radiační dermatitidy a pozdním následkem této léčby bývá vznik fibrózy v ozařované oblasti nebo lymfedém postižené končetiny.
Kostní metastázy lze paliativně ozařovat, pozitivně zareaguje 67–85 % nemocných. Indikací tu je paliativní ozáření při bolestech, ovlivnění statiky těla nebo komprese spinálního kanálu s neurologickou symptomatologií nebo bez ní. Celkově se podává 35–36 Gy v dávkách 2,5–3 Gy na sezení.
U solitárních mozkových metastáz je indikována operační resekce nebo ozáření Lekselovým gama nožem. Výhodou stereotaktického ozáření je minimální poškození okolních tkání. Při kombinaci lokální terapie (operace nebo stereotaktické ozáření) v kombinaci s ozářením celého mozku lze dosáhnout zdvojnásobení délky přežití v průměru ze 4 na 10 měsíců.
Chemoterapie a chemoimunoterapie v paliativních indikacích
Indikací k celkové chemoterapii nebo chemoimunoterapii jsou inoperabilní recidivy nádorů, inoperabilní regionální metastázy a vzdálené metastázy stadia IV. Nejčastěji jsou jako první vnitřní orgán postiženy plíce. V dalším průběhu onemocnění se objevují metastázy v játrech, v centrálním nervovém systému, kostech, gastrointestinálním traktu a dalších orgánech. S počtem postižených orgánů stoupá i závažnost onemocnění. Protože léčba probíhá z paliativního hlediska, je třeba vždy zohledňovat kvalitu života jedince.
Pacienti s metastázami v kůži, měkkých tkáních, lymfatických uzlinách nebo pouze v plicích (limitované onemocnění) by měli být léčeni jiným terapeutickým postupem, protože reagují na léčbu lépe než pacienti s metastázami v játrech, skeletu, mozku nebo s generalizovanými metastázami (extenzivní onemocnění). V celkové monoterapii pokročilých stadií je k dispozici více preparátů, jejichž účinnost je srovnatelná (tab. 3).
Tab. 2. Příklady monoterapie a polychemoterapie melanomu stadia IV 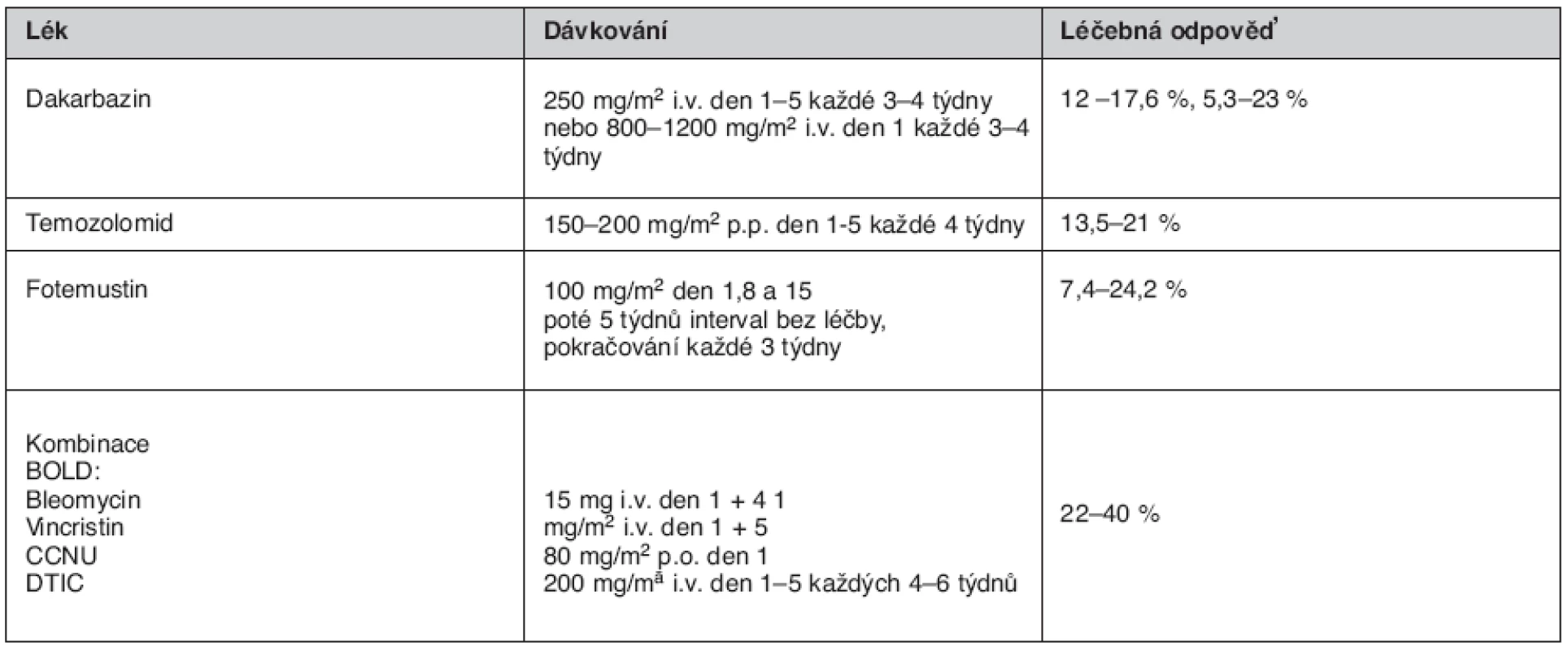
Při kombinaci cytostatik s cytokiny lze dosáhnout zvýšení účinnosti léčby. V dosud provedených studiích se ale neprokázalo signifikantní prodloužení celkové doby přežití. Nasazení interferonu alfa nebo interleukinu-2 k monoterapii zvýší procento nežádoucích účinků. Kombinace několika chemoterapeutik – polychemoterapie nebo chemoterapeutik s cytokiny – polychemoimunoterapie dosáhne vyššího počtu remisí, ale bez prodloužení celkového přežití. Toxicita polychemoterapie je také vyšší, a proto je pro udržení kvality života pacienta nutné aplikovat i podpůrnou léčbu, např. dakarbazinová schémata vyžadují účinnou antiemetickou terapii (granisetron).
Z novější, zatím ale experimentální, léčby metastázujícího melanomu je nutné zmínit látku oblimersen natrium, jenž představuje antisense přístup (15). Tento „antisense lék“ je složen z chemicky změněných malých fragmentů DNA (oligonukleotid). Specificky blokuje lidskou bcl-2 mRNA vedoucí k poklesu translace Bcl-2 proteinu. Bcl-2 protein je bílkovina, která se účastní antiapoptotických procesů a snižuje odpověď na apoptotické signály vyvolané protinádorovou léčbou. Zvýšená hladina Bcl-2 většinou znamená horší průběh onemocnění a rezistenci k chemoterapii. Podávání preparátu anti Bcl-2 by mělo potlačit rezistenci nádorových buněk k podávané chemoterapii a současně zvýšit jejich schopnost apoptózy.
Další preparát, nově zkoušený v léčbě metastázujícího melanomu, je monoklonální protilátka proti cytotoxickému T lymfocytárnímu antigenu 4 (CTLA-4). Tento antigen je exprimován na povrchu aktivovaných T-lymfocytů a blokuje imunitní odpověď navozenou interakcí T-buněčných receptorů TCR s molekulami HLA systému na povrchu antigen prezentujících buněk. Nová, plně humánní monoklonální protilátka, ipilimumab je v klinickém zkoušení. Selektivně se váže na antigen CTLA-4 na povrchu aktivovaných T-lymfocytů, čímž zabrání inhibiční modulaci jejich funkce, a zesílí tak imunitní odpověď. V prvních klinických studiích se prokázala celková léčebná odpověď u metastázujícího melanomu 21,6 % ve skupině s monoterapií a 31,4 % u kombinace s dakarbazinem (16).
Primární a sekundární prevence melanomu
Primární prevence souvisí s osvětou. Využívá šíření informací o škodlivém vlivu UV-záření, napomáhá vyhledávání rizikových osob a doporučuje pravidelné preventivní prohlídky.
Sekundární prevence spočívá ve sledování pacientů s maligním melanomem s cílem zabránit či včas podchytit progresi nebo odhalit duplicitu melanomu.
Dispenzarizace pacientů s maligním melanomem
Typ a délka dispenzarizace se odvíjí od klinického stadia pacienta. Dispenzarizace pacienta v prvních třech letech po operaci primárního nádoru je zejména důležitá, protože se v tomto období objevuje zhruba 70–80 % metastáz. Pozdní metastázy po 10 i 20 letech nejsou u melanomu výjimkou, proto by měla být dispenzární péče doživotní.
Při pravidelných kontrolách by mělo být standardně provedeno fyzikální vyšetření kůže a palpační vyšetření lymfatických uzlin. V závislosti na stadiu onemocnění (od Breslowa > 1 mm) se pak v pravidelných intervalech provádí: sonografické vyšetření regionálních lymfatických uzlin, sonografické vyšetření břicha včetně abdominálních lymfatických uzlin a RTG plic. U pacientů s lokoregionálním metastázováním se tato vyšetření doplňují o CT či magnetickou rezonanci mozku, případně o scintigrafii skeletu. U rizikových pacientů lze jako alternativu ke konvenčním vyšetřovacím postupům zvážit indikaci PET-CT. Kromě včasného rozpoznání progrese onemocnění a psychosociální péče slouží dispenzární péče u pacientů s melanomem i k diagnostice duplicitních melanomů, jimiž je tato populace ohrožena čtrnáctinásobně více.
Zkratky
AJCC – American Joint Commission on Cancer
ALM – akrolentiginózní melanom
ALP – alkalická fosfatáza
CCNU – lomustin
CRP – C-reaktivní protein
CT – počítačová tomografie
CTLA-4 – cytotoxický T-lymfocytární antigen 4
DNA – deoxyribonukleová kyselina
DTIC – dakarbazin
GM-CSF – granulocytárnía makrofágové kolonie stimulujícífaktor
HLA – human leukocyte antigen
IL-2 – interleukin 2
IL-12 – interleukin 12
LMM – lentigo maligna melanom
MIA – melanoma inhibitory activity
MSLT-1 – multicenter sentinel lymphadenectomy trial
mRNA – messengerová ribonukleová kyselina
NM – nodulární melanom
PET-CT – pozitronová emisní tomografie-počítačová tomografie
RT-PCR – polymerázová řetězová reakce v reálném čase
SLN – sentinelová uzlina
SSM – povrchově se šířící melanom
TCR – T-cell receptor
Adresa pro korespondenci:
prof. MUDr. Petr Arenberger, DrSc., MBA
Dermatovenerologická klinika 3. LF UK a FNKV
Šrobárova 50, 100 34 Praha 10
e-mail: arenberger@fnkv.cz, e-mail: dermasec@fnkv.cz
Zdroje
1. Garbe C. Mangement des Melanoms. Heidelberg: Springer 2006; 4.
2. Ettler K. Fotoprotekce kůže. Praha: Triton 2004; 47.
3. King M, Spooner D, Rowlands DC. Spontaneous regression of metastatic malignant melanoma of the parotid gland and neck lymph nodes: a case report and a review of the literature. Clin Oncol (R Coll Radiol) 2001; 13 : 466–469.
4. Weatherhead SC, Haniffa M, Lawrence CM. Melanomas arising from naevi and de novo melanomas-does origin matter? Br J Dermatol 2007; 156, s.72–76.
5. Balch CM, Buzaid AC, Soong SJ, et al. New TNM melanoma staging system: linking biology and natural history to clinical outcomes. Semin Surg Oncol 2003; 21 : 43–52.
6. Garbe C, Liter U. Melanoma epidemiology and trends. Clin Dermatol 2009; 27 : 3–9.
7. Kittler H. Use of digital dermoscopy to monitor melanocytic lesions: risks and benefits. J Drugs Dermatol 2003; 2 : 309–311.
8. Friedman RJ, Rigel DS. The clinical features of malignant melanoma. Dermatol Clin 1985; 3 : 271–283.
9. Arenberger P, Arenbergerova M, Gkalpakiotis S, et al. Multimarker real-time reverse transcription-PCR for quantitative detection of melanoma-associated antigens: a novel possible staging method. J Eur Acad Dermatol Venereol 2008; 22 : 56–64.
10. Lederman JS, Sober AJ. Does biopsy type influence survival in clinical stage I cutaneous melanoma? J Am Acad Dermatol 1985; 13 : 983–987.
11. Ross MI, Gershenwald JE. How should we view the results of the Multicenter Selective Lymphadenectomy Trial-1 (MSLT-1)? Ann Surg Oncol 2008; 15 : 670–673.
12. Grob JJ, Dreno B, de la SalmoniŹre P, et al. Randomised trial of interferon alpha–2a as adjuvant therapy in resected primary melanoma thicker than 1.5 mm without clinically detectable node metastases. French Cooperative Group on Melanoma. Lancet 1998; 351 : 1905–1910.
13. Kirkwood JM, Ibrahim JG, Sondak VK, et al. High - and low-dose interferon alfa-2b in high-risk melanoma: first analysis of intergroup trial E1690. J Clin Oncol 2000; 18 : 2444–2458.
14. Eggermont AM, Suciu S, Saštinami M, et al. Adjuvant therapy with pegylated interferon alfa-2b versus observation alone in resected stage III melanoma: final results of EORTC 18991, a randomised phase III trial. Lancet 2008; 372 : 117–126.
15. Bedikian AY, Millward M, Pehamberger H, et al. Bcl-2 antisense (oblimersen sodium) plus dacarbazine in patients with advanced melanoma: the Oblimersen Melanoma Study Group. J Clin Oncol 2006; 24 : 4738–4745.
16. Poust J. Targeting metastatic melanoma. Am J Health Syst Pharm 2008; 65 : 9–15.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
-
Všechny články tohoto čísla
- Maligní melanom: standardy a inovace v diagnostice a terapii
- Beta-blokátory navozená bradykardie nemá kardioprotektivní účinek u hypertoniků
- Utváření cévního řečiště: přehled molekulárních mechanismů a možnosti terapeutického ovlivnění
- Kniha
- Mirizziho syndrom s cholecystoduodenální píštělí – vzácná komplikace cholecystolitiázy
- Význam sfingosinového fosfátu v imunitě
- Závislost imunitní odpovědi na pohlaví
- Bezkrevní medicína
- Léčba závislosti na kanabinoidech
- Dendritické buňky v imunitní odpovědi
- Dvacet let od založení první Obezitologické jednotky v Československu
- Bezpečnostní profil anti-TNF terapie u nespecifických zánětů střevních
- Imunitní odpověď na protichřipkovou vakcinaci u dětí s nespecifickými záněty střevními
- Cyklosporin a infliximab jako záchranná terapie u pacientů s ulcerózní kolitidou refrakterní na kortikosteroidní terapii.
- XXXIV. angiologické dny s mezinárodní účastí
- Spolek lékařů českých
- LAUREÁTI NOBELOVY CENY
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Mirizziho syndrom s cholecystoduodenální píštělí – vzácná komplikace cholecystolitiázy
- Bezkrevní medicína
- Maligní melanom: standardy a inovace v diagnostice a terapii
- Léčba závislosti na kanabinoidech
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




