-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Utváření cévního řečiště: přehled molekulárních mechanismů a možnosti terapeutického ovlivnění
Formation of the vascular bed: a review of its molecular mechanisms and therapeutic implications
This review provides an update on recent advances in the field of molecular mechanisms of vascular bed development. We introduce the data about growth factors and their receptors and discuss the therapeutic potential of their modulation. The role of tissue hypoxia in vessel development is presented and documented by our own results. We review the role of ephrins and their receptors in differentiation of arterial and venous phenotype of endothelial cells and its loss in vein graft during adaptation to arterial circulation. Role of mutation in Foxc2 associated with valve failure in veins is discussed. Recent findings showing common genetic signals navigating blood vessels and nerves to common pathways are also described. Finally, we summarize current state of knowledge in therapeutic induction and inhibition of angiogenesis.
Key words:
vasculogenesis, angiogenesis, growth factors, hypoxia.
Autoři: O. Naňka; M. Grim
Působiště autorů: Univerzita Karlova v Praze, 1. lékařská fakulta, Anatomický ústav
Vyšlo v časopise: Čas. Lék. čes. 2009; 148: 158-163
Kategorie: Přehledový článek
Souhrn
Článek podává aktuální přehled o molekulárních mechanismech tvorby cévního řečiště. Je podán přehled poznatků o růstových faktorech endotelu krevních cév a jejich receptorech na angiogenních a endotelových buňkách. Je popsán a vlastními experimenty dokumentován význam tkáňové hypoxie pro aktivaci produkce VEGF a novotvorbu cév. Jsou zmíněny nové poznatky o efrinech a jejich receptorech, které řídí diferenciaci tepenné a žilní části krevního řečiště a o ztrátě fenotypu žilního štěpu v arteriálním řečišti. Je uveden poznatek o mutaci Foxc2, která podmiňuje insuficienci žilních chlopní. Je popsán molekulární mechanismus objasňující společný průběh cév a nervů. Jsou zmíněny látky, které vaskularizaci tkání stimulují nebo naopak tlumí, a tak otevírají nové léčebné postupy.
Klíčová slova:
vaskulogeneze, angiogeneze, růstové faktory, hypoxie.Úvod
Tvorba krevních cév je nezbytná jak pro vývoj embrya, tak pro regeneraci a procesy hojení v dospělosti, ale také pro růst nádoru. Poznání nejúčinnější molekuly, která růst cév ovlivňuje, přineslo studium nádorového růstu.Již v roce 1939 vyslovil Ide na základě výsledků svých pokusů domněnku, že buňky nádoru uvolňují faktory, které stimulují jeho vaskularizaci (1). O několik desetiletí později byla tato domněnka experimentálně potvrzena, když Folkman et al. (1971) izolovali „tumor angiogenic factor“. Současně vyslovili předpoklad, že nádory lze léčit blokádou této angiogenní látky (2). Takováto angiogenní látka byla izolována teprve v roce 1983 (3) a gen, který ji kóduje, byl identifikován v roce 1989 (4). Vyznačuje se specifickým mitogenním účinkem na angiogenní buňky a byla nazvána VEGF – Vascular Endothelial Growth Factor, růstový faktor cévního endotelu.
Poznání primární struktury VEGF umožnilo připravit specifickou myší anti-VEGF protilátku, která skutečně vykazovala inhibiční efekt in vivo (5). V roce 1997 byla připravena anti-VEGF protilátka, která se váže na lidské izoformy VEGF-A a jejich bioaktivní fragmenty (6). Byla nazvána bevacizumab a komerčně Avastin (Genentech). Prošla úspěšně klinickým testováním a v současnosti je Avastin používán jako lék první volby u metastazujícího kolorektálního karcinomu.
Na počátku 90. let minulého století byl poznán další významný faktor, který ovlivňuje tvorbu cév. Bylo zjištěno, že snížená tenze kyslíku ve tkáních má za následek zvýšenou expresi řady genů včetně VEGF. Vyvolávají ji faktory indukované hypoxií (HIF) (7). Zabývali jsme se studiem této kaskády a jejího významu pro embryonální růst cév, kdy je sycení tkání kyslíkem nižší než v dospělosti, a ukázali jsme, že mírná hypoxie se uplatňuje jako jeden z řídících faktorů vaskularizace embryonálních základů orgánů (8, 9).
Moderní metody studia rozšířily poznatky o faktorech, které řídí utváření cévního řečiště, a otevřely tak cestu k terapeutickému uplatnění látek, které vaskularizaci tkání stimulují nebo naopak tlumí. Problematika tvorby krevních cév se tak stala aktuálním tématem také v klinické medicíně.
Vznik a přestavba cévního řečiště
Základní stavební a funkční jednotkou cévního řečiště je endotelová buňka. Vzniká z prekurzorových buněk, angioblastů, jejichž diferenciace z buněk mesodermu je indukována buněčnými interakcemi, podobně jako při diferenciaci dalších buněčných linií v mnohobuněčném organismu. Angioblasty a endotelové buňky exprimují receptor růstového faktoru cévního endotelu (VEGFR2) a mají specifickou schopnost tvořit trubice a luminizované výběžky těchto trubic. Mechanismus, který se přitom uplatňuje, není dosud jednoznačně objasněn. V současné době převažuje názor, že cévní dutina vzniká z navzájem se propojujících intracelulárních vakuol (10). Alternativou zůstává vznik cévního lumen z extracelulárního prostoru (11).
První cévy vznikají spojováním krevních ostrůvků v mezodermu stěny žloutkového váčku, zárodečného stvolu a choria. Buňky krevních ostrůvků (hemangioblasty) mají dvojí vývojový potenciál. V centru ostrůvku se nacházejí výchozí buňky extraembryonální krvetvorby (hemoblasty) a stěnu ostrůvku tvoří prekurzory endotelových buněk (angioblasty). Ostrůvky se vzájemně propojují za vzniku pletení a trubic, které vrůstají do embrya, kde se spojují s cévami, které se tvoří ve vlastním embryu (12).
Intraembryonální angioblasty se diferencují z paraaxiálního mezodermu a z mezodermu splanchnopleury. Jejich diferenciaci navozují signální molekuly produkované buňkami entodermu a buňkami chorda dorsalis. Angioblasty tvoří nejprve primitivní sítě a pruhy, ve kterých záhy vzniká lumen, napojují se na srdce a tvoří základy velkých axiálních cév. Stěna těchto cév je zpočátku tvořena pouze endotelem. U člověka v nich proudí krev od 4. týdne a hemodynamika se uplatňuje jako jeden z formujících faktorů jejich vývoje (12). Další angioblasty, které se diferencují v paraaxiálním mezodermu, migrují do stěny trupu a do základů končetin dříve, než vytvoří definitivní cévy (13, 14). Vývoj primárních extra - a intra-embryonálních pletení a cév z angioblastů je označován termínem vaskulogeneze (obr. 1). Další fází vývoje je remodelace primárního cévního řečiště a jeho pokračující růst označovaný termínem angiogeneze. Spočívá v rychlé proliferaci endotelových buněk a v jejich pučení (sprouting) ze stěny již existujících cév. Angiogeneze je spojena s diferenciací stěny artérií a vén. Z buněk okolního mezenchymu se diferencují pericyty a hladké svalové buňky. Jejich interakce s endotelovými buňkami je zprostředkována signalizací mezi angiopoietiny a Tie receptory. Postupně se tak diferencují další složky cévní stěny.
Obr. 1. Schéma vývoje krevních a lymfatických cév Primární cévní pleteně vznikají procesem vaskulogeneze z angioblastů pod vlivem růstového faktoru VEGF. Termínem angiogeneze je označován vznik diferencovaného řečiště remodelací a růstem primárních pletení. Ve stěně větších cév se objevují pericyty a hladké svalové buňky. Lymfatické cévy vznikají většinou pučením z venózního endotelu. Zkratky jsou vysvětleny v textu článku. 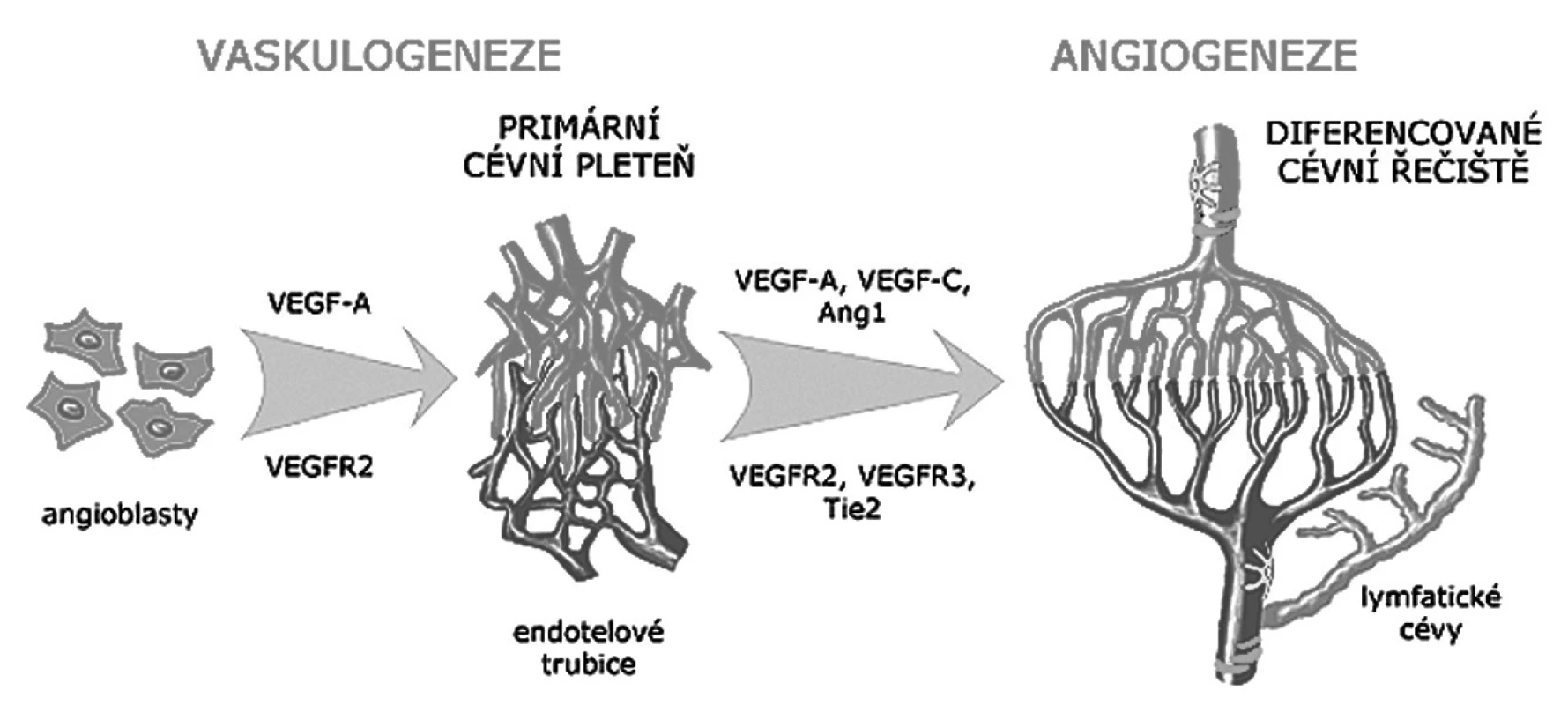
Lymfatické cévy se začínají tvořit o několik dní později než krevní cévy. Jejich diferenciaci navozuje exprese transkripčního faktoru Prox-1. Hluboké lymfatické cévy vznikají z endotelu velkých žil a povrchové cévy zřejmě také z lymfatických angiogenních prekursorů (15). Pro endotel lymfatických cév je typická exprese receptoru VEGFR3, na který se váže růstový faktor VEGF-C.
V dospělosti může být cévní řečiště přestavováno procesem, který je nazýván arteriogeneze (16). Je to rychlá proliferace malých kolaterálních tepen a jejich transformace ve větší přívodné tepny navozená postupně vznikajícím uzávěrem hlavní cévy. Je vyvolána hemodynamickým a mechanickým stresem (shear stress), který vede k akumulaci aktivovaných monocytů a makrofágů na poškozeném endotelu a k produkci řady cytokinů (MCP-1, GM-CSF, TGF-β, FGF-2), které stimulují částečnou degradaci původní arterioly a současně také proliferaci endotelových a hladkých svalových buněk. Arteriogeneze není provázena zvýšenou expresí VEGF a jeho receptorů a podání VEGF ji významněji neovlivňuje.
Růstové faktory cévního endotelu a jejich receptory
Proliferace a diferenciace angiogenních buněk je řízena růstovými faktory z rodiny VEGF. Do této rodiny patří VEGF-A–E, dále růstový faktor krevních destiček (PDGF) a placentární růstový faktor (PlGF). Jednotlivé faktory se vyznačují určitými specifickými vlastnostmi, i když se svým vlivem na růst cév zčásti překrývají (17).
VEGF-A se uplatňuje jako mitogen, který zároveň stimuluje endotelové buňky k degradaci extracelulární matrix, k migraci, k jejich diferenciaci a tvorbě cévních trubic. Zvyšuje také permeabilitu cév a indukuje antiapoptotické proteiny. Byly popsány různé formy VEGF-A (díky alternativnímu sestřihu), pro které je charakteristická orgánově specifická distribuce. Menší molekuly volně difundují, větší jsou vázány na extracelulární matrix. Za vývoje je VEGF-A exprimován extra - i intra-embryonálně a jeho exprese je na rozdíl od dalších členů rodiny VEGF stimulována hypoxií. Lokální produkce VEGF-A navozená hypoxií představuje molekulární substrát parakrinního signálního systému zodpovědného za lokální angiogenezi (18).
VEGF-B je exprimován především v kosterní svalovině, v myokardu a v hnědé tukové tkáni. Přesná úloha VEGF-B není dosud známa. Zřejmě se uplatňuje i při vývoji koronárního řečiště, neboť mutantní myši s delecí genu pro VEGF-B mají menší srdce (17).
VEGF-C hraje roli především v proliferaci endotelových buněk lymfatických cév a je považován za primární lymfangiogenní růstový faktor. V dospělosti je exprimován také v srdci, v tenkém střevě, v placentě a ve štítné žláze.
VEGF-D je exprimován v celé řadě tkání zejména v dospělosti. Stimuluje proliferaci endotelu krevních i lymfatických cév, není ale pro jejich vývoj nezbytný.
VEGF-E byl objeven jako součást genomu parapoxviru (Orf virus). Infekce tímto virem vede ke kožním lézím s proliferací a dilatací kapilár (17).
Růstový faktor krevních destiček, PDGF, byl izolován z trombocytů, ale je produkován v celé řadě buněk. Je to rodina několika faktorů a jejich receptorů, které ovlivňují růst různých buněk a tkání včetně endotelu. PlGF byl izolován z lidské placenty, kde se také uplatňuje vazbou na receptory VEGFR1 a 2.
Receptory pro VEGF jsou tyrozinkinázového typu a jsou označovány číslicemi 1–3. VEGFR1 se vyskytuje především v endotelu srdeční a kosterní svaloviny a váže se na něj VEGF-B (17). VEGFR2 slouží především pro vazbu VEGF-A (19). Tento receptor je exprimován již v angioblastech krevních ostrůvků a jeho vyřazení vede k defektům v jejich utváření. VEGFR3 se vyskytuje v endotelu lymfatických cév a slouží proto jako jejich marker. Je receptorem pro VEGF-C a -D (20).
Vývoj krevních cév je ovlivňován také skupinou signálních molekul, ke kterým patří efriny a angiopoietiny. Efriny jsou signální molekuly, které se vážou na tyrozinkinázové Eph receptory. Protože efriny zůstávají zakotveny v cytoplazmatické membráně buněk, operují mezi buňkami, které jsou v kontaktu. Efekt vazby ligandu a receptoru je přitom obousměrný, neboť je aktivována nejen buňka nesoucí receptor, ale i buňka exprimující ephrin. Wang et al. (21) zjistili, že arteriální endotel exprimuje ephrin-B2 (ligand), kdežto venózní endotel exprimuje jeho receptor Eph-B4 (21). Dále ukázali, že za selektivní propojování venózních a arteriálních úseků kapilár při remodelaci primárního kapilárního řečiště je zodpovědná komplementarita molekuly ephrin-B2 a jeho Eph-B4 receptoru (obr. 2). Proporcionalita rozsahu arteriálního a venózního úseku kapilárního řečiště je tak výsledkem uvedené interakce. Potvrzením tohoto předpokladu je výskyt narušené diferenciace artérií z kapilárních pletení u myších embryí s vyřazeným genem pro ephrin-B2. Embrya odumírají okolo 10. dne vývoje (21).
Obr. 2. Interakce arteriálních a venózních úseků kapilár Mediátorem této interakce je ligand ephrin-B2 exprimovaný arteriálním endotelem a jeho receptor Eph-B4 na venózním endotelu. 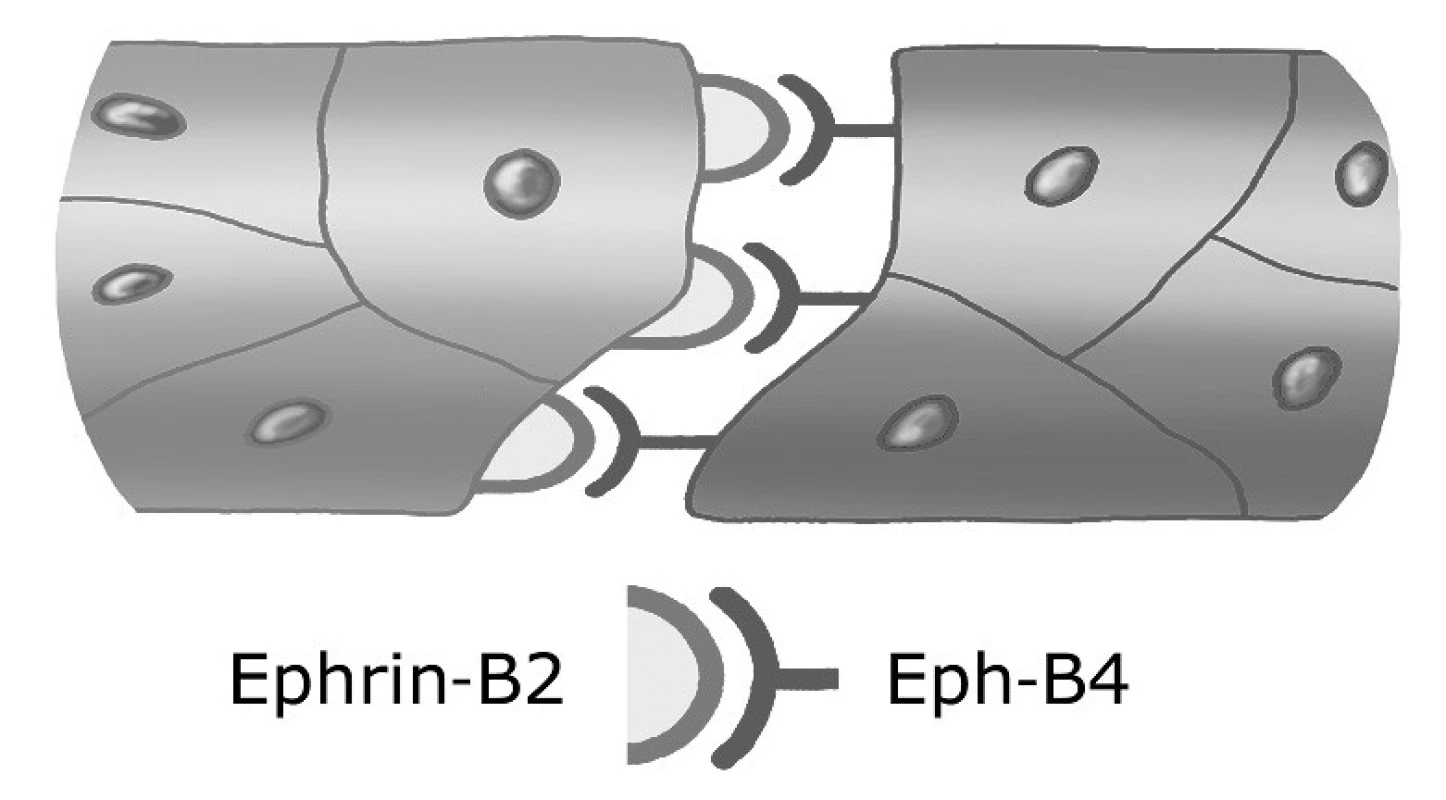
Angiopoietin 1–4 a jejich tyrozinkinázové receptory Tie1 a Tie2 se uplatňují při utváření a stabilizaci cévní stěny za vývoje i v dospělosti. Angiopoietiny jsou produkovány buňkami mezenchymu a hladké svaloviny, jejich receptory jsou obsaženy v cytoplazmatické membráně endotelových buněk. Uvedená signalizace je substrátem interakcí endotelu a přilehlého mezenchymu, ze kterého se diferencují pericyty a hladké svalové buňky ve stěně cév (22). Mutace receptoru Tie2 vede k familiárnímu výskytu žilních malformací, které se projevují dilatací žil, v jejichž stěně chybí hladké svalové buňky (23).
Neuropilin 1 a 2 (Nrp1, 2) jsou další receptory na povrchu endotelové buňky, které se mohou uplatňovat v diferenciaci arteriálního či venózního fenotypu díky schopnosti vázat specifické izoformy VEGF-A. Protože endotel artérií exprimuje především Nrp1, zatímco žilní endotel exprimuje Nrp2 (24), může být pomocí VEGF signalizace ovlivněna diferenciace arteriálního, resp. venózního endotelu.
Arteriální a venózní identita endotelu
Recentní studie ukazují, že arteriální a venózní identita cévy je za vývoje embrya určena genetickými mechanismy dříve, než se vyvine cirkulace (21). V určení arteriálního fenotypu dorzální aorty se uplatňuje signalizace zprostředkovaná molekulami Sonic hedgehog (Shh) produkovanými v chorda dorsalis. Buňky přilehlých somitů reagují na signalizaci Shh produkcí VEGF-A. Vazba VEGF-A na angiogenní buňky pak aktivuje transkripční faktory Foxc1 a Foxc2 a ty spouštějí signální kaskádu Delta/Notch. Ligand Delta a receptor Notch jsou membránové proteiny, které se uplatňují v interakci celé řady buněk nacházejících se ve vzájemném kontaktu. Za angiogeneze navozuje vazba ligandu Delta 4 na receptor Notch 1 expresi druhově odlišného transkripčního faktoru (gridlock u zebřičky, hesr1/hesr2 u myši), který aktivací exprese ephrinu-B2 vede k arteriální specifikaci endotelu (obr. 2). Naproti tomu je v endotelu vena cardinalis aktivován transkripční faktor COUP-TFII, který blokuje uvedenou kaskádu a navozuje expresi receptoru Eph-B4, který je odpovědný za venózní diferenciaci endotelu (25).
Zjištění, že arteriální a venózní endotel má rozdílnou identitu již od časných stadií vývoje, otevírá novou problematiku pro základní i klinický výzkum. Například by bylo zajímavé vědět, zda klinicky používané angiogenní a antiangiogenní látky mají selektivní vliv na arteriální, resp. venózní endotel. Je také otázkou, zda by bylo možné ovlivnit transformaci endotelu žilních bypassů používaných k přemostění arteriálního uzávěru. Kudo et al., kteří sledovali adaptaci žilního štěpu použitého k přemostění uzávěru v arteriálním řečišti, zjistili, že kromě ztluštění hladké svaloviny dochází ke ztrátě venózní identity endotelu vyjádřené vymizením exprese Eph-B4. Očekávaná indukce arteriálního markeru ephrinu-B2 však prokázána nebyla (26).
V souvislosti s uvedeným uplatněním transkripčního faktoru Foxc2 při diferenciaci arteriálního a venózního fenotypu je zajímavý nález mutace genu tohoto transkripčního faktoru u pacientů s primární insuficiencí žilních chlopní (27). Foxc2 se uplatňuje také při vývoji lymfatických cév a později je exprimován nejen v endotelu, ale také ve svalových buňkách a chlopních žil a lymfatických cév. Pacienti, kteří jsou nositeli Foxc2 mutace, mají insuficientní chlopně i v lymfatických cévách s následným rozvojem lymfedému.
Růst cév podél nervů
Je dobře známo, že celá řada tepen a žil probíhá společně s periferními nervy jako neurovaskulární svazky. Vysvětlení této vazby přineslo až zjištění, že signální molekuly, které navádějí periferní nervy na trasy jejich průběhu, jsou využívány také endotelem při formovánítrubic krevních cév. Mezi signální molekuly, které se přitom uplatňují, patří Netrin a jeho receptor UNC5B, Slit a jeho receptor Robo, Semaphorin 3A, který se váže na receptory Neuropilin 1 a 2 (28). Ke společnému průběhu senzitivních nervů a drobných tepen v podkoží přispívá také VEGF, který je produkován Schwannovými buňkami a atrahuje buňky na hrotu pučící cévy. Dalším příkladem vývojové koordinace průběhu cév a nervů je mechanismus, kterým jsou autonomní nervová vlákna naváděna na průběh artérií. Hladké svalové buňky cévní stěny tepen produkují signální molekulu artemin (ARTN), která atrahuje nervová vlákna sympatiku ke tvorbě periarteriální pleteně (28).
Význam tkáňové hypoxie pro tvorbu krevních cév
Na počátku poznání významu tkáňové hypoxie pro stimulaci tvorby cév bylo zjištění (29), že buňky reagují na sníženou tenzi kyslíku produkcí transkripčních faktorů indukovaných hypoxií (HIF). HIF faktory stimulují expresi celé řady genů, které usnadňují adaptaci na hypoxii. Jednou z těchto molekul je i VEGF-A – nejúčinnější stimulátor tvorby cév – a patří sem i erytropoetin, transferin a jeho receptor, enzymy glykolytického metabolismu, fosfoglycerát kináza, glukózové transportéry a endotelová NO syntáza (30). Postupně byla definována celá signální kaskáda (obr. 3) zodpovědná za vaskularizaci tkání vystavených hypoxii (31).
Obr. 3. Signální kaskáda od hypoxie k angiogeneze Hypoxie je definována rozmezím exponenciálního růstu hladiny HIF-1alfa. 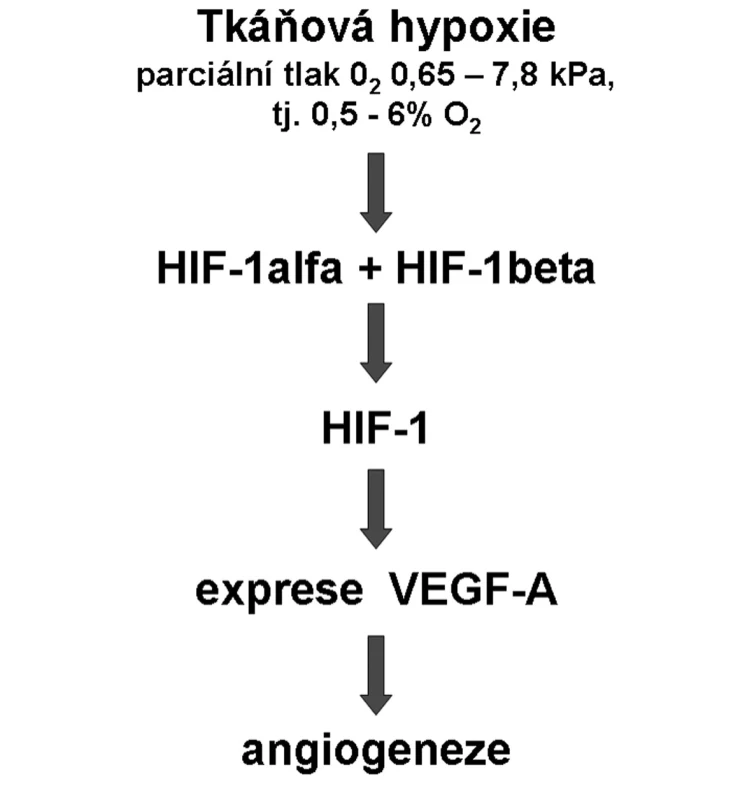
Byly popsány tři faktory HIF, které jsou označovány číslicemi 1–3. Klíčovou roli má HIF-1. Je to heterodimer složený z indukovatelné podjednotky alfa a trvale přítomné podjednotky beta. HIF-1alfa je v přítomnosti kyslíku rychle degradován, a proto je za normoxických podmínek jeho hladina nízká, kdežto za hypoxických podmínek je tato degradace snížena a hladina HIF-1 alfa ve tkáni vzrůstá. Její exponenciální růst začíná při 6% O2 (pO2 – 6 kPa) a maximální hladina je dosahována při 0–0,5% O2 (pO2 – 0–0,5 kPa) (30), přičemž minimální parciální tlak kyslíku, který umožňuje funkční oxidativní metabolismus mitochondrií je 0,133 kPa = 1mmHg = 0,1% O2 (32).
Prostorový gradient pO2 je složitý a je dán vzájemným uspořádáním kapilár a buněk, které kyslík spotřebovávají. Například v mozkové tkáni se pO2 může lišit až o 4–5 kPa v místech vzdálených od sebe pouze několik mikrometrů (33). Parciální tlak kyslíku ve tkáni lze měřit přímo pomocí platinové elektrody, ale je možný také imunohistochemický průkaz hypoxie v místech s parciálním tlakem kyslíku nižším než 10 mm Hg = 1,3 kPa = 1% O2 (34). Do oběhu se aplikují dusíkaté heterocyklické sloučeniny, které po hypoxické aktivaci enzymů ze skupiny nitroreduktáz vedou k tvorbě adduktů mezi podanou látkou a makromolekulami bílkovin. Tyto addukty jsou pak detegovatelné protilátkou (Hypoxyprobe), a tu lze vizualizovat v histologických řezech tkáněmi. V nádorové tkáni byly tímto způsobem znázorněny hypoxické okrsky, ve kterých byla tvorba cév stimulována. Důležitá je i skutečnost, že hypoxické okrsky se vyznačují sníženou radiosenzitivitou (34).
Použití imunohistochemického průkazu hypoxie při studiu embryonálních tkání ukázalo, že za embryonálního vývoje se hypoxické okrsky vyskytují fyziologicky, a že reprezentují místa fyziologické stimulace angiogeneze cestou kaskády HIF – VEGF – angiogeneze (8, 35). Exprese HIF faktorů navozuje vaskularizaci hypoxických okrsků; nejvíce je to patrné v neurální a trávicí trubici a za vývoje ledviny (obr. 4). V podmínkách zvýšené hypoxie se signální angiogenetická kaskáda uplatňuje ve zvýšené míře a hustota kapilárního řečiště v hypoxických tkáních narůstá (8). Lze proto usuzovat, že v řízení vývoje krevních cév se vedle genetických faktorů uplatňují změny lokálního mikroprostředí. Zatímco velké kmeny tepen a žil vznikají podle vývojového programu, který se vytvořil v průběhu historického vývoje, uplatňuje se za vývoje vaskularizace orgánů signální kaskáda navozená lokální produkcí HIF. Směr růstu nových kapilár odpovídá gradientu parciálního tlaku kyslíku ve tkáni, který s rostoucí vzdáleností od kapiláry klesá a zároveň stoupá produkce VEGF.
Obr. 4. A. Znázornění tkáňové hypoxie pomocí Hypoxyprobe na řezu glomerulem v mesonefros japonské křepelky 6. embryonální den. Třetí až šestý den byla koncentrace 02 snížena na 16 %. Modře jsou zbarveny okrsky tkáně s nižším parciálním tlakem kyslíku než 1,3 kPa přičemž intenzita zbarvení stoupá se stupněm hypoxie. Nejvyšší míru hypoxie vykazují podocyty (šipky); měřítko – 50 μm. B. Srovnatelný řez z embrya jako na obrázku A zpracovaný ke znázornění mRNA pro VEGF-A (modře) technikou in situ hybridizace a dobarvený protilátkou QH1 ke znázornění endotelu (hnědě). Podocyty (šipky) jsou největším zdrojem VEGF-A, který stimuluje tvorbu kapilárních kliček glomerulu; měřítko – 50 μm. 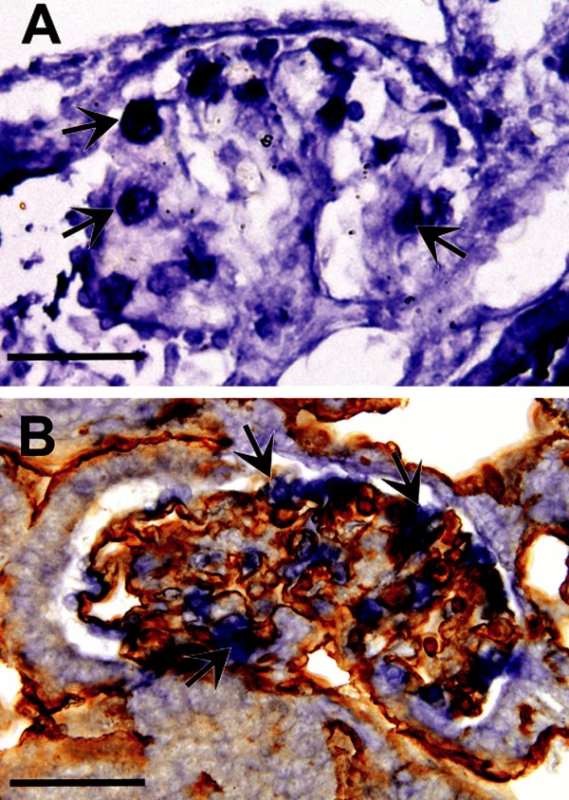
Terapeutické ovlivnění tvorby cév
Poznávání molekulární podstaty tvorby cév umožňuje hledat racionální ovlivnění tohoto děje s cílem tvorbu cév stimulovat nebo naopak potlačit. Terapeutické postupy zaměřené na zlepšení cévního zásobení jsou stále ve stadiu ověřování jejich efektivity. Podávání růstových faktorů (VEGF-A, VEGF C, FGF-1, 2 a 4) nepřineslo zatím pozitivní efekt ve srovnání s placebo-studiemi u pacientů s ICHDK či ICHS (36). Naproti tomu u pacientů s ICHDK vedla intramuskulární aplikace angiogenních buněk z autologní kostní dřeně k ústupu ischemické bolesti a k prodloužení klaudikačních intervalů. Transkutánním měřením byla v končetinách prokázána signifikantně zvýšená tenze kyslíku (36). Ve stadiu experimentu je intramyokardová injekce virového vektoru nesoucího gen pro HIF-1alfa, která přinesla zvýšenou perfuzi a lepší funkci levé komory (37).
Zastavit růst nádoru se podařilo blokádou VEGF na různých úrovních jeho signální kaskády. Inhibice samotného VEGF humanizovanou monoklonální protilátkou (bevacizumab) se zdá nejúčinnější. Bylo zjištěno, že bevacizumab významně omezuje novotvorbu cév. Usnadňuje i průnik cytostatik, protože současně snižuje intersticiální tlak v nádorové tkáni. Je proto vhodné kombinovat podání bevacizumabu s chemoterapií. V současné době je bevacizumab lékem první volby u kolorektálního karcinomu s metastázami (38). Některé studie však ukazují, že inhibice pučení cév a destrukce již vytvořených cév ustává po ukončení inhibice. V zachovaných bazálních membránách kapilár obklopených pericyty se může endotel obnovit (39).
Inhibice angiogeneze anti-VEGF protilátkou se osvědčila i u pacientů s makulární degenerací, které podléhá centrální část retiny pod makulou a která je způsobena tvorbou abnormálních cév se zvýšenou permeabilitou a krvácivostí. Lokální aplikace monoklonální anti-VEGF protilátky (ranibizumab, Lucentis) permeabilitu snižuje a růst cév omezuje (40).
Další, zatím méně využívanou možností blokády VEGF signalizace, je inhibice VEGF receptorů buď monoklonální protilátkou, nebo pomocí inaktivního heterodimeru VEGF, který obsadí vazebná místa receptorů (41). Blokovat lze i samotné tyrozinkinázy, které jsou součástí VEGF receptorů. Některé z takovýchto přípravků však blokují i tyrozinkinázy receptorů pro jiné růstové faktory (EGF, PDGF).
Lze využít i postupy genové terapie podáním antisense oligonukleotidů proti mRNA pro VEGF, nebo aplikací specifického ribozymu, který štěpí mRNA pro VEGF receptor (42).
Možnosti terapeutických zásahů do procesu tvorby cév otevírají v současné době nové oblasti klinické medicíny. Podmínkou jejich dalšího rozvoje je pokračující poznávání základních molekulárních mechanismů tvorby cévního řečiště.
Zkratky
ARTN – signální molekula artemin
EGF – epidermový růstový faktor
HIF – faktory indukované hypoxií
Nrp1, Nrp2 – Neuropilin 1 a 2
PDGF – růstový faktor krevních destiček
PlGF – placentární růstový faktor
VEGF – růstový faktor cévního endotelu
Práce byla vypracována s finanční podporou MŠMT ČR v průběhu řešení VZ 0021620806 a VC LC 06061.
Adresa pro korespondenci:
MUDr. Ondřej Naňka, Ph.D.
Anatomický ústav 1. LF UK
U Nemocnice 3, 128 00 Praha 2
e-mail: ondrej.nanka@lf1.cuni.cz
Zdroje
1. Ide AG. Vascularization of the Brown-Pearce rabbit epithelioma transplant as seen in the transparent ear chamber. Am J Radial 1939; 42 : 891–899.
2. Folkman J, Merler E, Abernathy C, Williams G. Isolation of a tumor factor responsible for angiogenesis. J Exp Med 1971; 133 : 275–288.
3. Senger DR, Galli J, Dvorak AM, Perruzzi CA, Harvey VS, Dvorak HF. Tumor cells secrete a vascular permeability factor that promotes accumulation of ascites fluid. Science 1983; 219: 983–985.
4. Ferrara N, Henzel WJ. Pituitary follicular cells secrete a novel heparin-binding growth factor specific for vascular endothelial cells. Biochem Biophys Res Commun 1989; 161: 851–858.
5. Kim KJ, Li B, Winer J, Armanini M, Gillett N, Phillips HS, Ferrara N. Inhibition of vascular end.othelial growth factor-induced angiogenesis suppresses tumour growth in vivo. Nature 1993; 362: 841–844.
6. Presta LG, Chen H, O’Connor J, Chisholm V, Meng YG, Krummen L, Winkler M, Ferrara N. Humanization of an anti-vascular endothelial growth factor monoclonal antibody for the therapy of solid tumors and other disorders. Cancer Res 1997; 57 : 4593–4599.
7. Shweiki D, Itin A, Soffer D, Keshet E. Vascular endothelial growth factor induced by hypoxia may mediate hypoxia-initiated angiogenesis. Nature 1992; 359 : 843–845.
8. Naňka O, Valášek P, Dvořáková M, Grim M. Experimental hypoxia and embryonic angiogenesis. Dev Dynamics 2006; 235 : 723–733.
9. Naňka O, Křížová P, Fikrle M, Tůma M, Bláha M, Sedmera D, Grim M. Abnormal myocardial and coronary vasculature development under hypoxia leads to embryonic heart failure and death. Anat Record 2008; 291 : 1187–1199.
10. Kamei M, Saunders WB, Bayless KJ, Dye L, Davis GE, Weinstein BM. Endothelial tubes assemble from intracellular vacuoles in vivo. Nature 2006; 442: 453–456.
11. Kucera T, Eglinger J, Strilić B, Lammert E. Vascular lumen formation from a cell biological perspective. Novartis Found Symp 2007; 283 : 46–56.
12. Schoenwolf GC, Bleyl B, Brauer PR, Francis-West PH. Larsen’s Human Embryology, 4. vyd. Philadelphia: Churchill Livingstone 2009; 712 s.
13. Wilting J, Brand-Saberi B, Huang R, Zhi Q, Kontges G, Ordahl CP, Christ B. Angiogenic potential of the avian somite. Dev Dynamics 1995; 202: 165–171.
14. Brand-Saberi B, Seifert R, Grim M, Wilting J, Kuehlewein M, Christ B. Blood vessel formation in the avian limb bud involves angioblastic and angiotrophic growth. Dev Dynamics 1995; 202 : 181–194.
15. Wilting J, Papoutsi M, Schneider M, Christ B. The lymphatic endothelium of the avian wing is of somitic origin. Dev Dynamics 2000; 217 : 271–278.
16. Buschmann I, Schaper W. Arteriogenesis Versus Angiogenesis: Two Mechanisms of Vessel Growth. News Physiol Sci 1999; 14 : 121–125.
17. Roya H, Bhardwaja S, Yla-Herttuala. Biology of vascular endothelial growth factors. FEBS Letters 2006; 580 : 2879–2887.
18. Millauer B, Wizigmann-Voos S, Schnurch H, Martinez R, Moller NP, Risau W, Ullrich A. High affinity VEGF binding and developmental expression suggest Flk-1 as a major regulator of vasculogenesis and angiogenesis. Cell 1993; 72 : 835–846.
19. Flamme I, Breier G, Risau W. Vascular endothelial growth‑factor (vegf) and vegf receptor-2(flk-1) are expressed during vasculogenesis and vascular differentiation in the quail embryo. Dev Biology 1995; 169 : 699–712.
20. Weinstein BM. What quides early embryonic blood vessel formation? Dev Dynamics 1999; 215 : 2–11.
21. Wang HU, Chen ZF, Anderson DJ. Molecular distinction and angiogenic interaction between embryonic arteries and veins revealed by ephrin-B2 and its receptor Eph-B4. Cell 1998; 93 : 741–753.
22. Suri C, Jones PF, Patan S, Bartunkova S, Maisonpierre PC, Davis S, Sato TN, Yancopoulos GD. Requisite role of angiopoietin-1, a ligand for the TIE2 receptor, during embryonic angiogenesis. Cell 1996; 87 : 71–80.
23. Vikkula M, Boon LM, Carraway KL, Calvert JT, Diamonti AJ, Goumnerov B, Pasyk KA, Marchuk DA, Warman ML, Cantley LC, Mulliken JB, Olsen BR. Vascular dysmorphogenesis caused by an activating mutation in the receptor tyrosine kinase Tie2. Cell 1996; 87 : 1181–1190.
24. Herzog Y, Kalcheim Ch, Kahane N, Reshef R, Neufeld G. Differential expression of neuropilin-1 and neuropilin-2 in arteries and veins. Mech Dev 2001; 109 : 115–119.
25. Aitsebaomo J, Portbury AL, Schisler JC, Patterson C. Brothers and sisters: molecular insights into arterial-venous heterogeneity. Circ Res 2008; 103 : 929–939.
26. Kudo FA, Muto A, Maloney P, Pimiento JM, Bergaya S, Fitzgerald TN, Westvik TS, Frattini JC, Breuer CK, Cha CH, Nishibe T, Tellides G, Sessa WC, Dardik A. Venous identity is lost but arterial identity is not gained during vein graft adaptation. Arterioscler Thromb Vasc Biol 2007; 27 : 1562–1572.
27. Mellor RH, Brice G, Stanton AW, French J, Smith A, Jeffery S, Levick JR, Burnand KG, Mortimer PS. Mutations in FOXC2 are strongly associated with primary valve failure in veins of the lower limb. Circulation 2007; 115 : 1912–1920.
28. Eichmann A, Le Noble F, Autiero M, Carmeliet P. Guidance of vascular and neural network formation. Curr Opin Neurobiol 2005; 15 : 108–115.
29. Semenza GL, Wang GL. A Nuclear Factor Induced by Hypoxia via De Novo Protein Synthesis Binds to the Human Erythropoietin Gene Enhancer at a Site Required for Transcriptional Activation. Mol Cell Biol 1992; 12 : 5447–5454.
30. Semenza GL, Agani F, Iyer N, Kotch L, Laughner E, Leung S, Yu A. Regulation of cardiovascular development and physiology by hypoxia-inducible factor 1. Ann NY Acad Sci 1999; 874 : 262–268.
31. Shweiki D, Itin A, Soffer D, Keshet E. Vascular endothelial growth factor induced by hypoxia may mediate hypoxia-initiated angiogenesis. Nature 1992; 359 : 843–845.
32. Chance B, Cohen P, Jobsis F, Schoener B. Intracellular oxidation-reduction states in vivo. Science 1962; 137 : 499–508.
33. Nečas E. Patofyziologie zásobování organismu a jeho tkání kyslíkem. Praha: Avicenum 1982; 258 s.
34. Raleigh JA, Calkins-Adams DP, Rinker LH, Ballenger CA, Weissler MC, Fowler WC. Jr, Novotny DB, Varia MA. Hypoxia and vascular endothelial growth factor expression in human squamous cell carcinomas using pimonidazole as a hypoxia marker. Cancer Res 1998; 58 : 3765–3768.
35. Lee YM, Jeong CH, Koo Y, Son MJ, Song HS, Bae K, Raleigh JA, Chung HY, Yoo MA, Kim KW. Determination of hypoxia region by hypoxia marker in developing mouse embryos in vivo: A possible signal for vessel development. Dev Dynamics, 2001; 220 : 175–186.
36. Ferrara N, Kerbel, RS. Angiogenesis as a therapeutic target. Nature 2005; 438 : 967–974.
37. Heinl-Green A, Radke PW, Munkonge FM, Frass O, Zhu J, Vincent K, Geddes DM, Alton EW. The efficacy of a ‘master switch gene’ HIF-1alpha in a porcine model of chronic myocardial ischaemia. Eur Heart J 2005; 26 : 1327–1332.
38. Ferrara N, Hillan KJ, Gerber HP, Novotny W. Discovery and development of bevacizumab, an anti-VEGF antibody for treating cancer. Nat Rev Drug Discov 2004; 3 : 391–400.
39. Kamba T, McDonald DM. Mechanisms of adverse effects of anti-VEGF therapy for cancer. Br J Cancer 2007; 96 : 1788–1795.
40. Hernandez-Pastor LJ, Ortega A, Garcia-Layana A, Giraldez J. Ranibizumab for neovascular age–related macular degeneration. Am. J. Health Syst. Pharm 2008; 65 : 1805–1814.
41. Pourgholami MH, Morris DL. Inhibitors of vascular endothelial growth factor in cancer. Cardiovasc. Hematol Agents Med Chem 2008; 6 : 343–347.
42. Sandberg JA, Sproul CD, Blanchard KS. Acute toxicology and pharmacokinetic assessment of a ribozyme (Angiozyme) targeting vascular endothelial growth factor receptor mRNA in the Cynomolgus monkey. Antisense Nucl Acid Drug Develop 2000; 10 : 153–162.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Maligní melanom: standardy a inovace v diagnostice a terapii
- Beta-blokátory navozená bradykardie nemá kardioprotektivní účinek u hypertoniků
- Utváření cévního řečiště: přehled molekulárních mechanismů a možnosti terapeutického ovlivnění
- Kniha
- Mirizziho syndrom s cholecystoduodenální píštělí – vzácná komplikace cholecystolitiázy
- Význam sfingosinového fosfátu v imunitě
- Závislost imunitní odpovědi na pohlaví
- Bezkrevní medicína
- Léčba závislosti na kanabinoidech
- Dendritické buňky v imunitní odpovědi
- Dvacet let od založení první Obezitologické jednotky v Československu
- Bezpečnostní profil anti-TNF terapie u nespecifických zánětů střevních
- Imunitní odpověď na protichřipkovou vakcinaci u dětí s nespecifickými záněty střevními
- Cyklosporin a infliximab jako záchranná terapie u pacientů s ulcerózní kolitidou refrakterní na kortikosteroidní terapii.
- XXXIV. angiologické dny s mezinárodní účastí
- Spolek lékařů českých
- LAUREÁTI NOBELOVY CENY
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Mirizziho syndrom s cholecystoduodenální píštělí – vzácná komplikace cholecystolitiázy
- Bezkrevní medicína
- Maligní melanom: standardy a inovace v diagnostice a terapii
- Léčba závislosti na kanabinoidech
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



