-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaCytokine release syndrom po terapii CAR T-lymfocyty: přehled literatury a naše zkušenosti
Cytokine release syndrome after CAR T-cell therapy: a review of the literature and our experience
Cytokine release syndrome is an acute systemic inflammatory response triggered by overactivation of the immune system that may be initiated by a variety of factors. The incidence of cytokine release syndrome is high, especially after immunotherapy with chimeric antigen receptor T-cells, which is effective for refractory or recurrent B cell hematological malignancies. Cytokine release syndrome occurs due to a high level of immune activation of lymphocytes, macrophages, or myeloid cells with a subsequent massive release of inflammatory cytokines.
After chimeric antigen receptor T-cell therapy, symptoms appear within days of infusion, which correlates with the maximum T-cells expansion. The monocyte-macrophage system, which is the main source of the most important cytokines, plays a key role in pathophysiology. The central mediator of toxicity is interleukin 6.
Cytokine release syndrome is presented by fever, hypotension, and hypoxia, severe forms are clinically indistinguishable from sepsis and may lead to multiorgan failure.
Because chimeric antigen receptor T-cell immunotherapy is a potentially curative treatment, patients should be provided with full resuscitation care after administration of this therapy. In severe cytokine release syndrome, treatment with tocilizumab is indicated, after which symptoms usually resolve rapidly. The challenge in clinical practice is to differentiate cytokine release syndrome from other serious conditions, which may be concomitant and may require a different therapeutic approach.
Keywords:
immunotherapy – cytokine release syndrome – multiple organ failures
Autoři: B. Čemusová
Působiště autorů: Ústav hematologie a krevní transfuze, Praha
Vyšlo v časopise: Anest. intenziv. Med., 33, 2022, č. 2, s. 90-96
Kategorie: Přehledový článek
Souhrn
Syndrom uvolnění cytokinů, cytokine release syndrom, je systémová zánětlivá odpověď organismu vyvolaná vystupňovanou aktivací imunitního systému v reakci na různé faktory. Vysoká incidence cytokine release syndromu je zejména po imunoterapii T-buňkami chimérického receptoru antigenu, která je vysoce efektivní na refrakterní nebo opakovaně relabující hematologické malignity z B‑buněk.
Syndrom uvolnění cytokinů vzniká v důsledku nepřiměřené imunitní aktivace lymfocytů, makrofágů nebo myeloidních buněk s následným masivním uvolněním zánětlivých cytokinů.
V případě terapie T-buňkami chimérického receptoru antigenu se příznaky objevují v řádu dnů po infuzi, což koreluje s maximem in vivo expanze T-lymfocytů. Klíčovou roli v patofyziologii hraje monocyto-makrofágový systém, který je hlavním zdrojem nejdůležitějších cytokinů. Hlavním mediátorem toxicity je interleukin 6.
Ke klinickému průběhu patří horečka, hypotenze a hypoxie, těžké formy jsou klinicky neodlišitelné od sepse a můžou vést k multiorgánovému selhání.
Vzhledem k tomu, že je imunoterapie T-buňkami chimérického receptoru antigenu potenciálně kurativní, měla by být pacientům po jejím podání poskytována plná resuscitační péče. V případě těžkého syndromu z uvolnění cytokinů je indikována léčba tocilizumabem, po jehož podání obvykle symptomy rychle odezní. Výzvou v klinické praxi bývá odlišení cytokine release syndromu od jiných závažných stavů, které mohou probíhat i konkomitantně a mohou vyžadovat odlišný terapeutický přístup.
Klíčová slova:
multiorgánové selhání – imunoterapie – cytokine release syndrom
Úvod
Syndrom uvolnění cytokinů, cytokine release syndrome (CRS), je systémová zánětlivá odpověď organismu projevující se zejména horečkou, hypotenzí a hypoxií, která je vyvolána vystupňovanou aktivací imunitního systému v reakci na různé faktory, nejčastěji imunoterapii, chemoterapii (oxaliplatina [1], lenalidomid [2]) či těžké virové infekce (Influenza [3, 4], covid-19 [5]).
Nejčastějšími příčinami CRS jsou terapie CAR T-lymfocyty (chimeric antigen receptor T-lymfocyty), podání monoklonálních protilátek (muromonab-CD3, alemtuzumab, rituximab, obinutuzam, brentuximab, nivolumab), blinatumomabu (bispecifická protilátka aktivující T‑lymfocyty) či provedení allogenní transplantace krvetvorných buněk od HLA haploidentického dárce.
Tento článek shrnuje současné poznatky o CRS po imunoterapii CAR T-lymfocyty a naše zkušenosti z klinické praxe.
CAR T‑lymfocyty
Léčba CAR T-lymfocyty je jedním z nejvýznamnějších milníků imunoterapie. Využívá geneticky modifikované autologní T-lymfocyty upravené tak, aby produkovaly umělý receptor specificky rozeznávající cílový antigen. Dosud se velmi úspěšně používá u refrakterních nebo opakovaně relabujících B-nonHodgkinských lymfomů a B-akutní lymfoblastové leukemie, u kterých dokáže často navodit i dlouhotrvající remisi. Nové přípravky rozšířily spektrum indikací o lymfom z buněk pláště a mnohočetný myelom.
Terapie CART - lymfocyty může vést k těžkým až život ohrožujícím komplikacím, zejména v prvních dnech a týdnech po podání, vedle CRS se jedná zejména o ICANS (immune effector cell-associated neurotoxicity syndrome). Klinická manifestace ICANS je velmi široká (bolesti hlavy, dysartrie, poruchy vědomí, křeče, encefalopatie, otok mozku) a terapie symptomatická. Patofyziologie zatím není zcela objasněna, předpokládá se aktivace endotelu, následně průnik CART - buněk přes hematoencefalickou bariéru a poškození neuronů přímo nebo nepřímo dysregulovanou imunitní odpovědí, důležitou roli by mohl hrát zejména interleukin 1. Těžký ICANS je často spojen s těžkým CRS.
Incidence CRS po podání CAR T-lymfocytů je 70 % [6], počet případů ICANS variuje dle různých studií mezi 23–67 % u pacientů s lymfomem [7] a 40–60 % u pacientů s leukemií [8].
V současné době jsou u FDA (Food and Drug Administration, Úřad pro kontrolu potravin a léčiv USA) registrovány 4 přípravky s anti-CD19 chimérickým antigenním receptorem: Kymriah™ (tisagenlecleucel), Yescarta™ (axicabtagene ciloleucel), Tecartus™ (brexucabtagene autoleucel), Breyanzi® (lisocabtagene maraleucel); a 1 lék s antiBCMA CAR (B cell maturation antigen): Abecma® (idecabtagene vicleucel).
Patofyziologie CRS
CRS vzniká vystupňovanou aktivací imunitního systému, zejm. monocytů a makrofágů, a uvolněním velkého množství prozánětlivých cytokinů.
Nástup symptomů a závažnost CRS závisí na vyvolávajícím přípravku, síle aktivace imunitních buněk a množství cílových struktur pro danou imunoterapii.
Po podání monoklonální protilátky, nejčastěji anti-CD3 (OKT3), anti - CD52 (alemtuzumabu), anti-CD20 (rituximabu), CD28 superagonisty (TGN1412/theralizumabu), dochází k reakci v řádu minut či jednotek hodin. Po elevaci tumor necrosis faktoru α (TNFα) následuje vzestup interferonu γ (INFγ), interleukinů (IL)-1β, IL-2, IL-6, IL-8 a IL-10 a GM-CSF (granulocyte-macrophage colony-stimulating factor) [9].
V případě CAR T-cell terapie se příznaky CRS objevují v řádu dnů po infuzi, což koreluje s maximem in vivo expanze T-lymfocytů, závažnost toxicity koreluje se sérovými hladinami INFγ a TNF [10].
CAR T-lymfocyty po rozpoznání svých cílů uvolňují obrovské množství perforinu, granzymů a cytokinů, vč. TNFα a IFNγ, což vede k pyroptóze nádorové buňky [11]. Pyroptóza je prozánětlivá programovaná buněčná smrt charakterizovaná rupturou plazmatické membrány s následným uvolněním zbylého buněčného obsahu a prozánětlivých faktorů. Granzym A (GZMA) a granzym B (GZMB) vstupují do buňky póry vytvořenými perforinem. GZMB štěpí gasdermin E (GSDME) přímo nebo přes aktivaci kaspázy 3, GZMA přímo aktivuje gasdermin B (GSDMB). N-domény gasderminu pak vytvářejí transmembránové póry, což vede k uvolňování cytokinů, zejm. IL-1β, a ke snížení viability buňky narušením regulace vnitřního prostředí, výsledkem je buněčná smrt nádorové buňky. GSDME je velmi rozšířen u hematologických malignit, zatímco GSDMB se častěji vyskytuje u karcinomu močového měchýře, světlobuněčného karcinomu ledvin a kožních nádorů; exprese gasderminů může být upregulována cytokiny, např. IFNγ [11].
CAR T-lymfocyty uvolní velké množství perforinu a granzymů a masivně tak indukují aktivaci GSDME, vysoce exprimovaného na B-leukemických buňkách, dochází tak k pyroptóze cílových buněk a začátku CRS. Závažnost CRS koreluje se vzestupem GSDME [12].
Klíčovou roli v patofyziologii hraje monocyto-makrofágový systém, který je hlavním zdrojem nejdůležitějších cytokinů CRS [13, 14]. Makrofágy mohou být aktivovány DAMPs (damage-associated molecular patterns), které se uvolňují z buněk podstupujících pyroptózu; patří mezi ně HMGB1 (high-mobility group box 1 = amphoterin), ATP (adenosintrifosfát) a dsDNA (double ‑ stranded DNA) [19]. HMGB1 vazbou na Toll-like receptor 2 (TLR2) a TLR4 na povrchu makrofágu aktivuje MAPKs (mitogen-activated protein kinases) a IκB kinázu (IKK), které regulují uvolnění širokého spektra cytokinů, vč. IL-6. TLR2 současně indukuje tvorbu solubilního IL-6R (IL-6 receptoru), což vede k transsignalizaci a výraznému prozánětlivému efektu IL-6. Vazbou ATP na makrofág dochází k aktivaci kaspázy 1 a následně uvolnění IL-1β, současně kaspáza 1 aktivuje granzym vyvolávající pyroptózu makrofágu a tím další uvolnění DAMPs a prozánětlivých cytokinů, což vede k tvorbě bludného kruhu a další a další aktivaci makrofágů [15].
Makrofágy jsou také aktivovány cytokiny přímo uvolněnými z CAR T-lymfocytů, zejm. TNFα, IL-2, GM-CSF a INFγ. Interakce mezi CAR T-lymfocytem a makrofágy také spouští uvolnění IL-6 a IL-1 a zvyšuje expresi syntázy inducibilního oxidu dusnatého (iNOS) [16], což potencuje vazodilataci a hemodynamickou nestabilitu.
Hlavním mediátorem toxicity u CRS je interleukin 6 [17, 18]. Na jeho produkci se podílejí makrofágy, monocyty, dendritické buňky, endoteliální buňky a pravděpodobně i samotné CAR T-lymfocyty.
IL - 6 signalizace vyžaduje vazbu na široce exprimovaný glykoprotein 130 (gp130, CD130) a IL-6 receptor (IL-6R, CD126), který je přítomen na makrofázích, neutrofilech, hepatocytech a některých T-lymfocytech.
Při vysoké hladině IL-6 dochází k transsignalizaci navázáním na solubilní IL-6R a následným spojením s membránově vázaným gp130 na buňkách, které neexprimují membránový IL-6R. Protizánětlivé účinky jsou obvykle mediovány klasickou signalizací, zatímco ty prozánětlivé jsou výsledkem transsignalizace [9].
Transsignalizací aktivované endoteliální buňky začnou uvolňovat další IL-6 a další prozánětlivé faktory, jako VEGF (vascular endothelial growth factor), IL-8, MCP-1 (monocyte chemoattractant protein 1) a PAI 1 (aktivátor inhibitoru plasminogenu), což kromě další amplifikace prozánětlivého stavu vede k poškození buněk endotelu a zvýšené permeabilitě cév a capillary leak syndromu, hypoperfuzi orgánů a koagulopatii [19].
Klíčovou roli IL-6 v patofyziologii CRS podporuje často promptní odeznění symptomů po podání IL-6R antagonisty tocilizumabu.
Klinický průběh
Klinicky se CRS typicky projevuje horečkou, myalgiemi, hypotenzí a/nebo hypoxií. Projevy mohou variovat od velmi lehkého průběhu, který nevyžaduje žádnou intervenci, až po život ohrožující stav s multiorgánovým selháním. CRS se také může manifestovat arytmiemi, výpotky, elevací transamináz, koagulopatií, renálním selháním a hemofagocytující lymfohistiocytózou (HLH) [20] – prakticky ve všech případech současně s hypotenzí a/nebo hypoxií [21]. Laboratorně často dochází k elevaci C-reaktivního proteinu (CRP), prokalcitoninu (PCT), ferritinu, rozvoji koagulopatie charakteru diseminované intravaskulární koagulopatie (DIC) a cytopenie.
Riziko těžkého CRS po podání rutinně používáných monoklonálních protilátek je při správné aplikaci vč. premedikace malé, případné reakce lze obvykle řešit přerušením infuze a symptomatickou terapií. Riziko CRS po podání blinotumomabu bylo sníženo postupnou eskalací dávky a podáním prefáze u rizikových pacientů.
Rizikovými faktory pro vznik těžkého CRS po imunoterapii CAR T-lymfocyty jsou velká tumorová nálož a postižení kostní dřeně, lymfodeplece režimem Flu/Cy (fludarabin + cyklofosfamid), podání vyšší dávky CAR T-lymfocytů, trvající zánětlivý stav při zahájení terapie (vysoká hladina ferritinu v séru) a již vstupně přítomná aktivace endotelu například při trombocytopenii. Nástup CRS do 3 dnů od převodu buněk také predikuje vyšší stupeň CRS [22].
Klinický obraz CRS je nespecifický a jeho odlišení od jiných nosologických jednotek je v praxi často nemožné. Proto je vždy nutné pátrat i po jiných možných příčinách aktuálního stavu.
Grading
Pro účely sledování ve studiích a zejména z důvodu strategie léčby CRS po léčbě CAR T-lymfocyty v klinické praxi vzniklo několik klasifikací (CTCAE 4.03 a 5.0, Lee, Penn, MSKCC, CARTOX), v r. 2018 vyšel ASTCT konsenzus (American Society for Transplantation and Cellular Therapy) [23], ze kterého vychází grading pro přípravek Kymriah™ doporučený výrobcem, podle kterého postupujeme v hodnocení CRS na našem pracovišti:
Grade 1 = horečka (tělesná teplota ≥ 38 °C) +/ - konstituční „flu‑like“ symptomy, nevolnost
Grade 2 = grade 1 + hypotenze reagující na volumexpanzi a/nebo hypoxie ≤ 6 l/min nosem
Grade 3 = grade 1 + hypotenze s nutností podání vazopresorické podpory a/nebo nutnost oxygenoterapie maskou k dosažení normosaturace
Grade 4 = grade 1 + hypotenze s potřebou kombinace vazopresorů a/nebo respirační insuficience vyžadující neinvazivní ventilaci, vysokoprůtokovou nazální oxygenoterapii nebo umělou plicní ventilaci.
Pokud je pacient léčen antipyretiky a/nebo již dostal anticytokinovou terapii (kortikosteroidy, tocilizumab), febrilie nemusí být přítomna a tíže CRS se určuje podle stupně hypotenze či hypoxie.
Terapie a prevence
Cílem terapie je zabránit rozvoji těžkého život ohrožujícího stupně CRS a přitom neinterferovat s cytokiny mediovaným protinádorovým efektem CART - buněk [23].
Těžký CRS probíhá pod obrazem sepse a může rychle progredovat do multiorgánového selhání, z tohoto důvodu je nutné pacienty od podání CAR T-lymfocytů monitorovat a ideálně již k podání přípravku mít zajištěný centrální žilní vstup; na našem pracovišti pacienty hospitalizujeme na lůžku intenzivní péče od podání přípravku vždy při vysokém riziku CRS, u nižšího rizika mohou být pacienti sledování na lůžkovém oddělení UHKT, v případě rozvoje CRS grade > 1 je ihned indikován překlad na jednotku intenzivní péče UHKT.
Léčba CRS je v první řadě symptomatická, při febriliích je nutné současné vyloučení a/nebo léčení konkomitantně probíhající infekce (minimálním standardem jsou pravidelné kultivace, hemokultury, RTG hrudníku), při poklesu TK volumexpanze, katecholaminy (viz protokol terapie níže), při rozvoji respirační insuficience oxygenoterapie, (ne)invazivní plicní ventilace; vše za současného pátrání po jiných příčinách rozvíjejících se příznaků. Kromě komplexní intenzivní terapie je současně indikována specifická terapie tlumící cytokinovou bouři.
Zcela zásadní roli v léčbě CRS má tocilizumab – humanizovaná IgG1 monoklonální protilátka proti lidskému receptoru interleukinu 6, která blokuje klasickou signalizaci i transsignalizaci [24]. Kompetitivně se váže na IL-6 membránově vázaný i solubilní receptor, což vede ke snížení IL-6 signalizace a poklesu imunitní aktivace a zánětlivé reakce [25].
Tocilizumab byl v r. 2017 schválen pro léčbu těžkého CRS na základě studií, ve kterých u 69 % pacientů odezněl těžký život ohrožující CRS do 2 týdnů po podání 1–2 dávek [26]. V současné době je dostupnost tocilizumabu pro konkrétního pacienta nutnou součástí léčby CAR T-lymfocyty. Předpokládá se, že zablokování IL-6 nemá vliv na protinádorový efekt CART - buněk [27]. IL-6 je produkováno antigen prezentujícími buňkami (APCs), přítomnost CRS cytokinů neovlivňuje ani transkripční profil ani protileukemický efekt CART - buněk [28, 29]. Po profylaktickém podání tocilizumabu hodinu před infuzí anti‑CD19 CART - lymfocytů byla snížená incidence i závažnost CRS, bez ovlivnění protinádorového působení a celkového přežití [30].
Systémové kortikosteroidy jsou pro své protizánětlivé vlastnosti také efektivní v tlumení CRS. Vzhledem k tomu, že inhibují funkce T-lymfocytů, předpokládalo se, že by mohly poškodit protinádorovou aktivitu CART - lymfocytů a jejich expanzi [31, 18]. Z tohoto důvodu byly relativně kontraindikovány a rezervovány až pro velmi těžký CRS. Současná předběžná data ale neukazují rozdíl v počtu relapsů po použití toculizumabu samotného či v kombinaci se steroidy [32, 33]. Ani dlouhodobá léčba kortikoidy (> 7 dní) neměla vliv na výsledky léčby CAR T-lymfocyty [34]. Tato zjištění vedou ke zvážení dřívějšího podání steroidů v léčebných schématech [35].
Tocilizumab a kortikosteroidy jsou standardní součástí protokolů managementu CRS po podání přípravků imunobuněčné terapie CAR T-lymfocyty. Zatím neexistuje všeobecná shoda na přesném načasování jejich podání, proto se indikace zahájení aplikace obou léčiv mírně liší v protokolu každého z přípravků i v každém hematologickém centru.
Pro toculizumab-refrakterní CRS lze zvážit off label podání siltuximabu, chimerické lidské/myší monoklonální protilátky proti IL-6; v ČR je schválená pouze v indikaci léčby dospělých pacientů s multicentrickou formou Castlemanovy choroby. Výhodou siltuximabu je přímá vazba na IL-6, která nevede ke vzestupu hladiny IL-6 jako k tomu dochází po podání tocilizumabu vazbou na IL-6 receptory [36].
Dalšími, v současnosti experimentálními léky, které se nabízejí pro léčbu CRS, je zejména anakinra, antagonista humánního receptoru pro IL-1, který neutralizuje biologickou aktivitu IL-1α a IL-1β kompetitivní inhibicí jejich vazby na receptor typu I pro interleukin 1 (IL-1RI). K uvolnění IL-1β dochází dříve než IL-6 a IL-1β zvyšuje produkci IL-6, což podporuje předpoklad pravděpodobného účinku u CRS. V klinické studii byla anakinra efektivní v léčbě HLH po imunoterapii anti-CD22 CAR T-lymfocyty [37].
Ve fázi (pre)klinických studií je cíleno i na další cytokiny: lenzilumab, monoklonální protilátku proti GM-CSF, která dle předběžných výsledků snižuje riziko těžkého CRS, neurotoxicity i hladiny prozánětlivých markerů u pacientů s refrakterním/relabujícím difuzním velkobuněčným B‑lymfomem (R/R DLBCL) [38]. JAK 1 inhibitor (inhibitor Janusovy kinázy 1) itacitinib by mohl mít potenciál k prevenci CAR T-lymfocyty indukovanému CRS [39]. Probíhají např. také studie s tyrozinkinázovým inhibitorem (TKI) dasatinibem, který reverzibilně potlačuje cytolytickou aktivitu a produkci cytokinů a proliferaci CAR T-lymfocytů (on/off switch effect) [40, 41].
Naše zkušenosti:
V UHKT (Ústav hematologie a krevní transfuze) máme zkušenosti s první registrovanou CAR T-cell terapií v ČR, s tisagenlecleucelem (Kymriah™, Novartis), autologními T-lymfocyty geneticky modifikovanými ex vivo za použití lentivirového vektoru kódujícího anti-CD19 chimérický antigenní receptor.
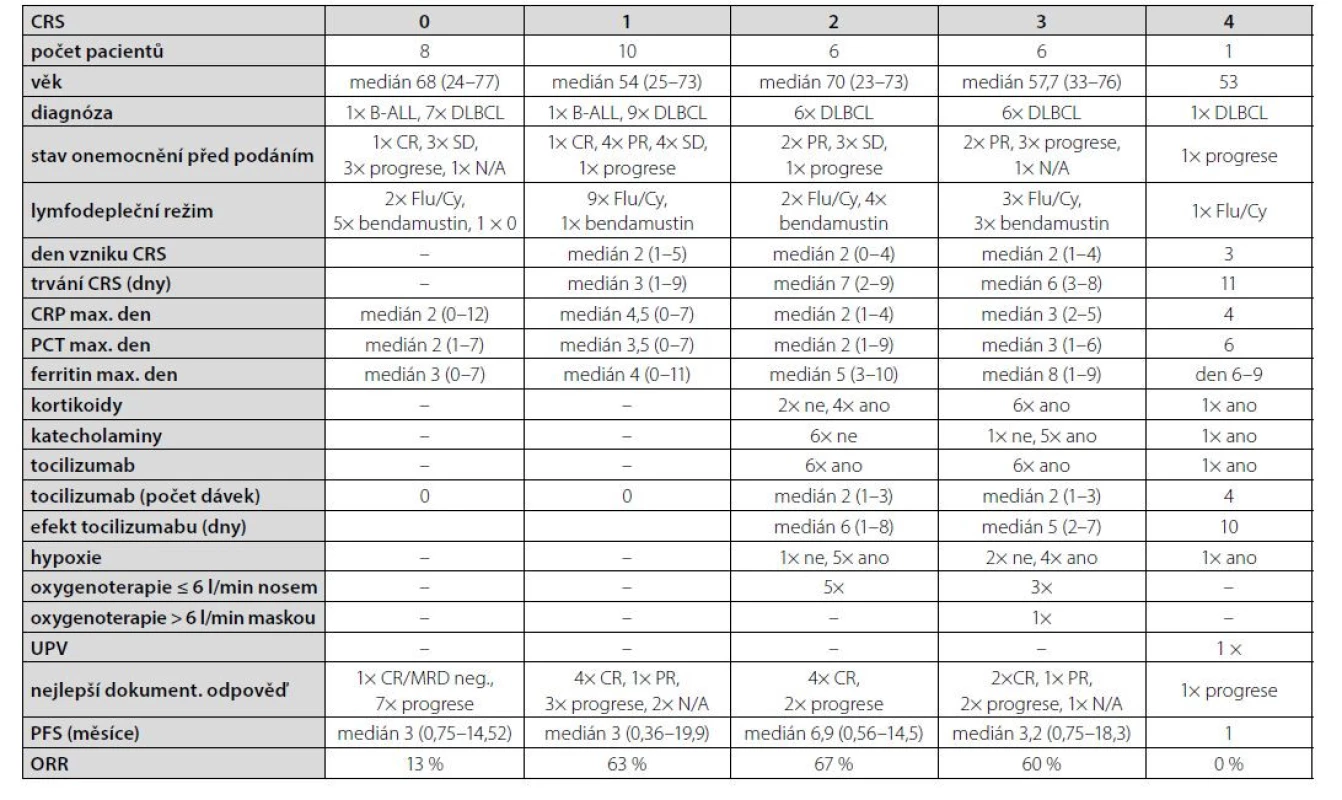
UHKT získalo akreditaci k podávání Kymriah™ v r. 2018, od té doby byl do konce roku 2021 tisagenlecleucel aplikován celkem 31 pacientům, 2x z indikace refrakterní/relabující B-akutní lymfoblastové leukemie (R/R B-ALL), u které je indikační omezení 25 let věku, ve 29 případech z důvodu R/R DLBCL. Soubor zahrnuje 22 mužů a 9 žen, věk 23–77 let (medián 61 let). Lymfodeplečním režimem byl Flu/Cy u 17 pacientů (55 %), bendamustin u 13 pacientů (42 %), v jednom případě nebyla přípravná chemoterapie pro těžkou lymfopenii indikována.
Ke vzniku CRS došlo u 23 pacientů (74 %) s mediánem nástupu 2 dny (1–4), z toho u 10 pacientů se jednalo o grade 1 (43 %), u 6 o grade 2 (26 %), u 6 pacientů grade 3 (26 %) a u jednoho grade 4 (4 %) dle ASTCT klasifikace.
Léčba CRS probíhala podle protokolu UHKT ve zkrácené a zjednodušené verzi takto:
CRS grade 1 → antipyretika, symptomatická terapie, zvýšená monitorace, lab. kontroly à 12 hod.; odběr hemokultur, antimikrobní zajištění
CRS grade 2 → zavedení CŽK, volumexpanze, kontinuální monitorace, lab. à 6 hod.; u rizikových (starších, komorbidních) pacientů terapie podle CRS grade 3
CRS grade 3 → tocilizumab 8 mg/kg (max. 800 mg) i. v., při nedostatečném efektu opakovat à 8 hod., max. 4 dávky + dexamethason 10 mg i. v. à 6 hod. + volumexpanze/noradrenalin
CRS grade 4 → k tocilizumabu + methylprednisolon 500 mg i. v. à 12 hod. + symptomatická intenzivní/resuscitační péče
Vzhledem k věkovému omezení podání Kymriah u B-ALL, ale zejména díky jiným vysoce účinným novým preparátům (blinatumomab, inotuzumab ozagamicin), které jsou indikované před CAR T-buněčnou terapií, v našem souboru výrazně převažují pacienti s R/R DLBCL. DLBCL je nejčastějším typem nonHodgkinského lymfomu (NHL) a s mediánem vzniku v 64 letech.
Tocilizumab byl v našem souboru aplikován celkem 13 pacientům (57 %), s ohledem na rizikové faktory a přidružené komorbidity byl podán i ve všech případech CRS grade 2. U všech došlo k odeznění příznaků s mediánem 6 dní (1–10). K ústupu CRS byly potřeba 2 dávky (1–4) tocilizumabu, bez signifikantního rozdílu mezi jednotlivými stupni tíže CRS.
Dexamethason z indikace CRS byl podán 11 pacientům (48 %), všem, kteří byli klasifikováni do 3. nebo 4. stupně. Oxygenoterapii z důvodu CRS vyžadovalo celkem 10 pacientů (43 %), z toho 8 pacientů nasálně do 6 l/min, 1 pacient až 15 l/min maskou s rezervoárem a v 1 případě byla nutná UPV.
Podle očekávání vznikl těžký CRS u pacientů s velkou masou rychle progredujícího tumoru.
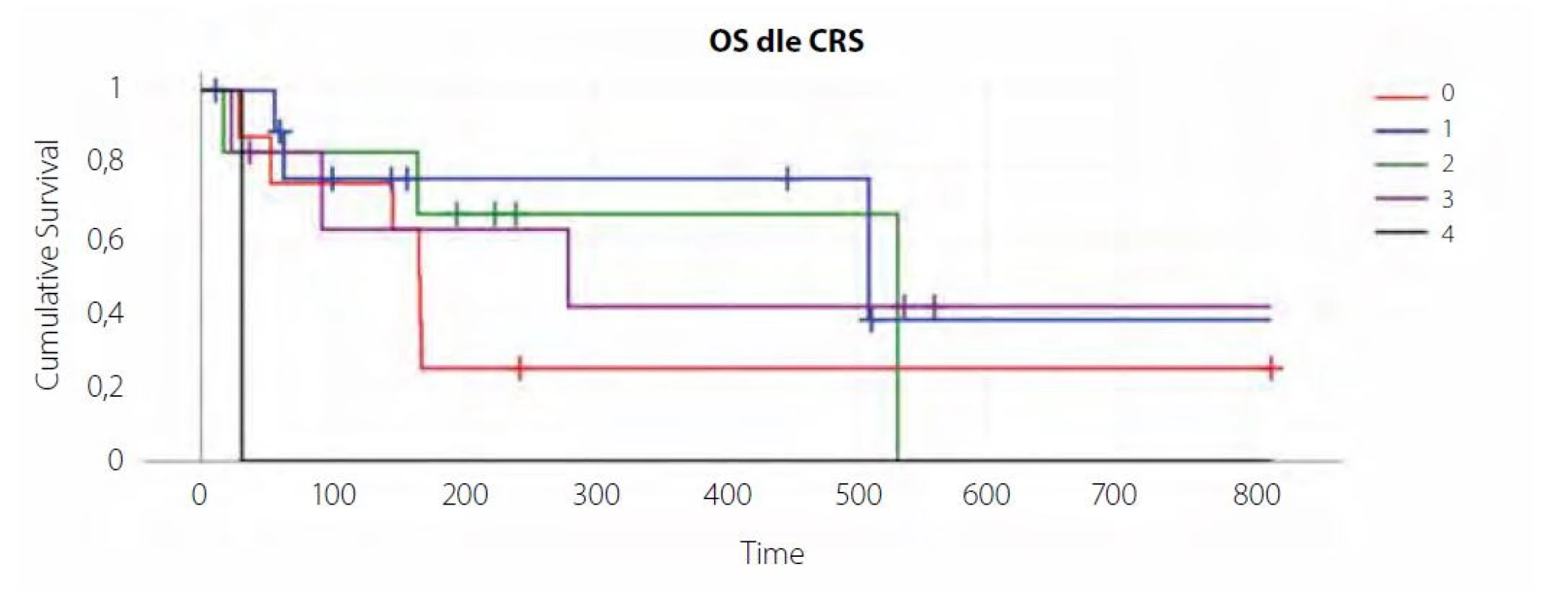
Výsledkem léčby tisagenlecleucelem v našem souboru bylo 11 kompletních remisí (CR), 2 parciální remise (PR), což odpovídá ORR 42 % (overall response rate), v 15 případech došlo k progresi základního onemocnění, z toho 7x ve skupině pacientů, u kterých nedošlo ke vzniku CRS (88 %) – viz graf 1, obrázek 1, tabulka 1.
Shrnutí:
Léčba CAR T-lymfocyty je vysoce efektivní metoda, která změnila strategii terapie některých hematologických malignit. Dokáže navodit dlouhotrvající remisi u R/R B‑ALL (Kymriah — ORR 82 % ve 3 měsících, RFS (relapse free survival) v 1 roce 62 % [8]) i R/R DLBCL (ORR 69 %, OS (overall survival) v 1 roce 58 % [42]) a výrazně tak zlepšuje prognózu těchto pacientů.
Specifickými vedlejšími účinky CAR T-imunoterapie jsou CRS a ICANS, které mohou vzniknout po léčbě samostatně či současně; případy těžké neurotoxicity provází prakticky vždy i CRS.
Mírné projevy jsou obvykle dobře kontrolovány symptomatickou terapií, těžké formy CRS jsou klinicky neodlišitelné od sepse a mohou vést až k multiorgánovému selhání.
S ohledem na vysokou incidenci CRS (70 %) a ICANS (až 50 %) a absenci spolehlivých prediktivních faktorů vyžaduje imunoterapie CAR T-lymfocyty časté monitorování klinického stavu a okamžitou dispozici intenzivní péče pro případ rozvoje těžkých komplikací. Nejvyšší pravděpodobnost jejich vzniku je v prvních dnech po infuzi CAR T-lymfocytů, z tohoto důvodu pacienty v UHKT hospitalizujeme minimálně 10 dní po infuzi CAR T-lymfocytů; v našem souboru byl nástup CRS nejčastěji 2 dny po aplikaci (minimálně 0, maximálně 5).
Tocilizumab je velmi efektivním lékem v léčbě CRS (nikoliv ICANS, kde je léčba zatím pouze symptomatická) a u většiny pacientů symptomy po jeho podání rychle ustupují (v našem souboru nejčastěji 6. den od aplikace; minimálně 1, maximálně 10). Zatím je převážně používán k terapii těžkých projevů CRS. Opakované studie nepotvrdily negativní ovlivnění protinádorového účinku CAR T-lymfocytů, což rezultuje v možnost dřívějšího podání u vysoce rizikových či komorbidních pacientů. Také systémová kortikoterapie je značně účinná v tlumení prozánětlivých dějů při CRS. Po vyvrácení teze, že snižuje efektivitu této imunoterapie, přestala být rezervována jen pro nejtěžší stavy.
Ve fázi klinických studií jsou další potenciálně účinné látky zaměřené na blokaci IL-6, IL-2, GM‑GSF, JAK/STAT či TKI.
Přestože je vznik CRS je podle současných poznatků iniciován pyroptózou nádorových buněk způsobenou CAR T-lymfocyty, nezdá se, že by existovala korelace mezi tíží CRS a klinickou odpovědí. Byly popsány kompletní remise u pacientů bez zaznamenaných symptomů i rychlá progrese maligního onemocnění přes velmi těžký průběh CRS [43].
V našem souboru jsme ale u pacientů, kteří nevyvinuli CRS, pozorovali jednoznačně zhoršenou odpověď na terapii (ORR 13 % oproti cca 60 % u CRS grade 2 a 3 – viz tabulka 1 a graf) i celkové přežití (viz křivka přežití).
Závěr
Impozantní efektivita imunoterapie CAR T-lymfocyty, která dává šanci na vyléčení a přežití mnohým pacientům s refrakterními hematologickými malignitami, je vyvážena vysokým rizikem potenciálně závažných i život ohrožujících vedlejších účinků, zejména CRS a ICANS.
Vzhledem k tomu, že jsou tyto syndromy plně reverzibilní a terapie CART - lymfocyty je potenciálně kurativní, měla by být pacientům po podání CART - lymfocytů poskytována plná resuscitační péče. V případě těžkého CRS je indikována léčba tocilizumabem, po jehož podání obvykle symptomy rychle odezní. Výzvou v klinické praxi bývá odlišení CRS a ICANS od jiných závažných stavů, které mohou probíhat i konkomitantně a mohou vyžadovat odlišný terapeutický přístup.
Článek přijat redakcí: 4. 3. 2022;
Článek přijat k tisku: 2. 5. 2022;
Cit. zkr: Anest intenziv Med. 2022;33(2):90-96
KORESPONDENČNÍ ADRESA AUTORA :
MUDr. Barbora Čemusová
Zdroje
1. Tonini G, Santini D, Vincenzi B, Borzomati D, Dicuonzo G, La Cesa A,et al. Oxaliplatin may induce cytokine‑release syndrome in colorectal cancer patients.J Biol Regul Homeost Agents. 2002 Apr‑Jun; 16(2):105-9.
2. Aue G, Njuguna N, Tian X, Soto S, Hughes T, Vire B, et al. Lenalidomide‑induced upregulation of CD80 on tumor cells correlates with T‑cell activation, the rapid onset of a cytokine release syndrome and leukemic cell clearance in chronic lymphocytic leukemia. Haematologica. 2009 Sep;94(9):1266-73.
3. de Jong MD, Simmons CP, Thanh TT, Hien VM, Smith GJ, Chau TN, et al. Fatal outcome of human influenza A (H5N1) is associated with high viral load and hypercytokinemia. Nat Med. 2006 Oct;12(10):1203-7.
4. Tisoncik JR, Korth MJ, Simmons CP, Farrar J, Martin TR, Katze MG. Into the eye of the cytokine storm. Microbiol Mol Biol Rev. 2012 Mar;76(1):16-32
5. Picchianti Diamanti A, Rosado MM, Pioli C, Sesti G, Laganà B. Cytokine Release Syndrome in COVID-19 Patients, A New Scenario for an Old Concern: The Fragile Balance between Infections and Autoimmunity. Int J Mol Sci. 2020 May 8;21(9):3330.
6. Kang L, Tang X, Zhang J, Li M, Xu N, Qi W, et al. Interleukin-6-knockdown of chimeric antigen receptor‑modified T cells significantly reduces IL-6 release from monocytes. Exp Hematol Oncol. 2020 Jun 8;9 : 11.
7. Neelapu SS, Locke FL, Bartlett NL, Lekakis LJ, Miklos DB, Jacobson CA, et al. Axicabtagene ciloleucel CAR T‑cell therapy in refractory large B‑cell lymphoma. N Engl J Med. 2017;377 : 2531-2544.
8. Maude SL, Laetsch TW, Buechner J, Rives S, Boyer M, Bittencourt H, et al. Tisagenlecleucel in Children and Young Adults with B‑Cell Lymphoblastic Leukemia. N Engl J Med. 2018 Feb 1;378(5):439-448.
9. Lee DW, Gardner R, Porter DL, Louis CU, Ahmed N, Jensen M, et al. Current concepts in the diagnosis and management of cytokine release syndrome. Blood. 2014 Jul 10;124(2):188 - 95. doi: 10.1182/blood-2014-05-552729. Epub 2014 May 29. Erratum in: Blood. 2015 Aug 20;126(8):1048.
10. Kochenderfer JN, Dudley ME, Feldman SA, Wilson WH, Spaner DE, Maric I, et al. B‑cell depletion and remissions of malignancy along with cytokine‑associated toxicity in a clinical trial of anti‑CD19 chimeric‑antigen‑receptor‑transduced T cells. Blood. 2012 Mar 22;119(12):2709-20.
11. Zhou Z, He H, Wang K, Shi X, Wang Y, Su Y, et al. Granzyme A from cytotoxic lymphocytes cleaves GSDMB to trigger pyroptosis in target cells. Science. 2020 May 29;368(6494).
12. Liu Y, Fang Y, Chen X, Wang Z, Liang X, Zhang T, et al. Gasdermin E‑mediated target cell pyroptosis by CAR T cells triggers cytokine release syndrome. Sci Immunol. 2020 Jan 17;5(43).
13. Hao Z, Li R, Meng L, Han Z, Hong Z. Macrophage, the potential key mediator in CAR‑T related CRS. Exp Hematol Oncol. 2020 Jul 10;9 : 15. doi: 10.1186/s40164-020-00171-5. PMID: 32665874; PMCID: PMC7349474.
14. Norelli M, Camisa B, Barbiera G, Falcone L, Purevdorj A, Genua M, et al. Monocyte‑derived IL-1 and IL-6 are differentially required for cytokine‑release syndrome and neurotoxicity due to CAR T cells. Nat Med. 2018 Jun;24(6):739-748.
15. Gong T, Liu L, Jiang W, Zhou R. DAMP‑sensing receptors in sterile inflammation and inflammatory diseases. Nat Rev Immunol. 2020 Feb;20(2):95-112. doi: 10.1038/s41577-019 - 0215-7. Epub 2019 Sep 26. PMID: 31558839.
16. Giavridis T, van der Stegen SJC, Eyquem J, Hamieh M, Piersigilli A, Sadelain M. CAR T cell ‑ induced cytokine release syndrome is mediated by macrophages and abated by IL-1 blockade. Nat Med. 2018 Jun;24(6):731-738.
17. Grupp SA, Kalos M, Barrett D, Aplenc R, Porter DL, Rheingold SR, et al. Chimeric antigen receptor‑modified T cells for acute lymphoid leukemia. N Engl J Med. 2013;368 : 1509-1518.
18. Maude SL, Frey N, Shaw PA, Aplenc R, Barrett DM, Bunin NJ, et al. N Engl J Med. 2014 Oct 16;371(16):1507-17.
19. Xiao X, Huang S, Chen S, Wang Y, Sun Q, Xu X, et al. Mechanisms of cytokine release syndrome and neurotoxicity of CAR T ‑ cell therapy and associated prevention and management strategies. J Exp Clin Cancer Res. 2021 Nov 18;40(1):367. doi: 10.1186/s13046-021 - 02148-6. PMID: 34794490; PMCID: PMC8600921.
20. Maude SL, Barrett D, Teachey DT, Grupp SA. Managing cytokine release syndrome associated with novel T cell‑engaging therapies. Cancer J. 2014;20(2):119-122.
21. Brudno JN, Kochenderfer JN. Toxicities of chimeric antigen receptor T cells: recognition and management. Blood. 2016;127(26):3321-3330.
22. Murthy H, Iqbal M, Chavez JC, Kharfan‑Dabaja MA. Cytokine Release Syndrome: Current Perspectives. Immunotargets Ther. 2019 Oct 29;8 : 43-52. doi: 10.2147/ITT.S202015. PMID: 31754614; PMCID: PMC6825470.
23. Lee DW, Santomasso BD, Locke FL, Ghobadi A, Turtle CJ, Brudno JN, et al. ASTCT Consensus Grading for Cytokine Release Syndrome and Neurologic Toxicity Associated with Immune Effector Cells. Biol Blood Marrow Transplant. 2019 Apr;25(4):625-638. doi: 10.1016/j. bbmt.2018. 12. 758. Epub 2018 Dec 25. PMID: 30592986.
24. Kotch C, Barrett D, Teachey DT. Tocilizumab for the treatment of chimeric antigen receptor T cell‑induced cytokine release syndrome. Expert Rev Clin Immunol. 2019;15(8):1-10.
25. Nishimoto N, Kishimoto T. Humanized antihuman IL-6 receptor antibody, tocilizumab. Handb Exp Pharmacol. 2008;181 : 151-160.
26. Le RQ, Li L, Yuan W, Shord SS, Nie L, Habtemariam BA, et al. FDA Approval Summary: Tocilizumab for Treatment of Chimeric Antigen Receptor T Cell ‑ Induced Severe or Life‑Threatening Cytokine Release Syndrome. Oncologist. 2018 Aug;23(8):943-947. doi: 10.1634/theoncologist.2018-0028. Epub 2018 Apr 5. PMID: 29622697; PMCID: PMC6156173.
27. Gardner RA, Ceppi F, Rivers J, Annesley C, Summers C, Taraseviciute A, et al. Preemptive mitigation of CD19 CAR T ‑ cell cytokine release syndrome without attenuation of antileukemic efficacy. Blood. 2019 Dec 12;134(24):2149-2158.
28. Barrett DM, Singh N, Hofmann TJ, Gershenson Z, Stephan A. Grupp; Interleukin 6 Is Not Made By Chimeric Antigen Receptor T Cells and Does Not Impact Their Function. Blood. 2016;128(22):654.
29. Neelapu SS, Locke FL, Bartlett NL, Lekakis LJ, Miklos DB, Jacobson CA, et al. Axicabtagene Ciloleucel CAR T‑Cell Therapy in Refractory Large B‑Cell Lymphoma. N Engl J Med. 2017 Dec 28;377(26):2531-2544.
30. Caimi PF, Pacheco Sanchez G, Sharma A, Otegbeye F, Ahmed N, Rojas P, et al. Prophylactic Tocilizumab Prior to Anti‑CD19 CAR‑T Cell Therapy for Non‑Hodgkin Lymphoma. Front Immunol. 2021 Oct 12;12 : 745320. doi: 10.3389/fimmu.2021.745320. PMID: 34712233; PMCID: PMC8546323.
31. Davila ML, Riviere I, Wang X, Bartido S, Park J, Curran K, et al. Efficacy and toxicity management of 19-28z CAR T cell therapy in B cell acute lymphoblastic leukemia. Sci Transl Med. 2014 Feb 19;6(224).
32. Santomasso B, Bachier C, Westin J, Rezvani K, Shpall EJ. The other side of CAR T ‑ cell therapy: cytokine release syndrome, neurologic toxicity, and financial burden. Am Soc Clin Oncol Educ Book. 2019;39 : 433-444.
33. June CH, Sadelain M. Chimeric antigen receptor therapy. N Engl J Med. 2018;379(1):64-73.
34. Karschnia P, Jordan JT, Forst DA, Arrillaga‑Romany IC, Batchelor TT, Baehring JM, et al. Clinical presentation, management, and biomarkers of neurotoxicity after adoptive immunotherapy with CAR T cells. Blood. 2019 May 16;133(20):2212-2221. doi: 10.1182/blood - 2018-12-893396. Epub 2019 Feb 26. PMID: 30808634.
35. Topp MS, van Meerten T, Wermke M, Lugtenburg EJ, Minnema M, Song KW, et al. Preliminary results of earlier steroid use with axicabtagene ciloleucel (axi ‑ cel) in patients with relapsed/refractory large B ‑ cell lymphoma (R/R LBCL). 2019. J Clin Oncol. 2019;37.
36. Chen F, Teachey DT, Pequignot E, Frey N, Porter D, Maude SL, et al. Measuring IL-6 and sIL-6R in serum from patients treated with tocilizumab and/or siltuximab following CAR T cell therapy. J Immunol Methods. 2016;434 : 1-8.
37. Shah NN, Highfill SL, Shalabi H, Yates B, Jin J, Wolters PL, et al. CD4/CD8 T‑Cell Selection Affects Chimeric Antigen Receptor (CAR) T‑Cell Potency and Toxicity: Updated Results From a Phase I Anti‑CD22 CAR T‑Cell Trial. J Clin Oncol. 2020 Jun 10;38(17):1938-1950.
38. Kenderian SS, Oluwole OO, McCarthy PL, Reshef R, Shiraz P, et al; ZUMA-19: A Phase 1/2 Multicenter Study of Lenzilumab Use With Axicabtagene Ciloleucel (Axi‑Cel) in Patients (Pts) With Relapsed or Refractory Large B Cell Lymphoma (R/R LBCL). Blood 2020;136(Supplement 1).
39. Huarte E, O’Connor RS, Peel MT, Nunez‑Cruz S, Leferovich J, Juvekar A, et al. Itacitinib (INCB039110), a JAK1 Inhibitor, Reduces Cytokines Associated with Cytokine Release Syndrome Induced by CAR T ‑ cell Therapy. Clin Cancer Res. 2020 Dec 1;26(23):6299-6309.
40. Mestermann K, Giavridis T, Weber J, Rydzek J, Frenz S, Nerreter T, et al. The tyrosine kinase inhibitor dasatinib acts as a pharmacologic on/off switch for CAR T cells. Sci Transl Med. 2019 Jul 3;11(499).
41. Weber EW, Lynn RC, Sotillo E, Lattin J, Xu P, Mackall CL. Pharmacologic control of CAR‑T cell function using dasatinib. Blood Adv. 2019 Mar 12;3(5):711-717.
42. Al‑Mansour M, Al‑Foheidi M, Ibrahim E. Efficacy and safety of second‑generation CAR T ‑ cell therapy in diffuse large B ‑ cell lymphoma: A meta‑analysis. Mol Clin Oncol. 2020 Oct;13(4):33. doi: 10.3892/mco.2020.2103. Epub 2020 Jul 29. PMID: 32789017; PMCID: PMC7416618.
43. Shimabukuro‑Vornhagen A, Gödel P, Subklewe M, Stemmler HJ, Schlößer HA, Schlaak M, et al. Cytokine release syndrome. J Immunother Cancer. 2018 Jun 15;6(1):56. doi: 10.1186/ s40425-018-0343-9. PMID: 29907163; PMCID: PMC6003181.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek EDITORIALČlánek Rabdomyolýza
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2022 Číslo 2- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Metamizol a jeho pozice v léčbě bolesti
-
Všechny články tohoto čísla
- Barotrauma u uměle ventilovaných pacientů s koronavirovou chorobou v roce 2019
- Delirium dětí po podání transfuze erymasy – rozhoduje čas skladování od odběru krve?
- Koncept „Fyziologicky obtížné dýchací cesty“ – nejde jenom o samotnou intubaci
- Anestezie v Rakousko‑Uhersku během I. světové války a po vzniku samostatného československého státu. Část 5 – Celková anestezie II: průběh a komplikace
- Rabdomyolýza
- Vztah mezi sérovou koncentrací perorálního midazolamu použitého v premedikaci a faktory ovlivňujícími úroveň sedace
- Je vhodné prodloužit dobu prognosticky určující neurologickou úpravu po srdeční zástavě?
- Doporučený postup – léčba akutní pooperační bolesti
- Pooperační intenzivní péče o pacienty s transplantací plic
- Srovnání výskytu nežádoucích účinků po sugammadexu a neostigminu
- Zajímavosti, tipy a triky, informace z jiných oborů
- EDITORIAL
- Aktualizovaná doporučení pro léčbu akutní pooperační bolesti – důvod pro „inventuru“ vlastní i institucionální praxe?
- Současná diagnostika a léčba anafylaktické reakce – s přihlédnutím k ERC 2021 doporučením
- Testosteron zmírňuje sevofluranem indukovanou tau fosforylaci a kognitivní poruchu u novorozených samečků myší
- Monitorování počítačem zpracovaného EEG v anestezii I
- Cytokine release syndrom po terapii CAR T-lymfocyty: přehled literatury a naše zkušenosti
- Závažná akutní mateřská morbidita – příjmy do specializované intenzivní péče
- Bdělost během operace v celkové anestezii
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Cytokine release syndrom po terapii CAR T-lymfocyty: přehled literatury a naše zkušenosti
- Bdělost během operace v celkové anestezii
- Doporučený postup – léčba akutní pooperační bolesti
- Současná diagnostika a léčba anafylaktické reakce – s přihlédnutím k ERC 2021 doporučením
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání