-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Rezistence na diuretika
Autoři: D. Astapenko 1; V.- Černý 1 5
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní medicíny, Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové, Fakultní nemocnice Hradec Králové 1; Centrum pro výzkum a vývoj, Fakultní nemocnice Hradec Králové 2; Klinika anesteziologie, perioperační a intenzivní medicíny, Univerzita J. E. Purkyně v Ústí nad Labem, Masarykova, nemocnice v Ústí nad Labem 3; Department of Anesthesia, Pain Management and Perioperative Medicine, Dalhousie University, Halifax, Nova Scotia, Canada 4; Technická univerzita v Liberci 5
Vyšlo v časopise: Anest. intenziv. Med., 31, 2020, č. 3, s. 136-137
Kategorie: Klinická fyziologie
Úvod
Diuretická terapie je jedním ze základních postupů symptomatické léčby srdečního selhání v kardiologii. V intenzivní péči jsou diuretika podávána rovněž s cílem tzv. kontroly tekutinové bilance, a to i přes řadu kontroverzních názorů k otázkám jejich účinnosti z pohledu jejich efektivity a ovlivnění dlouhodobého klinického výsledku.
Přesné údaje o výskytu „rezistence na diuretika“ nejsou k dispozici, mj. i z důvodu absence jednotné definice uvedeného fenoménu [1], jedna z definic je např. vylučování sodíku močí menší než 90 mmol/l během 72 hodin perorálního podávání furosemidu v dávce 160 mg 2× denně [2].
Mechanismus rezistence na diuretika
Rezistence na diuretika vzniká nejčastěji na podkladě jejich nedostatečné koncentrace v tubulární tekutině nefronu. U pacientů s chronickým srdečním selháním je příčinou abnormální farmakokinetiky městnání v gastrointestinálním traktu [3]. Nízká sekrece diuretik v proximální části nefronu může být způsobena hypoperfuzí ledvin, což vysvětluje přetrvávající rezistenci při zahájení nitrožilního podávání [4]. Dále, kličková diuretika jsou transportována aniontovým přenašečem, o který kompetují i nahromaděné organické anionty. Současné podávání léků ze skupiny nesteroidních antiflogistik blokuje syntézu prostaglandinů, což dále snižuje renální perfuzi a koncentraci diuretik v tubulární tekutině [5]. Podávání diuretik může též reflexivně aktivovat systém renin‑angiotenzin‑aldosteron, který zvyšuje retenci sodíku a povede k rezistenci na diuretika i u pacientů bez srdečního selhání [6]. K tomuto faktu přispívá i vysoký dietární příjem sodíku [7]. Experimentální data prokázala, že při dlouhodobé inhibici reabsorpce sodíku v proximální části nefronu (Henleova klička) dochází vlivem jeho vysoké koncentrace v distální části nefronu (distální tubulus) k hypertrofii a patologicky zvýšené reabsorpci, tzv. breaking phenomenon [8]. U pacientů v intenzivní péči může vzniknout ještě tzv. okultní rezistence na diuretika. Tento stav charakterizuje hypernatremie, dehydratace, snížená koncentrace sodíku v moči a tzv. kontrakční alkalóza. Příčinou je akutní stresová reakce (která fylogeneticky vede k retenci sodíku), tekutinová resuscitace s nefyziologickou náloží sodíku a minimální nebo žádný příjem hypotonické tekutiny.
Je rezistence na diuretika ovlivnitelná?
Z výše uvedeného vyplývá, že rezistence na diuretika bývá, zejména u pacientů v intenzivní péči, multifaktoriální. Naše terapeutické intervence bychom tedy měli cílit na více míst dle předpokládané příčiny rezistence (tab. 1). Autoregulace mikrocirkulace ledvin je závislá na stálém perfuzním tlaku, proto musíme optimalizovat srdeční výdej, krevní tlak, centrální žilní tlak a nitrobřišní tlak. Pokud to klinický kontext dovoluje, můžeme snížit příjem sodíku pod 100 mmol/den a kontrolovat koncentraci sodíku v moči. Zvýšení dávek kličkových diuretik per os může být bezpečné až do 4000 mg/den. Nicméně furosemid podaný touto cestou má variabilní biologickou dostupnost (10–100 %) [9] a roli hraje i u pacientů v intenzivní péči často přítomná hypoalbuminemie. Změnou lékové formy a nitrožilním podáním obejdeme problém abnormální farmakokinetiky a navíc furosemid podaný touto cestou působí i vazodilatačně (snižuje tlak v plicním řečišti a zvyšuje kapacitu systémového žilního řečiště). Proto dojde k úlevě symptomů u pacientů s plicním edémem ještě před zvýšením diurézy [2]. Tento efekt způsobuje zvýšená syntéza prostaglandinů v ledvinách a následující zvýšení diurézy může být též důsledkem zlepšené renální perfuze [1]. Kontinuální podání furosemidu zajistí jeho stálou hladinu a eliminuje postdiuretickou retenci sodíku (tzv. rebound retence sodíku) [10]. Přidáním thiazidového diuretika ke kličkovému docílíme tzv. sekvenční blokády nefronu, což sníží reabsorpci sodíku v distálním tubulu při dlouhodobém podávání kličkového diuretika. Pro použití spironolaktonu v kombinační terapii není dostatek důkazů a pozitivní výsledky byly shledány zatím pouze v malých souborech pacientů [11]. Kombinace s acetazolamidem působila zvýšení diurézy taktéž v malých souborech [12].
Tab. 1. Přehled příčin a intervencí při rezistenci na diuretika 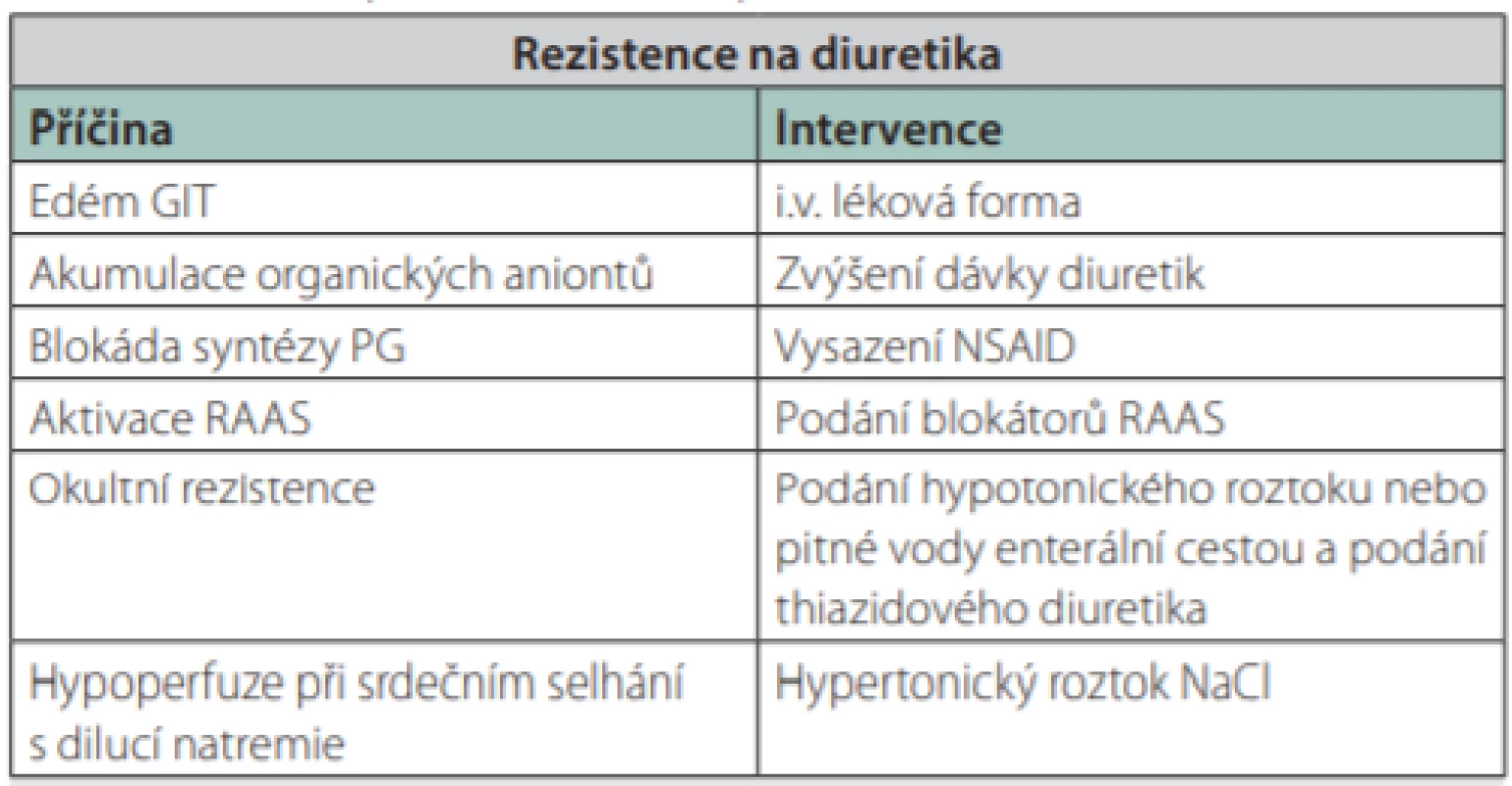
GIT – gastrointestinální trakt, i.v. – intravenózní podání, PG – prostaglandiny, NSAID – nesteroidní antiflogistika, RAAS – renin-angiotenzin-aldosteronový systém, NaCl – chlorid sodný. Alternativní terapie, která byla více populární v minulých letech, je nízká dávka dopaminu (tzv. reno‑protektivní dávka, 3 µg/kg/min), který působí v této dávce preferenčně na dopaminergních receptorech v ledvinách [13]. Nicméně tento postup neprokázal vliv na snížení renální insuficience [14]. Hypertonický NaCl zvyšuje perfuzi myokardu a ledvin, a ačkoli není v této indikaci doporučován, zdá se být účinný [15].
Body k zapamatování
- Rezistence na diuretika (RnD) je klinický fenomén charakterizovaný sníženou diuretickou odpovědí na obvyklou (a doposud dostateč ‑ nou) dávku diuretik.
- Rezistence na diuretika se vyskytuje nejčastěji u pacientů léčených diuretiky dlouhodobě nebo u pacientů s poruchou renálních funkcí.
- „Léčebné“ postupy k ovlivnění RnD by měly být založeny na předpokládaném mechanismu jejího vzniku (tab. 1).
- U pacientů v intenzivní péči léčených intermitentně podávaným furosemidem bez možnosti identifikovat pravděpodobnou příčinu RnD lze zvážit jako úvodní postup přechod na kontinuální podávání furosemidu a doplnit případně thiazidovým diuretikem.
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Vladimír Černý, Ph.D., FCCM,
Cit. zkr: Anest intenziv Med. 2020; 31(3): 136–137
Zdroje
1. Cox ZL, Lenihan DJ. Loop diuretic resistance in heart failure: Resistance etiology‑based strategies to restoring diuretic efficacy. J Card Fail 2014; 20 : 611–622.
2. Shah N, Madanieh R, Alkan M, Dogar MU, Kosmas CE, Vittorio TJ. A perspective on diuretic resistance in chronic congestive heart failure. Ther Adv Cardiovasc Dis 2017; 11 : 271–278.
3. De Bruyne LKM. Mechanisms and management of diuretic resistance in congestive heart failure. Postgrad Med J 2003; 79 : 268–271.
4. Brater DC. Resistance to Loop Diuretics: Why it Happens and What to Do About It. Drugs 1985; 30 : 427–443.
5. Koopmans PP, Thien T, Gribnau FWJ. Influence of non‑steroidal anti‑inflammatory drugs on diuretic treatment of mild to moderate essential hypertension. Br Med J 1984; 289 : 1492–1494.
6. Loon NR, Wilcox CS, Unwin RJ. Mechanism of impaired natriuretic response to furosemide during prolonged therapy. Kidney Int 1989; 36 : 682–689.
7. Cody RJ, Kubo SH, Pickworth KK. Diuretic treatment for the sodium retention of congestive heart failure. Arch Intern Med 1994; 154 : 1905–1914.
8. Aronson D. The complexity of diuretic resistance. Eur J Heart Fail 2017; 19 : 1023–1026.
9. Wargo KA, Banta WM. A comprehensive review of the loop diuretics: Should furosemide be first line? Ann Pharmacother 2009; 43 : 1836–1847.
10. Bowman BN, Nawarskas JJ, Anderson JR. Treating Diuretic Resistance: An Overview. Cardiol Rev 2016; 24 : 256–260.
11. Santos J, Planas R, Pardo A, Durández R, Cabré E, Morillas RM, et al. Spironolactone alone or in combination with furosemide in the treatment of moderate ascites in nonazotemic cirrhosis. A randomized comparative study of efficacy and safety. J Hepatol 2003; 39 : 187–192.
12. Verbrugge HF, Dupont M, Bertrand BP, Nijst P, Penders J, Dens J, et al. Determinants and impact of the natriuretic response to diuretic therapy in heart failure with reduced ejection fraction and volume overload. Acta Cardiol 2015; 70 : 265–273.
13. Elkayam U, Ng TMH, Hatamizadeh P, Janmohamed M, Mehra A. Renal vasodilatory action of dopamine in patients with heart failure: Magnitude of effect and site of action. Circulation 2008; 117 : 200–205.
14. Triposkiadis FK, Butler J, Karayannis G, Starling RC, Filippatos G, Wolski K, et al. Efficacy and safety of high dose versus low dose furosemide with or without dopamine infusion: The Dopamine in Acute Decompensated Heart Failure II (DAD‑HF II) Trial. Int J Cardiol 2014; 172 : 115–121.
15. De Vecchis R, Esposito C, Ariano C, Cantatrione S. Besseres renales Sicherheitsprofil und klinische Ergebnisse durch hypertone Kochsalzlösung plus Furosemid i.v. bei akuter dekompensierter Herzinsuffizienz: Eine Metaanalyse der Literatur. Herz 2015; 40 : 423–435.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2020 Číslo 3- Jak souvisí postcovidový syndrom s poškozením mozku?
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Léčba akutní pooperační bolesti z pohledu ortopeda
-
Všechny články tohoto čísla
- Sedace v intenzivní péči – část II. Monitorování hloubky sedace v intenzivní péči pomocí analýzy EEG
- Význam hyperbarické medicíny a současná doporučení u vybraných akutních indikací v urgentní medicíně a intenzivní péči
- Dárcovství orgánů po nevratné zástavě oběhu: Jak na to?
- Doporučení pro tzv. off‑label použití léčivých přípravků pro pacienty s COVID-19
- Opomíjená příčina reverzibilní anizokorie – jednostranné mydriázy
- Zajištění dýchacích cest u pacientů s COVID-19
- Syndrom akutní dechové tísně spojený s kouřením elektronických cigaret
- Rezistence na diuretika
- Zajímavosti, tipy a triky, informace z jiných oborů
- Třicet let časopisu – čas na změnu
- Metamizol – 100 let od objevu
- Fasciální prostory trupu ve vztahu k regionální anestezii – část druhá: lumbální oblast
- Použití albuminu v perioperační a intenzivní medicíně
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Opomíjená příčina reverzibilní anizokorie – jednostranné mydriázy
- Použití albuminu v perioperační a intenzivní medicíně
- Doporučení pro tzv. off‑label použití léčivých přípravků pro pacienty s COVID-19
- Zajištění dýchacích cest u pacientů s COVID-19
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



