-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaSrovnání antikoagulace pomocí heparinu a citrátu u kontinuální venovenózní hemodialýzy u kriticky nemocných dětí - prospektivní cross-over studie
Comparison of heparin and citrate anticoagulation during continuous veno-venous haemodialysis (CVVHD) in critically ill children – prospective, crossover study
Objective:
In continuous renal replacement therapy, heparin anticoagulation has been largely replaced with citrate anticoagulation to limit the risk of bleeding. In this prospective crossover trial, we compared the heparin and citrate effect on the circuit lifetimes during continuous veno-venous haemodialysis (CVVHD) in children.Design:
Prospective, crossover trial.Setting:
Paediatric intensive care unit, Department of Paediatrics, University Hospital.Materials and methods:
From 2009 to 2014, 63 eligible children (age 89.24 ± 62.9 months, weight 30.37 ± 20.62 kg) received at least 24 hours of CVVHD. Each child received four CVVHD circuits with anticoagulants in the following order: heparin, citrate, heparin, citrate. Circuit life ended when the trans-membrane pressure was ≥ 250 mmHg for > 60 min.Results:
The total mean circuit lifetime was 39.75 ± 10.73 h. Citrate had a significantly longer median circuit lifetime (41.0 h, CI: 37.6–44.4) than heparin (36.0 h, CI: 35.4–36.6; p < 0.0001). Mortality was 33.33%. Circuit lifetime was significantly correlated to patient age (r = 0.606), weight (r = 0.763), and blood flow rate (r = 0.697). Metabolic and electrolyte imbalances were readily resolved.Conclusion:
We showed that citrate provided significantly longer circuit lifetimes than heparin for CVVHD in children. Citrate was found to be feasible and safe in children and infants in our study.Keywords:
continuous venovenous hemodialysis – heparin – citrate – children
Autoři: T. Zaoral 1; M. Hladík 1; J. Zapletalová 2
Působiště autorů: Dětská klinika, Oddělení dětské intenzivní resuscitační péče, Lékařská fakulta OU, Fakultní nemocnice Ostrava 1; Ústav lékařské biofyziky, Lékařská fakulta, Fakultní nemocnice Olomouc 2
Vyšlo v časopise: Anest. intenziv. Med., 26, 2015, č. 5, s. 270-278
Kategorie: Intenzivní medicína - Původní práce
Souhrn
Cíl studie:
Srovnání délky životnosti mimotělního okruhu při použití heparinu a citrátu u kontinuální hemodialýzy u kriticky nemocných dětí.Typ studie:
Prospektivní zkřížená studie.Materiál a metoda:
Od ledna 2009 do června 2014 proběhla kontinuální hemodialýza u 63 dětí, z toho 34 muži (54 %), 29 ženy (46 %), průměrný věk 89,24 ± 62,9 měsíců, průměrná hmotnost 30,37 ± 20,62 kg. Ve zkřížené studii jsme u dětí prospektivně srovnávali, zda existuje rozdíl u kontinuální venovenózní hemodialýzy v délce fungování mimotělního okruhu při antikoagulaci heparinem a citrátem.Výsledky:
Délka přežití okruhu byla delší u citrátu (medián 41,0 (CI: 37,6–44,4) než u heparinu (medián 36,0 (CI: 35,4–36,6), p < 0,0001). Maximální délka trvání okruhu byla u heparinu 56 h, u citrátu 72 h. Mortalita všech dětí byla 33,33%. Byla prokázána statisticky významná závislost délky životnosti mimotělního okruhu na věku (r = 0,606), hmotnosti (r = 0,763) a na rychlosti průtoku krve (r = 0,697).Závěr:
V naší studii jsme prokázali, že u citrátové antikoagulace je délka životnosti mimotělního okruhu delší než při použití heparinu u kontinuální hemodialýzy u kriticky nemocných dětí.
Podle našeho protokolu je užití citrátu zatíženo jen minimem komplikací, které jsou snadno řešitelné.Klíčová slova:
kontinuální hemodialýza – heparin – citrát – dětiÚVOD
Užití kontinuálních eliminačních metod (CRRT) u kriticky nemocných dětí se během posledních 25 let stalo nedílnou součástí péče o děti s akutní renální dysfunkcí (AKI), s přetížením tekutinami nebo s multiorgánovou dysfunkcí. Pro fungování CRRT je nepostradatelná antikoagulace (ACG). V současnosti patří mezi nejčastěji užívané ACG metody heparin (HACG), který působí systémově a citrát (CACG), jehož působení se omezuje jen na mimotělní oběh (EC).
Některé studie při srovnání účinku HACG a CACG na délku životnosti okruhu CRRT u dospělých pacientů ukazují delší životnost u CACG [1, 3], naopak některé neprokázaly rozdíl v délce účinku, ale pouze nižší riziko krvácení u CACG [2]. Poslední metaanalýza na 488 pacientech však neprokázala rozdíl v životnosti EC ani vyšší míru krvácení u HCAG při srovnání s CACG [4]. U dětí v současnosti existuje jediná prospektivní observační multicentrická studie na srovnání délky životnosti a komplikací při užití HACG a CACG u CRRT [5], která nenašla rozdíl v délce fungování jednoho EC. Nedávné retrospektivní ka-zuistiky u dětí však popisují delší životnost EC při užití CACG ve srovnání s HACG u CRRT [6, 7]. Cílem naší studie bylo srovnat délku životnosti EC, přežití a komplikace při použití HACG a CACG u kontinuální hemodialýzy (CVVHD) u kriticky nemocných dětí. Do roku 2000 byly CRRT prováděny na našem oddělení výhradně pomocí HACG. Od roku 2000 pak byla v indikovaných případech (vyšší riziko krvácení, heparinem indukovaná trombocytopenie) použita CACG. Od roku 2006 byl na našem pracovišti vytvořen protokol s CACG u CVVHD – tabulka 1.
Tab. 1. Protokol připojení citrátu na CVVHD u dětí 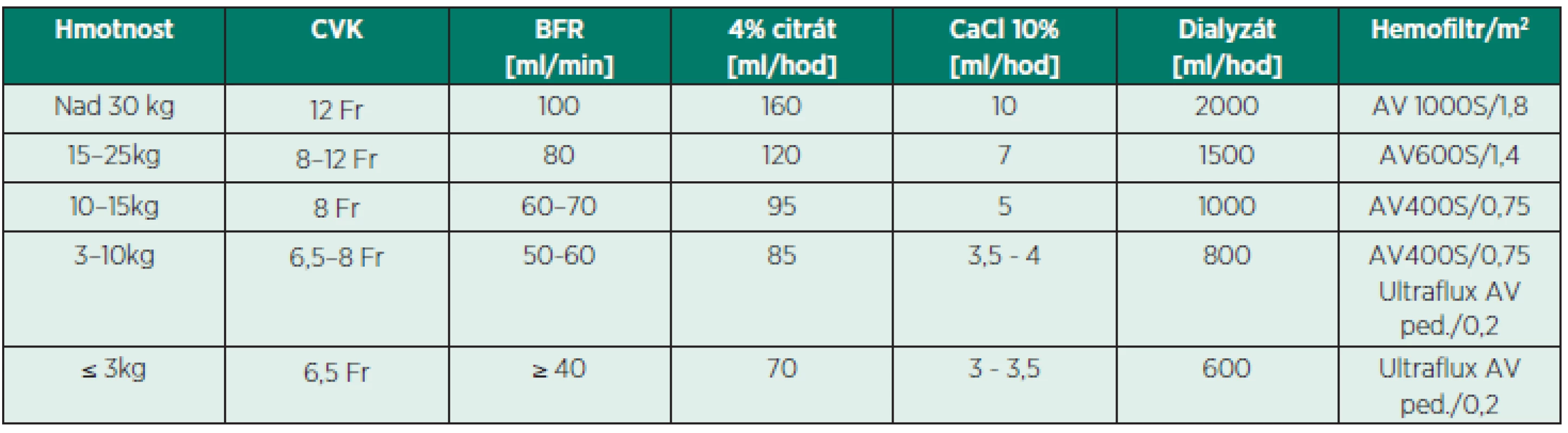
CVK – centrální venózní katétr, BFR – rychlost průtoku krve (blood flow rate) SOUBOR PACIENTŮ A METODA
Ve zkřížené prospektivní studii „crossover design“ jsme u 63 dětí ve věku od 0 do 18 let, které byly hospitalizovány na jednotce intenzivní péče Dětské kliniky Fakultní nemocnice v Ostravě, srovnávali, zda existuje rozdíl v délce fungování CVVHD u dětí při antikoagulaci CACG a HACG a četnost komplikací. Vzhledem k tomu, že terapie byla součástí běžné léčby, nebyl vyžadován pro tuto studii souhlas etické komise. Byl však vyžadován informovaný souhlas rodičů nebo právních zástupců. U všech dětí bylo provedeno CVVHD na přístroji MULTIFILTRATE (Fresenius Medical Care AG, BadHomburg, Germany).
Od ledna 2009 do června 2014 bylo provedeno na jednotce intenzivní péče Dětské kliniky Fakultní nemocnice v Ostravě CVVHD u 63 dětí (34 chlapců – 54 % a 29 děvčat – 46 %, průměrný věk byl 89,24 ± 62,90 měsíců. Průměrná hmotnost byla 30,37 ± 20,62 kg; 4 děti měly hmotnost pod 5 kg (6,3 %). Všechny děti, které byly indikované k zahájení CVVHD, byly zařazeny do studie. Indikace k zahájení CVVHD byla při poklesu diurézy či poklesu glomerulární filtrace podle kritérií pro dětskou renální dysfunkci [8]. CVVHD bylo indikováno také při převodnění (FO) nad 10 % při neúspěchu diuretické terapie, při klinicky zjevných známkách hyperhydratace (otoky, známky edému plic, hepatomegalie) [9]. Indikací pro zahájení CVVHD byla rovněž přítomnost dialyzovatelných látek při intoxikaci. Pro oligurii a FO nad 10 % bylo CVVHD indikováno u 38 dětí (60,3 % ), 21 dětí (33,3 %) na základě vzestupu kreatininu, pro intoxikaci celkem 4 děti (6,4 %). Všechny děti byly na umělé plicní ventilaci.
Vylučovací kritéria
INR ≥ 1,5, heparinem indukovaná trombocytopenie, pacienti s vysokým rizikem krvácení – posttraumatické krvácení (intracerebrální hematomy, hemotorax, hemoperitoneum). Pacienti s trombocytopenií pod 50 x 109/L.
Primární cíl
Délka trvání fungování jednoho okruhu při CVVHD u dětí. Ukončení bylo hodnoceno jako hodnota transmembranózního tlaku (TMP) ≥ 250 mm Hg. Maximální počet okruhů byl 2krát HACG a 2krát CACG, tedy maximálně 4 okruhy u jednoho pacienta. Maximální délka trvání 1 okruhu byla stanovena na 72 h s ohledem na maximální dobu doporučenou výrobcem.
Základní charakteristika souboru je uvedena v tabulce 2, diagnózy v tabulce 3.
Tab. 2. Základní charakteristika souboru 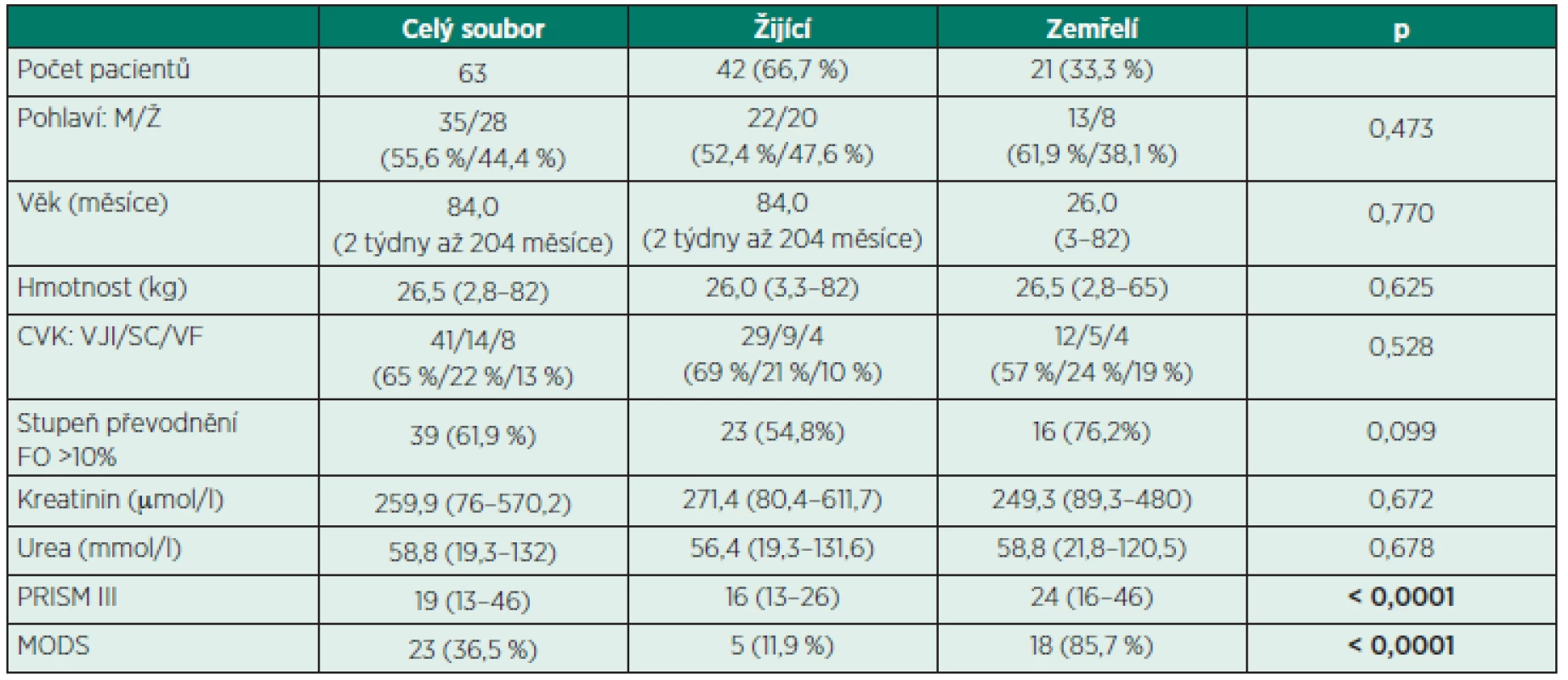
CVK – centrální venózní katétr, VJI – v. jugularis interna, SC – v. subclavia, VF – v. femoralis, FO – stupeň převodnění (fluid overload), %FO = hmotnost při zahájení CRRT – hmotnost při přijetí na JIP/hmotnost při přijetí na JIP x 100, PRISM III – prognostické skóre (pediatric risk of mortality) MODS – syndrom multiorgánové dysfunkce (multiorgan dysfunction syndrome) Tab. 3. Diagnózy 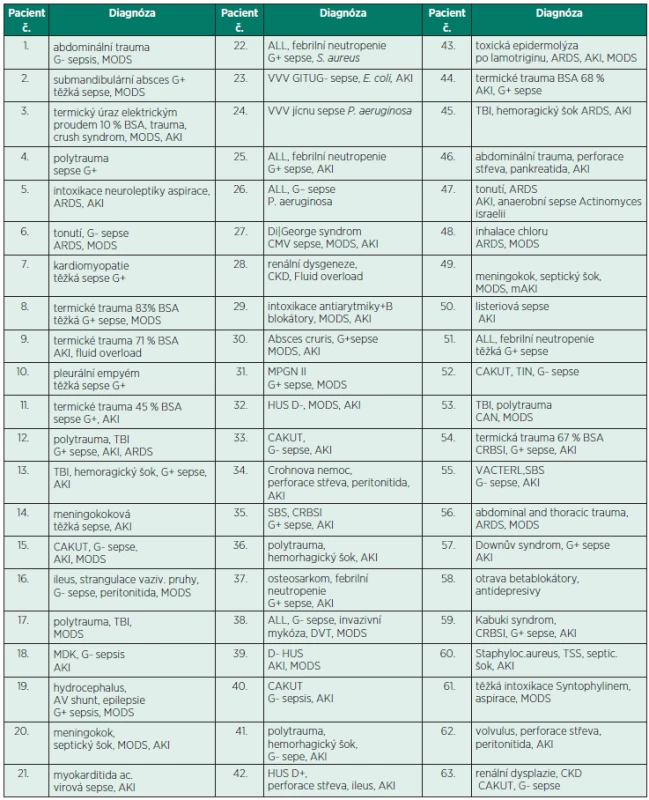
AKI – akutní renální dysfunkce (acute kidney injury), ALL – akutní lymfoblastická leukémie, ARDS – acute respiratory distress syndrome, BSA – povrch těla (body surface area), CAKUT – vrozená vývojová vada ledvin a urotraktu (congenital anomalies kidney and urinary tract), CAN – syndrom týraného dítěte (child abuse and neglect), CKD – chronická nemoc ledvin (chronic kidney disease), CO – oxid uhelnatý, CRBSI – catheter related blood stream infection, DVT – deep venous thrombosis, MDK – multicystická dysplazie ledvin, MODS – multiorgan dysfunction syndrome, MPGN – membranoproliferativní glomerulonefritida, SBS – syndrom krátkého střeva (short bowel syndrome), TBI – trauma brain injury, TIN – tubulointersticiální nefritida, TSS – syndrom toxického šoku (toxic shock syndrome), VACTERL – sdružená vrozená vývojová vada (vertebral, anal, cardiac, tracheoesophageal, renal, limbs abnormalities), VVV – vrozená vývojová vada Děti po indikaci k zahájení CVVHD byli napojení střídavě na HACG a následně na CACG, pak opět na HACG a potom na CACG. U jednoho pacienta tak byly počítány minimálně 2 okruhy (1krát HACG a 1krát CACG), maximálně však 4 okruhy (2krát HACG a 2krát CACG). Celkem bylo srovnáváno 63 dětí, z toho u 8 dětí byly jen 2 okruhy (1krát HACG, 1krát CACG) a u 55 dětí byly celkem 4 okruhy (2krát HACG a 2krát CACG). Celkem tedy vzniklo 118 párů HACG a CACG ke srovnání. Děti byly kontrolní skupinou sami pro sebe. Do studie nebylo zařazeno 8 dětí s AKI, z toho 1 dítě pro hepatální dysfunkci, 2 děti pro trvající INR ≥ 1.5 a 5 dětí pro polytrauma. U těchto dětí byla prováděna ACG v průběhu CRRT pomocí CACG a prostacyklinu. Do studie bylo iniciálně zařazeno 71 dětí, z toho 8 dětí bylo vyřazeno z důvodů nutnosti předčasného ukončení CVVHD. Pro nutnost CT vyšetření – 3krát, 3krát pro nutnost chirurgické intervence, 2 děti pro krvácivé komplikace byly převedeny z HACG jen na CACG. V průběhu sledovaného období bylo celkem 17 pacientů, kteří byli indikováni k CVVHD, avšak pro splnění vylučovacích kritérií nebyli zařazeni do studie. První EC byl napojen s HACG, následující EC byl napojen s CACG, další okruh pak opět s HACG a pak znovu s CACG. Po HACG byla vždy ponechána doba do normalizace APTT (maximálně 12 h). Po citrátu, kdy nedošlo k ovlivnění systémové koagulace, byl napojen další okruh s HACG ihned. V případě, kdy nenastala normalizace APTT do 12 h po ukončení CVVHD s HACG a při nutnosti okamžitého zahájení CVVHD, byl aplikován protamin sulfát k antagonizaci účinku heparinu v dávce 1 mg/100IU UFH s následnou kontrolou APTT. Protamin sulfát byl podán u 6 dětí, z toho u jednoho dítěte bylo nutno podat protamin 2krát k normalizaci APTT. U pacientů byla kontrolována aktivita antitrombinu 2krát denně po 12 h a byla udržována na 60–70 % normální hodnoty. Střídání HACG a CACG bylo zvoleno záměrně pro větší možnost srovnání obou metod u stejného pacienta. CVVHD bylo ukončeno, pokud hodnota TMP přesáhla trvale 250 mm Hg (po dobu 60minut).
Velikost použitých centrálních venózních katétrů (CVK) je uvedena v tabulce 1.
Nejmenší CVK byl užit dvoucestný 6,5 Fr. Byly užity polysulfonové hemofiltry (Ultraflux AV pediatric: 0,2 m2, plnící objem 18 ml, AV400S: 0,75m2, plnící objem 52 ml, AV600S: 1,4 m2, plnící objem 100 ml a pro adolescenty a dospělé AV1000S: 1,8 m2, plnící objem 130 ml) a sety pro mimotělní oběh (dospělé: plnící objem 110 ml a dětské: plnící objem 64 ml ). U dětí nad 20 kg byl užit tzv. „CiCa set“ (s plnícím objemem 146 ml), kde dochází automaticky ke zohlednění aplikace citrátu i kalcia do celkové tekutinové bilance. Tento set má již výrobcem zajištěný vstup jak pro citrát, tak i pro kalcium. Pro děti s hmotností pod 20 kg byl užit trojcestný kohout, kdy na arteriální straně EC byl zapojen predilučně citrát a na venózní straně kal-cium. U dětí pod 20 kg s tímto zapojením musela být zohledněna aplikace citrátu i kalcia do nastavení celkové ultrafiltrace. Pro citrátovou antikoagulaci byl užit dialyzační roztok bez kalcia s nižším obsahem natria a bikarbonátu.
Složení dialyzačního roztoku pro CACG: Na 133 mmol/l, Mg 0,75 mmol/l, K 2–4 mmol/l,Cl 116,5 mmol/l, Ca 0 mmol/l, HCO3 20 mmol, glukóza 1 g/1L, pH 7,4, osmolarita 277,8 mosmol/l: počítaná.
Složení dialyzačního roztoku pro HACG: Na 140 mmol/l, Mg 0,50 mmol/l, K 0–4 mmol/l,Cl 109–113 mmol/l, Ca 1,5 mmol/l, HCO3 3,5 mmol, glukóza 1 g/l, pH 7,2, osmolarita 292–300 mosmol/l: počítaná.
U všech dětí byl před zahájením CVVHD proveden proplach mimotělního oběhu heparinem (UFH) v dávce 10 000 IU/5 l fyziologického roztoku. U dětí s HACG byl podán iniciální bolus 30 IU/kg, pak byl kontinuálně podáván UFH v dávce 10 IU/kg/h a následně pak byla dávka titrována tak, aby bylo APPT v rozmezí 1,5–2,5násobku normy (60–80sec). Medián dávky UFH byl 15 (9,6–23,3) IU/kg/h – tabulka 4. Regionální citrátová ACG u dětí byla prováděna podle protokolu našeho pracoviště (viz tabulka 1). Citrát byl užit ve formě 4% trisodium citrátu = 136 mmol/l, kalcium jako CaCl2 = 500 mmol/l. Průtok citrátu byl nastaven s ohledem na rychlost průtoku krve na 4 mmol/l krevního průtoku, kalcium bylo iniciálně nastaveno na 1,7 mmol/l krevního průtoku. Roztok 4% citrátu a 10% kalcium chloratum byl dávkován pomocí infuze do mimotělního oběhu. Společně byly titrovány 4% citrát i 10% kalcium chloratum tak, aby ionizované kalcium (iCa++) v mimotělním oběhu bylo nižší než ≤ 0,3 mmol/l a iCa++ v krvi pacienta ve fyziologickém rozmezí 1,1–1,3 mmol/l. Odběry byly provedeny 1 h po zahájení, pak za 6 h, 12 h a při dosažení terapeutického cíle (APTT, iCa++) pak byly prováděny každých 12 h.
Tab. 4. Jednotlivé parametry při CVVHD 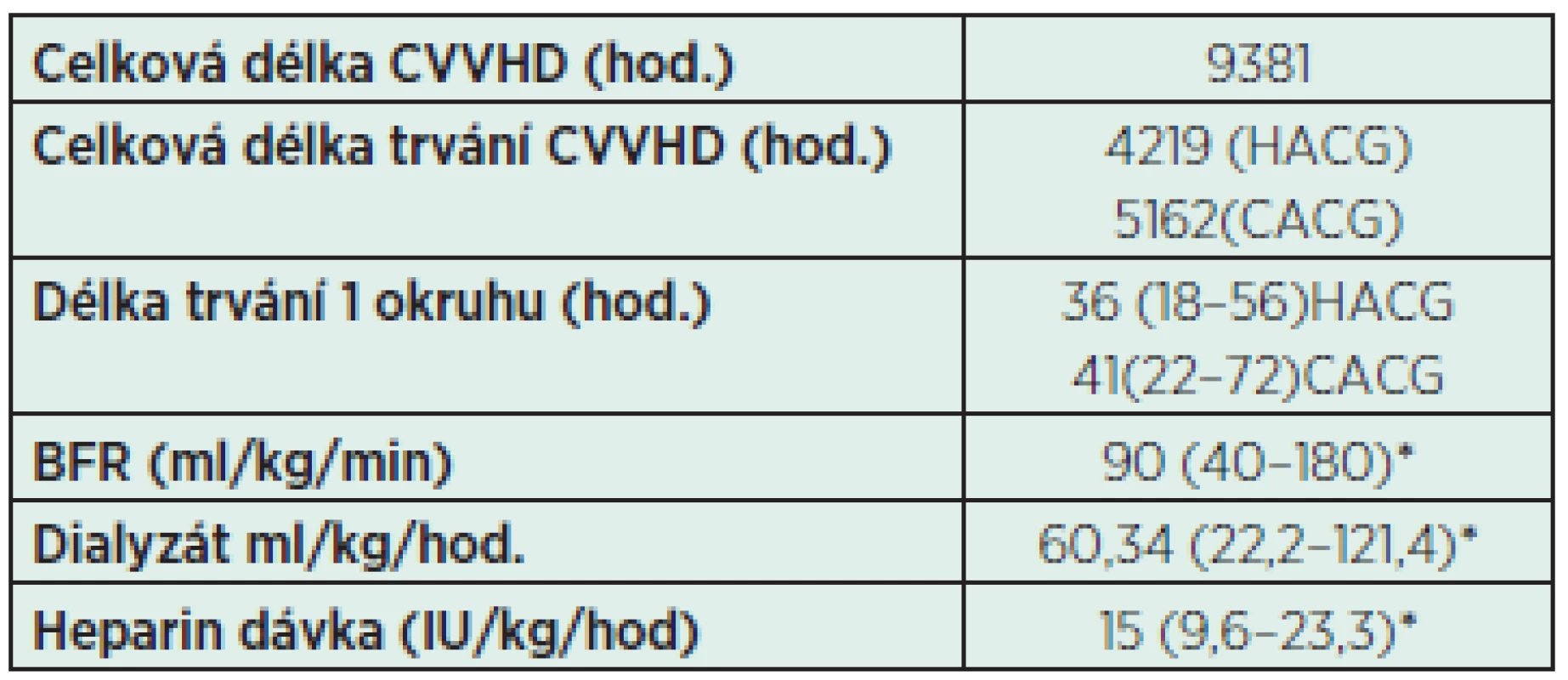
*Data jsou uváděna jako medián (min–max) CACG – citrátová antikoagulace HACG – heparinová antikoagulace BFR – rychlost průtoku krve (blood flow rate) CVVHD – kontinuální venovenózní hemodialýza Ke statistické analýze dat byl použit statistický software IBM SPSS Statistics verze 22.
Pro posouzení závislostí mezi mortalitou a kvantitativními parametry byl použit Mannův--Whitneyův U test nebo Studentův dvouvýběrový test v závislosti na normalitě dat. V případě kvalitativních parametrů byl použit chí-kvadrát test, respektive Fisherův přesný test. Pro posouzení závislostí mezí životností okruhu a kvantitativními parametry byla použita Spearmanova korelační analýza. Délka životnosti okruhu s použitím heparinu a citrátu byla porovnána pomocí Wilcoxonova párového testu. V případě mnohonásobného porovnávání byla provedena Bonferroniho korekce signifikance. Normalita dat byla ověřena pomocí Shapirova-Wilkova testu. Všechny testy byly provedeny na hladině významnosti 0,05.
VÝSLEDKY
Za sledované období od ledna 2009 do června 2014 proběhlo CVHHD v celkové délce 4 219 h, medián trvání životnosti EC byl u HACG (36,0 h – 95% CI: 35,4–36,6) a CACG (41,0 h – 95% CI: 37,6–44,4), p < 0,0001. Maximální délka 1 okruhu u HACG byla 56 hodin, u CACG 72 hodin. Maximální doba, po kterou byl ponechán 1 okruh, byla 72 hodin. Mortalita byla 33,33 % u všech dětí, u 4 dětí s hmotností pod 5 kg byla mortalita 75%. Medián PRISM III byl 19 (13–46). Nebyla prokázána signifikantní závislost mezi mortalitou a věkem (p = 0,770), pohlavím (p = 0,473), hmotností(p = 0,625), velikostí CVK (p = 0,528), stupněm převodnění FO nad 10 % (p = 0,099), hladinou kreatininu (p = 0,672) a urey (p = 0,678). Byla prokázána signifikantní závislost mezi mortalitou a PRISM III (p < 0,0001) a mezi mortalitou a syndromem multiorgánové dysfunkce (p < 0,0001). Při srovnání odběrů 12 h po zahájení CVVHD bylo zjištěno signifikantně delší APTT u heparinu při srovnání s citrátem (p < 0,0001), vyšší hladina natria u heparinu (p < 0,0001) a vyšší pH, HCO3 a base excess (BE) u citrátu při srovnání s heparinem – tabulka 5.
Tab. 5. Parametry 12 hodin po zahájení 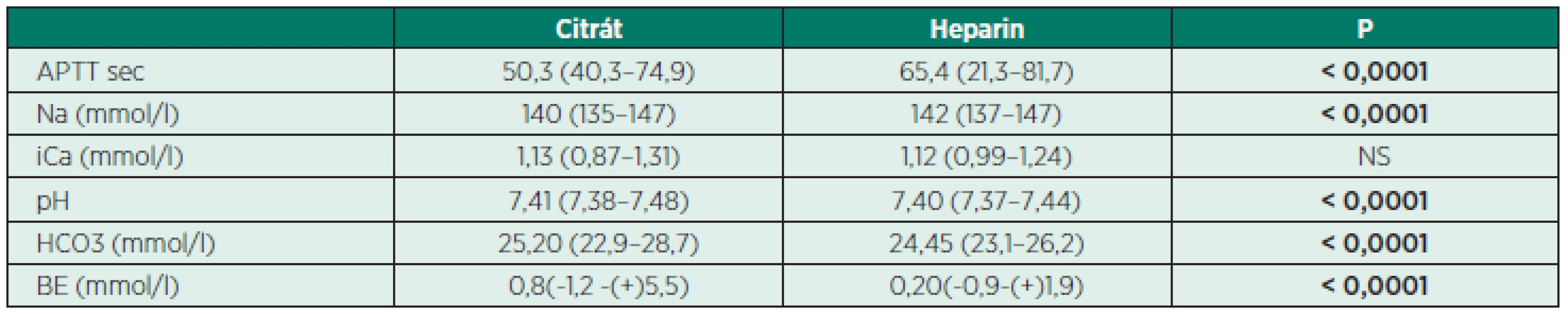
Data jsou uváděna jako medián (min–max) Multiorgánová dysfunkce (MODS) byla definována jako selhávání 3 a více orgánů podle definice pediatrické konference o sepsi [10]. Ve sledovaném souboru mělo MODS 26 dětí (36,5 %). Rychlost průtoku krve (BFR) byla 1,4–12,5 ml/kg v rozsahu od 40 ml/min do 120 ml/min.
Iontové dysbalance během CVVHD byly kategorizovány takto:
- hypokalcémie (ionizované kalciumiCa++ < 0,9 mmol/l),
- hyperkalcémie (iCa++ > 1,25 mmol/l),
- hyponatrémie (Na < 130 mmol/l),
- hypernatrémie (Na > 145 mmol/l),
- metabolická acidóza (pH < 7,36 nebo BE < -3),
- metabolická alkalóza (pH > 7,46 nebo BE > +3).
Výsledky iontové a metabolické dysbalance, hodnoty APTT jsou zaznamenány v tabulce 6.
Tab. 6. Iontové a metabolické dysbalance 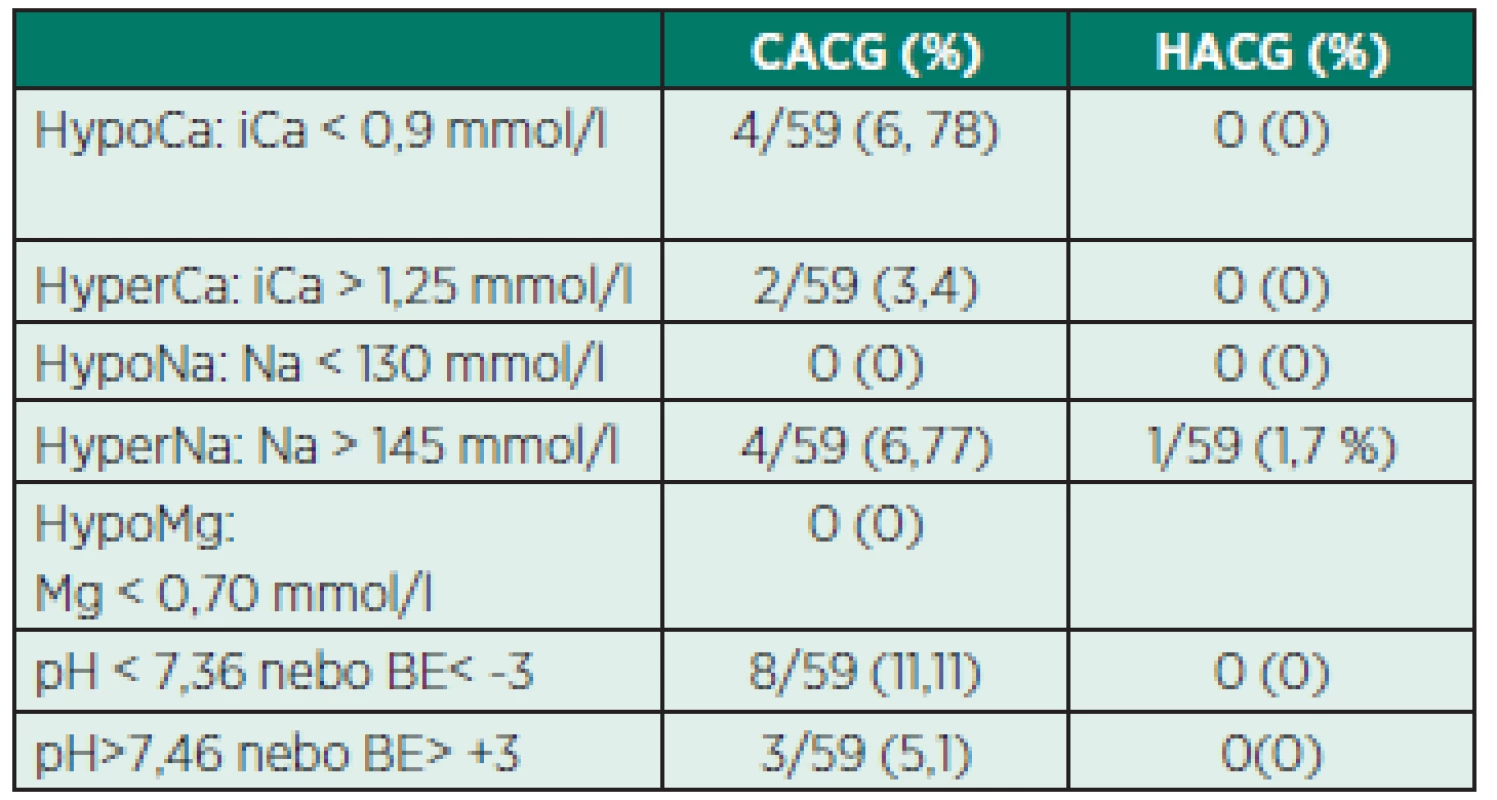
HypoCa – hypokalcémie, HyperCa – hyperkalcémie HypoNa – hyponatrémie, Hyper Na – hypernatrémie HypoMg – hypomagnezémie Hypotenze
Je definována jako pokles středního arteriálního tlaku (MAP) v průběhu 60 minut po zahájení CVVHD o více než 10 % oproti MAP před zahájením. Již před zahájením CVVHD bylo 27 dětí (42,85 %) na vazopresorech, hypotenze se objevila u 18 dětí (28,57 %) již během prvních 10 minut po napojení.
Celkem 2 děti měly před zahájením CVVHD chronickou renální insuficienci. Z toho jedno dítě zůstalo po CVVHD na chronické dialýze.
DISKUSE
Za posledních 20 let se staly CRRT u kriticky nemocných dětí s akutní renální dysfunkcí běžnou součástí podpůrné terapie. Kontinuální, ale pomalé změny osmolarity, vytvoření prostoru pro adekvátní nutrici u dětí i novorozenců s hyperhydratací a oligoanurií u oběhově nestabilních pacientů umožnily zvládnout do té doby obtížně řešitelné klinické stavy. Antikoagulace u dětských pacientů při provádění CRRT je zásadní s ohledem na omezení rychlosti průtoku krve při menším průměru CVK. Doposud nejčastěji užívaná byla HACG jak u dospělých, tak i u dětí. HACG však přináší díky systémovému účinku na rozdíl od CACG vyšší riziko krvácení [2, 11]. Jednou z alternativ je v současnosti stále více užívaná CACG, která působí pouze „regionálně“ – tedy jen v EC. Avšak CACG s sebou přináší riziko metabolických komplikací (alkalóza, acidóza) a vznik iontové dysbalance (hypernatrémie, hypokalcémie) [13]. I když některé kazuistiky u dospělých prokázaly delší přežití okruhu u CACG při srovnání s HACG u CRRT, poslední metaanalýza rozdíl v době přežití při srovnání CACG a CACG neukázala [4]. V současnosti existuje jediná prospektivní observační multicentrická studie u dětí, která nenašla rozdíl mezi CACG a HACG při CRRT u dětí [5]. Bohužel však v této studii dochází ke srovnání různých modalit u dětí různého věku, hmotnosti a s rozdílným BFR. Navíc indikace pro zahájení CRRT u jednotlivých center zapojených do studie není jednotná.
Citrátová antikoagulace u CRRT je proveditelná i u menších dětí a novorozenců [6, 14], avšak je zde větší riziko metabolických komplikací při srovnání s dospělými pacienty [12].
V naší studii jsme zjistili, že při srovnání mezi HACG a CACG u dětí na CVVHD má citrát statisticky delší životnost okruhu než heparin. Ve skupině CACG byl celkem 5krát zaznamenán maximální čas 72 hodin u jednoho okruhu, zatímco nejdelší čas ve skupině HACG byl 56 hodin. Není překvapivá závislost mezi zkracováním životnosti EC a klesajícím věkem, nižší hmotností a pomalejším průtokem krve.
V klinické praxi je výrazem účinnosti antikoagulace délka přežití hemofiltru. To koresponduje s hodnotou TMP. V našem souboru byl příčinou srážení nejčastěji právě vzestup TMP ve 44 % (tab. 7). Děti v našem souboru byly těžce nemocné – medián PRISM III byl 19 (13–46). Mortalita dětí v našem souboru byla 33,33%, vyšší mortalita 75% byla zaznamenána u menších dětí pod 5 kg hmotnosti, což odpovídá mortalitě jiných studií u dětí s CRRT [15].
Tab. 7. Příčiny ukončení CVVHD 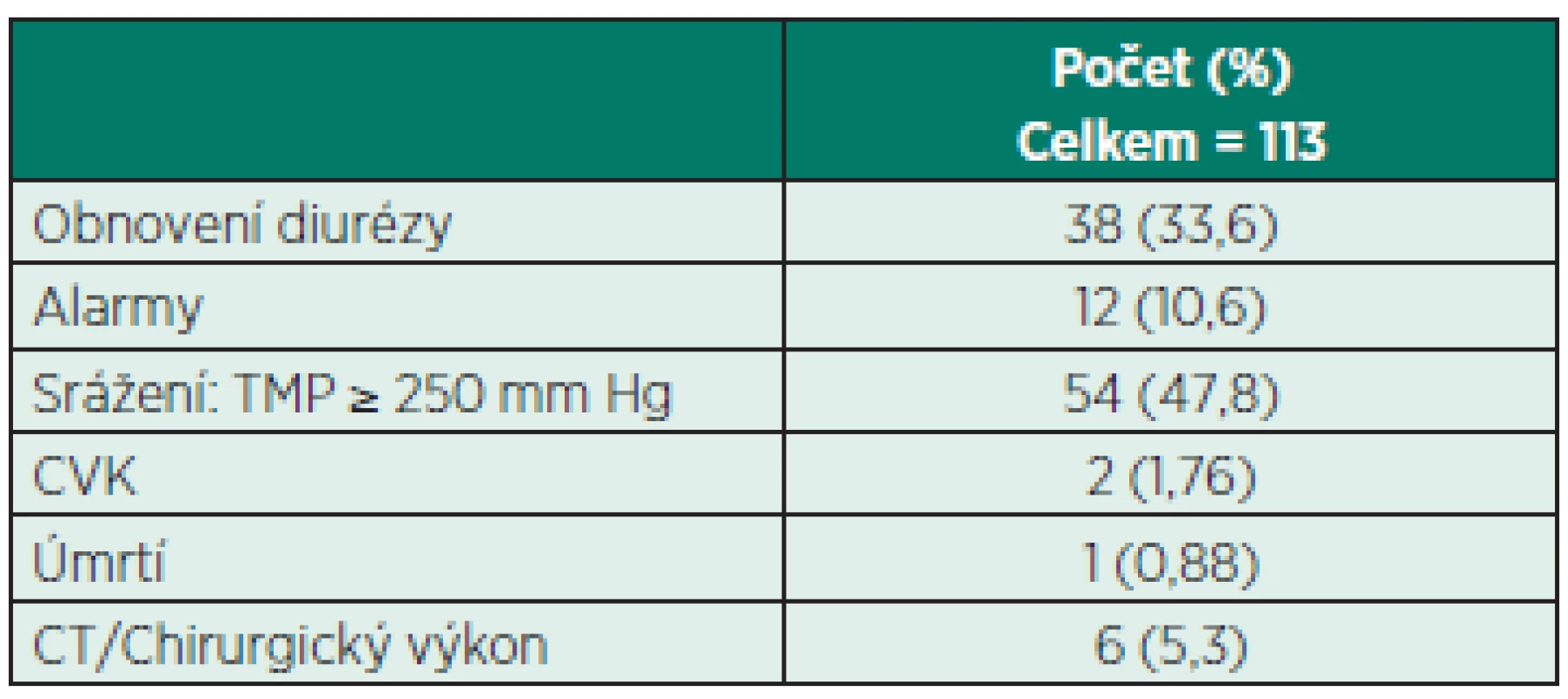
TMP – transmembranózní tlak 118 okruhů celkem, 5 okruhů dosáhlo maximum 72 h délky trvání; 113 okruhů bylo ukončeno do 72 h Nejčastější komplikací CACG u CRRT je vznik metabolické alkalózy (MAK), hypernatrémie a hypokalcémie. Citrát je látka tělu vlastní a metabolizuje se v Krebsově cyklu jako součást aerobního metabolismu. Každá molekula citrátu je metabolizována za přítomnosti kyslíku na 3 molekuly bikarbonátu, zejména v játrech. U některých studií je uváděno riziko metabolické alkalózy až 38% [16].
Metabolická alkalóza byla pozorována u 8 dětí (11,11 %) jen u CACG. Zvýšením rychlosti dialýzy jsme dosáhli normalizace pH u MAK během 6 h v 7 případech, v jednom případě jsme byli nuceni ke snížení průtoku citrátu a toleranci vyššího cílového iCa++ v systému do 0,35–0,4 mmol/l. U nejmenších dětí pod 5 kg je vyšší riziko MAK s ohledem na vyšší dávku citrátu/kg hmotnosti [12]. To lze řešit redukcí obsahu bikarbonátu v dialyzačním roztoku a rovněž i zvýšením dialyzační dávky v ml/kg/hod. V našem citrátovém protokolu pro CVVHD byla nejnižší rychlost dialyzátu limitována nejnižší rychlostí přístroje Multifiltrate, což odpovídá u dětí s hmotností pod 3 kg dávce 200 ml/kg. Největší riziko při vyšší dialyzační dávce spatřujeme ve zvýšené clearance a poddávkování antibiotik a léků. Metabolická acidóza nebyla pozorována vůbec, což je možno vysvětlit vyloučením pacientů s jaterní dysfunkcí, kdy nedochází k přeměně citrátu na bikarbonát a v těle dochází k hromadění citrátu.
V naší studii byla pozorována hypokalcémie u CACG 2krát při zahájení, u HACG nebyla zaznamenána vůbec. Byla velmi snadno vyřešena navýšením substituce kalcia. Hyperkalcémie byla u CACG zjištěna 2krát v odstupu 12 h po zahájení. Jednou stačila jen redukce substituce kalcia, lkrát došlo k podání dialyzačního roztoku s kalciem. Po výměně roztoku za roztok bez kalcia, zvýšením rychlosti dialýzy a po přechodném vysazení substituce kalcia byl problém vyřešen.
Citrát je aplikován ve formě trisodiumcitrátu a zvyšuje riziko hypernatrémie. Z tohoto důvodu je v dialyzačním roztoku pro CACG nižší obsah natria. V našem souboru byla hypernatrémie zaznamenána až po 12 hodinách celkem u 5 dětí, z toho u CACG 4 děti a u HACG 1 dítě. Stav byl vyřešen zvýšením dialyzační dávky a ředěním všech léků do 5% glukózy místo do fyziologického roztoku. Hyponatrémie nebyla zaznamenána vůbec.
Hypomagnezémie byla zaznamenána 1krát u CACG. Situace byla vyřešena zvýšením substituce. Magnezium je kovalentní kationt, který se kompetitivně váže na citrát a tím snižuje vazbu citrátu na kalcium. K dosažení stejného účinku je pak nutno zvýšit dodávku citrátu a dochází k vyššímu riziku tzv. toxicity citrátu a k vyšší pravděpodobnosti MAK.
Magnezium jsme při CACG substituovali bolusově 2krát denně a upravovali dávku podle hladin.
U dětí jsme často limitovaní velikostí CVK a tím je omezen i BFR. Výhoda CVVHD u dětí při srovnání s CVVH je v tom, že umožňuje i při nižším BFR a adekvátní ultrafiltraci zachování nízké filtrační frakce (FF). Postupně při průchodu krve je na venózním konci kapiláry krev koncentrovanější s vyšším rizikem hyperkoagulace a zneprůchodnění filtru. Míru zakoncentrování krve na venózním konci kapiláry je možné určit právě pomocí FF, která je vyjádřena jako podíl rychlosti ultrafiltrace vztažený k rychlosti průtoku krve EC, což je u dětí limitováno velikostí CVK. Čím vyšší FF, tím vyšší hematokrit a tím vyšší riziko srážení na konci kapiláry [16]. U dětí se snažíme udržet FF do 15–20 %. U většiny moderních přístrojů se tato hodnota zobrazuje na monitoru po zadání BFR a rychlosti ultrafiltrace (UF). Citrát je zároveň s kalciem nutné zohlednit v celkové tekutinové bilanci. To znamená, že musíme citrát i kalcium připočítat k UF a tím zvýšíme FF, která se zvyšuje s nižším BFR. Výhodou je proto použití difuze u citrátové antikoagulace, kde je FF významně nižší než u konvekce. Nevýhodou při difuzi je nižší odstraňování molekulárních látek střední velikosti při sepsi. Doposud však nebyla spolehlivě prokázána nižší mortalita u konvekce při srovnání s difuzí.
I přes malý počet pacientů ve studii jsme byli nuceni z celkového souboru všech dětí indikovaných k CVVHD vyloučit ještě děti s hepatální dysfunkcí a vyšším rizikem krvácení, což snižuje již tak nízký počet pacientů.
Omezení studie
1. malý soubor pacientů
Potřeba náhrady funkce ledvin je uváděna u dětí na JIP/ARK od 1 % v USA a Kanadě do 5 % v evropských zemích [17]. Jednotlivá centra v USA udávají potřebu CRRT u dětí do 15–20 výkonů za rok [18]. Poslední studie z Dánska uvádí 36 dětí na CRRT za období 13 let z jednoho centra [19]. S ohledem na nízkou incidenci CRRT u dětí byla zvolena metoda zkřížené studie, která umožňuje u jednoho pacienta střídavě hodnotit efekt CACG a HACG opakovaně. V případě srovnávání účinku CACG a HACG by vzniklo jen něco přes 30 párů ke srovnání. K získání alespoň 100 dětí by bylo zapotřebí 8–9 let. Jedinou možností by bylo provést multicentrickou studii, avšak řada center u dětí užívá pouze heparin a často i odlišný citrátový protokol. V ČR provádí CRRT s citrátem u dětí delší dobu jen 2 pracoviště.
2. vyloučení pacientů s hepatální dysfunkcí
Citrát je primárně metabolizován v játrech a při jeho dysfunkci nedochází k přeměně na bikarbonát a kumuluje se v organismu. Děti mají při citrátové antikoagulaci v průběhu CRRT vyšší dávku citrátu v přepočtu na kilogram hmotnosti. Při CACG u dětí s hepatální dysfunkcí tak vzniká větší riziko akumulace citrátu v těle a s tím souvisí rozvoj obtížně ovlivnitelné metabolické acidózy [20]. Hepatální dysfunkce je u dětí primárně definována jako koagulopatie i při absenci jaterní encefalopatie (obtížné hodnocení jaterní encefalopatie u dětí), která přetrvává i po substituci vitaminu K. Vzhledem k riziku krvácení při HACG a pro vyšší riziko vzniku metabolické acidózy byly děti s hepatální dysfunkcí vyřazeny ze souboru.
3. vyloučení pacientů s vysokým rizikem krvácení
Užití HACG a jeho systémový účinek zvyšuje riziko krvácení bezprostředně po operacích, u traumat. U těchto pacientů používáme výhradně regionální CACG, která dále neprohlubuje riziko krvácení.
Závěrem je třeba uvést, že citrátová antikoagulace u CVVHD je snadno a bezpečně proveditelná i u nejmenších dětí a že při srovnání s heparinem zlepšuje přežití mimotělního oběhu. Podle našeho protokolu je zatížena jen minimem komplikací, které jsou snadno řešitelné.
Použité zkratky
ACG – antikoagulace (anticoagulation)
AKI – akutní renální dysfunkce (acute kidney injury)
APTT – activated clotting time
BFR – rychlost průtoku krve (blood flow rate)
CACG – citrátová antikoagulace
HACG – heparinová antikoagulace
CRRT – kontinuální eliminační metody(continuous renal replacement therapy)
CVVHD – kontinuální venovenózní dialýza
CVK – centrální venózní katétr
EC – mimotělní oběh (extracorporeal circuit)
FF – filtrační frakce (filtration fraction)
FO – hyperhydratace (fluid overload)
MAC – metabolická acidóza
MAK – metabolická alkalóza
MAP – střední arteriální tlak (mean arterial pressure)
MODS – syndrom multiorgánové dysfunkce(multiorgan dysfunction failure)
PRISM – prognostické skóre pro děti (pediatric risk of mortality)
UF – odstranění tekutin (ultrafiltration)
UFH – nefrakcionovaný heparin (unfractioned heparin)
Práce je původní a nebyla dosud publikována v jiném časopise.
Autor deklaruje, že nemá žádný konflikt zájmů
Do redakce došlo dne 10. 3. 2015.
Do tisku přijato dne 22. 7. 2015.
Adresa pro korespondenci:
MUDr. Tomáš Zaoral
Hlavní 197
747 64 Horní Lhota
e-mail: tomas.zaoral@fno.cz
Zdroje
1. Monchi, M., Berghmans, D., Ledoux, D. et al. Citrate vs. heparin for anticoagulation in continuous venovenous hemofiltration: a prospective randomized study. Intensive Care Med., 2004, 30, p. 260–265.
2. Betjes, M. G., van Oosterom, D., van Agteren, M., van de W. J.Regional citrate versus heparin anticoagulation during venovenous hemofiltration in patiens at low risk for bleeding: simile hemofilter survival but significantly less bleeding. Journal of Nephrology, 2007, 20,; p. 602–608.
3. Kutsogiannis, D., Gibney, R., Stollery, D., Gao, J. Regional citrate versus systemic heparin anticoagulation for continuous renal replacement in critically ill patients. Kidney International, 2005, 67, 6, p. 2361–2367.
4. Wu, M. Y., Hsu, Y. H., Bai, CH., Lin, Y. F. et al. Regional citrate versus heparin anticoagulation for continuous renal replacement therapy: a meta-analysis of randomized controlled trials. American Journal of Kidney Disease, 2012, 59, 6, p. 810–818.
5. Brophy, P., Somers, M., Baum, M., Symons, J. M., McAfee, N.Multi-centre evaluation of anticoagulation in patiens receiving continuous renal replacement therapy (CRRT). Nephrology Dialysis Transplantation, 2005, 20, p. 1416–1421.
6. Soltysiak, J., Warzywoda, A., Kociński, B. et al. Citrate anticoagulation for continuous renal replacement. Pediatric Nephrology, 2014, 29, p. 469–475.
7. Fernández, S., Santiago, M., López-Herce, J., García, M., Del Castillo, J. et al. Citrate anticoagulation for CRRT in children: comparison with heparin. Biomed. Reearch International., Epub 2014, Aug 3, p. 1–7.
8. Akcan-Arikan, A1., Zappitelli, M., Loftis, L. et al. Modified RIFLE criteria in critically ill children with acute kidney injury. Kidney International, 2007, 71, 10, p. 1028–1035.
9. Akcan-Arikan, A1., Zappitelli, M., Goldstein, S. L. et al. Fluid overload is associated with impaired oxygenation and morbidity in critically ill children. Pediatr. Crit. Care Med., 2012, 13, p. 253–258.
10. Goldstein, B., Giroir, B., Randolph, A. Members of the International Consensus Conference Panel (2005) International pediatric sepsis consensus conference: definitions for sepsis and organ dysfunction in pediatrics. Pediatr. Crit. Care Med., 2005, 6, p. 2–8.
11. Stefanidis, I., Hägel, J. et al. Hemostatic alterations during continuous venovenous hemofiltration in acute renal failure. Clinical Nephrology, 1996, 46, 3, p. 199–205.
12. Chadha, V., Garg, U.,Warady, B., Alon, U. Citrate clearance in children receiving continuous venovenous renal replacement therapy. Pediatric Nephrology, 2002, 17, p. 819–824.
13. Gabutti, L., Marone, C. Citrate anticoagulation in continuous venovenous hemodiafiltration: a metabolic challenge. Intensive Care Medicine, 2002, 28, p. 1419–1425.
14. Sohn, Y. B., Paik, K. H., Cho, H. Y., Kim, S. J., Park, S. W. et al.Continuous renal replacement therapy in neonates weighting less than 3kg. Korean Journal of Pediatrics, 2012, 55, 8, p. 286–292.
15. Goldstein, S. L. Advances in pediatric renal replacement therapy for acute kidney injury. Seminars in Dialysis, 2011, 24, p. 187–191.
16. Mehta, R. L., McDonald, B. R. et al. Regional citrate anticoagulation for continuous arteriovenous hemodialysis in critically ill patients. Kidney International, 1990, 38, p. 976–981.
17. Moghal, N. E., Brocklebank, J. T., Meadow, S. R. A review of acute renal failure in children: incidence, etiology and outcome. Clinical Nephrology, 1998, 49, p. 91–95.
18. Bailey, D., Phan, V., Litalien, C. et al. Risk factors of acute renal failure in critically ill children: A prospective descriptive epidemiological study. Pediatr. Crit. Care Med., 2007, 8, p. 29–35.
19. Pedersen, O., Jepsen, S. B., Toft, P. Continuous renal replacement therapy for critically ill infants and children. Danish Medical Journal, 2012, 59, 2, A4385.
20. Kramer, L., Bauer, E., Joukhadar, C. et al. Citrate pharmacokinetics and metabolism in cirrhotic and noncirrhotic critically ill patients. Crit. Care Med., 2003, 31, p. 2450–2455.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2015 Číslo 5- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Metamizol a jeho pozice v léčbě bolesti
-
Všechny články tohoto čísla
- Sepse v souvislosti s těhotenstvím – proč vytvářet další speciální doporučení, když jsou k dispozici mezinárodní „sepsis guidelines“?
- Postoj k podávání transfuzních přípravků u svědků Jehovových – dotazníková studie
- Srovnání antikoagulace pomocí heparinu a citrátu u kontinuální venovenózní hemodialýzy u kriticky nemocných dětí - prospektivní cross-over studie
- Echokardiografické hodnocení preloadu a reakce na podané tekutiny
- Sledování a monitorování oběhu
- Měření krevního tlaku neinvazivní metodou – měli bychom znát, co je schováno za číslem na displeji...
- Doporučení pro anesteziologickou péči v průběhu vyšetření magnetickou rezonancí
- Patofyziologie a diagnostika anafylaktoidního těhotenského syndromu
- Diagnostika a léčba sepse v souvislosti s těhotenstvím
- Svědci Jehovovi – měníme názory?
- The 140th anniversary of the opening of the “St. Apollinaire’s” National Maternity Hospital
- Zpráva z IX. kongresu České společnosti intenzivní medicíny
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Diagnostika a léčba sepse v souvislosti s těhotenstvím
- Srovnání antikoagulace pomocí heparinu a citrátu u kontinuální venovenózní hemodialýzy u kriticky nemocných dětí - prospektivní cross-over studie
- Sledování a monitorování oběhu
- Patofyziologie a diagnostika anafylaktoidního těhotenského syndromu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



