-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Utajená příčina hypotenze – kazuistika
A concealed cause of hypotension – case respor
The case report presents a rare case of repeated paroxysms of significant hypotension with other clinical signs of systemic illness and discusses appropriate diagnostic methods and therapeutic management.
Keywords:
hypotension – mastocytosis – echocardiography – left ventricular outflow tract dynamic obstruction
Autoři: Karvunidis Thomas; Danihel Vojtěch; Chvojka Jiří; Ledvinová Lenka; Raděj Jaroslav; Novák Ivan; Matějovič Martin
Působiště autorů: JIP, I. Interní klinika FN Plzeň a LF v Plzni Univerzity Karlovy v Praze
Vyšlo v časopise: Anest. intenziv. Med., 26, 2015, č. 1, s. 23-28
Kategorie: Intenzivní medicína - Kazuistika
Souhrn
Kazuistika prezentuje raritní případ opakovaných atak významné hypotenze s dalšími příznaky systémového onemocnění a diskutuje o příslušných diagnostických postupech a léčebných opatřeních.
Klíčová slova:
hypotenze – mastocytóza – echokardiografie – dynamická obstrukce výtokového traktu levé komoryKAZUISTIKA
61letý muž s hypofunkcí štítné žlázy na substituční léčbě, bývalý vrcholový kulturista s chronickým myeloproliferativním onemocněním (MPO) typu primární myelofibrózy (PMF), s intersticiálním plicním procesem a mediastinální lymfadenopatií nejasné etiologie léčený kortikosteroidy, byl v srpnu 2012 přijat na jednotku intenzivní péče (JIP) I. interní kliniky Fakultní nemocnice (FN) pro kolapsový stav s hypotenzí, hyposaturací a poruchou vědomí vzniklou při návštěvě hematologicko-onkologické ambulance (HO). Předcházela přibližně měsíční anamnéza opakovaných atak krutých bolestí dolních končetin (DK) a bederní části zad spojenými s erytémem hlavy a horní části trupu, výraznou oběhovou nestabilitou a respirační insuficiencí. Pro tyto obtíže byl před přijetím na naše pracoviště již 13 dní hospitalizován na JIP regionální nemocnice. Do HO ambulance FN byl odeslán k aplikaci trombokoncentrátu.
Základní hematologické onemocnění bylo stacionární (chronická anémie a trombocytopenie) a nevyžadovalo žádnou specifickou léčbu, pouze ad hoc substituci krevními deriváty. Vzhledem k pokročilému stadiu a prognosticky střednímu riziku byla indikována a plánována transplantace kmenových buněk krvetvorby.
Výše zmíněné bolesti měly zpravidla uniformní charakter a průběh. Začínaly v obou DK, šířily se do oblasti křížové kosti, pánve a bederní oblasti. Intenzita byla vždy maximální, bolesti byly kruté, vyčerpávající a s nespolehlivou odpovědí na analgetickou léčbu včetně opiátů. Jejich frekvence byla velmi proměnlivá, od několika atak během jediného dne až po několikadenní intervaly bez bolestí. Detailní a opakovaná grafická vyšetření (RTG, CT, MR a PET/CT) neobjasnila etiologii těchto obtíží. Sytě červený erytém byl patrný vždy do několika minut od počátku bolestí. Obdobně se také rozvíjela hypotenze, tachykardie, hyposaturace a kvantitativní porucha vědomí charakteru somnolence až soporu.
Bezprostředně po přijetí na JIP byla zahájena komplexní intenzivní péče včetně umělé plicní ventilace a významné vazopresorické podpory (noradrenalin v dávce až 2 µg/kg/min). Současně byla pro známky systémové infekce (tab. 1) zahájena empirická antimikrobiální léčba. Zdrojem infekce byla pravděpodobně nozokomiální pneumonie a současně uroinfekce. Opakovaná kultivační vyšetření však neprokázala žádný patogen, pozitivní bylo pouze stanovení antigenů Aspergillus spp. ve sputu. Uvedená strategie vedla k rychlé kontrole komplikující systémové infekce a stabilizaci vitálních funkcí.
Tab. 1. Vybrané laboratorní hodnoty a parametry 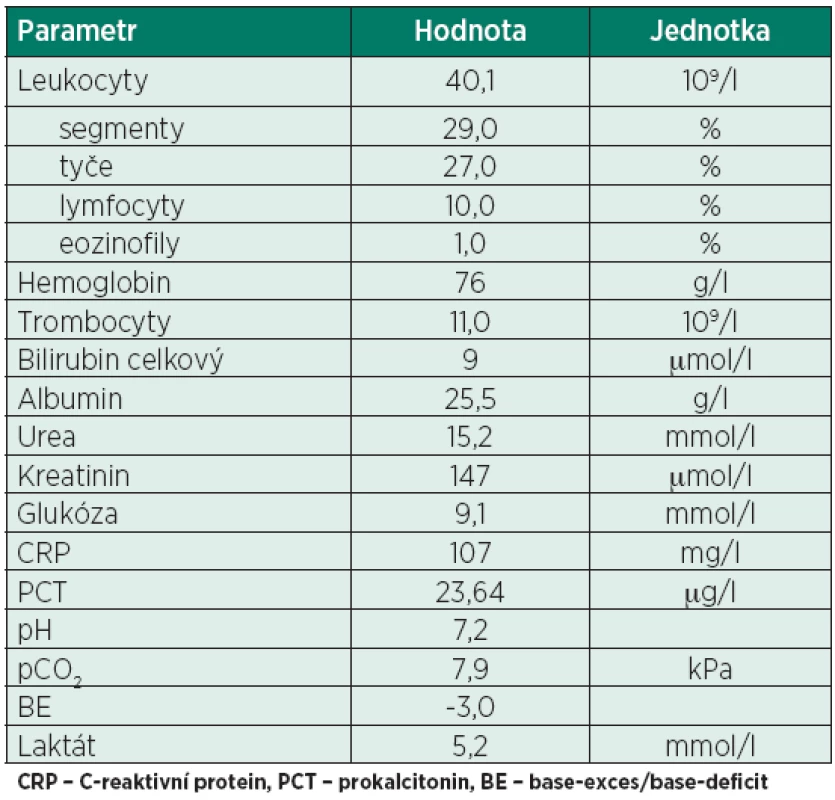
V dalším průběhu hospitalizace, respektive v prvních dvou dnech, se však opakovaly ataky výše popsaného erytému a bolestí se sinusovou tachykardií (až 150/min) a těžkou hypotenzí nereagující na vazopresorickou léčbu noradrenalinem. Bedside echokardiografické vyšetření (transtorakální echokardiografie, TTE) během jedné z typických atak obtíží ukázalo koncentricky hypertrofickou levou komoru srdeční (LKS) s dopředným pohybem cípů mitrální chlopně v systole (systolic anterior mo-tion, SAM) a hemodynamicky významnou dynamickou obstrukcí výtokového traktu levé komory (left ventricular outflow tract, LVOT) s tlakovým gra-dientem větším než 50 mm Hg. Toto zjištění vedlo ke změně léčebné strategie. Paradoxní snížení dávky a následné úplné vysazení noradrenalinu, jeho nahrazení terlipressinem (maximální dávka 0,05 µg/kg/min), aplikace bolusu krystaloidu, kontrola tepové frekvence a inotropie krátkodobě působícím i. v. betablokátorem (esmolol, maximální dávka 100 mg/h) umožnilo rychlou stabilizaci hemodynamiky. V době mimo ataku oběhové nestability byla echokardiograficky (TTE) patrná koncentrická hypertrofie LKS včetně septa (13 mm) s normální systolickou funkcí a lehkou diastolickou dysfunkcí. Nebyly patrné morfologické změny mitrální chlopně ani známky obstrukce LVOT.
Opakovaný náhlý vznik symptomů a jejich charakter budil důvodné podezření na paroxyzmální uvolňování vazoaktivního mediátoru. Případný neuroendokrinní tumor nebyl identifikován PET/CT vyšetřením, ani podle hladin metabolitů katecholaminů či chromograninů. Per exclusionem byla diagnostika zaměřena na systémovou mastocytózu. Detekovaná elevace plazmatických hladin tryptázy osmý den hospitalizace spolu s klinickým obrazem činily tuto možnost velmi pravděpodobnou. Již před vyslovením podezření na systémovou mastocytózu byla nemocnému podávána antihistaminika (bisulepin, cetirizin). I přes komplexní léčbu se však epizody významné hemodynamické nestability frekventně opakovaly a stávaly se terapeuticky jen velmi obtížně ovlivnitelnými. Stav nemocného se po sedmi dnech hospitalizace na JIP komplikoval rozvojem nozokomiální plicní infekce se septickým šokem a multiorgánovou dysfunkcí a postupně se stal refrakterním k léčbě. Současně se kontrolním vyšetřením kostní dřeně prokázala progrese základního hematologického onemocnění do blastického zvratu. Nemocný následně zemřel devátý den hospitalizace.
DISKUSE
Mastocytóza je skupinou onemocnění, pro které je charakteristická velká akumulace mastocytů ve tkáních. Lze odlišovat mastocytózu kožní se změnami lokalizovaným pouze na kůži a mastocytózu systémovou, při které žírné buňky infiltrují i jiné tkáně a orgány. Mastocytóza je ve všech svých formách velmi vzácné onemocnění, postihuje stejně obě pohlaví a její přesná incidence není známá. Dospělé postihuje častěji forma systémová a dlouhodobě perzistující [1].
Mastocyty obsahují velké množství vazoaktivních látek (tab. 2), které jsou secernovány v odpovědi na invazi patogenů. Klinický obraz pak odpovídá jejich chronickému či epizodickému uvolnění. Pokročilá forma onemocnění může být charakterizována i obtížemi plynoucími ze samotné infiltrace tkání a orgánů mastocyty a přítomností jiných asociovaných klonálních hematologických chorob. Detailní patofyziologické mechanismy rozvoje mastocytózy nejsou známy. Je popsána řada molekulárních defektů – mutací receptoru pro proliferační a diferenciační faktor (stem cell factor, SCF) na povrchu mastocytů (c-kit receptor, CD117) [2, 3, 4, 5]. Nejčastěji detekovanou mutací je záměna aspartátu za valin v kodonu 816 (Asp816Val). Rovněž není zcela objasněn vliv vyšších hladin SCF na klonální expanzi mastocytů, jelikož tyto elementy jsou v rámci autokrinních regulačních mechanismů současně také producenty tohoto růstového faktoru.
Tab. 2. Mediátory uvolňované z mastocytů 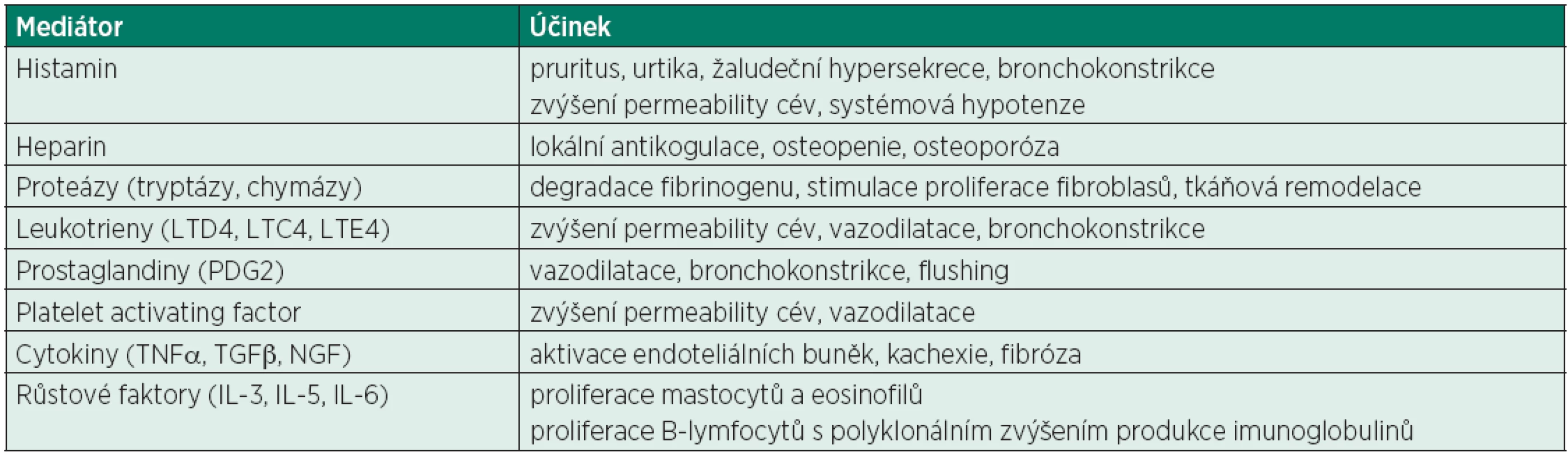
Systémová mastocytóza (SM) zahrnuje několik heterogenních nozokomiálních jednotek. Nejčastější formou je tzv. indolentní systémová mastocytóza (ISM), která představuje stabilní či pomalu progredující formu nemoci a mající ve většině případů dobrou prognózu. Systémová mastocytóza s asociovaným klonálním hematologickým onemocněním (SM-AHNMD) typu myeloproliferace, lymfoproliferace či myelodysplazie představuje další formu. Nemocní s agresivní systémovou mastocytózou (ASM) mají často orgánová postižení (fibróza jater, malabsorpce, cytopenie aj.) díky masivní infiltraci tkání a orgánů žírnými buňkami. Mastocytární leukémie (MCL) je velmi raritní chorobou s přítomností > 10 % nezralých mastocytů v periferní krvi a/nebo > 20 % v kostní dřeni.
Klinické symptomy zahrnují kožní změny, systémové příznaky v důsledku uvolnění mediátorů a symptomy vyplývající z infiltrace tkání a orgánů [4]. Vazoaktivní působky způsobují vazodilataci, hypotenzi, erytém (flush), pruritus, synkopu, bolesti břicha, nevolnosti, zvracení, průjem, slabost, bolesti hlavy, kachexii, remodelaci tkání a fibrózu. Uvolnění mediátorů, spouštěné celou řadou faktorů (tab. 3), může probíhat explozivně a velmi dramaticky pod obrazem alergické/anafylaktické reakce, která je nejzávažnějším a život ohrožujícím projevem SM. Mezi relativně časté projevy onemocnění patří neuropsychické symptomy jako deprese, změny nálad, emoční labilita, ztráta koncentrace a poruchy vědomí variabilní kvantity a kvality. U pacientů se SM jsou často popisovány výrazné muskuloskeletální bolesti zejména dlouhých kostí. Lokální infiltrací/proliferací mastocytů jsou nejčastěji postiženy: kostní dřen, játra a slezina, skelet aj.
Tab. 3. Nealergické faktory způsobující aktivaci mastocytů s uvolněním mediátorů 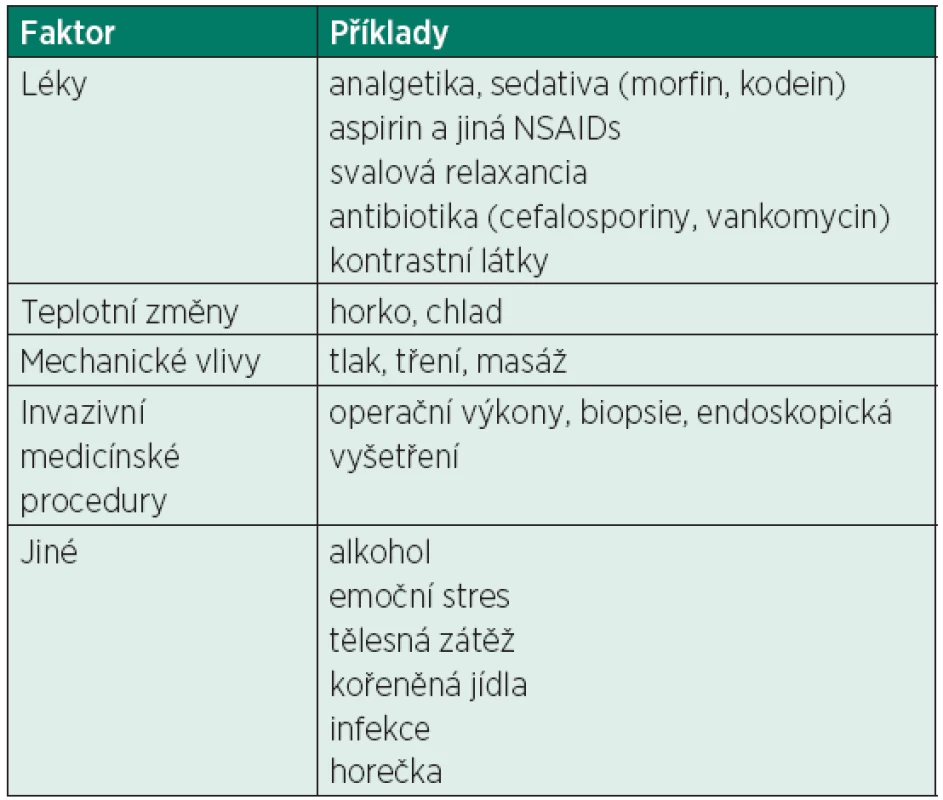
Stanovení diagnózy systémové mastocytózy spočívá ve zhodnocení popsaných klinických příznaků doplněných o grafická vyšetření, histopatologické vyšetření bioptických vzorků a laboratorní vyšetření [6]. U nemocných s kožními změnami a/nebo známkami postižení jiných orgánů, které nemohou být vysvětleny jiným onemocněním, je namístě stanovit sérovou hladinu tryptázy [7]. Tryptáza je proteáza produkovaná predominantně žírnými buňkami a v mnohem menší míře bazofilními granulocyty a myeloidními prekurzory. Normální hladiny se pohybují v rozmezí 1–15 ng/l, k jejich stanovení jsou užívány komerční kity. Elevace sérové hladiny tryptázy nad 20 ng/l je velmi suspektní pro kožní i systémovou mastocytózu a je jedním z jejich diagnostických kritérií [8] (tab. 4). Vzorek krve ke stanovení její hladiny by měl být odebrán v intervalu 15 minut až 3 hodin po začátku symptomů. Vzhledem k frekventnímu postižení kostní dřeně u nemocných se SM je její vyšetření nedílnou součástí diagnostiky tohoto onemocnění. Cytologickým a imunohistochemickým vyšetřením lze prokázat infiltraci žírnými buňkami s typickou patologickou expresí membránové molekuly CD25. Rovněž vyšetření průtokovou cytometrií (flowcytometrie, FCM) v pozitivním případě ukazuje přítomnost patologického klonu mastocytů. Nález nezralých forem mastocytů, tvořících více než 20 % buněčnosti kostní dřeně, je typický pro MCL. Všem nemocným s důvodným podezřením na SM by mělo být provedeno molekulárně genetické vyšetření případné mutace c-kit zejména varianty Asp816Val, která je přítomna u více než 90 % nemocných. Tato analýza je možná ze vzorku periferní krve, kostní dřeně i jakékoliv postižené tkáně či orgánu [3]. Diferenciální diagnostika stavů spojených se záchvatovitým zarudnutím (flush) a hypotenzí je stručně shrnuta v tabulce 5.
Tab. 4. Diagnostická kritéria systémové mastocytózy 
Tab. 5. Příčiny/diferenciální diagnostika záchvatovitého zrudnutí (flush) a hypotenze 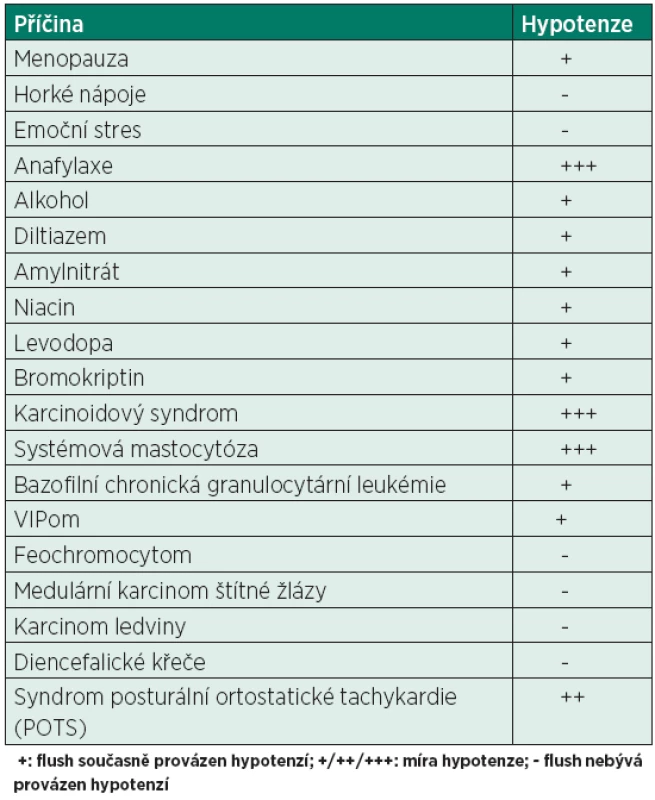
V současnosti není známa kurativní léčba mastocytózy. Terapie je zaměřena na prevenci, zmírnění příznaků a zlepšení kvality života [4, 7].Zásadní je snaha vyvarovat se známým či potenciálním spouštěcím faktorům degranulace žírných buněk. Bezpodmínečně všichni nemocní by měli být vybaveni nejméně dvěma dávkami adrenalinu ve formě vhodné k bezprostřední a laické aplikaci (adrenalinové pero) a pečlivě instruováni v jeho užití při známkách anafylaktické reakce. Základem farmakologické léčby většiny jsou antihistaminika (H1 - či H2-blokátory), dále také anti-leukotrieny (montelukast, zafir-lukast). Ataky erytémů (flushing) mohou být léčeny kyselinou acetylsalicylovou [9]. V terapii agresivních forem SM (ASM, SM-AHNMD) lze volit interferon(IFN)-α2b, kortikoidy, kladribin, hydroxyureu či inhibitory tyrosin-kinázy (imatinib, dasatinib) [5].
Prognóza nemocných s indolentní SM je velmi dobrá. Onemocnění zpravidla neprogreduje do více agresivních forem a nevyžaduje cytoredukční léčbu. Průběh a prognóza SM s asociovanou hematologickou malignitou jsou dány biologickou povahou a možnostmi léčby této přidružené choroby. Agresivní formy SM včetně MCL mají prognózu jednoznačně špatnou i přes extenzivní symptomatickou a cytoredukční terapii.
Uvedená kazuistika prezentuje případ možného systémového onemocnění mastocytů asociovaného s klonálním hematologickým onemocněním. Tímto lze vysvětlit řadu patologických nálezů nemocného. Typicky působí ataky erytémů (flush), hypotenzí a respiračních insuficiencí. Také bolesti dlouhých kostí je možno sdružit s popisovanými muskuloskeletálními symptomy systémového onemocnění žírných buněk. Mediastinální lymfadenopatie může mít rovněž svůj původ v infiltraci mastocyty, lymfadenopatie je totiž popisována ve 20–60 % případů nemocných, přičemž vyšší počty jsou mezi nemocnými s agresivními formami onemocnění (ASM, SM-AHNMD a MCL). Obdobně je tomu i v případě splenomegalie. Diagnóza systémové mastocytózy byla v daném případě z klinického průběhu a některých laboratorních vyšetření pravděpodobná (sérová hladina tryptázy opakovaně > 20 ng/l), nelze ji však považovat za definitivní. Nebyla naplněna rigorózní diagnostická kritéria (viz tab. 4), mutace Asp816Val (D816V) c-kit nebyla potvrzena, a ani cytologický a flowcytometrický nález v kostní dřeni neprokázal infiltraci žírnými buňkami. Bioptické/histologické vyšetření sleziny a/nebo lymfatických uzlin mediastina nebylo provedeno. Spíše se tedy kloníme k popisnému označení tohoto klinického stavu syndromem aktivace mastocytů (mast cell activation syndrome, MCAS) než k diagnóze systémové mastocytózy [10, 11].
Tato kazuistika rovněž ilustruje méně obvyklou příčinu oběhové nestability – dynamickou obstrukci výtokového traktu levé komory srdeční (DOLVOT) při její hypertrofii, zhoršeném diastolickém plnění při tachykardii a SAM. Tento stav může být identifikován až u 1/8 kriticky nemocných[12, 13, 14, 15]. Na DOLVOT je potřeba myslet zejména v situacích s progredující oběhovou nestabilitou při léčbě vazopresory, zejména se současnou tachykardií a hyperkontraktilitou myokardu. Klíčovým vyšetřením v identifikaci tohoto patofyziologického mechanismu a korespondujícího morfologického substrátu (hypertrofie LKS a SAM) je echokardiografické vyšetření (TTE) – obrázek 1. Pomocným vodítkem v diagnostice může být případně nově vzniklý parasternální systolický šelest a pulsus bisferiens – obrázek 2. DOLVOT při preexistující hypertrofii LKS popisovaná v kazuistice mohla být způsobena masivním uvolněním vazoaktivních látek se systémovou hypotenzí, kompenzační tachykardií a zvýšením kontraktility myokardu, což bylo současně potencováno i navýšením dávky noradrenalinu.
Obr. 1. Echokardiografický nález obstrukce výtokového traktu levé komory srdeční při dopředném pohybu cípu mitrální chlopně 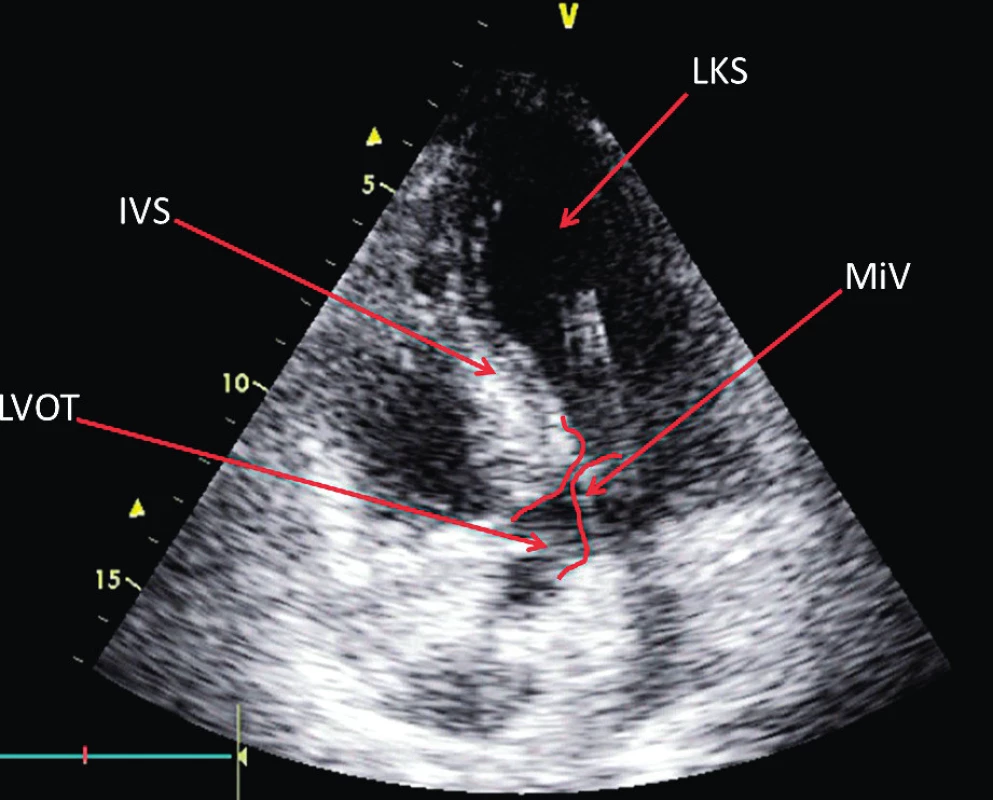
LKS – levá komora srdeční, IVS – interventrikulární septum, LVOT – výtokový trakt levé komory, MiV – mitrální chlopeň (cíp) Obr. 2. Pulsus bisferiens 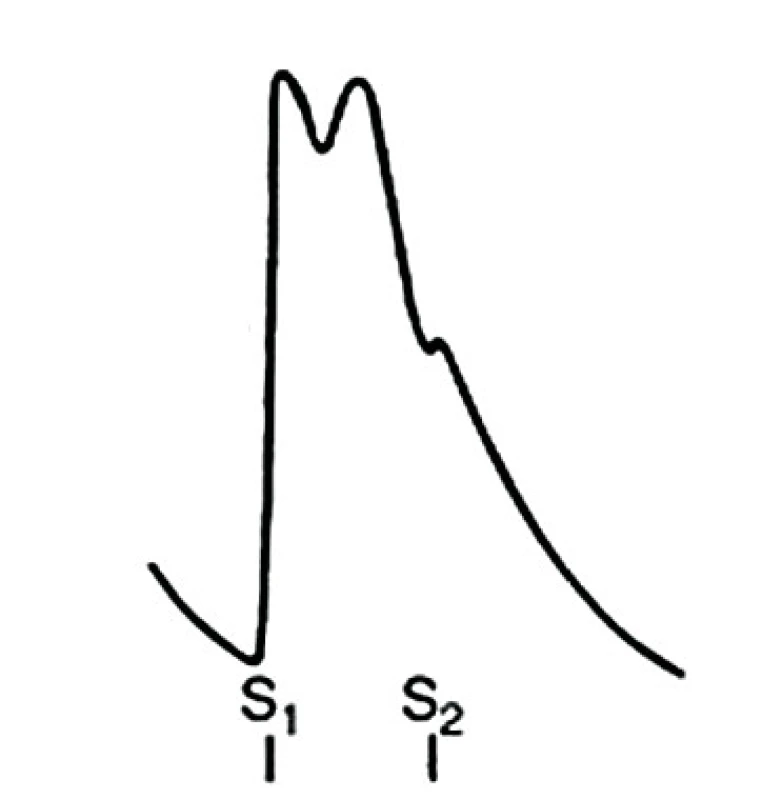
(upraveno; GNU Free Documentation License, Wikimedia Commons) Východiskem z tohoto začarovaného kruhu refrakterní hypotenze je kontrolovaná optimalizace intravenózní volémie (např. bolusovou aplikací krystaloidů), paradoxní (vzhledem k hypotenzi) snížení dávky noradrenalinu (dekatecholaminizace), podání vazopresoru bez chronotropního a inotropního potenciálu (terlipressin či vazopresin) a snížení srdeční frekvence a kontraktility betablokátorem s krátkým biologickým poločasem (esmolol). Striktně je třeba se vyvarovat podání pozitivně inotropních látek, nitrátů, diuretik a případnému použití mechanických systémů podpory srdečního výdeje (intraaortální balonková kontrapulzace, IABP aj.). Uvedené rovněž ukazuje na důležité postavení echokardiografie, respektive celé tzv. critical care ultrasonography v diagnostických, rozhodovacích a léčebných algoritmech.
ZÁVĚR
Onemocnění mastocytů jsou raritními nozologickými jednotkami. Je třeba na ně pomýšlet v případech opakujících se jinak nevysvětlitelných atak hypotenze s erytémem a bolestmi, spolu s případným rozvojem orgánových dysfunkcí. Uvedená symptomatologie může nezřídka nemocné dovést až na lůžka intenzivní péče, jak prezentuje i výše popsaný případ nadměrné aktivace mastocytů u nemocného s myeloproliferativním onemocněním. Také samotná refrakterní hypotenze s případnými projevy kardiálního selhání s nízkým srdečním výdejem může mít méně často svoji příčinu v dynamické obstrukci výtokového traktu levé srdeční komory. Tato možnost by v uvedených klinických situacích měla být vždy zvážena v rámci diferenciální diagnostiky a následně ověřena/vyloučena cíleným echokardiografickým vyšetřením, které zde má nezastupitelnou roli, jak v samotné diagnostice, tak i samotném léčebném managementu.
Podpora: Program rozvoje vědních oborů Univerzity Karlovy (PRVOUK - projekt P36) MZ ČR – RVO (Fakultní nemocnice Plzeň – FNPl, 00669806) CZ.1.05/2.1.00/03.0076 Evropský fond pro regionální rozvoj (Biomedicínské centrum LF Plzeň, UK v Praze).
Do redakce došlo dne 2. 9. 2014.
Do tisku přijato dne 20. 11. 2014.
Adresa pro korespondenci:
MUDr. Thomas Karvunidis, PhD.
JIP, I. interní klinika FN a LF v Plzni, UK v Praze
Alej Svobody 80
304 60 Plzeň
e-mail: karvunidist@fnplzen.cz
Zdroje
1. Akin, C., Metcalfe, D. D. Systemic mastocytosis. Annu. Rev. Med., 2004, 55, p. 419–432.
2. Garcia-Montero, A. C., Jara-Acevedo, M., Teodosio, C. et al. KIT mutation in mast cells and other bone marrow hematopoietic cell lineages in systemic mast cell disorders: a prospective study of the Spanish Network on Mastocytosis (REMA) in a series of 113 patients. Blood, 2006, 108, p. 2366–2372.
3. Akin, C. Molecular diagnosis of mast cell disorders: a paper from the 2005 William Beaumont Hospital Symposium on Molecular Pathology. J. Mol. Diagn., 2006, 8, p. 412–419.
4. Fuller, S. J. New insights into the pathogenesis, diagnosis, and management of mastocytosis. Hematol. Oncol. Clin. North. Am., 2012, 26, p. 1143–1168.
5. Verstovsek, S. Advanced systemic mastocytosis: the impact of KIT mutations in diagnosis, treatment, and progression. Eur. J. Haematol., 2013, 90, p. 89–98.
6. Sperr, W. R., Valent, P. Diagnosis, progression patterns and prognostification in mastocytosis. Expert. Rev. Hematol., 2012, 5, p. 261–274.
7. Pardanani, A. Systemic mastocytosis: disease overview, pathogenesis, and treatment. Hematol. Oncol. Clin. North Am., 2012, 26, p. 1117–1128.
8. Schwartz, L. B., Irani, A. M. Serum tryptase and the laboratory diagnosis of systemic mastocytosis. Hematol. Oncol. Clin. North Am., 2000, 14, p. 641–657.
9. Butterfield, J. H., Weiler, C. R. Prevention of mast cell activation disorder-associated clinical sequelae of excessive prostaglandin D(2) production. Int. Arch. Allergy Immunol., 2008, 147, p. 338–343.
10. Akin, C., Valent, P., Metcalfe, D. D. Mast cell activation syndrome: Proposed diagnostic criteria. J. Allergy Clin. Immunol., 2010, 126, p. 1099–1104.
11. Valent, P., Akin, C., Arock, M. et al. Definitions, criteria and global classification of mast cell disorders with special reference to mast cell activation syndromes: a consensus proposal. Int. Arch. Allergy Immunol., 2012, 157, p. 215–225.
12. Chockalingam, A., Tejwani, L., Aggarwal, K. et al. Dynamic left venticular outflow tract obstruction in acute myocardial infarction with shock: cause, effect, and coincidence. Circulation, 2007, 116, p. 110–113.
13. Bybee, K. A., Prasad, A. Stress-related cardiomyopathy syndromes. Circulation, 2008, 118, p. 397–409.
14. El Mahmoud, R., Mansencal, N., Pilliere, R. et al. Prevalence and characteristics of left ventricular outflow tract obstruction in Tako-Tsubo syndrome. Am. Heart J., 2008, 156, p. 543–548.
15. Chockalingam, A., Xie, G. Y. Echocardiography in stress cardiomyopathy and acute LVOT obstruction. Int. J. Cardiovasc. Imaging, 2010, 26, p. 527–535.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek Na konci volebního období…Článek Kongres ČSARIMČlánek ESPA 2014Článek Plánované akce na rok 2015Článek KALENDÁŘ NADCHÁZEJÍCÍCH AKCÍ
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2015 Číslo 1- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Léčba akutní pooperační bolesti z pohledu ortopeda
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
-
Všechny články tohoto čísla
- Muž s nebolestivým ikterem, anemickým syndromem a stenokardiemi – kazuistika
- Utajená příčina hypotenze – kazuistika
- Kaudální blokáda pod ultrazvukovou kontrolou
- Sledování a monitorování dýchání a ventilace
- Faktory regulující kontraktilitu myokardu, Anrepův a Bowditchův efekt
- Konsenzuální stanovisko k multimodálnímu monitorování v neurointenzivní péči
- Opatrovník a zástupný souhlasu pacientů v intenzivní péči
-
Kdo je kdo v anesteziologii a intenzivní medicíně
Doc. MUDr. Bořivoj Dvořáček, CSc. - Zpráva o XXI. kongresu ČSARIM
- Kongres ČSARIM
- Na konci volebního období…
- ESPA 2014
- Výzva sekce porodnické anestezie a analgezie
- Plánované akce na rok 2015
- Volby ČSARIM pro volební období 2015–2018
- KALENDÁŘ NADCHÁZEJÍCÍCH AKCÍ
- Nabídka Německé společnosti anesteziologie a intenzivní medicíny
- 16th Annual NATA Symposium on Patient Blood Management, Haemostasis & Thrombosis
- Perioperační hypotermie u plánovaných terapeutických a diagnostických výkonů
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Kaudální blokáda pod ultrazvukovou kontrolou
- Perioperační hypotermie u plánovaných terapeutických a diagnostických výkonů
- Opatrovník a zástupný souhlasu pacientů v intenzivní péči
- Utajená příčina hypotenze – kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



