-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hypovolemický šok
Autoři: Černá Pařízková Renata; Černý Vladimír
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Hradec Králové
Vyšlo v časopise: Anest. intenziv. Med., 25, 2014, č. 1, s. 47-57
Kategorie: Postgraduální vzdělávání - Atestační příprava
- Vymezení otázky a struktura problému
- Důležité body
- Související problematika/témata a příklady doplňujících otázek ze strany zkušební komise
1. Vymezení otázky a základní struktura problému
- Šok
- Definice a klasifikace
- Patofyziologie
- Diagnostika šokového stavu a syndrom tkáňové hypoperfuze
- Hypovolemický šok
- Léčba šoku
- Obecné zásady léčby šoku
- Syndrom hypotenze
- Speciální problematika léčby hypovolemického šoku
2. Důležité body
- Definice
Šok je definován jako akutní život ohrožující selhání oběhu charakterizované nedostatečnou systémovou tkáňovou perfuzí, vedoucí k neadek-vátní dodávce kyslíku a energetických substrátů tkáním ve vztahu k jejich aktuálním metabolickým potřebám. V důsledku tkáňové hypoperfuze dochází k rozvoji tkáňové hypoxie s funkčním a následně i morfologickým poškozením buněk, které může vést k rozvoji multiorgánového selhání. Mezi obecné příčiny šoku patří:
- ztráta intravaskulárního objemu,
- porucha funkce myokardu jako pumpy,
- překážka ve výtokové části srdce,
- nepoměr mezi objemem a náplní krevního řečiště,
- kombinace uvedených mechanismů.
- Klasifikace šoku
Selhání oběhu z jakékoliv příčiny vede v konečném důsledku ke změnám v oblasti mikrocirkulace, kde rozsah poškození je přímo úměrný rozsahu tkáňové hypoxie a orgánového selhání. Podle příčiny a kardiovaskulárních parametrů klasifikovali v roce 1972 Weil a Shubin šokové stavy na šok hypovolemický, kardiogenní, obstrukční a distribuční (někdy je používán pojem „distributivní“); modifikace této klasifikace používaná v současné době je uvedena v tabulce 1.
Tab. 1. Klasifikace šokových stavů 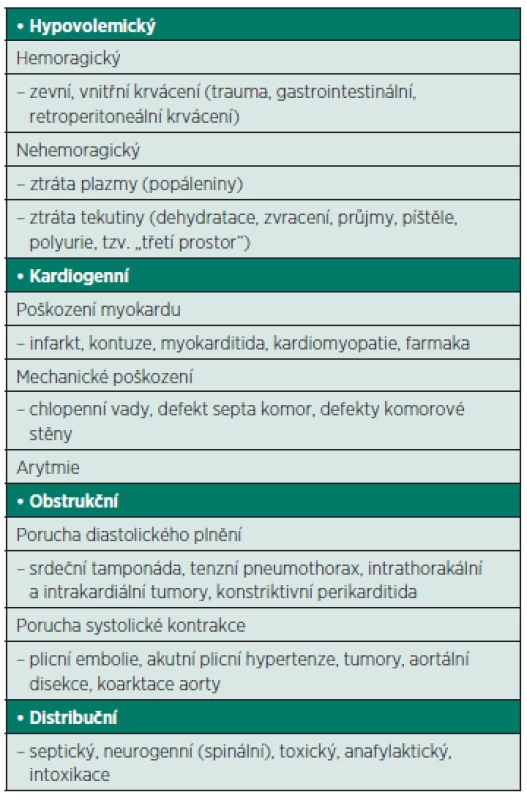
Hypovolemický šok vzniká v důsledku ztráty intravaskulárníbo objemu (zevní či vnitřní krvácení, ztráta plazmy, sekvestrace tekutiny do gastrointestinálního traktu apod.). Pokles krevního objemu vede ke snížení žilního návratu (pokles předtížení tzv. preload) a nedostatečnosti kompenzačních mechanismů k poklesu tepového obejmu a srdečního výdeje (CO).
Kardiogenní šok je charakterizován selháváním myokardu jako pumpy (akutní infarkt myokardu, dekompenzace chlopenní vady apod.) s poklesem tepového objemu a CO. Rozdíl mezi kardiálním selháním a kardiogenním šokem je v závažnosti selhávání vyjádřené symptomatologií tkáňové hypoperfuze.
Obstrukční šok je způsoben překážkou ve výtokovém traktu srdce či nemožností dostatečného plnění srdce (plicní embolie, tenzní pneumothorax) s poklesem tepového obejmu a srdečního výdeje.
Distribuční šok je charakterizován nadprodukcí mediátorů s vazodilatačním efektem, výrazně zvýšenou kapilární permeabilitou s redistribucí tekutiny extravaskulárně, sekvestrací krve do dilatovaného kapacitního řečiště, arteriovenózními zkraty. Nepoměr mezi náplní a kapacitou cévního řečiště spolu s reálnou hypovolémií při ztrátách tekutin extravaskulárně jsou příčinami hypotenze a ve většině případů se dále rozvíjející tkáňovou hypoperfuzí a buněčnou hypoxií.
- Patofyziologie
Reakce organismu na inzult je spojena s aktivací rozsáhlého systému biologických dějů, které mají primárně protektivní charakter a jsou zcela nezbytné pro přežití organismu a hojení poškozených tkání. Udržení dostatečného krevního průtoku tkáněmi je podmíněno udržením arteriálního perfuzního tlaku, jehož hlavními determinantami jsou srdeční výdej a systémová cévní rezistence. Organismus reaguje na inzult nespecifickou kompenzační patofyziologickou neuroendokrinní reakcí, jejímž cílem je udržení perfuze životně důležitých orgánů (především myokardu a mozku) pomocí aktivace sympatického nervového systému a humorální odezvy. Současně je iniciována zánětlivá imunologická odpověd, jejímž primárním úkolem je z fylogenetického hlediska ochrana organismu s eliminací příčinné noxy a následná reparace poškozených tkání. Systémová forma zánětlivé reakce je označována jako syndrom systémové zánětové (někdy je ještě používán pojem zánětlivé) odpovědi (systemic inflammatory response syndrome = SIRS), během které je produkována řada biologicky aktivních látek (mediátorů) s prozánětlivými i protizánětlivými účinky, jejichž vzájemný poměr je udržován řadou regulačních mechanismů, s cílem omezení působení reakce pouze v oblasti poškozených tkání.
Sympatoadrenální a neuroendokrinní reakce
Organismus reaguje na inzult aktivací sympatického nervového systému a humorální odezvy. Výsledkem této reakce je udržení srdečního výdeje (CO) ovlivněním jeho základních komponent – tepové frekvence (TF) a tepového objemu (SV) ve všech aspektech (srdeční rytmus, preload, kontraktilita, afterload). Pokles srdečního výdeje s poklesem krevního tlaku aktivuje cestou baroreceptorů centrální sympatický nervový systém. Aktivace autonomního sytému vede ke zvýšení syntézy a vyplavení noradrenalinu na postgangliových vláknech kardiálních nervů s přímým pozitivně chronotropním a pozitivně inotropním účinkem, později dochází k vyplavení endogenních katecholaminů z dřeně nadledvin se stejnými důsledky. Endogenní katecholaminy cestou periferních receptorů ovlivňují i cévní tonus, dochází k systémové vazokonstrikci s centralizací oběhu s cílem udržení perfuze životně důležitých orgánů. Snížení perfuze ledvin aktivuje juxtaglomerulární aparát se zvýšením uvolnění reninu a aktivací osy renin-angiotenzin-aldo-steron. Angiotenzin II má silný vazokonstrikční efekt, současně stimuluje tvorbu aldosteronu s následnou retencí natria a vody v organismu. Zvýšená produkce ACTH, růstového hormonu (GH) a antidiuretického hormonu (ADH) jsou další mechanismy k udržení dostatečného objemu tekutin a cévního tonu. Fyziologicky je zvýšená hladina kortizolu, za určitých stavů (krvácení do nadledvin např. při meningokokové sepsi, tzv. Waterhouse-Friderichsenův syndrom) může dojít ke známkám nadledvinové insuficience.
Fyziologické důsledky neuroendokrinní sympatoadrenální reakce:
- vazokonstrikce, centralizace oběhu (udržení tkáňového perfuzního tlaku),
- tachykardie (zvýšení CO),
- zvýšení inotropie (zvýšení SV a CO),
- přesun tekutin z intersticia intravaskulárně (zvýšení intravaskulárního objemu a CO),
- venokonstrikce (zvýšení žilního návratu a CO),
- renin-angiotenzin-aldosteron (vazokonstrikce, zvýšení intravaskulárního objemu a CO),
- kostní dřeň, játra, slezina (zvýšená tvorba a vyplavení zásob erytrocytů a leukocytů),
- hyperventilace (zvýšený přívod kyslíku).
Hemodynamické změny
Klinické známky a hemodynamické parametry jsou společné jednotlivým typům šoku, v některých případech dochází k jejich kombinaci.
Hypovolemický šok je charakterizován snížením venózního návratu (preload) s aktivací neuroendokrinní sympatoadrenální reakce, jejímž důsledkem je tachykardie, zvýšení inotropie s cílem udržení či zvýšení tepového objemu. Tachykardie a hypotenze je provázená vazokonstrikcí (zvýšení periferní cévní rezistence SVR) a centralizací oběhu s cílem udržení perfuze mozkem a myokardem, plnící tlaky srdce jsou nízké. Hypotenze se rozvíjí až při ztrátách 20 až 25 % krevního objemu.
Kardiogenní šok je charakterizován podle některých zdrojů poklesem srdečního indexu na hodnoty kolem 1,8 l/min/m2. Klinický obraz je obdobný jako u hypovolemického šoku s vystupňovanou vazokonstrikcí, centralizací oběhu a tachykardií, může docházet ke zvyšování plnících tlaků před selhávajícím srdečním oddílem.
Obstrukční šok má téměř identický hemodynamický profil jako šok kardiogenní, podle příčiny stavu lze rozlišovat především rozdílné plnící tlaky. U plicní embolizace odchází ke snížení srdečního výdeje, může být zvýšen CVT, tlak v zaklínění bývá obvykle nízký, je přítomna prekapilární plicní hypertenze, UZ srdce může prokázat dilataci pravé komory. U pacientů se srdeční tamponádou dochází k vzestupu CVT, progresi známek tkáňové hypoperfuze a sympatoadrenální odpovědi, podle UZ srdce mimo průkaz tekutiny v perikardu lze vidět zvýšenou kontraktilitu srdečních komor s minimální dilatací v diastole.
Distribuční šok se na rozdíl od předešlých typů šoku vyznačuje převahou vazodilatace s tzv. teplou periferií, v případě korekce hypovolémie a při dobré funkci myokardu je charakteristický vysokým srdečním výdejem. Produkce látek s kardiodepresivním účinkem vede k myokardiální dysfunkci, která je potencována nadměrnou zátěží myokardu a sekundárními inzulty, jako je acidóza, hypoxémie, buněčná hypoxie při difuzní ischémii. Hemodynamický a klinický obraz hypodynamické fáze distribučního šoku je podobný obrazu kardiogenního šoku, srdeční výdej většinou klesá do normálních hodnot, tento pokles je při progresi klinických a/nebo laboratorních známek tkáňové hypoperfuze jednozančně nepříznivý. Základní hemodynamická charakteristika jednotlivých typů šoku je uvedena v tabulce 2.
Tab. 2. Hemodynamická charakteristika jednotlivých typů šoku 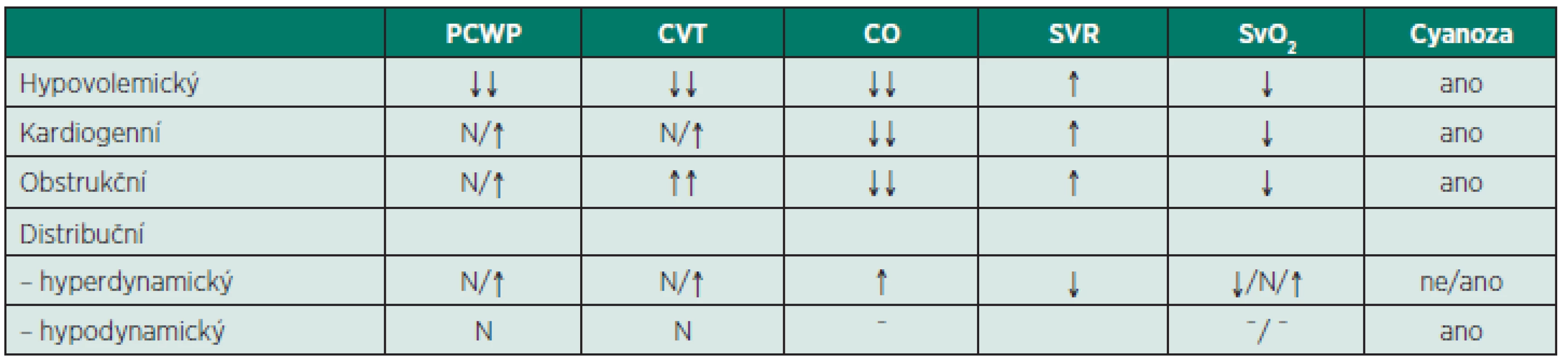
PCWP – plicní kapilární tlak v zaklínění, CVT – centrální žilní tlak, CO – srdeční výdej, SVR – periferní cévní rezistence, SvO2 – saturace hemoglobinu ve smíšené žilní krvi, N – normální hodnota Změny v mikrocirkulaci
Podkladem šokového stavu je nedostatečná tkáňová perfuze, základní patofyziologické změny vedoucí ke konečnému poškození tkání a orgánů se odehrávají na úrovni mikrocirkulace. Zvýšená aktivita sympatiku a angiotenzinu II vede k prekapilární i postkapilární vazokonstrikci a k udržení systémového krevního tlaku. Současně dochází ke snížení hydrostatického tlaku v kapilárách s tzv. transkapilárním plněním, dochází k přesunu tekutin z extravaskulárního prostoru intravazálně a tím ke zvýšení cirkulujícího intravaskulárního objemu. V případě progrese stavu dochází v důsledku metabolických změn (kyselé metabolity, vazodilatační mediátory) k prekapilární vazodilataci s přetrvávající konstrikcí venul. V této fázi dochází k poklesu perfuzního tlaku (snížení periferní cévní rezistence) a zvýšení hydrostatického tlaku v kapilárách s přesunem tekutiny extravaskulárně a k rozvoji intersticiálního tkáňového edému. Poškození endotelu (hypoxie, toxiny, adheze leukocytů, mediátory) má za následek zvýšení kapilární permeability s další progresí úniku tekutiny a bílkovin extravaskulárně a navození prokoagulačního stavu. Aktivace koagulace vede k aktivaci a diseminaci mikrotrombózy v mikrocirkulaci s prohloubením ischémie a tkáňové hypoxie. Obnovení průtoku mirkocirkulací je provázeno rozvojem tzv. reperfuzního syndromu, který lze považovat za sekundární inzult vedoucí k dalšímu poškození tkání. Odlišný obraz v oblasti mikrocirkulace lze pozorovat u nemocných s distribuční formou šoku, zvláště septického, kdy dochází k nadprodukci vazodilatačních látek (především oxid dusnatý NO), patologické distribuci perfuze s nárůstem její heterogenity; jsou prokázány arteriovenózní zkraty, které se významně podílejí na buněčné hypoxii. Oproti ostatním formám šoku je zvýrazněna nadměrná kapilární permeabilita s extravazací tekutin a intersticiálním edémem. Výsledkem výše uvedeného patofyziologického procesu je pokles cirkulujícího objemu, zhoršení edému tkání, tkáňové hypoperfuze a dodávky kyslíku tkáním.
Kyslíkový (oxidativní) metabolismus
Primární metabolický deficit u pacientů v šoku je porucha oxidativního metabolismu, který je způsoben především nedostatečnou dodávkou kyslíku tkáním (DO2) v důsledku sníženého průtoku krve a maldistribucí tkáňové perfuze. Hlavními determinantami dodávky kyslíku tkáním (DO2) jsou srdeční výdej a obsah kyslíku v arteriální krvi (CaO2). Obsah kyslíku v krvi ovlivňuje především hladina hemoglobinu a jeho saturace kyslíkem, rozpuštěný kyslík v krvi určovaný hodnotou par-ciálního tlaku (PaO2) má podíl na DO2 zcela minimální. Za fyziologických okolností je dodávka a spotřeba kyslíku (VO2) udržována autoregulačními mechanismy s ohledem na aktuální metabolické požadavky tkání. Příčiny poklesu DO2 v tkáních:
- Hypoxémie (pokles SaO2)
- Zvýšení spotřeby kyslíku VO2
- Snížení srdečního výdeje CO
- Snížení hemoglobinu (anémie)
Při snížení DO2 či zvýšení metabolických požadavků tkání dochází ke zvýšení extrakce kyslíku (fyziologické rozmezí 22–33 %) s udržením spotřeby kyslíku až do doby dosažení kritické hodnoty DO2, kdy již tkáně nejsou schopny zvýšit extrakci kyslíku a VO2 klesá („kritická“ hodnota VO2), za patologických situací může dojít k posunu kritického DO2. Hodnota centrální (ScvO2) nebo smíšené žilní krve (SvO2) je odrazem extrakce kyslíku a spotřeby tkáněmi. Normální hodnota SvO2 je v rozmezí 60–80 %, pokles hodnoty pod 60 % odráží zvýšenou extrakci kyslíku při hodnotách pod 55 %. Hodnoty pod 55% jsou spojeny s nedostatečnou tkáňovou perfuzí, laboratorně potvrzenou i laktátovou acidózou. Při nedostatku kyslíku pro aerobní metabolismus nastává zastavení oxidativní fosforylace v mitochondriích, dochází ke kumulaci pyruvátu, který nepřechází do mitochondrií, pyruvát je v cytosolu měněn na laktát za tvorby výrazně menšího množství energie ve formě ATP (2 mol vs. 38 mol). Při poklesu vstupu pyruvátu do Krebsova cyklu v mitochondriích dochází k navýšení anaerobního metabolismu, hromadění laktátu, tvorbě vodíkových iontů při hydrolýze ATP s rozvojem metabolické laktátové acidózy. Všechny tyto pochody vedou k energetickému selhání buňky s jejím funkčním a následně i organickým poškozením. Oxidativní metabolismus může být v šokových stavech poškozen i v důsledku nadprodukce prozánětlivých mediátorů (NO, endotoxin, kyslíkové radikály, kalcium, TNF alfa), které vedou k poškození mitochondriálních funkcí.
Buněčné změny, orgánová dysfunkce
V případě progredujícího inzultu se stávají kompenzační mechanismy nedostatečné, dochází k progresi stavu s rozvojem známek buněčné hypoxie vedoucí k funkčnímu a morfologickému poškození tkání. Dochází ke změně aerobního metabolismu na anaerobní s nadprodukcí laktátu s rozvojem metabolické laktátové acidózy. Deplece adenosintrifosfátu (ATP) vede k funkčnímu poškození buněk, selhávají základní buněčné a přenosové mechanismy včetně natrio-kaliové pumpy, dochází k influxu natria a vody intracelulárně s otokem buňky. Funkční porucha charakterizovaná poklesem transmembránového poten-ciálu, intracelulární akumulací kalcia, poruchou funkce mitochondrií a intracelulárních organel je následována strukturálním poškozením buňky. Extenzivní buněčná dysfunkce je klinicky vyjádřena různým stupněm poruchy funkce daného orgánu/tkáně, manifestující se typickou klinickou symptomatologií:
- kardiální dysfunkce,
- akutní renální insuficience,
- akutní respirační insuficience,
- dysfunkce splanchnické oblasti (neokluzivní ischémie, ileus, ulcerace),
- jaterní dysfunkce,
- mentální dysfunkce,
- diseminovaná intravaskulární koagulace,
- nervosvalová dysfunkce,
- porucha imunity, metabolismu.
Imunologická reakce
Organismus reaguje na inzult i imunologickou obrannou reakcí, během které dochází k aktivaci makrofágů, leukocytů, endotelu, trombocytů s produkcí řady prozánětlivých a protizánětlivých mediátorů. Zánětová reakce a její propagace na subcelulární, celulární, orgánové a systémové úrovni představuje klíčový mechanismus v patogenezi orgánové dysfunkce u nemocných v kritickém stavu, bez ohledu na vyvolávající příčinu (inzult). Podstatou systémové zánětové odpovědi organismu na specifický inzult je komplex nespecifických a uniformních reakcí, jejichž primárním cílem z fylogenetického hlediska je ochrana organismu s eliminací noxy a následná reparace poškozených tkání. Velikosti a závažnosti inzultu přiměřený stupeň zánětové odpovědi je nedílnou součástí řady výše uvedených reakcí zajišťujících integritu orgánových funkcí. Selhání systému regulace zánětové reakce v akutní fázi kritického stavu je spojeno s propagací zánětu i na původně nepoškozené tkáně a ve svém důsledku vede k jejich poškození s následnou poruchou orgánových funkcí. V klinickém průběhu dochází k rozvoji dysfunkce různého stupně jednotlivých orgánů a systémů – syndrom multiorgánové dysfunkce/multiorgánového selhání (MOF). Reakce organismu na inzult je spojena s aktivací rozsáhlého systému biologických dějů, které mají primárně protektivní charakter a jsou zcela nezbytné pro přežití organismu a hojení poškozených tkání. Systémová forma zánětové reakce je označována jako syndrom systémové zánětové odpovědi (systemic inflammatory response syndrome = SIRS), během které je produkována řada biologicky aktivních látek (mediátorů) s prozánětlivými i protizánětlivými účinky, jejichž vzájemný poměr je udržován řadou regulačních mechanismů s cílem omezení působení reakce pouze v oblasti poškozených tkání.
Kritéria SIRS
Je nutná přítomnost alespoň dvou následujících klinických kritérií:
- tepová frekvence > 90/min,
- dechová frekvence > 20/min neboPaCO2 < 32 mm Hg,
- tělesná teplota > 38 °C nebo < 36 °C,
- leukocyty > 12 000/mm3 nebo < 4 000/mm3 nebo ≥ 10 %.
Za fyziologických okolností je zánětová reakce s produkcí prozánětlivých mediátorů kompenzována komplexem protizánětlivých dějů, označovaných jako tzv. CARS (= compensatory anti-inflammatory response syndrome). Při odeznívání SIRS může dojít k převaze protizánětlivých dějů (CARS) vedoucích k imunosupresi s vysokým rizikem vzniku infekčních komplikací a sepse. V rozvoji tzv. syndromu imunologické nestability má rozhodující úlohu trvající přítomnost perzistujících a neodstraněných inzultů, které se podílejí na udržování neadekvátního stupně zánětové reakce. Rozhodujícím faktorem přetrvávající dysregulace se tak jeví spíše doba trvání než vlastní intenzita inzultů a je tedy velmi pravděpodobné, že nemocní s trvale aktivovanými ději zánětové reakce jsou významně ohroženi vznikem rozvoje MOF. Snaha o eliminaci všech intervencí, které mohou vést k udržování zánětlivého stavu a zvýšení koncentrace prozánětlivých mediátorů, by měla představovat trvalou součást léčebné strategie kriticky nemocných.
- Diagnostika šokového stavu a syndrom tkáňové hypoperfuze
Časná diagnostika a včasná razantní léčba šokového stavu je zcela zásadní pro klinický výsledek pacienta. Fáze charakterizovaná tachykardií a hypotenzí je celkem snadná pro diagnostiku a terapii, nicméně z patofyziologického hlediska znamená již fázi tkáňové hypoperfuze při selhání výše uvedených kompenzačních mechanismů. Pozdní rozpoznání a oddálená léčba šokového stavu je spojena se zhoršením klinického výsledku. Klinický obraz se odvíjí od typu šoku, příčiny a případně kombinace šokových stavů. Šok hypovolemický, kardiogenní a obstrukční jsou dle svého klinického podobného obrazu nazývány jako šoky „studené“, naopak distribuční formy šoku ve své hyperdynamické fázi, kdy je převaha vazodilatačních látek, jako šoky „teplé“. V diagnostice šokového stavu se uplatňuje anamnéza, klinický obraz, fyzikální vyšetření, laboratorní a eventuálně zobrazovací techniky. Současně již od počátku je nutná agresivní terapie zaměřená na dosažení/udržení adekvátní tkáňové perfuze současně s léčbou základní příčiny stavu.
Klinický obraz
- Tachykardie (nemusí být vyjádřena u pacientů s dysfunkcí sympatiku – neurogenní šok, adrenální dysfunkce, léčba betablokátory).
- Hypotenze (pozdní známky, v počátečních stadiích nemusí být vyjádřena).
- Klinické známky tkáňové periferní hypoperfuze.
- Chladná bledá akra, nitkovitý pulz, pocení.
- Periferní cyanóza.
- Snížený kapilární návrat.
- Distributivní forma šoku hyperdynamická:
- teplá akra,
- cyanóza nemusí být vyjádřena.
- Oligurie.
- Tachypnoe.
- Zhoršení mentálního stavu (somnolence, nebo naopak agitace).
- Další příznaky podle příčiny šoku – například anémie (krvácení), febrilie (např. septický šok), masivní otoky (anafylaktický).
Diagnostika
- Anamnéza je zaměřena na zjištění příčiny šokového stavu (vnitřní krvácení, bolesti břicha, hrudníku, onemocnění v anamnéze – kardiální aj.).
- Klinický obraz.
- Fyzikální vyšetření.
- Laboratorní vyšetření:
- KO, koagulace, mineralogram, markery zánětu;
- parametry tkáňové perfuze (SvO2, laktát, acidobazická rovnováha);
- biochemické ukazatele orgánově specifické;
- EKG.
- Zobrazovací a jiné metody podle stavu pacienta (UZ břicha a hrudníku, cév dolních končetin, RTG, CT břicha, hrudníku aj.).
- Hypovolemický šok
Hypovolemický šok vzniká v důsledku ztráty intravaskulárního objemu. Nejčastějším typem hypovolemického šoku je šok hemoragický, který vzniká při traumatu, krvácení do GIT apod. Příčiny hypovolemického šoku jsou nejčastěji:
- krevní ztráty (hemoragický šok),
- zevní krvácení;
- vnitřní krvácení;
- trauma intrathorakální, intraabdominální, retroperitoneální, měkké tkáně;
- krvácení do GIT (peptický vřed, jícnové varixy, erozivní gastritida, nádory, arteriovenózní malformace, divertikulitida, ulcerózní kolitida, morbus Crohn, ischémie);
- retroperitoneální netraumatické (ruptura aneurysmatu aorty);
- ztráty plazmy (popáleniny),
- ztráty tekutin (masivní zvracení, průjmy, polyurie).
Stadia šoku (klinické příznaky)
- Iniciální – kompenzace (neuroendokrinní reakce, vazokonstrikce, tachykardie, není hypotenze, pokles SvO2).
- Dekompenzace – hypotenze, tachykardie, tachypnoe, oligurie, alterace vědomí.
- Ireverzibilní – pokles CO, nereagující hypotenze.
Klasifikaci krvácení ukazuje tabulka 3.
Tab. 3. Klasifikace krvácení podle klinických známek 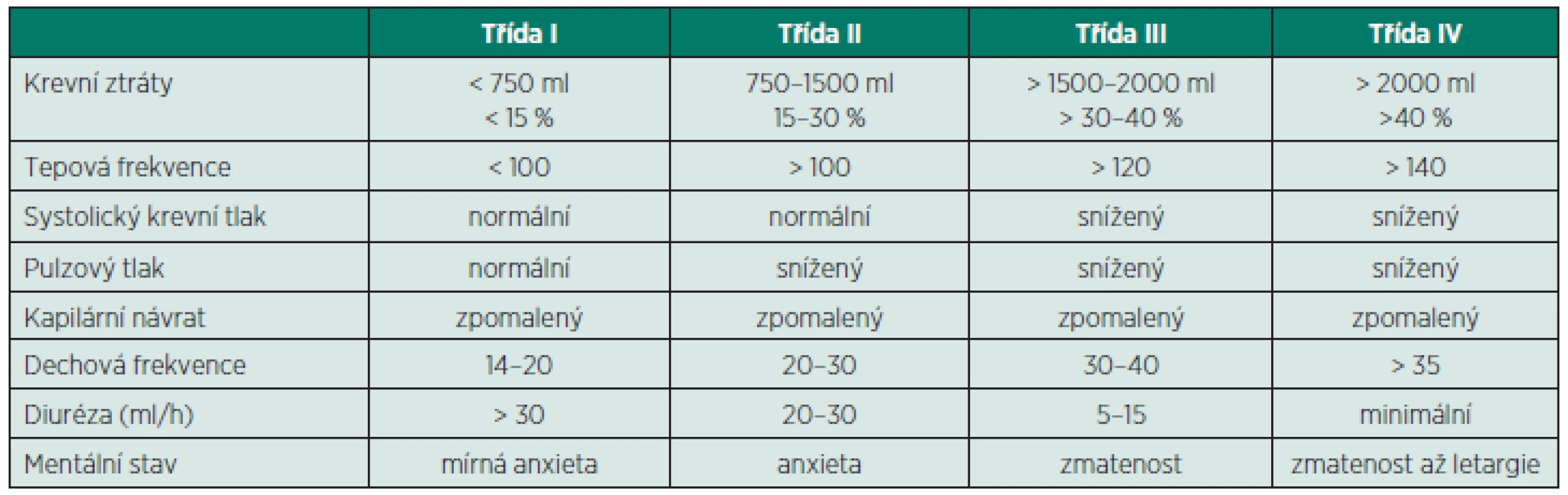
Odpověď organismu na krevní ztrátu
- Fáze I. – přesun tekutiny z intersticia do kapilár (transkapilární plnění).
- Fáze II. – aktivace systému renin-angiotenzin-aldosteron, retence Na a vody, zaplňuje deficit v intersticiu (cílem léčby u mírné ztráty je doplnění intersticiálního deficitu fyziologickým roztokem).
- Fáze III. – kostní dřeň produkuje erytrocyty.
- Léčba šoku
Obecné zásady léčby šoku
Rozpoznání/diagnostika šokového syndromu a určení jeho etiologie je klíčovým faktorem při formulaci léčebného plánu.
Cíle terapie šokového stavu jsou:
- léčba základní příčiny stavu
hemoragický šok – zástava krvácení, korekce koagulopatie;
septický šok – odstranění zdroje infekce, antibiotika;
obstrukční šok – drenáž tenzního pneumothoraxu, srdeční tamponády, trombolýza u masivní plicní embolie;
kardiogenní – reperfuze u akutního infarktu myokardu;
- zajištění dostatečné tkáňové perfuze;
- podpora orgánových funkcí.
U všech šokových syndromů je společná snaha o zachování tkáňové perfuze s optimalizací DO2 a VO2 pomocí volumoterapie a vazoaktivních látek. Snížení spotřeby kyslíku lze docílit kontrolou tělesné teploty (léčba febrilií), analgosedací a umělou plicní ventilací, případně hypotermií. Terapie a volba vazoaktivní látky se odvíjí od hemodynamického modelu šoku. U hypovolemického, obstrukčního a kardiogenního šoku je tkáňová hypoperfuze způsobena nedostatečným srdečním výdejem, u šoku distribučního se jedná o kombinaci snížené periferní cévní rezistence a maldistribuce krevního průtoku. Prvním krokem k terapii hypovolemického obstrukčního a distribučního šoku je tekutinová resuscitace, při neúspěchu tekutinové výzvy je indikováno nasazení vazoaktivních látek s pokračováním volumoterapie.
Cíle resuscitace
Primárním cílem terapie šokových stavů je obnovení a udržení tkáňové perfuze. Při časném rozpoznání šokového stavu a rychlé a adekvátní resuscitaci dochází k normalizaci systémových parametrů hemodynamiky a vitálních funkcí. Přes tyto nálezy může přetrvávat okultní hypoperfuze a trvající tkáňová acidóza ústící do rozvoje multior-gánového selhání. Tento stav bývá někdy nazýván “kompenzovaný šok”. Z toho důvodu se hledají nové tzv. end points, podle kterých by měla být terapie vedena, respektive ke kterým by měla být směrována.
Mezi systémové markery detekce tkáňové hypoperfuze patří laktát, pH, deficit bazí (BD), saturace smíšené žilní krve SvO2, které korelují s nepříznivým klinickým výsledkem pacientů.
Sledování a urgentní řešení známek tkáňové hypoperfuze je důležitou součástí péče o pacienty v šokovém stavu. Dosažení systémových parametrů hemodynamiky však nezaručuje adekvátní dodávky kyslíku do tkání na úrovni mikrocirkulace a buněčného metabolismu.
Jaký typ roztoku zvolit u jednotlivých šokových stavů je trvalým diskusním tématem a až na výjimky není dnes jednoznačné doporučení ohledně typu roztoku. Fyziologicky dochází k volnému přesunu vody mezi intravaskulárním a intersticiálním prostorem, na pohybu tekutiny se mimo jiné podílí především hydrostatické a koloidně-osmotické síly.
Typy roztoků
- Krystaloidní roztoky
- hypotonické (glukóza, poloviční fyziologický roztok),
- izotonické (fyziologický roztok, Ringerův roztok, balancované roztoky),
- hypertonické (hypertonický roztok NaCl).
- Koloidní roztoky
- albumin,
- cukry (dextran),
- syntetické škroby,
- želatina.
- Krevní náhrady
- erytrocyty
- koagulační faktory (čerstvá mražená plasma, koncentráty koagulačních faktorů),
- trombocyty.
Farmakoterapie
Udržení arteriálního perfuzního tlaku k zajištění dostatečné dodávky kyslíku a nutrientů buňkám je jedním z hlavních pilířů terapie všech šokových stavů bez ohledu na jejich etiologii. Udržení adekvátní náplně krevního řečiště lze dosáhnout tekutinovou náloží, v mnoha případech je však nutné i podávní vazopresorů k udržení perfuzního tlaku a snížení objemu tekutinové resuscitace. K hlavním látkám, kterými lze ovlivnit poměr mezi náplní a objemem krevního řečiště, patří vazopresory, inotropní a další vazoaktivní látky.
Vazoaktivní látky
Vazopresory jsou obvykle nasazeny po iniciálním bolusu tekutin, kdy nedochází k adekvátnímu zvýšení středního arteriálního tlaku (MAP). Vazopresory vedou zvýšením vazokonstrikce ke zvýšení MAP, pefuze tkání, redistribuci srdečního výdeje a při venokonstrikci ke snížení compliance venózní sítě se zvýšením efektivního krevního objemu. Nadměrná vazokonstrikce může vést k prohloubení hypoperfuze tkání, v klinické praxi je nutné vždy zachovávat rovnováhu mezi objemem a tlakem v kontextu typu a stadia šoku, časový faktor a s tím související pokročilost stavu je jedním z rozhodujících faktorů ovlivňujících efekt terapie. Časné rozpoznání šoku může při správném postupu s časnou volumoterapií předejít nutnosti nasazení katecholaminů. Vazoaktivní látky ovlivňují různé receptory a s tím souvisí i jejich efekt a použití v jednotlivých klinických situacích.
Noradrenalin
Noradrenalin je katecholamin, který je uvolňován na postgangliových adrenergních nervových zakončeních jako odpověď na stres. Jeho predilekční účinek cestou a-adrenergních receptorů (beta-stimulace je výrazně nižší) vede ke zvýšení systolického a diastolického tlaku při vazokonstrikci, současně snižuje venózní kapacitanci a vede ke zvýšení venózního návratu a plnícího tlaku. Zvýšení diastolického tlaku vede ke zvýšení koronárního perfuzního tlaku. Pozitivní chronotropní efekt je blokován cestou reflexů z baroreceptorů vyvolaných vazokonstrikcí, nicméně při vysokých dávkách dochází k viditelné tachykardii. Pozitivní inotropní efekt se zvýšením srdečního výdeje je limitován zvýšením afterloadu levé komory. Obavy z vystupňované vazokonstrikce a snížené perfuze renálním či splanchnickým řečištěm vedly ke snaze o limitaci jeho použití a doporučení maximálních dávek. Podle nových poznatků naopak noradrenalin může zlepšit renální funkce a je dnes lékem volby v podpoře oběhu u nemocných se septickým šokem. Menší randomizované studie srovnávající účinnost dopaminu a noradrenalinu prokázaly účinnější normalizaci hemodynamických parametrů a kyslíkového transportu při podávání noradrenalinu pacientům se septickým šokem. Recentní randomizovaná studie De Backera et al. neshledala rozdíl ve 28denní mortalitě mezi těmito katecholaminy u pacientů v šokových stavech; při subanalýze byly zjištěny překvapivé výsledky se zlepšením klinického výsledku pacientů v kardiogenním šoku léčených noradrenalinem. Na základě dostupných dat lze v této době doporučit podávání noradrenalinu jako katecholaminu první volby u nemocných v šokových stavech.
Adrenalin
Adrenalin je hlavním silně potentním endogenním katecholaminem produkovaným dření nadledvin. Adrenalin stimulací alfa1 receptorů vede k venózní a arteriální vazokonstrikci s negativním vlivem na regionální průtok, především v renální a mezenterické oblasti. Beta-efektem dochází ke zvýšení tepové frekvence a pozitivnímu inotropnímu účinku. Stimulací beta2 receptorů dochází ke kompenzaci vazokonstrikčního účinku a vliv adrenalinu na krevní tlak není tak velký jako u noradrenalinu. Účinnost adrenalinu je závislá na podané dávce, kdy v malých dávkách stimuluje preferenčně betareceptory (působí spíše jako inotropikum), ve vysokých dávkách převyšuje efekt vazokonstrikční. Adrenalin zvyšuje srdeční výdej a dodávku kyslíku tkáním, současně vede ke zvýšené spotřebě kyslíku, má silné tachykardizující a arytmogenní účinky. V současné době je adrenalin vzhledem ke svému efektu a vysokým rizikům určen k terapii anafylaktického šoku a k rozšířené kardiopulmonální resuscitaci. Nicméně adrenalin vede ke zvýšení krevního tlaku také u nemocných, kteří nereagují na tradiční vazopresory. U těchto nemocných v šokových stavech je některými autory doporučováno zvážit nasazení adrenalinu jako léku druhé volby.
Dopamin
Dopamin je prekurzorem noradrenalinu a adrenalinu, dříve býval katecholaminem volby téměř u všech šokových stavů, zvláště pak kardiogenního. Účinek dopaminu je závislý na dávce, kdy dávky nižší než 5 µg/kg/min aktivují dopaminergní receptory s vazodilatací v renálním a splanchnickém řečišti. Dávky 5–10 µg/kg/min aktivují především beta1 adrenergní receptory se zvýšením kontraktility myokardu a tepové frekvence, dávky nad 10 µg/kg/min přes alfa1 receptory vedou k vazokonstrikci. Předpoklad snížení výskytu renální insuficience a zlepšení klinického výsledku podáváním nízkých dávek dopaminu ovlivněním splanchnické cirkulace se nepotvrdil, naopak byl prokázán imunosupresivní efekt dopaminu (snížení prolaktinu, ovlivňování apoptózy lymfocytů). Kontroverzní výsledky studií sledující vliv dopaminu na přežití pacientů v šokových stavech a jeho výrazně tachykardizující a arytmogenní efekt oproti noradrenalinu spolu s imunosupresivními účinky jej prakticky eliminují z používání v intenzivní péči u kriticky nemocných.
Inotropika
Inotropní látky vedou ke zvýšení srdečního výdeje zvýšením kontraktility, nicméně v literatuře není dostatek dat, která by potvrdila pozitivní efekt ve snížení mortality. Inotropní látky by měly být použity co nekratší dobu, jejich prolognované podávání vede ke zvýšení myokardiální práce a ischémii. Vysoké dávky dobutaminu s cílem supranormální dodávky kyslíku tkáním zvýšením srdečního výdeje vedly ke zvýšení mortality a jen potvrzují rizikovost vysokých a dlouhodobě podávaných dávek inotropních látek.
Dobutamin
Dobutamin je syntetická adrenergní látka odvozená od dopaminu. Jedná se o racemickou směs, kde L-izomer stimuluje alfa1 a beta1 receptory, D-izomer stimuluje beta1 a beta2 receptory. Dobutamin působí pozitivně chronotropně a inotropně, a zvyšuje tak CO cestou přes beta2 receptory i vazodilatačně, kdy při jeho nasazení může dojít ke snížení krevního tlaku. U pacientů s kardiogenním šokem je dobutamin lékem volby, kdy může nekonstantně zvýšit krevní tlak u pacientů s hypotenzí. Dobutamin může vést ke zvýšení tepové frekvence a spotřebě kyslíku myokardem, a tak exacerbovat ischémii. Dobutamin je lékem volby u subpopulace pacientů v septickém šoku s nízkým srdečním výdejem za předpokladu adekvátního plnícího tlaku komor, kde kombinace dobutaminu s noradrenalinem může vést ke zvýšení CO a tkáňové perfuze.
Dopexamin
Dopexamin jako efektivní katecholamin působící cestou beta2 a dopaminergní receptory je u nás nedostupný. Vazodilatační a inotropní efekt vede ke zvýšení srdečního výdeje a v některých studiích byl účinnější oproti srovnání s dobutaminem.
Isoproterenol (isoprenalin)
Isoprenalin je látka s čistým betamimetickým účinkem vedoucí ke zvýšení tepového objemu, tepové frekvence a vazodilatace. Zvýšená spotřeba kyslíku myokardem při současném snížení koronárního perfuzního tlaku při poklesu diastolického tlaku v aortě může vést ke kardiální ischémii.
Inhibitory fosfodiesterázy
Inhibitory fosfodiesterázy III zvyšují intracelulární cyklický adenozinmonofosfát (cAMP) a potencují inotropní efekt nezávisle na beta adrenergním mechanismu, mají nižší chronotropní a arytmogenní efekt, zvýšení cAMP v hladké svalovině cév vede k vazodilataci s následnou hypotenzí. Milrinon je užíván k terapii akutního srdečního selhání, kde především u systolického selhání může vést ke zlepšení perfuze tkání. Studie OPTIME-CHF (Outcomes of a Prospective Trial of Intravenous Milrinone for Exacerbations of Chronic Heart Failure) srovnávala milrinon s digoxinem u nemocných bez známek tkáňové hypoperfuze. Výsledky neprokázaly přínos milrinonu ve sledovaných parametrech, naopak vyšší výskyt hypotenze a arytmií a zhoršený klinický výsledek pacientů s ischemickou kardiomyopatií. U nemocných s kardiogenním šokem je milrinon zvažován při absenci příznivé reakce na jiná inotropika vzhledem ke svému dlouhodobému účinku a riziku hypotenze. Milrinon je potentní vazodilatátor v plicním řečišti a z toho důvodu je preferován před dobutaminem u nemocných s dominantním pravostranným selháním. Milrinon jako syntetický inhibitor fosfodiesterázy III vede snížením tohoto enzymu ke zvýšení cyklického adenozinmonofosfátu (cAMP), modulátoru kontraktility myocytů. Ve vyšších dávkách vede k vazodilataci a tachykardii se zvýšením srdečního výdeje, snížením preloadu a afterloadu ke snížení práce myokardu. U pacientů s hypotenzí může vést k progresi oběhového selhání, v recentních studiích je srovnání.
Levosimendan
Levosimendan patří k nové třídě inotropních látek, jejichž primárním mechanismem je zvýšení citlivosti troponinu C na kalciové ionty intracelulárně bez vlivu na zvýšený tok kalcia do buněk, současně otevírá ATP-dependentní kaliové kanály, vede tak k inotropnímu a současně vazodilatačnímu účinku. Levosimendan jako jediná inotropní látka vede ke zvýšení srdečního výdeje bez zvýšení spotřeby kyslíku myokardem, není popsán proarytmogenní efekt. Levosimendan je široce studován a podáván u nemocných s akutním srdečním selháním, jeho příznivý hemodynamický efekt srovnatelný s dobutaminem byl pozorován u nemocných s kardiogenním šokem po akutním infarktu myokardu. U nemocných v septickém šoku se sepsí indukovanou myokardiální depresí bylo u pacientů s levosimendanem oproti skupině s dobutaminem pozorováno zlepšení ejekční frakce, tepového objemu, srdečního indexu, diurézy a perfuze splanchniku, v jiné studii levosimendan zlepšil funkci pravé komory a SvO2. Vzhledem k absenci dat z velkých randomizovaných studií dosud není levosimendan doporučen do širokého rutinního klinického použití.
Vazopresin
Vazopresin je peptidový hormon syntetizovaný v hypotalamu, který je následně transportován a ukládán v hypofýze. Je secernován jako odpověď na pokles krevního objemu a zvýšení plazmatické osmolarity, vazopresin cestou V1 receptorů vede ke konstrikci cévní svaloviny a současně zvyšuje citlivost cév na katecholaminy, inhibuje produkci oxidu dusnatého jako hlavní vazodilatační látky a inhibuje K1-ATP kanál. Vazopresin udržuje systémový krevní tlak v průběhu hypovolémie a reparuje dysfunkční hemodynamické mechanismy, nicméně u septického šoku jsou narozdíl od šoku hemoragického jeho hladiny v počátečních hodinách vyšší, následuje pokles a známky relativního nedostatku vazopresinu u nemocných v septickém šoku. Podání nízkých dávek vazopresinu (0,01–0,04 U/min) současně s katecholaminy u nemocných s refrakterním septickým šokem vedlo ke zvýšení krevního tlaku a snížení dávek katecholaminů. Podobné výsledky byly zjištěny u syntetického analogu terlipresinu, nicméně vysoké dávky vazopresinu u nemocných v septickém šoku mohou snížit perfuzi splanchniku a vést k nežádoucí redistribuci krevního průtoku. Multicentrická klinická studie (Vasopressin and Septic Shock Trial, VASST) zahrnující pacienty se septickým šokem srovnávala skupinu pacientů léčených noradrenalinem v dávce 15 µg/min se skupinou léčenou vazopresinem v konstantní dávce 0,03 U/min, krevní tlak byl udržován infuzí vazopresoru. Vazopresin v nízké dávce v kombinaci s noradrenalinem se zdá být bezpečný a efektivní u nemocných v septickém šoku, zvláště u nemocných s nižšími dávkami noradrenalinu (do 15 µg/min) než u nemocných s vysokými dávkami noradrenalinu. Vazopresin by měl být zvážen jako hormonální substituce při relativní insuficienci, nikoliv jako vazopresor, užívané dávky by neměly překročit nízké dávkování užívané ve studiích.
Syndrom hypotenze
Hypotenze je častým symptomem na standardních odděleních, urgentních příjmech, operačních sálech a odděleních intenzivní péče, jehož příčiny jsou zcela různorodé. Včasná diagnostika, určení příčiny a správně vedená léčba je předpokladem prevence tkáňové hypoperfuze. Hypotenzi nelze zaměňovat za šokový stav, v některých situacích probíhá šok bez hypotenze a naopak hypotenze nemusí být vždy spojena s nedostatečnou tkáňovou perfuzí. V klinické praxi je nutné vždy zvážit individuální situaci, kdy absolutní hodnota krevního tlaku nevypovídá o stavu orgánové perfuze. Pokles krevního tlaku o 40–50 mm Hg oproti výchozí hodnotě, pokles systolického krevního tlaku pod 90 mm Hg nebo středního krevního tlaku pod 60 mm Hg jsou nejčastěji uváděny jako hodnoty pro definici hypotenze, v individuálních situacích ale tyto hodnoty neplatí, uplatňuje se vliv věku, farmakoterapie a dalších faktorů. U kriticky nemocných pacientů je hypotenze často spojena se snížením dodávky kyslíku tkáním s následnou nedostatečnou tvorbou adenozintrifosfátu. Etiologie hypotenze je často multifaktoriální (např. těžké krvácení vede k ischémii myokardu, jehož selhání potencuje kritický stav) a při stanovení terapeutického postupu je nutné rozpoznat a léčit příčinu stavu. Hypotenze vzniká v důsledku nízkého srdečního výdeje a/nebo nízké periferní cévní rezistence (MAP = CO x SVR); nízký srdeční výdej je spojen s nedostatečnou dodávkou kyslíku tkáním (DO2 = CO x CaO2). Spotřeba kyslíku tkáněmi je udržována přes snížení DO2 zvýšenou extrakcí kyslíku do určitého bodu (kritický práh DO2), při dalším snižování dodávky kyslíku dochází již ke snížení spotřeby, nedostatečné tvorbě energie aerobní cestou, nadprodukcí laktátu se všemi důsledky. Laboratorní odezvou nedostatečné dodávky kyslíku tkáním je snížení hodnoty saturace centrální (ScvO2) nebo smíšené žilní krve (SvO2), hodnota ScvO2 je zpravidla nižší z důvodu zvýšené extrakce kyslíku tkáněmi horní poloviny těla. Stavy s nízkou cévní rezistencí jsou spojeny se zhoršenou extrakcí a utilizací kyslíku při současné poruše mitochondriálních funkcí. Podrobně je o kyslíkovém metabolismu pojednáno v oddíle patofyziologie šokových stavů.
Příčiny hypotenze
- Snížení plnění myokardu krví (hypovolémie, obstrukce krevního průtoku):
- krvácení,
- ztráty do třetího prostoru,
- ztráty gastrointestinálním traktem (průjmy, zvracení...),
- transdermální ztráty (popáleniny, hyperpyrexie),
- polyurie (diabetes insipidus, diuretika),
- nedostatečný příjem tekutin,
- vazodilatancia (nitráty, sedativa),
- arytmie,
- obstrukce krevního průtoku (plicní embolizace, tenzní pneumothorax, tamponáda srdeční, plicní hyperinflace).
- Snížení kontraktility myokardu (kardiogenní šok):
- ischémie, infarkt, omráčení myokardu;
- myokarditida, kardiomyopatie;
- systémový zánět – sepse, anafylaxe, stav po kardiochirurgické operaci;
- léky – betablokátory, blokátory kalciových kanálů;
- kontuze myokardu.
- Snížení periferní cévní rezistence (vazodilatace):
- systémový zánět – sepse, anafylaxe, stav po kardiochirurgické operaci;
- farmaka (ACE-inhibitory, nitráty, blokátory kalciových kanálů, sedativa);
- endokrinní onemocnění – nadledvinová insuficience, feochromocytom;
- ztráta aktivace periferního sympatiku – míšní trauma, epidurální anestezie.
U nemocného s hypotenzí je nutné odpovědět na dvě základní otázky:
- Jedná se o syndrom nízkého srdečního výdeje?
- Je syndrom nízkého srdečního výdeje dependentní na preloadu?
Kardiogenní, obstruktivní a hypovolemická příčina hypotenze je zpravidla spojená s nízkým srdečním výdejem, cirkulace pacientů s hypotenzí z důvodu sepse, anafylaxe nebo neurogenní příčina je zpravidla hyperdynamická. V případě těžké myokardiální deprese, extrémních ztrát při zvýšené kapilární permeabilitě a vazodilataci může stav probíhat pod obrazem nízkého srdečního výdeje, a maskovat tak skutečnou příčinu. Terapie hypotenze musí být zahájena neodkladně s cílem zlepšení orgánové perfuze a eliminace příčiny.
Speciální problematika léčby hypovolemického šoku
Základní terapeutickým přístupem je kontrola krvácení, udržení krevního perfuzního tlaku se zlepšením dodávky kyslíku tkáním a udržením adekvátního poměru mezi dodávkou a spotřebou kyslíku. Poloha pacienta vleže, případně s elevovanými dolními končetinami s cílem zvýšení venózního návratu a udržení perfuze životně důležitými orgány. Nebyl prokázán příznivý vliv Trendelenburgovy polohy na redistribuci perfuze, dochází pouze ke zhoršení výměny krevních plynů a srdeční funkce. Z těchto důvodu již nadále není u pacientů s hemoragickým šokem doporučována, dostatečná se jeví poloha vleže na zádech s elevovanými končetinami. Dříve používané pneumatické protišokové kalhoty vedly ke zvýšení mortality u nemocných s poraněním hrudníku a dnes jsou doporučeny pouze jako pomůcka ke stabilizaci pánve.
Základní kroky k zajištění adekvátní cirkulace:
- zajištění cévního vstupu k podávání tekutinové náhrady, krevních derivátů a léků;
- kontrola zdroje krvácení;
- iniciální resuscitace oběhu a odhad rozsahu krevních ztrát.
Normální krevní objem lze odhadnout v závislosti na pohlaví a tělesné hmotnosti pacienta:
- muži – 70 ml/kg nebo 3,2 ml/m2
- ženy – 60 ml/kg nebo 2,9 ml/m2
3. Související problematika/témata a příklady doplňujících otázek ze strany zkušební komise
- Determinanty dodávky kyslíku do tkání
- Současný pohled na koloidy typu HES
- Léčba hypotenze
- Refrakterní šok a jeho příčiny
- Transfuze a komplikace s ní související
- Multiorgánové selhání
- Podpora orgánových funkcí v šoku
- Princip „damage control surgery“
- Tekutinová resuscitace a její cíle
- Infuzní a transfuzní terapie
- Tekutinová výzva
- Léčba život ohrožujícího krvácení
Adresa pro korespondenci:
MUDr. Renata Černá Pařízková, Ph.D.
Fakultní nemocnice Hradec Králové
Klinika anesteziologie, resuscitace a intenzivní medicíny
Sokolská tř. 581
500 05 Hradec Králové
e-mail: parizkova@lfhk.cuni.cz
Prof. MUDr. Vladimír Černý, Ph.D., FCCM
Fakultní nemocnice Hradec Králové
Klinika anesteziologie, resuscitacea intenzivní medicínySokolská tř. 581
500 05 Hradec Králové
Dalhousie University, Dept. of Anesthesia,
Pain Management and Perioperative Medicine,
Halifax, Nova Scotia, Canada
e-mail: cernyvla1960@gmail.com
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek Zprávy ČSARIMČlánek Doporučení a stanoviska ČSIM
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2014 Číslo 1- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Léčba akutní pooperační bolesti z pohledu ortopeda
-
Všechny články tohoto čísla
- Souběžně probíhající neodkladný a akutní císařský řez – kazuistika*
- Myasthenia gravis a anestezie – nový bezpečnější postup
- Zaměřeno na prerenální akutní poškození ledvin – nastal čas přepsat učebnice?
-
Current Practice in Obstetric Anaesthesia.
Part III. Regional anaesthesia for caesarean section - Ultrazvukové vyšetření hrudníku v intenzivní medicíně
- Komplikace perkutánní biopsie plic pod CT kontrolou
- Hypovolemický šok
- Porodnická analgezie, aneb historie kontroverzí…
- Je vhodnější v rámci reverze nervosvalové blokády podat vagolytikum před neostigminem, nebo lze podávat obě látky současně?
-
Practice guidelines for management of the Difficult Airway
An updated Report by the American Societyof Anesthesiologists Task Forceon Management of the Difficult Airway - XV. kardioanesteziologické vědecké dny s mezinárodní účastí
-
Karl Koller, objevitel lokálně anestetického účinku kokainu,se narodil v Sušici!
Krátká historie lokálních anestetik - Zprávy ČSARIM
- Doporučení a stanoviska ČSIM
- Srovnání opioidní a neopioidní analgezie po císařském řezu v celkové anestezii – prospektivní observační studie
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Ultrazvukové vyšetření hrudníku v intenzivní medicíně
- Hypovolemický šok
- Myasthenia gravis a anestezie – nový bezpečnější postup
-
Current Practice in Obstetric Anaesthesia.
Part III. Regional anaesthesia for caesarean section
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



