-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Orální analgosedace mentálně postižených pacientů – předběžné výsledky
Oral analgesic sedation of mentally handicapped patients – preliminary results
Objective:
Patients who are uncooperative because of mental retardation present a challenge for the medical personnel. Intravenous or intramuscular administration of drugs is often difficult without restraint so the oral route seems to be the best option. The aim was to develop oral premedication for handling uncooperative adult patients in a dental care model.Design:
Prospective randomised single blinded clinical study.Setting:
A stomatology department of a research institute.Material and methods:
After ethics committee approval and trustees’ consent, a flavoured drink with midazolam 0.3 mg . kg-1 + clonidine 2 µg . kg-1 + ketamine 5 mg . kg-1 (Group Clo) or midazolam 0.3 mg . kg-1 + ketamine 5 mg . kg-1 (Group K) was offered to mentally handicapped patients scheduled for dental examination. The measured parameters included the onset of sedation enabling positioning the patient in the dental chair and securing venous access, vital signs (non-invasive blood pressure, pulse, SpO2) and psychomotor recovery. All monitoring was non-invasive.Results:
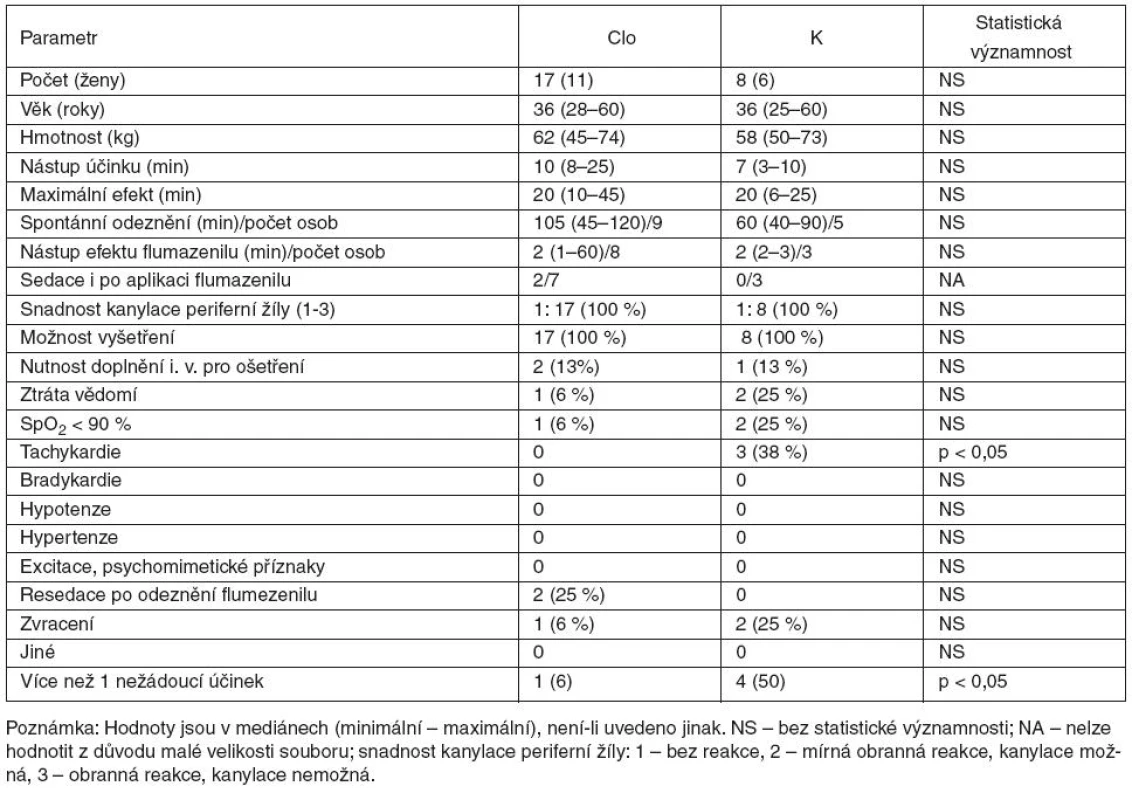
So far 17 patients in the Clo group and 8 patients in the K group have been included in the study. There were no differences in the demography and duration of treatment. All patients accepted the drink. Median time of the first signs of sedation was 10 minutes in the Clo group and 7 minutes in the K group, median onset time of full effect was 20 min in both groups. The level of sedation enabled stress-free peripheral vein cannulation in all patients and in 18 of 20 patients also dental treatment under local anaesthesia. Fractional administration of etomidate or propofol and/or ketamine was necessary in 2 patients. There was one case of deep sedation resulting in transitory loss of airway patency in each group and 3 cases of tachycardia in the K group vs. none in the Clo group (p < 0.05). Spontaneous recovery occurred at 105 min. in the Clo group and at 60 min. in the K group (median). Flumazenil IV was used in the remaining 8 patients in the Clo group and 3 in the K group. The onset of flumazenil effect was 1–2 min. There were 2 cases of resedation after flumazenil in the Clo group vs. 0 in the K group.Conclusion:
Preliminary results indicate that oral premedication with clonidine, ketamine and midazolam combination produces good quality sedation and better cardiovascular stability compared to sedation without clonidine.Keywords:
mental incapacity – oral premedication – analgesic sedation – ketamine – midazolam – clonidine – stomatology
Autoři: Málek Jiří 1; Hess Ladislav 2; Ščigel Vladimír 3; Fuksa Martin 4; Kurzová Alice 1
Působiště autorů: Klinika anesteziologie a resuscitace 3. LF UK a FNKV Praha 1; Experimentální pracoviště IKEM Praha 2; Stomatologické pracoviště pro rizikové pacienty IKEM Praha 3; Klinika transplantační anesteziologie a intenzivní medicíny IKEM Praha 4
Vyšlo v časopise: Anest. intenziv. Med., 22, 2011, č. 4, s. 209-214
Kategorie: Anesteziologie - Původní práce
Souhrn
Cíl studie:
Mentálně retardovaní pacienti představují pro analgosedaci problém. Parenterální podání bývá obtížné, proto jsme se zaměřili na vývoj orální premedikace.Typ studie:
Prospektivní zaslepená randomizovaná studie.Typ pracoviště:
Stomatologické pracoviště výzkumného ústavu.Materiál a metoda:
Po souhlasu etické komise a zákonných zástupců byl podán mentálně handicapovaným pacientům indikovaným ke stomatologickému vyšetření ochucený nápoj obsahující midazolam 0,3 mg . kg-1, + klonidin 2 µg . kg-1 + ketamin 5 mg . kg-1 (skupina Clo), nebo midazolam 0,3 mg . kg-1 + ketamin 5 mg . kg-1 (skupina K). Měřili jsme nástup a kvalitu sedace, vitální parametry a rychlost zotavení.Výsledky:
Dosud bylo zařazeno 17 pacientů v Clo a 8 v K. Medián nástupu prvních známek sedace byl u Clo 10 minut a u K 7 minut, nástup plného účinku byl 20 minut u obou skupin. U všech osob bylo možné bez potíží kanylovat žílu a u 18 z 20 rovněž ošetřit chrup v místní anestezii. U 2 bylo nutné podat frakcionovaně propofol nebo etomidat. V každé skupině se vyskytla 1krát hluboká sedace s přechodnou ztrátou průchodnosti dýchacích cest a 3krát tachykardie v K vs 0 v Clo (p < 0,05). Spontánní zotavení trvalo 105 minut v Clo a 60 minut v K (medián). U 8 pacientů v Clo a 3 v K byl podán flumazenil i. v. Nástup účinku byl 1–2 minuty, ale u 2 osob v Clo vs 0 v K došlo k resedaci.Závěr:
Podle předběžných výsledků orální premedikace s klonidinem, ketaminem a midazolamem poskytuje kvalitní analgosedaci a ve srovnání s kombinací bez klonidinu lepší kardiovaskulární stabilitu.Klíčová slova:
mentální handicap – orální premedikace – analgosedace – midazolam – ketamin – klonidin – stomatologieÚvod
Zdravotní péče o mentálně handicapované osoby, zvláště při vyšším stupni mentálního postižení, představuje často obtížný problém. Jde často o dospělé lidi, kteří nejsou schopni ovládat své chování a současně jsou dostatečně fyzicky disponováni k tomu, aby jakýmkoliv pokusům o své omezení úspěšně odolali, a proto je nutno i k pouhému vyšetření použít hlubokou analgosedaci nebo celkovou anestezii. Anesteziolog je tak čas od času konfrontován s pacienty, kteří se intenzivně brání intravenóznímu nebo inhalačnímu úvodu do anestezie. Také případná intramuskulární aplikace je spojena často s významnými obtížemi. Je proto výhodné používat neinvazivní způsoby podání analgetik a sedativ [1–6]. Jako nejsnadnější se zdá perorální aplikace tekutiny s anestetiky po dostatečně dlouhém žíznění a hladovění [7]. Tekutina s anestetiky je zpravidla dobře akceptována, zvláště od osoby, ke které má mentálně postižená osoba důvěru. Ideální je tekutina s vysokou koncentrací účinného farmaka v malém objemu, která je chuťově neutrální. Účinek musí být rychlý a jistý a dobře řiditelný, protože pacienti přicházejí většinou jako ambulantní.
K navození sedace jsou k dispozici především benzodiazepiny (hlavně ve vodě rozpustný midazolam), ketamin, a částečně i alfa2 agonisté (klonidin, dexmedetomidin).
Benzodiazepiny jsou receptorově specifická farmaka, která se váží na specifická benzodiazepinová vazebná místa GABA receptorů. V závislosti na dávce mají anxiolytický, amnestický, sedativní a ve vyšších dávkách i hypnotický účinek [8]. Ovlivnění kardiorespiračního systému je při klinickém dávkování nevýznamné [9]. Nebolestivý způsob aplikace – orální, nosní nebo rektální je běžně používán u dětí.
Ketamin patří mezi disociativní anestetika. Jeho farmakologické účinky jsou zcela unikátní. V závislosti na dávce působí sedaci, analgezii, katalepsii a ve vyšších dávkách má anestetický účinek. Ovlivnění kardiorespiračních funkcí je malé. I u ketaminu můžeme použít různé způsoby aplikace, včetně netradičních – orální, bukální nebo nazální [10].
Alfa2 agonisté jsou v humánní anesteziologii reprezentovány především parciálním agonistou klonidinem a vysoce specifickým alfa2 agonistou dexmedetomidinem. Klonidin v dávce 2–5 µg . kg-1 per os nebo per rektum je používán k sedaci malých dětí [11].
Uvedená farmaka se používají především k orální premedikaci malých dětí, údaje o použití v dospělé populaci jsou ojedinělé. Cílem naší práce bylo testovat tato farmaka při perorální aplikaci u neošetřitelných dospělých pacientů. Jako model vyšetření a ošetření byla zvolena stomatologická péče, kde ošetření představuje poměrně uniformní stimulaci. Navíc je známo, že stav chrupu u mentálně handicapovaných je velmi špatný, takže studie měla pro účastníky i praktický přínos. Jako základní kombinaci jsme vybrali midazolam--klonidin-ketamin, kterou jsme srovnávali s kombinací midazolam-ketamin. Naše hypotéza byla taková, že přidání klonidinu povede k rychlejšímu nástupu účinku, hlubší sedaci i u agresivních pacientů, k vyrovnaným hemodynamickým parametrům a k přetrvávání sedativního účinku do pooperačního období. Zajímala nás především rychlost nástupu účinku a stupeň sedace umožňující manipulaci s pacientem a intravenózní aplikaci. Hodnotili jsme základní kardiorespirační profil a rychlost psychomotorického zotavení. Všechny monitorovací testy byly neinvazivní.
Soubor pacientů a metoda
Protokol studie byl schválen etickou komisí 3. lékařské fakulty Univerzity Karlovy v Praze, etickou komisí Institutu klinické a experimentální medicíny Praha a Státním ústavem pro kontrolu léčiv. Studie byla koncipována jako dvojitě zaslepená a prospektivní. Do souboru byly zařazeny po souhlasu zákonných zástupců dospělé osoby obojího pohlaví s různým stupněm psychomotorické retardace, umístěné v ústavu sociální péče. Stupeň mentálního postižení byl diagnostikován odbornými lékaři před jejich umístěním do sociálního ústavu. Někteří z nich byli agresivní již při pokusu přiblížení se k nim a důvěřovali pouze doprovázející osobě. Byly vybrány osoby indikované k vyšetření a případnému ošetření chrupu, u kterých bylo z anamnézy známo, že pokusy o předchozí vyšetření byly neúspěšné a vyšetření vždy vyžadovalo celkovou anestezii. Vylučovací kritéria zařazení do studie byla známá alergie na použité látky a vehikulum (certifikovaný med) a závažné onemocnění kardiorespiračního systému, jater a ledvin (klasifikace ASA 4 a více). Všechny osoby ženského pohlaví ve fertilním věku dostávají v ústavu sociální péče, kde jsou hospitalizovány, antikoncepci, takže je vyloučena možnost těhotenství.
Příprava před plánovaným ošetřením/vyšetřením byla standardní jako před celkovou anestezií. Pacienti před orální aplikací lačnili 8 hodin, aby se usnadnila akceptace příjmu orální premedikace. Medikace psychofarmaky byla ponechána i v den ošetření ráno. Z ústavu sociální péče byli účastníci studie přivezeni vždy po dvou v doprovodu 1 zdravotní sestry a 1 ošetřovatelky. Studie probíhá v plně vybavené stomatologické ambulanci s anesteziologickým přístrojem, vybavením a kompletním monitorováním.
V den příjezdu proběhla randomizace generátorem náhodných čísel a zařazení obou osob do jedné ze 2 skupin: skupina Clo dostala premedikaci sestávající z kombinace klonidinu 2 μg . kg-1 + midazolamu 0,3 mg . kg-1 + ketaminu 5,0 mg . kg-1, kontrolní skupina K pouze midazolam 0,3 mg . kg-1 + ketamin 5,0 mg . kg-1. Randomizaci a přípravu orální medikace prováděl lékař, který se neúčastnil dalšího hodnocení kvality analgosedace a vedlejších účinků. Součástí protokolu bylo zaznamenání průběhu sedace na video.
V obou případech byla farmaka smíchána s 5 ml certifikovaného medu (certifikát Výzkumného ústavu včelařského, s. r.,o., Dol) a celkový objem medikace byl upraven pitnou vodou tak, aby byl 20 ml pro minimalizaci rizika aspirace. Každý pacient dostal výsledný nápoj s obsahem farmak k vypití zdravotníkem, který ho doprovázel a ke kterému měl důvěru.
Základní měření (puls – P, krevní tlak – TK, saturace hemoglobinu kyslíkem – SpO2) byla provedena, jakmile to stav sledované osoby umožnil, tj. v menšině případů ještě před aplikací premedikace, u ostatních až po nástupu sedace a imobilizace. Po ztrátě obranných projevů a/nebo vymizení agresivity byla sledovaná osoba dopravena na stomatologické křeslo a provedena kanylace periferní žíly. V případě, že by po 30 minutách nebyla dosažena dostatečná sedace umožňující manipulaci pacientem a kanylaci žíly, přidala by se sledovaná farmaka v poloviční dávce. Následovalo stomatologické vyšetření a v případě potřeby další výkony: odstranění zubního kamene ultrazvukem, extrakce nebo ošetření kariézního zubu v místní anestezii. Při nedostatečné hloubce sedace pro provedení výkonu by se podal propofol 0,25 mg . kg-1 i. v., nebo etomidát v dávce 0,05 mg . kg-1 i. v. Po ukončení práce stomatologa byli pacienti umístěni na lehátka v dospávacím pokoji k dalšímu sledování a monitorování. Část osob byla ponechána ke spontánnímu zotavení, části byl podán i. v. flumazenil. Po odeznění účinku farmak na stupeň, který odpovídal stavu před aplikací premedikace, popř. pouze zcela mírné reziduální sedaci, nejdříve však po 2 hodinách, byli pacienti v doprovodu převezeni zpět do ústavu sociální péče. Anesteziologický tým byl k dispozici po dobu 24 hodin od aplikace farmak, druhý den odpoledne byl telefonicky učiněn dotaz o dalším průběhu zotavování v ústavu sociální péče.
Hodnocené parametry
Kromě základních kardiorespiračních parametrů (viz výše) byl hodnocen:
- začátek účinku orální premedikace,
- interval do plného efektu premedikace,
- snadnost kanylace periferní žíly (1 – bez reakce, 2 – mírná obranná reakce, kanylace možná, 3 – obranná reakce, kanylace nemožná),
- možnost vyšetření chrupu (ano-ne),
- možnost ošetření chrupu (ano-ne),
- doba do spontánního zotavení, respektive efekt podání flumazenilu,
- přítomnost nežádoucích účinků:
- bradykardie/tachykardie – snížení/zvýšení tepové frekvence o 30 % oproti výchozím hodnotám;
- hypotenze/hypertenze – snížení/zvýšení krevního tlaku o 30 % oproti výchozím hodnotám;
- bezvědomí;
- poruchy průchodnosti dýchacích cest – nutnost předsunutí spodní čelisti nebo použití pomůcek,
- desaturace – pokles SpO2 pod 90 %
- agitovanost, psychomimetické účinky, agrese;
- jiné.
Statistické zpracování
Výsledky byly hodnoceny chí-kvadrát testem a Fisherovým exaktním testem s Yatesovou korekcí. Hodnota p < 0,05 byla považována za statisticky významnou.
Výsledky
Do konce roku 2010 bylo do studie zařazeno celkem 31 pacientů. V rámci průběžného hodnocení byla studie po 25. pacientovi odslepena a provedeno statistické zhodnocení prvních 25 pacientů. Výsledky jsou uvedeny v tabulce 1. Žádné další nežádoucí účinky kromě těch uvedených v tabulce se nevyskytly.
Diskuse
Sedace osob s mentálním postižením se liší od analgosedace u běžné populace. Zde nejčastěji používáme intravenózní analgosedaci při vědomí, jejíž hloubku můžeme cíleně titrovat. Cílem je poskytnout pacientovi anxiolýzu, mírnou sedaci a jistý stupeň komfortu, zachovat základní spolupráci a reakci na oslovení. U pacientů s mentálním handicapem je primárně obtížné určit správný stupeň sedace, protože udržování verbálního kontaktu u mnoha z nich díky postižení nemá smysl, respektive neposkytuje žádné vodítko a ze stejného důvodu nelze očekávat spolupráci. Optimálním cílem bylo dosáhnout toho, aby pacient bez odporu zaujal polohu ve stomatologickém křesle, nechal si zavést periferní žilní kanylu a strpěl manipulaci v ústech.
Předběžné výsledky potvrdily, že jak dvojkombinace, tak i trojkombinace jsou v tomto ohledu účinné. Na výsledném účinku se podílejí v různé míře všechny tři složky.
Ketamin patří mezi disociativní anestetika. Jeho farmakologické účinky jsou zcela unikátní. V závislosti na dávce působí sedaci, analgezii, katalepsii a ve vyšších dávkách má anestetický účinek. I vysoké dávky ketaminu per os (8–12 mg . kg-1) jsou dobře tolerovány. Orální podání vede k vysokému first pass efektu, takže biologická dostupnost orálně podaného ketaminu je pouze 16%. Při perorální aplikaci se však uplatní i účinek jeho hlavního metabolitu norketaminu, který má 2/3 účinnosti mateřské látky. Orální aplikace ketaminu se dočkala v současné době renesance při léčení chronické bolesti a při oddálení vzniku závislosti na opioidech. U dětí se používá také nazální a bukální aplikace. U extrémně nespolupracujících dětí se používá kombinace midazolamu v dávce 0,5 mg . kg-1 spolu s ketaminem v dávce 3 mg . kg-1 per os [12].
Orální dávka ketaminu je v anglo-americké literatuře jednotně uváděna jako 5–14 mg . kg-1. Zpravidla za 30–40 minut od aplikace dochází ke zklidnění pacienta, které umožňuje inhalační úvod do anestezie. Farmakokinetická vyšetření ukázala, že biologická dostupnost orálně aplikovaného ketaminu je přibližně 20%, s maximální plazmatickou koncentrací přibližně po 30 minutách. Lag time (čas k prvnímu výskytu účinku) je po perorálním podání 8 minut [13]. Při punkci žíly je příznivý i analgetický účinek ketaminu, který je patrný již po dávce 0,5 mg . kg-1 per os. Na účincích se podílí i jeho metabolit norketamin, který má 2/3 účinnosti mateřské látky. Biologická dostupnost se proto zvyšuje až na 59 ± 16 % [14].
Ketamin je hořký, a proto jeho chuť musí být korigována. Ke korekci jsme použili med. Je to koloid s micelární strukturou, který je hustý a viskózní. Tyto vlastnosti se patrně podílejí na transbukálním příjmu aplikovaných anestetik. Opakovaně jsme pozorovali, že se mentálně postižení pacienti olizovali, a tím si rozprostírali med s anestetikem na sliznici dutiny ústní. Tomu nasvědčoval i rychlý nástup účinku orální kombinace, v jednom případě již za 3 minuty od aplikace, v dalších několika případech do 10 minut od aplikace. Biologická dostupnost sublinguálně aplikovaného ketaminu je 54 ± 17 % [14].
Druhou komponentou je midazolam. Základní dávkování midazolamu per os u dětí je 0,5–1 mg . kg-1. Midazolam má hořkou chuť, proto je opět nutná korekce sladkým sirupem. Biologická dostupnost orálního midazolamu je okolo 50 %. Na zvýšení biologické dostupnosti se však podílí při perorální aplikaci i jeho aktivní metabolit hydroxymidazolam. Klinicky pozorovatelné sedativní účinky pozorujeme za 5–10 minut po aplikaci, vrchol účinku je dosažen za 20–30 minut. Projeví se změnou nálady směrem k euforii a ataxii [8]. Také sublinguální podání midazolamu má vysokou biologickou dostupnost – 74,5 % [15].
Hlavním metabolitem midazolamu je 1-hydroxymidazolam, který se také podílí na sedativních účincích tohoto benzodiazepinu. Marshall et al. [16] dokonce uvádějí, že midazolam společně se svým metabolitem hydroxymidazolamem mají lepší neurofarmakodynamické účinky než podání jednotlivých komponent. U dětí se k zesílení sedativního účinku podává kombinace midazolamu s hydroxyzinem [17]. Transbukální nebo nazální aplikace se může také uplatnit u větších dětí nebo alespoň u částečně spolupracujících dospělých pacientů. Jeho biologická dostupnost po orální aplikaci je asi 50% a po sublinguální 74,5% [15]. Na jeho účincích se podílí i hlavní metabolit alfa hydroxymidazolam, proto je při stejné plazmatické koncentraci midazolamu, jako při intravenózní aplikaci, jeho farmakologický účinek větší [18].
Třetí komponentou je klonidin. Jeho biologická dostupnost po perorální aplikaci se pohybuje mezi 75–100 % [11]. Je velmi dobře a rychle absorbován a počáteční lag time je 19–22 minut. Maximální plazmatická hladina je dosažena mezi 2,4–2,9 hodiny. Biologický poločas se pohybuje mezi 9–15 hodinami. V závislosti na dávce dochází k anxiolýze a sedaci. Centrální sympatolytický účinek vede k poklesu krevního tlaku, srdeční frekvence a k vegetativní stabilizaci. Kromě toho mají alfa2 agonisté také analgetické účinky. Tlumí psychomimetické účinky způsobené ketaminem [19]. Klonidin se velice potencuje s midazolamem v oblasti hypnotického účinku. Podání alfa2 agonistů v premedikaci zajistí klidnou indukci anestezie (snížení oběhové reakce při intubaci, redukce dávky anestetik, v průběhu výkonu kardiovaskulární stabilita, antiischemický účinek) i v pooperační době (analgetický účinek – redukce spotřeby analgetik, antitřesový účinek).
Kardiorespirační parametry byly účinkem perorálně aplikovaných farmak ovlivněny pouze klinicky nevýznamně. Ketamin po perorální aplikaci nevede k podstatnému zvýšení krevního tlaku ani srdeční frekvence. Stejně tak se výrazně neprojevil ani případný hypotenzní účinek klonidinu. Také dýchání nebylo klinicky významně ovlivněno. Stabilní kardiorespirační poměry jsou velkou výhodou u této dvoj - nebo trojkombinace.
V případech nedostatečné klinické sedace pro ošetření lze po zajištění žíly aplikovat intravenózně velmi nízké dávky hypnotik, zejména propofolu nebo etomidátu. Již minimální dávky obou hypnotik vedou k výraznému prohloubení sedace, která pak umožní plánované vyšetření. Kardiorespirační parametry jsou přitom ovlivněny minimálně, ale v jednotlivých případech je nutno zajistit průchodnost horních dýchacích cest Esmarchovým hmatem. To platí zejména pro pacienty s tlustým krátkým a velkým objemným jazykem, jako je tomu u Downova syndromu.
Vzhledem k transportu pacienta zpět do ústavního zařízení jsme u části pacientů aplikovali specifického antagonistu flumazenil. Již během dvou minut došlo k výraznému změlčení sedace a zvýšení psychomotorické aktivity pacientů. To svědčí o tom, že midazolam hraje důležitou úlohu ve směsi jako hypnotická komponenta. Pouze u dvou pacientů jsme po aplikaci flumazenilu nepozorovali podstatné odeznění sedace. Bylo to ve skupině s klonidinem, který se podílel na zvýšené sedaci. U některých pacientů je však přetrvávající sedace účinkem klonidinu výhodou, protože zajišťuje klidnou dopravu pacienta do ústavu sociální péče.
Kombinací zvolených farmak využíváme jejich synergický účinek. Bylo opakovaně zjištěno, že mentálně handicapovaní mají sníženou odpověď na i. v. sedativa [20]. Příčinou může být jak změněná farmakokinetika (současné používání antiepileptik vede ke zvýšení aktivity cytochromu P450 [21]), ale zřejmě i farmakodynamika mechanismem, který není dosud znám [20]. Alfa2 agonisté a benzodiazepiny se výrazně potencují ve svém sedativním a hypnotickém účinku [22]. Rovněž výrazně redukují výskyt případných psychomimetických účinků po ketaminu a redukují i výskyt kardiostimulačních účinků po tomto anestetiku [19]. Zatímco běžně užívaná dávka samotného ketaminu per os je 6–10 mg . kg-1 [23], kombinace ketaminu s midazolamem a klonidinem umožní výraznou redukci jeho dávkování. Tato trojkombinace kromě toho, že usnadní ošetření pacienta, může ovlivnit příznivě i případnou indukci anestezie a její průběh v bezprostředním pooperačním období (redukce dávkování farmak, hemodynamická stabilita, redukce analgetik v pooperačním období).
Závěr
Předběžné výsledky napovídají, že zvolená premedikace je účinná: ve všech případech byla akceptována bez potíží a ve všech případech umožnila manipulaci mentálně handicapovaným, kanylaci periferní žíly a vyšetření chrupu, a to zcela bez nutnosti použít fyzického omezování mentálně handicapovaného.
Studie vznikla za podpory grantu IGA NS 10503.
Došlo dne 22. 2. 2011.
Přijato dne 6. 6. 2011.Adresa pro korespondenci:
Doc. MUDr. Jiří Málek, CSc.
KAR 3. LF UK a FNKV Praha
Ruská 87
100 00 Praha 10
e-mail: malekj@fnkv.cz
Zdroje
1. Wong, A. Treatment planning considerations for adult oral rehabilitation cases in the operating room. Dent. Clin. North. Am., 2009, 53, p. 255–267.
2. Solomowitz, B. H. Treatment of mentally disabled patients with intravenous sedation in a dental clinic outpatient setting. Dent. Clin. North. Am., 2009, 53, p. 231–242.
3. Miyawaki, T., Kohjitani, A., Maeda, S. et al. Intravenous sedation for dental patients with intellectual disability. J. Intellect. Disabil. Res., 2004, 48, p. 764–768.
4. Vadivelu, N., Harkness, P., Richman, S., Shelley, K. H. Special anesthetic concerns in mentally handicapped institutionalized patients undergoing gynecological procedures in an outpatient setting. Conn. Med., 2004, 68, p. 359–362.
5. Fukuta, O., Braham, R. L., Yanase, H., Kurosu, K. The sedative effects of intranasal midazolam administration in the dental treatment of patients with mental disabilities. Part 2: optimal concentration of intranasal midazolam. J. Clin. Pediatr. Dent., 1994, 18, p. 259–265.
6. Rosenberg, M. Oral ketamine for deep sedation of difficult--to-manage children who are mentally handicapped: case report. Pediatr. Dent., 1991, 13, p. 221–223.
7. Neckel, W., Jacobs, F. E., Tolksdorf, W. Oral ketamine as preferred preanesthetic medication of uncooperative patients. Anasthesiol Intensivmed Notfallmed Schmerzther, 1992, 27, p. 381–384.
8. Cote, C. J., Cohen, I. T., Suresh, S. et al. A comparison of three doses of a commercially prepared oral midazolam syrup in children. Anesth. Analg., 2002, 94, p. 37–43, table of contents.
9. Amrein, R., Hetzel, W. Pharmacology of Dormicum (midazolam) and Anexate (flumazenil). Acta Anaesthesiol. Scand. Suppl., 1990, 92, p. 6–15; discussion p. 47.
10. Cortinas, M., Oya, B., Caparros, P., Cano, G., Ibarra, M., Martinez, L. Oral ketamine-midazolam premedication of uncooperative patients in major outpatient surgery. Rev. Esp. Anestesiol. Reanim., 2010, 57, p. 479–485.
11. Bergendahl, H., Lonnqvist, P. A., Eksborg, S. Clonidine in paediatric anaesthesia: review of the literature and comparison with benzodiazepines for premedication. Acta Anaesthesiol. Scand., 2006, 50, p. 135–143.
12. Funk, W., Jakob, W., Riedl, T., Taeger, K. Oral preanaesthetic medication for children: double-blind randomized study of a combination of midazolam and ketamine vs midazolam or ketamine alone. Br. J. Anaesth., 2000, 84, p. 335–340.
13. Grant, I. S., Nimmo, W. S., Clements, J. A. Pharmacokinetics and analgesic effects of i.m. and oral ketamine. Br. J. Anaesth., 1981, 53, p. 805–810.
14. Chong, C., Schug, S. A., Page-Sharp, M., Jenkins, B., Ilett, K. F. Development of a sublingual/oral formulation of ketamine for use in neuropathic pain: Preliminary findings from a three-way randomized, crossover study. Clin. Drug Investig., 2009, 29, p. 317–324.
15. Schwagmeier, R., Alincic, S., Striebel, H. W. Midazolam pharmacokinetics following intravenous and buccal administration. Br. J. Clin. Pharmacol., 1998, 46, p. 203–206.
16. Marshall, J., Rodarte, A., Blumer, J., Khoo, K. C., Akbari, B., Kearns, G. Pediatric pharmacodynamics of midazolam oral syrup. Pediatric Pharmacology Research Unit Network. J. Clin. Pharmacol., 2000, 40, p. 578–589.
17. Shapira, J., Holan, G., Botzer, E., Kupietzky, A., Tal, E., Fuks, A. B. The effectiveness of midazolam and hydroxyzine as sedative agents for young pediatric dental patients. ASDC J. Dent. Child, 1996, 63, p. 421–425.
18. Crevoisier, C., Ziegler, W. H., Eckert, M., Heizmann, P. Relationship between plasma concentration and effect of midazolam after oral and intravenous administration. Br. J. Clin. Pharmacol., 1983, 16, Suppl. 1, p. 51S–61S.
19. Levanen, J., Makela, M. L., Scheinin, H. Dexmedetomidine premedication attenuates ketamine-induced cardiostimulatory effects and postanesthetic delirium. Anesthesiology, 1995, 82, p. 1117–1125.
20. Miyawaki, T., Kohjitani, A., Maeda, S. et al. Intravenous sedation for dental patients with intellectual disability. J. Intellect. Disabil. Res., 2004, 48, p. 764–768.
21. Patsalos, P. N., Froscher, W., Pisani, F., van Rijn, C. M. The importance of drug interactions in epilepsy therapy. Epilepsia, 2002, 43, p. 365–385.
22. Salonen, M., Reid, K., Maze, M. Synergistic interaction between alpha 2-adrenergic agonists and benzodiazepines in rats. Anesthesiology, 1992, 76, p. 1004–1011.
23. Bozkurt, P. Premedication of the pediatric patient – anesthesia for the uncooperative child. Curr. Opin. Anaesthesiol., 2007, 20, p. 211–215.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek Kdo se bojí TEE?Článek Nová farmaka – jak s nimi?Článek Jak zacházet s VIP pacientemČlánek Cena Josefa HlávkyČlánek Nadcházející konference
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2011 Číslo 4- Jak souvisí postcovidový syndrom s poškozením mozku?
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Léčba akutní pooperační bolesti z pohledu ortopeda
-
Všechny články tohoto čísla
- Kdo se bojí TEE?
- Nová farmaka – jak s nimi?
- Využití peroperační jícnové echokardiografie během kardiochirurgických operací anesteziology v České republice
- Povrchový a mediální cervikální blok – MRI studie
- Orální analgosedace mentálně postižených pacientů – předběžné výsledky
- Má mírná terapeutická hypotermie stejný vliv na výsledný neurologický stav nemocných po resuscitaci v nemocnici a mimo nemocnici pro defibrilovatelný a nedefibrilovatelný rytmus?
- 13. kardioanesteziologické vědecké dny s mezinárodní účastí, Pardubice 26.–27. 5. 2011
- Jak zacházet s VIP pacientem
- Statistika oboru anesteziologie a resuscitace
- ESA 2011 Amsterodam 11.–14. června 2011
- Cena Josefa Hlávky
- Nadcházející konference
- Periferní nervové blokády pro klinickou praxi, včetně ultrazvukového navádění
- Upozornění na důležité publikace ze Slovenské republiky
- Oceněné práce na V. česko-slovenském kongresu intenzivní medicíny (Praha 26. 5. 2011)
- Vzdělávací program oboru Intenzivní medicína (VP IM)
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Periferní nervové blokády pro klinickou praxi, včetně ultrazvukového navádění
- Orální analgosedace mentálně postižených pacientů – předběžné výsledky
- Kdo se bojí TEE?
- Povrchový a mediální cervikální blok – MRI studie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání