-
Medical journals
- Career
Vysokodávková léčba a přípravné režimy před transplantací krvetvorných buněk
Authors: M. Tomíška; Z. Kořístek; M. Navrátil; J. Mayer
Authors‘ workplace: Interní hematologická a onkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc.
Published in: Vnitř Lék 2012; 58(7 a 8): 175-180
Category: 60th Birthday prof. MUDr. Miroslav Penka, CSc.
Overview
Vysokodávková chemoterapie může být definována jako dávka cytotoxických léků, která vede k ablaci kostní dřeně. Následný převod autologního štěpu slouží jako záchrana z jinak většinou smrtelné myelotoxicity. Významným přínosem alogenní transplantace krvetvorných buněk je imunitní reakce štěpu proti nádoru (GvT), která proti autologní léčbě snižuje výskyt relapsů maligního onemocnění. Na tento efekt spoléhají nové režimy s redukovanou intenzitou, jež sice mají menší úvodní cytotoxický účinek, ale dodatečně dosahují eliminace zbylých nádorových buněk imunitním efektem. Jejich hlavní výhodou je snížení toxicity přípravného režimu, což umožňuje podat tuto léčbu také starším pacientům a nemocným s přidruženými chorobami.
Klíčová slova:
vysokodávková chemoterapie – transplantace krvetvorných buněk – přípravný režim – nemyeloablativní přípravaCharakteristika vysokodávkové chemoterapie
Léčba nádorů vysokými dávkami cytotoxických léků je založena na skutečnosti, že s nárůstem dávky stoupá toxický účinek léku na chemosenzitivní nádorové buňky. Následná transplantace štěpu krvetvorných buněk slouží k překonání myelosuprese, která by jinak představovala limitující toxicitu této léčby.
Vy sokodávková chemoterapie může být def inována jako dávka cytotoxických léků, která vede k ablaci kostní dřeně. U řady cytotoxických léků způsobuje 3násobný vzestup plochy pod křivkou až 10násobný nárůst cytotoxicity, což je pravděpodobně nejmenší nárůst, který může znamenat zřetelný klinický efekt. Z tohoto pohledu je možno za vysokodávkovou chemoterapii považovat dávku, jež zvyšuje systémovou expozici léku nejméně 3krát (tab. 1).
Table 1. Farmakokinetika a farmakodynamika vysokodávkové chemoterapie. 
1násobek obvyklé dávky Závislost léčebné odpovědi na koncentraci cytotoxického léku
Použití cytotoxických léků pro vysokodávkovou chemoterapii je většinou založeno na in vitro testování závislosti koncentrace léku na dosaženém efektu. Minimálním výchozím požadavkem je účinek léku na daný typ nádoru v běžném dávkování. Experimentální studie prokázaly, že většina cytotoxických léků se ve svém protinádorovém účinku řídí kinetikou prvního řádu, což znamená, že koncentrace léku působící po určitou dobu eliminuje fixní počet nádorových buněk. Alkylační cytostatika mají strmě stoupající křivku protinádorové účinnosti až do vysokých dávek, aniž se přitom objeví efekt plateau, kdy cytotoxicita již dále nenarůstá. Plateau efekt je charakteristický pro antimetabolity, zatímco antracykliny, taxany a etoposid mají účinek intermediární. Při jejich prolongované expozici však in vitro dochází také ke značnému vzestupu cytotoxicity.
Alkylační látky jsou vhodné léky pro přípravné režimy i proto, že jejich účinek není závislý na fázi buněčného cyklu a nemají také mezi sebou navzájem zkříženou rezistenci. Tato vlastnost je nezbytná podmínka pro možnost kombinované léčby.
Efekt intenzívní chemoterapie in vivo je závislý na mnoha okolnostech, které nemohou být postiženy pouhým testováním in vitro. Odpověď na cytotoxickou léčbu může být limitována heterogenitou nádorových buněk, primární nebo sekundární rezistencí, rozdíly v perfuzi a oxygenaci nádorové tkáně, imunologickými faktory a farmakokinetikou protinádorových léků. Mnoho z těchto faktorů může být za určitých okolností překonáno použitím vysoké dávky cytotoxického léku.
Heterogenita nádorových buněk
I když u mnoha maligních nádorů lze předpokládat vznik z jednoho klonu, většina nádorů jeví genetickou nestabilitu. Genetická heterogenita lidských nádorů způsobuje nepředvídatelnou odpověď na cytotoxickou léčbu u jednotlivých pacientů (v populaci nemocných však predikce možná je). Nádorová tkáň obsahuje nádorové buňky schopné sebeobnovy, které mohou být rezistentnější k chemoterapii než více diferencované buňky nádoru. Tato vnitřní necitlivost nádorových buněk může být překonána vysokodávkovou chemoterapií.
Pravděpodobnost příznivého výsledku vysokodávkové léčby je možno zvýšit strategií předcházející redukce objemu nádorové tkáně. Nádory velkého objemu mají totiž častější náhodné mutace vedoucí k rezistenci na léčbu a často také obsahují špatně vaskularizované okrsky s nedostatečným průnikem cytostatika. Použití vysoké dávky cytotoxického léku se tak stává jednou z možných strategií, jak překonat tuto špatnou distribuci léku do místa nádoru. Opakovaně se ukazuje, že příznivý efekt vysoké dávky chemoterapie je pravděpodobnější při nízké mase nádoru.
Rezistence nádorových buněk k cytotoxické léčbě
Řada lidských nádorů obsahuje malé populace nádorových buněk, které jsou rezistentní buď primárně, nebo získávají rezistenci během léčby. Rezistentní klony pak mají růstovou výhodu způsobenou selektivním tlakem protinádorové léčby. Pokud však je expozice cytotoxickému léku dostatečná, mohou být eliminovány i vysoce rezistentní buňky.
Mechanizmy rezistence jsou rozmanité a mohou zahrnovat snížené vychytávání léku buňkou (funkční změny membránových transportních proteinů), zvýšený intracelulární metabolizmus cytostatika a jeho detoxikaci, zvýšené opravy poškozené DNA, zvýšenou expresi cytoprotektivních genů, zvýšené vypuzování cytotoxického léku z buňky a další.
Použití kombinované vysokodávkové léčby, kdy jednotlivé léky zasahují nádorové buňky různým mechanizmem účinku, může být efektivní k překonání rezistence nebo k zábraně jejího vzniku.
Farmakokinetika cytotoxické léčby
Pro celou současnou paletu cytostatik je charakteristická farmakokinetická variabilita mezi jednotlivými pacienty. U vysokodávkové chemoterapie je tato variabilita ještě patrnější. Systémová clearance se u jednotlivých pacientů běžně liší v rozsahu 3násobku až 10násobku. Výsledkem je velmi rozdílná variace v celkové expozici léku – plocha pod křivkou (area under curve – AUC) nebo rovnovážná koncentrace – mezi pacienty, kterým je lék dávkován v ekvivalentních dávkách.
Farmakokinetika cytostatik může být ovlivněna genetickým polymorfizmem v metabolizmu daného léku (farmakogenomika). Ve většině případů jde o polygenní proces, který je třeba studovat spíše na úrovni genomu než jednotlivých genů. Genetické varianty typicky kódují proteiny s nižší enzymatickou aktivitou proti přirozenému typu (wild type).
Detoxikace řady cytostatik (busulfan, thiotepa, cyklofosfamid a ifosfamid, platinová cytostatika i antracykliny) je závislá na intracelulárním obsahu glutationu (GSH). Enzymy ze skupiny glutation S-transferáz (GST) eliminují silné elektrofilní skupiny cytostatik vazbou na GSH. Geny pro GST jsou vysoce polymorfní. Zvýšená exprese aktivnější formy glutation S-transferázy vede k rezistenci buněk na uvedená cytostatika a naopak, buňky s deplecí GSH jsou zvýšeně citlivé na toxický efekt těchto léků.
U léků se strmou křivkou dávka-odpověď a úzkým terapeutickým rozmezím dochází k těžko předvídatelné klinické odpovědi nebo toxicitě. Nejzávažnějším aspektem této variability je, že metabolizmus některých léků je saturovatelný. To vede ke značnému nelineárnímu nárůstu systémové expozice při relativně malém zvýšení dávky. Na druhé straně u léků s lineární farmakokinetikou terapeutické monitorování hladin umožňuje dosáhnout cílené expozice léku.
Dávkování léků podle velikosti tělesného povrchu vychází z experimentů na zvířatech. Maximální tolerované dávky různých cytotoxických léků u různých živočišných druhů jsou nejpodobnější, pokud jsou vztahovány k tělesnému povrchu. V posledních letech je tento přístup kritizován zejména proto, že tělesný povrch se pohybuje v poměrně úzkém rozmezí, na rozdíl od různých farmakokinetických parametrů (clearance, distribuční objem, vylučování), jejichž variace jsou 3 - až 10násobné. Proto by dávkování podle tělesného povrchu mělo být používáno jen u těch léků, u nichž byla příslušná závislost prokázána. Jedním z argumentů proti užívání tělesného povrchu pro výpočet dávky je samotná složitost výpočtu a riziko chyby. Podávání fixních dávek může být pro pacienta bezpečnější.
Farmakokinetika cytotoxických léků často závisí více na funkci orgánů, jež se podílejí na jejich eliminaci, jako jsou zejména játra a ledviny. Vylučování karboplatiny závisí na funkci ledvin, zatímco porucha funkce jater vyžaduje snížení dávky doxorubicinu, vinkristinu nebo taxanů. Běžné laboratorní jaterní testy, na rozdíl od renálních ukazatelů, však nejsou dostatečně citlivé pro určení eliminační kapacity jater.
Při hodnocení efektu léčby je třeba také brát do úvahy, že distribuce léku v těle není rovnoměrná. Průnik do některých tkání (nervový systém, varlata) je za normálních okolností omezený a tato místa mohou ukrývat nádorové buňky před účinkem cytostatik.
Faktory hostitele nádoru
Úspěšnost vysokodávkové léčby výrazně závisí také na faktorech nemocného, jako jsou nutriční stav, funkční kapacita a integrita hlavních orgánových systémů.
Nemocní s dysfunkcí orgánu, který se významně podílí na metabolizmu a exkreci cytostatika, mají vysokou pravděpodobnost toxicity. Nemocní s podvýživou (BMI < 20,5 kg/m2), přítomnou již před vysokodávkovou léčbou, mají signifikantně vyšší riziko toxicity protinádorové chemoterapie a transplantační mortality.
Charakteristika přípravného režimu
Použití přípravného režimu (conditioning) znamená přípravu podmínek k přijetí nového krvetvorného štěpu po odstranění původní, často nemocné krvetvorby. Při nádorovém onemocnění má přípravný režim potenciál zajistit dlouhodobý úspěšný výsledek léčby, ale může také klíčovým způsobem ovlivnit časnou mortalitu.
Chyby v použití přípravného režimu mohou mít dalekosáhlé důsledky, které mohou být pro nemocného i fatální. Volba optimálního režimu a kontrola kvality při jeho podání proto má zásadní důležitost.
Cíle přípravného režimu
Příprava před transplantací krvetvorných buněk (hematopoietic stem cell transplantation – HSCT) sleduje 3 následující hlavní cíle.
- Vytvoření prostoru v kostní dřeni. Za normálních okolností obsazují nezralé progenitorové buňky definovaná místa uvnitř stromatu kostní dřeně s cílem získat podporu pro svou proliferaci a diferenciaci. Aby dárcovské buňky získaly přístup k těmto místům a mohlo dojít k přihojení štěpu, musí být existující hostitelské kmenové buňky nejprve eradikovány.
I když experimentální a klinické údaje nejsou jednoznačné, je i po přípravných režimech s redukovanou intenzitou přihojení štěpu rychlejší, pokud je kostní dřeň „vyprázděná“. - Imunosuprese s cílem snížit riziko nepřijetí štěpu. U alogenní transplantace je nezbytné použít imunosupresivní léčbu k zabránění rejekce štěpu hostitelskými imunitními buňkami. Potřeba imunosuprese narůstá se zvyšující se neshodou v HLA systému. Zvyšuje se také při senzibilizaci proti malým histokompatibilitním antigenům po opakovaných transfuzích krevních elementů před HSCT. Riziko rejekce štěpu se zvyšuje také při převodu štěpu s odstraněnými T-lymfocyty.
Na druhé straně je možno přijetí štěpu podpořit převodem většího počtu kmenových buněk a nebo většího počtu T-lymfocytů. Imunosuprese není nezbytná před autologní HSCT ani před syngenní HSCT. - Potlačení nádoru. Klíčovou úlohou přípravného režimu u maligních chorob je nejen zajistit přihojení štěpu, ale také významně přispět k zajištění dlouhodobé kontroly nádorového onemocnění. Ke splnění tohoto cíle přispívá co možná největší eliminace nádorových buněk z postižených tkání.
Základní principy autologní HSCT
Autologní HSCT využívá klasického konceptu vysokodávkové léčby. Základem je nárůst protinádorového účinku s nárůstem dávky cytotoxického léku, který byl pro jednotlivé léky ověřen experimentálně i klinicky. Limitujícím faktorem dávky je nehematologická orgánová toxicita a samotný převod autologního štěpu slouží jako záchrana z jinak většinou smrtelné myelotoxicity.
Volba cytotoxických léků pro vysokodávkovou léčbu závisí na jejich efektu v primární léčbě daného nádorového onemocnění. Přípravné režimy pro autologní HSCT byly většinou vytvořeny empiricky, ale některé z nich jsou odvozeny ze zkušeností s alogenní HSCT. I když některé režimy jsou založeny na monoterapii, většinou obsahují různé kombinace několika cytotoxických léků, které mají nepřekrývající se orgánovou nehematologickou toxicitu, ale potencují se v protinádorovém účinku.
Pokroky v podpůrné léčbě posledních 2 desetiletích vedly k nárůstu počtu nemocných, jimž může být autologní HSCT nabídnuta. Hlavním problémem autologní HSCT však zůstává relativně vysoký výskyt relapsů nádorového onemocnění.
V posledních letech se ukazuje, že autologní HSCT může sloužit jako cytoredukční strategie k dosažení stavu minimální reziduální choroby, po níž může být použita nemyeloablativní alogenní HSCT s cílem eradikovat reziduální nádorové buňky imunitním efektem štěpu proti tumoru (graft versus tumor – GvT).
Někteří autoři ukazují, že i po autologní HSCT se může vyvinout imunitní efekt podobný GvHD, který by mohl být vysvětlen zničením regulačních T-lymfocytů. Výsledkem je autoagresivní syndrom nebo autologní GvHD. Klinicky se většinou manifestuje projevy limitovanými na kůži, jeho význam ve vztahu k nádoru však není jasný.
Imunosuprese při alogenní HSCT
Úspěšná alogenní HSCT musí překonat 2 imunologické bariéry, a to reakci hostitele proti štěpu (host versus graft – HvG) a štěpu proti hostiteli (graft versus host – GvH). Obě tyto protisměrné reakce jsou zprostředkovány T-lymfocyty, v prvním případě hostitelskými, ve druhém dárcovskými. Strategie překonání této obousměrné bariéry spoléhá na 3 elementy:
- intenzivní přípravný režim s cílem způsobit imunoablaci, potřebnou k neodhojení štěpu,
- podání dárcovských buněk k záchraně pacienta z jinak smrtelné myeloablace a
- imunosuprese po přihojení štěpu, nezbytná k zábraně reakce štěpu proti hostiteli a k navození dlouhodobé tolerance štěpu a hostitele navzájem.
Významným efektem alogenní HSCT je reakce štěpu proti nádoru (GvT), která snižuje výskyt relapsů maligního onemocnění. Nemodifikovaná alogenní HSCT, tedy podání štěpu, jenž nebyl zbaven dárcovských lymfocytů, má proto výhodu větší pravděpodobnosti dlouhotrvající remise nádorového onemocnění než transplantace autologní nebo dokonce i syngenní HSCT.
Antitymocytární globulin
Imunosupresívní účinek přípravného režimu je možno zesílit kombinací s antitymocytárním globulinem (ATG), který se tak stává součástí přípravy. Jedná se o různé typy přípravků většinou králičího původu s obsahem polyklonálních protilátek, působících selektivně proti lidským T-lymfocytům. Opsonizačním mechanizmem a vazbou komplementu způsobují rozpad lymfocytů a tím vedou in vivo k lymfocytární depleci.
Příznivým účinkem přípravy pomocí ATG je zvýšení pravděpodobnosti přihojení štěpu a snížení výskytu GvHD, což je zvláštní výhoda u nepříbuzenské HSCT, která má obecně vyšší riziko selhání štěpu i akutní a chronické GvHD. Redukce výskytu GvHD je hlavní efekt ATG přípravy, přičemž většinou nedochází k významnému nárůstu relapsů, a tedy ani k významnému potlačení efektu GvT. V rámci přípravy podané ATG je prokazatelné na lymfocytech dárce ještě za 30 dnů po HSCT, což však významně neoddaluje plný dárcovský chimérizmus T-lymfocytů.
Klinické studie prokazují efekt ATG závislý na dávce v rozmezí 10–60 mg/kg, přičemž u nepříbuzenské HSCT je preferována plná celková dávka 60 mg/kg aktuální tělesné hmotnosti. ATG je takto možno přidat k různým přípravným režimům, většinou rozděleně do 2–5 dnů.
Lék je podáván formou intravenózní infuze trvající nejméně 6 hod, spolu s antialergickou profylaxí zahrnující kortikosteroidy, antihistaminika a antipyretikum. Reakce po aplikaci jsou časté zejména 1. den podání, kdy se jako zásadní jeví pomalejší rychlost podávání. Následkem léčby ATG, zvláště při vyšších dávkách, je častá trombocytopenie a někdy i hemolytická anemie s nespecifickou vazbou protilátky na erytrocyty.
Alemtuzumab
Zvýšení imunosupresivního efektu přípravného režimu je možno dosáhnout také začleněním specifické monoklonální protilátky, jako je alemtuzumab, humanizovaná protilátka proti panlymfocytárnímu znaku CD52. Výsledkem je hluboká imunosuprese snižující výskyt GvHD, ale za cenu zvýšení rizika infekčních komplikací a potenciálně také relapsů nádorového onemocnění.
Základní typy přípravných režimů
Cíle přípravy před HSCT mohou být splněny buď radikálním odstraněním kostní dřeně (myeloablativní příprava – MA), nebo méně intenzivním potlačením krvetvorby příjemce za současného spoléhání na popsaný imunitní efekt (nemyeloablativní příprava – NMA).
Myeloablativní příprava při primárním nádorovém postižení krvetvorby splňuje všechny cíle přípravného režimu. Vede k úplné eradikaci nádorových buněk, k ablaci kostní dřeně s vytvořením prostoru pro přijetí dárcovské krvetvorby a k výrazné imunosupresi, nutné k přihojení štěpu. Proto jsou přípravné režimy typu MA až dosud považovány za standardní.
Naproti tomu režimy s redukovanou intenzitou (reduced intensity conditioning – RIC) mají sice menší cytotoxický účinek, ale zbylé nádorové buňky mohou být eliminovány dodatečně při imunitní reakci typu GvT. Hlavní výhodou RIC je snížení toxicity přípravného režimu, což umožňuje podat tuto léčbu také starším pacientům a nemocným s přidruženými chorobami, pro které by MA příprava byla provázena velkým rizikem komplikací, včetně fatálních. Snížení nehematologické toxicity přípravy však není jediným cílem RIC. Stejně významným cílem je zajistit imunomodulační efekt dárcovských T-lymfocytů k dosažení eradikace reziduálních nádorových buněk.
Význam imunitního efektu při HSCT je možno dokladovat vysokým výskytem relapsů nádoru v situacích, kdy tento efekt chybí, jako je tomu po syngenní HSCT a po převodu štěpu s deplecí T-lymfocytů. Potlačení nádoru imunitním efektem je také patrno ze snížení výskytu relapsů při chronické GvHD a při aktivním použití infuze dárcovských lymfocytů po alogenní HSCT.
Režimy typu RIC vycházejí z preklinických studií, které definovaly minimální požadavky na přihojení štěpu. Umožňují dočasnou koexistenci krvetvorných buněk dárce a příjemce (smíšený chimérizmus), což by v případě selhání štěpu umožnilo obnovení krvetvorby příjemce (nemyeloablativní účinek, reverzibilní myelosuprese). Smíšený chimérizmus však může být následně převeden na plný dárcovský chimérizmus pomocí infuze dárcovských lymfocytů. Naproti tomu jedna práce z poslední doby ukazuje, že po NMA režimu došlo k dárcovskému chimérizmu u většiny pacientů v podobném časovém odstupu jako po MA přípravě, zatímco u některých nemocných po MA přetrvávala přítomnost leukocytů příjemce déle než 4 týdny po HSCT.
Příchod nových modifikovaných typů přípravy v posledních 10–15 letech vytváří spektrum přípravných režimů od standardních MA přes režimy typu RIC až po skutečnou NMA přípravu, která spoléhá především na imunosupresivní účinek, v krajním případě na izolovanou imunoablaci (tab. 2).
Table 2. Všeobecně akceptovaná kritéria pro MA a NMA dávky TBI a léků1. 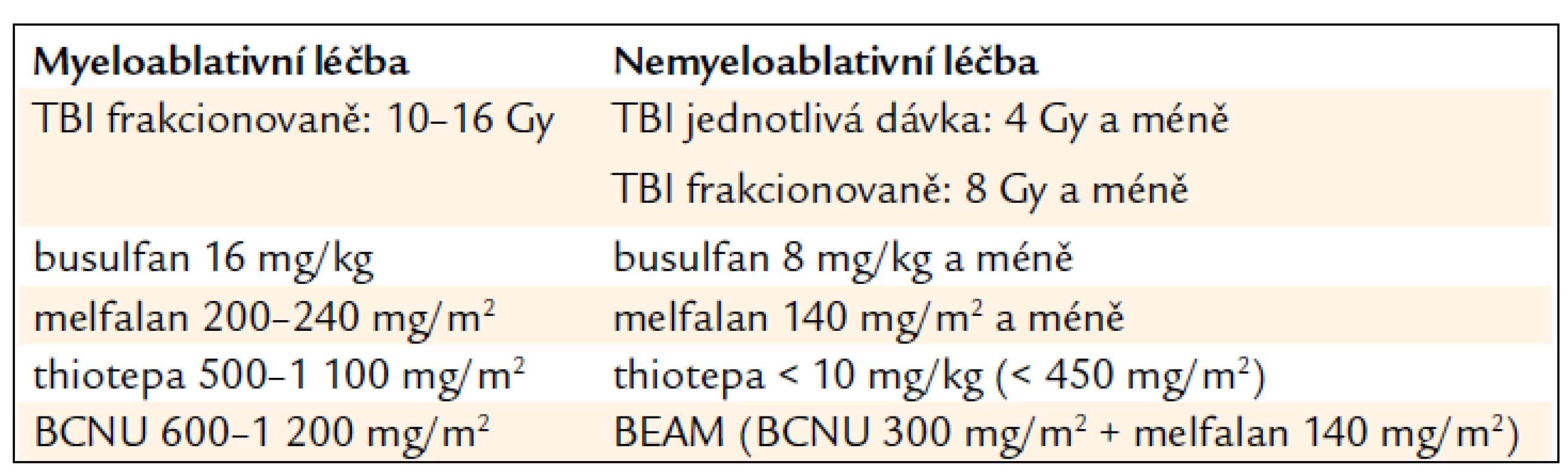
1uvedené dávky nejsou jednoznačně definovány Přípravné režimy typu RIC významně rozšiřují možnosti transplantační léčby. Velká část nemocných s maligním onemocněním krvetvorby spadá do vyšší věkové kategorie, např. medián věku nemocných s nově diagnostikovanou akutní leukemií je 67 roků. Tito pacienti často nejsou schopni MA přípravy pro různá přidružená onemocnění, nízkou funkční orgánovou rezervu a snížený performance status, ale mohou absolvovat léčbu s redukovanou intenzitou.
Srovnání účinnosti standardních MA režimů s přípravou typu RIC je obtížné, protože nemocní s RIC jsou obvykle vyššího věku, mají větší komorbiditu a méně často mají vhodného příbuzného dárce. Až dosud neexistují prospektivní randomizované studie, které by umožnily srovnání celkového výsledku obou typů léčby.
Obecně má HSCT po RIC nižší časnou nehematologickou toxicitu včetně menšího výskytu infekcí, nižší hematologickou toxicitu s menší potřebou transfuzních přípravků a nižší časné náklady. Nižší transplantační mortalita je však obvykle vyvážena vyšším výskytem relapsů nádoru.
Význam TBI pro přípravný režim
Historicky byla transplantace kostní dřeně vyvíjena k ochraně nemocných zasažených vysokou dávkou záření. Ve stejné době se stalo zřejmým, že ozáření může být použito také k odstranění leukemické krvetvorby, aniž dojde k trvalému poškození jiných orgánů.
TBI má aktivitu proti širokému spektru nádorů, a to i rezistentních k chemoterapii, včetně penetrace do míst, kam chemoterapie proniká špatně, jako jsou centrální nervový systém nebo varlata.
Vysoká citlivost kostní dřeně k účinkům TBI přispívá k dosažení jednoho z cílů přípravného režimu, kterým je vytvoření prostoru k přihojení štěpu.
Z hlediska HSCT byly od počátku velkou výhodou TBI jeho výborné imunosupresivní vlastnosti, které dostačovaly k přihojení štěpu i po relativně nízkých dávkách (tab. 2). TBI samotné však nebylo dostačující k dlouhodobé kontrole nádorového onemocnění, a proto bylo třeba kombinovat je s cytotoxickými léky. Výhodou takových kombinací je také relativně nízká extramedulární toxicita TBI.
TBI tedy může naplňovat současně několik cílů přípravy k transplantaci krvetvorby. Proto je možno přípravné režimy dělit podle toho, zda obsahují nebo neobsahují TBI.
Volba přípravného režimu podle typu onemocnění
Typ onemocnění je hlavním faktorem rozhodování o volbě přípravného režimu především u autologní HSCT.
Maximálního protinádorového účinku je dosaženo vysokou dávkou cytotoxických léků účinných v primární léčbě (tab. 3).
Table 3. Příklady přípravných režimů. 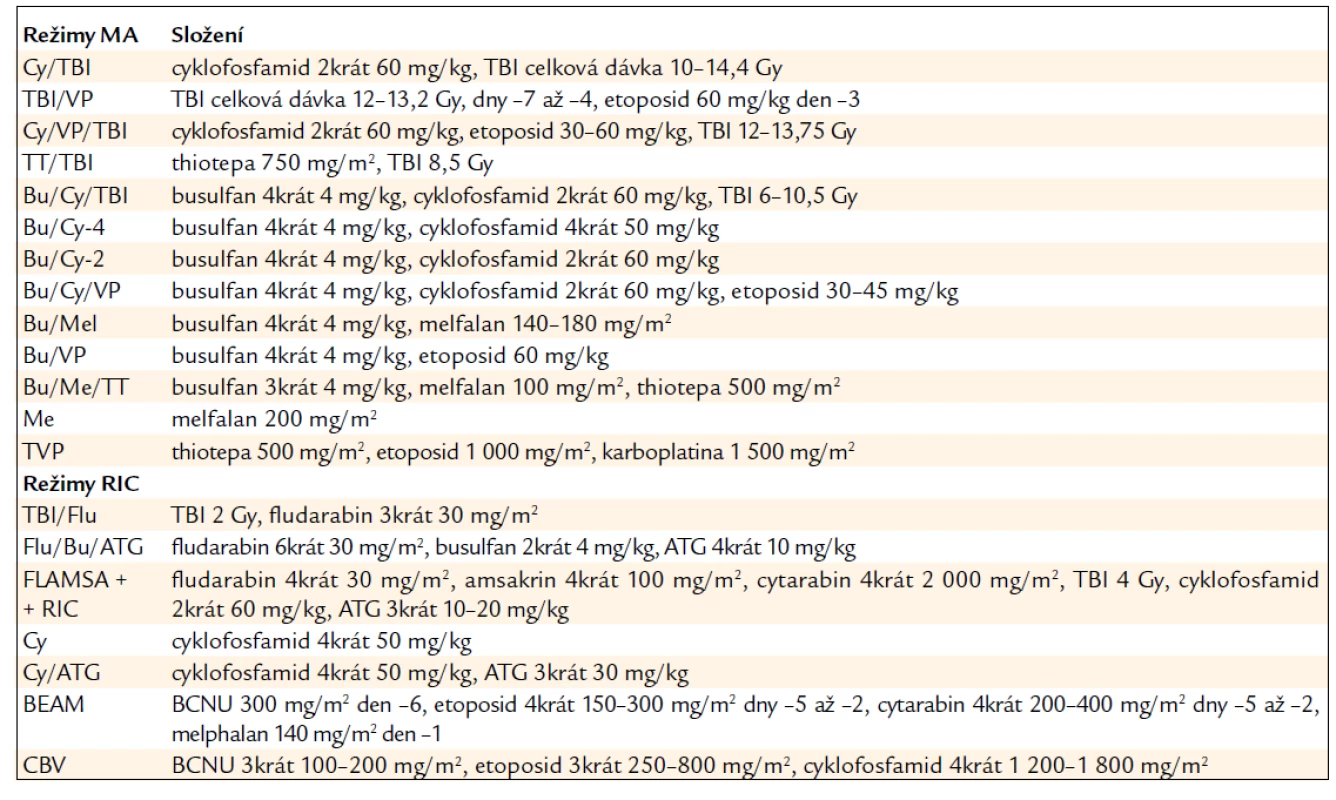
Příkladem je mnohočetný myelom, kde melfalan stále představuje zlatý standard terapie a ve vysoké dávce s podporou autologní HSCT může být podán i v monoterapii. U různých typů maligního lymfomu, včetně NHL vysoké i nízké malignity a také u relabující Hodgkinovy choroby je však podobného efektu dosaženo stejným režimem BEAM nebo BEAC.
U nemocných se solidními nádory, zvláště s karcinomem prsu, vedly velké klinické studie posledních roků k téměř úplnému opuštění léčby s autologní HSCT.
U alogenní HSCT závisí volba přípravného režimu na riziku progrese nádorového onemocnění. V případě rychle progredujících chorob je obvykle nezbytná předcházející cytoredukce k minimalizaci reziduální choroby. Na GvT efekt spoléhá především léčba indolentních maligních onemocnění a eradikace reziduálních nádorových buněk.
V případě akutní leukemie však nemají přednost cytotoxické léky specificky používané pro léčbu těchto onemocnění před obvyklou kombinací CyTBI nebo BuCy, který byl původně vytvořen právě pro nemocné s leukemií. Obecně žádný z přípravných režimů nevede u nemocných s leukemií k lepšímu dlouhodobému přežívání než právě režimy BuCy nebo CyTBI (tab. 3).
Pro léčbu ALL má z dlouhodobého hlediska výhodu režim s TBI, na něž jsou nádorové buňky zvláště citlivé a které navíc působí i na místech, kam cytotoxické léky špatně pronikají, jako je CNS. U nemocných ve druhé remisi je vhodné zvýšit dávku TBI až na 13,2 Gy spolu s cyklofosfamidem, nebo nahradit cyklofosfamid etoposidem. Kombinace etoposid/TBI se stává standardní přípravou u všech nemocných s ALL.
Zvláštní situaci představuje těžká aplastická anémie jako nenádorové onemocnění. Imunosupresivní příprava pomocí ATG usnadňuje přihojení a současně snižuje výskyt GvHD. Jedna dávka TBI 2 Gy může být dostačující k přihojení kmenových krvetvorných buněk i od nepříbuzných dárců. Alternativním přístupem ve snaze vyhnout se TBI je nahrazení části efektu cyklofosfamidu fludarabinem.
U autoimunitních chorob počty HSCT narůstají, ale zatím stále zůstávají metodou pro výzkum a testování v rámci klinických studií.
doc. MUDr. Miroslav Tomíška, CSc.
www.fnbrno.cz
e-mail: mtomiska@fnbrno.cz
Doručeno do redakce: 28. 3. 2012
Sources
1. Doroshow JH, Synold TW. Pharmacologic basis for high-dose chemotherapy. In: Thomas’ Hematopoietic Cell Transplantation. Singapore: Blackwell Publishing 2008 : 289–315.
2. Bensinger WI. High-dose preparatory regimens. In: Thomas’ Hematopoietic Cell Transplantation. Singapore: Blackwell Publishing 2008 : 316–330.
3. Soiffer RJ, LeRademacher J, Ho V et al. Impact of immune modulation with anti-T-cell antibodies on the outcome of reduced-intensity allogeneic hematopoietic stem cell transplantation for hematologic malignancies. Blood 2011; 117 : 6963–6970.
4. Uberti JP, Agovi MA, Tarima S et al. Comparative analysis of BU and CY versus CY and TBI in full intensity unrelated marrow donor transplantation for AML, CML and myelodysplasia. Bone Marrow Transplant 2011; 46 : 34–43.
5. Cantoni N, Gerull S, Heim D et al. Order of application and liver toxicity in patients given BU and CY containing conditioning regimens for allogeneic hematopoietic SCT. Bone Marrow Transplant 2011; 46 : 344–349.
6. Hill-Kayser CE, Plastaras JP, Tochner Z et al. TBI during BM and SCT: review of the past, discussion of the present and consideration of future directions. Bone Marrow Transplant 2011; 46 : 475–484.
7. Mickelson DM, Sproat L, Dean R et al. Comparison of donor chimerism following myeloablative and nonmyeloablative allogeneic hematopoietic SCT. Bone Marrow Transplant 2011; 46 : 84–89.
8. Khabori MA, El-Emary M, Xu W et al. Impact of intensity of conditioning therapy in patients aged 40–60 years with AML/myelodysplastic syndrome undergoing allogeneic transplantation. Bone Marrow Transplant 2011; 46 : 516–522.
9. Kline J, Subbiah S, Lazarus HM et al. Autologous graft-versus-host disease: harnessing anti - tumor immunity through impaired self-tolerance. Bone Marrow Transplant 2008; 41 : 505–513.
10. Wallen H, Gooley TA, Deeg HJ et al. Ablative allogeneic hematopoietic cell transplantation in adults 60 years of age and older. J Clin Oncol 2005; 23 : 3439–3446.
11. Gyurkocza B, Storb R, Storer BE et al. Nonmyeloablative allogeneic hematopoietic cell transplantation in patients with acute leukemia. J Clin Oncol 2010; 28 : 2859–2867.
12. Cetkovský P. Alogenní transplantace kmenových buněk krvetvorby po přípravě s redukovanou intenzitou. Bilancování poznatků po deseti letech používání této metody. Postgraduální medicína 2007; 9 : 336–343.
13. Schleuning M, Günther W, Tischer J et al. Dose-dependent effects of in vivo antithymocyte globulin during conditioning for allogeneic bone marrow transplantation from unrelated donors in patients with chronic phase CML. Bone Marrow Transplant 2003; 32 : 243–250.
14. Andersson BS, de Lima M, Thall PF et al. Once daily i.v. busulfan and fludarabine (i.v.Bu-Flu) compares favourably with i.v. busulfan and cyclophosphamide (i.v.BuCy2) as pretransplant conditioning therapy in AML/MDS. Biol Blood Marrow Transplant 2008; 14 : 672–684.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue 7 a 8-
All articles in this issue
- Syndróm nepokojných nôh u dialyzovaných pacientov
- Antagonisty aldosterónu v liečbe chronického srdcového zlyhávania
- Manažment stabilnej anginy pectoris a iných foriem chronickej kardiovaskulárnej artériovej choroby
- Antiaterogénny účinok HDL subpopulácií u jedincov s novodiagnostikovanou končatinovocievnou artériovou chorobou
- Koncentrace sodíku v dialyzačním roztoku – důležitý, ale opomíjený parametr hemodialýzy u nemocných s chronickým selháním ledvin
- Oxidačný stres a antioxidačné systémy u hemodialyzovaných chorých
- Farmakogenetické aspekty liečby orálnymi antidiabetikami
- Refeeding syndrom u mladého pacienta s anxiózně-depresivní poruchou
- Detekce KRAS a jeho mutace v biopsii pokročilého kolorektálního karcinomu při koloskopii
- Tuhosť aorty zvyšuje centrálny aortový tlak u pacientov s hypertenziou
- Jak definovat osoby s vysokým rizikem pankreatického karcinomu
- Veľkosť LDL lipoproteínových partikúl u pacientov s náhlou mozgovocievnou príhodou
- Chronický zánět a metabolický syndrom
- Profylaxe a léčba antifosfolipidového syndromu – současné možnosti, úskalí a perspektivy do budoucna
- Pokrok v oblasti mnohočetného myelomu a vývoj souvisejícího laboratorního zázemí
- Jak v ambulantní péči neprošvihnout rozvíjející se kritické poruchy hemostázy
- Frekvence nových trombofilních mutací antitrombinu (SERPINC1) (IVS +141G>A), glykoproteinu GPVI (Ser219Pro) a cytochromu CYP4V2 (Lys259Gln) u zdravých osob středního věku v oblasti středních Čech
- Megakaryopoéza a geneze destiček
- Současné možnosti diagnostiky a léčby myelomové kostní nemoci v klinické praxi
- Změny kalcium-fosfátového metabolizmu při chronických nefropatiích
- Konečné stadium chronického onemocnění ledvin a metabolická acidóza
- Chronické ochorenie obličiek a vápniková homeostáza bunky
- Solit nebo nesolit při ledvinových chorobách? Ne více než quantum satis!
- Infarkt myokardu v mladom veku – naše výsledky a skúsenosti
- Vzťah mikroalbuminúrie a obezity u zdravých mladistvých – predbežné výsledky štúdie „Rešpekt pre zdravie“
- Kontrastová nefropatie a možnosti její prevence
- Terapeutický přístup ke krvácení v souvislosti se „starými“ a „novými“ antikoagulans
- Možnosti diagnostiky heparinem indukované trombocytopenie v České republice
- Získaná hemofilie A
- Vysokodávková léčba a přípravné režimy před transplantací krvetvorných buněk
- Trojkombinační léčba chronické hepatitidy C
- Požadavky na předoperační vyšetření z pohledu anesteziologa
- Fixní kombinace v léčbě hypertenze
- Farmakoterapie hypertenze po transplantaci srdce
- Snížení srdeční frekvence u srdečního selhání: změny funkce levé komory a kvalita života v podstudiích SHIFT
- Ischemické a neischemické příčiny elevace ST segmentu u pacientů s bolestí na hrudi: Systematický přehled literatury
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Infarkt myokardu v mladom veku – naše výsledky a skúsenosti
- Požadavky na předoperační vyšetření z pohledu anesteziologa
- Megakaryopoéza a geneze destiček
- Ischemické a neischemické příčiny elevace ST segmentu u pacientů s bolestí na hrudi: Systematický přehled literatury
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

