-
Medical journals
- Career
Frekvence nových trombofilních mutací antitrombinu (SERPINC1) (IVS +141G>A), glykoproteinu GPVI (Ser219Pro) a cytochromu CYP4V2 (Lys259Gln) u zdravých osob středního věku v oblasti středních Čech
Authors: J. Kvasnička 1; J. Hájková 1; P. Bobčíková 1; T. Kvasnička 1; D. Dušková 2; Š. Poletínová 2; V. Kieferová 2
Authors‘ workplace: Trombotické centrum a Centrální hematologické laboratoře, přednosta prof. MUDr. Jan Kvasnička, DrSc., Ústavu klinické biochemie a laboratorní diagnostiky 1. lékařské fakulty UK a VFN v Praze, přednosta prof. MUDr. Tomáš Zima, DrSc., MBA 1; Fakultní transfuzní oddělení VFN v Praze, přednostka prim. MUDr. Daniela Dušková 2
Published in: Vnitř Lék 2012; 58(7 a 8): 146-151
Category: 60th Birthday prof. MUDr. Miroslav Penka, CSc.
Overview
Cíl:
Primárním cílem bylo zjistit frekvenci alel a genotypů nových polymorfizmů spojovaných podle GWAS studií s výskytem žilní trombózy u zdravých osob kavkazské rasy v regionu středních Čech.Metody:
Genotypizace trombofilních mutací SERPINC1 IVS +141G>A, GP6 13254T>C a CYP4V2 (Lys259Gln) byla provedena u 1 527 zdravých osob pomocí robotické izolace DNA a následnou amplifikací PCR s analýzou křivky tání (LightCycler 480 System, Roche).Výsledky:
Frekvence rizikové alely A polymorfizmu SERPINC1 (IVS +141G>A) byla u sledovaného souboru 11,3 % a frekvence genotypů byla GG 78,36 %, GA 20,66 % a AA 0,98 %. Frekvence rizikové alely T polymorfizmu GP6 13254T>C byla 87,7 % a frekvence genotypů TT 77,14 %, TC 21,15 % a CC 1,70 %. Frekvence rizikové alely A polymorfizmu CYP4V2 (Lys259Gln) byla 65,2 % a frekvence genotypů CC 12,25 %, CA 45,12 % a AA 42,63 %. U obou pohlaví se tyto frekvence nelišily.Závěr:
Zjištěné frekvence genotypů a alel potvrzují relativně vysokou prevalenci dalších hereditárních trombofilií v regionu střední Čechy. Jejich klinický význam však zatím není plně znám.Klíčová slova:
SERPINC1 (IVS +141G>A) – GP6 (13254T>C) – CYP4V2 (Lys259Gln) – prevalence – střední ČechyÚvod
V etiopatogenezi tromboembolické nemoci (TEN) se, jak známo, neuplatňuje jen jeden rizikový faktor, ale jedná se o onemocnění multifaktoriální [1]. Dochází zde k interakci mezi různými získanými rizikovými faktory (jako je trauma, hormonální léčba, gravidita aj.) a vlivy genetickými [2]. Při určení výše rizika vzniku žilního tromboembolizmu spojeného s výskytem genetických mutací lze vycházet z výsledků zatím nejrozsáhlejší metaanalytické studie Gohila et al [3]. Zahrnuje výsledky 173 studií provedených celkem u 22 000 nemocných s TEN a u 37 000 kontrolních osob, ve kterých bylo vyšetřováno 28 polymorfizmů 21 genů spojovaných s žilní trombofilií. Z nich kritérium středně vysokého rizika TEN, to je OR > 1,5, splňoval vedle FV Leiden (FVL) a FII 20210G>A ještě polymorfizmus genu inhibitoru aktivátoru plazmingenu PAI-1 4G/5G (SERPINE1). Jejich frekvence v ČR byla již popsána [4–6]. V posledních třech letech však dochází k publikování výsledků vyšetření tzv. celogenomových studií (GWAS) s vyšetřením desítek až stovek tisíců známých jednonukleotidových polymorfizmů (SNP) v několikatisícových kohortách jedinců s prodělanou žilní trombózou a zdravé kontrolní skupiny [7,8]. K tomuto účelu byla použita i nová technologie vyšetření tzv. DNA microarray. Při tomto vyšetření je fragmentovaná DNA vyšetřovaného jedince přichycena k matrix a poté hybridizována s označenou sondou [9].
Cílem této naší studie bylo zjistit frekvenci genotypů a alel nových polymofizmů spojených s výskytem TEN, které byly nyní určeny v uvedených GWAS studiích: SERPINC1 (IVS +141G>A, rs2227589), GP6 (Ser219Pro, rs1613662) a CYP4V2 (Lys259Gln, rs13146272) v populaci zdravých osob středního věku v regionu střední Čechy. Z těchto údajů by pak již bylo možné vycházet při hledání jejich asociace s TEN u rizikových skupin obyvatelstva.
Metodiky
Výběr souboru zdravých osob ve věku 18–60 let
Do studie bylo náhodným výběrem zařazeno celkem 1 527 zdravých osob, z toho 1 450 anonymních dárců krve z fakultního transfuzního oddělení VFN v Praze. Vyšetření bylo provedeno v rámci studie Diagnostika a léčba geneticky podmíněných poruch II schválené etickou komisí 1. LF UK a VFN v Praze. Všichni byli evropského původu a pocházeli z oblasti města Prahy nebo Středočeského kraje ČR. S odběrem na vyšetření souhlasili. Další demografické údaje o této kohortě jsou uvedeny v tab. 1.
Table 1. Základní charakteristiky studované populace. 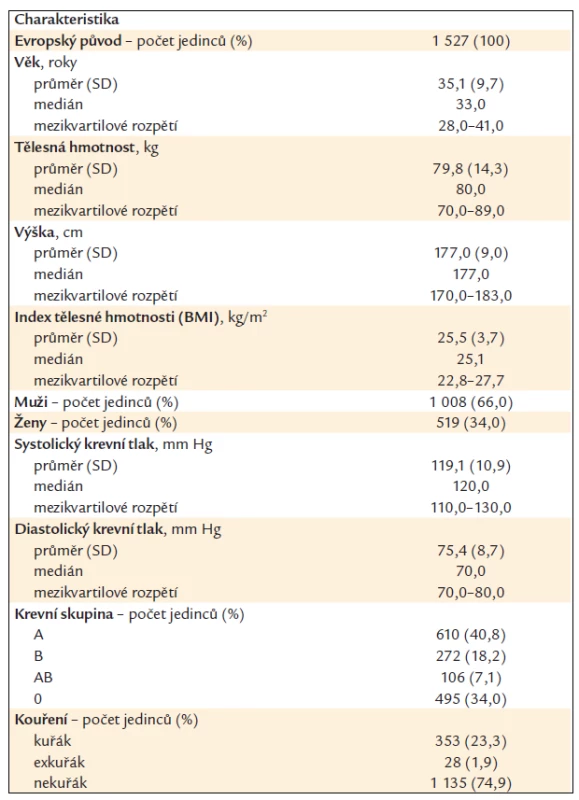
Genetické testy
Vyšetření polymorfizmů
Genomová DNA (deoxyribonukleová kyselina) byla extrahována z leukocytů periferní krve a izolována pomocí MagNA Pure LC Nucleic Acid Extraction systemTM se soupravou MagNA Pure DNA Isolation Kit ITM (vše Roche Diagnostics, Mannheim, Německo) podle návodu výrobce. Vstupní a výstupní objemy vzorku byly nastaveny na 100 μl. DNA byla izolována podle protokolu MagNA Pure High-Performance DNA ExtractionTM.
Sledované mutace byly stanoveny pomocí polymerázové řetězové reakce (PCR) následované analýzou křivky tání se specifickými fluorescenčně značenými hybridizačními sondami v procesu FRET (Fluorescence Resonance Energy Transfer). Vyšetření bylo provedeno na přístroji LightCycler® 480 System s použitím kitů LC® 480 Genotyping Master (vše Roche Diagnostics, Mannheim, Německo) podle instrukcí výrobce.
Sekvenčně specifické primery a fluorescenčně značené sondy byly navrženy ve spolupráci s firmou TIB MOLBIOL (Berlín, Německo), kde byly také na zakázku připraveny. Primery byly použity v 0,4μM koncentraci a fluorescenční sondy v 0,1μM, resp. 0,3μM koncentraci. Reakce proběhla v prostředí Mg2+ kationtů. V tab. 2 jsou uvedeny sekvence použitých primerů a sond a v tab. 3 jsou uvedeny parametry provedených PCR.
Table 2. Použité primery a sondy. 
Table 3. Parametry PCR reakce. 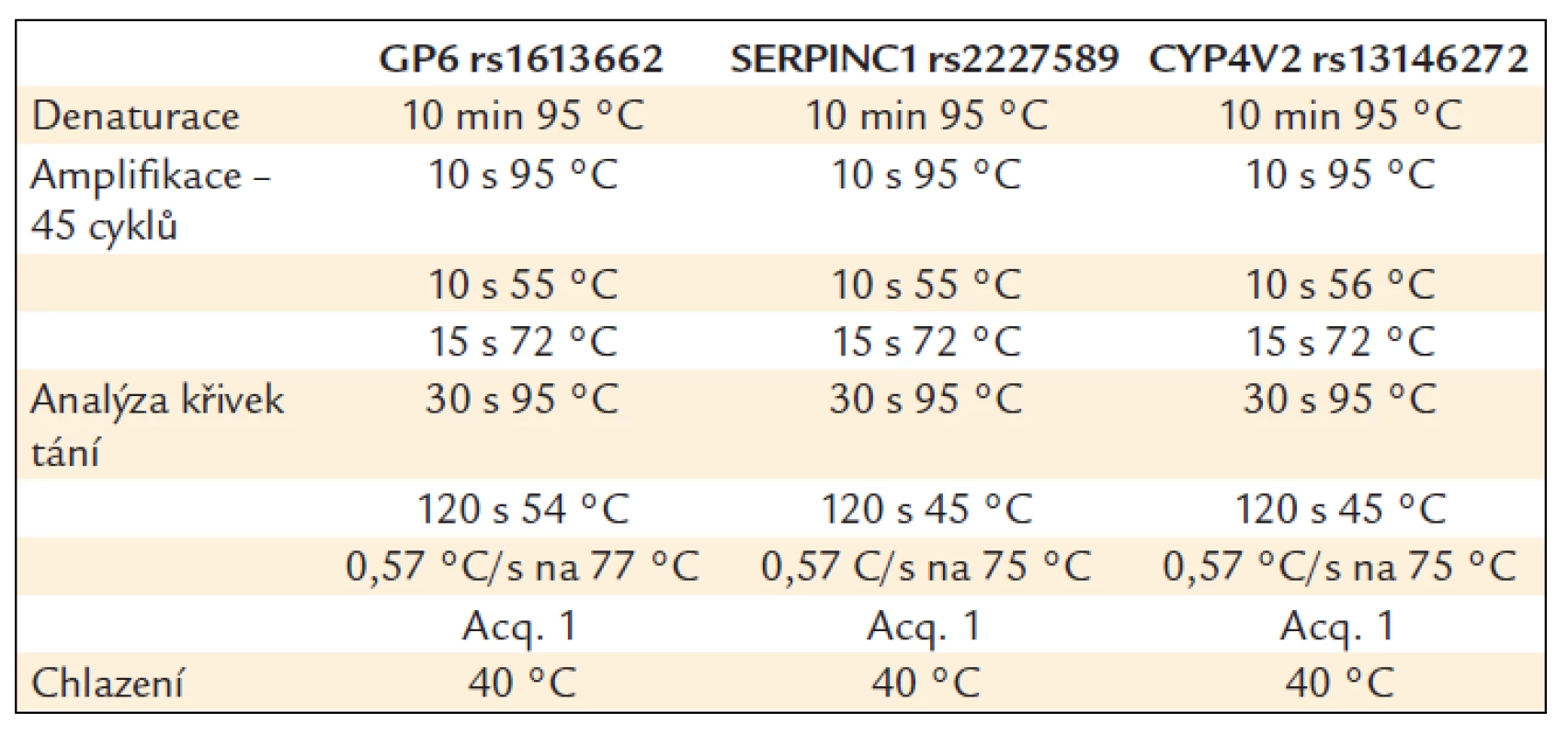
Statistické testy
Ke stanovení odchylky od Hardy-Weinbergova zákona (p > 0,05) byl použit χ2 test. Při nízkému zastoupení homozygotních mutací jsme použili přesnější variantu exact test. Interval 95% spolehlivosti byl kalkulován metodou dle Walda. Rozdíly mezi zastoupením genotypů a frekvencí alel mezi muži a ženami byly vyhodnoceny opět χ2 testem.
K výpočtu byl použit statistický program SAS, verze 9.2 (SAS Institute, NC, USA) s genetickým souborem.
Výsledky
Určené genotypy a frekvence alel SERPINC1 (IVS +141G>A, rs2227589), GP6 (Ser219Pro, rs1613662) a CYP4V2 (Lys259Gln, rs13146272) v celém souboru a poté zvlášť u žen a mužů jsou uvedeny v tab. 4–6. Všechny splňovaly požadavky Hardy-Weinbergovy rovnováhy.
Table 4. Frekvence genotypů a alel ve sledované české populaci. 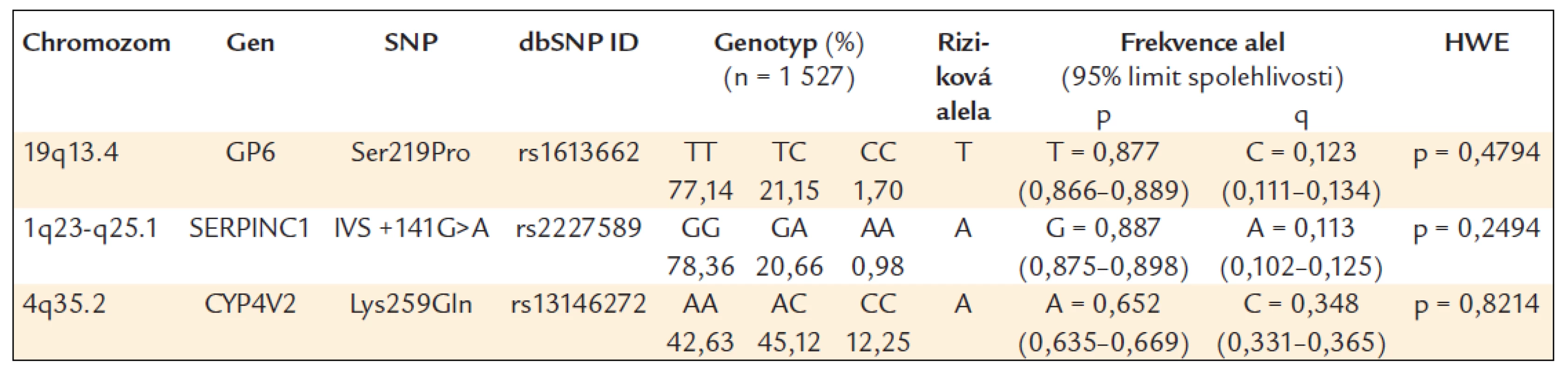
Poznámka: symboly genů, rs čísla, SNP typy a čísla chromozomů vycházejí z National Center for Biotechnology Information build 37.1
Table 5. Frekvence genotypů a alel ve sledované české populaci (muži). 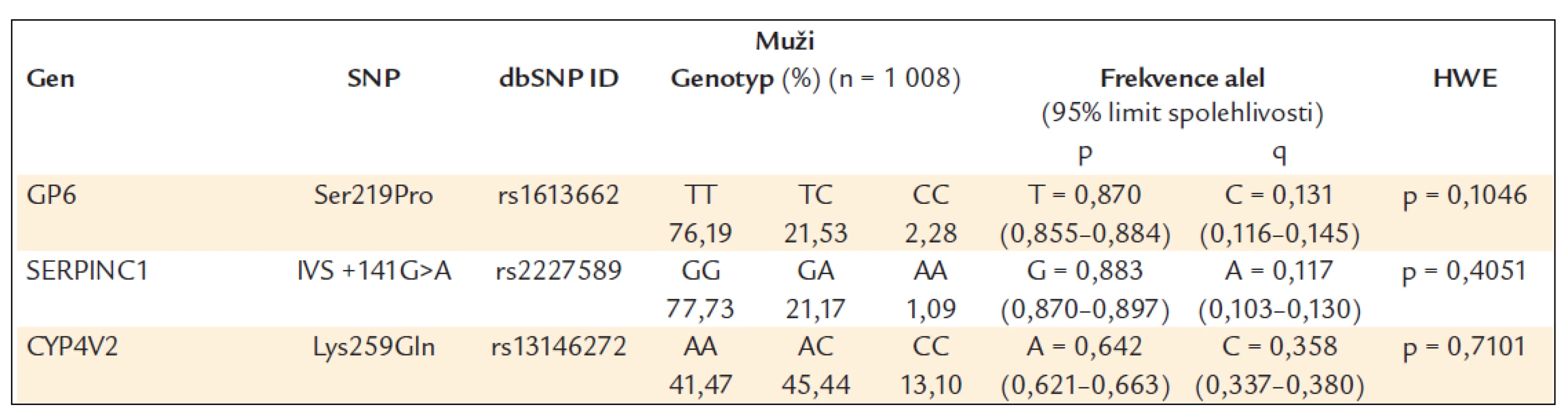
Poznámka: Symboly genů, rs čísla, SNP typy a čísla chromozomů vycházejí z National Center for Biotechnology Information build 37.1. Table 6. Frekvence genotypů a alel ve sledované české populaci (ženy). 
Poznámka: Symboly genů, rs čísla, SNP typy a čísla chromozomů vycházejí z National Center for Biotechnology Information build 37.1. Diskuze
Gen antitrombinu SERPINC1 (serpin peptidase inhibitor, clade C, member 1) je lokalizován na 1. chromozomu v oblasti q23–q25.1. Jeho polymorfizmus (SERPINC1, IVS + +141G>A, rs2227589) je podle výsledků studií LETS, MEGA-1 a MEGA-2 spojen s velmi nízkým rizikem žilního tromboembolizmu (zjištěné OR pro rizikovou minoritní alelu A bylo určeno 1,42; 1,24 a/nebo 1,29) [7]. V dalších studiích [8,10] však tento vztah již potvrzen nebyl. Výskyt rizikové alely A je u nositelů spojen s lehkým protrombogenním funkčním defektem – nižší inhibicí F Xa (genotyp AA 94,6 ± 8,4 %) a nižší koncentrací antitrombinu (AA 94,8 ± 5,6 %), než jaké byly zjištěny u jedinců s genotypem GG (97,0 ± 7,3 % a 99,5 ± 5,8 %, resp.) [10]. Frekvence genotypů SERPINC1 IVS +141G>A byla u zdravých osob evropského původu ve Španělsku [11] 80,5 % GG, 18,1 % GA a 1,3 % AA, s frekvencí alely A 12 %. V Nizozemsku [7] dle výsledků studie Mega-2 je to 82 % GG, 17 % GA a 1 % AA, s frekvencí alely A 11 %. U zdravých Američanů bílé rasy byla zjištěna frekvence minoritní alely 11 % s frekvencí genotypů CC 79,82 %, CT 19,13 % a TT 1,05 %. U zdravých černých Američanů byla ale frekvence minoritní alely nižší – 7 %, s nálezem frekvence genotypů CC 86,78 %, CT 12,35 % a TT 0,87 % [10]. V naší studii je nález frekvence minoritní rizikové alely A polymorfizmu IVS +141G>A 11,3 %, tedy podobný jako v Nizozemsku. Frekvence genotypů GG 78,36 %, GA 20,66 % a AA 0,98 % se pak blíží spíše nálezům genotypů u bílé rasy v USA.
Gen destičkového glykoproteinu VI (GP6) je lokalizován na 19. chromozomu v oblasti q13.4. Kóduje 319 aminokyselin tvořících transmembránový protein, řazený do imunoglobulinové (Ig) superrodiny I spolu s proteiny imunoreceptorů NK buněk a receptorů leukocytů Fc α. Glykoprotein VI se však v lidském organizmu vyskytuje jen na destičkách a na megakaryocytech, na jiných buňkách nikoli [12]. Je destičkovým receptorem pro kolagen a při styku destiček s volným kolagenem umožňuje jejich sekundovou aktivaci. Prostřednictvím GP VI tedy velmi rychle dochází při poranění cévy k vytvoření destičkového trombu. Bohužel také rychle navodí trombotizaci v koronárním řečišti po ruptuře aterosklerotického plátu. V kavkazské populaci se vyskytují různé varianty GP6, z nichž funkční rozdíly byly popsány mezi výskytem majoritního (a) a minoritního (b) haplotypu, který kóduje izoformy proteinu GP6 s aminokyselinami SKTQH nebo PEALN v pozici 219, 237, 249, 317 a 322, resp. mutace GP6 655T>C, 709A>G, 745A>G, 950A>T a 964C>A, které jsou v silné LD (D˘ 0,92) [13]. Výskyt minoritní alely GP6 (haplotypu b), resp. její představitelky mutace GP6 655T>C (Ser219Pro, 13254T>C, rs1613662), byl zkoumán především ve vztahu k aterotrombóze, zejména k infarktu myokardu, kde byly dosud popsány protichůdné nálezy. V řadě asociačních studií byl sice prokázán vztah polymorfizmu GP6 s infarktem myokardu u mladých osob [14–16] a s vyšší incidencí u žen [17], zejména pokud užívaly hormonální substituci v menopauze (studie HERS) [18]. Další velká studie SMILE [19] však tento vztah s infarktem u mužů a vznikem rekurencí kardiovaskulárních příhod nebo mortalitou (studie Leiden) nepotvrdila. V incidenci rekurence infarktu myokardu nebo nestabilní anginy pectoris však nebylo možné vyloučit vliv užívání, nebo neužívání aspirinu sledovanými osobami. Ve svém úsudku, že minoritní alela C polymorfizmu GP6 13254T>C není spojena s rizikem infarktu myokardu, se pak studie SMILE opírala i o výsledky laboratorního vyšetření, kdy výskyt minoritní alely byl spojen i s nižší aktivací destiček (expresí P-selektinu) po přidání agonisty GPVI. U nemocných s infarktem myokardu se totiž předpokládá, že zde ve vyšší míře cirkulují destičky aktivované po styku s kolagenem prasklého aterosklerotického plátu [20]. Nižší reaktivita po styku destiček s kolagenem byla při nálezu haplotypu b přisuzována snížené expresi GPVI na jejich povrchu [21]. Nyní však bylo zjištěno, že za tento funkční defekt je v destičkách s minoritní alelou GPVI odpovědná porucha přenosu aktivačního signálu na úrovni konstitučně aktivované Src-tyrozinové kinázy Fyn/Lyn v tzv. imunotyrozinovém aktivním motivu (ITAM) [22]. Co se však týká spojení výskytu mutace GP6 13254T>C, resp. minoritního haplotypu b, a žilního tromboembolizmu, byl v GWAS studiích [7,8] prokázán spíše jeho protektivní vliv s nálezem OR 0,80–0,87. Riziko žilního tromboembolizmu je tedy podle těchto výsledků GWAS studií spojeno s výskytem majoritního haplotypu a, tedy alely T (A) (OR 1,5–1,36). V opakované studii provedené nyní Austinem et al [10] to však v souboru Američanů evropské rasy potvrzeno nebylo, OR pro majoritní alelu bylo jen 1,04. U zdravých Francouzů evropské rasy byla nalezena frekvence majoritní alely v 84–85 % a minoritní alely 15–16 %. Podobný výskyt alel T v 85 % a C v 15 % u osob evropské rasy nalézají i Watkins et al [13]. V nizozemské populaci zdravých osob byl výskyt majoritní alely opět prakticky stejný 80–82 % a minoritní v 18–20 %. Ve studii MEGA-2 byl dále uveden i výskyt genotypů TT 68 %, TC v 29 % a CC ve 3 %. I u bílých Američanů byla podobná frekvence majoritní alely (84 %) s frekvencí genotypu TT 71,04 %, TC 26,40 % a CC 2,56 %. U Afroameričanů však frekvence majoritní alely T byla 76 %, to je nižší než u evropské rasy, s výskytem genotypů TT 58,71 %, TC 34,50 % a CC 6,79 %. V naší studii jsme u zdravé populace nalezli frekvenci „rizikové“ majoritní alely T (A) 87,7 %, minoritní C (G) 12,3 %, s tímto zastoupením genotypů AA (TT) 77,14 %, AG (TC) 21,15 % a GG (CC) 1,7 %. Tyto nálezy odpovídají frekvenci nalezené v populaci evropského etnika s lehkou převahou výskytu majoritní alely a naopak poklesu frekvence výskytu minoritní alely.
Také další polymorfizmus CYP4V2 rs13146272 (Lys259Gln, záměna alel A>C) je spojován s rizikem žilního tromboembolizmu. Nalézá se v genu cytochromu P450, jeho rodiny 4, podrodiny V, polypeptidu 2. Tento gen však dosud vůbec nebyl spojován s hemokoagulací nebo s funkcí krevních destiček. Nachází se na 4. chromozomu v oblasti q35.2 a jím kódovaný protein se podílí na oxidaci mastných kyselin. Účastní se např. přeměny prekurzorů mastných kyselin na n-3 poly-nenasycené mastné kyseliny (n-3PUFA) [23]. Dosud byly známy jen mutace CYP4V2 vyvolávající metabolickou poruchu mastných kyselin spojenou s Biettiho progresivní krystalickou dystrofií oční rohovky a retiny a postupnou slepotou. Tato porucha tukového metabolizmu se však týká i jiných tkání, kde je spojena s vyšším obsahem triglyceridů a cholesterolu v buňkách. Lipidové inkluze se přitom mohou nalézt i v lymfocytech [24]. Nyní však ve všech 3 výše uvedených asociačních studiích [7,8,10] bylo potvrzeno, že minoritní alela C nového polymorfizmu genu CYP4V2, označeného v databazi SNP jako rs13146272 (Lys259Gln), se u osob s žilní trombózou vyskytuje v nižším počtu než v kontrolním souboru. Za rizikovou alelu pro žilní trombózu lze tedy v tomto případě považovat majoritní alelu A, kdy je její výskyt spojen s OR pro TEN ve výši 1,24 [7]. V tomto případě se však nepředpokládá, že je tato asociace vyvolána metabolickou poruchou mastných kyselin, ale že patrně bude spjata s aktivitou koagulačního faktoru FXI, jehož gen je na čtvrtém chromozomu umístěn v blízkosti genu CYP4V2 [25]. Li et al [26] pomocí rozsáhlé haplotypové studie provedené v oblasti 4q35.2 totiž prokázali, že dva polymorfizmy genu F11 rs2289252 a rs2036914, spojené s vyšší hladinou FXI, jsou též přítomny v nalezených haplotypech obsahujících rizikovou alelu A polymorfizmu CYP4V2 rs13146272. K tomuto nálezu došli i přes velmi nízkou LD (r2 ≤ 0,12) rs13146272 v CYP4V2 s rs2289252 a rs2036914 genu F11. Vlastní trombofilii zde tedy bude vyvolávat vyšší hladina F11 spojená s oběma uvedenými polymorfizmy F11, se kterými se riziková alela A rs13146272 CYP4V2 u jejich nosičů vyskytuje společně. Mutace CYP4V2 (Lys259Gln) je zde tedy jen markerem vyššího rizika vzniku žilního tromboembolizmu. V kontrolních souborech osob bez žilního tromboembolizmu byly u jedinců evropského etnika zjištěny tyto frekvence výskytu rizikové majoritní alely A (rs13146272 CYP4V2): u Nizozemců 64–65 % a frekvence minoritní alely 35–36 %, s frekvencí genotypů (Studie MEGA-2) CC 13 %, CA 45 % a AA 42 % [7]. U Francouzů byla frekvence rizikové majoritní alely A 63–67 % a minoritní alely C 33–37 % (s OR 0,84) [8] a u bílých Američanů byla frekvence alely A 62 % a alely C 38 % s výskytem genotypů CC 15,43 %, CA 45,84 % a AA 38,73 %. U amerických černochů byl výskyt podobný, majoritní rizikové alely A 61 % a minoritní alely C 39 % s výskytem genotypů CC 14,69 %, CA 48,60 % a AA 36,71 %. V naší populaci jsme došli k těmto výsledům: frekvence majoritní rizikové alely A je 65,2 %, minoritní alely C je 34,8 % a frekvence genotypů CC 12,25 %, CA 45,12 % a AA 42,63 %. Tedy k velmi podobným nálezům jako v dalších populací evropského původu.
Závěr
Z výše uvedeného tedy závěrem vyplývá, že i v běžné české populaci je poměrně vysoký nález frekvencí nových trombofilních polymorfizmů, které byly zjištěny celogenomovými asociačními studiemi. Z výsledků citovaných studií však je zřejmé, že po zjištění OR je výše rizika TEN u osob s těmito mutacemi poměrně nízká. Předpokládá se tedy, že vlastní klinický význam tohoto nálezu bude ještě předmětem dalšího studia, zejména z hlediska možných kombinací jejich výskytu se známými trombofilními mutacemi, jako je mutace FV Leiden, nebo mutace FII.
Seznam zkratek
SNP (Single Nucleotid Polymorphism) – jednonukleotidový polymorfizmus
dbSNP – databáze SNP
rs – reference SNP ID
p – frekvence „major“ alely
q – frekvence „minor“ alely
HWE – Hardy-Weinbergovo equilibrium
FII – koagulační faktor II, protrombin
FVL – faktor V Leiden
SERPINE1 – serpin peptidase inhibitor, clade E (inhibitor aktivátoru plazminogenu (PAI-1)
PCR (Polymerase Chain Reaction) – polymerázová řetězová reakce
TEN – tromboembolická nemoc
OR (Odds Ratio) – poměr šancí
GWAS (Genome Wide Association Study) – celogenomové asociační studie
LD (Linkage Disequilibrium) – vazebná nerovnováha
Studie byla podpořena finančními prostředky z RVO – VFN 64165/2012 a IGA MZ ČR NT 11176-5.
doc. MUDr. Tomáš Kvasnička, CSc.
e-mail: tomas.kvasnicka@seznam.cz
Doručeno do redakce: 18. 5. 2012
Sources
1. Rosendaal FR. Venous thrombosis: a multicausal disease. Lancet 1999; 353 : 1167–1173.
2. Margaglione M, Grandone E. Population genetics of venous thromboembolism. A narrative review. Thromb Haemostas 2011; 105 : 221–231.
3. Gohil R, Peck G, Sharma P. The genetics of venous thromboembolism. A meta-analysis involving approximately 120,000 cases and 180,000 controls. Thromb Haemost 2009; 102 : 360–370.
4. Matýšková M, Paseka J, Vorlová Z et al. Prevalence of factor V Leiden mutation in healthy women. In: Scharrer I, Schramm W (eds). 29. Hämophilie Symposion Hamburg1998, Berlin--Heidelberg: Springer Verlag 1999 : 309–311.
5. Hrachovinová I, Vorlová Z, Matýšková M et al. Thrombotic risk of the prothrombin gene G20210A mutation and clinical features of thrombophilia in 50 carriers of mutation. XVIIth Congress of the ISTH, Washington D.C., USA. Thromb Haemostas 1999; (Suppl): Abstract No 2060, 652.
6. Bucková D, Izakovicová-Hollá L, Vácha J. Polymorphism 4G/5G in the plasminogen activator inhibitor-1 (PAI-1) gene is associated with IgE-mediated allergic diseases and asthma in the Czech population. Allergy 2002; 57 : 446–448.
7. Bezemer ID, Bare LA, Doggen CJ et al. Gene variants associated with deep vein thrombosis. JAMA 2008; 299 : 1306–1314.
8. Tregouet DA, Heath S, Saut N et al. Common susceptibility alleles are unlikely to contribute as strongly as the FV and ABO loci to VTE risk: results from a GWAS approach. Blood 2009; 113 : 5298–3303.
9. Manolio TA. Genomewide association studies and assessment of the risk of disease. N Engl J Med 2010; 363 : 166–176.
10. Austin H, De Staercke C, Lally C et al. New gene variants associated with venous thrombosis: a replication study in White and Black Americans. J Thromb Haemost 2011; 9 : 489–495.
11. Antón AI, Teruel R, Corral J et al. Functional consequences of the prothrombotic SERPINC1 rs2227589 polymorphism on antithrombin levels. Haematologica 2009; 94 : 589–592.
12. Clemetson JM, Polgar J, Magnenat E et al. The platelet collagen receptor glycoprotein VI is a member of the immunoglobulin superfamily closely related to FcalphaR and the natural killer receptors. J Biol Chem 1999; 274 : 29019–29024.
13. Watkins NA, O’Connor MN, Rankin A et al. Definition of novel GP6 polymorphisms and major difference in haplotype frequencies between populations by a combination of in-depth exon resequencing and genotyping with tag single nucleotide polymorphisms. J Thromb Haemost 2006; 4 : 1197–1205.
14. Croft SA, Samani NJ, Teare MD et al. Novel platelet membrane glycoprotein VI dimorphism is a risk factor for myocardial infarction. Circulation 2001; 104 : 1459–1463.
15. Ollikainen E, Mikkelsson J, Perola M et al. Platelet membrane collagen receptor glycoprotein VI polymorphism is associated with coronary thrombosis and fatal myocardial infarction in middle-aged men. Atherosclerosis 2004; 176 : 95–99.
16. Takagi S, Iwai N, Baba S et al. A GPVI polymorphism is a risk factor for myocardial infarction in Japanese. Atherosclerosis 2002; 165 : 397–398.
17. Motovska Z, Kvasnicka J, Widimsky P et al. Platelet glycoprotein GP VI 13254C allele is an independent risk factor of premature myocardial infarction. Thromb Res 2010; 125: e61–e64.
18. Bray PF, Howard TD, Vittinghoff E et al. Effect of genetic variations in platelet glycoproteins Ibalpha and VI on the risk for coronary heart disease events in postmenopausal women taking hormone therapy. Blood 2007; 109 : 1862–1869.
19. Snoep JD, Gaussem P, Eikenboom JC et al. The minor allele of GP6 13254T>C is associated with decreased platelet activation and a reduced risk of recurrent cardiovascular events and mortality: results from the SMILE-Platelets project. J Thromb Haemost 2010; 8 : 2377–2384.
20. Parguiña AF, Grigorian-Shamagian L, Agra RM et al. Variations in platelet proteins associated with ST-elevation myocardial infarction: novel clues on pathways underlying platelet activation in acute coronary syndromes. Arterioscler Thromb Vasc Biol 2011; 31 : 2957–2964.
21. Joutsi-Korhonen L, Smethurst PA, Rankin A et al. The low frequency allele of the platelet collagen signalling receptor glycoprotein VI is associated with reduced functional responses and expression. Blood 2003; 101 : 4372–4379.
22. Trifiro E, Williams SA, Cheli Y et al. The low--frequency isoform of platelet glycoprotein VIb attenuates ligand-mediated signal transduction but not receptor expression or ligand binding. Blood 2009; 114 : 1893–1899.
23. http//: www.Genecards.org/cgi-bin/carddisp.pl?gene=CYP4V2.
24. Li A, Jiao X, Munier FL et al. Bietti crystalline corneoretinal dystrophy is caused by mutations in the novel gene CYP4V2. Am J Hum Genet 2004; 74 : 817–826.
25. Bezemer A, Morange PE, Tregouet DA. Lessons from genome-wide association studies in venous thrombosis. J Thromb Haemost 2011; 9 (Suppl 1): 258–264.
26. Li Y, Bezemer ID, Rowland CM et al. Genetic variants associated with deep vein thrombosis: the F11 locus. J Thromb Haemost 2009; 7 : 1802–1808.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue 7 a 8-
All articles in this issue
- Syndróm nepokojných nôh u dialyzovaných pacientov
- Antagonisty aldosterónu v liečbe chronického srdcového zlyhávania
- Manažment stabilnej anginy pectoris a iných foriem chronickej kardiovaskulárnej artériovej choroby
- Antiaterogénny účinok HDL subpopulácií u jedincov s novodiagnostikovanou končatinovocievnou artériovou chorobou
- Koncentrace sodíku v dialyzačním roztoku – důležitý, ale opomíjený parametr hemodialýzy u nemocných s chronickým selháním ledvin
- Oxidačný stres a antioxidačné systémy u hemodialyzovaných chorých
- Farmakogenetické aspekty liečby orálnymi antidiabetikami
- Refeeding syndrom u mladého pacienta s anxiózně-depresivní poruchou
- Detekce KRAS a jeho mutace v biopsii pokročilého kolorektálního karcinomu při koloskopii
- Tuhosť aorty zvyšuje centrálny aortový tlak u pacientov s hypertenziou
- Jak definovat osoby s vysokým rizikem pankreatického karcinomu
- Veľkosť LDL lipoproteínových partikúl u pacientov s náhlou mozgovocievnou príhodou
- Chronický zánět a metabolický syndrom
- Profylaxe a léčba antifosfolipidového syndromu – současné možnosti, úskalí a perspektivy do budoucna
- Pokrok v oblasti mnohočetného myelomu a vývoj souvisejícího laboratorního zázemí
- Jak v ambulantní péči neprošvihnout rozvíjející se kritické poruchy hemostázy
- Frekvence nových trombofilních mutací antitrombinu (SERPINC1) (IVS +141G>A), glykoproteinu GPVI (Ser219Pro) a cytochromu CYP4V2 (Lys259Gln) u zdravých osob středního věku v oblasti středních Čech
- Megakaryopoéza a geneze destiček
- Současné možnosti diagnostiky a léčby myelomové kostní nemoci v klinické praxi
- Změny kalcium-fosfátového metabolizmu při chronických nefropatiích
- Konečné stadium chronického onemocnění ledvin a metabolická acidóza
- Chronické ochorenie obličiek a vápniková homeostáza bunky
- Solit nebo nesolit při ledvinových chorobách? Ne více než quantum satis!
- Infarkt myokardu v mladom veku – naše výsledky a skúsenosti
- Vzťah mikroalbuminúrie a obezity u zdravých mladistvých – predbežné výsledky štúdie „Rešpekt pre zdravie“
- Kontrastová nefropatie a možnosti její prevence
- Terapeutický přístup ke krvácení v souvislosti se „starými“ a „novými“ antikoagulans
- Možnosti diagnostiky heparinem indukované trombocytopenie v České republice
- Získaná hemofilie A
- Vysokodávková léčba a přípravné režimy před transplantací krvetvorných buněk
- Trojkombinační léčba chronické hepatitidy C
- Požadavky na předoperační vyšetření z pohledu anesteziologa
- Fixní kombinace v léčbě hypertenze
- Farmakoterapie hypertenze po transplantaci srdce
- Snížení srdeční frekvence u srdečního selhání: změny funkce levé komory a kvalita života v podstudiích SHIFT
- Ischemické a neischemické příčiny elevace ST segmentu u pacientů s bolestí na hrudi: Systematický přehled literatury
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Infarkt myokardu v mladom veku – naše výsledky a skúsenosti
- Požadavky na předoperační vyšetření z pohledu anesteziologa
- Megakaryopoéza a geneze destiček
- Ischemické a neischemické příčiny elevace ST segmentu u pacientů s bolestí na hrudi: Systematický přehled literatury
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

