-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaDyslipidemie – známá neznámá
Dyslipidemia – the known unknown
Dyslipidemia (DLP) is the most important risk factor for atherosclerotic cardiovascular disease (ASCVD) and, in the context of severe hypertriglyceridemia (TG > 10 mmol/l), a risk factor for the development of acute pancreatitis. The prevalence of DLP is very high, but their control, especially among the patients at highest risk, is often inadequate. When diagnosing DLP, we should always exclude its possible secondary aetiology (e.g. DLP in the context of hypothyroidism, diabetes, ...). Based on the assessment of the overall CV risk (according to SCORE2/SCORE2-OP or according to the comorbidities of the individual), target values for blood lipids, especially LDL-cholesterol, are determined according to the risk category. The basis of the management of DLP in the prevention of ASCVD is dietary and regimen measures, followed by adequate lipid-lowering therapy in indicated cases. As of April 2023, the portfolio of lipid-lowering medication has been expanded to include inclisiran (small interfering RNA against proprotein convertase subtilisin/kexin type 9 (PCSK9)), which is administered directly in cardiologists‘ and internists‘ outpatient clinics, ensuring 100% adherence. In severe hypertriglyceridaemia, fibrate monotherapy may be indicated in addition to dietary and regimen measures; if this treatment fails, some patients may be offered lomitapide, volanesorsen or evinacumab as part of clinical trials or specific treatment programmes if very strict indication criteria are met.
Keywords:
dyslipidemia – cardiovascular risk – acute pancreatitis – atherosclerotic cardiovascular disease – inclisiran
Autoři: Martin Šatný
Působiště autorů: Centrum preventivní kardiologie, 3. interní klinika – klinika endokrinologie a metabolismu 1. LF UK a VFN v Praze
Vyšlo v časopise: Vnitř Lék 2023; 69(5): 305-310
Kategorie: Přehledové články
doi: https://doi.org/10.36290/vnl.2023.060Souhrn
Dyslipidemie (DLP) představují nejvýznamnější rizikový faktor aterosklerotických kardiovaskulárních onemocnění (ASKVO) a v kontextu těžké hypertriglyceridemie (TG > 10 mmol/l) také rizikový faktor rozvoje akutní pankreatitidy. Prevalence DLP je velmi vysoká, avšak jejich kontrola, a to zejména u nejrizikovějších nemocných, často nedostatečná. Diagnostikujeme-li DLP, vždy bychom měli v úvodu vyloučit její možnou sekundární etiologii (např. DLP v rámci hypotyreózy, diabetes mellitus…). Na základě zhodnocení celkového KV rizika (dle SCORE2/SCORE2-OP či dle komorbidit daného jedince) jsou určeny dle příslušné kategorie rizika cílové hodnoty krevních lipidů, zejména pak LDL-cholesterolu. Základem managementu DLP v prevenci ASKVO jsou dietní a režimová opatření, na která v indikovaných případech navazuje adekvátní hypolipidemická terapie. Nově od dubna 2023 se portfolio hypolipidemik rozšířilo o inklisiran (malá interferující RNA proti proprotein konvertáze subtilisin/kexin typu 9 (PCSK9)), jež je podáván přímo v ambulancích kardiologů a internistů, čímž je zajištěna 100% adherence. Při těžké hypertriglyceridemii může být indikována nad rámec dietních a režimových opatření také monoterapie fibrátem, pokud tato léčba selhává, lze některým pacientům v rámci klinických studií či specifických léčebných programů při splnění velmi přísných indikačních kritérií nabídnout lomitapid, volanesorsen či evinakumab.
Klíčová slova:
dyslipidemie – kardiovaskulární riziko – akutní pankreatitida – inklisiran – aterosklerotická kardiovaskulární onemocnění
Kdy hovoříme o dyslipidemiích?
Dyslipidemie (DLP) představují metabolické odchylky spojené s kvantitativními, ale často také kvalitativními změnami lipidů a lipoproteinových částic.
Dyslipidemie jsou častým onemocněním…
Přesná epidemiologická data stran výskytu DLP v populaci jsou velmi obtížně získatelná, jelikož se v kontextu DLP hovoří spíše o cílových hodnotách krevních lipidů než o DLP jako takových. Z observačních studií však vyplývá, že prevalence DLP je velmi vysoká – dle některých zdrojů 50–65 % dospělé populace nemá optimální parametry lipidového spektra (1, 2).
Tab. 1. Primární, geneticky podmíněné DLP, upraveno dle (6) 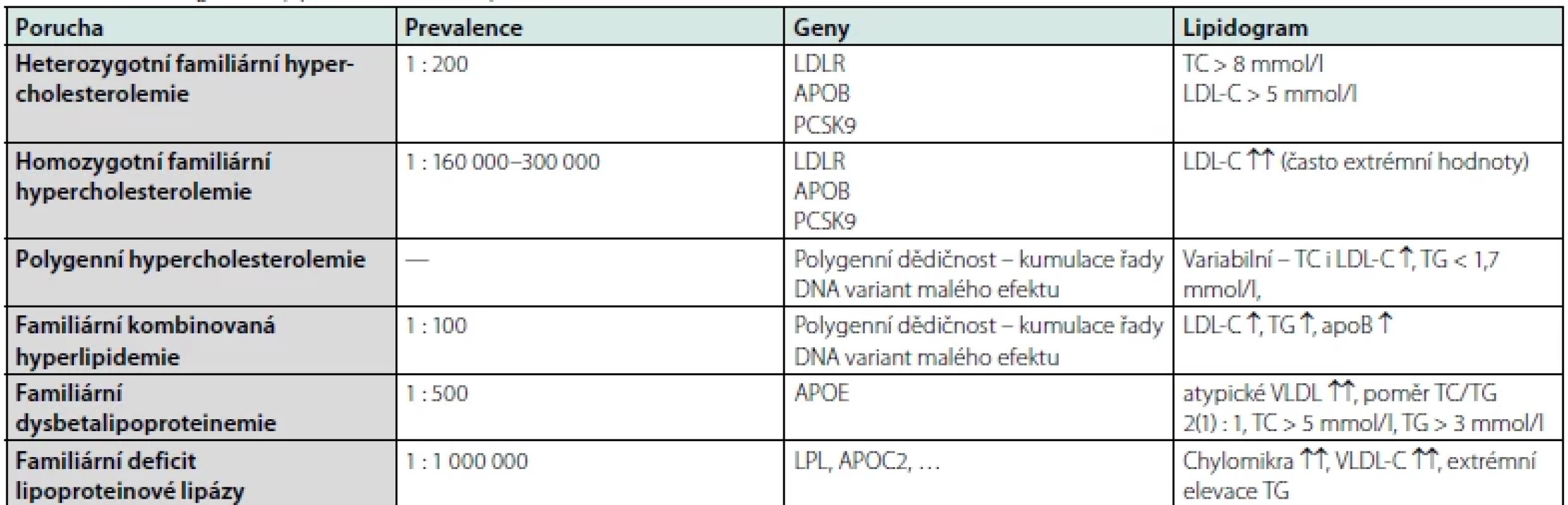
LDLR – gen pro LDL receptor, APOB – gen pro apolipoprotein B, PCSK9 – gen pro proprotein konvertázu subtilisin/kexin typu 9, APOE – gen pro apolipoprotein E, LPL – gen pro lipoproteinovou lipázu, APOC2 – gen pro apolipoprotein C2 (kofaktor LPL), LDL – low density lipoprotein, VLDL – very low density lipoprotein, LDL-C – LDL-cholesterol, VLDL-C – VLDL-cholesterol, TC – celkový cholesterol, TG – triglyceridy Tab. 2. Některé stavy s možným výskytem sekundární DLP, upraveno dle (8) 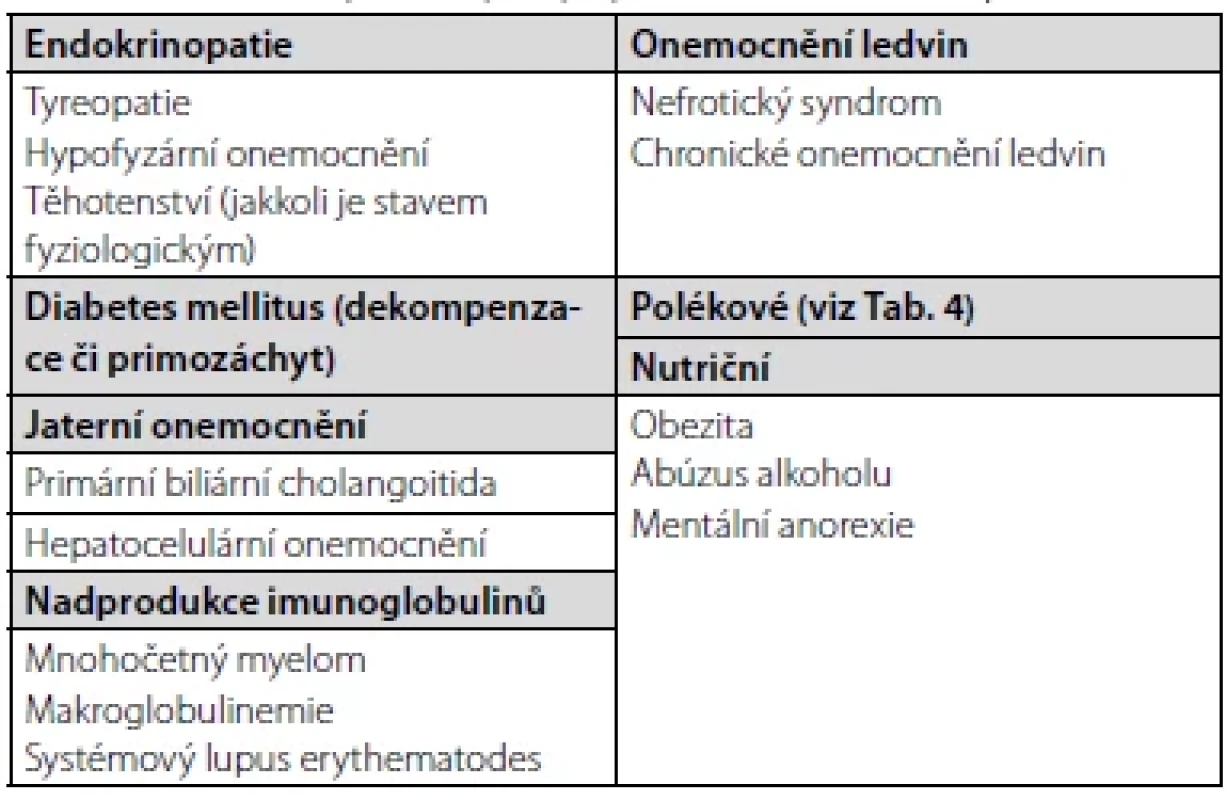
Tab. 3. Fredricksonova klasifikace DLP, upraveno dle (9) 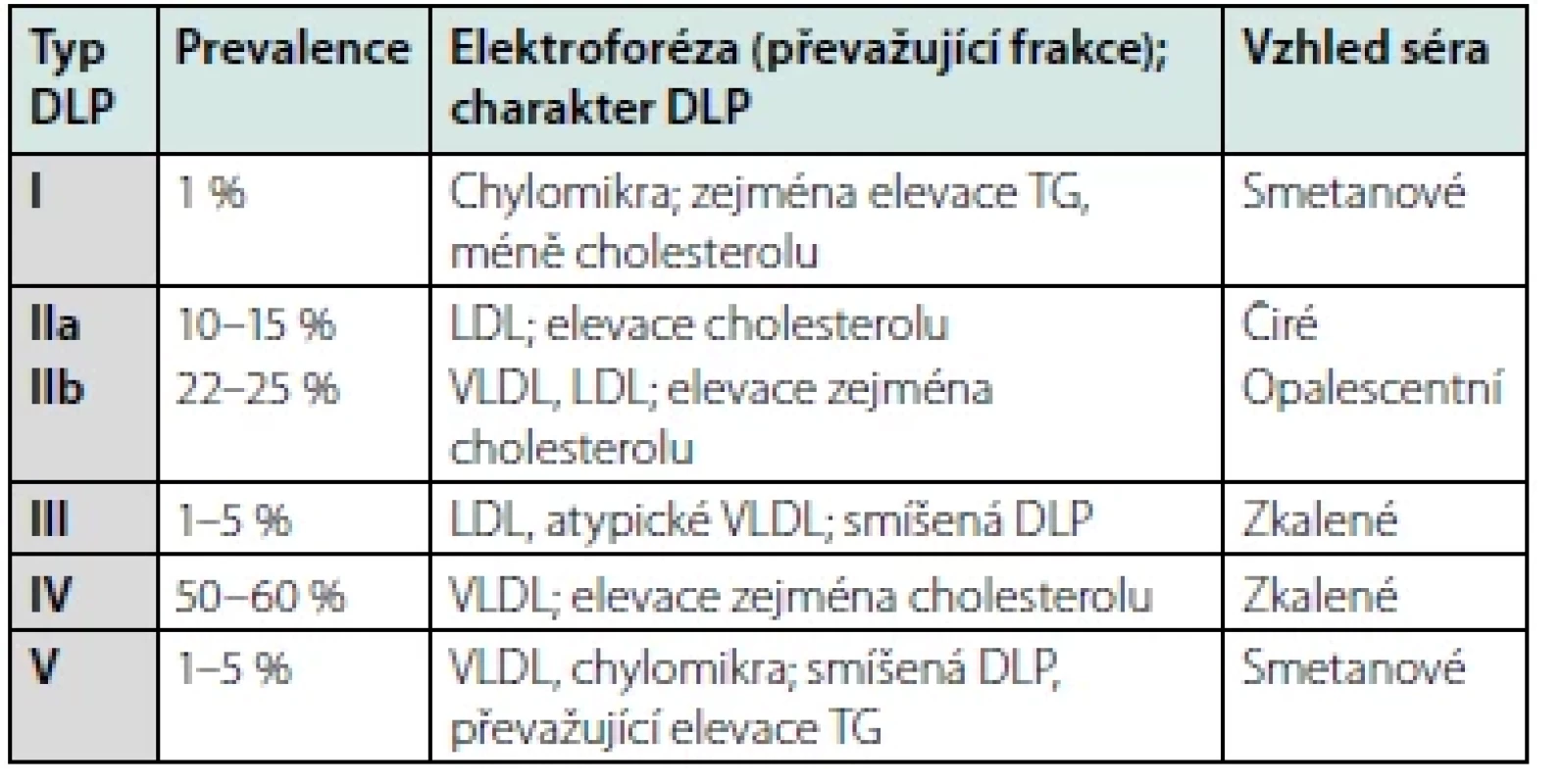
Dyslipidemie jako rizikový faktor
Dyslipidemie, respektive lipoproteinové částice obsahující cholesterol a apolipoprotein B (apoB, zejména LDL-částice), hrají klíčovou roli v procesu aterogenního postižení cévní stěny a v současnosti jsou považovány za jediný kauzální rizikový faktor (RF) aterosklerotických kardiovaskulárních (KV) onemocnění (ASKVO), přičemž ostatní RF, jako např. arteriální hypertenze, kouření či diabetes mellitus (DM), jsou označovány pouze za iniciátory či akcelerátory aterogeneze (3, 4).
V kontextu těžké hypertriglyceridemie (HTG, hladina triglyceridů (TG) opakovaně > 10 mmol/l) představuje DLP také významný RF rozvoje akutní pankreatitidy, kdy se uvádí, že riziko pankreatitidy u nemocných s TG > 10 mmol/l může být až 350× vyšší ve srovnání s populací pacientů s TG < 9 mmol/l (5).
Jak klasifikujeme dyslipidemie?
První – základní – klasifikací je rozdělení DLP dle etiologie, tj. na primární – geneticky determinované (mono-, oligoči polygenní), a sekundární – vznikající v důsledku jiných onemocnění, patologických stavů či exogenních příčin. Jakkoli nutno podotknout, že u většiny DLP se předpokládá etiologie kombinovaná, tj. vrozená predispozice agravovaná dalšími faktory, např. vlivem životního stylu. Pro přehlednost je problematika sumarizována v tabulkách 1, 2 (6–8).
Jako zdaleka nejčastější se užívá rozdělení dle fenotypu, kdy je rozlišována izolovaná hypercholesterolemie, izolovaná HTG a smíšená DLP.
Poslední, dnes již nepoužívanou, modalitou je dělení dle původní Fredricksonovy klasifikace, jež odlišuje 5 typů DLP v závislosti na rozdílné elektroforetické pohyblivosti dílčích lipoproteinových částic a vzhledu séra (Tab. 3) (9).
Základem je vyloučení sekundární etiologie…
Zachytíme-li nově u pacienta DLP, vždy bychom měli v úvodu vyloučit její možnou sekundární etiologii. Základem je důkladné odebrání anamnestických dat se zaměřením na:
- osobní anamnézu – pátráme po možných onemocněních, jež by mohla vést k manifestaci DLP (typicky hypotyreóza, primozáchyt či dekompenzace DM – více Tab. 2), či přítomnosti již manifestního ASKVO; cenný je také dotaz na břišní diskomfort či anamnézu (recidivujících) pankreatitid,
- rodinnou anamnézu (RA) – pozitivní RA definujeme jako manifestaci ASKVO do 55 let u muže, resp. 60 let u ženy,
- farmakologickou anamnézu – celá řada běžně užívaných léků může vést k alteraci lipidogramu, podrobněji Tab. 4,
- abúzus – zcela zásadní je informace o konzumaci alkoholu a tabákových výrobků (8).
Nedílnou součástí vyšetření pacienta s DLP musí být také zhodnocení jeho subjektivních obtíží (výskytu dušnosti, stenokardií, klaudikací, kolapsů, vertiga, recidivujících bolestí břicha…) a fyzikálního nálezu. Pátráme po klinických projevech DLP (kožní – xantelazmata, xantomy; oční – arcus corneae lipoides – u mladších 45 let je spojen s vysokou pravděpodobností těžké DLP), které jsou sice vzácné, ale často patognomické. Vyšetřujeme pulzace a šelesty nad karotidami či femorálními tepnami (6–8).
Laboratorní odběry bychom měli provádět ideálně nalačno, alespoň 2× po sobě v rozestupu 2 týdnů, a to v době bez jiného interkurentního onemocnění či v době co nejlepší kompenzace přidružených komorbidit, zejména DM či hypotyreózy. Laboratorní vyšetření by mělo zahrnovat:
- lipidogram – celkový cholesterol, TG, LDL-cholesterol (LDL-C), HDL-cholesterol, apoB (zejména v kontextu inzulinové rezistence),
- 1× za život má být změřen lipoprotein(a) (Lp(a)),
- krevní obraz + differenciál,
- základní iontogram (natrium, kalium, chloridy),
- renální parametry (urea, kreatinin, odhad glomerulární filtrace),
- glykemii, resp. glykovaný hemoglobin,
- jaterní testy (aspartátaminotransferáza (AST), alaninaminotransferáza (ALT), gamaglutamiltransferáza (GGT), alkalická fosfatáza (ALP), bilirubin),
- thyreostimulační hormon (TSH),
- celkovou bílkovinu, albumin,
- vyšetření moči (chemicky, sediment),
- posouzení abúzu alkoholu – stanovení ethanolu v krvi, izolovaně vyšší GGT při normálním ALP, ethylglukuronid v moči či karbohydrát-deficientní transferin.
Je-li vyloučena možná sekundární DLP, můžeme pomýšlet na některou z DLP primárních (viz Tab. 1). Nejčastěji se setkáváme s pacienty s polygenní DLP (prevalence vysoká, avšak není jasně stanovena), familiární hypercholesterolemií (FH, 1 : 200) či familiární kombinovanou hyperlipidemií (1 : 100); obecně – nemocní s primární DLP by měli být vyšetřeni v některém z lipidových center, resp. ambulancí (seznam viz webové stránky www.athero.cz), kde je dostupná nejen komplexní léčebně preventivní péče, ale také možnost genetického vyšetření a navazujícího tzv. kaskádového screeningu, tj. dovyšetření a intervence případné DLP u rodinných příslušníků (6–8).
Tab. 4. Vliv podávané medikace na hladiny krevních lipidů, upraveno dle (8) 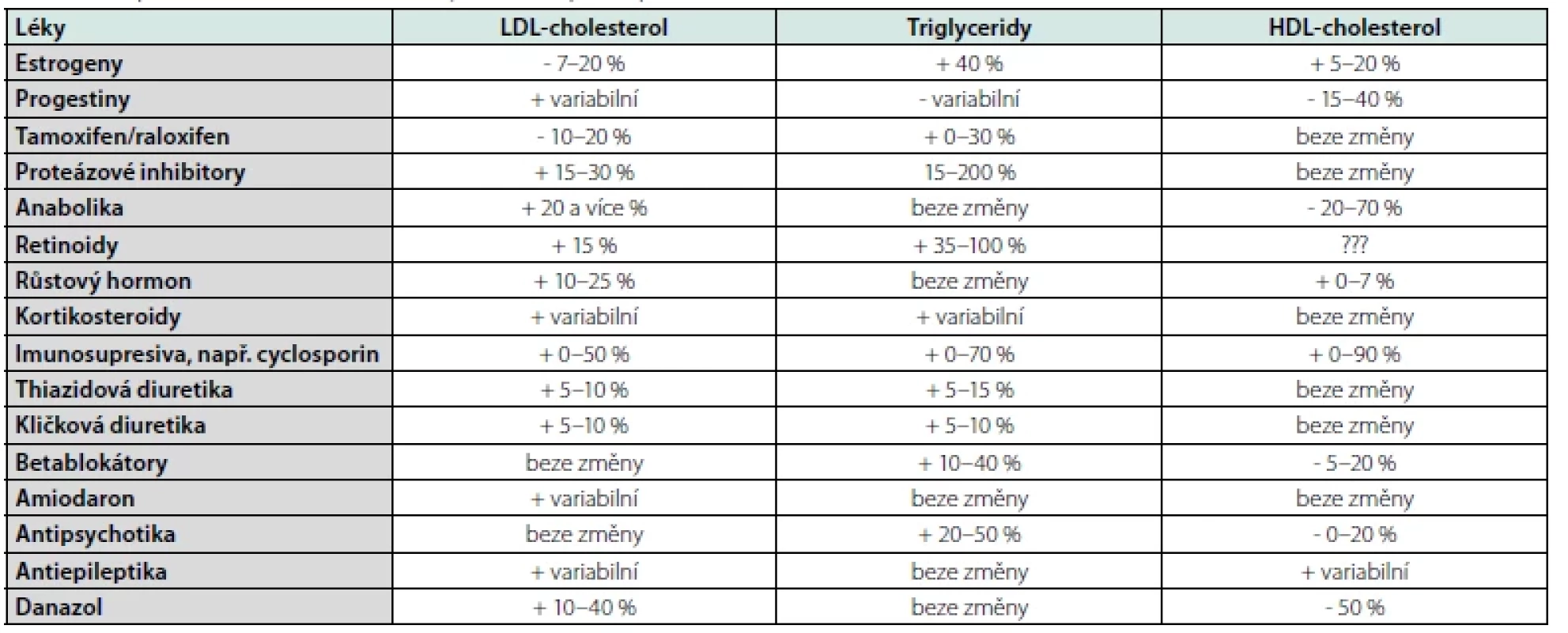
Proč věnovat KV prevenci, potažmo léčbě DLP, takovou pozornost?
Odpověď je jednoduchá, i přes veškeré snahy zůstávají KVO, zastoupená převážně těmi aterosklerotickými, vedoucí příčinou morbidity a mortality nejen v České republice (ČR), ale také globálně. Dle posledních dat Ústavu pro zdravotnické informace a statistiku z roku 2020 se KVO podílela na takřka 40 % standardizované úmrtnosti v ČR (10).
Jak již bylo uvedeno výše, DLP, respektive lipoproteinové částice obsahující cholesterol a apoB, jsou jediným kauzálním RF ASKVO, jež se v populaci vyskytuje s velmi vysokou prevalencí (až 65 %) (1, 2, 4). Bohužel, jak ukazuje řada národních i mezinárodních studií, kontrola DLP, a to zejména u nejrizikovějších nemocných, je velmi nedobrá – cílových hodnot LDL-C dosahuje sotva 10–30 % sledovaných (11–15).
Bohužel (bohudík!) platí dobře známé „čím níže, tím lépe“, tj. máme k dispozici robustní data podporující fakt, že dosahování často ambiciozních léčebných cílů krevních lipidů je spojeno s redukcí KV morbidity a mortality, a to jak ve studiích se statiny samotnými, tak v kombinaci s ezetimibem či inhibitory proprotein konvertázy subtilisin/ kexin typu 9 (PCSK9i): každé snížení LDL-C o 1 mmol/l vede k redukci KV rizika přibližně o 20 % (6, 7). S tímto úzce souvisí také problematika tzv. kumulativní dávky LDL-C (definována jako 150 mmol/l – počítáno v letech, po které má nemocný určitou hladinu LDL-C), která je nutná k manifestaci KV příhody (Graf 1). Z uvedeného diagramu (Graf 1) jasně vyplývá potřeba nejen razantního snížení LDL-C, ale také včasnost této intervence, tedy „čím níže, tím lépe, čím déle, tím lépe“ (7, 16).
Jak je to s triglyceridy? Mají spojitost s ASKVO? Nebo jsou jen RF akutní pankreatitidy?
Hypertriglyceridemie je definována hodnotami TG > 1,7 mmol/l nalačno, přičemž na vyšší hladiny TG pohlížíme jako na marker kumulace na TG bohatých (včetně remnantních) částic, tj. ukazatel vyššího (chce-li reziduálního) KV rizika. Spojitost samotných TG s ASKVO nebyla dosud jasně prokázána. V pracích zabývajících se touto otázkou se asociace HTG s ASKVO po adjustaci na non-HDL-cholesterol (non-HDL-C) atenuuje (7, 17). Toto samozřejmě podporuje výše uvedené konstatování, že TG jsou pouze markerem částic, které kromě TG obsahují také cholesterol – základní stavební kámen aterosklerotických cévních lézí. TG jako takové bývají spíše spojovány s iniciací či propagací zánětu cévní stěny (18).
Předpokládá se, že HTG jsou velmi častou odchylkou – až u pětiny populace dokumentujeme abnormální hladiny TG; těžká HTG je pak zachycena cca ve 2 % případů (19). Hladiny TG do 10 mmol/l jsou asociovány spíše s rostoucím KV rizikem (rostoucí absolutní riziko infarktu myokardu, aortální stenózy či ischemické cévní mozkové příhody), jakkoli hodnoty vyšší jsou významným RF rozvoje akutní pankreatitidy, a to i po adjustaci na věk, pohlaví, přítomnost DM či abúzu alkoholu (20–22). Hypertriglyceridemií indukované pankreatitidy zaujímají cca 4 % všech pankreatitid, přičemž po alkoholové a biliární etiologii jsou 3. nejčastější příčinou jejího vzniku (22). Ve srovnání s jinými etiologiemi jsou daleko závažnější, častěji recidivují, dříve destruují exoi endokrinní části pankreatu a v neposlední řadě byla popsána jejich asociace s vyšší morbiditou i mortalitou (23).
S těžkými HTG se setkáváme mimo vzácné monogenně dědičné poruchy (např. deficit lipoproteinové lipázy či jejich kofaktorů) typicky u pacientů s dědičnou predispozicí (kumulací běžných DNA variant (single nucleotide polymorphisms – SNPs) genů zapojených do metabolismu na TG bohatých částic) a přítomností dalších faktorů, např. při abúzu alkoholu, v kontextu dietních excesů či dekompenzace DM.
V konsenzu Evropské společnosti pro aterosklerózu z roku 2021 se nově diskutuje problematika ideálních hodnot TG nalačno, přičemž se uvádí, že hladina TG < 1,2 mmol/l je asociována s optimálním nastavením metabolismu na TG bohatých částic; již hladiny TG mezi 1,7–5,6 mmol/l jsou spojeny s jejich významnou kumulací, a tedy i vyšší KV rizikem (21).
Graf 1. Problematika kumulativní dávky LDL-C, upraveno dle (16) 
Co víme o lipoproteinu(a)?
Lipoprotein(a) (Lp(a)) představuje částici podobnou LDL, která je považována za nezávislý RF ASKVO, kdy v posledních doporučeních Evropské kardiologické společnosti z roku 2021 se dokonce hovoří o vysokých hladinách Lp(a) jako o samostatné metabolické poruše. Hladiny Lp(a) > 430 nmol/l (> 180 mg/dl) jsou asociovány s obdobným KV rizikem jako heterozygotní FH (7). Po řadě desetiletí skepse kolem Lp(a) zažívá tento v posledních letech opět období renesance, jelikož se objevují nová léčiva, jež mohou jeho hladiny dramaticky snížit – až o 90 %. Jakkoli není dosud jasné, zda snížení Lp(a) povede ke kýžené redukci KV příhod (24). Jasno do této problematiky snad přinese právě probíhající studie HORIZON, testující pelacarsen (antisense oligonukleotid proti apolipoproteinu(a)) v prevenci KV příhod.
Jak tedy ideálně v praxi postupovat?
Po vyloučení možné sekundární DLP bychom měli zhodnotit celkové KV riziko daného pacienta – tedy odrazový můstek k určení cílových hodnot krevních lipidů. V praxi u zdánlivě zdravých jedinců bez manifestního ASKVO či přítomnosti jeho RF (zejména DM, chronického onemocnění ledvin, arteriální hypertenze či geneticky podmíněné DLP) využíváme hodnocení KV rizika dle systému SCORE2/SCORE2-OP (Obr. 1), případně při stratifikaci KV rizika vycházíme z přítomných komorbidit daného jedince (Tab. 5). Po determinaci KV rizika dle SCORE2/ SCORE2-OP či vyplývajícího z přítomných komorbidit stratifikujeme pacienty do 3 kategorií KV rizika, od nichž se pak odvíjí také cílové hodnoty lipidových parametrů (Tab. 6). Primární léčebný cíl představuje LDL-C, sekundární pak non-HDL-C či apoB (6, 7).
Redukce KV rizika však nespočívá jen v léčbě DLP, ale také v intervenci všech dalších konkomitantních RF ASKVO, jelikož pouze komplexní intervence je nejúčinnější. Léčebné cíle dílčích RF jsou pro přehlednost uvedeny v tabulce 6.
Jak dosáhnout stanovených cílů v léčbě DLP?
Základem jsou vždy dietní a režimová opatření, tj. adekvátní stravovací návyky (preferenčně dieta středomořského typu), pravidelná pohybová aktivita (např. 6000–10000 kroků denně), prevence sedavého způsobu života či zanechání kouření (7).
Samotná dietní a režimová opatření zřídka stačí k dosahování často velmi ambiciózních cílových hodnot LDL-C, proto u většiny pacientů musíme využít některou z farmakoterapeutických modalit. Základním pilířem léčby DLP jsou statiny – léky dostupné, velmi dobře tolerované s minimem nežádoucích účinků. Vždy bychom měli usilovat o podávání moderních potentních statinů (atorvači rosuvastatinu) v maximálních, respektive maximálních tolerovaných dávkách. Pokud není dosaženo cílových hodnot LDL-C při monoterapii statinem je indikována kombinační hypolipidemická léčba. Přednostně se s ohledem na dostupnost využívá kombinací s ezetimibem, přičemž lze očekávat aditivní pokles LDL-C nad rámec monoterapie statinem o 20–25 % (pozn. zdvojnásobení dávky statinu vede k dalšímu poklesu LDL-C přibližně o 6 %) (6, 7, 25). V indikovaných případech (Tab. 7) máme již od roku 2018 k dispozici „klasické“ PCKS9i, tj. monoklonální protilátky proti PCSK9 – aliroa evolokumab; při jejich podávání lze očekávat dodatečný pokles LDL-C kolem 60 % (26–30). Při indikaci PCSK9i nemusí být ezetimib v souladu s hodnotícími zprávami Státního ústavu pro kontrolu léčiv nasazen, pokud je u pacienta užívajícího maximální tolerovanou dávku statinu výchozí LDL-C více než 20 % od cílové hodnoty, případně u statin-naivních nemocných LDL-C více než 50 % od cíle (26, 27). V obdobných indikacích jako monoklonální protilátky se portfolio hypolipidemik od 1. 4. 2023 rozšířilo o inklisiran – malou interferující RNA proti PCSK9, která v konečném důsledku působí obdobně jako „klasické“ PCSK9i. U inklisiranu je popisován aditivní pokles LDL-C kolem 50 %; výhodou jeho podávání je 100% adherence k léčbě, jelikož je aplikován přímo v ambulanci internisty či kardiologa, a to každých 6 měsíců (s výjimkou booster dávky v 3. měsíci od první aplikace). Inklisiran představuje lék velmi dobře tolerovaný, kdy jediným relevantním nežádoucím účinkem byla reakce v místě vpichu. Nepředpokládají se také žádné lékové interakce a není nutná redukce dávky u pacientů s renální či jaterní insuficiencí (31, 32).
Tabulka 7 pro přehlednost shrnuje současné možnosti cílené léčby DLP v ČR (Tab. 7) (26, 27, 31).
Obr. 1. Tabulka SCORE2/SCORE2-OP, dle (7) 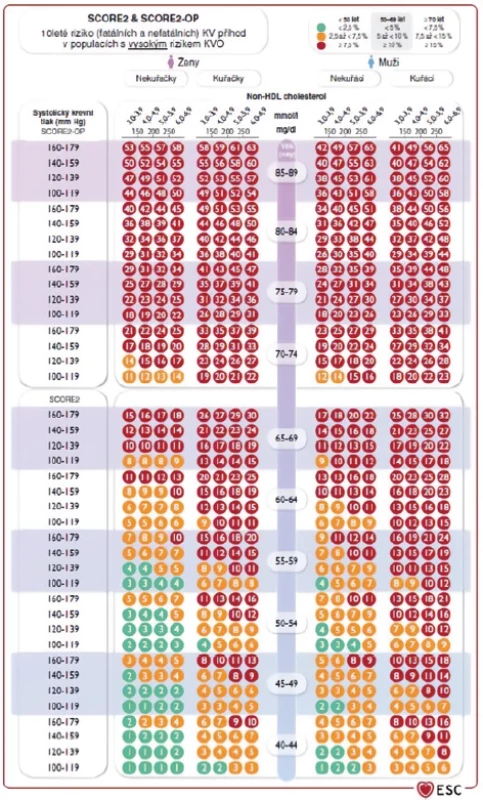
Tab. 5. Kategorie KV rizika, upraveno dle (6, 7) 
DM – diabetes mellitus – pozn. DM 2. typu či DM 1. typu u pacientů ve věku > 40 let, eGFR (estimated glomerular filtration rate) – odhadovaná glomerulární filtrace, ACR – albumin-to-creatinine ratio, CKD – chronické onemocnění ledvin,FH – familiární hypercholesterolemie Jak se nám daří dosahovat cílových hodnot LDL‑C v praxi?
Zrcadlem běžné klinické praxe budiž např. série studií EUROASPIRE, studie DaVinci, LIPIcontrol 1,2 či LipitecClidec 1,2, jež sice poukazují na uspokojivou implementaci aktuálních doporučených postupů do praxe, kdy se ukazuje, že je správně volena odpovídající kardioprotektivní medikace, avšak tato je často titrována až s přílišnou opatrností a pomalu (i při dobré toleranci) či je zcela nevyužita vhodná léčba kombinační. Bohužel nedostatečná kontrola DLP je typicky u nejrizikovějších nemocných (ve velmi vysokém KV riziku či v sekundární prevenci); v této populaci nemocných je dosahováno cílových hodnot LDL-C v 10–30 % případů (11–15,33). Možných vysvětlení je jistě celá řada, a to jak na straně pacienta, tak i lékaře. Nedosahování cílových hodnot LDL-C může být zapříčiněno obavami z podávání intenzivní hypolipidemické léčby, obavami z nežádoucích účinků či prostou inercií, kdy není dávka hypolipidemik při nedostatečné kontrole DLP upravena, přestože je léčba dobře tolerována. Svou roli sehrává také pacient, jeho ochota řídit se pokyny lékaře a dlouhodobě užívat předepsanou medikaci. Je velmi dobře dokumentována klesající adherence k léčbě, a to nepřímo úměrně k délce trvání terapie. Non-adherence je dokonce považována dle některých pramenů za samostatný RF ASKVO. Zcela zásadní je v tomto ohledu důkladná edukace pacientů, řešení případných nežádoucích účinků podávané léčby a v neposlední řadě také využití fixní kombinační léčby (6, 7).
Tab. 6. Cíle dílčích intervenovaných RF ASKVO, upraveno dle (6, 7) 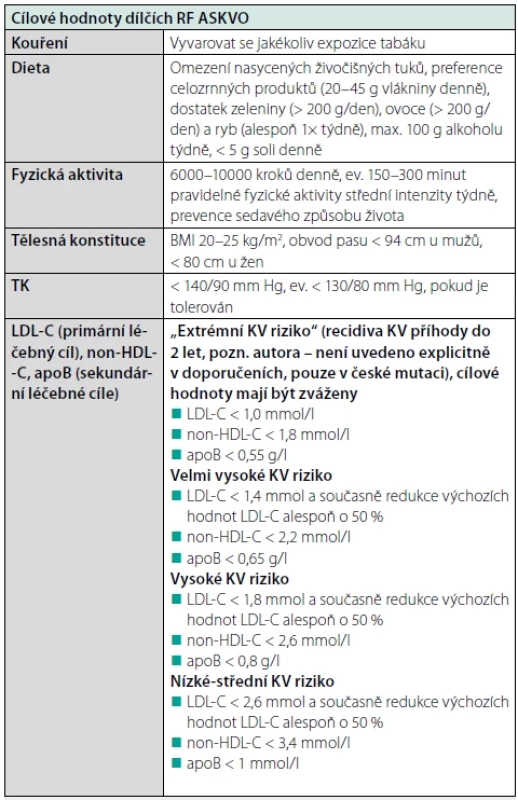
BMI – body mass index, LDL-C – LDL-cholesterol, apoB – apolipoprotein B, non-HDL-C – non-HDL-cholesterol Jak postupovat u pacientů s těžkou HTG?
Jelikož se s těžkými HTG často setkáváme u pacientů s dekompenzací DM, abúzem alkoholu či dietními excesy, jsou zcela zásadní dietní (preferenčně opět tzv. středomořská dieta) a režimová opatření, tj. především zanechání kouření, abstinence alkoholu a pravidelná pohybová aktivita, kdy se ukazuje, že nejvyššího poklesu TG lze dosáhnout rezistentním, ale nikoliv aerobním, tréninkem (6, 7, 34, 35).
Farmakoterapií volby v prevenci vzniku akutní pankreatitidy je monoterapie fibrátem (v ČR především fenofibrátem), který má mimo jiné také zásadní vliv na postprandiální lipemii (36). U pacientů s nejtěžšími HTG fenotypy máme omezeně k dispozici v rámci lipidových center či specifických léčebných programů (resp. studií) také např. lomitapid, volanesorsen či evinakumab. Jednou z krajních léčebných modalit je také aferéza (6, 7). Při léčbě těžké HTG je zcela zásadní také snaha o maximální kompenzaci přidružených komorbidit, zejména pak DM.
Jaký je současný pohled na léčbu fibráty?
Kromě výše zmíněné indikace monoterapie fibráty v prevenci akutní pankreatitidy má být tato léčba zvážena u pacientů s trvající HTG > 2,3 mmol/l i přes maximální dávku statinu (6). V klinické praxi lze fibráty využívat spíše jen u pacientů s DM, u nichž byl popsán ve studii ACCORD či FIELD pozitivní dopad jejich podávání na rozvoj, resp. progresi mikrovaskulárních komplikací DM, jakkoli výskyt komplikací makrovaskulárních nebyl v žádné ze studií terapií fibráty ovlivněn (36, 37).
V ČR je ve valné většině případů preskribován fenofibrát v některé z jeho lékových forem. Pokud tento není tolerován, lze užít v indikovaných případech druhý z dostupných preparátů – ciprofibrát, který však nemá oporu v doporučených postupech, resp. klinických studiích.
Tab. 7. Přehled možností cílené léčby DLP, upraveno dle (26, 27, 31) 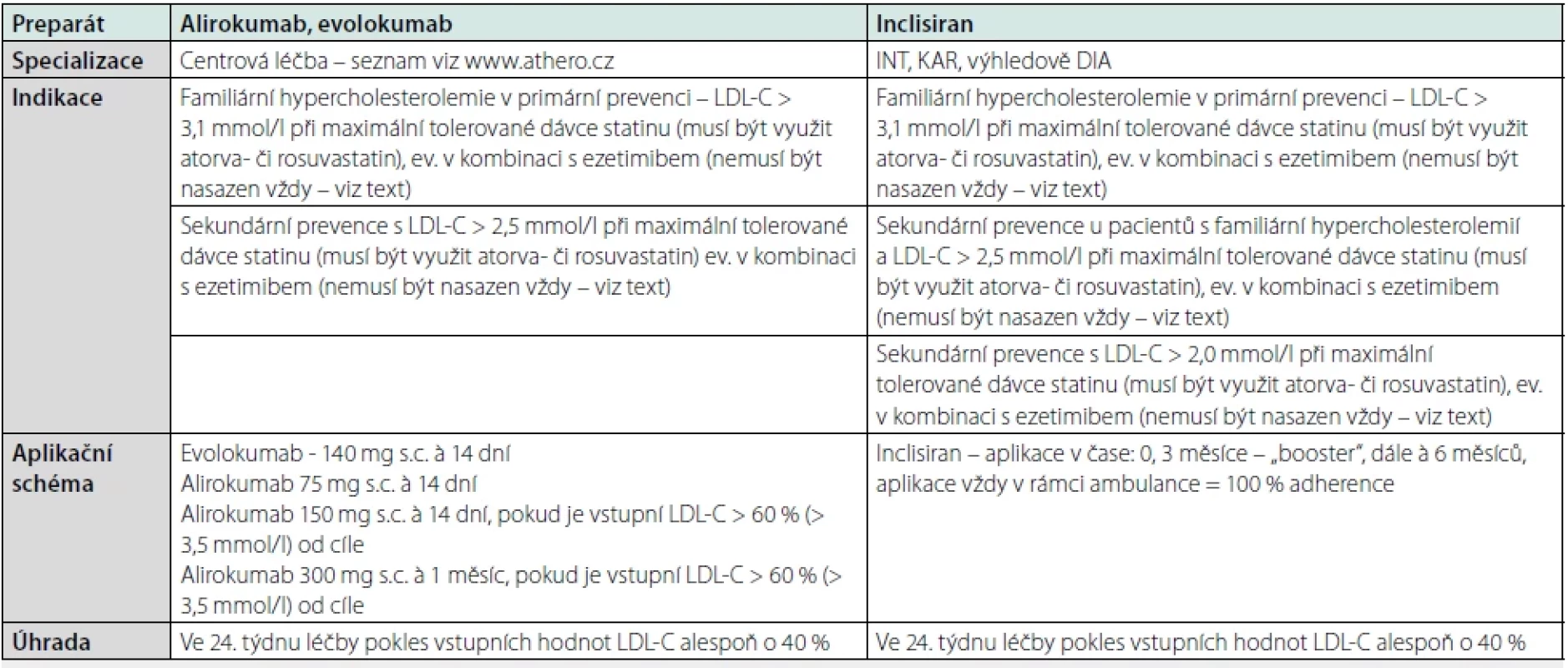
LDL‑C – LDL‑cholesterol Jaké jsou výhledy stran léčby DLP do budoucna?
Na podzim 2023 by měla být k dispozici kyselina bempedoová, jež funguje obdobným mechanismem jako statiny (pouze o několik úrovní dané metabolické dráhy výše); podrobnosti stran jejího předepisování nejsou t. č. známy.
Již řadu let se hovoří o možnosti „vakcinace proti DLP“ či dokonce její genové manipulaci pomocí CRISPR-Cas9. V preklinických animálních studiích bylo zjištěno, že vakcína proti PCSK9, respektive apolipoproteinu B-100, snižuje nejen hladinu LDL-C, ale také zabraňuje progresi aterosklerózy (38, 39). V roce 2020 byla udělena Nobelova cena za technologii editace genů CRISPR-Cas 9 – tzv. genové nůžky, jež mají potenciál cílit na geny spojené s DLP a modifikovat je. V jedné ze studií na primátech bylo díky CRISP-Cas9 editaci genu proteinu PCSK9 docíleno nejen jeho výrazného a dlouhodobého poklesu, ale také doprovodného setrvalého snížení hladin LDL-C (40). V současnosti již existuje několik pacientů, již podstoupili tuto genovou manipulaci; jedná se však o zcela recentní studie, jež dosud nepřinesly žádné relevantní výsledky.
Jakkoli výše zmíněné léčebné modality vykazují v preklinických pracích slibné výsledky, je zapotřebí dalšího výzkumu a rozsáhlých klinických studií, aby byla dokumentována jejich bezpečnost a účinnost.
Závěr
Dyslipidemie představují jednu z nejčastěji zachycených metabolických poruch, na které musíme pohlížet nejen jako na nejvýznamnější RF ASKVO, ale v kontextu těžké HTG (TG > 10 mmol/l) také jako na významný RF rozvoje akutní pankreatitidy. Pokud je u nemocného zachycena alterace lipidového spektra, vždy by měla být v úvodu vyloučena možná sekundární DLP (např. v kontextu hypotyreózy, DM, abúzu alkoholu…). Po zhodnocení KV rizika jsou základem léčby DLP vždy dietní a režimová opatření, na která by měla v indikovaných případech navazovat adekvátní hypolipidemická terapie. Tato byla od dubna 2023 rozšířena o inklisiran, který je t. č. v rukou ambulantních specialistů – kardiologů a internistů.
Nezapomínejme však, že redukce KV rizika nespočívá jen v léčbě DLP, ale také v intervenci všech dalších konkomitantních RF, jelikož pouze komplexní intervence je nejúčinnější.
Podpořeno: MZ ČR RVO 64165.
MUDr. Martin Šatný
3. interní klinika – klinika endokrinologie a metabolismu 1. LF UK a VFN v Praze
Martin.Satny@vfn.cz
Zdroje
- Sanin V, Koenig W. Therapie der Hypercholesterinämie in der Primärprävention. DMW Deutsche Medizinische Wochenschrift [online]. 2019;144(05):322-328. doi: 10.1055/a0657-1668.
- Cífková R, Bruthans J, Wolhlfahrt P, et al. (The prevalence of major cardiovascular risk factors in the Czech population in 2015-2018. The Czech post-MONICA study). Cor et Vasa. 2020;62(1):6-16. doi: 10.33678/cor.2020.010.
- Yusuf S, Hawken S, Ôunpuu S, et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. The Lancet. 2004;364(9438):937-952. doi: 10.1016/S0140-6736(04)17018-9.
- Borén J, Williams KJ. The central role of arterial retention of cholesterol-rich apolipoprotein-B-containing lipoproteins in the pathogenesis of atherosclerosis: a triumph of simplicity. Curr Opin Lipidol. 2016 Oct;27(5):473-83. doi: 10.1097/MOL.0000000000000330.
- Gaudet D, de Wal J, Tremblay K, et al. Review of the clinical development of alipogene tiparvovec gene therapy for lipoprotein lipase deficiency. Atheroscler Suppl. 2010 Jun;11(1):55-60. doi: 10.1016/j.atherosclerosissup.2010. 03. 004.
- Mach F, Baigent C, Catapano AL, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. European Heart Journal. 2019 DOI: 10.1093/eurheartj/ehz455.
- Visseren FLJ, Mach F, Smulders YM, et al. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. European Heart Journal [online]. 2021;42 (34):3227-3337. doi:10.1093/eurheartj/ehab484.
- Šatný M, Vrablík M. Sekundární dyslipidemie. AtheroRev 2017;2(3):162-168.
- Fredrickson DS, Lees RS. A system for phenotyping hyperlipoproteinemia. Circulation. 1965 Mar;31 : 321-7. doi: 10.1161/01.cir.31. 3. 321.
- Zemřelí 2020. Ústav pro zdravotnické informace a statistiku 2021. ISSN 1210-9967.
- Kotseva K. The EUROASPIRE surveys: lessons learned in cardiovascular disease prevention. Cardiovascular Diagnosis and Therapy. 2017;633-639. doi: 10.21037/cdt.2017. 04. 06. 12.
- Šatný M, Vrablík M, Tůmová E, et al. Profil pacientů s nekontrolovanou arteriální hypertenzí a/nebo dyslipidemií v primární péči v Česku – studie LipitenCliDec: výsledky 1. fáze, AtheroRev. 2020;5(1):47-52.
- Šatný M, Tůmová E, Vrablík M. LIPIcontrol: daří se zlepšovat úroveň kontroly hlavních rizikových faktorů kardiovaskulárních onemocnění v každodenní praxi?. Hypertenze KV Prevence. 2018;7(1):15-21.
- Šatný M, Tůmová E, Vrablík M. Srovnání profilu a léčby pacientů s nekontrolovanou arteriální hypertenzí a/nebo dyslipidemií v péči specialistů a v primární péči v Česku: srovnání výsledků studie LipitenCliDec 1 a LipitenCliDec 2. AtheroRev. 2021;6(3):154-162.
- Šatný M, Vrablík M. LIPIcontrol 2 aneb co se změnilo po 3 letech. AtheroRev 2020;5(3):185-190.
- Vrablík M. Farmakoterapie dyslipidemie. 2. rozšířené vydání. Praha: Maxdorf, 2016. Farmakoterapie pro praxi. ISBN 978-80-7345-503-3.
- Nordestgaard BG. Triglyceride-rich lipoproteins and atherosclerotic cardiovascular disease: new insights from epidemiology, genetics, and biology. Circ Res. 2016;118 : 547-563.
- Schwartz EA, Reaven PD. Lipolysis of triglyceride-rich lipoproteins, vascular inflammation, and atherosclerosis. Biochim Biophys Acta. 2012;1821 : 858-866.
- Simha V. Management of hypertriglyceridemia. BMJ. ISSN 1756-1833. doi:10.1136/ bmj.m3109.
- Laufs U, Parhofer KG, Ginsberg HN, et al. Clinical review on triglycerides. European Heart Journal. 2020;41(1):99-109c. doi:10.1093/eurheartj/ehz785.
- Ginsberg HN, Packard CJ, Chapman MJ, et al. Triglyceride-rich lipoproteins and their remnants: metabolic insights, role in atherosclerotic cardiovascular disease, and emerging therapeutic strategies–a consensus statement from the European Atherosclerosis Society. European Heart Journal. 2021;42(47):4791-4806. doi:10.1093/eurheartj/ehab551.
- Pedersen SB, Langsted SB, Nordestgaard BG. Nonfasting Mild-to-Moderate Hypertriglyceridemia and Risk of Acute Pancreatitis. JAMA Internal Medicine. 2016;176(12). doi:10.1001/ jamainternmed.2016.6875.
- He WH, Zhu Y, Zhu Y, et al. Comparison of severity and clinical outcomes between hypertriglyceridemic pancreatitis and acute pancreatitis due to other causes. Zhonghua Yi Xue Za Zhi. 2016 Aug 23;96(32):2569-72. doi: 10.3760/cma.j.issn.0376-2491.2016. 32. 011.
- Graham MJ, Viney N, Crooke RM, et al. Antisense inhibition of apolipoprotein (a) to lower plasma lipoprotein (a) levels in humans. J Lipid Res. 2016 Mar;57(3):340-51. doi: 10.1194/jlr.R052258.
- Ezetimib (SPC). Souhrn informací o přípravku. Available from: www.sukl.cz.
- Alirocumab (SPC). Souhrn informací o přípravku. Available from: www.sukl.cz.
- Evolocumab (SPC). Souhrn informací o přípravku. Available from: www.sukl.cz.
- Altschmiedová T, Todorovová V, Šnejdrlová M, et al. PCSK9 Inhibitors in Real-world Practice: Analysis of Data from 314 Patients and 2 Years of Experience in a Center of Preventive Cardiology. Curr Atheroscler Rep. 2022 May;24(5):357-363. doi: 10.1007/s11883-022-01008-8.
- Sabatine MS, Giugliano RP, Keech AC, et al. FOURIER Steering Committee and Investigators. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med. 2017 May 4;376(18):1713-1722. doi: 10.1056/NEJMoa1615664.
- Robinson JG, Farnier M, Krempf M, et al. ODYSSEY LONG TERM Investigators. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med. 2015 Apr 16;372(16):1489-99. doi: 10.1056/NEJMoa1501031.
- Inclisiran (SPC). Souhrn informací o přípravku. Available from: www.sukl.cz.
- Frampton JE. Inclisiran: A Review in Hypercholesterolemia. Am J Cardiovasc Drugs. 2023 Mar;23(2):219-230. doi: 10.1007/s40256-023-00568-7.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2023 Číslo 5- S MUDr. Štěpánem Budkou o rizicích obezity pro fertilitu ze všech úhlů pohledu
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Kardiovaskulární onemocnění a transplantace ledviny
- Důsledky vysoce supresivní léčby infekce HIV
- Interní komorbidity a komplikace terapie roztroušené sklerózy – nenechte se zaskočit!
- Akutní poškození ledvin u pacientů s jaterní cirhózou - shrnutí pro praxi
- Dyslipidemie – známá neznámá
- Diferencovaný karcinom štítné žlázy – možná rizika léčby, supresní léčby a adherence k současným doporučení
- Atypická forma Goodpastureovy nemoci
- Farmakologický profil mepolizumabu
- Co je nového v pneumologii – rok 2022
- Finerenon: další možnost léčby u pacientů s chronickým onemocněním ledvin a diabetem 2. typu
- Zemřela prof. MUDr. Marie Brodanová, DrSc.
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Akutní poškození ledvin u pacientů s jaterní cirhózou - shrnutí pro praxi
- Dyslipidemie – známá neznámá
- Co je nového v pneumologii – rok 2022
- Kardiovaskulární onemocnění a transplantace ledviny
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



