-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Farmakologický profil mepolizumabu
Pharmacological profile of mepolizumab
An elevated number of eosinophils have been implicated in several type 2 inflammatory chronic diseases that occur at various sites in the body. Over the past 20 years, our knowledge of diseases associated with increased numbers of eosinophils has advanced thanks to the development of drugs that can reduce or even eliminate eosinophils. One such agent is mepolizumab, a humanized monoclonal antibody that binds to interleukin -5 (IL-5). This article briefly and clearly summarizes the pharmacological profile of mepolizumab and its current indications for a number of chronic eosinophilic diseases.
Keywords:
mepolizumab – severe eosinophilic asthma (SEA) – chronic rhinosinusitis with nasal polyps (CRSwNP) – eosinophilic granulomatosis with polyangiitis (EGPA) – hypereosinophilic syndrome (HES).
Autoři: Norbert Pauk
Působiště autorů: Klinika pneumologie 3. LF UK a Fakultní nemocnice Bulovka, Praha
Vyšlo v časopise: Vnitř Lék 2023; 69(5): 322-328
Kategorie: Farmakologický profil
doi: https://doi.org/10.36290/vnl.2023.063Souhrn
Zvýšený počet eozinofilů se podílí na několika chronických zánětlivých onemocněních 2. typu, která se vyskytují na různých místech v těle. Během posledních 20 let se naše znalosti o onemocněních asociovaných se zvýšeným počtem eozinofilů posunuly i díky vývoji léků, které eozinofily dokáží snižovat či dokonce eliminovat. Jednou z takových látek je mepolizumab, humanizovaná monoklonální protilátka, která se váže na interleukin-5 (IL-5). Článek stručně a přehledně shrnuje farmakologický profil mepolizumabu a jeho současné indikace u řady chronických eozinofilních onemocnění.
Klíčová slova:
mepolizumab – těžké eozinofilní astma (SEA) – chronická rinosinusitida s polypy (CRSwNP) – eozinofilní granulomatóza s polyangiitidou (EGPA) – hypereozinofilní syndrom (HES)
Zařazení do skupiny léčiv
Mepolizumab je zařazen do farmakoterapeutické skupiny jiná systémová léčiva onemocnění spojených s obstrukcí dýchacích cest, ATC kód: R03DX09. Název přípravku obsahujícího mepolizumab je pod obchodním názvem Nucala (GSK). Jedna injekční lahvička obsahuje prášek 100 mg mepolizumabu. Léčivo je distribuováno nejen v podobě lyofilizátu k přípravě injekčního roztoku, ale také v předplněných stříkačkách a předplněném peru.
Chemická struktura
Mepolizumab je humanizovaná monoklonální protilátka (IgG1, kappa). Struktura je zobrazena na obrázku 1.
Obr. 1. Struktura mepolizumabu (archiv autora) 
Mechanismus účinku
Mepolizumab je humanizovaná monoklonální protilátka, která s vysokou afinitou a specificitou cílí k interleukinu-5 (IL-5) a inhibuje jeho biologickou aktivitu. IL-5 je významný cytokin, který ovlivňuje růst, diferenciaci, migraci eozinofilů do tkání a jejich aktivaci a přežívání. Mepolizumab blokuje vazbu IL-5 na alfa řetězec komplexu IL-5 receptoru, který je umístěn na povrhu eozinofilní buňky. Jako humanizovaná monoklonální protilátka je vyráběna na ovariálních buňkách čínských křečíků rekombinantní DNA technologií (1).
Obr. 2. Mechanismus účinku mepolizumabu (archiv autora) 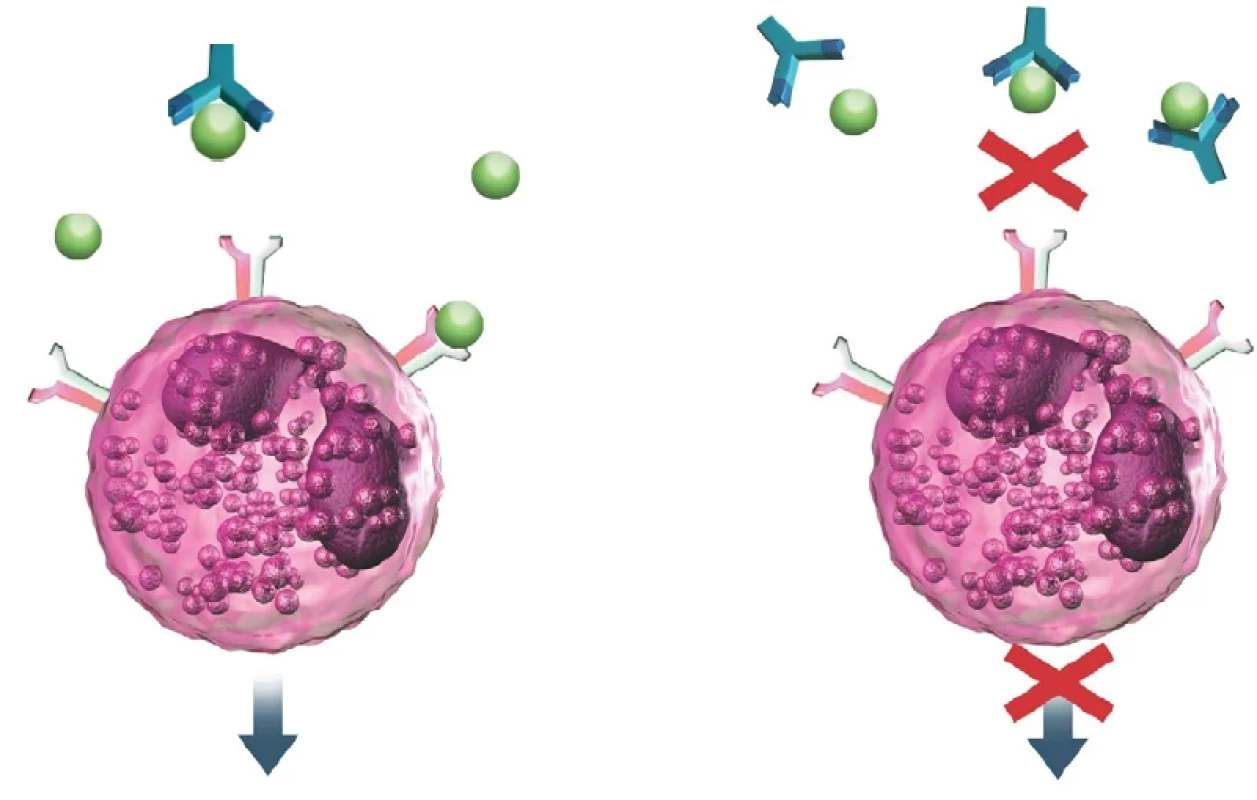
Vlevo – IL-5 (znázorněno zeleně) volně a po vazbě na receptor eozinofilu Vpravo – blokace vazby IL-5 na eozinofil po navázání na monoklonální protilátku anti-IL-5 Využití v praxi
Účinná léčba zánětlivých onemocnění je často náročná vzhledem k jejich heterogenní patofyziologii. Nyní rozumíme daleko lépe základním mechanismům onemocnění a víme, že eozinofily dnes hrají komplexní patofyziologickou roli v široké škále zánětlivých onemocnění druhého typu (type 2) (2). Standardní léčbou u těžkých refrakterních forem onemocnění byla donedávna perorální léčba kortikosteroidy a/nebo imunoterapie s řadou nežádoucích účinků. Současná selektivnější biologická terapie snižující počet eozinofilů poskytuje zlepšení klinických příznaků a exacerbací řady nemocí spojených s eozinofilním zánětem (3–4).
Současné indikace mepolizumabu
V roce 2023 je mepolizumab (Nucala) používán v terapii již ve 4 indikacích.
- Těžké eozinofilní refrakterní astma bronchiale (SEA)
- Těžká chronická rinosinusitida s nosními polypy (CRSwNP)
- Eozinofilní granulomatóza s polyangiitidou (EGPA)
- Hypereozinofilní syndrom (HES)
Těžké eozinofilní refrakterní astma bronchiale
Astma bronchiale je heterogenní chronické zánětlivé onemocnění průdušek. Cílem léčby je dosažení kontroly nad nemocí. Dle literatury asi u 3–10 % astmatiků je kontrola nemoci obtížně dosažitelná, a to i přes maximální standardní kombinovanou léčbu. Pacienti s těžkým refrakterním astmatem mají časté exacerbace s rizikem hospitalizací, respiračního selhání a úmrtí. Heterogenita onemocnění souvisí s poznáním fenotypů onemocnění s různými patofyziologickými zánětlivými imunitními odpověďmi v dýchacích cestách. Těžké formy astmatu jsou často spojeny s eozinofilním fenotypem (3).
Účinnost mepolizumabu byla prokázána v případě těžkého refrakterního eozinofilního astmatu ve třech randomizovaných dvojitě zaslepených klinických studiích s paralelními skupinami trvajících 24–52 týdnů u pacientů ve věku 12 let a starších. Nemocní neměli astma pod kontrolou (výskyt alespoň dvou těžkých exacerbací během předchozích 12 měsíců) jejich současnou standardní léčbou zahrnující kombinace vysokých dávek inhalačních kortikosteroidů (IKS) a přídatné udržovací léčby (inhalační dlouhodobě působící beta-2-agonisté, inhalační dlouhodobě působící anticholinergika, antagonisté leukotrienů, theofylin a perorální kortikosteroidy – OCS). Dvě studie se zabývaly výskytem exacerbací astmatu MEA 112997 (studie DREAM) (5) a MEA 115588 (studie MENSA) (6). Celkově zahrnovaly 1 192 pacientů v průměrném věku 49 let (rozmezí 12–82 let). V 60 % byly zastoupeny ženy. Podíl pacientů na udržovací OCS léčbě byl 31 %, resp. 24 %. Průměrný počet exacerbací v posledním roce byl 3,6 a průměrná prebronchodilatační hodnota FEV1 byla 60 % náležité hodnoty. V průběhu studií pacienti pokračovali v zavedené léčbě astmatu.
DREAM (Dose Ranging Efficacy And safety with Mepolizumab in severe asthma) sledovala účinnost různých dávek. Byla to randomizovaná, dvojitě zaslepená, placebem kontrolovaná, multicentrická studie s paralelními skupinami v trvání 52 týdnů s počtem 616 zařazených pacientů s těžkým refrakterním eozinofilním astmatem, kde mepolizumab v dávce 75 mg, 250 mg nebo 750 mg podané intravenózně ve srovnání s placebem významně snižoval výskyt klinicky významných exacerbací astmatu o 39–52 % (5). Souvislost mezi počtem eozinofilů v krvi a odpovědí na mepolizumab byla potvrzena ve studii fáze III MENSA (MEpolizumab as adjuctive therapy iN patients with Severe Asthma), kde se prokázal přímý vztah mezi výchozím počtem eozinofilů v krvi a snížením počtem exacerbací (6). Klinicky relevantní snížení počtu exacerbací (54 % ve studii DREAM a 53 % ve studii MENSA) bylo pozorováno při výchozím počtu eozinofilů v krvi ≥ 150 buněk/µl. Léčebné benefity byly navíc prokázány i ve zlepšení plicních funkcí a příznaků astmatu. Pokud bychom dali pozitiva dohromady, nemocní s těžkým eozinofilním astmatem léčeným mepolizumabem profitují s ohledem na snížení exacerbací, zlepšení plicních funkcí, zlepšení kontroly astmatu a kvality života (5–6).
Studie MEA 115575 SIRIUS (SteroId ReductIon with mepolizUamb Study) prokázala kortikoid-šetřící účinky u 135 pacientů. Tato studie hodnotila vliv mepolizumabu 100 mg podaného subkutánně na snížení potřeby podávání udržovacích perorálních kortikosteroidů při zachování kontroly astmatu (7). Dlouhodobá účinnost a bezpečnost byla prokázána řadou dalších studií MEA 115666 (COLUMBA) (8), MEA 115661 (COSMOS) a 201312 (COSMEX) (9).
Současná praxe ale ukázala, že pozitivní účinky z klinických studií, jsou dále potvrzovány i z velkých prospektivních studií z reálného života. Příkladem je studie REALITI-A (REAL world effectiveness of mepolizumab In paTIent care-Asthma), kde bylo prokázáno 83% snížení periferní eozinofilie a významné 69% snížení počtu exacerbací za posledních 12 měsíců (10). Dále pak i 52% snížení mediánu denní udržovací dávky celkových kortikosteroidů v posledním roce (11).
Od roku 2015 je mepolizumab indikován jako přídatná léčba těžkého refrakterního eozinofilního astmatu u dospělých pacientů, dospívajících a dětí od 6 let věku.
Mepolizumab je hrazen v léčbě dospělých pacientů s těžkým refrakterním eozinofilním astmatem, kteří dodržují zákaz kouření, mají v průběhu 12 měsíců před zahájením léčby dokumentováno nejméně 300 eozinofilů/μl periferní krve a nejméně 4 těžké řádně dokumentované exacerbace astmatu v průběhu 12 měsíců před zahájením léčby, a to navzdory vysokým denním dávkám inhalačních kortikosteroidů a přidané udržovací léčbě, nebo užívají perorální kortikosteroidy v dávce ekvivalentní nejméně 5 mg prednizonu denně po dobu alespoň 6 měsíců před zahájením léčby. V případě, že pacient užívá perorální kortikosteroidy v dávce ekvivalentní 5 mg prednizonu denně po dobu alespoň 6 měsíců před zahájením léčby, je dále nutný průkaz eozinofilie v periferní krvi v průběhu 12 měsíců před zahájením systémové kortikoterapie.
Těžká chronická rinosinusitida s nosními polypy (CRSwNP)
CRSwNP je heterogenní onemocnění horních cest dýchacích charakterizované chronickým lokálním eozinofilním zánětem a příznaky ucpání nosu, ztráty čichu (anosmie), výtoku z nosu, bolesti a tlaku v obličeji a kýchání v důsledku ztluštění nosní sliznice a tvorby nosních polypů. Typický je často zánět 2. typu a je častou komorbiditou u pacientů s těžkým eozinofilním astmatem (12). Úloha IL-5 v patogenezi nosních polypů byla prokázána v roce 1997, kdy byl nalezen ve významném množství ve vzorcích tkáně nosních polypů u nemocných s astmatem, kteří podstoupili polypektomii. Neutralizace IL-5 vedla ke snížení eozinofilie ve tkáních nosních polypů. V roce 2010 byl IL-5 prokázán jako prediktivní faktor těžkého astmatu u nemocných s nosními polypy. U pacientů s CRSwNP léčba systémovými kortikosteroidy redukuje velikost nosních polypů a zlepšuje příznaky, tato léčba má ale řadu nežádoucích účinků. Pacienti, kteří podstupují chirurgickou léčbu polypů, mají časté recidivy (12).
Ukázalo se, že u těžkých eozinofilních astmatiků léčených anti-IL-5 léčbu dochází také ke zlepšení příznaků u nosních polypů. Na základě těchto výsledků došlo ke studiu mepolizumabu u nemocných s relabujícími a refrakterními polypy. Ve studii fáze III SYNAPSE (StudY in NAsal Polyps patients to assess the Safety and Efficacy of mepolizumab) dokázal mepolizumab 100 mg snížit počet chirurgických zákroků a nutnost užití celkových kortikosteroidů a zlepšit příznaky spolu s významnou redukcí počtu eozinofilů v krvi ve srovnání s placebem.
Od listopadu 2021 je indikace dále rozšířena jako přídatná léčba k intranazálním kortikosteroidům v léčbě dospělých pacientů s těžkou chronickou rinosinusitidou s nosní polypózou, u nichž léčba systémovými kortikosteroidy a/nebo chirurgický zákrok nevedou k dosažení dostatečné kontroly nad onemocněním. Hrazení mepolizumabu v této indikaci zatím v ČR není, ale nemocné je možné indikovat na paragraf 16.
Eozinofilní granulomatóza s polyangiitidou (EGPA)
EGPA dříve nazývaná syndrom Churga-Straussové či alergická granulomatóza s angiitidou je velmi vzácné multisystémové onemocnění charakterizované astmatem, hypereozinofilií v periferní krvi a histologickým obrazem nekrotizující vaskulitidy, extravaskulárních granulomů a tkáňové eozinofilie. Incidence se odhaduje na 0,5–6,8 nových případů na 1 milion obyvatel. Prevalence EGPA je 10,7–13 případů na 1 milion obyvatel. Onemocnění postihuje hlavně dospělé ve věku mezi 40 a 50 lety (14). V séru jsou přítomny ANCA protilátky (protilátky proti cytoplazmě neutrofilů) u 55–67 % nemocných. Většinou jsou to p-ANCA (perinukleární protilátky proti myeloperoxidáze, MPO). Typickým laboratorním nálezem je eozinofilie v diferenciálním krevním obraze přesahující 1,5 × 109/l. Moiseev rozdělil toto onemocnění do dvou odlišných syndromů na základě MPO + ANCA pozitivity. První skupina nemocných s EGPA má pozitivní MPO + ANCA protilátky a tvoří eozinofilní autoimunitní onemocnění, které sdílí podobné klinické rysy a HLA DQ (skupina molekul hlavního histokompatibilního komplexu II) asociací s MPO + ANCA asociovanou vaskulitidou. Nemocní mají často neuropatie a postižení ledvin – glomerulonefritidu. Druhá skupina jsou pacienti MPO + ANCA negativní. Tento fenotyp může mít původ v dysfunkci slizniční bariéry a u nemocných jsou přítomny plicní infiltráty a postižení srdce (15). Onemocnění probíhá ve třech fázích, první je charakterizovaná alergickými projevy jako alergickou rýmou a průduškovým astmatem, ve druhé fází se objevuje eozinofilie v krvi a ve tkáních s eozinofilními plicními infiltráty a plicní nodulace bez tendence k rozpadům. Třetí fáze je vlastně již přítomnost systémové vaskulitidy s celkovými projevy: únavou, horečkou, ztrátou hmotnosti, bolestmi kloubů, svalstva a projevy poškození jednotlivých orgánů (14).
Účinnost a bezpečnost mepolizumabu jako přídatné léčby k systémovým kortikosteroidům byla proti placebu u EGPA hodnocena ve studii MIRRA (16). Tato multicentrická randomizovaná, dvojitě zaslepená studie fáze III prokázala významné delší celkové období remise při léčbě mepolizumabem v. s. placebo (OR 5,91, CI 2,68–13,03; p < 0,001). Dále 32 % pacientů ze skupiny mepolizumabu vs 3 % ze skupiny placeba dosáhlo remise ve 36. a 48. týdnu (OR 16,74, 95 % CI 3,61–77,56, p < 0,001). Dále byl pozorován nižší výskyt relapsů při léčbě mepolizumabem vs. placebem. Mepolizumab oproti placebu významně prodloužil čas do prvního relapsu v průběhu 52 týdnů. Remise trvající ≥ 24 týdnů dosáhlo 33 % pacientů se vstupním počtem eozinofilů ≥ 1,5 × 109/l léčených mepolizumabem vs. 0 % na placebu. Mepolizumab dále zajišťoval trvalé snížení počtu eozinofilů v periferní krvi oproti placebu. Byla prokázána i nižší průměrná dávka p. o. glukokortikoidů ve 48.–52. týdnu při léčbě mepolizumabem vs. placebem (OR 0,20, 95% CI 0,09–0,41; p < 0,001) (16). Souhrnný článek o mepolizumabu ve vztahu k léčbě eozinofilní granulomatózy s polyangiitidou byl nedávno publikován i u nás (17).
Hypereozinofilní syndrom (HES)
HES je vzácná, heterogenní skupina onemocnění definovaná přítomností trvalého počtu eozinofilů v krvi a/nebo tkáni (≥ 1500 buněk/µl v krvi) a eozinofilním poškozením cílových orgánů. Právě zvýšený počet eozinofilů v krvi je takovým náhradním markerem pro tkáňovou eozinofilii a orgánové poškození. Snížení eozinofilie je terapeutický cíl, který má zvrátit a zabránit dalšímu orgánovému postižení. Mechanismy zvýšené eozinofilie u HES se liší (subtypy HES). Vzájemně se liší klinickými projevy, prognózou a odpovědí na léčbu. Léčebné možnosti HES jsou podobně jako u EGPA omezené se standardní terapií zahrnující systémové kortikosteroidy a cytotoxickou/imunosupresivní terapii (18).
Studie 200622 pro HES byla randomizovaná, dvojitě zaslepená, placebem kontrolovaná 32týdenní studie, které hodnotila 108 pacientů s HES ve věku ≥ 12 let (19). Pacientům byla jako doplněk k základní léčbě HES jednou za 4 týdny subkutánně podávána dávka 300 mg mepolizumabu nebo placebo. Základní léčba HES v této studii zahrnovala mimo jiné perorální kortikosteroidy, imunosupresiva, cytotoxickou léčbu a další symptomatickou léčbu HES. Pacienti zařazení do studie prodělali nejméně dvě vzplanutí HES a při screeningu měli počet eozinofilů v krvi ≥ 1 000 buněk/µl. Ze studie byli vyloučeni pacienti s FIP1L1-PDGFR-alfa pozitivitou. Primárním cílem studie byl podíl pacientů, u nichž došlo v průběhu 32týdenního léčebného období ke vzplanutí HES. Vzplanutí HES bylo definováno jako zhoršení klinických známek a příznaků HES, jež vyvolalo potřebu zvýšit dávky celkových kortikosteroidů, případně jinou imunosupresivní medikaci. V průběhu 32týdenního léčebného období zaznamenalo vzplanutí HES nebo odstoupení ze studie o 50 % méně pacientů ve skupině léčené 300 mg mepolizumabu oproti skupině na placebu, konkrétně 28 % oproti 56 % (OR 0,28, 95 % CI 0,12–0,64) (19).
Kontraindikace
Kontraindikace jsou velmi vzácné a zahrnují hypersenzitivitu na léčivou látku nebo na kteroukoliv obsaženou pomocnou látku. Po podání mepolizumabu se vyskytly výjimečně akutní a opožděné systémové reakce včetně reakcí hypersenzitivity (např. anafylaxe, kopřivka, angioedém, vyrážka, bronchospazmus, hypotenze). Tyto reakce se zpravidla objevily během několika hodin po podání, někdy měly opožděný nástup.
Nežádoucí účinky
V placebem kontrolovaných studiích u dospělých a dospívajících pacientů s těžkým refrakterním eozinofilním astmatem byly nejčastěji hlášenými nežádoucími účinky během léčby bolest hlavy (20 %), reakce v místě podání injekce (8 %) a bolest zad (6 %). Ve studiích s CRSwNP byly nejčastěji hlášeny během léčby bolest hlavy (18 %) a bolest zad (7 %). Ve studiích u pacientů s EGPA byly nejčastěji hlášenými nežádoucími účinky bolesti hlavy (32 %), reakce v místě vpichu (15 %) a bolest zad (13 %). U 4 % pacientů s EGPA byly hlášeny systémové alergické/ hypersenzitivní reakce. U pacientů s HES byly nejčastěji hlášeny bolest hlavy (13 %), infekce močových cest (9 %), reakce v místě vpichu a horečka (obojí po 7 %).
Zvláštní populace
U starších pacientů není nutná úprava dávky, úpravu dávky také nevyžaduje porušená funkce ledvin nebo jater.
Parazitární infekce
Eozinofily mohou být zapojeny do imunologické odpovědi na některé parazity. Pacienty s již exitující parazitární infekcí je nutno před zahájením léčby mepolizumabem léčit. Jsou-li pacienti infikovaní během léčby mepolizumabem a neodpovídají-li na antiparazitární léčbu, je třeba zvážit dočasné přerušení léčby (21).
Lékové interakce
Clearence mepolizumabu není ovlivněna enzymy cytochromu P 450, efluxními pumpami a mechanismem vazby na bílkoviny. Pravděpodobnost potencionálních lékových interakcí s mepolizumabem je tedy nízká (21).
Fertilita, těhotenství a kojení (21)
Množství údajů o podávání těhotným ženám je omezené (výsledky u méně než 300 těhotenství). U opic prochází mepolizumab placentární bariérou. Studie na zvířatech nenaznačují reprodukční toxicitu. Potenciál škodlivosti pro plod není znám. Z bezpečnostních důvodů se nedoporučuje podávat přípravek Nucala během těhotenství. Podávání lze zvážit pouze pokud očekávaný přínos pro matku převýší jakékoliv možné riziko pro plod (20).
Není známo, zda se mepolizumab vylučuje do lidského mateřského mléka. O tom, zda přerušit kojení, nebo ukončit podávání je nutno rozhodnout individuálně.
Studie na zvířatech také neprokázaly žádné nežádoucí účinky anti-IL-5 na plodnost (21).
Dávkování a způsob podání (21)
Přípravek mepolizumab (Nucala) má být předepisován lékaři, kteří mají zkušenost s diagnózou a léčbou těžkého refrakterního eozinofilního astmatu, CRSwNP, EGPA nebo HES, tedy indikace je pouze v centrech.
Těžké eozinofilní astma
Dospělým a dospívajícím ve věku 12 let a starším je doporučená dávka mepolizumabu 100 mg podaná subkutánně jednou za 4 týdny. U dětí ve věku 6 až 11 let je doporučená dávka mepolizumabu 40 mg podaná subkutánně jednou za 4 týdny.
Přípravek Nucala je zde určen pro dlouhodobou léčbu. Potřebu pokračovat v léčbě je třeba hodnotit alespoň jednou ročně na základě posouzení závažnosti astmatu a úrovně kontroly exacerbací.
CRSwNP
Zde je mepolizumab indikován pro dospělé pacienty 100 mg subkutánně jednou za 4 týdny.
Přípravek Nucala je určen pro dlouhodobou léčbu. U pacientů, kteří po 24 týdnech léčby CRSwNP nevykazují žádnou odpověď, lze zvážit alternativní léčbu. U některých pacientů, u nichž je odpověď na léčbu zpočátku pouze částečná, může dojít ke zlepšení, pokud se v léčbě pokračuje po delší dobu než 24 týdnů. V době psaní článku je možné indikovat pouze na paragraf 16.
EGPA
U dospělých a dospívajících ve věku 12 let a starších je dávka mepolizumabu 300 mg podaná subkutánně jednou za 4 týdny. Ve věku 6 až 11 let s tělesnou hmotností ≥ 40 kg je doporučená dávka mepolizumabu 200 mg subkutánně jednou za 4 týdny, u dětí ve věku 6 až 11 let s tělesnou hmotností < 40 kg je doporučená dávka mepolizumabu 100 mg podaná subkutánně jednou za 4 týdny.
I zde je léčba dlouhodobá, potřebu pokračovat v léčbě je třeba přehodnotit alespoň jednou ročně na základě lékařského posouzení a zlepšení kontroly symptomů. Potřebu pokračovat v léčbě je třeba přehodnotit rovněž u pacientů, u nichž dojde k rozvoji život ohrožujících projevů EGPA, neboť u této populace nebyl přípravek Nucala hodnocen. V případě EGPA zatím není léčba hrazena a pacienty je možno indikovat na paragraf 16.
HES
Doporučená dávka mepolizumabu je 300 mg podaná subkutánně jednou za 4 týdny. Indikován pro dospělé pacienty.
I zde je léčba indikovaná dlouhodobě. Potřebu pokračovat v léčbě je třeba přehodnotit alespoň jednou ročně na základě lékařského posouzení závažnosti onemocnění a úrovně kontroly symptomů.
Potřebu pokračovat v léčbě je třeba přehodnotit rovněž u pacientů, u nichž dojde k život ohrožujících projevů HES, neboť u této populace nebyl přípravek Nucala hodnocen.
I v případě HES zatím není indikace hrazena a pacienty je možno indikovat pouze na paragraf 16.
Způsob podání
Mepolizumab (přípravek Nucala) je určen pouze pro subkutánní injekční podání. Injekce může být podána do horní části paže, do stehna nebo břicha. V případě podání více než jedné injekce se doporučuje, aby místa vpichu každé injekce byla od sebe vzdálena alespoň 5 cm (21).
Závěr
Mepolizumab (komerčně prodáván jako Nucala 100 mg prášek pro injekční roztok) je účinné a bezpečné léčivo u řady chronických eozinofilních onemocnění. V současné době je tato biologická léčba indikována u nemocných s těžkým refrakterním eozinofilním astmatem, chronickou rinosinusitidou s polypy, eozinofilní granulomatózou s polyangiitidou a u hypereozinofilního syndromu. Indikace a podávání je vázáno v České republice na Národní centra těžkého astmatu (NTCA) (22) a v případě rinosinusitidy je v rukou ORL specialistů.
Tato práce byla podpořena výzkumným programem Univerzity Karlovy,
Cooperatio 34.doc. MUDr. Norbert Pauk, Ph.D.
Klinika pneumologie 3. LF UK a Fakultní nemocnice Bulovka, Praha
norbert.pauk@bulovka.cz
Zdroje
- Matera MG, Calzetta L, Rogliani P, Cazzola M. Monoclonal antibodies for severe asthma: Pharmacokinetic profiles. Respir Med. 2019 Jul;153 : 3-13. doi: 10.1016/j.rmed.2019.05.005. Epub 2019 May 13. PMID: 31136930.
- Hammad H, Lambrecht BN. The basic immunology of asthma. Cell. 2021 Mar 18;184(6):1469-1485. doi: 10.1016/j.cell.2021.02.016. Epub 2021 Mar 11. Erratum in: Cell. 2021 Apr 29;184(9):2521-2522. PMID: 33711259.
- GINA (Global Initiative for Asthma). Global Strategy for Asthma Management and Prevention. 2022. http://www.ginasthma.org
- Teřl M, Sedlák V, Krčmová I. Doporučený postup diagnostiky a léčby těžkého astmatu. Stud. Pneumol. Phthiseol. 82, č. 4, 2022.
- Pavord ID, Korn S, Howarth P, et al. Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, double-blind, placebo-controlled trial. Lancet. 2012 Aug 18;380(9842):6519. doi: 10.1016/S0140-6736(12)60988-X. PMID: 22901886.
- Ortega HG, Liu MC, Pavord ID, et al; Mepolizumab treatment in patients with severe eosinophilic asthma. N Engl J Med. 2014 Sep 25;371(13):1198-207. doi: 10.1056/NEJMoa1403290. Epub 2014 Sep 8. Erratum in: N Engl J Med. 2015 Apr 30;372(18):1777. PMID: 25199059.
- Bel EH, Wenzel SE, Thompson PJ, et al. Oral glucocorticoid-sparing effect of mepolizumab in eosinophilic asthma. N Engl J Med. 2014 Sep 25;371(13):1189-97. doi: 10.1056/ NEJMoa1403291. Epub 2014 Sep 8. PMID: 25199060.
- Gibson PG, Prazma CM, Chupp GL, et al. Mepolizumab improves clinical outcomes in patients with severe asthma and comorbid conditions. Respir Res. 2021 Jun 7;22(1):171. doi: 10.1186/s12931-021-01746-4. PMID: 34098955; PMCID: PMC8182929.
- Khurana S, Brusselle GG, Bel EH, et al. Long-term Safety and Clinical Benefit of Mepolizumab in Patients With the Most Severe Eosinophilic Asthma: The COSMEX Study. Clin Ther. 2019 Oct;41(10):2041-2056.e5. doi: 10.1016/j.clinthera.2019.07.007. Epub 2019 Aug 22. PMID: 31447130.
- Harrison T, Canonica GW, Chupp G, et al. Real-world mepolizumab in the prospective severe asthma REALITI-A study: initial analysis. Eur Respir J. 2020 Oct 15;56(4):2000151. doi: 10.1183/13993003.00151-2020. PMID: 32817259; PMCID: PMC7559868.
- Pilette C, Canonica GW, Chaudhuri R, et al. REALITI-A Study: Real-World Oral Corticosteroid-Sparing Effect of Mepolizumab in Severe Asthma. J Allergy Clin Immunol Pract. 2022 Oct;10(10):2646-2656. doi: 10.1016/j.jaip.2022.05.042. Epub 2022 Jun 24. PMID: 35753668. 12.
- Hellings PW, Verhoeven E, Fokkens WJ. State-of-the-art overview on biological treatment for CRSwNP. Rhinology. 2021 Apr 1;59(2):151-163. doi: 10.4193/Rhin20.570. PMID: 33459728.
- Han JK, Bachert C, Fokkens W, Desrosiers M, et al. SYNAPSE study investigators. Mepolizumab for chronic rhinosinusitis with nasal polyps (SYNAPSE): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Respir Med. 2021 Oct;9(10):1141-1153. doi: 10.1016/S2213-2600(21)00097-7. Epub 2021 Apr 16. PMID: 33872587.
- Raffray L, Guillevin L. Updates for the treatment of EGPA. Presse Med. 2020 Oct;49(3):104036. doi: 10.1016/j.lpm.2020.104036. Epub 2020 Jul 8. PMID: 32652104.
- Moiseev S, Cohen Tervaert JW, Arimura Y, et al. 2020 international consensus on ANCA testing beyond systemic vasculitis. Autoimmun Rev. 2020 Sep;19(9):102618. doi: 10.1016/j.autrev.2020.102618. Epub 2020 Jul 12. PMID: 32663621.
- Wechsler ME, Akuthota P, Jayne D, et al. Mepolizumab or Placebo for Eosinophilic Granulomatosis with Polyangiitis. N Engl J Med. 2017 May 18;376(20):1921-1932. doi: 10.1056/ NEJMoa1702079. PMID: 28514601; PMCID: PMC5548295.
- Žurkova M, Jakubec P, Lošťáková V, et al.Mepolizumab v léčbě eozinofilní granulomatózy s polyangiitidou. Remedia. 2023;33 : 1-6.
- Requena G, van den Bosch J, Akuthota P, et al. Clinical Profile and Treatment in Hypereosinophilic Syndrome Variants: A Pragmatic Review. J Allergy Clin Immunol Pract. 2022 Aug;10(8):2125-2134. doi: 10.1016/j.jaip.2022.03.034. Epub 2022 Apr 22. PMID: 35470096.
- Roufosse F, Kahn JE, Rothenberg ME, et al. HES Mepolizumab study group. Efficacy and safety of mepolizumab in hypereosinophilic syndrome: A phase III, randomized, placebo-controlled trial. J Allergy Clin Immunol. 2020 Dec;146(6):1397-1405. doi: 10.1016/j. jaci.2020.08.037. Epub 2020 Sep 18. PMID: 32956756; PMCID: PMC9579892.
- Domingo Ribas C, Carrillo Díaz T, Blanco Aparicio M, et al. REal worlD Effectiveness and Safety of Mepolizumab in a Multicentric Spanish Cohort of Asthma Patients Stratified by Eosinophils: The REDES Study. Drugs. 2021 Oct;81(15):1763-1774. doi: 10.1007/ s40265-021-01597-9. Epub 2021 Sep 29. Erratum in: Drugs. 2021 Oct 21;: PMID: 34586602; PMCID: PMC8550660.
- Nucala 100 mg inj plv sol 1, Available from: www.sukl.cz.
- Národní centra těžkého astmatu; Available from: www.tezke-astma.cz.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Dyslipidemie – známá neznámá
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2023 Číslo 5- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Kardiovaskulární onemocnění a transplantace ledviny
- Důsledky vysoce supresivní léčby infekce HIV
- Interní komorbidity a komplikace terapie roztroušené sklerózy – nenechte se zaskočit!
- Akutní poškození ledvin u pacientů s jaterní cirhózou - shrnutí pro praxi
- Dyslipidemie – známá neznámá
- Diferencovaný karcinom štítné žlázy – možná rizika léčby, supresní léčby a adherence k současným doporučení
- Atypická forma Goodpastureovy nemoci
- Farmakologický profil mepolizumabu
- Co je nového v pneumologii – rok 2022
- Finerenon: další možnost léčby u pacientů s chronickým onemocněním ledvin a diabetem 2. typu
- Zemřela prof. MUDr. Marie Brodanová, DrSc.
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Akutní poškození ledvin u pacientů s jaterní cirhózou - shrnutí pro praxi
- Dyslipidemie – známá neznámá
- Co je nového v pneumologii – rok 2022
- Kardiovaskulární onemocnění a transplantace ledviny
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



