-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Diferencovaný karcinom štítné žlázy – možná rizika léčby, supresní léčby a adherence k současným doporučení
Differentiated thyroid cancer – possible risks of treatment, suppressive therapy and adherence to current recommendations
Thyroid carcinoma (TC) is rare and represents 1–2 % of all human tumors. The incidence of TC has been increasing worldwide. TC comprises of a heterogeneous group of tumours with variable biological activity. Women are mostly affected. TC can be divided in differentiated TC/DTCs (papillary – PTC, follicular – FTC, from Hürthle cells – HCC), medullary carcinoma – MTC and anaplastic thyroid cancer – ATC. In this article, we focus on possible pitfalls of suppression therapy (cardiovascular, bone and mental), particularly in low-risk patients, and we discuss the data on the adherence to guidelines for suppression therapy in DTC.
Keywords:
adherence – risks – differentiated thyroid cancer – supression therapy
Autoři: Petra Němčíková 1,2; Ludmila Brunerová 1,3
Působiště autorů: 3. lékařská fakulta Univerzity Karlovy, Praha 1; Oddělení nukleární medicíny Nemocnice České Budějovice 2; Interní klinika FNKV a 3. LF UK Praha 3
Vyšlo v časopise: Vnitř Lék 2023; 69(5): 312-315
Kategorie: Přehledové články
doi: https://doi.org/10.36290/vnl.2023.061Souhrn
Karcinomy štítné žlázy (TC) jsou vzácné, představují 1–2 % všech lidských nádorů. Tvoří heterogenní skupinu nádorů s variabilní biologickou aktivitou, celosvětově rostoucí incidencí a vyšším výskytem u žen. Dělí se na skupinu diferencovaných karcinomů (DTC), zahrnujících papilární karcinom (PTC), folikulární karcinom (FTC) a karcinom z Hürthleho buněk (HCC), dále medulární karcinom (MTC) a anaplastický karcinom (ATC). V tomto článku se věnujeme možným rizikům supresní terapie u pacientů s DTC (zvláště ve skupině s nízkým rizikem) – kardiovaskulárním, kostním a psychickým, a diskutujeme data o adherenci k současným doporučením této terapie.
Klíčová slova:
rizika – adherence – diferencované karcinomy štítné žlázy – supresní terapie
Úvod
Nádory štítné žlázy jsou poměrně vzácné a představují nejčastější nádory v endokrinologii. Diferencované karcinomy štítné žlázy (DTC) vznikají z folikulárních buněk, jedná se o heterogenní skupinu nádorů, kam patří papilární karcinom (PTC), folikulární karcinom (FTC) a karcinom z Hürthleho buněk (HCC).
Incidence DTC roste celosvětově i v České republice (ČR). V roce 2021 bylo v ČR nově diagnostikováno 1 148 případů, tj. incidence 10,9 na 100 000 osob (1). V mezinárodním srovnání incidence karcinomu štítné žlázy obsazuje ČR 13.–14. místo v Evropě. Rostoucí výskyt karcinomů štítné žlázy v posledních 30 letech je způsoben především detekcí malých (≤ 2 cm) nádorů v důsledku dostupnosti a zvýšené četnosti provádění zobrazovacích vyšetření, především ultrasonografie (2).
DTC se častěji vyskytují u žen. Mezi rizikové faktory spojené s jejich výskytem patří pozitivní rodinná anamnéza DTC u příbuzného prvního stupně, expozice radiační zátěži a vzácné genetické syndromy (3). Prognóza pacientů s DTC (na rozdíl od pacientů s ATC) je velmi dobrá.
Klasifikace nádorů štítné žlázy
Při volbě optimálního léčebného postupu je nutné vždy posoudit rizikovost nádoru a klasifikovat stadium onemocnění (4).
Klasifikace TNM je založena na velikosti primárního nádoru, počtu a lokalizaci metastáz do lymfatických uzlin a přítomnosti vzdálených metastáz (4, 5). Na základě TNM se pacienti dělí do tří skupin dle rizika mortality:
- skupina s velmi nízkým rizikem: pT1a, cN0/pN0, CM0,
- skupina s nízkým rizikem: pT1b, pT2, cN0/pN0, CM0,
- vysoce riziková skupina: pT3, pT4 každé N1, všechny M1.
Americká tyreoidální asociace (ATA) ve svých posledních doporučeních (6) navrhuje dělení DTC na základě výskytu četnosti rizika recidivy podle některých strukturálních charakteristik (Tab. 1).
Terapie diferencovaného karcinomu štítné žlázy
Terapie karcinomů štítné žlázy vyžaduje multioborový přístup zahrnující spolupráci specialistů v oboru endokrinologie, tyreochirurgie a nukleární medicína. Léčba je primárně chirurgická, s totálním odstraněním štítné žlázy (TTE) a následnou terapií radiojódem (nádorové tkáně a případné metastázy diferencovaného karcinomu si zachovávají schopnost akumulovat jód) (4).
V poslední dekádě však odborné společnosti doporučují méně agresivní a personalizovaný přístup (např. hemithyroidektomie u pacientů s nízce rizikovými nádory, tj. cytologicky prokázaný PTC do velikosti uzlu 4 cm, při absenci rizikových faktorů jako infiltrace štítné žlázy, histologické varianty papilárního karcinomu, nízký stupeň diferenciace, multifokalita, molekulární markery jako BRAF-V600E, TERT mutace či anamnéza zevního ozařování krku) (6, 7).
Recentně přibývá dat o efektivitě miniinvazivních přístupů – radiofrekvenční ablace (RFA) a mikrovlnné ablace (MWA), tedy metod založených na tepelných účincích vysokofrekvenčního elektrického proudu nebo mikrovln na tkáně. Zavedení speciální sondy s elektrodami pod navigací CT nebo ultrazvuku umožnuje směřovat energii přímo do nádorového ložiska (tzv. termální ablace). Výhodou těchto metod je absence celkové anestezie, šetrnost k okolním tkáním, malé riziko komplikací a rychlost celého zákroku.
RFA představuje terapeutickou možnost u pacientů s recidivami DTC v oblasti krku, kteří mají vysoké chirurgické riziko nebo odmítají další operaci. Perspektivně by se mohla stát léčebnou modalitou papilárních mikrokarcinomů, zejména po vyřešení otázky přesného stagingu a rizikové stratifikace onemocnění (8). Definitivní postavení těchto miniinvazivních léčebných přístupů bude však třeba podpořit prospektivními studiemi.
Terapie DTC radijódem probíhá na specializovaných lůžkových stanicích nukleární medicíny v hluboké endogenní hypotyreóze nebo po předchozí stimulaci rekombinantním lidským tyrotropinem (rhTSH) a jejím cílem je eliminace reziduální tkáně štítné žlázy po TTE a adjuvantně eliminace mikroskopického onemocnění. Léčba radiojódem není obvykle indikována u pacientů v kategorii velmi nízkého rizika (dle TNM); v současné době není k dispozici dostatek dat o efektu léčby radiojódem na riziko rekurence nádoru u pacientů v kategorii nízkého rizika dle TNM, léčba by měla být indikována selektivně (9).
Přestože má léčba DTC obvykle velmi dobrý průběh a nízkou úmrtnost, vyžaduje toto onemocnění pravidelnou dispenzarizaci.
Tab. 1. Rizikovost pacienta z hlediska recidivy DTC dle ATA (6) 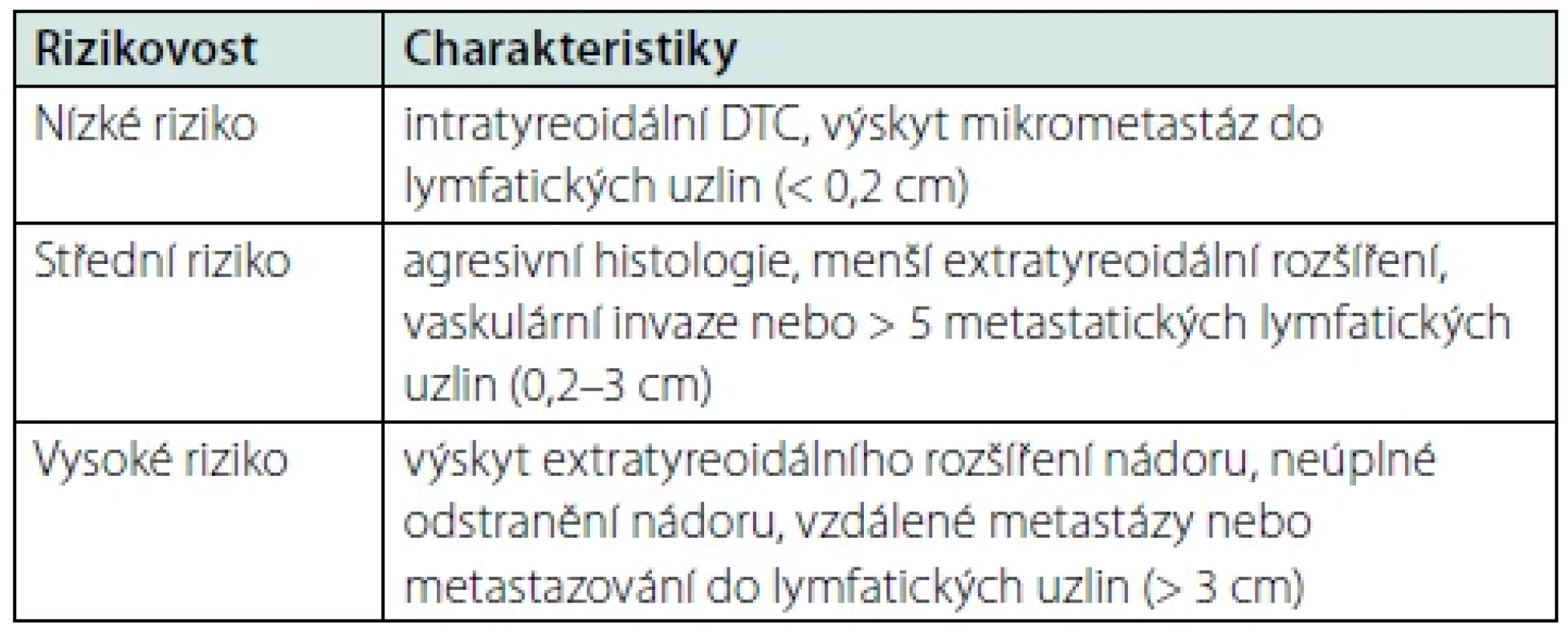
Hormonální léčba
Po totální tyroidektomii je samozřejmě nutné doživotní podávání substituční hormonální terapie, obvykle ve formě monoterapie levotyroxinem (LT4). Vzhledem k tomu, že TSH stimuluje růst zbývajících tyreoidálních buněk (tedy i nádorových), je nezbytné, aby počáteční dávka LT4 byla dostatečně vysoká, aby bylo dosaženo útlumu sekrece TSH.
Supresní terapie je nutná pouze u perzistujících nádorů, obvykle u většiny pacientů s biochemicky nekompletní odpovědí (negativní zobrazení + hladina tyreoglobulinu/Tg při supresi ≥ 1 ng/ml nebo TSH-stimulovaná hladina Tg ≥ 10 ng/ml nebo rostoucí anti-Tg protilátky) a přechodně u vysoce rizikových DTC (2, 6). U pacientů s nízkým rizikem a při vynikající odpovědi na léčbu (tj. je dosaženo hladiny Tg při supresi < 0,2 ng/ml, či TSH-stimulované hladiny Tg < 1 ng/ml při negativitě anti-Tg protilátek a nejsou scintigrafické, sonografické ani klinické známky relapsu) můžeme sérovou hladinu TSH udržovat v rozmezí 0,5–2,0 mU/l (6). Pacienti s neurčenou odpovědí na léčbu (nespecifický zobrazovací nález, slabé vychytávání radiojódu v lůžku po TTE, detekovatelná hladina Tg při supresi, ale pod < 1 ng/m, případně stimulovaná < 10 ng/ml) vyžadují opakované zobrazení a monitoraci Tg a aktivizaci při suspektním nálezu. U pacientů se strukturálně inkompletní odpovědí se další léčba volí na základě celé řady klinicko-patologických faktorů (6).
Správně indikovaná supresní léčba snižuje riziko rekurence nádorového onemocnění, přílišná a neodůvodněná supresní terapie však může vést k nežádoucím projevům subklinické hypertyreózy, které zahrnují zejména srdeční komplikace a osteoporózu.
Komplikace spojené se supresní terapií hormony štítné žlázy
Kardiovaskulární komplikace
Tyreoidální hormony ovlivňují mnoho metabolických procesů v organismu, stěžejním je jejich vliv na srdeční výkon působením na myokard a cévní systém. Biologicky účinným hormonem je trijodtyronin (T3). Za fyziologických okolností většina T3 vzniká dejodací z tyroxinu (T4) ve štítné žláze a v periferních tkáních působením enzymů dejodáz, jen malá část T3 (asi 20 %) vzniká syntézou ve štítné žláze. T3 má vliv na metabolismus řady důležitých strukturálních i funkčních srdečních proteinů. Nadbytek volných hormonů štítné žlázy vyvolává tachykardii a hyperkinetickou cirkulaci, a přestože zvyšuje sílu srdečního stahu, může vyústit do srdečního selhání.
Nejčastější a známou kardiovaskulární komplikací nadbytku hormonů štítné žlázy je fibrilace nebo flutter síní. Bylo zjištěno, že osoby ve věku nad 60 let se suprimovanou hladinou TSH měly 3× vyšší riziko vzniku fibrilace síní (10).
V metaanalýze 12 prospektivních studií z let 1950–2008 zahrnující 140 449 osob zvyšovala subklinická hypertyreóza oproti kontrolám kardiovaskulární (KV) morbiditu o 21 %, KV mortalitu o 19 % a celkovou mortalitu o 12 %. Pro srovnání jsou tyto parametry u subklinické hypotyreózy o 20, 18 a 12 % (11).
Podmínkou supresní terapie levotyroxinem je proto u polymorbidních pacientů ve vyšším věku dobrá compliance a pečlivá dispenzarizace.
Osteologické komplikace
Tyreoidální hormony významně ovlivňují kost ve všech životních obdobích (od fetálního po dospělost) a jejich působení je přímé (prostřednictvím RANKL (receptor activator of nuclear factor kappa beta) i nepřímé (prostřednictvím růstových faktorů, pohlavních hormonů, parathormonu, vitaminu D atd.). Nadbytek hormonů štítné žlázy vede ke zvýšení kostní resorpce, poklesu BMD (hustota kostního minerálu) (preferenčně v oblasti kosti kortikální) a vyššímu riziku fraktur (12).
Na základě recentních studií představuje supresní terapie u pacientů s DTC významný rizikový faktor kostního postižení. Ve studii Rana et al. bylo u postmenopauzálních pacientek s DTC na supresní léčbě popsáno nižší trabekulární kostní skóre (TBS, parametr odpovídající kvalitě kosti, nezávislý prediktor fraktur v obecné populaci) a TBS byl identifikován jako nezávislý prediktor rizika osteoporotických fraktur v této skupině pacientů (13).
Dle výsledků metaanalýzy, zahrnující 17 studií (739 pacientů a 1085 kontrol), byl u postmenopauzálních žen s DTC na supresní léčbě pozorován signifikantní pokles BMD v oblasti lumbální páteře i proximálního femuru. Naopak u premenopauzálních žen tento trend snížení BMD zaznamenán nebyl. U mužů nebyla ve srovnání s kontrolami zjištěna žádná významná souvislost mezi supresní terapií a BMD (14).
Recentně publikovaná retrospektivní studie hodnotila načasování opakovaného testování BMD u pacientů s DTC a supresí TSH. U pacientek starších 50 let, které byly léčené supresní terapií pro DTC, byl odhadovaný časový interval pro přechod k osteoporóze 85, 65 a 15 měsíců u mírné, středně těžké a těžké osteopenie (15).
Na základě výsledků těchto studií lze doporučit pravidelný denzitometrický skrínink u postmenopauzálních pacientek léčených supresní terapií pro DTC.
Psychické komplikace
O vlivu suprese TSH na mentální zdraví (úzkostnost, depresivita, kognitivní dysfunce) a kvalitu života bylo publikováno pouze několik prací, obvykle však s limitovaným počtem pacientů.
V turecké studii se 127 pacienty porovnávali autoři úzkostnost, depresivitu a kvalitu života dvou skupin pacientů – pacientů po TTE pro DTC s iatrogenní subklinickou hypertyreózou v rámci supresní léčby a u euthyreózních pacientů po TTE pro benigní tyreopatii. Ve skupině pacientů léčených levotyroxinem v suprafyziologických dávkách byla zjištěna vyšší úzkostnost a zhoršená kvalita života než v kontrolní skupině pacientů v eutyreóze (16).
Do další turecké studie bylo zařazeno 191 pacientů (ve věku 18–76 let) s diagnózou nemetastazujícího DTC a 79 zdravých jedinců. Pacienti s DTC byli stratifikováni do tří skupin podle hladin TSH: suprimované TSH (pod 0,1 mIU/l), mírně suprimované TSH (0,11–0,49 mIU/l) a eutyreóza (THS mezi 0,5 a 2 IU/l). Všichni účastníci vyplnili baterii dotazníků hodnotících depresi, úzkost, kvalitu spánku a kvalitu života. Deprese, úzkostné poruchy a problémy se spánkem byly častější u pacientů s DTC, přičemž byly výraznější ve skupině se suprimovaným TSH. Tyto výsledky nepřímo korelovaly s hodnotami TSH a pozitivně korelovaly s délkou užívání LT4 (17).
Supresní léčba dle dostupných dat pravděpodobně negativně ovlivňuje psychické zdraví a kvalitu života.
Adherence k současným doporučením
V ČR nejsou k dispozici data o adherenci lékařů k současným doporučením substitučně supresní terapie u DTC. Velmi limitovaná zahraniční data ukazují, že téměř polovina specialistů nerespektuje platná doporučení a u pacientů s nízkorizikovým karcinomem cílí na hladinu TSH významně pod doporučené rozmezí.
V letech 2018–2019 proběhl v Georgii a Los Angeles průzkum mezi lékaři chirurgy a endokrinology, kteří mají v péči pacienty s DTC. Lékaři byli požádáni, aby uvedli, s jakou pravděpodobností doporučí supresní terapii, tj. TSH < 0,5 mIU/l ve třech klinických modelech: pacienti se středním rizikem, s nízkým rizikem a velmi nízkým rizikem recidivy PTC. Celkově 80,4 % lékařů pravděpodobně / velmi pravděpodobně doporučilo supresi TSH u pacientů se středně rizikovým papilárním karcinomem štítné žlázy; 48,8 % u pacientů s nízkým rizikem papilárního karcinomu štítné žlázy a 29,7 % u pacienta s velmi nízkým rizikem. Lékaři, kteří dispenzarizovali více pacientů, méně pravděpodobně doporučovali supresi TSH u pacientů s nízkým a velmi nízkým rizikem (18).
Velmi zajímavá průřezová studie byla provedena ve 21 lékařských centrech ve 12 městech v Turecku. Do studie bylo zařazeno 1125 pacientů s DTC sledovaných nejméně jeden rok ve stejném centru. Během poslední návštěvy byly zaznamenány klinické údaje, sérové hladiny TSH, volného tyroxinu (FT4), tyreoglobulinu (Tg) a anti-Tg protilátek. Stratifikace rizika pro předpověď přetrvávání nebo rekurence onemocnění byla hodnocena pomocí kalkulátoru (American Joint Committee on Cancer-7th edition thyroid cancer staging calculator). Sérové koncentrace TSH byly hodnoceny jako těžká suprese (TSH < 0,01 mU/l), střední suprese (TSH: 0,01–0,1 mU/l), mírná suprese (TSH: 0,1–0,5 mU/l), eutyreóza (TSH 0,5–4 mU/l) a hypotyreóza (TSH > 4 mU/l). U 29,2 % pacientů s DTC byly sérové hladiny TSH na cílové úrovni. Zbývající pacienti měli hladiny TSH pod nebo nad léčebným rozmezím, což představovalo riziko vedlejších účinků léčby (19).
Závěr
Diferencovaný karcinom štítné žlázy patří mezi vzácné nádory se stále rostoucí incidencí. Standardizované diagnostické a léčebné postupy a pravidelná dispenzarizace přispívají k velmi dobré prognóze většiny pacientů. V posledních letech sílí tendence k minimálně invazivním způsobům léčby (lobektomie, MW či RF destrukce, bez následné léčby radiojódem) u nízkorizikových nádorů.
Vzhledem k možným rizikům supresní léčby (kardiovaskulární, kostní, psychické) je však klíčové ji indikovat uvážlivě na základě stratifikace pacientů podle rizikovosti recidivy DTC a přítomných komorbidit, optimálně v souladu se současně platnými doporučeními. Velmi limitovaná dostupná data o adherenci k aktuálním terapeutickým doporučením naznačují, že adherence lékařů není optimální.
Práce byla podpořena Cooperatio 37 – Metabolic Diseases a MH CZ – DRO („Kralovske Vinohrady University Hospital – FNKV, 00064173“).
doc. MUDr. Ludmila Brunerová, Ph.D.
Interní klinika FNKV a 3. LFUK Praha
ludmila.brunerova@fnkv.cz
Zdroje
- Epidemiologie zhoubných nádorů data z roku 2021. Available from: www: <https:// www.svod.cz/>.
- Ahn HS, Kim HJ, Kim KH, et al. Thyroid cancer screening in South Korea increases detection of papillary cancers with no impact on other subtypes or thyroid cancer mortality. Thyroid. 2016;26(11):1535-1540.
- Fagin JA, Wells SA. Biologic and clinical perspectives on thyroid cancer. N Engl J Med. 2016;375(11):1054-1067.
- Vlček P, Nováková D, Katra R. Karcinomy štítné žlázy: současný pohled na diagnostiku a léčbu. Vnitr Lek. 2017;63(9):572-579.
- Brierley JD (ed.), Gospodarowicz MK (ed.), Wittekind Ch (ed). TNM Classification of Malignant Tumours, 8th Edition. Wiley-Blackwell 2016. ISBN 978-1-119-26357-9. Available from: <https://www.wiley.com/en-gb/TNM+Classification+of+Malignant+Tumours%2C+8th+ Edition-p-9781119263579>.
- Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016;26(1):1-133.
- Haddad R.I. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines): Thyroid Carcinoma. NCCN; Plymouth, PA, USA 2023. Available from: <https://www.nccn.org/pro - fessionals/physician_gls/pdf/thyroid.pdf>
- Bernardi S, Palermo A, Grasso RF, et al. Current Status and Challenges of US-Guided Radiofrequency Ablation of Thyroid Nodules in the Long Term: A Systematic Review. Cancers (Basel) 2021;13(11):2746.
- Avram AM, Giovanella L, Greenspan B, et al. SNMMI Procedure Standard/EANM Practice Guideline for Nuclear Medicine Evaluation and Therapy of Differentiated Thyroid Cancer: Abbreviated Version. J Nucl Med. 2022,63(6):15N-35N.
- Sawin CT, Geller A, Wolf P, et al. Low serum thyrotropin concentrations as a risk factor for atrial fibrilation in older persons. N Engl J Med. 1994;331(19):1249-1952.
- Ochs N, Auer R, Bauer DC et al. Metaanalysis: subclinical thyroid dysfunction and the risk for coronary heart disease and mortality. Ann Intern Med. 2008;148(11):832-845. 12.
- Quan ML, Pasieka JL, Rorstad O. Bone mineral density in well-differentiated thyroid cancer patients treated with suppressive thyroxine: A systematic overview of the literature. J Surg Oncol. 2002;79(1):62-70.
- Ran B, Wei F, Gong J, Xu H, et al. Application and prospect of trabecular bone score in differentiated thyroid cancer patients receiving thyrotropin suppression therapy. Front Endocrinol (Lausanne). 2022 Oct 12;13 : 1004962. doi: 10.3389/fendo.2022.1004962
- Ku EJ, Yoo WS, Lee EK, et al. Effect of TSH Suppression Therapy on Bone Mineral Density in Differentiated Thyroid Cancer: A Systematic Review and Meta-analysis. J Clin Endocrinol Metab. 2021;106(12):3655-3667.
- Park H, Park J, Yoo H, et al. Bone-density testing interval and transition to osteoporosis in differentiated thyroid carcinoma patients on TSH suppression therapy. Clin Endocrinol (Oxf) 2022;97(1):130-136.
- Gülsoy Kirnap N, Turhan Iyidir Ö, Bozkuş Y, et al. The effect of iatrogenic subclinical hyperthyroidism on anxiety, depression and quality of life in differentiated thyroid carcinoma. Turk J Med Sci. 2020;50(4):870-876.
- Altuntaş SÇ, Hocaoğlu Ç. Effects of Chronic Suppression or Oversuppression of Thyroid-Stimulating Hormone on Psychological Symptoms and Sleep Quality in Patients with Differentiated Thyroid Cancer. Horm Metab Res. 2021;53(10):683-691.
- Papaleontiou M, Chen DW, Banerjee M. et al. Thyrotropin Suppression for Papillary Thyroid Cancer: A Physician Survey Study. Thyroid. 2021;31(9):1383-1390.
- Yavuz DG, Yazan CD, Hekimsoy Z, et al. Assesment of attainment of recommended TSH levels and levothyroxine compliance in differentiated thyroid cancer patients. Clin Endocrinol (Oxf) 2022;97(6):833-840.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Dyslipidemie – známá neznámá
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2023 Číslo 5- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Kardiovaskulární onemocnění a transplantace ledviny
- Důsledky vysoce supresivní léčby infekce HIV
- Interní komorbidity a komplikace terapie roztroušené sklerózy – nenechte se zaskočit!
- Akutní poškození ledvin u pacientů s jaterní cirhózou - shrnutí pro praxi
- Dyslipidemie – známá neznámá
- Diferencovaný karcinom štítné žlázy – možná rizika léčby, supresní léčby a adherence k současným doporučení
- Atypická forma Goodpastureovy nemoci
- Farmakologický profil mepolizumabu
- Co je nového v pneumologii – rok 2022
- Finerenon: další možnost léčby u pacientů s chronickým onemocněním ledvin a diabetem 2. typu
- Zemřela prof. MUDr. Marie Brodanová, DrSc.
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Akutní poškození ledvin u pacientů s jaterní cirhózou - shrnutí pro praxi
- Dyslipidemie – známá neznámá
- Co je nového v pneumologii – rok 2022
- Kardiovaskulární onemocnění a transplantace ledviny
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



