-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Imunosenescence – západ slunce nad imunitním systémem
Immunosenescence – the sunset over the immune system
Immunosenescence is characterized by remodeling and dysregulation of immune system due to aging process. These changes affect innate as well as adaptive immunity. Due to the complexity of the physiological processes, in which the mechanisms of the immune system interfere, also other systems of the organism are affected by these changes. Thymus involution as well as chronic antigenic stimulation are the main causes of immunosenescence and lead to a proinflammatory setting of the organism. In addition to impaired immune response against infections or reactivation of latent infections, reduced response to vaccination or decreased antitumor immune surveillance, changes of the immune system in elderly are clinically reflected in the development of chronic diseases typical for older age groups, such as neurodegenerative or metabolic diseases. The mechanisms of immunosenescence can be at least partially influenced by an active lifestyle and adequate dietary measures.
Keywords:
immunosenescence – aging – immune system dysregulation
Autoři: Zita Chovancová
Působiště autorů: Lékařská fakulta Masarykovy univerzity ; Ústav klinické imunologie a alergologie, FN u sv. Anny v Brně
Vyšlo v časopise: Vnitř Lék 2020; 66(6): 353-358
Kategorie: Hlavní téma
Souhrn
Imunosenescence představuje charakteristické procesy remodelace a dysregulace funkce imunitního systému, které souvisejí s přibývajícím věkem. Tyto změny postihují vrozený i adaptivní imunitní systém. Vzhledem ke komplexnosti fyziologických procesů, do kterých mechanismy imunitního systému zasahují, jsou těmito změnami ovlivněny také další systémy organismu. Mezi základní příčiny rozvoje imunosenescence patří involuce thymu a chronická antigenní stimulace, která vede k prozánětlivému nastavení organismu. Změny imunitního systému ve stáří se klinicky odrážejí kromě porušené imunitní reakce proti infekcím nebo reaktivace latentních infekcí, snížené odpovídavosti na vakcinaci nebo zhoršení protinádorového imunitního dohledu také v rozvoji chronických onemocnění typických pro vyšší věkové skupiny, jako jsou neurodegenerativní nebo metabolické choroby. Mechanismy imunosenescence můžeme alespoň částečně ovlivnit aktivním životním stylem a adekvátními dietními opatřeními.
Klíčová slova:
dysregulace imunitního systému – imunosenescence – stárnutí
Úvod
Schopnost imunitního systému člověka reagovat na různé podněty se během života mění. Po narození se obranyschopnost člověka postupně rozvíjí ve snaze dosáhnout co nejlepší funkce v boji proti nežádoucím vlivům vnějšího i vnitřního prostředí, čehož je pak využíváno během produktivního života člověka. Nicméně ve vyšším věku dochází k postupné remodelaci funkce imunitního systému, která může být v jistých ohledech pro organismus výhodná, ale ve většině případů je tomu spíše naopak. Tento proces je označován jako imunosenescence.
Imunosenescence však není imunodeficience (1). Ve vyšším věku se sice v populaci setkáváme se sníženou schopností obranyschopnosti zejména proti dříve neprodělaným infekcím, postupným vymizením vakcinační odpovědi (2) a vyšším rizikem rozvoje nádorových onemocnění (3), ale změny funkce imunitního systému nejsou shodné s těmi, které jsou popisovány u pacientů s imunodeficientními onemocněními (1). V posledních dekádách se zvyšuje věkový průměr populace, a to s sebou přináší také zvyšující se počet různých chronických onemocnění, jako jsou degenerativní nebo kardiovaskulární onemocnění. Mnoho z těchto patologických stavů se dává do souvislosti také s dysregulací imunitního systému přicházející s věkem. Imunosenescence je totiž komplexní proces, který zasahuje víceméně všechny součásti imunitního systému. Neprojevuje se však jen poruchou mechanismů prosté obranyschopnosti proti infekcím, ale zasahuje i další systémy lidského organismu, se kterými imunitní systém úzce spolupracuje (např. systém neuroendokrinní) (4).
Imunosenescence jako důsledek involuce thymu a chronické antigenní stimulace
Imunosenescence nevzniká primárně v důsledku nedostatečného počtu buněk imunitního systému, ale v důsledku snížení diverzity imunitního repertoáru. Na tom se podílí nedostatečná tvorba naivních a oligoklonální expanze paměťových buněk imunitního systému (5). Imunosenescence proto odkazuje na funkci thymu, který během života obratlovců prochází procesy strukturálních a funkčních změn, které se označují jako involuce thymu.
Tento proces pozvolného zániku tkáně brzlíku vede ke snižování počtu z thymu uvolněných naivních T lymfocytů o zhruba 3 % ročně do 50 let věku, kdy objem tkáně thymu dosahuje asi 10 % objemu počátečního (6), a dále o 1 % ročně do věku 85 let (7). T lymfocyty se vyvíjejí podobně jako ostatní buňky v krvi z pluripotentních kmenových buněk kostní dřeně. Následně putují do thymu, kde prochází thymovou výchovou pomocí mechanismů tzv. centrální tolerance, kdy se učí rozpoznávat antigeny našemu tělu vlastní. Jejich rozpoznání má za fyziologických podmínek vést k utlumení aktivace T lymfocytů (8). Tento proces se skládá z negativní selekce (apoptotického odstranění většiny autoreaktivních T lymfocytů) a vývoje CD4+Foxp3+ regulačních T lymfocytů (Treg), které mají za úkol tlumit aktivitu autoreaktivních T lymfocytů, které unikly mechanismům centrální tolerance a dostaly se do periferie (5). Involuce thymu vede k sníženému uvolňování naivních T lymfocytů do periferie, a tím ke snížení diverzity T ‑buněčných receptorů a repertoáru T lymfocytů v periferních lymfatických orgánech (5). Na druhou stranu se však ve stáří zvyšuje počet paměťových a dlouze žijících naivních T lymfocytů. Tyto změny v zastoupení T‑lymfocytárních subpopulací vedou k poruše T‑buněčné homeostázy, a tím jejích funkcí (7). Jedním ze základních faktorů, které ovlivňují involuci thymu, jsou pravděpodobně pohlavní hormony. Snížení koncentrace testosteronu v pokusech na myších vedlo k rekonstituci thymu a počtů T lymfocytů v periferních lymfatických uzlinách a slezině na úroveň odpovídající mladým jedincům. Podobné změny byly pozorovány i u pacientů starších 60 let léčených pro karcinom prostaty agonisty hormonů uvolňujících luteinizační hormony (LHRH), kdy dochází k zvýšení počtu lymfocytů, a to především pomocných CD3+CD4+ T lymfocytů, a NK buněk (9).
Dalším důležitým charakteristickým rysem procesu imunosenescence je prozánětlivé nastavení vnitřního prostředí jedinců vyššího věku i bez přítomnosti akutní infekce (tzv. prozánětlivost) (10). K tomu přispívá právě i dříve zmíněný pokles efektivity mechanismů centrální tolerance a s tím spojené větší množství autoreaktivních T lymfocytů, které unikají do periferního oběhu (11). Dalším faktorem, který může být zodpovědný za prozánětlivé nastavení organismu, je chronická antigenní stimulace pomocí bakteriálních nebo zejména virových latentních infekcí. V poslední době se tedy výzkum kromě klasického mikrobiomu zaměřuje na tzv. viriom, tedy přítomnosti komenzálních virů v lidském organismu. Bylo zjištěno, že lidský viriom obsahuje velké množství různých virů se známou nebo neznámou klinickou nebo biologickou signifikancí a že lidský genom obsahuje mobilní genetické virové elementy (retrotranspozony nebo endogenní retroviry), z nichž některé mohou být stále aktivní a ovlivňovat imunitní systém (12). Bylo prokázáno, že bakteriofágy jsou schopné vyvolat tvorbu prozánětlivých cytokinů in vitro. Přepokládá se, že u starších jedinců, kdy dochází k vyšší propustnosti střeva, by se takto do vnitřního prostředí vniklé bakteriofágy nebo jiné viry mohly podílet na rozvoji prozánětlivého nastavení organismu (12). Předpokládá se, že prozánětlivé nastavení organismu by mohlo být způsobeno také chronickou aktivací vrozeného imunitního systému díky dlouhodobým latentním nebo perzistujícím virovým infekcím. Mnoho těchto perzistujících latentních virů patří do herpesvirové rodiny, z nichž nejčastěji se jedná o herpes simplex virus 1 a 2 (HSV‑1, HSV‑2), virus Epstein‑Barrové (EBV), virus varicely a zosteru (VZV) a cytomegalovirus (CMV) (13). Do souvislosti s procesem imunosenescence bývá dáván nejvíce právě CMV. Předpokládá se totiž, že přítomnost CMV infekce by mohla vést k replikativní imunosenescenci tímto antigenem chronicky stimulovaných T lymfocytů, snížení diverzity TCR receptorů nebo imunitní odpovědi na jiné antigeny. Nicméně dosud neexistují klinické studie, které by tyto hypotézy jasně potvrdily.
Senescence a imunosenescence
Obecná senescence (proces stárnutí organismu) a imunosenescence (dysregulace funkcí imunitního systému podmíněná věkem) jsou sice dva odlišné procesy, nicméně v nedávné době byly mezi nimi popsány jisté souvislosti. Senescentní somatické buňky (SSC) vznikají ze somatických buněk organismu po průměrném počtu asi padesáti dělení. Telomery se při každém buněčném dělení zkracují o několik nukleotidů až do okamžiku, kdy nadále buňka dalšího dělení není schopna. Buňka tím přechází do určitého klidovějšího stádia, ve kterém sice dále probíhají jednotlivé metabolické děje, ale buňka se již nedělí. Z fylogenetického hlediska se jedná o určitou formu ochrany integrity organismu, protože při procesu dělení buněk vzniká celá řada chyb, které se mohou podílet na rozvoji maligního bujení. Na druhou stranu však SSC odolávají apoptóze, takže se postupem času v těle hromadí, což je dáváno do souvislosti s procesem stárnutí (14). Při přechodu buněk do senescentního stavu začnou tyto buňky produkovat ve vyšší míře prozánětlivé cytokiny, chemokiny a faktory remodelace extracelulární matrix nebo růstové faktory. Takto parakrinně vytvořené látky zasahují do fyziologických funkcí tkáňového mikroprostředí, kde se mohou podílet na pozitivním i negativním ovlivňování okolních buněk. Tento stav je označován jako „sekreční fenotyp asociovaný se senescencí“ (SASP) (15). Jednotlivé SASP proteiny mají různé funkce, z nichž některé jsou spíše pozitivní, jiné naopak negativní. Určité SASP proteiny vedou například k zastavení buněčného cyklu dělení u senescentních buněk a podporují eliminaci těchto buněk, a tím se podílí na prevenci malignizace, pozitivně ovlivňují strukturu placenty a její funkci během těhotenství, podílí se na procesech embryonálního vývoje nebo snižují fibrotizaci tkání jako následek jejich poškození a hrají důležitou roli v urychlení hojení ran (16, 17). Na druhou stranu jiné SASP proteiny se v závislosti na biologickém kontextu mohou podílet na rozvoji chronického zánětu a/nebo tumorogenezi (18).
Ačkoli by se na první prohled mohlo zdát, že imunosenescence a prozánětlivost jsou protichůdné jevy, představují vlastně dvě strany jedné mince (10). Právě imunosenescence je zodpovědná za porušené odstraňování senescentních buněk, což vede k akumulaci těchto buněk v organismu. Je to dáno sníženou chemotaxí NK buněk, makrofágů, T lymfocytů a porušenou fagocytózou neutrofilů a makrofágů (19). To může mít za následek zvýšenou tvorbu prozánětlivých cytokinů a nastavení organismu do prozánětlivého stavu, který se zásadně podílí na rozvoji chronických onemocnění, jako jsou metabolické poruchy (diabetes mellitus II. typu), neurodegenerativní onemocnění (Alzheimerova choroba), kardiovaskulární onemocnění (ateroskleróza), osteoartritida, plicní fibróza nebo nádorová onemocnění (20).
Imunosenescence postihuje vrozený i adaptivní imunitní systém
Mezi základní znaky imunosenescence patří porušená imunitní odpověď proti bakteriálním a virovým infekcím (a to zejména dříve neprodělaným), ale také reaktivace latentních infekcí (například viru varicely a zosteru vyvolávajícího pásový opar), snížená odpověď po vakcinaci, zhoršování protinádorového imunitního dohledu a pozměněný fenotyp imunitní odpovědi (21, 22). Tyto změny jsou způsobeny dysregulací vrozené i adaptivní imunity (tabulka 1 a 2).
Tab. 1. Imunosenescence adaptivního imunitního systému 
Tab. 2. Imunosenescence vrozeného imunitního systému 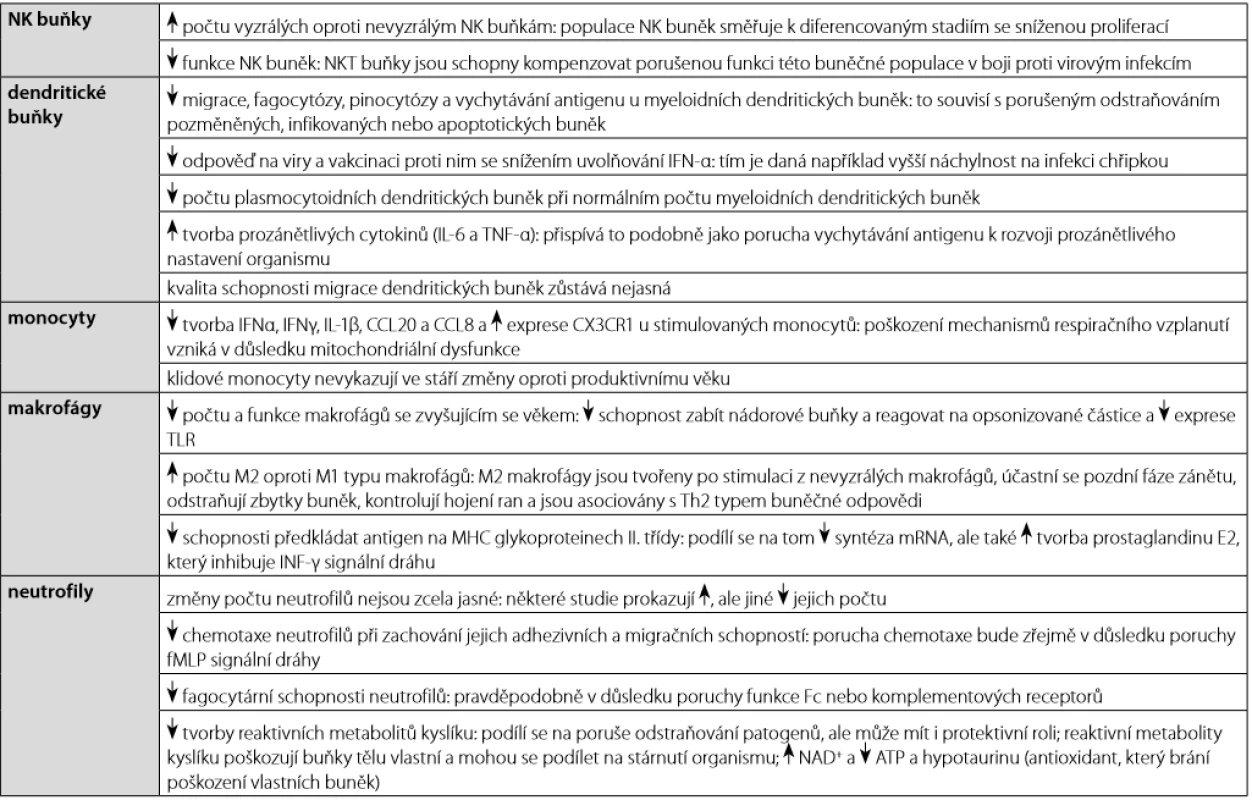
Procesy imunosenescence jsou v rámci adaptivní imunity velmi dobře definované, přičemž ze všech mechanismů postihují zejména T lymfocyty (tabulka 1). Během života dochází ke změně zastoupení T lymfocytárních subpopulací, což přispívá k nastavení organismu do prozánětlivého stavu. Klesá počet naivních T lymfocytů a stoupá počet T lymfocytů paměťových. Depleci naivních T lymfocytů lze považovat za marker relativního rizika úmrtí (23). Během života se také mění počet regulačních T lymfocytů (Treg), i když tendence změny jejich počtu není zcela jasná. Některé studie prokazují snížení jejich počtu, jiné zase jejich zvýšení (7). S věkem souvisí také zvyšování počtu prozánětlivých Th17 lymfocytů, přičemž zvyšování poměru Th17/Treg lymfocytů také přispívá k prozánětlivému nastavení organismu. Opakovaná antigenní stimulace a klonální proliferace paměťových buněk může vést během stárnutí organismu k akumulaci buněk, které se tak dostávají ke svému replikativnímu maximu. Postupem času dochází v organismu k akumulaci senescentních T lymfocytů, které představují populaci CD3+CD28‑CD57+ T lymfocytů se znaky paměťových buněk. Jejich akumulace je výsledkem chronické antigenní stimulace během života. Proto by snížená expozice chronickým nákazám, kterou zažíváme v dnešní době díky zvýšené hygieně a očkování, mohla mít vliv na pozvolnější vyčerpání naivních T lymfocytů a přispět k neustálému prodlužování průměrné délky života v civilizovaných zemích (1).
Změny v důsledku imunosenescence se týkají také B lymfocytů, které tvoří protilátky (tabulka 1). Během života se snižuje počet prekurzorů B lymfocytů pocházejících z kostní dřeně, která také podobně jako jiné orgány prochází procesem senescence. Na druhou stranu počet vyzrálých B lymfocytů se zdá být stabilní. Starší lidé vykazují sníženou humorální odpověď po prodělaných infekcích nebo po vakcinaci. S přibývajícím věkem na druhou stranu dochází ke zvýšení koncentrace orgánově specifických i orgánově nespecifických autoprotilátek v periferní krvi. Přítomnost autoprotilátek v nízkém titru bez doprovodných klinických příznaků typických pro dané autoimunitní onemocnění je však ve vyšším věku fyziologickým jevem. Zvýšená tvorba autoprotilátek může souviset se zvýšením množství B lymfocytů a plazmatických buněk v samotných orgánech, jejich prodlouženou délkou života v zárodečných centrech či zvýšenou produkcí imunoglobulinů jednotlivými buňkami (1).
Ačkoli imunosenescence postihuje zejména adaptivní imunitní odpověď, změny související se stářím se týkají také mechanismů vrozeného imunitního systému (tabulka 2) (4). Neutrofily, které se do místa zánětu z krevního oběhu dostávají obvykle jako první, fagocytují patogeny a odstraňují je prostřednictvím uvolňování proteolytických enzymů z cytoplazmatických granulí a tvorby reaktivních metabolitů kyslíku. Za určitých okolností jsou schopni procesu aktivní buněčné smrti za tvorby tzv. neutrofilních extracelulárních pastí (NETs), které jsou tvořeny rozvolněným chromatinem asociovaným s jadernými a granulárními proteiny neutrofilů. Tyto sítě slouží primárně k zachycení a imobilizaci bakterií (24). Tento proces (tzv. netóza) je považován za unikátní typ aktivní buněčné smrti, která se liší od apoptózy nebo nekrózy. Není zatím jasné, jak se mechanismus netózy mění s věkem, ale zvažuje se také jeho role v prozánětlivém nastavení organismu (4). Během procesu stárnutí dochází ke snížení počtu plasmocytoidních dendritických buněk, přičemž počet myeloidních dendritických buněk zůstává zachován. Dendritické buňky vykazují také porušené fagocytární funkce, schopnost prezentace antigenů a vytvářejí větší množství prozánětlivých cytokinů. U monocytů a makrofágů byla také popsána snížená schopnost jejich antimikrobiální funkce, a to například snížená exprese Toll‑like receptorů, porucha prezentace antigenů na MHC glykoproteinech II. třídy nebo poškození mechanismů respiračního vzplanutí. U NK buněk dochází ke změně zastoupení od méně vyzrálých CD14+CD56dim do vyzrálých CD14+CD56bright subpopulace. Nicméně oba tyto typy NK buněk vykazují sníženou cytokinovou sekreci a porušení mechanismů cytotoxicity, ale také porušenou schopnost migrace a diverzity aktivačních a inhibičních receptorů (tabulka 2) (2).
Role imunosenescence v rozvoji chronických onemocnění
Postupné vyhasínání a dysregulace imunitního systému a zároveň prozánětlivé nastavení organismu charakteristické pro starší populaci se pravděpodobně podílí také na rozvoji onemocnění pro tuto věkovou kategorii typických.
Neurodegenerativní onemocnění, jako je například Alzheimerova choroba (AD), se u starších osob vyskytují s vyšší prevalencí, která stoupá s věkem. Bylo prokázáno, že neurodegenerativní proces mozkové tkáně je provázen zánětem zprostředkovaným mikrogliemi. Ty produkují prozánětlivé cytokiny, přičemž fagocytóza amyloidu beta (Aβ), jehož agregace je v mozkové tkání pro pacienty s AD příznačná, je významně snížena. Kumulace agregátů vede též k aktivaci dalších mechanismů vrozené imunity, které se podílejí na udržování zánětu mozkové tkáně. I když role zánětu v patogenezi AD musí být ještě blíže prozkoumána, už dnes je jasné, že se v mozku pacientů s AD vyskytují také vysoce diferencované CD3+CD4+ a CD3+CD8+ T lymfocyty, kterým chybí kostimulační receptor CD28 (tzv. CD3+CD28 ‑ T lymfocyty). Výskyt CD3+CD28 ‑ T lymfocytů u stárnoucích organismů je spojen s replikativní senescencí po opakované antigenní stimulaci a souvisí s jejich odolností vůči apoptóze (20).
Také diabetes mellitus II. typu je onemocnění, na jehož patogenezi se podílí chronické zánětlivé prostředí. Vyskytuje se s vzrůstající tendencí ve vyšším věku a většinou je spojen s nadváhou pacientů. Tuková tkáň se podílí na rozvoji inzulinové rezistence a snížení produkce inzulinu beta buňkami pankreatu. U pacientů s diabetem mellitem II. typu se vyskytuje vyšší koncentrace prozánětlivých cytokinů, jako je CRP, IL‑6 nebo TNF, což je asociováno se zvýšeným oxidativním stresem (20).
Ateroskleróza je typické zánětem mediované onemocnění tvořící patogenetický podklad kardiovaskulárních onemocnění, jejichž incidence opět stoupá s věkem. Podkladem rozvoje zánětu může být reakce na autoantigeny nebo exoantigeny, které stimulují infiltraci intimy stěny arterií buňkami imunitního systému. Jedná se zejména o CD3+CD4+ T lymfocyty, které produkují INF‑γ, čímž je následně stimulována také vrozená imunitní odpověď, a patologický kruh se uzavírá (25). Ukázalo se, že přítomnost senescentních paměťových CD3+CD4+ T lymfocytů je asociována se subklinickou aterosklerózou charakterizovanou kalcifikací koronárních arterií a ztluštěním jejich intima media. U pacientů s kardiovaskulárními onemocněními byl prokázán vyšší výskyt senescentních T lymfocytů. Například senescentní CD3+CD4+ T lymfocyty byly nakumulovány především v aterosklerotických koronárních placích, jejich signifikantně vyšší počet byl popsán u pacientů s nestabilní anginou pectoris nebo u pacientů s opakovanými akutními koronárními příhodami. Zvýšený počet senescentních CD3+CD8+ T lymfocytů se vyskytuje v periferní krvi pacientů s akutním koronárním syndromem nebo anginou pectoris a jejich vyšší počet je asociován s horší rekonvalescencí po prodělání akutního infarktu myokardu. Nicméně není zcela jasné, zda přítomnost těchto buněk je příčinou nebo následkem proběhlých patologických procesů. Předpokládá se však, že svou produkcí cytokinů a uvolňováním vysokých koncentrací perforinů a granzymů se na patogenezi aterosklerózy podílejí. Zajímavé také je, že statiny nejen zlepšují profil lipidového spektra, ale snižují i počty senescentních cirkulujících CD3+CD4+ T lymfocytů tím, že navozují jejich apoptózu, což může být další z léčebných efektů těchto medikamentů u pacientů s aterosklerózou (25).
Také výskyt osteoartrózy je významně vázán na vyšší věk. Systémový zánět může být podporován s věkem asociovanými změnami v tukové tkáni, která produkuje více prozánětlivých cytokinů, jako je IL‑6 nebo TNF ‑α. Vyšší hladiny IL‑6 byly dávány do souvislosti s progresí osteoartrózy kolenních kloubů. Nicméně v pokusech na myších se zablokovanou produkcí IL‑6 byly osteoartrotické změny související s věkem ještě vyšší než s přítomností jeho produkce. Na tvorbě prozánětlivých cytokinů se bude pravděpodobně podílet taky vnitřní kolenní tkáň (26).
Imunosenescence a vakcinace
Je známo, že pacienti vyššího věku odpovídají hůře na očkování. Vzhledem ke komplikovanějšímu průběhu infekcí je u této generace doporučováno očkování proti chřipce, pneumokokovým infekcím, tetanu, pertusi a vhodná je i vakcinace k zabránění reaktivace viru varicely a zosteru. Nicméně tyto očkovací látky jsou vyráběny se zaměřením na mladší populaci, což může být jeden z důvodů, proč některé z nich jsou méně účinné u starší generace. Poměrně dobrá imunitní odpověď bývá po vakcinaci kombinovanou vakcínou proti tetanickému, difterickému toxoidu a pertusi, i když ve srovnání s mladými dospělými je protilátková odpověď u starší generace přeci jen snížená. Účinná bývá i vakcinace živou vakcínou proti viru varicely a zosteru, která brání reaktivaci tohoto viru, tedy vzniku pásového oparu a s tím spojených neuralgických komplikací. Na druhou stranu vakcinace proti chřipce nebo pneumokokovým onemocněním nebývají u významné části pacientů starší generace účinné (27). Nicméně Streptococcus pneumoniae je jedním z nejčastějších původců komunitních pneumonií spojených s hospitalizací seniorů. Bylo také prokázáno, že v období po prodělaném pneumokokovém onemocnění jsou pacienti náchylnější k rozvoji akutního koronárního syndromu, srdečního selhání nebo srdečních arytmií. Starší pacienti jsou také náchylnější k rozvoji invazivních pneumokokových onemocnění. Také hospitalizace a úmrtí spojená s chřipkovou infekcí se týkají nejčastěji osob starších 65 let. Proto i když vakcinace proti pneumokokovým infekcím nebo chřipce může přinášet nižší úroveň protekce u seniorů v porovnání s mladší generací, stále přetrvává dostatečný klinický účinek na prevenci rozvoje onemocnění a jejich komplikací, proto je seniory vhodné očkovat, a to konjugovanou pneumokokovou vakcínou každých 5 let a inaktivovanou tetravalentní vakcínou proti chřipce každý rok (28).
Můžeme se pokusit o „facelifting“ imunitního systému?
Cvičení a ovlivnění imunitního systému
Aktivní životní styl je jedním ze základních faktorů determinujících zdravé stárnutí. Je totiž spojen se snížením prozánětlivého nastavení organismu a rizika aktivace latentních virových infekcí, zlepšuje kognitivní funkce a snižuje výskyt pro vyšší věk typických nádorů, jako jsou karcinomy prsu, střev a prostaty (29–31). Předpokládá se, že cvičení by mohlo působit proti imunosenescenci, a to zpomalením těchto procesů, nebo dokonce jistým „omlazením“ imunitního systému. Některé formy cvičení působí protizánětlivě, a pokud jsou během života opakovaně a dlouhodobě provozovány, mohou mít vliv na snížení morbidity a mortality na onemocnění způsobená na imunologickém nebo prozánětlivém podkladě (29).
Celá řada studií prokázala, že cvičení zlepšuje imunologický profil, a to především pozitivním ovlivněním funkce T lymfocytů. Například u starších osob provozujících pravidelnou fyzickou aktivitu (jako je jízda na kole) bylo prokázáno zlepšení funkce thymu s počtem tzv. thymus nedávno opustivších buněk (z anglického „recent thymic emigrants“) podobným jako u mladých lidí, snížení prozánětlivých Th17 lymfocytů a nebyly pozorovány takové změny regulačních T a B lymfocytů jako u kontrolních starších osob bez pravidelné fyzické aktivity (21). Nicméně počet senescentních CD3+CD28‑CD57+ T lymfocytů byl srovnatelný u aktivních i neaktivních lidí vyššího věku, což znamená, že fyzická aktivita zpomaluje nebo zlepšuje procesy imunosenescence, ale neumí je zcela zastavit. Pravidelné cvičení též zlepšuje parametry vrozeného imunitního systému. Jedná se o udržení funkce NK buněk, baktericidní i migrační funkce neutrofilů (mechanismy respiračního vzplanutí a fagocytózy) a snižuje se počet prozánětlivých CD16+ monocytů. Fyzická aktivita vede také ke snížení tukových zásob, což vede ke změně zastoupení prozánětlivých M1 makrofágů směrem k protizánětlivým M2 makrofágům v tukové tkání, což se následně podílí na snižování prozánětlivého nastavení organismu (31). Ve studii koncentrace cytokinů v periferní krvi v závislosti na fyzické aktivitě u atletů tří věkových skupin se ukázalo, že celoživotní cvičení napomáhá udržovat rovnováhu prozánětlivých a protizánětlivých cytokinů, kdy hladiny protizánětlivého cytokinu IL‑10 se u atletů vyššího věku blížilo hodnotám těch mladých (32).
Aktivní životní styl s sebou přináší snížení absolutního i relativního počtu paměťových T lymfocytů a zvýšení počtu naivních T lymfocytů (29). Názory na nejefektivnější způsoby fyzické aktivity ve vztahu k posilování imunitního systému se však různí. I když studií vyšla celá řada, chybí randomizované placebem kontrolované nebo longitudinální studie. Nicméně v pokusech na myších se ukázalo, že dobrovolné cvičení může napomáhat ke zvrácení změn typických pro imunosenescenci, která je prohlubována oxidačním stresem (33). Obecně středně intenzivní aerobní fyzická aktivita (jako je chůze nebo plavání) nejméně 150 minut týdně poskytuje ochranu proti celé řadě imunitně podmíněných a zánětlivých onemocnění (31). Ale také 2–3× týdně nejméně po dobu 6 týdnů prováděný silový vytrvalostní trénink vedl u žen starších 65 let věku k poklesu koncentrace senescentních T lymfocytů (34). Dlouhodobě aktivní atleti měli také v porovnání s kontrolní skupinou snížené procentuální zastoupení senescentních naivních, centrálních paměťových a efektorových paměťových CD3+CD8+ T lymfocytů a senescentních naivních a efektorových paměťových CD+CD4+ T lymfocytů (35).
Jedním z možných vysvětlení je to, že cvičení může pozitivně ovlivňovat procesy autofagie (36). Jedná se o evolučně velmi starý proces udržení buněčné homeostázy, který slouží k odstraňování nefunkčních proteinů, poškozených buněčných organel nebo intracelulárních patogenů. Během stárnutí organismu dochází k porušení tohoto procesu. Bylo prokázáno, že intenzivní intervalový trénink, stejně jako středně intenzivní udržovací trénink, byly schopny obnovit porušenou autofagii u senescentních CD3+CD4+ T lymfocytů, vedou k mobilizaci T lymfocytů a směřují je k apoptóze (intenzivní intervalový trénink vede k apoptóze vysoce diferencovaných T lymfocytů, zatímco středně intenzivní udržovací trénink k apoptóze regulačních T lymfocytů) (21). Tyto změny T lymfocytů navozené pravidelným cvičením mohou pomoci nahradit senescentní buňky naivními T lymfocyty, což vede ke zlepšení imunitní odpovědi proti patogenům (37).
Dieta a ovlivnění imunitního systému
Kromě cvičení se také vyvážená strava podílí na ovlivnění správné funkce imunitního systému a umožňuje pozitivně ovlivnit proces imunosenescence. Jednoduchou strategií, jak toho dosáhnout, je kalorická restrikce, která snižuje T‑buněčnou senescenci, věkem podmíněnou involuci thymu. Dalším důležitým je dostatečný přísun vitaminů. Například vitamin C je důležitým antioxidantem, který ve vysokých dávkách zpomaluje involuci thymu, což se projevuje zvýšeným počtem naivních a paměťových T lymfocytů. Jako antioxidant působí také vitamin E, který navíc napomáhá regulovat funkci dendritických buněk (7).
Závěr
Imunosenescence zahrnuje procesy remodelace a dysregulace funkce imunitního systému související s přibývajícím věkem. Tyto změny postihují vrozený i adaptivní imunitní systém. Jsou způsobeny zejména involucí thymu a chronickou antigenní stimulací, které vedou k prozánětlivému nastavení organismu. Imunosenescence jednak predisponuje osoby vyššího věku ke zvýšené náchylnosti k infekcím, ale významně se také podílí na vyšším riziku rozvoje řady chronických onemocnění. S přítomností imunosenescence je třeba počítat i při rozhodování o správné vakcinační strategii pacientů ve vyšším věku. Jednou z možných prevencí procesů imunosenescence je fyzická aktivita, protože u aktivních jedinců je přítomno zpomalení s věkem souvisejícího poklesu počtu naivních T lymfocytů a akumulace paměťových T lymfocytů. Dalším opatřením je pak střídmá dieta s dostatkem vitaminů a minerálů.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Zita Chovancová, Ph.D.,
Ústav klinické imunologie a alergologie,
FN u sv. Anny v Brně,
Pekařská 664/53,
656 91 Brno
Cit. zkr: Vnitř Lék 2020; 66(6): 353–358
Článek přijat redakcí: 11. 7. 2020
Článek přijat po recenzích k publikaci: 29. 7. 2020
Zdroje
1. Rychlíková J, Šterzl I. Imunosenescence – vymezení pojmu a možné souvislosti. Alergie 2004, 6(4): 240–247.
2. Nikolich ‑Žugich J. The twilight of immunity: emerging concepts in aging of the immune system. Nat Immunol 2018, 19(1): 10–19.
3. Zinger A, Cho WC, Ben ‑Yehuda A. Cancer and Aging – the Inflammatory Connection. Aging Dis 2017; 8(5): 611–627.
4. Solana R, Tarazona R, Gayoso I, Lesur O, Dupuis G, Fulop T. Innate immunosenescence: effect of aging on cells and receptors of the innate immune system in humans. Semin Immunol 2012, 24(5): 331–341.
5. Thomas R, Wang W, Su DM. Contributions of Age ‑Related Thymic Involution to Immunosenescence and Inflammaging. Immun Ageing 2020; 17 : 2.
6. Romanyukha AA, Yashin AI. Age related changes in population of peripheral T cells: towards a model of immunosenescence. Mech Ageing Dev 2003; 124(4): 433–443.
7. Bischof J, Gärtner F, Zeiser K, Kunz R, Schreiner C, Hoffer E, Burster T, Knippschild U, Zimecki M. Immune Cells and Immunosenescence. Folia Biol (Praha) 2019; 65(2): 53–63.
8. Kurd N, Robey EA. T ‑cell selection in the thymus: a spatial and temporal perspective. Immunol Rev 2016; 271(1): 114–126.
9. Sutherland JS, Goldberg GL, Hammett MV, Uldrich AP, Berzins SP, Heng TS, Blazar BR, Millar JL, Malin MA, Chidgey AP, et al. Activation of thymic regeneration in mice and humans following androgen blockade. J Immunol 2005; 175(4): 2741–2753.
10. Fulop T, Larbi A, Dupuis G, Le Page A, Frost EH, Cohen AA, Witkowski JM, Franceschi C. Immunosenescence and Inflamm ‑Aging As Two Sides of the Same Coin: Friends or Foes? Front Immunol 2017, 8 : 1960.
11. Rezzani R, Nardo L, Favero G, Peroni M, Rodella LF. Thymus and aging: morphological, radiological, and functional overview. Age (Dordr) 2014; 36(1): 313–351.
12. Hurme M. Viruses and immunosenescence – more players in the game. Immun Ageing 2019; 16 : 13.
13. Nikolich ‑Zugich J, Goodrum F, Knox K, Smithey MJ. Known unknowns: how might the persistent herpesvirome shape immunity and aging? Curr Opin Immunol 2017; 48 : 23–30.
14. Grimes A, Chandra SB. Significance of cellular senescence in aging and cancer. Can ‑ cer Res Treat 2009; 41(4): 187–195.
15. Coppé JP, Patil CK, Rodier F, Sun Y, Muñoz DP, Goldstein J, Nelson PS, Desprez PY, Campisi J. Senescence ‑associated secretory phenotypes reveal cell ‑nonautonomous functions of oncogenic RAS and the p53 tumor suppressor. PLoS Biol 2008; 6(12): 2853–2868.
16. Gal H, Lysenko M, Stroganov S, Vadai E, Youssef SA, Tzadikevitch ‑Geffen K, Rotkopf R, Biron ‑Shental T, de Bruin A, Neeman M et al: Molecular pathways of senescence regulate placental structure and function. EMBO J 2019; 38(18): e100849.
17. Demaria M, Ohtani N, Youssef SA, Rodier F, Toussaint W, Mitchell JR, Laberge RM, Vijg J, Van Steeg H, Dollé ME et al. An essential role for senescent cells in optimal wound healing through secretion of PDGF ‑AA. Dev Cell 2014; 31(6): 722–733.
18. Watanabe S, Kawamoto S, Ohtani N, Hara E. Impact of senescence ‑associated secretory phenotype and its potential as a therapeutic target for senescence ‑associated di ‑ seases. Cancer Sci 2017; 108(4): 563–569.
19. Prata LGPL, Ovsyannikova IG, Tchkonia T, Kirkland JL. Senescent cell clearance by the immune system: Emerging therapeutic opportunities. Semin Immunol 2018; 40 : 101275.
20. Fülöp T, Dupuis G, Witkowski JM, Larbi A. The Role of Immunosenescence in the Development of Age ‑Related Diseases. Rev Invest Clin 2016; 68(2): 84–91.
21. Fukushima Y, Minato N, Hattori M. The impact of senescence ‑associated T cells on immunosenescence and age ‑related disorders. Inflamm Regen 2018; 38 : 24.
22. Výška O, Matějovská Kubešová H. Imunosenescence a infekční komplikace vyššího věku. Kardiol Rev Int Med 2018; 20(1): 41–43.
23. Dennett NS, Barcia RN, McLeod JD. Age associated decline in CD25 and CD28 expression correlate with an increased susceptibility to CD95 mediated apoptosis in T cells. Exp Gerontol 2002; 37(2–3): 271–283.
24. Fuchs TA, Abed U, Goosmann C, Hurwitz R, Schulze I, Wahn V, Weinrauch Y, Brinkmann V, Zychlinsky A. Novel cell death program leads to neutrophil extracellular traps. J Cell Biol 2007; 176(2): 231–241.
25. Yu HT, Park S, Shin EC, Lee WW. T cell senescence and cardiovascular diseases. Clin Exp Med 2016; 16(3): 257–263.
26. Greene MA, Loeser RF. Aging ‑related inflammation in osteoarthritis. Osteoarthritis Cartilage 2015; 23(11): 1966–1971.
27. Pera A, Campos C, López N, Hassouneh F, Alonso C, Tarazona R, Solana R. Immuno ‑ senescence: Implications for response to infection and vaccination in older people. Maturitas 2015; 82(1): 50–55.
28. Chlíbek R. Doporučená očkování seniorů. Remedia 2019; 29 : 43–51.
29. Turner JE: Is immunosenescence influenced by our lifetime „dose“ of exercise? Biogerontology 2016; 17(3): 581–602.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2020 Číslo 6- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Perkutánní okluze ouška levé síně
- Současné postavení dietních opatření u pacientů s pokročilým stupněm chronického onemocnění ledvin
- Dysfunkčný dialyzačný cievny prístup a jeho endovaskulárna liečba
- Histiocytózy a neoplazie odvozené od makrofágů a dendritických buněk. Srovnání WHO klasifikace z roku 2017 a klasifikace Histiocyte society z roku 2016
- Glykovaný hemoglobín ako marker zvýšenia LDL a TAG – kohortná štúdia
- Alergie a imunopatologie – hlavní téma
- Anafylaxe – akutní a dlouhodobý management
- Potravinová alergie a intolerance
- Poruchy v komplementovém systému
- Deriváty sulfonylurey a riziko hypoglykemie u diabetiků 2. typu
- Imunosenescence – západ slunce nad imunitním systémem
- Chřipka a její komplikace
- Familiární plicní fibróza – doporučení pro diagnostiku a léčbu
- Nové dělení krystalopatií z pohledu nefrologa
- Infarkt myokardu nebo syndrom zlomeného srdce?
- Dieulafoy lézia jejuna ako zdroj život ohrozujúceho krvácania
- Co nového internistům přinášejí doporučené postupy pro diagnostiku a léčbu plicní embolie z roku 2019?
- Endoskopická diagnostika a terapie pankreatobiliárních onemocnění u osob po resekci žaludku podle Billrotha I
- Nozokomiální methemoglobinemie
- Postihnutie tráviaceho traktu pri zmiešanej chorobe spojivového tkaniva (Sharpovom syndróme)
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Infarkt myokardu nebo syndrom zlomeného srdce?
- Postihnutie tráviaceho traktu pri zmiešanej chorobe spojivového tkaniva (Sharpovom syndróme)
- Potravinová alergie a intolerance
- Poruchy v komplementovém systému
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



