-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaHistiocytózy a neoplazie odvozené od makrofágů a dendritických buněk. Srovnání WHO klasifikace z roku 2017 a klasifikace Histiocyte society z roku 2016
Histiocytoses and neoplasms of the macrophage-dendritic cell lineages. Comparison of recent WHO classification published 2017 and classification of Histiocyte Society published 2016
The histiocytoses are rare disorders characterized by the accumulation of cells thought to be derived from dendritic cells or macrophages. Their clinical behaviour ranges from mild to disseminated and, sometimes, life-threatening forms. The incidence of this diseases is much smaller, then the incidence of diseases derived from lymphocytic or myeloid lineage. Langerhans cell histiocytosis is most frequent disease from this group. The last version of WHO classification from 2017 and last version of classification published by Histiocyte Society is summarised in this paper.
Keywords:
Langerhans cell histiocytosis – Erdheim Chester disease – sarcomas from dendritic cells – Rosai-Dorfman disease – haemophagocytic histiocytosis
Autoři: Zdeněk Král 1; Zdeněk Adam 1; Marta Ježová 2; Luděk Pour 1; Marta Krejčí 1
Působiště autorů: Interní hematoonkologická klinika LF MU a FN Brno, pracoviště Bohunice 1; Ústav patologie LF MU a FN Brno, pracoviště Bohunice 2
Vyšlo v časopise: Vnitř Lék 2020; 66(6): 19-27
Kategorie: Přehledové články
Souhrn
Neoplazie z histiocytárních a dendritických buněk jsou velmi raritní, a tedy obtížně diagnostikovalné nemoci. Nejčastější z nich je histiocytóza z Langerhansových buněk, incidence ostatních nemocí je ještě menší. V následujícím přehledu je shrnuta jejich charakteristika a uvedeny recentní klasifikace, standardně používaná WHO klasifikace (poslední verze publikovaná v roce 2017) a paralelně s ní existující klasifikace, vytvořená společností Histiocyte Society (poslední verze publikovaná v roce 2016).
Klíčová slova:
neoplazie odvozené od histiocytárních a dendritických buněk – Erdheim Chester disease – sarcomas from dendritic cells – Rosai-Dorfman disease – haemophagocytic histiocytosis
Úvod
Histocytózy, neboli nemoci odvozené od histiocytárních a dendritických buněk, se vyskytují velmi vzácně, podstatně vzácněji než nemoci odvozené od buněk linie myeloidní nebo linie lymfocytární, či nemoci odvozené od buněk plazmocytárních. Jejich výskyt je natolik vzácný, že hematolog se za svůj pracovní život ani se všemi nesetká. Nejčastější nemocí z této skupiny je histiocytóza z Langerhansových buněk. V rámci tohoto textu uvedeme přehled všech nemocí, které jsou řazeny poslední WHO klasifikací krevních chorob z roku 2017 (1) a klasifikací Histiocyte Society z roku 2016 (2) do této kategorie nemocí.
Dendritické buňky, monocyty a makrofágy jsou součástí mononukleárního fagocytujícího systému. Historickým termínem histiocyt označujeme makrofágy usazené ve tkáních. Monocyty vznikají v kostní dřeni z myeloidní kmenové buňky. Po průniku do tkání vyzrávají v makrofágy nadané schopností fagocytózy – odstraňují apoptotické buňky, cizorodý materiál a patogeny. Jsou to velké ovoidní buňky s excentrickým oválným nebo ledvinovitým jádrem. Mohou střádat lipidy (xantomové buňky) a splývat v buňky mnohojaderné. Při imunohistochemickém vyšetření jsou cytoplazmaticky pozitivní s CD68 a lysozymem, cytoplazmaticky nebo membránově s CD163.
Dendritické buňky nemají jednotný původ. Většina je stejně jako monocyty odvozována z myeloidní kmenové buňky kostní dřeně. Úlohou dendritických buněk je prezentovat antigen a komplex histokompatibilních molekul a aktivovat naivní T buňky. Dendritické buňky se dělí na myeloidní a plazmocytoidní. Plazmocytoidní dendritické buňky cirkulují v periferní krvi, tvoří speciální kategorii, a budou proto z dalšího pojednání vyjmuty. V lidském organismu jsou hlavními typy dendritických buněk Langerhansovy buňky a dermální dendritické buňky (synonymum intersticiální dendritické buňky). Langerhansovy buňky nacházíme v kůži a na sliznicích. Charakterizuje je exprese antigenu CD1a, langerinu (CD 207), S100 a ultrastrukturálně zvláštní Birbeckova granula ve tvaru tenisových raket. Při aktivaci migrují do drénujících lymfatických uzlin, kde se pravděpodobně mění na interdigitující dendritické buňky. Ty ztrácejí většinu antigenů s výjimkou S100. Indeterminované buňky jsou považovány za prekurzory Langerhansových buněk, alternativně za zralé buňky ve stadiu migrace. Nemají Birbeckova granula, a proto nereagují s langerinem, exprese CD1a je zachována. Dermální dendritické buňky se nalézají v kožní škáře, hlubokých měkkých tkáních i vnitřních orgánech. Imunohistochemický profil je relativně nespecifický, pozitivní bývá faktor XIIIa, CD68; CD1a je negativní a S100 variabilní, spíše negativní.
Kromě toho jsou známy nejméně 2 další skupiny dendritických buněk, které nepocházejí z krvetvorné linie, ale z nediferencované mezenchymové buňky (stromální kmenové buňky). Mají vřetenitý tvar a podobu fibroblastů či myofibroblastů. Folikulární dendritické buňky jsou v lymfatických uzlinách. Nemigrují, tvoří stabilní síť v zárodečných centrech lymfatických foliklů, osídlenou B -lymfocyty. Exprimují unikátní znaky CD21 a CD23. Fibroblastické retikulární buňky jsou přítomny v uzlinách podél postkapilárních venul. Ve slezině a kostní dřeni tvoří opěrnou kostru. Reagují pozitivně s protilátkou proti hladkosvalovému aktinu (1, 2).
Z tohoto morfologického podkladu se odvíjejí klasifikace. Poslední 3 desetiletí jsme svědky existence 2 klasifikačních systémů vedle sebe. V roce 2017 vyšla v pořadí již 4. WHO klasifikace krevních chorob a v této světově platné klasifikaci je také kapitola nazvaná Histocytic and dedritic cell neplasms. A paralelně s touto klasifikací vychází klasifikace tvořená skupinou Working Group of the Histiocyte Society. Klasifikace tvořená Histiocyte Society obsahuje více klinických pohledů a zaměřuje se na ty četnější, ale méně agresivní nemoci a obsahuje definice některých jednotek, které ve WHO klasifikaci nejsou, neboť jsou spíše reaktivní než neoplastické etiologie, např. hemofagocytující lymfohistiocytóza, Rosaiova - Dorfmanova choroba a skupina mukokutáních histiocytárních proliferací. Jednotlivá onemocnění se nyní odvozují od koncových zralých buněk a mají tomu odpovídající imunofenotyp. Nejnovější revize zohledňují i molekulárně genetické poznatky. Obě klasifikace nejsou v zájemném rozporu, pouze se liší členěním na některé podjednotky (1, 2).
První klasifikace histiocytóz, zveřejněná v roce 1987 skupinou Working Group of the Histiocyte Society, definovala 3 zásadní kategorie:
- Langerhans cell histiocytosis,
- non -Langerhans cell histiocytoses,
- maligní histiocytózy.
V roce 2016 navrhla Working Group of the Histiocyte Society novou klasifikaci. Tato nová klasifikace dělí histiocytární choroby do celkem 5 velkých skupin. Do 1. skupiny řadí histiocytózu z Langerhansových buněk. 2. skupinu pak tvoří kožní a mukokutání histiocytózy, 3. skupinu maligní histiocytózy, 4. skupinu Rosaiova - Dorfmanova nemoc a 5. pak hemofagocytující lymfohistiocytóza a syndrom aktivace makrofágů (2).
Překvapivé je, že autoři klasifikace Histiocyte Society do první skupiny k histiocytózám z Langerhansových buněk přiřadili i Erdheimovu - Chesterovu nemoc, kterou poslední WHO klasifikace krevních chorob řadí jako samostatnou jednotku, zatímco předposlední WHO klasifikaci ji řadila pod kapitolu juvenilní xantogranulom. Autoři Histiocyte Society uvádějí, že v histologických vzorcích se často podařilo identifkovat současně obě nemoci a že obě nemoci mají některé společné vlastnosti: postihují stopku hypofýzy a způsobují diabetes insipidus. Při dlouhém trvání obou těchto nemocí se jako pozdní komplikace vyskytuje neurodegenerativní onemocnění mozku (2). Tyto přesuny jen ilustrují, jak málo o této skupině nemocí víme.
Obě klasifikace v přehledu uvádíme v Tab. 1 a v dalším textu pak stručně budeme charakterizovat tyto nemoci.
Tab. 1. WHO klasifikace chorob ze skupiny histiocytárních a dendritických neoplazíí. Tam kde není zaužívaný český termín, ponecháváme raději originální anglický termín 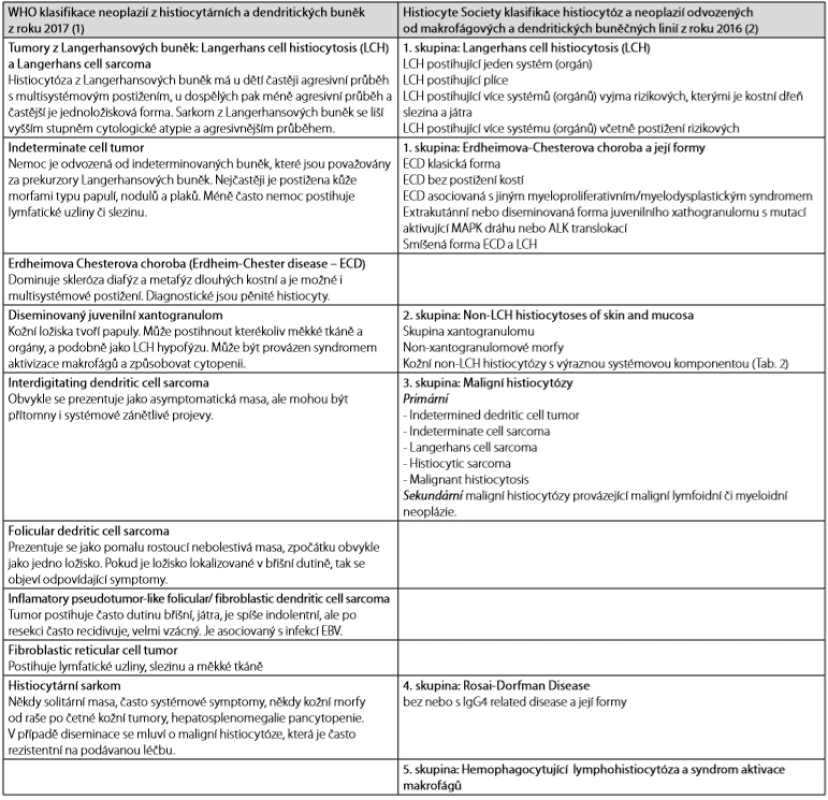
Stručná charakteristika jednotlivých jednotek
Histiocytóza z Langerhansových buněk (LCH)
Diagnózu histiocytózy z Langerhansových buněk lze stanovit pouze histologickým vyšetřením.
Mikroskopicky vidíme infiltráty z velkých oválných buněk se světle eozinofilní cytoplazmou a ledvinovitými nebo zprohýbanými jádry se zářezy. Počet mitóz je různý, jsou divergentní názory na prognostickou hodnotu proliferačního indexu Ki67. V pozadí je nenádorová příměs, v níž převládají eozinofily. Diagnostické buňky dávají difuzně pozitivní reakci s CD1a a S100. Náročná detekce Birbeckových granul, pro což je nutná elektronová mikroskopie, byla nahrazena průkazem znaku CD207 (langerinu), což je proveditelné i na fixovaných vzorcích (1, 2).
Nemoc zvaná histiocytóza z indeterminovaných buněk (ICH) nemá přítomný znak CD207 a tím ji lze odlišit. V případě Rosaiovy - Dorfmanovy nemoci jsou S100+ histiocyty často vícejaderné a mají prokazatelný jev zvaný emperipolesis a neexprimují ani CD1a a ani CD207 (1, 2).
Uvádí se, že histiocytóza z Langerhasových buněk může provázet jiné krevní nemoci, ale tento jev jsme u našich pacientů zatím nepozorovali. Autoři z Histiocyte Society a další uvádějí, že klasické dělení histiocytóz na Langerhansovu histiocytózu a non Langerhansovy histiocytózy, kam patří Erheimova -Chesterova nemoc mírně ztrácí na své důležitosti, protože 20 % pacientů s Erdheimovou - Chesterovou nemocí má také ložiska LCH (2, 3).
Proto Working Group of Histiocyte Society doporučuje zahrnout histiocytózu z Langerhanosových buněk, Erdheimovu -Chesterovu nemoc a extrakutánní juvenilní xantogranulom do jedné skupiny nemocí. Obě nemoci mají klonální mutace, postihující geny MAPK signální cesty a to více než v 80 % případů. Monocyty z periferní krve přitom mívají tu samou mutaci, jaká se popisuje v patologických buňkách (2–5).
Přelom v léčbě této nemoci přinesla detekce mutace genu BRAFV600E. Tato mutace má za následek konstitutivní aktivaci MAPK signální cesty, které způsobuje malignizaci u více typů tumorů. Přítomna je přibližně u poloviny případů LCH. Průkaz BRAF mutace u CD34+ buněk kostní dřeně u některých pacientů s vysoce rizikovou formou nemoci signalizuje, že LCH může být odvozena od hemopoetických progenitorových buněk. Dále asi u 19 % případů byly detekovány mutace MAP2K1 nebo MEK1 kinázy, která také souvisí s MAPK signální cestou. V posledních letech byly popsány mutace i v dalších signálních cestách. Molekulárně biologickou charakteristiku podrobně rozebírá recentní publikace zveřejněná v časopise Klinická onkologie v roce 2018 (4, 6).
Po stanovení diagnózy je vždy třeba stanovit rozsah nemoci a dle toho pak zvolit vhodnou léčbu. V rámci vyšetřování rozsahu nemoci je třeba vždy vyšetřit nejet PET/CT, ale pátrat i po kožních projevech, plicních projevech a endokrinních důsledcích (nejčastěji diabetes insipidus).
Pro dětské i dospělé pacienty byla publikována mezinárodní doporučení jak pro vyšetření rozsahu nemoci, tak pro léčbu (7, 8). Pro pacienty s prokázanou mutací BRAF lze po domluvě s pojišťovnou použít Vemurafenib, excelentní výsledky podání Vemurafebu popsali i slovenští autoři (9).
Vzácnější než LCH je sarkom z Langerhansových buněk. Je tvořen a Langerhansovými buňkami s cytologickými znaky malignity a nezvykle vysokou mitotickou aktivitou včetně mitóz atypických. Eozinofily na pozadí mizí. Imunofenotyp je shodný. Nádor se chová zhoubně (10).
Indeterminate cell tumor
Indeterminate cell tumor (histiocytóza z indeterminovaných buněk) je choroba morfologicky podobná LCH, odlišit ji lze na základě imunofenotypu. Je podstatně vzácnější než LCH a postihuje dominantně kůži ve formě makul a papul (11, 12). Pro léčbu této nemoci lze použít kladribin podobně jako pro léčbě histiocytózy z Langerhansových buněk.
Erdheimova-Chesterova choroba
Erdheimova - Chesterova choroba (Erheim - Chester disease) je histiocytární onemocnění, patřící do skupiny juvenilního xantogranulomu. Choroba se projevuje symetrickou osteosklerózou, postihující diafýzu i metafýzu dlouhých kostí, šetřící epifýzy. Radiologický nález je pro tuto nemoc patognomický. Nicméně 5–8 % pacientů může mít také postiženy ploché kosti. Erdheimova - Chesterova choroba představuje vlastně systémovou formu xantogranulomatózního onemocnění.
Patologické infiltráty tvoří pěnité histiocyty, histiocyty s eozinofilní cytoplazmou a příměs malých reaktivních lymfocytů, plazmocytů a neutrofilů. Jsou i případy, kdy dominuje neurčitá fibróza. Nález připomíná zánět nebo reparativní změny. Diagnosticky cenné jsou vícejaderné buňky Toutonova typu s věnečkem jader kolem eozinofilního středu a lemem pěnité cytoplazmy na periferii. Histiocyty jsou pozitivní s markery CD68, CD163 a faktorem XIIIa, negativní s S100, CD1a a langerinem. Diferenciální diagnostika je široká a zahrnuje histiocytózu z Langerhansových buněk, obrovskobuněčné kostní léze, chronické sklerotizující a hnisavé záněty, xantomy a specifické záněty (lepru, mykobakteriózu). Malá biopsie může být nevýtěžná. Patolog musí být klinikem podrobně informován o podezření na toto vzácné onemocnění včetně radiologického nálezu. Nemoc je považována za blízkou juvenilnímu xantogranulomu, histologicky jsou obě jednotky identické. Proto v předcházející WHO klasifikaci byla zařazena do kapitoly juvenilní xantogranulom (13).
Mimokostní postižení je u této nemoci popisováno v 50 % případů. Byly popsány následující komplikace: postižení hypotalamu s následným diabetes insipidus a hypopituarismem, retroperitonální infiltrace s postižením ledvin s perirenální fibrózou, případy s ložisky na očních víčkách vzhledu xantomů, exoftalmus, a také postižení plic a velkých cév se zesílením cévní stěny. Plicní fibróza s dušností a srdeční selhání jsou nejčastější příčiny úmrtí. Neurologické postižení může způsobovat ataxii či parézy. Xantogranulomatózní proces při Edheimově - Chesterově nemoci může mimo viscerální orgány či kosti postihovat také kůži, dutinu orbity či paranazální dutiny.
Klinicky se nemoc projevuje bolestmi končetin a může způsobit klasické zánětlivé projevy zvané v tomto případně „B symptomy“, úbytek hmotnosti, subfebrilie či febrilie, noční pocení, patologickou únavu. Laboratorně tomu odpovídají vysoké hodnoty CRP obvykle s normální hodnotou prokalcitoninu.
Průběh nemoci je velmi individuální a odpovídá stupni poškození organismu, nezřídka byl popsán fatální konec (14).
Někteří autoři popisují současný výskyt Erdheimovy - Chesterovy nemoci s myeloidními neoplaziemi (2, 15).
Léčba
Díky vzácnosti této nemoci neproběhly žádné registrační studie, a tak o léky, u nichž byla prokázána účinnost je nutno vždy mít schvální úhrady revizním lékařem.
V léčbě této nemoci byly testovány všechny dostupné léky. Za lék volby se zatím stále považuje interferon α (16), i když má četné nežádoucí účinky.
V případně prokázané mutace BRAF je doporučován Vemurafenib (17–19).
V některých případech byla popsána účinná léčbě kladribinem (20, 21), která má potenciál navodil dlouhodobější kompletní remisi.
Systémové zánětlivé příznaky lze redukovat pomocí anakinry (22). Tato léčba má potenciál zastavit vývoj retroperitoneální fibrózy, která může způsobit oboustrannou hydronefrózu (22). Novými léky, u nichž byla popsána účinnost u této nemoci, jsou dabrafenib a trametinib (23, 24).
Kožní a mukokutání histiocytózy
Working Party of Histocytose Society dále definuje kožní a mukokutánní formy a vytváří označení kožní formy xantogranulomových chorob. U dětí tyto formy spontánně mizí. Pro jednotlivé klinické formy byla vyvinuta speciální označení, které uvádíme v přehledu v Tab. 2. Při výjimečnosti těchto chorob je těžké se v nich orientovat a zřejmě častěji než hematologové s nimi přicházejí do kontaktu kožní specialisté a v případě periorbitální lokalizace oční lékaři.
Tab. 2. Non-LCH histiocytózy kůže a sliznic dle Histiocyte Society klasifikace (2) 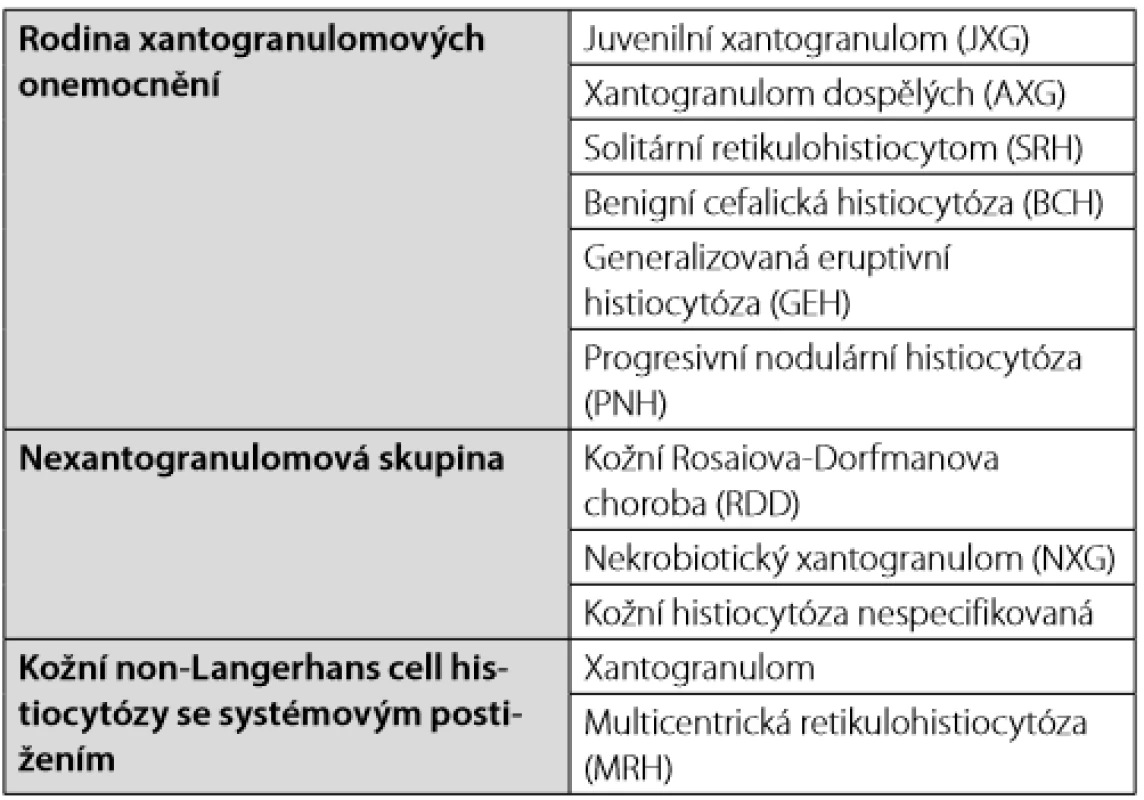
Juvenilní xantogranulom (synonymum névoxantoendoteliom) je častý kožní tumorek u malých dětí. Vypadá jako solitární červenožlutý nebo žlutý uzel na kůži hlavy, krku a trupu. Histologicky je pod epidermis neostře ohraničené ložisko smíšené stavby, z jednojaderných okrouhlých histiocytů s eozinofilní, vakuolizovanou i pěnitou cytoplazmou, vřetenitých histiocytů a vícejaderných Toutonových buněk. Na pozadí jsou malé lymfocyty a neutrofily. Mnohočetné, gigantické, hluboké, viscerální a diseminované formy jsou mikroskopicky podobné, ale mnohem vzácnější. Podtypem je pak nekrobiotický xantogranulom, který je velmi často spojen s přítomností monoklonálního imunoglobulinu.
Nemoc probíhá indolentně, ale setkali jsme se s pacientkou, u níž postižení víček a snaha o operační řešení způsobily lagoftalmus a oboustrannou slepotu. Někdy se pro ploché morfy užívá termínu xanthoma planum, pro indurované morfy pak xanthogranuloma (25–36).
Léčba xantogranulomů se odvozuje z popisů jednotlivých zkušeností, neexistuje žádná studie či doporučení pro léčbu v této oblasti. V popsaných léčebných postupech byly použity tyto léky: topické a systémové podání glukokortikoidů, thalidomid, lenalidomid, farmakologické dávky intravenózních imunoglobulinů, chlorambucil, cyklofosfamid, fludarabin, rituximab, melfalan, infliximab, interferon α, kladribin, hydroxychlorochin, azathioprin, methotrexát, laserová léčba, operační léčba, plazmaferéza a extrakorporální fotoforéza (25–36).
Rosaiova-Dorfmanova nemoc
Rosaiova - Dorfmanova nemoc (synonymum sinusová histiocytóza s masivní lymfadenopatií) se vyznačuje postižením uzlin, v nichž jsou dilatované dřeňové sinusy přeplněné velkými bledými makrofágy. Ty fagocytují lymfocyty, které zůstávají po pohlcení v cytoplazmě neporušené (tzv. emperipoleza). Velké buňky jsou pozitivní s protilátkou proti S100 a histiocytárními markery (CD68, CD163). Rosaiova - Dorfmanova nemoc typicky postihuje krční uzliny. Emperipolesis je základním z morfologických znaků této nemoci.
Rosaiova - Dorfmanova nemoc typicky postihuje krční uzliny a často tvoří masivní lymfadenopatii. Nicméně může mít i mimouzlinové projevy, které se popisují u 43 % nemocných. Nejčastěji je postižena kůže, paranazální dutiny, kosti a retroorbitální prostor. Nemoc je popisována i intrakraniálně, postihuje tvrdou plenu. Na zobrazovacím vyšetření nemoc může vypadat jako meningiom, ale vyšetření likvoru může pomoci v odlišení těchto nemocí. Zcela výjimečně může nemoc způsobit pachymeningitidu. Uvádí se, že v případě Rosaiovy - Dorfmanovy nemoci obsahují ložiska vyšší počet IgG4+ plazmocytů, a proto je odlišení od IgG4 related disease velmi obtížné, ne - li nemožné. Laboratorní abnormality jsou nespecifické, zvýšená sedimentace erytrocytů, leukocytóza, zvýšený ferritin, polyklonální hypergamaglobulinemie a někdy i autoimunitní hemolytická anémie (37–42). Histiocyte Society uvádí několik forem Rosaiovy -Dorfmanovy nemoci (RDD) – Tab. 3.
Tab. 3. Formy Rosaiovy-Dorfmanovy nemoci (Rosai-Dorfman Disease – RDD) dle klasifikace Histocyte Society (2) 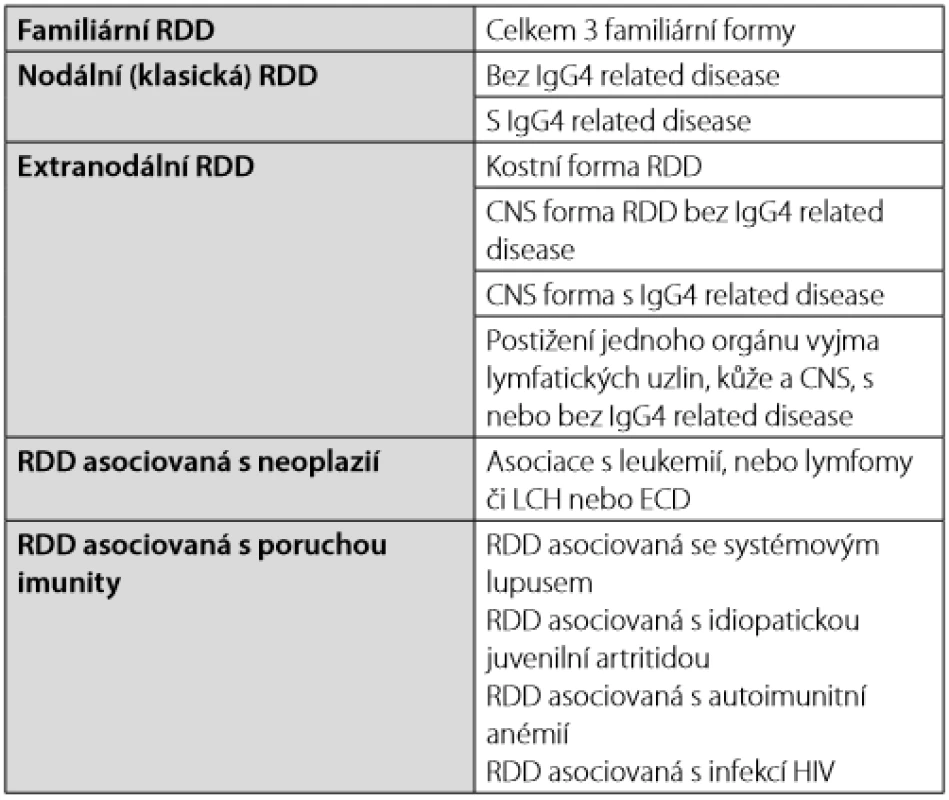
Maligní histiocytární choroby
Do skupiny maligních chorob, odvozených od histiocytů dle WHO patří:
- histiocytární sarkom,
- sarkom z folikulárních dendritických buněk,
- sarkom z interdigitujících dendritických buněk,
- fibroblastický retikulární tumor,
- inflamatorní pseudotumor -like sarkom z folikulárních/fibroblastových buněk.
Před zavedením imunofenotypizace byla diagnóza maligní histiocytózy stanovena mnohem častěji, protože četné B i T buněčné lymfoproliferace byly považovány za histiocytární malignity. V současné době jsou patology diagnostikovány velice zřídka.
Přibližně třetina histiocytárních sarkomů se manifestuje lokalizovanou lymfadenopatií, třetina se manifestuje kožními ložisky (solitární či mnohočetná) a poslední třetina vzniká extranodálně, často v oblasti zažívacího traktu.
Někteří nemocní mají systémové postižení s mnohočetnými ložisky, jehož popis se může shodovat s dřívějšími popisy maligní histiocytózy. WHO klasifikace by nyní pro tento stav použila termínu generalizovaná či diseminovaná forma histiocytárního sarkomu.
Lokalizovaný histiocytární sarkom
Tato jednotka je odvozena od fagocytujících mononukleárních buněk ve stadiu tkáňové fixace a diferenciace, tj. zralých makrofágů. Může vzniknout jak v kůži, tak zažívacím traktu či v kostech. Pokud se nepodaří totální odstranění s lemem zdravé tkáně, je tento tumor poměrně rezistentní k následné chemoterapii případně radioterapii.
Diseminovaný histiocytární sarkom, synonymem maligní histiocytóza
Někteří pacienti s histiocytárním sarkomem mají mnohočetné postižení včetně hepatomegalie a splenomegalie, což odpovídá staršímu popisu maligní histiocytózy. Tento termín se dnes již nepoužívá a místo něj se používá termín diseminovaný histiocytární sarkom (43–45).
Tato diseminovaná forma histiocytárního sarkomu je velmi agresivně probíhající nemoc. Klinické příznaky se podobají projevům lymfoblastické leukemie s generalizovaným postižením orgánů. Maligní histiocytózu velmi často provází vysoké horečky nad 39 °C, splenomegalie (100 %), lymfadenopatie (92 %), hepatomegalie (67 %). Mohou však být infiltrovány i jiné orgány, např. plíce, mozek, kůže, což k výše uvedeným příznakům může přidat dušnost či bolesti hlavy. Někdy způsobuje osteolýzu a s ní spojené bolesti kostí. Kožní manifestace může nabývat různých podob, od benigně vyhlížejícího exantému až po četné kožní tumory trupu a končetin. Postižení střeva se často projeví obstrukčními příznaky.
Nemoc charakterizují následující laboratorní změny: trombocytopenie (92 %), anémie (92 %), leukocytopenie (67 %). V biochemickém vyšetření se u těchto pacientů velmi často detekují vysoké hodnoty LDH a bilirubinu, přičemž jaterní enzymy a renální funkce bývají jen nepatrně zhoršené. Nepravidelně se vyskytuje zvýšení ACE - inhibitoru (Angiotensin Converting Enzym Inhibitor) a TNF (Tumor Necrosis Factor).
Při postižení CNS lze často nalézt v mozkomíšním moku patologické fagocytující neoplastické histiocyty.
Vyšetření kostní dřeně metodou trepanobiopsie je nejpřístupnější cestou ke zjištění diagnózy. Je však nutno upozornit na skutečnost, že první vzorky mohou být hodnoceny jako negativní a teprve při výraznější infiltraci se podaří identifikovat proliferující anaplastické histiocyty.
Nádorovou populaci tvoří velké atypické buňky rostoucí v plochách. V uzlinách se mohou šířit sinusy. Buňky jsou oválné, nepravidelné nebo vřetenité s velkými hyperchromními jádry. Cytoplazma je eozinofilní i slabě vakuolizovaná, hemofagocytóza není typická. Některé buňky jsou vícejaderné nebo vyloženě bizarní. Nenádorovou příměs reprezentují malé lymfocyty, neutrofily, eozinofily a blandní histiocyty. V některých případech převládají a vlastní nádorové buňky překryjí. Histologická diagnostika je velmi obtížná. Nádor se totiž v základním barvení podobá jak velkobuněčným lymfomům (ALCL, DLBCL aj.), tak nediferencovanému karcinomu, melanomu, vřetenobuněčnému nebo pleomorfnímu sarkomu. Jedině široký panel protilátek dokáže tyto jednotky vyloučit. Musí být pozitivní alespoň některé histiocytární znaky (CD68, CD163, lysozym). Znak CD4 bývá v histiocytárních sarkomech atypicky cytoplazmatciky pozitivní, ale není původním histiocytárním markerem. Komplikované je také odlišení myelosarkomu, v čemž může pomoci klinická anamnéza. Klinicky se tyto histiocytární sarkomy chovají velmi agresivně, asi v 70 % je nemoc rozpoznána v generalizovaném stadiu (III a IV), a proto asi 60 % nemocných zemře v průběhu léčby na progresi nemoci. Medián přežití je pořád velmi krátký, jen 6 měsíců (45, 46).
Pro léčbu diseminované formy histiocytárního sarkomu (po staru maligní histiocytózy) se používají stejná cytostatická schémata jako pro léčbu agresivních lymfomů.
Také u maligní histiocytózy či histiocytárního lymfomu lze použít k léčbě kladribin neboli 2-chlorodeoxyadenosin. Pokud se prokáže mutace signální cesty BRAF, lze použít vemurafenib a v jedné zprávě pozitivní hodnotí trametinib (47–49).
Sarkom z folikulárních dendritických buněk
Sarkom z folikulárních dendritických buněk (folicular dedritic cell sarcoma) často (asi ve 2/3 případů) tvoří lokalizovanou lymfadenopatii, která má tendenci k lokálním recidivám po léčbě. Méně často vzniká primárně extranodálně, a to v jakékoliv lokalizaci, např. v tonzile. Tendence k diseminaci není velká.
Někteří autoři uvádějí, že v 10–20 % je tento typ tumoru asociován s hyalinně - vaskulárním typem Castlemanovy nemoci. Pro sarkom z folikulárních dendritických buněk je typická pomalu rostoucí nádorová masa bez přítomnosti systémových příznaků. Sarkom z folikulárních dendritických buněk se chová indolentně, jako low grade sarkom (50–52).
Nádor je tvořen protáhlými nebo ovoidními buňkami, které rostou ve svazcích, vírech nebo se rohožovitě proplétají. Jádra jsou oválná a chromatin bledý. Buňky nemusí být výrazně atypické, počet mitóz je také variabilní. Mezi vřetenitými buňkami jsou roztroušeny malé lymfocyty. Buňky sarkomu lze při imunohistochemickém vyšetření potvrdit podle markerů folikulárních dendritických buněk (CD21, CD23 a CD35).
Léčba je podobná jako u většiny sarkomů. Zásadní je možnost a realizace kompletní chirurgické resekce s nebo bez adjuvantní chemoterapie a radioterapie. Lokální recidivy se vyskytují asi v 50 % případů a metastázy asi u 25 % případů. Nemoc je poměrně chemorezistentní, takže pokud není možná operační léčba, samotná protinádorová chemoterapie nevede k vyléčení (53, 54).
Sarkom z interdigitujících dendritických buněk
Sarkom z interdigitujících dendritických buněk (Interdigitating dendritic cell sarcoma) je velmi vzácné onemocnění. Může vzniknout primárně v uzlině, ale i kůži a v měkkých tkáních. Byly také popsány různé formy viscerálního postižení. Nemoc se většinou projeví symptomatickou nádorovou masou, klasické B symptomy jsou popisovány spíše výjimečně (55).
Nádorové buňky jsou vřetenité, s popraškem malých T -lymfocytů a plazmocytů. Bez imunohistochemie jej nelze rozpoznat od sarkomu z folikulárních dendritických buněk, CD21 i CD23 jsou však negativní. Pozitivní bývá vimentin, S100 a slabě CD68.
Zásadní pro léčbu je možnost provedení totální resekce. Pokud to není možné, používají se stejné chemoterapeutické režimy jako pro léčbu nehodgkinských lymfomů. Uvádí se, že efekt samotné chemoterapie není tak dobrý, jako je u maligních lymfomů. Transplantace kostní dřeně je proto vždy ke zvážení, pokud není možná radikální operace a odstranění patologické masy. Prognóza této nemoci je v případě nemožnosti radikální operace nepříznivá (55, 56), o něco příznivější je snad při průkazu mutace BRAF a podání cílené léčby (57).
Hemofagocytující lymfohistiocytóza a syndrom aktivace makrofágů
Hemofagocytární lymfohistiocytóza přestavuje reaktivní zmnožení lymfocytů a histiocytů s probíhají hemofagocytózou.
Existuje familiární forma této nemoci s prokázanou mutací více než dvou genů, z nichž každý narušuje cytotoxickou funkci NK a T buněk. Defekt NK a T buněk má klíčovou roli pro uvedenou poruchu. A dále byla definována podobná jednotka – syndrom aktivace makrofágů, včetně diferenciálně diagnostických postupů (58–60).
Získané formy se mohou vyskytnout u osoby s vrozenou nebo získanou poruchou imunity. Vyvolávající stimulem pak může být infekce.
Podmínkou, aby tato získaná forma mohla vzniknout, je však výrazný defekt NK a T buněčné imunity.
Hereditární i získané formy se klinicky velmi podobají, a proto se pro ně používá společný termín hemofagocytární lymfohistiocytóza. Společným jmenovatelem je narušená cytotoxická funkce lymfocytů, vedoucí k přetrvávající aktivitě imunitního systému, tedy k proliferaci a akumulaci lymfocytů a histiocytů v postižených orgánech.
Familiární hemofagocytující lymfohistiocytóza je jednotka, u níž byla prokázána mutace různých genů, které jsou důležité pro cytotoxickou funkci T a NK buněk.
První byla popsána mutace genu pro perforin, další pak byla mutace genu Munc 13–4, která způsobuje defektní fúzi cytoplazmatických granulí. Následovalo odhalení dalších genů, unc13d, syntaxin 11. Také vrozené defekty imunity predisponují pro tuto nemoc (Chédiak - Higashi syndrom, Griscelli syndrom 2 a na X chromozom vázaný lymfoproliferativní syndrom) (60, 61).
V případě získaného hemofagocytárního syndromu byla prokázána excesivní tvorba cytokinů normálními nebo maligními T - lymfocyty. Kontinuálně zvýšená produkce určitých cytokinů pak indukuje hemofagocytání syndrom. Důkazem excesivní imunitní stimulace je zvýšená hladina solubilního receptoru IL2 u pacientů s aktivní nemocí.
Charakteristickým nálezem v biopsii lymfatických uzlin je deplece lymfocytů a široké, jakoby prázdné sinusy s velkými makrofágy. Ty při podrobném cytologickém hodnocení vykazují známky aktivace, je zvýšeno množství cytoplazmy a je zřetelná fagocytóza erytrocytů, leukocytů, krevních destiček a jejich fragmentů. V postižených orgánech je vždy smíšená lymfo -histiocytární infiltrace. Výrazná histiocytární proliferace je zřetelná v celém retikuloendoteliálním systému, nejvíce je postižena kostní dřeň, červená pulpa sleziny, jaterní sinusy a lymfatické uzliny. Infiltrace kostní dřeně je vždy zřetelná u hemofagocytující lymfohistiocytózy spojené s infekcí, ale může být opožděná v případě familiární formy, kdy iniciální histologie kostní dřeně může prokázat hyperplazii červené krvetvorby bez hemofagocytózy. Proto je vhodné bioptovat i jiné tkáně a orgány.
Musíme upozornit, že hemofagocytóza není nález zcela specifický pro HLH. Může doprovázet i jiné stavy s aktivací retikuloendoteliálního systému, tj. sepsi, hemolytické anémie, podání krevní transfuze a GvHD. Diagnóza HLH se musí zakládat na korelaci projevů klinických, biochemických, imunologických a morfologických. V guidelines je požadováno splnění 5 z 8 vyjmenovaných diagnostických kritérií (Tab. 4), hemofagocytóza je pouze jedním z nich.
Tab. 4. Diagnostická kritéria fagocytární lymfohistiocytózy publikovaná 2007 (61) 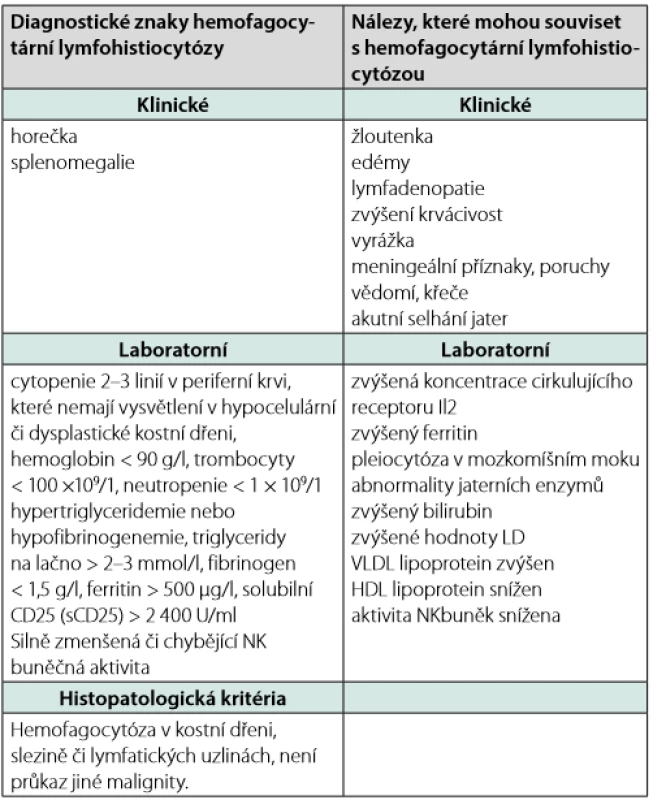
Dle souvislosti lze hemofagocytární lymfohistiocytózu dělit do 3–4 skupin:
- familiární hemofagocytární lymfohistiocytóza,
- hemofagocytární lymfohistiocytóza asociovaná s infekcí,
- hemofagocytární lymfohistiocytóza asociovaná s maligní neoplazií,
- hemofagocytární lymfohistiocytóza asociovaná s neznámým vyvolávajícím činitelem.
Familiární erytrofagocytární lymfohistiocytóza (FEL)
FEL je vzácné, často fatální multiorgánové onemocnění, postihující játra, slezinu, lymfatické uzliny a centrální nervový systém. Rodinná anamnéza může být pozitivní, choroba má autozomálně recesivní způsob dědičnosti. Choroba se manifestuje u kojenců a batolat. Projevuje se horečkou nejasného původu, úbytkem na váze, cytopenií a hepatosplenomegalií. Někdy lze detekovat makulopapulární exantém červeno - fialového zbarvení (eflorescence u LCH bývají žluto - hnědé). FEL se obtížně diagnostikuje, neboť první bioptické vyšetření kostní dřeně nezachytí hemofagocytózu. Ta je přítomna až po delším průběhu nemoci, kdy se objevuje také pancytopenie a žloutenka. Diagnóza nemoci je podpořena průkazem lymfohistiocytárních infiltrátů a přítomnosti erytrocytofagocytózy ve vzorcích z lymfatických uzlin, sleziny, jater, kostní dřeně, nebo plic a průkaz familiární formy pak na molekulárně genetickém vyšetření (63, 64). Diagnostická kritéria uvádí Tab. 4.
Porucha se projeví náhle vzniklými horečkami a postižením výše uvedených orgánů. Možné je i postižení CNS, dezorientace, křeče, porucha vědomí, kóma. Laboratorní vyšetření mohou odhalit hyperlipidemii, hypofibrinogenemii a poruchu buněčné imunity (snížení aktivity cytotoxicity). Onemocnění je autozomálně recesivně vázané. Průkaz pozitivní rodinné anamnézy může při stanovení diagnózy napomoci. Průběh nemoci je rychlý a velmi často fatální.
Klasickým lékem je etoposid, dále kortikosteroidy, vinblastin a další formy imunosuprese. Při postižení CNS se intratekálně aplikují steroidy a methotrexát. Novým a velmi účinným preparátem, podobně jako u Langerhansovy histiocytózy, je kladribin. S terapeutickým cílem byla u těchto dětí dělána také splenektomie.
Klasickým léčebným protokolem pro hemogacytující lymfohistiocytózu, který se používá jak u familiární, tak u nefamiliární formy, je trojkombinace složená z etoposidu, dexametazonu a cyklosporinu (64–66). Léčebný protokol uvádí www.histio.org/society/protocols se všem podrobnostmi. U méně rozvinuté dětské formy je možné použít jen kortikoidy a imunoglobuliny. Léčba druhé linie při insuficienci první není přesně definována. Formou kazuistik byly popsány případy, kdy pomohl daclizumab nebo alemtuzumab či etanercept.
Uvedená cytostatická léčba má potenciál dosáhnout u dětí zpomalení průběhu, nicméně zastavení procesu a vyléčení se uvedenou chemoterapií nepodaří vždy dosáhnout. Jediným zásadním léčebným postupem je alogenní transplantace. Ta je považována za léčbu volby, pokud je vhodný dárce.
Sekundární hemofagocytující lymfohistiocytóza
Sekundární hemofagocytující lymfohistiocytóza, asociovaná s infekcí, byla poprvé popsána při virové infekci u imunokompromitovaného pacienta, později i u řady jiných virových, bakteriálních, mykotických a parazitárních onemocnění, ale i maligních onemocnění (66).
Podmínkou vzniku byl stav imunodeficience, a to buď vrozeného, získaného či iatrogenního původu. Sekundární hemofagocytující lymfohistiocytózu lze rovněž pozorovat v souvislosti s některými T - lymfoidními malignitami. Klinická symptomatologie je obdobná jako u familiární erytrofagocytující lymfohistiocytóze. Dominuje horečka, hepatopatie, anémie a koagulopatie. Příčina koagulopatie je zřejmě v infiltraci jater.
Základem pro stanovení diagnózy je biopsie kostní dřeně, v níž jsou benigně vyhlížející histiocytární buňky obsahující fagocytované erytrocyty a další krvinky. Fenotyp a cytochemická charakteristika je shodná s fyziologickými histiocyty a odlišná od maligních histiocytů. Podobný obraz lze nalézt i v uzlinách. V kostní dřeni může být přitom zřetelné zmnožení tvorby jak erytrocytů, tak trombocytů, přičemž v periferní krvi je jich nedostatek a nejsou přítomny specifické protilátky, které by způsobily jejich zánět na autoimunitním podkladě (62, 66).
Léčba se zaměřuje na zvládnutí souběžně probíhající infekce, imunodeficitního stavu, případně vyvolávajícího maligního onemocnění. Pokud nemoc vznikne u pacientů na imunosupresi, je to indikací k přerušení imunosuprese.
V případech asociovaných s maligní nemocí je třeba paralelně s intenzivní symptomatickou léčbou HLH léčit i základní maligní onemocnění (6, 63, 66). V poslední době se objevily publikace popisující účinek ruxolitibu u sekundární hemofagocytující lymfohistiocytózy (67).
Kikuchi-Fujimoto histiocytární nekrotizující lymfadenitis
Tato nemoc není uvedena ve výčtu histocytárních onemocnění ani ve WHO klasifikaci ani v klasifikaci Histiocyte Society. Jde o reaktivní změny. Tato nemoc do kapitoly histiocytárních onemocnění nepatří, ale protože ve svém názvu nese přídavné jméno „histiocytární“, tak ji stručně zmíníme.
Kikuchi -Fujimoto histiocytární nekrotizující lymfadenitis je termín pro self limiting cervikální lymfadenopatii nejasného původu. Předpokládá se, že se jedná o postvirální hyperimunní reakci. Je zde možné spojení s lupus erythematodes a s nespecifickými hyperimunitními reakcemi na různé vyvolávající příčiny. Klinicky se projeví jako zvětšené uzliny, nejčastěji v oblasti krku, případně spojené s horečkou nejasného původu.
Diagnózu lze stanovit pouze histologicky z extirpované uzliny. V uzlině jsou přítomna ložiska nekrózy, která mohou splývat, agretáty histiocytů a aktivované lymfocyty.
Léčba této nemoci se odvíjí od tíže příznaků. Lehčí příznaky by měla zvládnout nesteroidní antiflogistika, závažnější průběh s horečkami pak léčba glukokortikoidy. Vzhledem k tomu, že podobný obraz může mít i lupusová lymfadenitida, doporučuje vždy vyšetření cílené na průkaz systémových chorob pojiva (68).
Závěr
Stručně jsme charakterizovali jednotlivé choroby, které současná WHO klasifikace krevních chorob a klasifikace Histiocyte Society řadí do skupiny histiocytárních chorob. Popis jednotlivých z nich je uveden v citované literatuře.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Zdeněk Král, CSc.,
Interní hematologická a onkologická klinika LF MU a FN Brno,
pracoviště Bohunice,
Jihlavská 20,
625 00 Brno
Cit. zkr: Vnitř Lék 2020; 66(6): e19–e27 Článek přijat redakcí: 12. 6. 2019 Článek přijat po recenzích: 3. 8. 2019
Zdroje
1. Swerdlow SH, Campo E, Harris NL, et al. WHO classification of the tumours of Haematopoietic and lymphoid diseases. Revised 4th edition, Lyon 2017, 585 s.
2. Emile JF, Abla O, Fraitag S, et al. Histiocyte Society. Revised classification of histiocytoses and neoplasms of the macrophage - dendritic cell lineages. Blood 2016; 127 : 2672–2681.
3. Chen M, Ding C, Lu T, et al. Langerhans cell histiocytosis and Erdheim -Chester disease overlap syndrome with bone marrow involvement and type 2 diabetes mellitus. Ann Hematol 2018; 97 : 189–192.
4. Novosad O, Skrypets T, Pastushenko Y, et al. MAPK/ERK signal pathway alterations in patients with Langerhans Cell Histiocytosis. Klinická onkol 2018; v tisku.
5. Tzankov A, Kremer M, Leguit R, et al. Histiocytic cell neoplasms involving the bone marrow: summary of the workshop cases submitted to the 18th Meeting of the European Association for Haematopathology (EAHP) organized by the European Bone Marrow Working Group, Basel 2016. Ann Hematol 2018; 97 : 2117–2128.
6. Diamond EL, Subbiah V, Lockhart AC, et al. Vemurafenib for BRAF V600-Mutant Erdheim - Chester Disease and Langerhans Cell Histiocytosis: Analysis of Data From the Histology -Independent, Phase 2, Open -label VE -BASKET Study. JAMA Oncol 2018; 4 : 384–388.
7. Girschikofsky M, Arico M, Castillo D, et al. Management of adult patients with Langerhans cell histiocytosis: recommendations from an expert panel on behalf of Euro - Histio-Net. Orphanet J Rare Dis 2013; 8 : 72.
8. Haupt R, Minkov M, Astigarraga I, et al. Euro Histio Network. Langerhans cell histiocytosis (LCH): guidelines for diagnosis, clinical work - up, and treatment for patients till the age of 18 years. Pediatr Blood Cancer 2013; 60 : 175–184.
9. Kolenová A, Bubanská E, Špotová A, et al. Cielená liečba závažnej multisystémovej histiocytózy z Langerhansových buniek. Pediatr Prax 2018; 19 : 27–31.
10. Nakamine H, Yamakawa M, Yoshino T, et al. Langerhans Cell Histiocytosis and Langerhans Cell Sarcoma: Current Understanding and Differential Diagnosis. J Clin Exp Hematop 2016; 56 : 109–118.
11. Xu XL, Bu WB, Zong WK, et al. Indeterminate cell histiocytosis: a case series and review of the literature. Eur J Dermatol 2017; 27 : 559–561.
12. Rezk SA, Spagnolo DV, Brynes RK, et al. Indeterminate cell tumor: a rare dendritic neoplasm. Am J Surg Pathol 2008; 32 : 1868–1876.
13. Cohen - Aubart F, Emile JF, Carrat F, et al. Phenotypes and survival in Erdheim - Chester disease: Results from a 165-patient cohort. Am J Hematol 2018; doi: 10.1002/ajh.25055.
14. Suzuki H, Wanibuchi M, Komatsu K, et al. Erdheim - Chester Disease Involving the Central Nervous System with the Unique Appearance of a Coated Vertebral Artery. NMC Case Rep J 2016; 3 : 125–128.
15. Papo M, Diamond EL, Cohen - Aubart F, et al. High prevalence of myeloid neoplasms in adults with non -Langerhans cell histiocytosis. Blood 2017; 130 : 1007–1013.
16. Cao XX, Niu N, Sun J, et al. Clinical and positron emission tomography responses to long -term high -dose interferon -α treatment among patients with Erdheim -Chester disease. Orphanet J Rare Dis 2019; 14 : 11.
17. Goyal G, Shah MV, Call TG, et al. Efficacy of biological agents in the treatment of Erdheim-Chester disease. Br J Haematol 2017; doi:10.1111/bjh.14997.
18. Oneal PA, Kwitkowski V, Luo L, et al. FDA Approval Summary: Vemurafenib for the Treatment of Patients with Erdheim - Chester Disease with the BRAFV600 Mutation. Oncologist 2018; 23 : 1520–1524.
19. Cohen Aubart F, Emile JF, et al. Targeted therapies in 54 patients with Erdheim-Chester disease, including follow - up after interruption (the LOVE study). Blood 2017; 130 : 1377–1380.
20. Tamura S, Kawamoto K, Miyoshi H, et al. Cladribine treatment for Erdheim - Chester disease involving the central nervous system and concomitant polycythemia vera: A case report. J Clin Exp Hematop 2018; 58 : 161–165.
21. Adam Z, Szturz P, Pour L, et al. Kladribin je vysoce účinný v léčbě histiocytózy z Langerhanosových buněk a vzácných chorob ze skupiny juvelního xantogranulomu. Vnitř Lék 2012; 58 : 455–465.
22. Franconieri F, Deshayes S, de Boysson H et al. Superior efficacy and similar safety of double dose anakinra in Erdheim -Chester disease after single dose treatment. Oncoimmunology 2018; 7: e1450712.
23. Hao X, Feng R, Bi Y, et al. Dramatic efficacy of dabrafenib in Erdheim - Chester disease (ECD): a pediatric patient with multiple large intracranial ECD lesions hidden by refractory Langerhans cell histiocytosis. J Neurosurg Pediatr 2018; 23 : 48–53.
24. Al Bayati A, Plate T, Al Bayati M, et al. Dabrafenib and Trametinib Treatment for Erdheim -Chester Disease With Brain Stem Involvement. Mayo Clin Proc Innov Qual Outcomes 2018; 2 : 303–308.
25. Luder CM, Nordmann TM, et al. Histiocytosis - cutaneous manifestations of hematopoietic neoplasm and non -neoplastic histiocytic proliferations. J Eur Acad Dermatol Venereol 2018; doi: 10.1111/jdv.14794.
26. Mahendran P, Wee J, Chong H, et al. Necrobiotic xanthogranuloma treated with lenalidomide. Clin Exp Dermatol 2018; 43 : 345–347.
27. Sagiv O, Thakar SD, Morrell G, et al. Rituximab Monotherapy Is Effective in Treating Orbital Necrobiotic Xanthogranuloma. Ophthal Plast Reconstr Surg 2018; 34: e24–e27.
28. Techavichit P, Sosothikul D, Chaichana T, et al. BRAF V600E mutation in pediatric intracranial and cranial juvenile xanthogranuloma. Hum Pathol 2017; 69 : 118–122.
29. Fölster - Holst R. Severe systemic juvenile xanthogranuloma is an indication for systemic therapy. Br J Dermatol 2017; 176 : 302–304.
30. Klingner M, Hansel G, Schönlebe J, et al. Disseminated necrobiotic xanthogranuloma. Hautarzt 2016; 67 : 902–906.
31. Honda Y, Nakamizo S, Dainichi T, et al. Adult -onset asthma and periocular xanthogranuloma associated with IgG4-related disease with infiltration of regulatory T cells. J Eur Acad Dermatol Venereol 2017; 31: e124–e125.
32. Miguel D, Lukacs J, Illing T, et al. Treatment of necrobiotic xanthogranuloma - a systematic review. J Eur Acad Dermatol Venereol 2017; 31 : 221–235.
33. Maintz L, Wenzel J, Irnich M, et al. Successful treatment of systemic juvenile xanthogranulomatosis with cytarabine and 2-chlorodeoxyadenosine: case report and review of the literature. Br J Dermatol 2017; 176 : 481–487.
34. Higgins LS, Go RS, Dingli D, et al. Clinical Features and Treatment Outcomes of Patients With Necrobiotic Xanthogranuloma Associated With Monoclonal Gammopathies. Clin Lymphoma Myeloma Leuk 2016; 16 : 447–452.
35. Hilal T, DiCaudo DJ, Connolly SM et al. Necrobiotic xanthogranuloma: a 30-year single-center experience. Ann Hematol 2018; 97 : 1471–1479.
36. Sagiv O, Thakar SD, Morrell G, et al. Rituximab Monotherapy Is Effective in Treating Orbital Necrobiotic Xanthogranuloma. Ophthalmic Plast Reconstr Surg 2018; 34: e24–e27.
37. Jacobsen E, Shanmugam V, Jagannathan J. Rosai - Dorfman Disease with Activating KRAS Mutation - Response to Cobimetinib. N Engl J Med 2017; 377 : 2398–2399.
38. Matter MS, Bihl M, Juskevicius D. Is Rosai - Dorfman disease a reactve process? Detection of a MAP2K1 L115V mutation in a case of Rosai -Dorfman disease. Virchows Arch 2017; 471 : 545–547.
39. Hasegawa M, Sakai F, Okabayashi A, et al. Rosai -Dorfman Disease of the Lung Overlapping with IgG4-related Disease: The Difficulty in Its Differential Diagnosis. Intern Med 2017; 56 : 937–941.
40. Ghawas MS, Ng T, Chen LYC. Confirmed Efficacy of Lenalidomide and Dexamethasone in Unresectable Cutaneous Facial Rosai -Dorfman -Destombes Disease Mayo Clin Proc Innov Qual Outcomes 2019; 3 : 94–96.
41. Geller S, Busam K, Hamlin PA et al. Treatment of Rosai - Dorfman disease with oral bexarotene: a case series. J Dermatolog Treat 2018; doi: 10.1080/09546634.2018.1528001.
42. Averitt AW, Heym K, Akers L, et al. Sinus Histiocytosis With Massive Lymphadenopathy (Rosai Dorfman Disease): Diagnostic and Treatment Modalities for this Rare Entity Revisited. J Pediatr Hematol Oncol 2018; 40: e198–e202.
43. Huhn D. Therapy of malignant histiocytosis. Haematol Blood Transfus 1981; 27 : 211–216.
44. Kommalapati A, Tella SH, Durkin M, et al. Histiocytic sarcoma: a population -based analysis of incidence, demographic disparities, and long - term outcomes. Blood 2018; 131 : 265–268.
45. Kommalapati A, Tella SH, Durkin M, et al. Histiocytic sarcoma: a population - based analysis of incidence, demographic disparities, and long - term outcomes. Blood 2018; 131 : 265–268.
46. Broadwater DR, Conant JL, Czuchlewski DR, et al. Clinicopathologic Features and Clinical Outcome Differences in De Novo Versus Secondary Histiocytic Sarcomas: A Multi-institutional Experience and Review of the Literature. Clin Lymphoma Myeloma Leuk 2018; 18: e427–e435.
47. Voruz S, Cairoli A, Naveiras O, et al. Response to MEK inhibition with trametinib and tyrosine kinase inhibition with imatinib in multifocal histiocytic sarcoma. Haematologica 2018; 103: e39–e41.
48. Iwabuchi H, Kawashima H, Umezu H, et al. Successful treatment of histiocytic sarcoma with cladribine and high - dose cytosine arabinoside in a child. Int J Hematol 2017; 106 : 299–303.
49. Gounder MM, Solit DB, Tap WD. Trametinib in Histiocytic Sarcoma with an Activating MAP2K1 (MEK1) Mutation. N Engl J Med 2018; 378 : 1945–1947.
50. Chen T, Gopal P. Follicular Dendritic Cell Sarcoma. Arch Pathol Lab Med 2017; 141 : 596–599.
51. Facchetti F, Lorenzi L. Follicular dendritic cells and related sarcoma. Semin Diagn Pathol 2016; 33 : 262–276.
52. Jain P, Milgrom SA, Patel KP, et al. Characteristics, management, and outcomes of patients with follicular dendritic cell sarcoma. Br J Haematol 2017; 178 : 403–412.
53. Sasaki M, Izumi H, Yokoyama T, et al. Follicular dendritic cell sarcoma treated with a variety of chemotherapy. Hematol Oncol 2017; 35 : 905–908.
54. Purkait S, Mallick S, Joshi PP, et al. Retroperitoneal and mediastinal follicular dendritic cell sarcoma: report of 3 cases with review of literature. Hematol Oncol 2017; 35 : 374–379.
55. Ninkovic S, Cole - Sinclair MF. Interdigitating dendritic cell sarcoma: diagnostic pitfalls, treatment challenges and role of transdifferentation in pathogenesis. Pathology 2017; 49 : 643–646.
56. Nguyen CM, Cassarino D. Primary Cutaneous Interdigitating Dendritic Cell Sarcoma: A Case Report and Review of the Literature. Am J Dermatopathol 2016; 38 : 628–631.
57. Di Liso E, Pennelli N, Lodovichetti G, et al. Braf mutation in interdigitating dendritic cell sarcoma: a case report and review of the literature. Cancer Biol Ther 2015; 16 : 1128–1135.
58. Minoia F, Bovis F, Davì S, et al. Development and Initial Validation of the Macrophage Activation Syndrome/Primary Hemophagocytic Lymphohistiocytosis Score, a Diagnostic Tool that Differentiates Primary Hemophagocytic Lymphohistiocytosis from Macrophage Activation Syndrome. J Pediatr 2017; 189 : 72–78.e3.
59. Lerkvaleekul B, Vilaiyuk S. Macrophage activation syndrome: early diagnosis is key. Open Access Rheumatol 2018; 10 : 117–128.
60. Otrock ZK, Daver N, Kantarjian HM, et al. Diagnostic Challenges of Hemophagocytic Lymphohistiocytosis. Clin Lymphoma Myeloma Leuk 2017; 17: S105–S110.
61. Henter JI, Horne A, Aricó M et al. HLH-2004: Diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis. Pediatr Blood Cancer 2007; 48 : 124–131.
62. Šrámek J, Karvunidis T, Lysák D, et al. Hemofagocytární lymfohistiocytóza u dospělých - review a kazuistika. Vnitř Lék 2018; 64 : 300–307
63. La Rosée P, Horne A, Hines M, et al. Recommendations for the management of hemophagocytic lymphohistiocytosis in adults. Blood 2019; doi: 10.1182/blood.2018894618.
64. Bergsten E, Horne A, Aricó M, et al. Confirmed efficacy of etoposide and dexamethasone in HLH treatment: long - term results of the cooperative HLH-2004 study. Blood 2017; 130 : 2728–2738.
65. Risma KA, Marsh RA. Hemophagocytic Lymphohistiocytosis: Clinical Presentations and Diagnosis. J Allergy Clin Immunol Pract 2019; 7 : 824–832.
66. Daver N, McClain K, Allen CE, et al. A consensus review on malignancy - associated hemophagocytic lymphohistiocytosis in adults. Cancer 2017; 123 : 3229–3240.
67. Zandvakili I, Conboy CB, Ayed AO, et al. Ruxolitinib as first - line treatment in secondary hemophagocytic lymphohistiocytosis: A second experience. Am J Hematol 2018; doi: 10.1002/ajh.25063.
68. Cuglievan B, Miranda RN. Kikuchi -Fujimoto disease. Blood 2017; 129 : 917–918.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2020 Číslo 6- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Pregabalin je účinné léčivo s příznivým bezpečnostním profilem pro pacienty s neuropatickou bolestí
-
Všechny články tohoto čísla
- Perkutánní okluze ouška levé síně
- Současné postavení dietních opatření u pacientů s pokročilým stupněm chronického onemocnění ledvin
- Dysfunkčný dialyzačný cievny prístup a jeho endovaskulárna liečba
- Histiocytózy a neoplazie odvozené od makrofágů a dendritických buněk. Srovnání WHO klasifikace z roku 2017 a klasifikace Histiocyte society z roku 2016
- Glykovaný hemoglobín ako marker zvýšenia LDL a TAG – kohortná štúdia
- Alergie a imunopatologie – hlavní téma
- Anafylaxe – akutní a dlouhodobý management
- Potravinová alergie a intolerance
- Poruchy v komplementovém systému
- Deriváty sulfonylurey a riziko hypoglykemie u diabetiků 2. typu
- Imunosenescence – západ slunce nad imunitním systémem
- Chřipka a její komplikace
- Familiární plicní fibróza – doporučení pro diagnostiku a léčbu
- Nové dělení krystalopatií z pohledu nefrologa
- Infarkt myokardu nebo syndrom zlomeného srdce?
- Dieulafoy lézia jejuna ako zdroj život ohrozujúceho krvácania
- Co nového internistům přinášejí doporučené postupy pro diagnostiku a léčbu plicní embolie z roku 2019?
- Endoskopická diagnostika a terapie pankreatobiliárních onemocnění u osob po resekci žaludku podle Billrotha I
- Nozokomiální methemoglobinemie
- Postihnutie tráviaceho traktu pri zmiešanej chorobe spojivového tkaniva (Sharpovom syndróme)
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Infarkt myokardu nebo syndrom zlomeného srdce?
- Postihnutie tráviaceho traktu pri zmiešanej chorobe spojivového tkaniva (Sharpovom syndróme)
- Potravinová alergie a intolerance
- Poruchy v komplementovém systému
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



