-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hepatorenální syndrom – update 2020
Hepatorenal syndrome – update 2020
Hepatorenal syndrome (HRS) is a serious complication in patients with advanced liver cirrhosis and ascites occurring simultaneously. According to current diagnostic criteria it is considered as one of the less common forms of acute kidney injury (AKI), referred to as HRS-AKI. As a result of the revision of the diagnostic criteria, there was a significant shift in the diagnosis of AKI in patients with liver cirrhosis, allowing early initiation of adequate measures and appropriate treatment. The following article describes the issue of AKI in liver cirrhosis in a wider context, the diagnostic criteria and algorithm of HRS-AKI treatment.
Keywords:
hepatorenal syndrome – liver cirrhosis – albumin – acute kidney injury – acute on chronic liver failure – terlipressin
Autoři: Karolína Krátká; Pavla Libicherová; Nikola Mejzlíková; Ivan Rychlík
Působiště autorů: I. interní klinika 3. LF UK a FN Královské Vinohrady, Praha
Vyšlo v časopise: Vnitř Lék 2020; 66(3): 71-75
Kategorie: Diferenciálně-diagnostické okénko aneb na co se vás mohou zeptat u atestace
Souhrn
Hepatorenální syndrom (HRS) představuje závažnou komplikaci u nemocných s pokročilou jaterní cirhózou a současně se vyskytujícím ascitem. Podle současných diagnostických kritérií je řazen mezi méně časté formy akutního poškození ledvin (acute kidney injury – AKI), označován jako HRS‑AKI. V důsledku přepracování diagnostických kritérií došlo k významnému posunu v diagnostice AKI u nemocných s jaterní cirhózou, s možností časného zahájení adekvátních opatřeních a příslušné léčby. V následujícím článku je popsána problematika AKI u jaterní cirhózy v širším kontextu, definována diagnostická kritéria a algoritmus léčby HRS‑AKI.
Klíčová slova:
akutní poškození ledvin – akutní selhání jater nasedající na chronické poškození jater – albumin – hepatorenální syndrom – jaterní cirhóza – terlipresin
Úvod
Hepatorenální syndrom (HRS) představuje dlouhodobé úskalí hepatologické péče o pacienty s pokročilou jaterní cirhózou, se současně se vyskytujícím ascitem. Problematice snížené funkce a poškození ledvin u jaterní cirhózy nebyla v minulosti věnována patřičná pozornost, a tak se všechny formy deteriorace funkce ledvin shrnovaly pod jednotný pojem hepatorenální syndrom (HRS). Zvyšující se incidence různých forem AKI s negativním ovlivněním prognózy nemocných vedla odborníky k podrobnější analýze patogenetických mechanismů AKI a přehodnocení původních diagnostických kritérií HRS.
V současné době již je upuštěno od původního dělení HRS na 2 podtypy podle závažnosti a rychlosti rozvoje renálního poškození, přesto se však nevyhneme jejich uvedení. HRS 1. typu byl tradičně definován rychlým rozvojem renálního selhání s velmi špatnou prognózou a vysokou mortalitou, s mediánem přežití 1 měsíce. Původní klasifikace HRS 1. typu byla založena na dosažení konkrétní hladiny sérového kreatininu (SCr), a tak vedla k opožděné diagnostice renálního poškození při již velmi snížené glomerulární filtraci (SCr ≥ 1,5 mg/dl, SCr ≥ 133 µmol/l odpovídající zhruba eGFR 30 ml/min). Použití fixních hodnot SCr ke stanovení HRS navíc nezohledňovala předchozí hladiny SCr, a tedy stupeň renálního poškození. HRS 2. typu byl naopak charakterizován pozvolným zhoršováním renální funkce a lepší prognózou, typicky u pacientů s refrakterním ascitem. HRS 2. typu však v současné době nereflektuje definici HRS‑AKI, ale řadí se spíše mezi formy chronického onemocnění ledvin (chronic kidney disease – CKD, tedy HRS‑CKD) (1).
Akutní poškození ledvin u jaterní cirhózy
AKI je častou komplikací u nemocných s jaterní cirhózou a je popisováno u 20–50 % pacientů přijatých k hospitalizaci pro známky dekompenzace jaterního onemocnění (2). Rozvoj jakékoliv formy AKI u cirhózy je nepochybně spojován s horší prognózou, v závislosti na příčině AKI. Může se jednat o vlastní formy AKI, nebo o AKI nasedající na preexistující terén CKD, s již přítomnou sníženou glomerulární filtrací a nebo současně s přítomnými známkami parenchymového poškození ledvin, s výskytem glomerulární hematurie či proteinurie. U jaterní cirhózy byl zaznamenán častější výskyt IgA nefropatie, nefropatie asociované s kryoglobulinemií při chronické hepatitidě C nebo jiné formy nefropatií vázané na další, současně přidružená onemocnění (např. diabetické poškození ledvin).
Jednoznačně nejčastější formou AKI u jaterní cirhózy je AKI prerenální etiologie, které je přítomno u téměř 70 % případů. Mezi tradiční vyvolávající faktory patří např. předávkování diuretik, velkoobjemová paracentéza ascitu bez následné aplikace albuminu, krvácení do gastrointestinálního systému, bakteriální infekce a další.
Po AKI z prerenálních příčin je další frekventní příčinou AKI akutní tubulární nekróza (ATN). ATN je nejčastěji způsobena ischemickým poškozením tubulů následkem hypotenze (tzv. postischemická ATN), např. z důvodu proběhlého krvácení z jícnových varixů nebo sepse. Klinická manifestace je velmi podobná HRS‑AKI, a tak rutinní markery velmi často neodliší tyto 2 klinické jednotky. V této souvislosti stoupá zájem o studie zkoumající úlohu močových biomarkerů v diferenciální diagnostice AKI.
HRS‑AKI tvoří menšinu forem AKI u jaterní cirhózy (8–12 % případů), která je spojena se sekundárně navozenou vazokonstrikcí v ledvinách, vznikající v důsledku komplexních cirkulačních změn spojených s portální hypertenzí.
V současné době je v hepatologii velmi studovanou problematikou relativně nová klinická jednotka – acute on chronic liver failure (ACLF). ACLF je charakterizován akutním jaterním selháním a současně přítomným jedním nebo vícečetným extrahepatálním orgánovým selháním, vznikajícím v důsledku dysregulace imunitní odpovědi na známý či dosud nepoznaný spouštěcí faktor, dále se současným podílem systémové zánětlivé reakce. Přítomnost AKI je jednou ze součástí definice ACLF, nejčastějším samostatným orgánovým postižením a hlavní komponentou v hodnocení závažnosti ACLF. Stupeň renální dysfunkce u ACLF koreluje s hladinami prozánětlivých mediátorů IL-6 (IL – interleukin), IL-8, naopak nereflektuje koncentraci plazmatického reninu, markeru poruchy v systémové cirkulaci. Tyto nálezy potvrzují klíčovou úlohu zánětu v patogenezi ACLF (3).
Diagnostická kritéria AKI u jaterní cirhózy
Diagnóza AKI je tradičně založena na vzestupu hladiny kreatininu a/nebo poklesu diurézy. Definice AKI prodělala vývoj od tzv. RIFLE kritérií navržených mezioborovou skupinou intenzivistů a nefrologů (Acute Dialysis Quality Initiative – ADQI) v roce 2004 ke klasifikaci AKIN (Acute Kidney Injury Network) v roce 2007. V roce 2012 KDIGO (Kidney Disease Improving Global Outcome) doporučení rozdíly mezi oběma klasifikacemi harmonizovala.
V roce 2015 byla hepatologickou společností ICA (International Club of Ascites) publikována diagnostická kritéria AKI u jaterní cirhózy (ICA‑AKI). Na rozdíl od KDIGO guidelines není v ICA‑AKI kritériích zařazeno hodnocení diurézy, která je u pacientů s jaterní cirhózou značně ovlivněna retencí tekutin, diuretickou léčbou a obtížně hodnotitelná pro všeobecný problém se správným sběrem moče. Současná diagnostická kritéria jsou založena na malých změnách SCr v krátké časové periodě, zdůrazněna je potřeba znalosti a hodnocení předchozích („baseline“) hladin SCr, včetně její dynamiky. „Baseline“ SCr je definován jako hladina SCr známá v posledních 3 měsících před přijetím, při známosti více hodnot je nejvíce vypovídající hladina SCr v úzké návaznosti na přijetí k hospitalizaci. Při neznámé předchozí hladině je za baseline SCr považována hodnota při přijetí. Tato modifikace vedla k časnějšímu záchytu akutního renálního poškození a lepšímu odhadu prognózy (4).
Podle ICA‑AKI je AKI definováno jako zvýšení SCr ≥ 0,3 mg/dl (≥ 26,5 µmol/l) během 48 hod nebo vzestup SCr o 50 % oproti známým výchozím hodnotám během posledních 7 dnů. Tato kritéria stratifikují AKI do 3 stadií s ohledem na míru vzestupu hladiny SCr. Stadia AKI umožňují stratifikovat prognózu pacientů s cirhózou a AKI (5). Výsledky studií ukázaly výraznou heterogennost skupiny nemocných s AKI 1. stadia, proto byla tato skupina rozdělena do 2 skupin s výrazně odlišnou prognózou (Tab. 1). Ke skupině pacientů stadia 1B je doporučováno přistupovat jako u pacientů s pokročilejším stadiem AKI. Pacienti ve 2. a 3. stadiu AKI mají výrazně horší prognózou s 3měsíční pravděpodobností přežití 42 % vs. 31 %. Oproti tomu nemocní v 1. stadiu AKI mají 3měsíční pravděpodobnost přežití více než 70 % (6).
Tab. 1. Diagnostická kritéria AKI podle ICA-AKI kritérií (upraveno dle (4)) 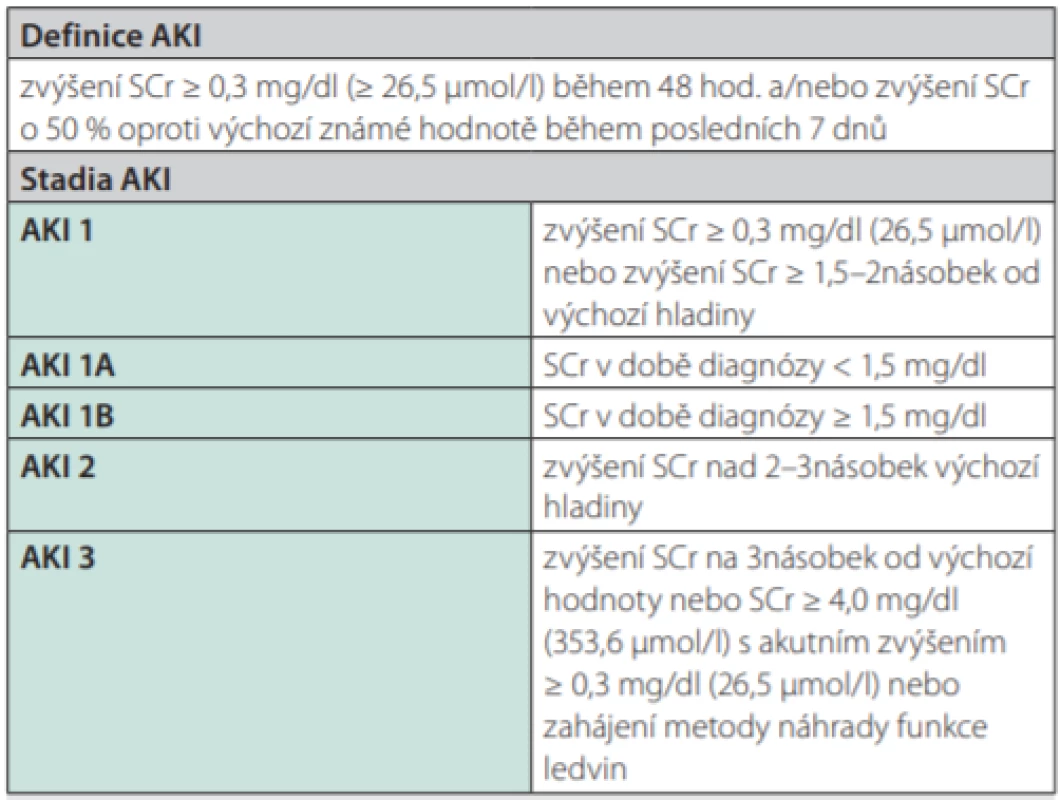
AKI – acute kidney injury, SCr – serum creatinine Diagnostická kritéria HRS‑AKI
Diagnóza HRS‑AKI je stanovena při současném splnění diagnostických kritérií ICA‑AKI a dalších bodů (Tab. 2). Sporné je vyloučení parenchymových změn v ledvinách u pacientů s výrazně sníženou funkcí ledvin, u kterých lze očekávat významné glomerulární změny, poškození cév a tubulointersticiálního prostoru. Z důvodu omezené možnosti histologické verifikace renální biopsií nelze také opominout možnost poškození ledvin při jiných přidružených komorbiditách.
Tab. 2. Diagnostická kritéria HRS-AKI (podle ICA) (upraveno dle [3]) ![Diagnostická kritéria HRS-AKI (podle ICA) (upraveno dle [3])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/5de2d00f4d486576b7c66d493dc54491.png)
ICA – International Club of Ascites, SCr – serum creatinine, NSAID – non-steroid anti-inflammatory drug) Hodnocení renální funkce u jaterní cirhózy a biomarkery AKI
Výpočet odhadu glomerulární filtrace s použitím hladiny SCr je u jaterní cirhózy značně limitován. Vlastní syntéza SCr je značně snížena v důsledku poruchy proteosyntézy s následnou redukcí svalové hmoty. Hladina SCr je dále ovlivněna tubulární sekrecí kreatininu, její stanovení může navíc interferovat se zvýšenou hladinou bilirubinu. Hladina SCr může být také významně modifikována retencí tekutin a soli, s následným zvýšeným distribučním objemem vedoucím k dilučnímu efektu. A tak už i malá změna hladiny SCr nepochybně reflektuje větší změnu renální funkce. Často používaná frakční exkrece sodíku v moči není rovněž pro diagnostiku HRS‑AKI relevantní, neboť je zkreslena již zmíněnou retencí tekutin a soli a současným užíváním diuretik (7).
Citlivějším markerem v hodnocení glomerulární filtrace se zdá využití stanovení cystatinu C – neglykosylovaného, nízkomolekulárního proteinu z rodiny inhibitorů cysteinových proteáz, jenž je filtrovaný glomeruly a plně reabsorbovaný tubuly ledvin. Hladina cystatinu C není zkreslena věkem, množstvím svalové hmoty a přítomností hyperbilirubinemie. Je však ovlivněna sníženou hladinou albuminu, zvýšeným počtem bílých krvinek a C‑reaktivního proteinu (CRP). Mnohé studie poukazují na výhody současného stanovování sérového kreatininu a cystatinu C v hodnocení odhadu glomerulární filtrace (8).
Studie z posledních let se soustřeďují na výzkum ostatních močových biomarkerů v diferenciální diagnostice forem AKI u jaterní cirhózy. Zatím nejslibnějším markerem se jeví NGAL (Neutrophil Gelatinase‑associated Lipocalin) – protein lipokalinové rodiny vázaný na želatinázu ve specifických granulech leukocytů. NGAL se zdá přínosný v diagnostice zejména ATN, u které byly zaznamenány výrazně zvýšené hodnoty (9). Mezi další biomarkery AKI patří IL-18 (interleukin-18), KIM-1 (Kidney Injury Molecule -1) a L‑FABP (liver‑type‑fatty‑acid binding protein), jejich rozsáhlejší použití je však stále kontroverzní. Podobně jako NGAL, je IL-18 také mediátorem zánětu, exprimovaným v ledvinných tubulech a makrofázích, uvolňovaný do moče při tubulárním poškození (10). Zavedení stanovování močových biomarkerů do rutinní klinické praxe zabraňují především vysoké náklady se zavedením jednotlivých laboratorních metod.
Patogeneze HRS‑AKI
V poslední době došlo k výrazné změně v pohledu na patogenezi HRS‑AKI, které ještě do nedávné doby bylo považováno za čistou formu funkčního selhání ledvin, vznikající v důsledku komplexu cirkulačních změn při portální hypertenzi (schéma 1). Velká úloha je nyní přisuzována vlivu zánětlivých změn, které významně ovlivňují terapeutické výsledky s běžně používanými vazokonstriktory ve splanchnickém řečišti.
Schéma 1. Patogeneze HRS-AKI (upraveno dle (1) 
Při rozvoji HRS‑AKI se uplatňuje několik patofyziologických mechanismů:
Vazodilatace ve splanchnickém řečišti
V důsledku změn při portální hypertenzi dochází k celému komplexu cirkulačních změn s následnými změnami v systémové hemodynamice, vedoucí v konečné fázi k renální vazokonstrikci. Nadprodukce oxidu dusnatého a dalších vazoaktivních působků vede k vazodilataci ve splanchnickém řečišti a ve většině periferního řečiště. Důsledkem je hyperkinetická cirkulace, která představuje kompenzační mechanismus pro udržení krevního tlaku. Progredující vazodilatace a hyperkinetická cirkulace při jaterní cirhóze však později nedokážou kompenzovat arteriální hypovolemii. V důsledku arteriální hypotenze dochází k aktivaci sympatického nervového systému, systému renin‑angiotenzin‑aldosteron (RAS) a později také adiuretinu (vazopresinu), s následnou retencí sodíku a vody a následně ke vzniku diluční hyponatremie. Krevní tlak se udržuje zejména v důsledku vazokonstrikce v některých orgánech, např. v ledvinách. Při extrémně vystupňované renální vazokonstrikci dochází k poklesu glomerulární filtrace a rozvoji HRS‑AKI. O aktivaci vazopresinu vypovídají zvýšené hladiny kopeptinu – fragmenty prekurzoru vasopresinu, které jsou typicky zvýšené u dekompenzované cirhózy. Zvýšené hladiny kopeptinu korelují s tíží hemodynamických změn u cirhózy a jsou prediktorem rozvoje AKI s horší prognózou (11, 12). Současná terapie HRS‑AKI je založena na ovlivnění cirkulujícího objemu aplikací albuminu a splanchnických vazokonstriktorů. Roli jiných patofyziologických mechanismů nebo podíl tubulárního poškození potvrzuje skutečnost, že pouze 40 % případů HRS‑AKI je reverzibilní (13).
Kardiální dysfunkce
U více než 50 % cirhotiků je popsána abnormální nebo otupělá kardiální odpověď na fyziologický nebo patologický stres, označovaná jako cirhotická kardiomyopatie. Ta společně se sníženým srdečným výdejem přispívá k rozvoji HRS‑AKI. Preskripce neselektivních betablokátorů u pacientů s ascitem může predisponovat k rozvoji HRS‑AKI a tím horší prognóze. Dávka těchto léků by měla být titrována k udržení středního arteriálního tlaku (MAP) a současně k zabránění rozvoje HRS‑AKI (14).
Insuficience nadledvin
Relativní insuficience nadledvin je popisována u 20 % nemocných s dekompenzovanou jaterní cirhózou, s vyšším zastoupením u pokročilých forem cirhózy. Relativní adrenální insuficience může přispívat k cirhotické kardiomyopatii snížením počtu β‑adrenergních receptorů v srdci a ovlivněním účinku katecholaminů na srdeční kontraktilitu a napětí cévní stěny (15).
Úloha zánětu
Systémová zánětlivá odpověď (systemic inflammatory response syndrome – SIRS) představuje další z důležitých aspektů v patogenezi dekompenzace jaterní cirhózy a hraje klíčovou roli v rozvoji orgánové dysfunkce asociované s ACLF (16). SIRS a sepse vedou k redistribuci průtoku krve v ledvinách navozující ischemii a posléze poškození tubulů ve formě ATN.
Další mechanismy
V experimentálních studiích byla prokázána zvýšená exprese Toll‑like receptorů 4 (TLR4) v ledvinách a moči u pacientů s AKI a cirhózou, následující zánětlivý inzult (17). Endotoxiny nebo lipopolysacharidy (LPS), které jsou součástí buněčné stěny gramnegativních bakterií, představují přirozené ligandy pro TLR4. LPS jsou dále silnými prozánětlivými faktory stimulujícími tumor necrosis factor-α (TNF-α). U jaterní cirhózy, vysoké hladiny LPS, např. u spontánní bakteriální peritonitidy či sepse, zvyšují portální tlak a mohou způsobit nekrózu hepatocytů s následným navozením obrazu akutní jaterní dekompenzace (18).
Léčba HRS‑AKI
Základem léčebné strategie u HRS‑AKI je včasná identifikace a eliminace potencionálního spouštěcího faktoru. Z medikace je nutné vysadit diuretika a další léky, které mohou vyvolat či zhoršit arteriální hypotenzi (vazodilatátory, neselektivní betablokátory), je nutné současně dbát na adekvátní hydrataci aplikací parenterální infuzní terapie s albuminem. Pozornost musí být věnována užívání potenciálně nefrotoxické medikace (nesteroidním antiflogistikům, antibiotikům). Při podezření na bakteriální infekci by měla být provedena diagnostická punkce ascitu k vyloučení SBP a ihned zahájena empirická terapie antibiotiky podle zvyklostí pracoviště na základě epidemiologických dat. K prevenci rozvoje HRS‑AKI hraje také důležitou úlohu aplikace albuminu po každé velkoobjemové paracentéze ascitu (punkce více než 5 l ascitu) (19).
Již od AKI stadia 1B, a dále u závažnějších stadiích AKI, při současně splněných kritériích HRS‑AKI, je od počátku základním pilířem léčby ovlivnění alterované cirkulace, s docílením zvýšení nízkého srdečního výdeje a středního arteriálního tlaku (MAP) zvýšením efektivního cirkulujícího objemu aplikací albuminu s kombinaci se systémovým vazokonstriktorem. Vstupně by měla být vysazena diuretická léčba a zahájena volumexpanze s parenterální aplikací albuminu v dávce 1,0 g/kg/den, první 2 dny léčby maximálně v dávce 100 g/den, poté pokračovat v dávce 20–40 g/den (20). Albumin je vysoce účinný u SIRS a sepse, kromě volumexpandujícího efektu je dále popisován antioxidační a endotel stabilizující efekt (21). Z výsledků studií je zřejmé, že efekt parenterální aplikace albuminu v prevenci a léčbě HRS‑AKI koreluje s dávkou, s lepšími výsledky při vyšší kumulativní dávce (22, 23).
Z vazoaktivních látek je v randomizovaných studiích nejlépe dokumentován efekt léčby terlipresinem, a to jak na zlepšení renálních funkcí, tak na snížení mortality. Terlipresin (N‑triglycyl-8-lysin‑vazopresin), syntetický analog vazopresinu s biologickým poločasem 3,5 hod, má afinitu k V1 i V2 receptorům. Stimulace V1 receptorů působí arteriolární vazokonstrikci převážně ve splanchnickém řečišti, aktivací V2 receptorů stimulují transport ve sběrných kanálcích zvýšením počtu aquaporinových (vodních) kanálů. Kromě potlačení aktivity jednotlivých vazokonstrikčních mechanismů (sympatického nervového systému, RAS), dochází zvýšením efektivního cirkulujícího objemu a síňového plnícího tlaku ke zvýšení sekrece atriálního natriuretického peptidu (ANP) a jeho účinkem ke zvýšení natriuézy. Terlipresin se aplikuje v bolusových dávkách 0,5–1,0 mg po 4–6 hod., dávka terlipresinu by měla být titrována postupně k maximální dávce 12 mg/den. Délka podávání by měla trvat do dosažení kompletní remise (dosažení SCr < 1,5 mg/dl), nebo maximálně v celkové délce po dobu 14 dnů při dosažení parciální remise (pokles SCr ≥ 50, s konečnou hladinou SCr ≥ 1,5 mg/dl) či u non‑respondérů. V případě recidivy HRS‑AKI je však možné léčbu terlipresinem opakovat. Terlipresin by měl být s opatrností podáván u pacientů s kardiovaskulárním onemocněním, neboť může navodit celou řadu ischemických komplikací (ischemické srdeční příhody, střevní ischemie, ischemie akrálních částí končetin), závažné arytmie či minerálový rozvrat ve formě těžké hyponatremie. Recentní studie ukázala nižší výskyt nežádoucích účinků a dosažení stejného účinku při aplikaci terlipresinu v kontinuální infuzi (2 mg terlipresinu ředěného v 250 ml roztoku 5% glukózy), navíc s podáním nižší celkové kumulativní dávky (24). Léčebná odpověď je definována snížením SCr o minimálně 25 % oproti výchozí hladině, na které byla léčba terlipresinem zahajována. Prediktory příznivé odpovědi na léčbu terlipresinem je efekt na dosažení zvýšení systémového krevního tlaku a současná přítomnost systémové zánětlivé reakce. Za negativní prognostické faktory v úspěšnosti léčby jsou naopak považovány vysoké vstupní hladiny SCr a bilirubinu.
Alternativu k léčbě terlipresinem představuje léčba noradrenalinem, u kterého byl v randomizovaných studiích prokázán srovnatelný efekt a náklady za léčbu (25). Naopak mnohem menší úspěšnost léčby je dokumentována u léčby midodrinem společně s oktreotidem, jež jsou běžně používané v zemích s nedostupností terlipresinu (26).
Zahájení dialyzační léčby (renal replacement therapy – RRT) u HRS‑AKI v celé řadě studií neprokázalo vliv na ovlivnění prognózy a mortality nemocných. RRT byl měla být zvažována pouze jako přemosťující léčba k transplantaci jater, která představuje jedinou kurativní léčbu HRS‑AKI v pokročilém stadiu jaterní cirhózy. Kombinovaná transplantace jater a ledvin by měla být indikována v případě nutnosti RRT po dobu více než 12 týdnů (27).
Závěr
Hepatorenální syndrom, v současné době řazený mezi formu AKI (HRS‑AKI), zůstává nadále závažnou problematikou u nemocných s pokročilou jaterní cirhózou. Díky přepracování diagnostických kritérií došlo nepochybně k pokroku v časnějším odhalení této komplikace s následným zahájením adekvátní terapie. Časná diagnostika HRS‑AKI a včasné zahájení příslušné terapie je klíčovým problémem v ovlivnění prognózy a následné mortality nemocných s jaterní cirhózou.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Karolína Krátká, Ph.D.,
I. interní klinika 3. LF UK a FN Královské Vinohrady,
Šrobárova 50,
100 34 Praha 10
Cit. zkr:Vnitř Lék 2020; 66(3): e58–e62
Článek přijat redakcí: 14. 11. 2018
Aktualizováno: 20. 4. 2020
Zdroje
1. Angeli P, Ginès P, Wong F, et al. Diagnosis and management of acute kidney injury in patients with cirrhosis: revised consensus recommendations of the International Club of Ascites. J Hepatol 2015; 62 : 986–994.
2. Huelin P, Piano S, Solà E et al. Validation of a staging system for acute kidney injury in patients with cirrhosis and association with acute‑on‑chronic‑liver failure. Clin Gastroenterol Hepatol 2017; 15 : 438–445.
3. Davenport A, Sheikh MF, Lamb E, et al. Acute kidney injury in acute‑on chronic liver failure: where does hepatorenal syndrome fit? Kidney International 2017; 92 : 1058–1070.
4. Solé C, Pole E, Solà E, et al. Hepatorenal syndrome in the era of acute kidney injury. Liver International 2018; 25 : 1–11.
5. Belcher JM, Garcia‑Tsao G, Sanyal AJ, et al. Association of AKI with mortality and compli ‑ cations in hospitalized patients with cirrhosis. Hepatology 2013; 57 : 753–762.
6. Fagundes C, Barreto R, Guevara M, et al. A modified acute kidney injury classification for diagnosis and risk stratification of impairment of kidney function in cirrhosis. J Hepatol 2013; 59 : 474–481.
7. Bucsics T, Krones E. Renal dysfunction in cirrhosis: acute kidney injury and the hepatorenal syndrome. Gastroenterology Report 2017; 5 : 127–137.
8. Krones E, Fickert P, Zitta S, et al. The chronic kidney disease epidemiology colloboration equation combining creatinine and cystatin C accurately assesses renal function in patients with cirrhosis. BMC Nephrol 2015; 16 : 1–10.
9. Barreto R, Elia C, Solà E, et al. Urinary neutrophil gelatinase‑associated lipocalin predicts kidney outcome and death in patients with cirrhosis and bacterial infections. J Hepatol 2014; 61 : 35–42.
10. Belcher JM, Sanyal AJ, Peixoto AJ, et al. Kidney biomarkers and differential diagnosis of patients with cirrhosis and acute kidney injury. Hepatology 2013; 57 : 1–37.
11. Sola E, Kerbert AJ, Verspaget HW, et al. Plasma copeptin as biomarker of disease progression and prognosis in cirrhosis. J Hepatol 2016; 65 : 914–920.
12. Kerbert AJ, Verbeke L, Chiang FW, et al. Copeptin as an Indicator of Hemodynamic Derangement and Prognosis in Liver Cirrhosis. PloS One 2015; 10: e0138264.
13. Adebayo D, Morabito V, Davenport A, et al. Renal dysfunction in cirrhosis is not just a vasomotor nephropathy. Kidney Int 2015; 87 : 509–515.
14. Mandorfer M, Bota S, Schwabl P, et al. Nonselective beta blockers increase risk for hepatorenal syndrome and death in patients with cirrhosis and spontaneous bacterial peritonitis. Gastroenterology 2014; 146 : 1680–1690.
15. Theocharidou E, Krag A, Bendtsen F, et al. Cardiac dysfunction in cirrhosis – does adrenal function play a role? A hypothesis. Liver Int 2012; 32 : 1327–1332.
16. Weichselbaum L, Gustot T. The Organs in Acute‑on‑Chronic Liver Failure. Semin Liver Dis 2016; 36 : 174–180.
17. Shah N, Mohamed PE, Jover‑cobos M et al. Increased renal expression and urinary excretion of TLR4 in acute kidney injury associated with cirrhosis. Liver Int 2013; 33 : 398–409.
18. Gustot T, Durand F, Lebrec D, et al. Severe sepsis in cirrhosis. Hepatology 2009; 50 : 2022–2033.
19. Bernardi M, Caraceni P, Navickis RJ, et al. Albumin infusion in patients undergoing large‑volume paracentesis: a meta‑analysis of randomized trials. Hepatology 2012; 55 : 1172–1181.
20. European Association for the Study of the Liver. EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis. J Hepatol 2018; 69 : 406–460.
21. Bernardi M, Ricci CS, Zaccherini G. Role of human albumin in the management of complications of liver cirrhosis. J Clin Exp Hepatol 2014; 4 : 302–311.
22. Afinogenova Y, Tapper EB. The efficacy and safety profile of albumin administration for patients with cirrhosis at high risk of hepatorenal syndrome is dose dependent. Gastroenterol Rep (Oxf) 2015; 3 : 216–221.
23. Salerno F. Albumin treatment regimen for type 1 hepatorenal syndrome: a dose‑response meta‑analysis. BMC Gastroenterol 2015; 55 : 1–11.
24. Cavallin M, Piano S, Romano A, et al. Terlipressin given by continuous intravenous infusion versus intravenous boluses in the treatment of hepatorenal syndrome: a randomized controlled study. Hepatology 2016; 63 : 983–992.
25. Singh V, Ghosh S, Singh B, et al. Noradrenaline vs. terlipressin in the treatment of hepatorenal syndrome: a randomized study. J Hepatol 2012; 56 : 1293–1298.
26. Cavallin M, Kamath PS, Merli M, et al. Terlipressin plus albumin versus midodrine and octreotide plus albumin in the treatment of hepatorenal syndrome: A randomized trial. Hepatology 2015; 62 : 567–574.
27. European Association for the Study of the Liver. EASL clinical practise guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis. J Hepatol 2010; 53 : 397–417.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2020 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Magnosolv a jeho využití v neurologii
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Arteriální hypertenze a infekce COVID-19: Stručný komentář
- Distanční léčba diabetu: Co mohou pacient, lékař a sestra zvládnout na dálku?
- Vnitřní lékařství v době koronavirové
- Lokální trombolýza v léčbě pacientů s hlubokou žilní trombózou: proč, komu a jak?
- „All‑in‑one“ koncept funkčně vedené revaskularizace myokardu v katetrizační laboratoři
- Prodlužování agresivní antitrombotické léčby po infarktu myokardu: proč, komu a jakou léčbu vybrat?
- Jsou inhibitory protonové pumpy účinným a bezpečným lékem nejen v profylaxi gastrointestinálního krvácení při antitrombotické léčbě?
- Psychické reakce nemocných na negativní informaci typu: „Máte maligní nemocnění“
- Prvé prípady geneticky potvrdenej kongenitálnej hnačky so stratou chloridov na Slovensku
- Euvascor – časná intervence u hypertonika s dyslipidemií, resp. dyslipidemika s hypertenzí (fixní kombinace atorvastatinu a perindoprilu)
- Rivaroxaban ve studii COMPASS
- Vážení a milí čtenáři Vnitřního lékařství,
- Jaké jsou cílové hodnoty krevního tlaku u pacientů s chronickým onemocněním ledvin?
- Čo sa skrýva za autoinflamáciou?
- Postižení srdce při hypereozinofilii
- Význam dechových testů k hodnocení jaterních funkcí u pacientů s chronickým onemocněním ledvin
- Adherence k principům kardiovaskulární prevence u osob s vysokým rizikem
- Stresová kardiomyopatia vyprovokovaná netypickou situáciou
- Hepatorenální syndrom – update 2020
- Proteinurie z pohledu internisty
- Proteinurie z pohledu internisty
- Miroslav Souček, Petr Svačina a kolektiv. Vnitřní lékařství v kostce. Grada; Praha 2019; 462 stran; ISBN 978-80-271-2289-9 (print)
- Profesorka MUDr. Sylvie Opatrná, PhD. – in memoriam (1959–2020)
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Čo sa skrýva za autoinflamáciou?
- Lokální trombolýza v léčbě pacientů s hlubokou žilní trombózou: proč, komu a jak?
- Proteinurie z pohledu internisty
- Hepatorenální syndrom – update 2020
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



