-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Jsou inhibitory protonové pumpy účinným a bezpečným lékem nejen v profylaxi gastrointestinálního krvácení při antitrombotické léčbě?
Are proton pump inhibitors an effective and safe drug not only in the prophylaxis of gastrointestinal bleeding in antithrombotic treatment?
Proton pump inhibitors (PPIs) are popular and widely used “gastroprotectives”. More than 10% of our population is treated. In addition to classical indications such as gastroduodenal peptic disease or gastroesophageal reflux disease, they are indicated for the reduction of hemorrhagic complications in the digestive tract during antithrombotic treatment. The effect of PPIs on reducing upper gastrointestinal bleeding in antithrombotic treatment (rivaroxaban, acetylsalicylic acid or a combination) was called into question by a recently published randomised mega-study – COMPASS pantoprazole. Treatment of PPIs is accompanied by a number of significant drug interactions, in particular a severe reduction in the bioactivation of clopidogrel and a reduction in the absorption of acetylsalicylic acid or dabigatran. As a result, the effect of these antithrombotics is reduced. A number of observational studies – in the indication of PPIs in the treatment of gastroduodenal or gastrooesophageal disease or when used in the treatment of PPIs in antithrombotic treatment – found a greater incidence of major vascular events and an increase in mortality. So are PPIs effective in protecting gastrointestinal bleeding and are they safe?
Keywords:
clopidogrel – antithrombotics – atherothrombotic diseases – proton pump inhibitors – H2 receptor blockers – acetylsalicylic acid – overview
Autoři: Jan Bultas
Působiště autorů: Ústav farmakologie 3. LF UK Praha
Vyšlo v časopise: Vnitř Lék 2020; 66(3): 169-179
Kategorie: Hlavní téma
Souhrn
Inhibitory protonové pumpy (IPP) jsou oblíbenými a široce užívanými „gastroprotektivy“. Více než 10 % naší populace je jimi léčeno. Vedle klasických indikací, jako je vředová choroba či gastroezofageální refluxní choroba, jsou indikovány pro snížení hemoragických komplikací v trávicím traktu při antitrombotické léčbě. Efekt IPP na snížení krvácení do horní části trávicího traktu při antitrombotické léčbě (rivaroxabanem, kyselinou acetylsalicylovou či jejich kombinací) byl zpochybněn recentně publikovanou randomizovanou megastudií COMPASS – pantoprazol. Léčba IPP je provázena řadou významných lékových interakcí, zejména je závažné snížení bioaktivace klopidogrelu a omezení absorpce kyseliny acetylsalicylové či dabigatranu. Výsledkem je snížení efektu těchto antitrombotik. Řada observačních studií – v indikaci IPP v léčbě vředové či refluxní choroby nebo při užití v rámci komedikace IPP při antitrombotické léčbě – nachází větší výskyt velkých vaskulárních příhod a zvýšení mortality. Jsou tedy IPP v protekci krvácení do trávicího traktu účinné a jsou i bezpečné?
Klíčová slova:
antitrombotika – aterotrombotická onemocnění – blokátory receptoru H2 – inhibitory protonové pumpy – klopidogrel – kyselina acetylsalicylová – přehled
Úvod
Co mě přivedlo k položení si otázky, zda jsou inhibitory protonové pumpy účinné a zejména, zda jsou bezpečné? Jako člověk, eufemisticky řečeno „s nadváhou“, trpím po některých jídlech pyrózou při gastroezofageálním refluxu. Účinnou obranou je podání některého z inhibitorů protonové pumpy (IPP). Jako internista, kardiolog a v posledních letech též farmakolog, sleduji účinnost a bezpečnost řady léčiv, o kterých studentům přednáším. Ta, která si indikuji sám, sleduji o to pozorněji.
V posledních letech se objevují observační studie, často i velkého rozsahu, naznačující, že IPP nemusí být tak zcela bezpečné. Řada studií ukazuje nejen zvýšený výskyt kardiovaskulárních příhod, ale i mortality, a to nejen kardiovaskulární. Navíc recentně publikovaná studie COMPASS, její pantoprazolová větev ukazuje, že i gastroprotektivní efekt při protidestičkové a antikoagulační léčbě nemusí být přítomen (1). To vše mě vedlo k položení několika otázek: Jsou inhibitory protonové pumpy účinné v profylaxi krvácení do trávicího traktu? Nemají inhibitory protonové pumpy negativní vliv na výskyt vaskulárních příhod a mortalitu? Jaké mechanismy by mohly zvyšovat riziko kardiovaskulárních příhod a mortality? A poslední logická otázka zní: Nezneužíváme inhibitory protonové pumpy v indikacích, kde jejich efekt není jednoznačně doložen?
Základní farmakologické vlastnosti IPP
Mluvíme‑li o IPP, nelze vynechat základní vlastnosti, pro pochopení mechanismu účinku, lékových interakcí a nežádoucích efektů mají význam.
Vlastnosti farmakodynamické
Nejprve vlastnosti farmakodynamické. Primárním efektem na úrovni parietálních buněk žaludku je inhibice protonové pumpy, čili H+ .K+ ATPázy, transportéru aktivně směňujícím protony za draslíkové kationy. Souhrou s paralelním transportérem (K+ .Cl symportem), pumpujícím kationty kalia a chloridové anionty zpět, vzniká kyselina chlorovodíková. Po stimulaci protonové pumpy klesá pH v žaludku na hodnoty 1–2.
Kyselina solná v žaludku má řadu biologických funkcí. Kyselé pH denaturuje proteiny a usnadňuje jejich degradaci, aktivuje trávicí enzymy (zejména pepsinogen na pepsin), umožňuje absorpci léčiv typu slabých hydrofilních kyselin v neionizovaném stavu (např. acetylsalicylové kyseliny) a v neposlední řadě je důležitou obranou před invazí řady patogenních organismů do střev. Vzestup pH (např. při léčbě IPP) má malý efekt na vlastní trávení, snížení aktivity žaludečních enzymů je dostatečně kompenzováno enzymy v nižších etážích traktu. Naopak ztráta prvé bariéry infekce se uplatňuje, riziko infekčních chorob přestupujících trávicím traktem (např. „cestovatelských průjmů“) je zvýšeno. Stejně tak má význam změna (zpravidla snížení) dostupnosti řady léčiv, minerálů či vitaminů.
Nižší koncentrace protonů v žaludeční šťávě má vliv i na kinetiku žaludku. Vzestup sekrece gastrinu v antrálních G buňkách žaludku (stimulovaný nižší koncentrací protonů) významně zvýší nejen motilitu žaludku, ale i tonus dolního svěrače jícnu, naopak napětí pyloru klesá. Léčebně využíváme tento účinek v léčbě gastroezofageální refluxní choroby (GERD).
Již menší povědomí máme o extragastrické funkci protonové pumpy. Protonová pumpa je též v resorpční kavitě osteoklastu, kyselé prostředí pomáhá rozpouštět hydroxyapatit v kostní matrix. Správná funkce osteoklastů je podmínkou fyziologické přestavby kosti. Klinický význam inhibice pumpy na této úrovni bude diskutován níže.
Podobně je protonová pumpa součástí tubulární části nefronu. Zde ovlivňuje aciditu moči a tím i vylučování celé řady léčiv. Klinický význam změny acidity moče na eliminaci léčiv je sice v řadě prací konstatován, konkrétní data však chybí. Ovlivnění renálních funkcí inhibicí pumpy bude opět probráno níže. Protonová pumpa je i na dalších místech, informace o významu inhibice však chybí. Příkladem je protonová pumpa v lysozomech všech buněk organismu, zejména v buňkách defenzivních systémů kontrolujících mimo jiné onkogenezi. Dlouhodobá blokáda na této úrovni nemusí být bez následků.
Vlastnosti farmakokinetické
Také farmakokinetické vlastnosti IPP jsou zajímavé. Všechny IPP velmi dobře prostupují membránami a rychle se absorbují. V kyselém prostředí se velmi rychle aktivují (vytvářejí sulfonamid) a uvolňují sulfhydrilovou skupinu. Tou se váží přímo na protonovou pumpu, čímž ji ireverzibilně inaktivují. K vlastní aktivaci musí dojít až v sekrečním acinu parietální buňky, kam se dostává IPP z cirkulace, lokální koncentrace IPP v acinu je asi 1000× větší než v plazmě. Tak je dosaženo dostatečné lokální koncentrace léčiva. Aby nedošlo k nežádoucí aktivaci molekuly již v lumen žaludku, jsou IPP podávány v acidorezistentní formě. Limitní hodnota pH pro vytvoření sulfenamidu se mírně liší, nejvyšší (kolem 3,5) je u rabeprazolu, u ostatních je pod pH 3. To znamená, že při léčbě IPP, kdy pH stoupá nad 3 je bioaktivace omezena. Kyselost žaludečních šťáv je tak regulována na stejné úrovni – při poklesu pH se vytvoří více aktivního metabolitu (pH stoupá nad 3), naopak tento vzestup sníží aktivaci mateřské látky (pH klesá). Díky tomuto mechanismu, kdy je účinek regulován v úzkém rozmezí nezávisle na koncentraci, mají IPP velmi široké terapeutické okno.
K tomu, aby došlo k inaktivaci H+ .K+ ATPázy, je nutné, aby byla pumpa v aktivním stavu, což je zejména po jídle. Potřebná koncentrace IPP v plazmě, resp. v acinu je krátká, jen 1–2 hod. K dosažení optimálního efektu je tak nutno podat léčivo 30–60 min před jídlem, požití potravy protonové pumpy aktivuje a umožní jejich ireverzibilní blokádu. Jednorázová aplikace IPP inhibuje asi 60 % funkčních pump. Teprve opakované podání zajistí plný efekt.
V nástupu efektu se IPP liší, nejkratší aktivaci na účinnou molekulu na úrovni acinu má rabeprazol (asi 20 min), nejdelší pantoprazol (asi 2 hod). Při jednorázovém podání při potížích je tak rabeprazol nejvýhodnější. Délka účinku je u všech IPP stejná, pumpy jsou resyntetizovány po více než 24 hod. Při podání ve farmakoekvivalentních dávkách nejsou praktické rozdíly v dosaženém efektu, tj. vzestupu pH. Eliminace IPP je hepatální s přispěním polymorfního izoenzymu CYP 2C19. Tato oxidáza je inhibitory protonové pumpy, zejména omeprazolem, inhibována. Klinický význam této inhibice bude probrán níže.
Nejvýznamnější lékové interakce IPP
Jako u ostatních léčiv se lékové interakce IPP dělí na farmakodynamické (ovlivňující účinek léku) a farmakokinetické (ovlivňující absorpci, aktivaci.inaktivaci a eliminaci léčiva).
Mechanismus lékových interakcí IPP na farmakodynamickém podkladě
Interakce na úrovni ovlivnění farmakodynamiky mají u IPP omezený praktický význam. Z hlediska případného vlivu IPP na poruchy srdečního rytmu by mohlo být významné riziko navození hypomagnezemie a hypokalcemie při inhibici transportního kanálu TRPM6.7 (transient receptor potential). Tento transportér kontroluje absorpci bivalentních kationů magnezia a kalcia na úrovni enterocytu a jejich eliminaci tubulárními epiteliemi ledvin. Inhibitory protonové pumpy, stejně jako diuretika, tento kanál významně inhibují – diuretika na úrovni nefronu, inhibitory protonové pumpy na úrovni enterocytu. Léčba IPP může vést k významné depleci zejména magnezia. Lze si dobře představit, že se tento mechanismus může podílet na vyšším výskytu srdečního selhání, poruch srdečního rytmu a zhoršení prognózy u nemocných léčených IPP. Detailněji bude tento problém probrán níže.
Mechanismus lékových interakcí IPP na farmakokinetickém podkladě
Daleko větší význam mají lékové interakce zvyšující či snižující koncentraci léčiv, tedy interakce na farmakokinetickém podkladě. Mechanismus, kterým IPP ovlivní kinetiku jiných léčiv, je pestrý.
Prvým je působení na absorpci slabých hydrofilních kyselin. Ty se zpravidla vstřebávají prostou difuzí v nedisociovaném stavu. Vzestup pH (snížení acidity) při léčbě IPP pak vede k disociaci molekuly léčiva. Negativní náboj zhoršuje transmembranózní přestup léčiva a snižuje jeho absorpci. Naopak slabé zásady, např. alkaloidy, se lépe vstřebávají v prostředí zásaditém. Vzestup pH naopak jejich absorpci zvyšuje. Tento typ interakce – ovlivnění dostupnosti změnou pH v žaludku a v proximálním duodenu – je specifický pro skupinu léčiv ovlivňujících sekreci kyseliny solné. Buď přímo inhibicí H+ .K+ ATPázy (protonové pumpy), či nepřímo snížením její aktivace (např. inhibitory receptorů H2 či inhibitory gastrinu). Vedle snížení dostupnosti kyseliny acetylsalicylové či dabigatranu, které se budeme věnovat, snižují IPP tímto mechanismem dostupnost celé řady dalších léčiv, např. inhibitorů tyrosinkináz a dalších multikináz, užívaných v onkologii (2).
Druhým mechanismem ovlivňujícím koncentraci léčiva je interakce na úrovni eliminace, konkrétně eliminace tubulární sekrecí. Ta je závislá na pH primární moče, inhibice protonové pumpy kyselost mění a tak zvyšuje či snižuje renální eliminaci léčiva. Na rozdíl od absorpce, je eliminace léčiv užívaných v kardiologii ovlivněna IPP méně významně. Podílí se však na výskytu nežádoucích účinků, zejména nefropatií (včetně renálního selhání) a nefrolitiázy (3). Změny pH na úrovni žaludečních šťáv či moče vlivem IPP nejsou závislé na konkrétním léčivu, jedná se o skupinový efekt (4).
Naproti tomu ovlivnění transformace léčiv na úrovni inhibice izoenzymu CYP 2C19 je u jednotlivých IPP různě významné. Všechny IPP jsou transformovány oxidázou CYP 2C19. Tato oxidáza je polymorfní, podle aktivity rozeznáváme pomalé, střední a rychlé metabolizátory. Změny v expozici IPP se odráží i v klinické účinnosti, např. u rychlých metabolizátorů s nízkou expozicí IPP je doložena menší účinnost v eradikaci Helicobacter pylori. Na úrovni lékových interakcí má význam skutečnost, že IPP jsou významnými inhibitory izoenzymu CYP 2C19. Nejsilnějším je omeprazol, esomeprazol, deslansoprazol a lansoprazol, středně silným pantoprazol a nejslabším rabeprazol (5, 6). Nicméně i u „slabších“ inhibitorů je snížení aktivity CYP 2C19 klinicky významné, konkrétně se tento typ interakce projeví při bioaktivaci klopidogrelu či biodegradaci některých antidepresiv.
Shrneme‑li, pak IPP ovlivňují absorpci, eliminaci a biotransformaci léčiv 3 způsoby – změna pH v žaludku a proximálním duodenu mění disociaci slabých kyselin a bazí a tak ovlivňuje jejich vstřebávání, změna pH moče v tubulárním systému ovlivňuje vylučování a inhibice izoenzymu CYP2C19 zpomaluje metabolismus (jak aktivaci, tak degradaci).
Praktický význam lékových interakcí IPP
Dominantní cílovou skupinou, které indikujeme IPP, jsou beze sporu senioři. Tedy nemocní často polymorbidní a léčení řadou léků. Otázka lékových interakcí je v tomto případě velmi aktuální. Lékové interakce jsou významné zejména u léčiv s úzkým terapeutickým oknem, kdy již mírné snížení koncentrace či zkrácení doby působení vede ke snížení až selhání efektu, naopak vyšší expozice vedou k nežádoucím účinkům až toxickému působení. Toto zadání, tedy úzké terapeutické okno, splňují zejména antitrombotika, snížení expozice vede ke zvýšenému výskytu trombotických komplikací, naopak zvýšení vede ke krvácení. Lékové interakce IPP s antitrombotiky jsou všechny na podkladě farmakokinetiky, omezena je buď jejich absorpce (dabigatran či ASA) nebo je snížena jejich bioaktivace (klopidogrel).
Podobně jako při antikoagulační léčbě jsou IPP často podávány v rámci protidestičkové léčby, zejména při léčbě duální, kombinující ASA s blokátory trombocytárních ADP receptorů (s klopidogrelem, prasugrelem či tikagrelorem). Dle dat z řady databází, např. Oxford Vascular Study, je v Evropě současně léčeno IPP – v rámci komedikace s protidestičkovou léčbou – více než 20 % pacientů, u nemocných užívajících duální protidestičkovou léčbu je to pak polovina (7). Dle starší analýzy DrugAgency, a. s., není v ČR situace odlišná (ústní sdělení). Uvědomíme‑li si, že kyselinu acetylsalicylovou užívá v ČR téměř milion osob a klopidogrel kolem 100 000, je komedikace IPP s protidestičkovou léčbou velmi rozšířena. V případě protidestičkové léčby se jedná řádově o 200 000 tisíc nemocných, u antikoagulancií o několik desítek tisíc pacientů. Tedy číslo blížící se čtvrt milionu nemocných, množství jistě významné, kterým stojí za to se zabývat.
Interakce IPP s antikoagulancii, konkrétně s dabigatranem
Nejprve se podívejme na interakci přímých antikoagulancií s IPP. Není známa léková interakce s xabany, ty je možno s IPP kombinovat volně. Naopak, klinicky významná je léková interakce s dabigatranem. Dabigatran je podáván ve formě soli, dabigatran etexilátu. Jeho absorpce je vázána na kyselé prostředí žaludku a duodena. Současně je omezena eliminačním transportérem glykoproteinem P (P‑gp). Výsledná biologická dostupnost dabigatranu je nízká, pohybuje se mezi 5–8 %. Jak vzestup pH v žaludku, tak aktivace P‑gp dostupnost dabigatranu snižují. V japonské studii léčba IPP vedla ke snížení vrcholové i minimální koncentrace dabigatranu o 1.3, nebyl rozdíl mezi jednotlivými IPP (8). Pro evropskou populaci máme data firemní studie a slovenské studie. Prvá studie dokládá snížení expozice dabigatranu při kombinaci s IPP o 1,4 (9). Ve druhé byly rozdíly výraznější, minimální i vrcholová koncentrace dabigatranu klesla při léčbě IPP o polovinu (10). Všechny rozdíly byly vysoce statisticky signifikantní, klinická relevance poklesu koncentrací téměř na polovinu byla rovněž významná. Nutno zdůraznit velkou interindividuální variabilitu působení léčby IPP. Také SPC Pradaxa konstatuje 30% snížení koncentrace dabigatranu při občasném podávání IPP, nález reflektuje výsledky populační farmakokinetiky provedené ve studii RELY (11). Dá se konstatovat, že kombinace dabigatranu s IPP vede ke snížení koncentrace dabigatranu o 30–50 %. Takového snížení je jistě klinicky významné, data ze studie RELY u nemocných s fibrilací síní, kde byly užity 2 dávky dabigatranu (2× 110 mg a 2× 150 mg), vedl 40% rozdíl v plazmatických koncentracích k 30% rozdílu účinnosti (12). Jinak řečeno, snížení dávky o 36 % vedlo k 41% rozdílu v koncentraci a k 31% vzestupu incidence ischemických iktů.
Interakce IPP s kyselinou acetylsalicylovou
Druhou interakcí IPP v oblasti antitrombotik je ovlivnění absorpce kyseliny acetylsalicylové. Jak bylo řečeno, slabé kyseliny se vstřebávají v nedisociované podobě pasivní difuzí, konkrétně v kyselém prostředí žaludku a duodena. Vzhledem k disociační konstantě 3,5 je ASA dobře vstřebávána pouze při pH pod 3,5. Při léčbě IPP je absorpce nedostatečná, ASA se dostává do střeva, kde je z převážné části deacetylována esterázami (tzv. aspirinové esterázy) a absorbována již jako kyselina salicylová. Ta již nemá acetylovou skupinu a není schopna acetylovat serin v katalytickém místě cyklooxygenázy (13). Podobně tomu je při podání enterosolventní formy ASA (14). Salicylová kyselina je sice biologicky aktivní, potlačuje projevy zánětu, nicméně protidestičkový efekt postrádá. Ve studiích s touto enterosolventní lékovou formou: Japanese Primary Prevention Project (JPPP), Aspirin to Reduce Risk of Initial Vascular Events (ARRIVE), Aspirin in Reducing Events in the Elderly (ASPREE), A Study of Cardiovascular Events in Diabetes (ASCEND) či Aspirin for Asymptomatic Atherosclerosis (AAA), nebyl pozorován pokles aterotrombotických příhod proti placebu. Ukazuje se, že ověřovat efekt komedikace IPP s enterosolventní formou ASA nemá praktický význam, protidestičkový efekt je dubiózní.
Jediná data, dokládající snížení protidestičkového efektu ASA při kombinaci s IPP, máme z Dánského národního registru nemocných po infarktu myokardu (15). Tato práce byla první, která vzbudila pochybnosti o vhodnosti komedikace IPP s ASA. Do retrospektivní analýzy mortality a morbidity bylo zařazeno téměř 20 000 nemocných po 1. infarktu myokardu, kteří nebyli léčeni duální protidestičkovou léčbou. Acetylsalicylovou kyselinu reprezentovala klasická rychle rozpustná forma v dávce 75 mg. Ve skupině léčené ASA v kombinaci s IPP se objevilo 23 % příhod typu MACE (úmrtí z kardiovaskulárních příčin, infarkt myokardu či iktus), ve skupině neléčené IPP se těchto komplikací objevilo 15 %. Při analýze rizika Coxovým modelem byl doložen vzestup kardiovaskulárního rizika o 46 % (HR = 1,46; CI 1,33–1,61, p < 0,001), absolutní riziko vzrostlo o významně o 7,7 % (Graf 1). Vzhledem k tomu, že příhod bylo téměř 3 500, je analýza dostatečně robustní. Nemocní, kteří byli léčeni inhibitory H2 receptorů (kdy pH v žaludku nestoupá nad 3,5), neměli prognózu negativně ovlivněnu. Na základě této studie nelze jednoznačně říci, že komedikace IPP s ASA je nebezpečná, pochybnosti však jsou opodstatněné. A v kontextu dalších studií, které budou prezentovány, je důležitým kamínkem celé mozaiky.
Graf 1. Výskyt velkých vaskulárních příhod (typu MACE) u nemocných po infarktu myokardu léčených ASA (nikoli klopidogrelem) při komedikaci IPP (analýza dat Dánského národního registru). Je patrný významný vzestup incidence. Podle (15) 
Interakce IPP s klopidogrelem
Jak bylo řečeno, interakce IPP s klopidogrelem má jiný mechanismus, je inhibována aktivace proléčiva na aktivní metabolit. V tomto ději má klíčovou úlohu oxidáza CYP 2C19, kterou IPP v různé míře tlumí. Je‑li počáteční přeměna mateřské látky na 2-oxoklopidogrel příliš pomalá, je klopidogrel téměř všechen inaktivován hydrolýzou. Vázne‑li konverze na aktivní metabolit, snižuje se protidestičkový efekt. Na výslednou koncentraci aktivního metabolitu má vliv nejen inhibice CYP 2C19, ale též farmakogenetické vlivy na úrovni absorpce klopidogrelu (aktivita transportéru P‑gp), aktivita hydrolázy CES-1 či aktivita polymorfního enzymu CYP 2C19. Proto je obtížné sledovat izolovaně vliv pouze IPP.
Klinický význam inhibice izoenzymu CYP 2C19 komedikací IPP s klopidogrelem je diskutován téměř 20 let. Problémem je, že nejsou validní kontrolované prospektivní studie. Jediná studie COGENT s větším počtem probandů sice doložila snížení krvácení z horní části traktu bez vzestupu výskytu velkých vaskulárních příhod, ale léková forma vyvinutá firmou Cogent umožnila asymetrické uvolnění IPP a klopidogrelu (16). Aktivace proléčiva tak byla inhibována méně. Tato skutečnost se pravděpodobně uplatnila na zachování efektu klopidogrelu, bohužel tato léková forma není dostupná. Navíc nemocní byli současně léčeni ASA v problematické enterosolventní formě. Ostatní kontrolované studie byly nevýznamné pro malý počet probandů, počet velkých vaskulárních příhod ve všech dohromady nedosáhl ani 50.
Zbývají tedy studie retrospektivní a post‑hoc analýzy. V roce 2018 vyšla velká metaanalýza 27 studií (více než 150 000 probandů) sledující výskyt velkých vaskulárních příhod typu MACE, kardiovaskulární mortalitu a samostatně výskyt infarktu myokardu při léčbě klopidogrelem s či bez komedikace IPP (17). Při zařazení všech prospektivních i observačních studií stouplo riziko MACE při léčbě IPP o více než pětinu (HR = 1,22; CI 1,06–1,396, p = 0,004). Riziko kardiovaskulární mortality se zvýšilo rovněž o pětinu, výsledek však nedosáhl signifikance (RR = 1,21; CI 0,97-1,50, p = 0,09). Riziko infarktu myokardu stouplo o více než 40 % (HR = 1,43; CI 1,24–1,66, p < 0,001). Při samostatném hodnocení randomizovaných studií (včetně post‑hoc analýz studií, v nichž byly IPP užívány jen nepravidelně) signifikance vymizela, nicméně např. u kardiovaskulární mortality trend přetrvával a vzestup o 2,3 (HR = 1,67; CI 0,40–7,0) byl varující. Problémem této i dalších analýz je absence rozdělení efektu podle užitého inhibitoru protonové pumpy.
Třetí generace blokátorů ADP receptorů – prasugrel, tikagrelor či kangrelor již nevyžadují bioaktivaci problematickou oxidázou CYP 2C19 a lékové interakce s IPP nejsou známy.
Interakce IPP s duální protidestičkovou léčbou (ASA, klopidogrel)
Komedikace duální protidestičkové léčby s IPP je velmi častá, užívá ji kolem 1,2 pacientů léčených ASA s klopidogrelem. Lze předpokládat, že zde by interakce měla mít aditivní efekt, uplatní se nižší dostupnost ASA a omezená bioaktivace klopidogrelu. Jaká tedy jsou klinická data?
I pro tento typ protidestičkové léčby máme málo dat z kontrolovaných studií. Studie COGENT sice byla provedena při bazální medikaci enterosolventní ASA, ale právě užití této dubiózní lékové formy ji činí pro daný účel špatně použitelnou. Zbývá tedy opět relativně čerstvá metaanalýza 35 studií (převážně observačních) sledujících efekt přidání IPP k duální protidestičkové léčbě (18). I zde studie randomizované, kde rozhodující většinu dat poskytla studie COGENT, neukázaly vliv IPP na zvýšení výskytu vaskulárních příhod. Naopak analýza observačních studií (s více než 250 000 pro ‑ bandů) našla významný nárůst rizika velkých vaskulárních příhod typu MACE o 1.3 již po roce komedikace IPP (HR 1,35; CI 1,18–1,54). Stejný byl nárůst výskytu infarktu myokardu (HR 1,33; CI 1,15–1,55), iktu téměř o 50 % (HR 1,49; CI 1,2–1,84) či trombóz ve stentu o třetinu (HR 1,34; CI 1,16–1,55). Celková mortalita stoupla po 6 letech léčby o třetinu (HR 1,32; CI 1,00–1,73). Při analýze efektu samotného omeprazolu (jen u malého počtu studií) nebyl pozorován rozdíl proti ostatním IPP.
Podobná, zcela recentní metaanalýza, zařadila do výběru, vedle kombinace klopidogrel.ASA, též studie s kombinací tikagrelor.ASA či prasugrel.ASA (19). Opět byl analyzován výskyt příhod s či bez komedikace IPP. Data ze 4 studií randomizovaných (opět většinu dat reprezentovala studie COGENT) byla postavena na analýze několika tisících pacient.roků, kdežto data z 35 observačních studií byla získána na základě stovek tisíc pacient/roků. Výsledky jsou pro přehlednost prezentovány v grafu zvlášť pro studie randomizované a zvláště pro observační (Grafy 2a, 2b).
Graf 2. a. Ovlivnění účinnosti, tj. snížení výskytu krvácení do trávicího traktu, a ovlivnění bezpečnosti, tj. mortality a vaskulárních příhod, při komedikaci IPP k duální protidestičkové léčbě (ASA.klopidogrel) ve 4 randomizovaných studiích. Data převážně reprezentují výsledky studie COGENT. Není patrný dopad na vaskulární příhody, vzestup celkové mortality nebyl statisticky významný. Pokles gastrointestinálního krvácení byl významný jak klinicky, tak statisticky. Podle (18) 
Graf 2b. Ovlivnění účinnosti, tj. snížení výskytu krvácení do trávicího traktu, a ovlivnění bezpečnosti, tj. mortality a vaskulárních příhod, při komedikaci IPP k duální protidestičkové léčbě (ASA.klopidogrel) ve 35 observačních studiích. Je patrný vzestup celkové i vaskulární mortality, stejně jako zvýšení vaskulárních příhod. Pokles gastrointestinálního krvácení nebyl statisticky významný. Podle (18) 
Shrneme‑li data o lékových interakcích IPP s protidestičkovou léčbou, trvá naléhavé podezření na významné snížení efektu ASA (v účinné rychle rozpustné formě) i významné snížení účinku klopidogrelu. Výsledkem je snížení efektu jak jednotlivých komponent (ASA i klopidogrelu), tak duální protidestičkové léčby. Snahou snížit výskyt krvácení do trávicího traktu tak pravděpodobně ztrácíme i terapeutický efekt, minimálně jeho část. Vlastní snížení rizika krvácení do horní části trávicího traktu se zdá být zcela logické, nicméně bylo přítomno jen v části retrospektivních studií. Kontrolovaná randomizovaná megastudie COMPASS – pantoprazol však prakticky významný efekt na pokles hemoragických příhod neprokázala. Nejasné jen zůstává, zda se jedná o následek skutečné „gastroprotekce“ inhibitorů protonové pumpy či zda převažuje snížení protidestičkového účinku. Vlastnímu ochrannému účinku IPP se věnuje následující část.
Klinický význam IPP na úrovni gastroprotekce
Inhibitory protonové pumpy snižují sekreci kyseliny solné v koncovém článku, tedy na všechny podněty (stimulaci gastrinem, histaminem i cholinergní stimulací). Jedná se o nejúčinnější léčbu, jsou schopny udržet pH v žaludku nad 4 téměř po dobu 24 hod, jak postprandiálně, tak noční sekreci. Na rozdíl od blokátorů H2 receptorů se neobjevuje tachyfylaxe, není nutná eskalace dávky. Tyto vlastnosti vedou k jednoznačné preferenci této skupiny v léčbě a v profylaxi řady afekcí horní části trávicího traktu (léčba peptických vředů, eradikace Helicobacter pylori, Zollinger‑Ellisonův syndrom, léčba a profylaxe erozivní i neerozivní ezofagitidy včetně refluxní choroby či profylaxe peptických vředů při antiflogistické léčbě). O těchto indikaci není pochyb, inhibitory protonové pumpy jsou stále nejúčinnější léčbou v porovnání s ostatními gastroprotektivy (20). Dnes si již léčbu bez IPP nedovedeme představit a její význam není zpochybňován. Účinnost a bezpečnost nové generace supresorů žaludeční acidity, blokujících protonovou pumpu reverzibilně, tzv. prazanů (např. vonoprazan), je prověřována.
Efekt IPP v profylaxi krvácení do trávicího traktu a gastroduodenálních příhod při antitrombotické léčbě
Situace v indikaci rutinního podávání IPP při antitrombotické léčbě je méně přehledná, řada prací efekt zpochybňuje, jiné zdůrazňují vyšší kardiovaskulární riziko. Navzdory tomu čtvrtina až polovina nemocných léčených antitrombotiky, zejména při užití duální léčby je dlouhodobě „kryta“ IPP. Význam této komedikace, kdy jedno léčivo je podáváno pro snížení nežádoucích účinků primárního léku, však je zpochybněn recentně zveřejněnou studií COMPASS, konkrétně její pantoprazolovou větví.
Studie COMPASS měla 2 větve, v prvé byl porovnáván efekt rivaroxabanu, kombinace rivaroxabanu s kyselinou acetylovou (100 mg v ente ‑ rosolventních tabletách – ecASA) a samotné ecASA v indikaci profylaxe vaskulárních příhod u nemocných s ICHS či ICHDK. Druhá větev prověřovala, zda přidání IPP – pantoprazolu (1× 40mg) – sníží výskyt gastrointestinálních příhod, zejména krvácení z horní části trávicího traktu (1). Také tato větev měla charakter dvojitě zaslepené, randomizované studie. Do pantoprazolové větve bylo zařazeno 17600 nemocných o průměrném věku 68 let, 22 % tvořily ženy, 90 % bylo zařazeno na podkladě ICHS, 27 % mělo ICHDK. Primární ukazatel efektu byl kombinovaný – čas do prvé gastrointestinální příhody. Velkým počtem – 53000 pacient.roků – se jednalo o zdaleka největší randomizovanou studii v této indikaci.
Během 3–4 let trvání studie nebyl nalezen rozdíl ve výskytu gastrointestinálních příhod ve větvi pantroprazolové a placebové (HR 0,88; CI 0,67–1,15). Nelišil se výskyt všech GI krvácení (roční výskyt 0,8 % vs. 0,9 %), krvácení nejasného původu (0,5 % vs. 0,4 %), okultního krvácení (0,1 % vs. 0,1 %) či výskyt symptomatického gastroduodenálního vředu (0,03 vs. 0,06). Nelišil se výskyt GI obstrukcí či perforací (0,2 % vs. 0,2 %). Jediným významným rozdílem byl nižší výskyt krvácení z endoskopicky ověřené gastroduodenální léze (0,2 % vs. 0,4 %). Celkový počet gastrointestinálních příhod byl 1,16 % ve větvi pantoprazolové a 1,32 % ve větvi placebové, rozdíl nebyl významný ani statisticky, ani klinicky. Výskyt primárního ukazatele efektu i jednotlivých komponent je podán v Grafech 3 a 4.
Graf 3. Křivky kumulativní incidence primárního ukazatele efektu (gastrointestinálních příhod) v pantoprazolové a placebové větvi studie COMPASSPANTOPRAZOL. Je patrná stejná incidence příhod v obou větvích. Podle (1) 
Graf 4. Výskyt jednotlivých komponent primárního ukazatele efektu v pantoprazolové a placebové větvi studie COMPASS-PANTOPRAZOL. Jediným významným rozdílem byla incidence gastroduodenálního krvácení ověřená endoskopicky (snížení na polovinu, resp. o 0,2 % za 3–4 roky léčby), celkový výskyt krvácení do trávicího traktu se však nelišil. Podle (1) 
Vzhledem k tomu, že studie byla v prvé řadě koncipována ke sledování výskytu vaskulárních příhod a mortality, je důležitý též údaj o incidenci vaskulárních příhod. V pantoprazolové větvi se vaskulární příhody a celková mortalita objevily ve 12,2 %, v placebové v 11,8 %, rozdíl nebyl významný celkově ani na úrovni komponent. V rámci bezpečnostních hledisek byl sledován též výskyt jiných GI příhod, dalších chorob či infekcí ve větvi pantoprazolové a placebové. Pouze enterálních infekcí bylo v pantoprazolové větvi o třetinu více (HR 1,33; 1,01–1, 75, p < 0,04).
Shrneme‑li, pak v jediné randomizované kontrolované megastudii komedikace IPP při antitrombotické léčbě rivaroxabanem, resp. při léčbě enterosolventní formou kyseliny acetylsalicylové či při jejich kombinaci – podávaných v rámci sekundární prevence aterotrombotických příhod – nesnížila výskyt hemoragických příhod v trávicím traktu. Jediným příznivým efektem byl pokles gastroduodenálního krvácení ověřeného endoskopicky na polovinu, absolutní rozdíl 0,2 % ročně však nebyl impresivní, počet léčených k zabránění jednoho krvácení NNT byl 982. Výsledky však nelze generalizovat, platí pro užití nižší dávky rivaroxabanu – 10 mg denně. Nález je specifický pro rivaroxaban v dávce 2× 5 mg. Nelze jej přenášet ani na jiná antikoagulancia. Důvodem je významně vyšší (prakticky dvojnásobná) incidence krvácení do trávicího traktu při léčbě rivaroxabanem proti např. apixabanu, pozorovaná v klinických studiích 3. fáze hodnocení i v analýzách registrů. Výsledky nelze přenášet ani na klasickou rychle rozpustnou formu ASA. Užití enterosolventní formy, která se špatně absorbuje a jejíž efekt byl v řadě studií zpochybněn, nedovoluje zevšeobecnit závěry. Chybí‑li protidestičkový efekt, nelze očekávat ani příznivé působení IPP.
Vedle této zaslepené, randomizované studie máme k dispozici řadu retrospektivních studií, zpravidla analýzy databází. Velká řada z nich je zatížena chybou nestejné charakteristiky populace srovnávaných strategiích. Validita těchto retrospektivních studií je sice nižší, nicméně odráží situaci v klinické praxi a svou vypovídající hodnotu určitě má.
Co nám říkají o efektu IPP v profylaxi krvácení studie retrospektivní, observační? V loňském roce byla publikována skutečně velká retrospektivní analýza databáze Medicare (21). Autoři v ní analyzovali efekt komedikace IPP s apixabanem, dabigatranem, rivaroxabanem a warfarinem v úctyhodné kohortě 1,6 mil. nemocných léčených antikoagulancii (část s komedikací IPP, část bez).
Nejprve uveďme výskyt krvácení bez komedikace IPP: v celé skupině antikoagulancií byla incidence hospitalizací pro krvácení z horní části trávicího traktu po adjustaci 115 na 10 000 pacient.roků bez souběžné léčby IPP. Léčba rivaroxabanem byla zatížena vyšší incidencí (144 na 10 000 pacient.roků), naopak nižší výskyt byl při léčbě apixabanem (73 na 10 000 pacient.roků), rozdíl rizik (rivaroxaban vs. apixaban) byl téměř dvojnásobný (HR 1,97; CI 1,73–2,25). Léčba dabigatranem vedla k 120 hospitalizacím na 10 000 pacient.roků a léčba warfarinem k 113 hospitalizacím na 10 000 pacient.roků. Výsledky výskytu krvácení z horní části traktu bez IPP potvrzují nálezy z registračních studií, tedy nejvyšší riziko při léčbě rivaroxabanem a nejnižší při léčbě apixabanem.
Daleko zajímavější je srovnání hospitalizací pro krvácení z horní části trávicího traktu bez a s podáváním IPP při léčbě antikoagulanciem. Komedikace antikoagulancia s IPP vedla v této retrospektivní studii k významnému snížení hospitalizací u všech antikoagulancií (Graf 5). V absolutních číslech poklesl výskyt hospitalizací o 39 příhod na každých 10 000 pacient.roků. V relativních číslech klesla nutnost hospitalizací pro krvácení o čtvrtinu až polovinu. Konkrétně v celé skupině klesla incidence o 34 % (RR 0,66; CI 0,62-0,69), při léčbě apixabanem o 34 % (RR 0,66; CI 0,52-0,85), při léčbě rivaroxabanem o 25 % (RR 0,75; CI 0,68–0,84), dabigatranem o 51 % (RR 0,49; CI 0,41–0,59) a warfarinem o 35 % (RR 0,65; CI 0,62–0,69). Data jsou významná nejen statisticky, ale i klinicky. Největší pokles byl pozorován při léčbě dabigatranem, byl dvojnásobný proti např. rivaroxabanu. To pravděpodobně reflektuje skutečnost, že dabigatran se lépe absorbuje v kyselém prostředí, takže vzestup pH při léčbě IPP snížil dostupnost a vedl současně k nižší expozici dabigatranu.
Graf 5. Pokles hospitalizací pro krvácení z horní části trávicího traktu při komedikaci IPP s jednotlivými perorálními antikoagulancii v databázi MEDICARE. Analýza dat od 1,6 milionu nemocných léčených jednotlivými antikoagulancii. Incidence hospitalizací vyjádřena počtem příhod na 10 000 pacient.roků. Podle (21) 
Dilema, zda komedikace IPP s antikoagulancii snižuje výskyt krvácení z horní části trávicího traktu, nelze jednoznačně rozhodnout. Prioritu většinou mají studie randomizované, prospektivní nad studiemi kohortovými, observačními. My jsme však v situaci, kdy v pantoprazolové větvi studie COMPASS nebyla „klasická“ intervenovaná populace (jednalo se o obecné pacienty s aterotrombotickým postižením, a nikoli prevenci krvácení u osob s vyšším hemoragickým rizikem), nebyla užita standardní dávka rivaroxabanu, tj. 20 mg denně, ale dávka poloviční, a v případě protidestičkového léku nebyla zvolena ani účinná léková forma ASA. Tato omezení nám nedovoluje vynést závěr, že IPP nemají gastroprotektiví efekt při komedikaci s antitrombotiky.
Sám jsem přesvědčen, že protektivní efekt IPP přítomen je, nicméně není velký. Musíme léčit více než 250 nemocných, abychom zabránili jedné hospitalizaci pro krvácení z horní části trávicího traktu (počet léčených k zabránění jedné příhodě – NNT je 256 v databázi MEDICARE). Na druhé misce vah jsou pak nežádoucí účinky IPP, např. riziko pneumonií při léčbě IPP téměř vyvažuje přínos IPP v indikaci snížení krvácení při antikoagulační léčbě, zde se počet léčených potřebných k danému nežádoucímu účinku (number need to harm – NNH) pohybuje na zcela srovnatelné hodnotě kolem 300–400 pacient.roků (22). Farmakoekonomický pohled též není povzbuzující. Při současných nákladech na léčbu v ČR se přímé náklady na zabránění jedné hospitalizaci pohybují při užití 40 mg omeprazolu denně kolem půl milionu Kč (23). Navíc však je nutno kalkulovat i s významnými nežádoucími účinky IPP, které budou diskutovány posléze.
Shrneme‑li, pak protektivní efekt IPP podávaných v rámci komedikace při léčbě antikoagulancii – s cílem snížit výskyt gastrointestinálních hemoragických příhod – má oporu jen v datech získaných retrospektivní analýzou registrů. Naopak randomizovaná megastudie efekt IPP v této indikaci nepotvrdila. Jak bylo doloženo, ani z klinického, ani z farmakoekonomického pohledu, není přínos IPP v této indikaci jednoznačný, a pokud je, není velký.
Nežádoucí účinky IPP, které jsou skutečně významné?
Jako každý biologicky aktivní lék, mají i IPP specifické nežádoucí účinky (Tab. 1). Častější, jako je zácpa či průjem, bolest hlavy či exantémy, nejsou závažné. Naopak závažnější, např. riziko pneumonie, akutní intersticiální nefritidy a renálního selhání, demence či myopatií, jsou relativně vzácné. Řada nežádoucích účinků je často asymptomatických, např. hypomagnezemie a hypokalcemie, souvislost s léčbou IPP nepředpokládáme. Jiné, např. „cestovatelské průjmy“, se objevují jen za specifických okolností. Spojení mezi nežádoucím účinkem a léčbou IPP komplikuje i skutečnost, že se nežádoucí efekt objeví až po mnoha letech soustavného užívání. Tak je tomu v případě degenerace kostí s frakturami při zpomalení přestavby na úrovni osteoklastů či u renální insuficience. A v neposlední řadě očekáváme spíše pozitivní efekt IPP a negativní působení bagatelizujeme, tak je tomu třeba při riziku karcinomu žaludku (24–29). Tyto důvody nás vedou k tomu, že pokládáme IPP za léky bez významných nežádoucích účinků a nerozpakujeme se je předepsat i v případech, kdy dyspeptického pacienta léčíme IPP jaksi „z rozpaků“ či v případě antitrombotické léčby i při nižším riziku krvácení pod vlivem příkazu „nihil nocere“ předepíšeme „gastroprotektivum“.
Tab. 1. Přehled nežádoucích účinků inhibitorů protonové pumpy 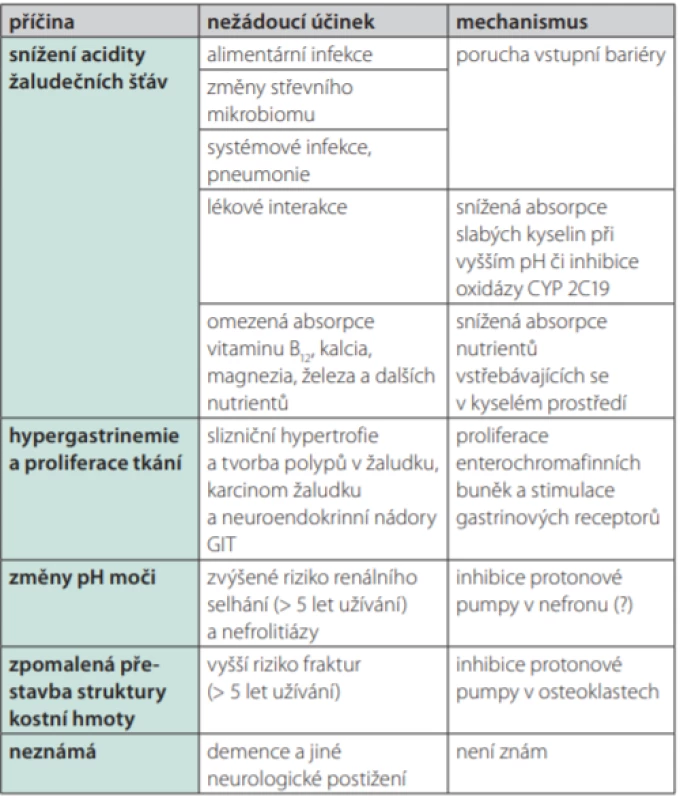
Naštěstí žádný z uvedených nežádoucích účinků není skutečně akutně život ohrožující, resp. u závažných komplikací je jejich frekvence nízká. O významu omezené absorpce bivalentních kationtů – kalcia a magnezia – na případný vznik srdečních arytmií nejsou data. Pouze lékové interakce, zejména interakce s antitrombotiky, jsou skutečně významné a mohou zvyšovat riziko vaskulárních příhod i mortalitu již brzo po zahájení léčby. Oslabení účinku některých antitrombotik (kyseliny acetylsalicylové, klopidogrelu či dabigatranu) sníží protektivní efekt léčby.
Vliv IPP na kardiovaskulární a celkovou mortalitu
Poslední otázkou, kterou je třeba se zabývat, je otázka bezpečnosti IPP. Zejména bezpečnosti dlouhodobé. Vedle řady specifických a ne zjevných nežádoucích účinků, které jsou naštěstí vzácnější, se v posledních letech setkáváme s narůstajícím počtem prací poukazujících na zvýšení kardiovaskulární i celkové mortality při léčbě IPP. Jak dalece je toto obvinění opodstatněné a jaké mohou být příčiny negativního dopadu na prognózu? Jedná se o specifickou vlastnost IPP, či se objevuje i u jiných lékových skupin snižujících žaludeční aciditu?
Předně je nutno předeslat, že nemáme žádnou dlouhodobou a stran počtu zařazených nemocných validní randomizovanou studii, která by sledovala riziko IPP z pohledu vyšší incidence vaskulárních příhod či mortality. Všechna předložená data jsou z analýz registrů, často registrů skutečně „mamutích“. Nad všemi celkem koherentními výsledky nelze jen mávnout rukou a říci, že se jedná o observační studii v případě, že se nám to nehodí. Jindy naopak, když se nám to hodí, bereme retrospektivní studie vážně s tím, že se jedná o „reálnou praxi“.
Data jsou vzata z renomovaných databází, např. z celoamerického registru „US veterans“ či jiné analýzy byly provedeny plátci zdravotní péče. Je tak nepravděpodobné, že by se jednalo o iniciativu „průmyslu“ v rámci připravovaného nástupu reverzibilních blokátorů protonové pumpy, neboli prazanů. Žádná z těchto prací totiž není japonská, tedy ze země, kde jsou prazany již do praxe zavedeny. Nicméně zůstávejme obezřetní, v minulosti jsme podobnou aktivitu PR agentur zaznamenali v situaci, kdy bylo potřeba zpochybnit efekt staršího zavedeného léku s připravovaným nástupem léku nového. Vzpomeňme jen vlnu článků o „aspirinové rezistenci“, která se objevila „náhodou“ těsně před uvedením klopidogrelu či zcela nepřiměřené zdůrazňování myalgií/myopatií při léčbě statiny v době před nástupem inhibitorů PCSK9.
Vliv IPP na výskyt vaskulárních a dalších příhod – porovnání se stavem bez léčby
Jedna z prvých retrospektivních analýz poukazujících na možný negativní dopad léčby IPP na výskyt kardiovaskulárních onemocnění byla studie z roku 2013 (30). Během více než 10 let autoři sledovali v populaci provincie Ontaria výskyt infarktu myokardu a srdečního selhání během prvých týdnů léčby IPP. Kontrolou byl výskyt sledovaných jednotek v období bez podávání IPP u stejné populace. V období léčby IPP byl zaznamenán 80% vzestup výskytu infarktu myokardu (HR 1,8; CI 1,7–1,9), resp. 2595 příhod proti 1439 příhodám. Stejný byl i vzestup výskytu srdečního selhání. Zcela stejný, 80% vzestup příhod byl pozorován během obdobného 12týdenního užívání blokátorů H2 receptorů (2384 příhod proti 1336 příhodám).
Výhodou této observace je kontrolní období, velký počet příhod a nezávislost zadavatelů studie na průmyslu. Naopak slabinou studie je absence údajů o konkomitantní léčbě – kolik probandů bylo léčeno klopidogrelem a kolik ASA. Častá léčba ASA by např. mohla vysvětlit vyšší výskyt koronárních příhod v obou skupinách – IPP i blokátorů receptorů H2 , u obou se může projevit nižší dostupnost ASA a nižší protidestičkový efekt při supresi žaludeční acidity.
Další velkou studií, tentokrát z Národního dánského registru, byla studie u 55 000 nemocných po infarktu myokardu (31). Část ne ‑ mocných byla léčena ASA, část klopidogrelem. Sledován krátkodobý (3 týdny) efekt komedikace IPP na prognózu pacientů léčených klopidogrelem (s či bez ASA) či jinou protidestičkovou strategií, zejména samostatně ASA. V klopidogrelové větvi byl zvýšen výskyt velkých vaskulárních příhod téměř o třetinu (o 29 % při Coxově regresní analýze: HR 1,29; CI 1,17–1,42 a o 35 % při analýze užitím statistického párování PSM: HR 1,35; CI 1,22–1,45). V druhé větvi léčené ASA bylo zvýšení stejné (o 29 % dle regresní analýzy, HR 1,29; CI 1,21–1,37, resp. dle analýzy PSM o 45 %, HR 1,43; CI 1,34–1,53). Rozdíl patrný v obou větvích nezávisel na typu protidestičkové léčby, což je v souladu s tím, co bylo již řečeno o interakcích, tedy se skutečností, že inhibitory protonové pumpy snižují efekt jak kyseliny acetylsalicylové, tak klopidogrelu. Problémem této studie, vedle krátkého trvání, byly rozdíly (v komorbiditách a věku) v populaci s IPP a bez IPP. Nicméně efekt se neměnil ani po adjustaci.
Delší (4 měsíce trvající) a větší studie (250 000 probandů) na dané téma, tentokrát v populaci bez vaskulární anamnézy, tj. s nízkým rizikovým skóre, byla provedena u pojištěnců zdravotní pojišťovny USA (32). Zařazeni byli probandi nově užívající IPP, kontrolní skupina bez IPP odpovídala věkem, rizikem, pohlavím apod. Sledován byl výskyt infarktu myokardu. Po 4 měsících od zahájení léčby IPP vzrostlo riziko infarktu myokardu o téměř 60 % (HR 1,58; CI 1,11–2,25), přitom v prvém týdnu léčby bylo riziko dokonce 4násobné (HR 4,61; CI 1,76–12,1). V absolutních číslech však bylo riziko velmi malé, jeden infarkt myokardu na každých 4 000 léčených v prvých dnech IPP. Vzhledem k odpovídající charakteristice populace v obou větvích a velkému počtu probandů jsou data podporující negativní dopad léčby IPP na výskyt vaskulárních příhod věrohodná. Nicméně přínos léčby v tomto případě, tj. při velmi malém absolutním riziku aterotrombotické příhody, převyšuje riziko.
Pro úplnost je vhodné uvést i relativně malou studii (700 nemocných, 400 z nich bylo léčeno IPP), do které byli zařazeni pacienti s ICHS léčení ASA či klopidogrelem, sledováni 2–4 roky (33). Léčba IPP byla nezávislým faktorem zvyšujícím výskyt velkých vaskulárních příhod, úmrtí či srdečního selhání na dvojnásobek při Coxově analýze (HR 2,2; CI 1,2–4,2, P < 0,007). Stejné zvýšení bylo doloženo při použití metody statistického párování (HR 1,9; CI 1,04–3,5, P < 0,028). Malý počet probandů a rozdílné rizikové skóre v obou kohortách je hlavním nedostatkem této studie. Nicméně tato data ukazují, že v rizikové populaci, po koronární příhodě léčené protidestičkovou léčbou, mohou IPP riziko zvyšovat výrazně.
Poslední retrospektivní analýza, opět u nemocných s ICHS léčených v rámci sekundární prevence kyselinou acetylsalicylovou (neléčených klopidogrelem), došla k závěru, že léčba nezvyšuje výskyt vaskulárních příhod (34). Tato studie byla podobná studii předešlé, podobné byly i nálezy, jen nebylo dosaženo statistické významnosti. Byť článek vyšel v prestižním časopise, lze se závěrem, že léčba IPP je zcela bezpečná, polemizovat. Do studie bylo zařazeny necelé 300 pacientů v každé větvi, hodnocena byla data v průměru za 3 roky komedikace IPP. Výskyt velkých vaskulárních příhod typu MACE (IM, iktus a úmrtí z vaskulárních příčin) byl 21,4 % (294 příhod) ve skupině užívajících IPP a 13,5 % (231 příhod) ve skupině bez léčby. Výsledek, tj. o třetinu vyšší výskyt MACE při léčbě IPP, sice nebyl statisticky významný (HR 1,32; CI 0,8–2,4), ale velmi malý počet probandů nedovoluje závěr, že léčba IPP je stran KV rizika zcela bezpečná. Obdobný výsledek, tj. nesignifikantní nárůst o 1.3, byl nalezen pro celkovou mortalitu (HR 1,33; CI 0,9–1,9), konkrétně 15,9 % (201 úmrtí) proti 9 % (154 úmrtím). Na nesignifikantním rozdílu ve výskytu vaskulárních příhod se jistě podepsala skutečnost, že u 1,4 sledovaných nemocných chyběl údaj o příčině úmrtí, tj. údaj při hodnocení MACE zcela základní!
Shrneme‑li data srovnávající prognózu s léčbou IPP a bez léčby IPP, pak máme 3 velké studie provedené na desítkách až stovkách tisíc probandů a jednu malou studii o stovkách probandů, které dokládají významně vyšší kardiovaskulární riziko při léčbě inhibitory protonové pumpy (Graf 6). Relativní vzestup rizika příhody se pohyboval mezi 30 a 80 %. Absolutní vzestup byl v nízkorizikové populaci malý, NNH (number need to harm, tedy počet léčených, u nichž se objeví příhoda) se pohyboval v tisících.rok. Naopak v populaci s pozitivní kardiovaskulární anamnézou se NNH pohyboval kolem 20.rok, tedy na každých 20 léčených IPP se objevila jedna příhoda ročně. Proti těmto studiím stojí jedna studie, daleko menší (provedená na stovkách nemocných), navíc nemocných s neúplnými daty stran příčin úmrtí, která tvrdí, že je léčba IPP zcela bezpečná. Nicméně i v této studii je patrný trend ke zvýšení výskytu velkých vaskulárních příhod typu MACE.
Graf 6. Porovnání výskytu významných vaskulárních příhod v kohortě léčených a neléčených IPP v jednotlivých studiích. Uvedeny jsou primární ukazatele efektu tak, jak byly v dané studii definovány. Při více typech statistického zpracování uvedena hodnota dle Coxovy multifaktoriální analýzy. S výjimkou jedné studie je patrné zvýšení výskytu velkých vaskulárních příhod ve zbývajících čtyřech. Podle (30–34) 
Vliv IPP na výskyt vaskulárních a dalších příhod – porovnání proti léčbě blokátory histaminových receptorů H2
Velmi důležité jsou studie srovnávající IPP s blokátory histaminových receptorů H2 , tak je minimalizována chyba vzniklá odlišným výskytem vředové choroby, refluxní choroby apod., která se objevuje při porovnávání IPP s placebem, není‑li užita metoda statistického párování.
Prvou studií srovnávající oba typy gastroprotektiv byla studie prospektivní, provedená z důvodů sledování farmakovigilance (35). Zařazeni byli probandi z obecné americké populace (téměř 300000 nemocných bez či s pozitivní kardiovaskulární anamnézou), kteří byli indikováni k léčbě jedním z obou gastroprotektiv pro refluxní chorobu gastroezofageální. Vzájemně byla porovnávána prognóza ve skupině léčených IPP, tak pro skupinu léčenou blokátory H2 receptorů. Ve skupině léčené IPP bylo pětileté riziko kardiovaskulární mortality o 1.5 větší v porovnání s léčbou inhibitory histaminových receptorů (HR 1,19; CI 1,09–1,30). Efekt nebyl dán inhibicí bioaktivace klopidogrelu, po vyloučení pacientů užívajících klopidogrel (jen 6 % probandů) zvýšení kardiovaskulární mortality přetrvávalo.
Otázkou, zda je rozdíl mezi IPP a ostatními gastroprotektivy, konkrétně blokátory žaludečních histaminových receptorů H2 , se zabývala zřejmě nejmohutnější analýza registru pojištěnců USA čítající 4,5 mil. osob (36). Vedle skutečně velkého počtu sledovaných probandů a nezávislosti zadavatelů studie (plátci zdravotní péče) je analýza cenná tím, že srovnává dvě gastroprotektivní strategie – IPP (3,7 mil. probandů, kterým byl předepsán jeden ze 6 IPP) s blokátory H2 receptorů (0,8 mil. probandů, kterým byl předepsán jeden ze 4 inhibitorů H2 R). Vstupní data určující kardiovaskulární riziko byla v obou skupinách srovnatelná. Tato observační studie ukázala významné zvýšení frekvence infarktu myokardu o jednu pětinu (HR 1,21; CI 1,07–1,37) při léčbě IPP pouze v prvých 3 měsících léčby. V dalších měsících, až do doby 3 let, byla incidence infarktu myokardu v obou kohortách stejná. Výskyt dalších vaskulárních příhod nebyl sledován. Tato robustní data sice ukazují jen nevelký rozdíl v incidenci infarktu myokardu mezi oběma skupinami v prvých měsících léčby. Bohužel nejsou údaje o tom, jak pravidelně a jak dlouho byla léčiva užívána. Je pravděpodobné, že zpočátku, tedy v inkriminovaném prvém tříměsíčním období byla adherence k léčbě nejvyšší a s odstupem od iniciální preskripce mohla s ústupem potíží klesat.
Třetí, byť stran počtu sledovaných pacientů menší studie (ve skupině PPI bylo více než 150 000 nových uživatelů, ve skupině blokátorů H2 R více než 50 000 nově užívajících) srovnávala obě skupiny po dobu užívání až 10 let (37). Předností této studie bylo jak dlouhodobé sledování, přesné sledování preskripce, vysoká kvalita registru (US Department of Veterans Affairs) i rozdělení mortality podle příčin. Demografická charakteristika, tj. prevalence rizikových faktorů aterogeneze, indikace léčby (vředová choroba či gastroeofageální reflux), byla ve všech těchto bodech srovnatelná. Stejně jako v předchozí studii byla sledována mortalita při léčbě IPP a blokátory H2 receptorů. Analýza dat byla provedena s aspektem získání informací o mortalitě (celkové i podle příčin) v obou větvích. Rozdíly ve výskytu jsou uvedeny v grafu a statistická analýza v Tab. 2 a v Grafu 7. Je patrna mírná, ale významně vyšší celková mortalita (zvýšení o 17 %) při léčbě IPP, v absolutních číslech 45 úmrtí na 1000 léčených pacientů. Podobně stoupla kardiovaskulární mortalita o 19 %, resp. o 17 úmrtí na 1 000 léčených. Úmrtí na onkologická onemocnění rovněž významně stoupla o 18 % (o 13 úmrtí na 1 000), na infekční a parazitární onemocnění o 66 % (o 4 na 1 000) či na onemocnění genitorurinární o 94 % (o 6 na 1 000). V případě nádorů byl exces na vrub karcinomu žaludku, v případě genitourinárním se jednalo především o úmrtí na renální selhání (37).
Tab. 2. Statistická analýza celkové mortality a mortality podle jednotlivých příčin ve skupině léčené IPP a léčené blokátory receptorů H2 (H2RI) během 10 let sledování více než 200 000 pacientů indikovaných k léčbě pro vředovou chorobu či GERD v databázi Veterans Affairs. Podle (37) 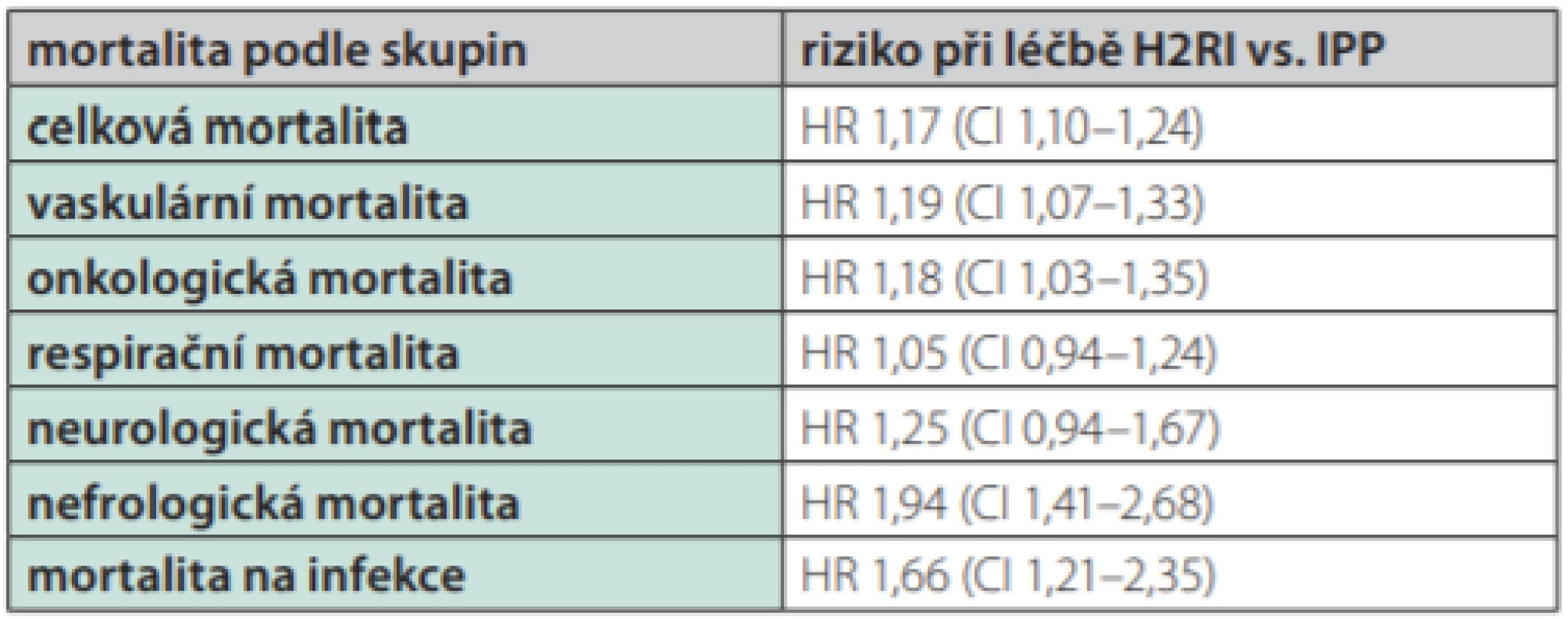
Graf 7. Srovnání celkové mortality a mortality podle jednotlivých příčin ve skupině léčené IPP a léčené blokátory receptorů H2 (H2RI) během 10 let sledování více než 200 000 pacientů indikovaných k léčbě pro vředovou chorobu či GERD v databázi Veterans Affairs. S výjimkou neurologických a respiračních onemocnění je patrná vyšší mortalita při léčbě IPP na vaskulární, onkologická, nefrologická onemocnění či úmrtí na infekční choroby. Podle (37) 
Z analýzy dat předložených 3 studií vyplývá, že léčba IPP je v porovnání s léčbou blokátorů histaminových receptorů H2 zatížena mírným (asi 20%), nicméně významným vzestupem úmrtnosti (Graf 8). Toto zjištění má větší váhu než srovnání IPP proti absenci léčby. Při tomto srovnání je zachována zásada porovnatelného výskytu komorbidit i obdobného kardiovaskulárního rizika v obou větvích. Ve studiích porovnávajících léčbu IPP proti její absenci byla indikace gastroprotektiva zejména z důvodu prevence gastrointestinálního krvácení při antitrombotické léčbě. Naopak, při srovnání IPP s blokátory receptorů H2 bylo indikací postižení horní části trávicího traktu. V prvém případě je pravděpodobná spoluúčast lékových interakcí na úrovni IPP a protidestičkové léčby, při srovnání s blokátory receptorů H2 je významný podíl lékových interakcí méně pravděpodobný. Předložené studie sice nejsou randomizované, nicméně homogenní nález 20% zvýšení vaskulární mortality či infarktu myokardu je podán ve třech nezávislých registrech. Analyzovaná populace stovek tisíc až milionů pacientů je obrovská, výsledky není možno jen tak zavrhnout.
Graf 8. Porovnání vaskulární mortality a infarktu myokardu v kohortě léčených blokátory histaminových receptorů H2 a léčených IPP v jednotlivých studiích (35–37). Uvedeny jsou primární ukazatele efektu v dané studii. Ve všech studiích je patrné zvýšení výskytu vaskulární mortality či infarktu myokardu. Ve studii mající za primární ukazatel efektu infarkt myokardu byla vyšší incidence jen v prvých 3 měsících, dále nebyl rozdíl mezi oběma gastroprotektivy 
Co vyplývá z předložených dat?
Na začátku tohoto článku byly položeny tyto otázky: Jsou inhibitory protonové pumpy účinné v profylaxi krvácení do trávicího traktu? Nemají inhibitory protonové pumpy negativní vliv na výskyt vaskulárních příhod a mortalitu? Jaké mechanismy by mohly zvyšovat riziko kardiovaskulárních příhod a mortality? Nezneužíváme inhibitory protonové pumpy v indikacích, kde jejich efekt není jednoznačně doložen? Jaké jsou odpovědi?
Navzdory negativnímu vyznění randomizované studie COMPASS – pantoprazol, kdy komedikace IPP s antikoagulanciem, s protidestičkovým lékem či s jejich kombinací nedoložila snížení krvácení do trávicího traktu, je protektivní efekt IPP vysoce pravděpodobný. Velké observační studie – jak u nemocných léčených duální protidestičkovou léčbou, tak s perorálními antikoagulancii – efekt, tj. snížení gastrointestinálního krvácení řádově o třetinu, dokládají. Nutno jen zdůraznit relativně malý benefit, kdy se hodnoty NNT k zabránění jedné hemoragické příhodě pohybují ve stovkách léčených. Problémem je i významné riziko lékových interakcí vedoucích k významnému poklesu účinku antitrombotika (konkrétně kyseliny acetylsalicylové, klopidogrelu či dabigatranu). Farmakoekonomický pohled také není příznivý. Navíc je oprávněné podezření na negativní vliv IPP na prognózu léčených, zejména na vyšší výskyt velkých cévních příhod. Odpověď na otázku „Jsou inhibitory protonové pumpy účinné v profylaxi krvácení do trávicího traktu?“ je tedy pozitivní. Nicméně prostor pro skutečně racionální komedikaci IPP s antitrombotiky v indikaci snížení rizika krvácení je velmi omezený. V tomto duchu lze odpovědět i na otázku „Nezneužíváme inhibitory protonové pumpy v indikacích, kde jejich efekt není jednoznačně doložen?“ U nemocných s nízkým rizikem hemoragické příhody přinášejí IPP malý zisk. Negativní působení pak velmi pravděpodobně benefit převýší.
Také odpověď na další dvě otázky: „Nemají inhibitory protonové pumpy negativní vliv na výskyt vaskulárních příhod a mortalitu?“ a „Jaké mechanismy by mohly zvyšovat riziko kardiovaskulárních příhod a mortality?“ nutno řešit najednou. Pravděpodobnost, že IPP – jak při srovnání se stavem bez léčby, tak proti jiným gastroprotektivům – zvyšují riziko vaskulárních příhod, je vysoká. Data z mnoha studií založená na stovkách tisíc pacient.roků jsou sice observačního charakteru, nicméně výsledek je ve všech stejný. V porovnání se stavem bez IPP je riziko velkých vaskulárních příhod zvýšeno nejméně o 1,3, v porovnání s léčbou blokátory receptorů H2 je zvýšeno asi o 1,5. V absolutních číslech je zvýšení malé u nízkorizikové populace, naopak výrazně zvýšené u osob s vysokým rizikem příhody. Hodnota NNH se pohybuje od stovek při vstupním riziku nízkém do desítek při riziku vysokém.
Příčin, proč může dojít ke zvýšení incidence velkých vaskulárních příhod při komedikaci IPP s antitrombotickou léčbou, je více. Nezanedbatelný podíl mají pravděpodobně lékové interakce snižující antitrombotický efekt. Konkrétně se podílí nižší bioaktivace klopidogrelu a nižší absorpce kyseliny acetylsalicylové či dabigatranu při léčbě IPP. Naopak blokátory receptorů H2 neovlivňují bioaktivaci klopidogrelu vůbec a absorpci kyseliny acetylsalicylové a dabigatranu méně. Vzestup pH je totiž menší a krátkodobější než při podávání IPP.
Proč je nárůst vaskulárních příhod při léčbě IPP proti stavu bez IPP větší než při srovnání s blokádou receptorů H2 , není jasné. Jednou z možností je vlastní indikace IPP. Tou je léčba a profylaxe vředové choroby, eradikace helicobakterové infekce a gastroezofageální reflux. Tedy vesměs onemocnění provázené chronickým zánětem (ezofagitida a gastritida). Řada chronických zánětlivých onemocnění je spojena s aktivací aterogeneze a trombogeneze a vyšším výskytem vaskulárních příhod. Vedle periodontiidy, revmatoidní artritidy to platí též pro gastritidu (38). Prevalence ICHS je u nemocných s atrofickou gastritidou dvojnásobná než u osob bez ní. Stejná vazba je mezi koronárním postižením a infekcí Helicobacter pylori (39). Tento vztah může přispět k vysvětlení vyšší incidence vaskulárních příhod při léčbě IPP v porovnání se stavem bez léčby pouze u nemocných indikovaných ke gastroprotekci z důvodů postižení horní části trávicího traktu. Nevysvětlí však rozdíl při indikaci IPP jako komedikace s antitrombotiky. Nevysvětlí ani rozdíl v prognóze mezi IPP a inhibitory receptorů H2 při aplikaci pro vředovou chorobu či gastroezofageální reflux.
Předložená fakta mohou někoho překvapit, někoho přivést k zamyšlení, zda přece jen není na negativním efektu IPP na prognózu kousek pravdy, či v někom vzbudit dojem „šíření poplašné zprávy“. Vždyť všichni inhibitory protonové pumpy důvěrně známe, patří ke skutečným pilířům moderní farmakoterapie a je jimi v zemích našeho socioekonomického regionu léčeno nejméně 10 % populace. Navíc renomované učebnice farmakologie udávají, že IPP jsou dobře tolerovány, maximálně se může objevit bolest hlavy, průjem či exantém (40). Jak by tedy bylo možné, že by takto „zasloužilá“ léková skupina mohla mít i svou „třináctou komnatu“?
Regulace biologických funkcí je složitý a jen částečně objasněný děj. Vzájemné vazby, nám většinou skryté, jsou daleko častější, než zpravidla tušíme. Proto farmakologický zásah nemusí mít jen jednoduchý vztah, např. inhibice protonové pumpy – gastroprotekce. Protonová pumpa je přítomna ve více tkáních, takže se její blokáda projeví globálně. Navíc vlastní molekula léčiva nemusí mít jen jedno účinné místo – farmakofor, ale může působit pozitivně či negativně i na zcela vzdálených místech. Připomeňme např. karcinogenní působení řady léčiv či jako pozitivní příklad uveďme významný antibiotický efekt protidestičkového léčiva – tikagreloru. Podobně komplikované vztahy jsou ve vztahu mezi systémy kontrolujícími absorpci, aktivaci, degradaci a eliminaci cizorodých látek v organismu, tedy i léčiv. Mějme proto pokoru a nemysleme si, že to, co jsme se kdysi naučili či posbírali za své praxe, platí absolutně. Někdy je nutno respektovat i data, která nám nezapadají do zavedeného pořádku. Doufejme, že i tento přehled povede k zamyšlení.
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Jan Bultas, CSc.,
Ústav farmakologie 3. LF UK,
Ruská 87,
100 00 Praha 10
Cit. zkr: Vnitř Lék 2020; 66(3): 169–179
Článek přijat redakcí: 27. 8. 2019
Článek přijat k publikaci: 23. 9. 2019
Zdroje
1. Moayyedi P, Eikelboom JW, Bosch J et al. Pantoprazole to Prevents Gastroduodenal Events in Patients Receiving Rivaroxaban and.or Aspirin in a Randomized, Double‑blind, Placebo‑controlled Trial, Gastroenterology 2019, DOI https:..doi.org.10.1053.j. gastro.2019. 04. 041
2. Hussaarts GAM, Marijn Veerman GD, Jansman FGA et al, Clinically relevant drug interactions with multikinase inhibitors: a review. Ther Adv Med Oncol 2019, 11 : 1–34.
3. Makunts T, Cohen IV, Awdishu L Analysis of postmarketing safety data for proton‑pump inhibitors reveals increased propensity for renal injury, electrolyte abnormalities, and nephrolithiasis, Scientific Reports 2019; 9 : 2282.
4. https: doi.org.10.1038.s41598-019-39335-7
5. Wedemeyer RS, Blume H Pharmacokinetic drug interaction profiles of proton pump inhibitors: an update. Drug Saf 2014; 37 : 201–211.
6. Strand DS, Kim D, Peura DA 25 Years of Proton Pump Inhibitors: A Comprehensive Review. Gut Liver. 2017; 11(1): 27–37.
7. Zvyaga T, Chang SY, Chen C et al. Evaluation of Six Proton Pump Inhibitors As Inhibitors of Various Human Cytochromes P450: Focus on Cytochrome P450 2C19. Drug Metabolism and Disposition 2012; 40 : 1698–1711.
8. Li L, Geraghty OC, Mehta Z et al, Age‑specific risks, severity, time course, and outcome of bleeding on long‑term antiplatelet treatment after vascular events: a population‑based cohort study. Lancet 2017; 390 : 490–499.
9. Kuwayama T, Osanai H, Ajioka M et al. Influence of proton pump inhibitors on blood dabigatran concentrations in Japanese patients with non‑valvular atrial fibrillation. J Arrhythm 2017; 33 : 619–623.
10. Stangier J, Stähle H, Rathgen K et al. Pharmacokinetics and pharmacodynamics of the direct oral thrombin inhibitor dabigatran in healthy elderly subjects. Clin Pharmacokinet 2008; 47 : 47–59.
11. Bolek T, Samoš M, Stančiaková L et al. The Impact of Proton Pump Inhibition on Da ‑ bigatran Levels in Patients With Atrial Fibrillation. Am J Ther 2017; Apr 25. doi: 10.1097. MJT.0000000000000599https: ..www.ema.europa.eu.documents.product‑information. pradaxa‑epar‑product‑information_cs.pdf
12. Connolly SJ, Ezekowitz MD, Yusuf S et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361 : 1139–1151.
13. Bultas J Kyselina acetylsalicylová - stále neotřesitelné postavení i v roce 2018? Remedia 2018; 28 : 127–136.
14. Bultas J, Karetová D Enterosolventní forma kyseliny acetylsalicylové - ano, či ne? Remedia 2017; 27 : 145–151.
15. Charlot M, Grove EL, Hansen PR et al. Proton pump inhibitor use and risk of adverse cardiovascular events in aspirin treated patients with first time myocardial infarction: nationwide propensity score matched study. BMJ 2011; 342: d2690.
16. Bhatt DL, Cryer BL, Contant CF et al. Clopidogrel with or without omeprazole in coronary artery disease. N Engl J Med 2010; 363 : 1909–1917.
17. Demcsak A, Lantos T, Balint ER et al. PPIs Are Not Responsible for Elevating Cardiovascular Risk in Patients on Clopidogrel - A Systematic Review and Meta‑Analysis. Front Physiol 2018; 9 : 1550.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2020 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Arteriální hypertenze a infekce COVID-19: Stručný komentář
- Distanční léčba diabetu: Co mohou pacient, lékař a sestra zvládnout na dálku?
- Vnitřní lékařství v době koronavirové
- Lokální trombolýza v léčbě pacientů s hlubokou žilní trombózou: proč, komu a jak?
- „All‑in‑one“ koncept funkčně vedené revaskularizace myokardu v katetrizační laboratoři
- Prodlužování agresivní antitrombotické léčby po infarktu myokardu: proč, komu a jakou léčbu vybrat?
- Jsou inhibitory protonové pumpy účinným a bezpečným lékem nejen v profylaxi gastrointestinálního krvácení při antitrombotické léčbě?
- Psychické reakce nemocných na negativní informaci typu: „Máte maligní nemocnění“
- Prvé prípady geneticky potvrdenej kongenitálnej hnačky so stratou chloridov na Slovensku
- Euvascor – časná intervence u hypertonika s dyslipidemií, resp. dyslipidemika s hypertenzí (fixní kombinace atorvastatinu a perindoprilu)
- Rivaroxaban ve studii COMPASS
- Vážení a milí čtenáři Vnitřního lékařství,
- Jaké jsou cílové hodnoty krevního tlaku u pacientů s chronickým onemocněním ledvin?
- Čo sa skrýva za autoinflamáciou?
- Postižení srdce při hypereozinofilii
- Význam dechových testů k hodnocení jaterních funkcí u pacientů s chronickým onemocněním ledvin
- Adherence k principům kardiovaskulární prevence u osob s vysokým rizikem
- Stresová kardiomyopatia vyprovokovaná netypickou situáciou
- Hepatorenální syndrom – update 2020
- Proteinurie z pohledu internisty
- Proteinurie z pohledu internisty
- Miroslav Souček, Petr Svačina a kolektiv. Vnitřní lékařství v kostce. Grada; Praha 2019; 462 stran; ISBN 978-80-271-2289-9 (print)
- Profesorka MUDr. Sylvie Opatrná, PhD. – in memoriam (1959–2020)
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Čo sa skrýva za autoinflamáciou?
- Lokální trombolýza v léčbě pacientů s hlubokou žilní trombózou: proč, komu a jak?
- Proteinurie z pohledu internisty
- Hepatorenální syndrom – update 2020
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



