-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Lokální trombolýza v léčbě pacientů s hlubokou žilní trombózou: proč, komu a jak?
Local thrombolysis for deep vein thrombosis: why, for whom and how?
Despite the progress achieved in prevention and therapy in recent decades, venous thromboembolic disorder still presents medical burden. Incidence is estimated about 100-200/100 000 per year. Patients, who underwent deep vein thrombosis are at risk of recurrence and/or development of post-thrombotic syndrome. Both can affect the quality of life. In acute phase of the disease anticoagulation and compression are effective therapy in most cases. But in severe clinical manifestations escalation of the therapy should be considered. Surgical embolectomy is possible, but complication rate is high. Endovascular approaches are viable option. Catheter directed local thrombolysis is effective not only in situation of limb emergency (phlegmasia). We summarize indications, technical approach and evidence for this specific treatment.
Keywords:
endovascular therapy – Deep vein thrombosis – local thrombolysis – thrombembolic disease – anticoagulation – posttrombotic syndrome – cava filter
Autoři: Martin Radvan 1; Jakub Hustý 1; Alena Floriánová 2; Kateřina Hořáková 2; Petr Kala 1
Působiště autorů: Interní kardiologická klinika FN Brno a LF MU, Brno 1; Klinika radiologie a nukleární medicíny FN Brno a LF MU, Brno 2
Vyšlo v časopise: Vnitř Lék 2020; 66(3): 146-151
Kategorie: Hlavní téma
Souhrn
Přes pokroky minulých desetiletí v terapii i prevenci žilního trombembolismu zůstává tato choroba s incidencí 100–200/100000 závažným medicínským problémem. Pacienti po prodělané epizodě hluboké žilní trombózy jsou ohroženi rekurencí nebo rozvojem posttrombotického syndromu se zásadním dopadem na kvalitu života. V akutní fázi je antikoagulace a komprese účinná u většiny pacientů. Nejzávažnější klinické stavy však vyžadují úvahu o eskalaci terapie. Chirurgická embolektomie je technicky možná, ale výsledky nejsou zdaleka ideální. Účinnou terapeutickou alternativu tak představují endovaskulární přístupy. Lokální trombolýza pomocí zavedeného katetru je efektivní nejen v situaci akutního ohrožení končetiny. V přehledném článku představujeme indikace této metody, její technické provedení i souhrn výsledků klinických hodnocení.
Klíčová slova:
hluboká žilní trombóza – lokální trombolýza – trombembolická nemoc – antikoagulace – posttrombotický syndrom – endovaskulární terapie – kavální filtr
Úvod
Trombembolická nemoc zahrnující hlubokou žilní trombózu (HŽT) a plicní embolii (PE) představuje s incidencí 100–200/100 000 za rok závažný zdravotnický a ekonomický problém. Mortalita není zanedbatelná: 10–30 % pacientů s akutním trombembolismem umírá do měsíce od prvních symptomů, přičemž je pouze odhadováno, že až čtvrtina pacientů má jako první symptom plicní embolie náhlou smrt. Třetina pacientů s PE/HŽT prodělá recidivu během následujících 10 let a celá polovina pacientů trpí po prodělané hluboké žilní trombóze posttrombotickým syndromem (PTS) (1).
Spektrum pacientů s HŽT zahrnuje lehké distální formy s postižením nejčastěji bércových žil, kde je možná terapie ambulantní: antikoagulace a komprese. Riziko mortality je nízké, efekt terapie zpravidla velmi dobrý. Opačný konec spektra představují nemocní s těžkými projevy obstrukčního šoku a vysokou mortalitou, vyžadující nejnáročnější léčebné postupy a specializovaný komplexní přístup.
V našem přehledovém článku se zaměřujeme na pacienty s hlubokou žilní trombózou, kteří mají závažnější formu onemocnění a kteří dle současného stavu znalostí a našich zkušeností profitují z endovaskulárního přístupu.
Patofyziologie trombózy a posttrombotického syndromu
Řadu faktorů asociovaných s tromboembolickou chorobou popsal již v roce 1856 legendární Rudolf Virchow (1821–1902) (2). Známá triáda (hyperkoagulace, poškození cévní stěny, stáza krve) se však objevuje na scéně pravděpodobně až v roce 1950 (3). Šíření vzniklého trombu pak může být ascendentní při origu vzniku distálně, descendentní při útlaku žilního kmene proximálně, nebo transfasciální při postižení perforátorů. Příkladem descendentní trombózy dolní končetiny je například obstrukce levé ilické žíly při křížení s tepnou spojená s její chronickou traumatizací (May‑Thurnerův syndrom) (4) nebo malignita v malé pánvi či retroperitoneu s útlakem cévních svazků. V případě končetiny horní může být příčinou například nitrožilní kanyla či zavedená elektroda, postižení uzlin v axile nebo úžinové syndromy. Pacienti s descendentní formou HŽT jsou kandidáty případných endovaskulárních výkonů navazujících na provedení lokální trombolýzy (viz dále).
Dalším důvodem pro intenzifikaci terapie HŽT je prevence následných komplikací, zejména posttrombotického syndromu. Při jeho vzniku se patofyziologicky uplatňuje nejen přetrvávající obstrukce žíly při její inkompletní rekanalizaci, ale i její inkompetence v případě poškození žilních chlopní – ať už samotnou trombózou, nebo v rámci katetrizační či chirurgické terapie.
Diagnostika hluboké žilní trombózy
Základem diagnostiky je pochopitelně anamnéza a pečlivé klinické vyšetření. Bez zobrazovacích metod se ale neobejdeme. Dominantní modalitou při suspekci na hlubokou žilní trombózu je duplexní ultrazvukové zobrazení žil. V rozsahu tříslo – proximální třetina bérce je vysoce senzitivní i specifické (5). Posouzení pánevních žil a vlastní dolní duté žíly je již sonograficky komplikovanější a nezřídka nahrazováno kontrastním CT či MR vyšetřením. Přesné určení rozsahu trombózy je důležité při rozhodování o indikaci kaválního filtru (viz níže), současně může zobrazení poměrů v pánvi i dutině břišní (při IF trombóze) nebo hrudníku (při trombóze v. subclavia) přispět k diagnostice příčiny trombózy.
Cíle endovaskulární léčby
Úkolem endovaskulární terapie je ideálně kompletní zprůchodnění hlubokého žilního systému postiženého orgánu nebo končetiny, zpravidla pomocí lokální farmakologické či mechanické embolektomie (či kombinací obou). Maximální míra rekanalizace je předpokladem regrese klinických potíží, snížení rizika recidivy HŽT, prevencí vzniku žilní hypertenze a posttrombotického syndromu. Chirurgické přístupy nejsou pro dosažení rekanalizace vhodné, neboť při poškození chlopní dochází ke vzniku žilní nedostatečnosti.
Souhrn indikací a kontraindikací lokální trombolýzy uvádíme v tabulce 1.
Tab. 1. Indikace, kontraindikace (jedná se o rámcový přehled, každý pacient vyžaduje individuální posouzení a mezioborovou diskuzi se zvážením rizika a potenciálního přínosu terapie) 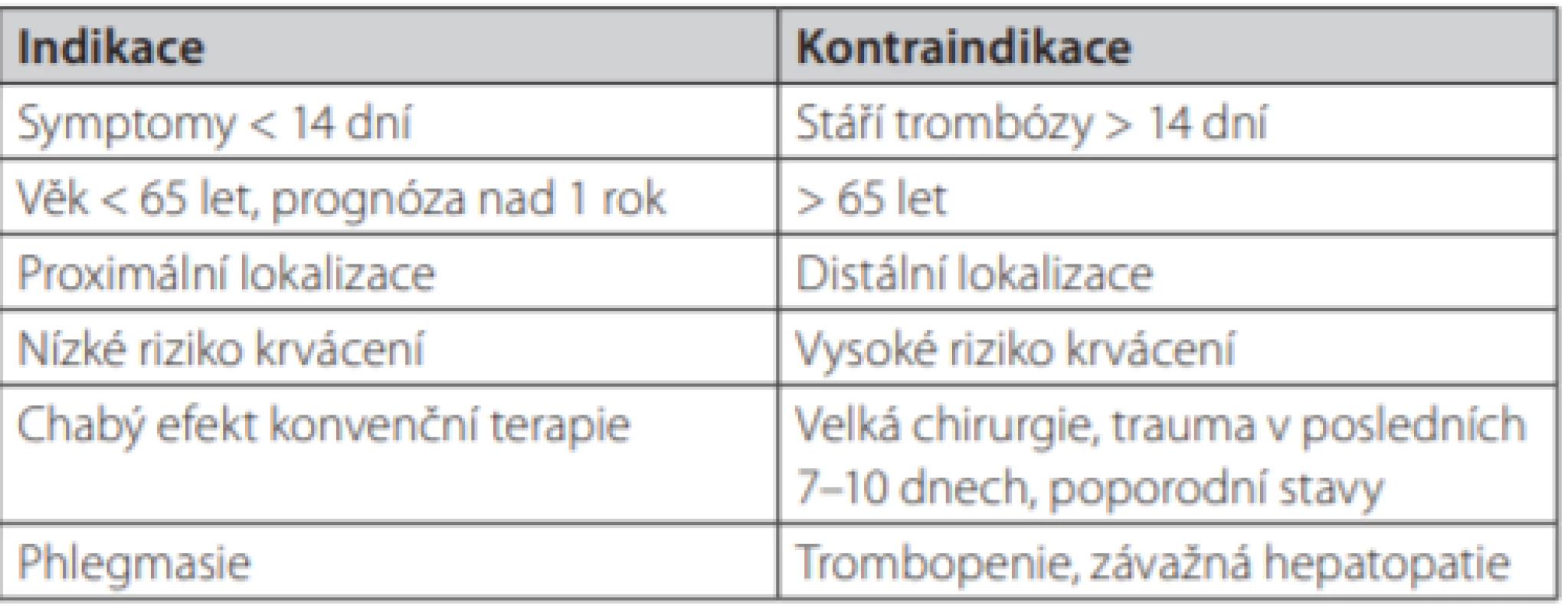
Posttrombotický syndrom
Z pohledu patofyziologie je PTS po atace hluboké žilní trombózy ekvivalentem chronické tromboembolické plicní hypertenze (CTEPH – chronic trombembolic pulmonary hypertension) po prodělané plicní embolii. Incidence CTEPH se dle literatury pohybuje v širokém rozmezí 0,4–9 % (6), zatímco nějakou formou žilní hypertenze či přímo PTS trpí až polovina pacientů po hluboké žilní trombóze. Nejčastěji se jedná o přetrvávající či recidivující otok postižené končetiny, pocity tíže, bolesti, barevné změny charakteru stasis dermatitidy či dokonce rozvoj žilní bércové ulcerace. Změny se co do závažnosti jistě nedají srovnávat s limitacemi provázejícími CTEPH, nicméně dopady na kvalitu života, zejména při rozvoji PTS v mladém věku, nelze rozhodně bagatelizovat. Závažným postižením trpí až 10 % jedinců po prodělané HŽT (1).
Systémová trombolýza
Přestože je systémová trombolýza v terapii vysoce rizikové plicní embolie u pacientů s absencí kontraindikací efektivní, její role v terapii proximální HŽT je zcela marginální a její podání není indikováno (7, 8). U akutní plicní embolie s obstrukcí proximálního plicního řečiště stačí pouze relativně mírná redukce masy trombu, aby se tento posunul více do periferie, přičemž s každým větvením se souhrnná plocha lumen plicní cirkulace zvětšuje a stupeň obstrukce zmírňuje. Nitrožilně podaná látka je navíc v místě plicnicového trombu ve vysoké koncentraci. Zde je role trombolýzy jasná a efekt léčby promptní. V případě hluboké žilní trombózy se však otvírají kolaterály, průnik trombolytika do nitra vlastního trombu je při necíleném podání omezený a systémové účinky provázené rizikem krvácení naopak značné (9). Účinná látka tak musí být podávána přímo do trombu cestou trombolytického katetru.
Vlastní provedení lokální trombolýzy
Po zhodnocení indikace i případných kontraindikací a po konzultaci s pacientem, včetně podepsání informovaného souhlasu, je pod ultrazvukovou kontrolou proveden vpich do trombózou postiženého řečiště a po vodiči je zaveden zpravidla 4-5 F sheath. V případě trombózy ileofemorální používáme přístup přes v. poplitea, při trombóze podklíčkové žíly používáme nejčastěji přístup z v. brachialis. Po ověření polohy katetru v žilním systému je provedena venografie k určení rozsahu trombózy a pod kontrolou skiaskopie je zaveden hydrofilní vodič ve snaze projít trombem proximálně (Obr. 1). Následně je dle délky postižení volena délka trombolytického katetru v rozsahu od 5 do 30 cm (Obr. 2). Poté je zahájena vlastní trombolýza. Otvory po stranách trombolytického katetru je léčivo podáváno přímo do trombu a je tak zajištěna jeho rychlejší disoluce při omezeném systémovém účinku. Pokud je místo v blízkosti zavedení sheatu rovněž postiženo trombózou, je altepláza podávána i do sheatu. Efekt terapie je po 8–12 hodinách skiaskopicky kontrolován, poloha katetru upravována, případně je provedena jeho výměna za vhodnější velikost. Vedle trombolytika (altepláza, 0,01 mg/kg/h s maximální dávkou nepřekračující 1 mg/h) podáváme i kontinuální infuzi nízkomolekulárního heparinu (LMWH, 50–75IU/kg/den dle rizika krvácení), nejčastěji přímo cestou sheatu v postižené žíle. Cílem je během trombolýzy antiXa těsně pod terapeutickou hranicí. Každých 6 hodin jsou prováděny kontroly krevního obrazu, koagulací, včetně antitrombinu III a antiXa. Dávka trombolytika i LMWH je následně upravována. Velmi důležitou je hladina fibrinogenu: při hodnotách pod 1 mg/l je doporučeno trombolýzu přerušit. Dalšími důvody pro přerušení či ukončení trombolýzy je pochopitelně krvácení, závažný pokles v krevním obraze, rozvoj koagulopatie. Při deficitu antitrombinu III je tento substituován. Vzhledem k četnosti odběrů v krátkém časovém období zavádíme zpravidla linku do radiální arterie. Terapie trombolýzou je ve většině případů v trvání do 48 hodin, zřídka má smysl extenze za třetí či čtvrtý den. Ideální je kompletní rekanalizace (Obr. 3).
Obr. 1. Levostranná ileofemorální trombóza 
Obr. 2. Zavedený trombolytický katetr 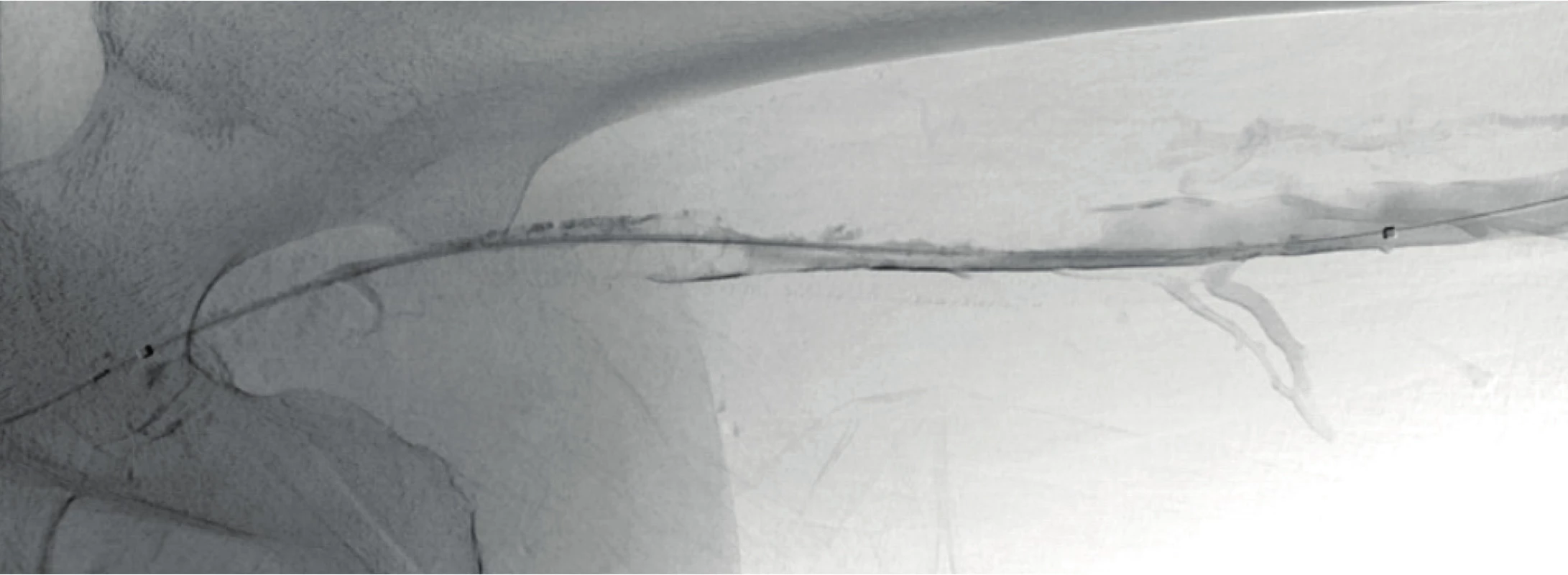
Obr. 3. Rekanalizace ileofemorální trombózy 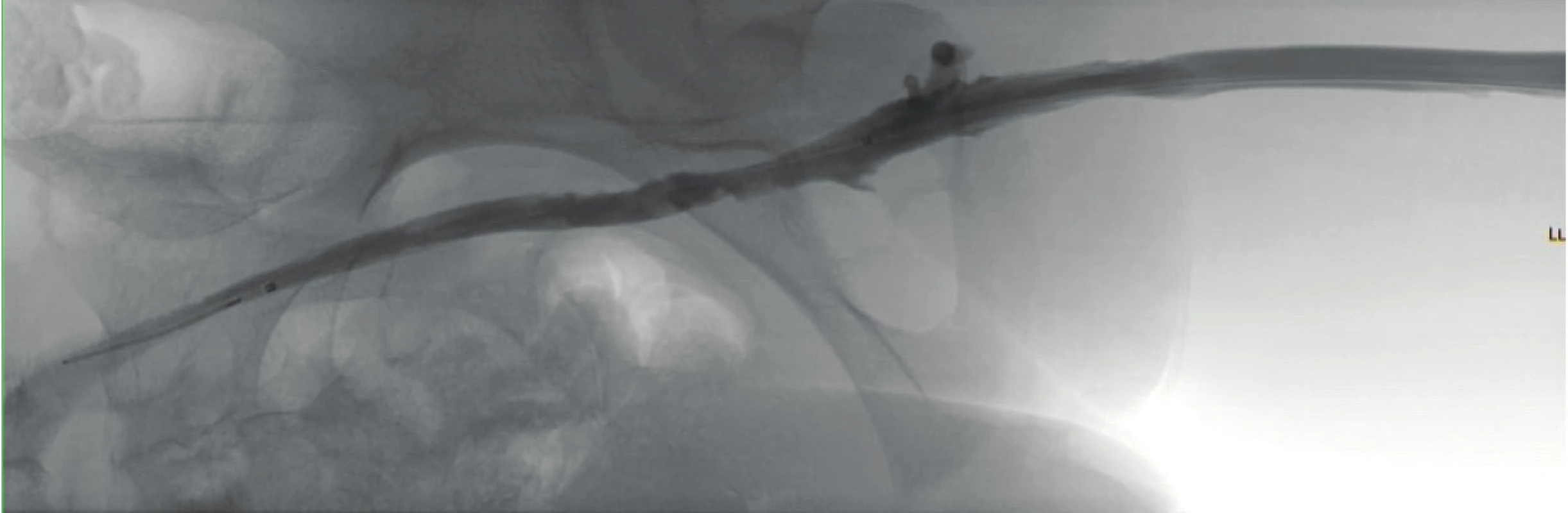
Reziduální trombóza při ukončení lokální trombolýzy je rizikovým faktorem jak recidivy HŽT, tak rozvoje PTS. Pokud i po kompletním odstranění trombu zůstává venograficky (Obr. 4), případně dle intravaskulárního ultrazvuku, patrná proximálně stenóza žilního kmene (nad 50 % nebo významné kolaterály), je zvažována angioplastika. Samotná balónková dilatace je náchylná k recidivám či primárně rezistentní k plastice (10). Nezřídka tedy navazuje zavedení stentu (Obr. 5). Dříve byly používány standardní arteriální stenty, nyní jsou k dispozici speciální dedikované žilní stenty (11) konstrukčně odpovídající nárokům na zavedení do venózního řečiště, včetně speciálně tvarovaných pro implantaci do ileokaválního přechodu.
Obr. 4. Kompresivní May-Thurnerůn syndom po lokální trombolýze pro recidivu IF trombózy 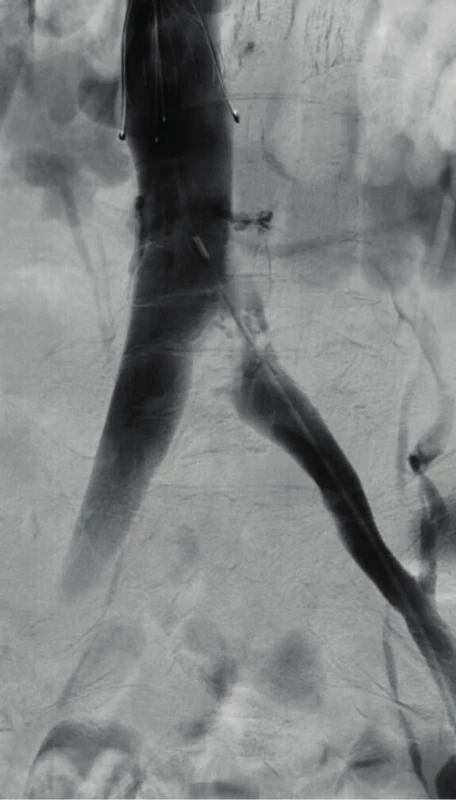
Obr. 5. Stav po implantaci stentu 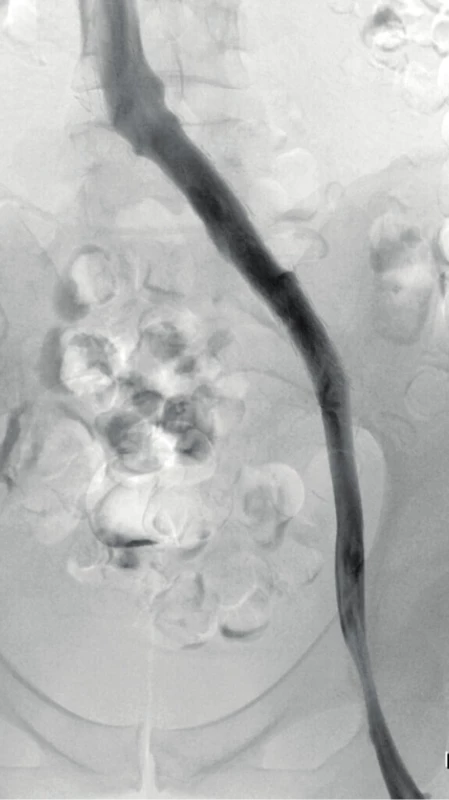
Komplikace lokální trombolýzy a jejich prevence
Nejobávanější komplikací je krvácení. Od benigního z místa vpichu, přes krvácení do trávicího traktu či retroperitonea, až po maligní intrakraniální. Pečlivý výběr indikovaných nemocných s nízkým rizikem krvácení je tedy kruciální. S výjimkou phlegmasie, kdy lokální trombolýza zachraňuje končetinu, je totiž lokální trombolýza „jen“ výkonem kvalitu života zlepšujícím, nikoliv život zachraňujícím. Naopak případné komplikace mohou být, naštěstí vzácně, i život ohrožující. Efekt lokální trombolýzy (zejména ve smyslu snížení incidence PTS) má šanci se projevit zejména u mladších pacientů, kde je naštěstí riziko krevních ztrát zpravidla relativně malé. Zvážení rizika a přínosu, správné poučení pacienta o charakteru a smyslu výkonu jsou nedílnou součástí plánování léčebné strategie. Pro snížení rizika krvácivých komplikací je zásadní ultrazvukem navigovaná punkce, vyvarování se zbytečných invazí, profylaktické podávání inhibitorů protonové pumpy, správná dávka antikoagulans a trombolytika. Důležitý je i pečlivý monitoring koagulačních parametrů a fibrinogenu (viz výše).
Postavení kaválních filtrů
Hluboká žilní trombóza a plicní embolie představují dvě strany jedné mince. V případě diagnostikované trombózy žil dolní končetiny lze při pečlivém zhodnocení CT angiografie plicnice či ventilačně‑perfuzního scanu nalézt známky plicní embolie i u pacientů zcela asymptomatických: PE byla nalezena u 36 % pacientů se stehenní a až u poloviny pacientů s pánevní trombózou (12). Lokální trombolýza zásadně urychluje zprůchodnění žilního řečiště, omezuje rozsah trombózy. Na druhé straně manipulace vodičem či katetrem v oblasti trombózy pochopitelně zvyšuje riziko uvolnění trombu a jeho následné vmetení do plicní cirkulace. S proximální lokalizací a narůstajícím kalibrem žil se zvětšuje i objem trombů a tím i riziko hemodynamicky významné plicní embolie. V původní indikaci byly kavální filtry vyhrazeny pro pacienty neschůdné k antikoagulaci nebo embolizující vzdor účinnému ředění krve. Později byla indikace rozšířena o proximální hlubokou žilní trombózu u pacientů, u nichž by případná plicní embolie mohla vést ke zhroucení hemodynamiky. Typickým příkladem je pacient se sníženou kardiovaskulární rezervou. Kavální filtr (Obr. 6) zavedený perkutánně zpravidla cestou pravé v. jugularis interna a fixovaný pod vyústěním renálních žil má potenciál velké tromby z kmenů dolních končetin zachytit a významné plicní embolii zabránit. Nerandomizovaná data naznačují efektivitu kaválního filtru u nestabilních pacientů s plicní embolií (13). Jasné důkazy z randomizovaných studií ale chybí a diskuze ohledně indikací stále probíhají. Na našem pracovišti indikujeme zavedení kaválního filtru bezprostředně před zahájením lokální trombolýzy při propagaci trombu do dolní duté žíly (tzv. „vlající trombus“), v ostatních případech filtr zpravidla nezavádíme. Po zavedení pak preferujeme co nejčasnější extrakci (ideálně do 6 týdnů od zavedení), která zvyšuje šanci na nekomplikované úspěšné perkutánní odstranění filtru. S délkou zavedení se také zvyšuje riziko komplikací: migrace filtru, jeho trombotizace, mechanické poškození; stenotizací a obleněním toku v dolní duté žíle se zvyšuje i riziko recidivy trombózy či rozvoje posttrombotického syndromu.
Obr. 6. Zavedený kavální filtr 
Dlouhodobá terapie po úspěšné lokální trombolýze
V dlouhodobé terapii tromboembolické nemoci převládají v současné době přímá antikoagulancia. Perorální podání, v řadě případů absence nutnosti laboratorní monitorace, nízké riziko krvácení a dobrá data (pro non‑inferioritu efektu) jsou atraktivní pro poskytovatele i pacienty. Pacienti indikovaní k lokální trombolýze jsou ovšem přeci jen specifickou podskupinou. Po trombolýze se obecně doporučuje pokračovat v terapii nefrakcionovaným či nízkomolekulárním heparinem, minimálně do doby odeznění lytického účinku. Argumentem pro odložení perorální terapie je nejen riziko krvácení, ale i ev. indikace dalších procedur – extrakce kaválního filtru, došetření případné paramaligní etiologie. Rozhodování o strategii následné terapie je individuální dle situace s přihlédnutím k preferencím pacienta. Na našem pracovišti se přikláníme k extendované terapii LMWH s následným převedením na warfarin s důsledným překryvem účinku. Přímá antikoagulancia indikujeme nejdříve po uplynutí 4–6 týdnů od zahájení terapie. Trvání antikoagulace po první epizodě TEN je 6–12 měsíců, v případě recidivujících příhod navrhujeme antikoagulaci doživotní. Samostatnou problematikou je pak situace po zavedení žilního stentu, kde jasná data zejména o protidestičkové terapii zcela chybí a opíráme se o zkušenost jednotlivých pracovišť (14).
V souvislosti s dlouhodobou terapií HŽT stojí za připomenutí často opomíjená role lokální komprese. Punčochy na míru a dostatečná edukace v aplikaci krátkotažné bandáže může zlepšit obecně suboptimální complience pacientů s touto zásadní fyzikální léčbou. Komprese je rovněž účinná v prevenci rozvoje PTS. Nicméně například studie TORPEDO (15) hlásila užívání punčoch po 6 měsících od akutní ataky jen u necelé třetiny pacientů s poklesem na méně než pětinu v průběhu dvou let. V reálné populaci budou čísla zcela jistě ještě nižší.
Endovaskulární terapie ve světle medicíny založené na důkazech
Americký registr PEARL (16) zahrnuje 392 pacientů po farmakomechanické trombolýze a přináší data o zlepšení kvality jejich života.
Multicentrická studie CaVenT (17) randomizovala 189 norských pacientů s vysokou femorální či ilickou hlubokou žilní trombózou k lokální trombolýze či konvenční terapii. U trombolyzovaných prokázala v průběhu dvou let redukci PTS o 26 % ve srovnání se samotnou antikoagulací. Stent byl použit u 17 % pacientů. Velké krvácení bylo přítomno u 3,2 % pacientů léčených trombolýzou, přičemž nebylo zaznamenáno úmrtí ani intrakraniální krvácení.
Sharifi ve studii TORPEDO (15) prokázal na souboru 183 pacientů s proximálním postižením při dvouletém sledování efekt ve smyslu snížení recidivy HŽT (4 vs. 13, p = 0,02) i incidence PTS (6 vs. 24, p < 0,001) při použití intravaskulární léčby ve srovnání s pouhou antikoagulací. Zhruba u třetiny intervenovaných byl implantován stent. Z posthoc analýzy vyplývá snížení incidence PTS při použití acetylsalicylové kyseliny (RR 0,37, 95% CI 0,19 – 0,74, p = 0,006).
Nejrozsáhlejší studie ATTRACT (18), která srovnávala farmakomechanickou trombolýzu se samotnou antikoagulací na téměř sedmi stovkách pacientů s proximální hlubokou žilní trombózou (femorální, ielofemorální, ilickou), sice nezjistila celkově rozdíl v incidenci PTS, prokázala ovšem rozdíl v jeho tíži a asociované kvalitě života (Villalta skóre). Nejvíce z terapie profitovali nemocní s postižením pánevního řečiště (19). Incidence velkého krvácení během prvních 10 dnů terapie byla i vzhledem k preselekci nízká (1,7 %), nicméně ve srovnání s pouhou antikoagulací významně vyšší (6 vs. 1 pacient; p = 0,049).
V praxi se setkáváme i s pacienty s absolutní kontraindikací trombolýzy, kdy je situace z pohledu medicíny založené na důkazu mimořádně složitá. Mechanické katetry (aspirační, neaspirační) bez podání trombolýzy ve studiích totiž selhaly zcela (20). U pacientů se závažným nálezem a s kontraindikací trombolýzy pak nezbývá než volit terapii chirurgickou.
Jediná randomizovaná studie zaměřená na stentování po katetrové trombolýze prokázala lepší zachování průchodnosti cévy a menší „žilní“ symptomatičnost pacientů v průběhu prvního roku při použití stentu ve srovnání s pouhou lokální trombolýzou (21). Studie ATTRACT s 28 % stentovaných v intervenčně léčené skupině vliv angioplastiky na kvalitu života nebo žilní skóre naopak neprokázala (18).
Z výše uvedeného vyplývá, že studie zaměřené na lokální trombolýzu jsou relativně málo rozsáhlé, heterogenní v přístupu k intervencím i následné terapii, ne zcela jednotné ve způsobu hodnocení kvality života či žilních skóre. Je pochopitelně značný rozdíl v hodnocení průchodnosti žil či reziduální trombózy při použití multiplanární venografie, duplexní sonografie či intravaskulárního ultrazvuku. Pro hodnocení rizika PTS je také nutná delší doba sledování – 2 roky považujeme za minimum. Data z metanalýz jsou málo přínosná (11). Výsledkem je často neshoda výsledku jednotlivých studií či přímo absence dat (například o kombinaci protidestičkové terapie s antikoagualcí po zavedení žilního stentu).
Závěr
Rozhodování o endovaskulární léčbě hluboké žilní trombózy je složité a individuální přístup naprosto nutný. Efekt invazivní léčby v krátkodobém i dlouhodobém horizontu je zřetelný, nicméně vykoupen zvýšeným rizikem krvácení.
Ideálním, ale nikoliv jediným, kandidátem k lokální trombolýze je pacient mladší 65 let, se symptomy kratšími 14 dní, proximální lokalizací trombózy (v případě dolní končetiny nad tříselný vaz), s nízkým rizikem krvácení, iniciálně chudou či pozvolnou reakcí na úvodní antikoagulační terapii a s životní prognózou nad 1 rok (viz Tab. 1). Samostatnou indikaci představuje akutní ohrožení končetiny charakteru phlegmazie. Vzhledem k malé četnosti, pestrosti a relativní logistické náročnosti se přimlouváme za koncentraci těchto stavů na pracoviště s dostatečnými zkušenostmi s endovaskulární terapií hluboké žilní trombózy.
Podpořeno MZ ČR – RVO (FNBr, 65269705)
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Martin Radvan, Ph.D.,
Interní kardiologická klinika FN Brno a LF MU,
Jihlavská 20,
625 00 Brno
Cit. zkr: Vnitř Lék 2020; 66(3): 146–151
Článek přijat redakcí: 19. 2. 2020
Článek přijat k publikaci: 28. 2. 2020
Zdroje
1. Beckman MG, Hooper WC, Critchley SE, et al. Venous thromboembolism: a public health concern. Am J Prev Med. 2010 Apr;38(4 Suppl): S495–501. Dostupné z DOI: http:.doi: 0.1016.j.amepre.2009. 12. 017>
2. Virchow, R. (1856). „Thrombose und Embolie. Gefässentzündung und septische Infektion“. Gesammelte Abhandlungen zur wissenschaftlichen Medicin (in German). Frankfurt am Main: Von Meidinger & Sohn. pp. 219–732.Matzdorff AC, Bell WR (1998). Thrombosis and embolie (1846–1856). Canton, Massachusetts: Science History Publications. ISBN 0-88135-113-X.
3. Malone PC, Agutter PS. (2008). The Aetiology of Deep Venous Thrombosis: A Critical, Historical and Epistemological Survey. Paris: Springer. p. 84. ISBN 978-1-4020-6649-8.
4. O‘Sullivan GJ, Semba CP, Bittner CA, et al. Endovascular management of iliac vein compression (May‑Thurner) syndrome. J Vasc Interv Radiol. 2000; 11(7): 823–836.
5. Goodacre S, Sampson F, Thomas S, et al. Systematic review and meta‑analysis of the diagnostic accuracy of ultrasonography for deep vein thrombosis. BMC Med Imaging. 2005; 5:
6. Published 2005 Oct 3. Dostupné z DOI: http:.doi:10.1186.1471-2342-5-6> 6. Pepke‑Zaba J, Delcroix M, Lang I, et al. Chronic thromboembolic pulmonary hypertension (CTEPH): results from an international prospective registry. Circulation. 2011; 124 : 1973–1981.
7. Vedantham S, Piazza G, Sista AK, et al. Guidance for the use of thrombolytic therapy for the treatment of venous thromboembolism J Thromb Thrombolysis. 2016; 41 : 68 – 80. Published online 2016 Jan 16. Dostupné z DOI: http:.doi: 10.1007.s11239-015-1318-z>
8. Vedantham S, Sista AK, Klein SJ, et al. For the Society of Interventional Radiology and Cardiovascular and Interventional Radiological Society of Europe Standards of Practice Committees Quality improvement guidelines for the treatment of lower‑extremity deep vein thrombosis with use of endovascular thrombus removal. J Vasc Interv Radiol. 2014; 25 : 1317–1325.
9. Goldhaber SZ, Buring JE, Lipnick RJ, et al. Pooled analyses of randomized trials of streptokinase and heparin in phlebographically documented acute deep venous thrombosis. Am J Med. 1984; 76 : 393–397 Dostupné z DOI: http:.doi: org.10.1016.0002-9343(84)90656-9>
10. Nazarian GK, et al., Austin WR, Wegryn SA, et al. Venous recanalization by metallic stents after failure of balloon angioplasty or surgery: four‑year experience. Cardiovasc Intervent Radiol; 19 : 227–233
11. Taha MA, Busuttil A, Bootun R, et al. A systematic review on the use of deep venous stenting for acute venous thrombosis of the lower limb. Phlebology. 2019 Mar; 34(2): 115 – 127. Dostupné z DOI: http:.doi: 10.1177.0268355518772760>
12. Stein PD, Maita F, Musani MH, et al. Silent Pulmonary Embolism in Patients with Deep Venous Thrombosis: A Systematic Review The American Journal of Medicine, Volume 123, Issue 5, 426–431
13. Stein PD, Matta F, Keyes DC, et al. Impact of vena cava filters on in‑hospital case fatality rate from pulmonary embolism. Am J Med. 2012; 125 : 478–484.
14. Milinis K, Thapar A, Shalhoub J et al. Antithrombotic Therapy Following Venous Stenting: International Delphi Consensus. Eur J Vasc Endovasc Surg. 2018 Apr;55(4):537-544. Dostupné z DOI: http:.doi: 10.1016.j.ejvs.2018. 01. 007>
15. Sharifi M, Bay C, Mehdipour M, et al. TORPEDO Investigators. Thrombus Obliteration by Rapid Percutaneous Endovenous Intervention in Deep Venous Occlusion (TORPEDO) trial: midterm results. J Endovasc Ther. 2012 Apr; 19(2): 273–280. Dostupné z DOI: http:. doi: 10.1583.11-3674MR.1>
16. Garcia MJ, Lookstein R, Malhotra R, et al. Endovascular Management of Deep Vein Thrombosis with Rheolytic Thrombectomy: Final Report of the Prospective Multicenter PEARL (Peripheral Use of AngioJet Rheolytic Thrombectomy with a Variety of Catheter Lengths) Registry. J Vasc Interv Radiol. 2015 Jun;26(6):777-85; quiz 786. Dostupné z DOI: http:.doi: 10.1016.j.jvir.2015. 01. 036>
17. Enden T, Haig Y, Klow N et al. Long‑term outcomes after additional catheter‑directed thrombolysis versus standard treatment for acute iliofemoral deep vein thrombosis (the CaVenT study): a randomised controlled trial. Lancet. 2012; 379(9810): 31–38.
18. Vedantham S, Goldhaber SZ, Julian JA, et al. Pharmacomechanical Catheter‑Directed Thrombolysis for Deep‑Vein Thrombosis. N Engl J Med. 2017 Dec 7; 377(23): 2240–2252. Dostupné z DOI: http:.doi: 10.1056.NEJMoa1615066>
19. Comerota AJ, Kearon C, Gu CS, et al. ATTRACT Trial Investigators. Endovascular Thrombus Removal for Acute Iliofemoral Deep Vein Thrombosis. Circulation. 2019 Feb 26; 139(9): 1162–1173.
20. Kasirajan K, Gray B, Ouriel K. Percutaneous Angiojet thrombectomy in the management of extensive deep venous thrombosis. J Vasc Interv Radiol. 2001; 12 : 179–185.
21. Meng QY, Li XQ, Jiang K, et al. Stenting of iliac vein obstruction following catheter‑directed thrombolysis in lower extremity deep vein thrombosis. Chin Med J (Engl) 2013; 126 : 3519–3522.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2020 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Arteriální hypertenze a infekce COVID-19: Stručný komentář
- Distanční léčba diabetu: Co mohou pacient, lékař a sestra zvládnout na dálku?
- Vnitřní lékařství v době koronavirové
- Lokální trombolýza v léčbě pacientů s hlubokou žilní trombózou: proč, komu a jak?
- „All‑in‑one“ koncept funkčně vedené revaskularizace myokardu v katetrizační laboratoři
- Prodlužování agresivní antitrombotické léčby po infarktu myokardu: proč, komu a jakou léčbu vybrat?
- Jsou inhibitory protonové pumpy účinným a bezpečným lékem nejen v profylaxi gastrointestinálního krvácení při antitrombotické léčbě?
- Psychické reakce nemocných na negativní informaci typu: „Máte maligní nemocnění“
- Prvé prípady geneticky potvrdenej kongenitálnej hnačky so stratou chloridov na Slovensku
- Euvascor – časná intervence u hypertonika s dyslipidemií, resp. dyslipidemika s hypertenzí (fixní kombinace atorvastatinu a perindoprilu)
- Rivaroxaban ve studii COMPASS
- Vážení a milí čtenáři Vnitřního lékařství,
- Jaké jsou cílové hodnoty krevního tlaku u pacientů s chronickým onemocněním ledvin?
- Čo sa skrýva za autoinflamáciou?
- Postižení srdce při hypereozinofilii
- Význam dechových testů k hodnocení jaterních funkcí u pacientů s chronickým onemocněním ledvin
- Adherence k principům kardiovaskulární prevence u osob s vysokým rizikem
- Stresová kardiomyopatia vyprovokovaná netypickou situáciou
- Hepatorenální syndrom – update 2020
- Proteinurie z pohledu internisty
- Proteinurie z pohledu internisty
- Miroslav Souček, Petr Svačina a kolektiv. Vnitřní lékařství v kostce. Grada; Praha 2019; 462 stran; ISBN 978-80-271-2289-9 (print)
- Profesorka MUDr. Sylvie Opatrná, PhD. – in memoriam (1959–2020)
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Čo sa skrýva za autoinflamáciou?
- Lokální trombolýza v léčbě pacientů s hlubokou žilní trombózou: proč, komu a jak?
- Proteinurie z pohledu internisty
- Hepatorenální syndrom – update 2020
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



