-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Současnost a perspektivy léčby akromegalie
Current and future therapy of acromegaly
Acromegaly is a rare disease caused by overproduction of growth hormone, which significantly worsens quality of life and increases morbidity and mortality of patients. Modern specialized surgery, radiosurgery, radiotherapy and pharmacotherapy substantially improved therapeutical possibilities and the perspective of patients. Current therapeutic modalities enable to create individually tailored therapy for the specific patient and suppress the acromegalic activity. Novel forms of currently used active substances and even conceptually new forms of pharmacotherapy are under preparation and testing (eg. octreotide in capsules, CAM2029, Somatoprim, ATL1103).
Key words:
acromegaly – cabergoline – new drugs – pegvisomant – somatostatin analogs – therapy
Autoři: Václav Hána
Působiště autorů: III. interní klinika 1. LF UK a VFN v Praze
Vyšlo v časopise: Vnitř Lék 2016; 62(Suppl 3): 68-72
Kategorie: Přehledné referáty
Souhrn
Akromegalie je vzácné onemocnění způsobené nadprodukcí růstového hormonu, které zhoršuje kvalitu života a významně zvyšuje morbiditu a mortalitu pacientů. Moderní specializovaná operační léčba, radiochirurgie, radioterapie a farmakoterapie zásadně zlepšily terapeutické možnosti a perspektivu pacientů. Současné léčebné modality umožňují individuálně volit optimální postup pro konkrétního pacienta a dosáhnout inaktivity akromegalie. Farmaceutický průmysl připravuje nové formy podání užívaných účinných látek i koncepčně nové formy medikamentózní léčby (např. oktreotid v kapslích, CAM2029, Somatoprim, ATL1103).
Klíčová slova:
akromegalie – analoga somatostatinu – kabergolin/carbegolin – léčba – nové léky – pegvisomantÚvod
Akromegalie je závažné vzácné onemocnění, způsobené nadprodukcí růstového hormonu (GH – growth hormone). Prevalence onemocnění se pohybuje okolo 100 osob na 1 milion obyvatel. Téměř vždy je onemocnění způsobeno adenomem hypofýzy a jen zcela výjimečně má jinou příčinu (Mc Cuneův-Albrightův syndrom, extrahypofyzární nádor produkující GH nebo GH-RH (growth hormone releasing hormone) a karcinom hypofýzy jsou extrémně vzácné). Hypofyzární adenom produkuje autonomně růstový hormon a v přibližně 30 % bývá přítomna kosekrece i dalšího hypofyzárního hormonu, nejčastěji prolaktinu a výjimečně i TSH. Adenomy jsou v 95 % případů sporadické a jen v 5 % se vyskytují v rámci některého z familiárních syndromů.
Diagnóza akromegalie bývá u většiny pacientů stanovena obvykle až po několika letech trvání onemocnění, když má nádor v 75–80 % případů charakter makroadenomu (> 1 cm alespoň v jednom rozměru) a když bývají příznaky onemocnění již výrazněji rozvinuté [1]. Nadbytek GH a jím stimulovaného inzulinu-podobného faktoru 1 (IGF1), který je významným mediátorem působení GH (kromě přímého působení GH) na tkáně, má dopad na celou řadu orgánů s odpovídajícími klinickými projevy. Neléčené onemocnění výrazně zvyšuje morbiditu, zhoršuje kvalitu životu, zvyšuje mortalitu zejména na kardiovaskulární a cerebrovaskulární onemocnění a zkracuje délku života přibližně o 10 let [2]. Nádor svou velikostí může též působit lokální příznaky jako poruchy zorného pole při supraselární propagaci s útlakem optických nervů, bolesti hlavy, diplopii při porušení okohybných nervů a výjimečně při mimořádně velkém tumoru i hydrocefalus a epilepsii. Poškození zdravé hypofýzy nádorem vede k rozvoji hypopituitarizmu parciálního nebo úplného (panhypopituitarizmu).
Léčba akromegalie
Cílem léčby akromegalie je normalizace koncentrace GH nebo případně zablokování působení GH na cílové tkáně a odstranění nebo zmenšení adenomu. Optimální je situace, při níž se těchto cílů dosáhne bez dalšího poškození zdravé části hypofýzy. Vzhledem k tomu, že u většiny pacientů je v době diagnózy onemocnění již přítomen makroadenom, který často není možné celý odstranit, je léčba komplikovanější a vyžaduje obvykle multimodální terapeutický přístup (schéma).
Schéma. Současný algoritmus léčby akromegalie v České republice 
DA – dopaminergní agonista SMSA – analoga somatostatinu Chirurgická léčba
Nejrychlejším a nejúčinnějším způsobem léčby je operační odstranění celého adenomu hypofýzy a operace je doporučována jako primoterapie [3]. Není-li možný radikální výkon, pak je cílem maximální zmenšení adenomu s podstatným snížením koncentrací GH a IGF1 v cirkulaci. Na specializovaných pracovištích je dosahováno normalizace IGF1 po operaci adenomu hypofýzy, pokud hodnotíme všechny operované pacienty neselektovaně, v 61 % případů (hodnoceno z našeho souboru celkem 105 pacientů; 16 pacientů s mikroadenomy). U mikroadenomů bylo v našem souboru dosaženo radikální resekce v 75 % a u makroadenomu v 58,4 %. V případech, v nichž lze z předoperačního vyšetření magnetickou rezonancí (MRI) předpokládat radikální resekci (v našem souboru 80 pacientů), je dosaženo pooperačního vyhasnutí aktivity akromegalie v 77,5 % případů. V případech, v nichž lze z MRI nálezu předpokládat, že radikální výkon vzhledem k šíření expanze není možný, je dosaženo radikální resekce zcela výjimečně – v naší sestavě 25 pacientů u 2 (8 %) [4]. Nicméně, i v případech, v nichž není nádor odstraněn celý a je dosaženo významného debulkingu, je operace významným přínosem. Výrazná redukce tumorózní masy vytváří lepší podmínky pro uplatnění následné radiochirurgie nebo radioterapie a současně farmakoterapie [5,6]. Pokud nebyl hypofyzární adenom odstraněn celý a jsou pro to vhodné podmínky, reziduum tumoru ozáříme gama nožem. Použití gama nože není možné, pokud se jedná o nádor příliš velký (> 2,5 cm), v kontaktu nebo příliš blízko u optiků (< 2 mm) nebo když pacient nemůže podstoupit magnetickou rezonanci, která se užívá k zaměření paprsků záření (např. při zavedeném kardiostimulátoru atd). Nelze-li aplikovat radiochirurgii gama nožem, pak nádor ozáříme nejčastěji frakcionovaně lineárním urychlovačem případně ve specifických situacích protonovým zářením [7,8]. Efekt ozáření se projeví nejdříve v průběhu následujících měsíců až let. V naší sestavě dosáhla polovina pacientů vyhasnutí aktivity akromegalie přibližně za 5 let [9]. Do uplatnění plného efektu ozáření je nutné potlačit aktivitu akromegalie (GH, IGF1) farmakoterapií.
Farmakoterapie
Ve farmakoterapii máme v současnosti v rutinní praxi k dispozici 3 skupiny léků.
První skupinu tvoří dopaminergní agonisté a z nich především kabergolin. Výhodou kabergolinu je perorální podání, velmi dobrá snášenlivost léku s minimem vedlejších účinků a nízká cena. Nevýhodou je jeho malá účinnost. Ve studiích se ukázalo, že nejlepších výsledků je dosaženo u pacientů s nízkou hormonální aktivitou. U pacientů s IGF1 pod 1,5násobek horní hranice normy bylo dosaženo normalizace IGF1 až v 50 % [10]. V rutinní praxi při neselektované populaci pacientů lze očekávat normalizaci parametrů aktivity akromegalie kabergolinem mnohem nižší (odhadem do 10 %). Nicméně i při celkově nízké účinnosti z hlediska celé skupiny pacientů s akromegalií je kabergolin v případě účinnosti u daného pacienta léčbou pro pacienta velmi výhodnou umožňující individualizovanou dobře snášenou léčbu. Je proto vhodné účinnost kabergolinu vyzkoušet dříve, nežli přistoupíme k jiným formám farmakologické léčby, a to zvláště u pacientů s relativně mírnou hormonální aktivitou.
Druhou skupinou léků, které také působí přímo na buňky hypofyzárního adenomu, jsou analoga somatostatinu (SMSA). Kromě dominantního centrálního účinku je známo, že SMSA inhibují i tvorbu IGF1 na úrovni hepatocytu [11]. V této skupině jsou rutinně v ČR používány v současnosti oktreotid a lanreotid ve formě preparátů s pomalým uvolňováním (Sandostatin LAR Novartis a Somatuline Autogel Ipsen). Oktreotid a lanreotid působí především na somatostatinové receptory (SMSR) 2., a méně 3. a 5. typu. Injekce jsou aplikovány převážně v 4týdenním intervalu, ale podle odpovědi laboratorních parametrů aktivity onemocnění na léčbu (IGF1, GH) je někdy nutné interval zkrátit, a jindy je naopak možné interval prodloužit na 6–8 týdnů. Účinnost obou těchto preparátů v léčbě akromegalie je srovnatelná [12]. Plné normalizace parametrů aktivity akromegalie (GH, IGF-1) podle přísných kritérií je při léčbě SMSA dosaženo v přibližně 25 % neselektované populace pacientů s akromegalií [13]. V jiném hodnocení účinnosti se uvádí zhruba u třetiny úplné potlačení aktivity akromegalie, u třetiny parciální a u třetiny nedostatečný efekt. Oba tyto preparáty působí kromě potlačení aktivity akromegalie i zmenšení rezidua adenomu – o více než 20 % u 75 % [14].
Nově je v této skupině registrován pasireotid (Signifor LAR Novartis), který prokázal ve studiích větší účinnost ve srovnání s oktreotidem. Bylo dosaženo normalizace IGF1 u 38,6 % pacientů léčených pasireotidem LAR proti 23,6 % léčených oktreotidem LAR [15]. Pokles GH byl podobný po pasireotidu i oktreotidu. Přesný mechanizmus, který by vysvětlil výraznější supresi IGF1 při pasireotidu, není zcela jasný. Mohl by se podílet výraznější inhibiční vliv pasireotidu na sekreci inzulinu. Pasireotid má jiné spektrum afinity k somatostatinovým receptorům než oba výše zmíněné analogy. Má 40krát vyšší afinitu k SMSR5, 30krát k SMSR1 a 5krát k SMSR3, ale nižší afinitu k SMSR2. Jeho nevýhodou jsou vedlejší účinky, především výrazně vyšší výskyt hyperglykemie – při pasireotidu v 57 % proti 22 % při oktreotidu LAR [15]. To je způsobeno výraznější supresí sekrece inzulinu, jen mírnou supresí glukagonu a sníženou odpovědí inkretinů (GLP1 a GIP) při léčbě pasireotidem. V léčbě hyperglykemie při pasireotidu se proto doporučuje podání gliptinů nebo DPP4 inhibitorů [16,17]. Ke kompenzaci hyperglykemie přispívá i léčba metforminem.
Třetí skupinu farmak v léčbě akromegalie představuje blokátor receptorů pro GH – pegvisomant (Somavert Pfizer). Na rozdíl od prvních 2 skupin léků, které ovlivňují buňky adenomu, působí pegvisomant v cílových tkáních. Blokuje účinek růstového hormonu na úrovni receptoru GH. Pegvisomant je modifikovaná molekula růstového hormonu, která se v jednom místě pevně váže na receptor GH a blokuje účinnou dimerizaci receptorů GH, která je nezbytná pro aktivaci další kaskády dějů nutných k účinku GH v cílových tkáních. Účinnost pegvisomantu je vysoká (ve studiích přes 90 %) a závisí na výši podané dávky [18]. V každodenní praxi se ukázalo, že dávkování není vždy adekvátně zvýšeno a plně kontrolovaná aktivita akromegalie byla jen u 63 % pacientů [19]. Při léčbě pegvisomantem je výhodné podání v kombinaci s SMSA, kdy se využije synergistického potlačení aktivity akromegalie působením obou preparátů na různých úrovních [20]. U pegvisomantu se setkáváme s těmito vedlejšími účinky – elevace v jaterním souboru (ve velké observační studii ACROSTUDY do 3 %), lipodystrofie, lipohypertrofie, při velmi nízkých koncentracích IGF1 mohou být až známky deficitu GH. Pokud byl pozorován růst rezidua adenomu hypofýzy, jednalo se ve většině případů o rebound fenomen po vysazení SMSA při jeho nedostatečném efektu.
Při nedostatečném efektu léčby jedním preparátem bývá farmakologická léčba kombinována s preparátem z druhé skupiny (D2 agonista + SMSA; D2 agonista + pegvisomant; SMSA + pegvisomant).
Perspektivy léčby akromegalie
Současný farmakologický výzkum vyvíjí nová farmaka k léčbě akromegalie. Jednou cestou je vývoj nových aplikačních forem stávajících účinných látek – oktreotidu a lanreotidu a druhou cestou vývoj nových účinných látek [21,22].
Nové aplikační formy současných analogů somatostatinu
Subkutánní aplikace oktreotidu – CAM2029
Vyvíjený preparát pod označením CAM2029 obsahuje oktreotid, který se postupně uvolňuje z tekutých krystalů, a má tedy depotní charakter. Účinná látka je uložena v nanostrukturách. Aplikuje se injekčně v podobě subkutánních předplněných injekcí. Jeho výhodou se jeví lepší biologická dostupnost s kontinuálním uvolňováním oktreotidu, rychlejší nástup a příjemnější aplikace malého objemu tenkou jehlou ve srovnání s dosud nutnými silnými jehlami. Umožnil by i vlastní aplikaci a uchovávání v pokojové teplotě.
Klinická zkoušení fáze 1 již proběhla a nyní probíhá fáze 2, ve které je porovnávána subkutánní aplikace CAM2029 à 2 nebo 4 týdny u pacientů s akromegalií a neuroendokrinními tumory proti Sandostatin® LAR, Novartis.
Subkutánně implantované kapsle oktreotidu
Jako další aplikační forma SMSA je vyvíjena kapsle s pomalým uvolňováním oktreotidu k subkutánní implantaci. Výhodou by mohla být aplikace kapsle à 6 měsíců. Proběhly studie fáze 2 a 3, během nichž byl srovnáván biochemický efekt a bezpečnostní profil během 24 týdnů v porovnání s léčbou měsíčně aplikovaného oktreotidu LAR. Efektivita i bezpečnostní profil byly obdobné [23]. Program vývoje byl dle dostupných informací pozastaven (Endo Pharmaceuticals, Philadelphia, U. S.), ale další vývoj se předpokládá.
Perorálně podávaný oktreotid v kapslích – Octreolin
Za fyziologických okolností je oktreotid po požití vstřebáván do cirkulace v jejunu, ale bariéra gastrointestinálního traktu brání jeho resorpci, takže se vstřebá jen minimální množství. Při podání oktreotidu ve speciálních kapslích označovaných TPE (transient permeability enhancer; obsahují sůl mastné kyseliny o střední délce sodium kaprylát a inertní excipienty spolu s oktreotidem v olejové suspenzi) dochází k přechodnému otevření těsných mezibuněčných spojení (tight junctions) a většímu přechodu oktreotidu do cirkulace, čímž je dosaženo účinných koncentrací. Zvýšená mezibuněčná permeabilita je limitována časem (1–2 hod) a velikostí molekul. Výrazně lepší efekt byl pozorován při podání nalačno, bez inhibitorů protonové pumpy.
Proběhly již zkoušky fáze 3. Ve studii byl posuzován efekt oktreolinu (Octreolin cps), proti injekčnímu oktreotidu. U 85 % byla zachována kontrola aktivity akromegalie ve srovnání s injekčním oktreotidem podávaným v předchozí fázi zkoušení [24]. Výhodou této formy aplikace je vyloučení injekčního podání a dále by mohlo jeho podání zmírnit průlomové potíže ke konci efektu injekčního podání SMSA. Profil vedlejších účinků je obdobný jako u i. m. podání oktreotidu s výjimkou obtíží v místě vpichu.
Octreolin zatím nemohl být uveden do praxe, protože FDA v dubnu roku 2016 preparát neschválila a vyžádala provedení další studie (nová aplikační forma již byla ve FDA schválena v roce 2015). V Evropské unii je zkoušení preparátu ve fázi 3 klinických studií.
Nové preparáty
Analog somatostatinu označený DG3173, Somatoprim (Aspireo Pharm)
Tento nově vyvíjený analog somatostatinu je heptapeptid, který má vysokou afinitu k SMSR-2, SMSR-4 a SMSR-5 a farmakokinetický profil podobný oktreotidu. Je vysoce selektivní v supresi sekrece GH a vykazuje minimální inhibiční efekt na inzulin [25]. Studie in vitro ukazují na větší účinnost než oktreotid. Lepší odpověď byla pozorována in vitro u tumorů s řídkými granulacemi. Studie fáze 1 ukázala menší účinek DG3173 na sekreci inzulinu a glukagonu a na koncentrace glukózy ve srovnání s oktreotidem i při užití vyšších dávek [26]. V současnosti probíhá klinické zkoušení fáze 2 u dosud neléčených pacientů s akromegalií. V listopadu roku 2015 získal Somatoprim statut Orphan Drug pro akromegalii v Evropské unii.
Inhibitor sekrece odvozený od botulotoxinu – SXN101959
Je to rekombinantní protein tvořený chimérou domény vážící se na receptor releasing hormonu GH (GHRH) a endopeptidázové domény botulotoxinu. Váže se na GHRH receptor na somatotropních buňkách hypofýzy, je internalizován a následně štěpí proteiny, které jsou důležité pro exocytózu GH z granul buněk. In vivo u potkanů inhibuje syntézu, skladování a sekreci GH a tím snižuje i IGF-1 [27].
Antisens oligonukleotid RNA – ATL1103 (COR-004)
Antisens oligonukleotidy jsou navržené tak, aby se specificky vázaly na komplementární mRNA a snižovaly tvorbu jejího peptidového produktu. Oligonukleotid 2. generace ATL1103 obsahuje 20 nukleotidů, je namířený proti mRNA receptoru pro GH a aktivuje ribonukleázu H, která vzniklý komplex štěpí. Tím klesá tvorba receptorů pro GH v játrech a následně se snižuje tvorba IGF-1 v játrech a tím se oslabí působení ve tkáních. Účinnost potvrzuje i pozorovaný pokles vazebného proteinu GH, který tvoří extracelulární část receptoru GH.
Ve studii fáze 2 u pacientů s akromegalií při aplikaci injekcí 2krát týdně došlo k poklesu IGF-1 o 26 % (byla potvrzena závislost poklesu na dávce). Současně byl pozorován vzestup GH během studie. U více než 85 % pacientů byla pozorována mírná až střední reakce v místě vpichu. Reakce typu „flu-like“ se nevyskytly. Současné výsledky je možné brát jako potvrzení konceptu účinnosti antisens nukleotidů namířených proti receptoru GH u pacientů s akromegalií, i když zatím nelze říci, zda tato cesta představuje nějakou výhodu oproti pegvisomantu. V plánu je provedení studie s vyšším dávkováním, která by měla ukázat, zda podání vyšších dávek přinese lepší účinnost, aniž by se zhoršil bezpečnostní profil [28].
Přehled zmíněných preparátů užívaných v současnosti k léčbě akromegalie je uveden v tab.
Tab. 1. Přehled aktuálně užívaných i vyvíjených preparátů k léčbě akromegalie 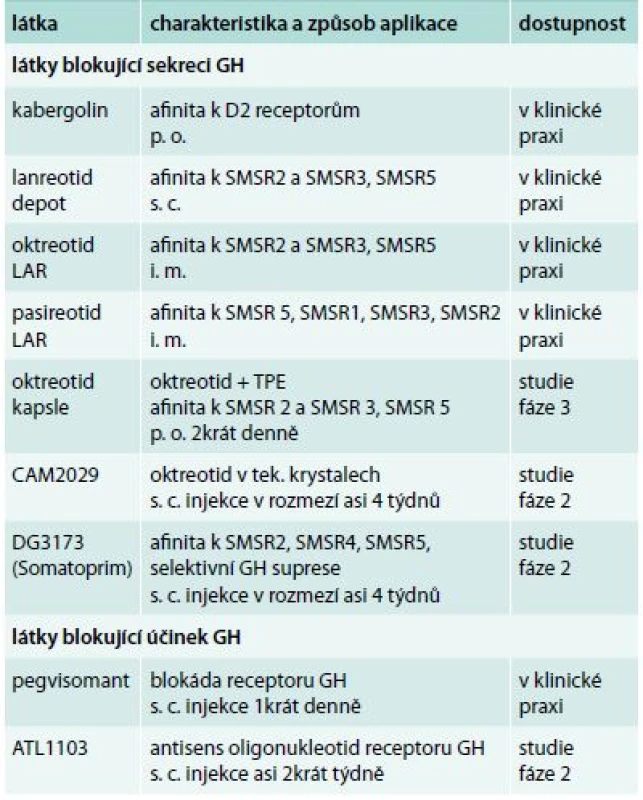
SMSR – receptor somatostatinu Závěr
Akromegalie je vzácné onemocnění, které neléčené významně zvyšuje morbiditu a mortalitu pacientů. Moderní specializovaná operační léčba, radiochirurgie, radioterapie a farmakoterapie zásadně zlepšily osud pacientů s akromegalií. Současné léčebné možnosti umožňují individuálně volit optimální postupy pro konkrétního pacienta. I když se zatím volba terapie opírá především o klinickou zkušenost, je možné předpokládat, že časem bude naše rozhodování podloženo novými molekulárně biologickými objevy. Farmaceutický průmysl připravuje nové formy podání stávajících účinných látek i koncepčně nové formy léčby.
prof. MUDr. Václav Hána, CSc.
vhana@lf1.cuni.cz
III. interní klinika 1. LF UK a VFN v Praze
www.int3.lf1.cuni.cz
Doručeno do redakce 15. 8. 2016
Přijato po recenzi 1. 9. 2016
Zdroje
1. Hána V, Švancara J, Bandúrová L et al. Registr selárních tumorů – RESET: diagnostika a léčba akromegalie v České a Slovenské republice v 21. století. DMEV2013; 16(4): 219–224. Dostupné z WWW: http://www.tigis.cz/images/stories/DMEV/2013/04/04_hana.pdf.
2. Rajasoorya C, Holdaway IM, Wrightson P et al. Determinants of clinical outcome and survival in acromegaly. Clin Endocrinol (Oxf) 1994; 41(1): 95–102.
3. Katznelson L, Laws jr. ER, Melmed S et al. Acromegaly: an Endocrine society clinical practice guideline. J Clin Endocrinol Metab 2014; 99(11): 3933–3951. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2014–2700>.
4. Netuka D, Májovský M, Masopust V et al. Intraoperative MRI during endoscopic transsphenoidal surgery of growth hormone-secreting pituitary adenomas. World Neurosurg 2016; 91 : 490–496. Dostupné z DOI: <http://dx.doi.org/10.1016/j.wneu.2016.04.094>.
5. Petrossians P, Borges-Martins L, Espinoza C et al. Gross total resection or debulking of pituitary adenomas improves hormonal control of acromegaly by somatostatin analogs. Eur J Endocrinol 2005; 152(1): 61–66.
6. Colao A, Attanasio R, Pivonello R et al. Partial surgical removal of growth hormone-secreting pituitary tumors enhances the response to somatostatin analogs in acromegaly. J Clin Endocrinol Metab 2006; 91(1): 85–92.
7. Rowland NC, Aghi MK. Radiation treatment strategies for acromegaly. Neurosurg Focus 2010; 29(4): E12. Dostupné z DOI: <http://dx.doi.org/10.3171/2010.7.FOCUS10124>.
8. Wattson DA, Tanguturi SK, Spiegel DY et al. Outcomes of proton therapy for patients with functional pituitary adenomas. Int J Radiat Oncol Biol Phys 2014; 90(3): 532–539. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ijrobp.2014.06.068>.
9. Ježková J, Marek J, Hána V et al. Gamma knife radiosurgery for acromegaly--long-term experience. Clin Endocrinol (Oxf) 2006; 64(5): 588–595.
10. Sandret L, Maison P, Chanson P. Place of cabergoline in acromegaly: a meta-analysis. J Clin Endocrinol Metab 2011; 96(5): 1327–1335. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2010–2443>.
11. Pokrajac A, Frystyk J , Flyvbjerg A et al. Pituitary-independent effect of octreotide on IGF1 generation. Eur J Endocrinol 2009; 160(4): 543–548. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-08–0822>.
12. Murray RD, Melmed S. A critical analysis of clinically available somatostatin analog formulations for therapy of acromegaly. J Clin Endocrinol Metab 2008; 93(8): 2957–2968. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2008–0027>.
13. Giustina A, Chanson P, Kleinberg D et al. Expert consensus document: A consensus on the medical treatment of acromegaly. Nature Rev Endocrinol 2014; 10(4): 243–248. Dostupné z DOI: <http://dx.doi.org/10.1038/nrendo.2014.21>.
14. Mercado M, Borges F, Bouterfa H et al. A prospective, multicentre study to investigate the efficacy, safety and tolerability of octreotide LAR in the primary therapy of patients with acromegaly. Clin Endocrinol 2007; 66(6): 859–868.
15. Colao A, Bronstein MD, Freda P et al. Pasireotide versus octreotide in acromegaly: a head-to-head superiority study. J Clin Endocrinol Metab 2014; 99(3): 791–799. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2013–2480>.
16. Breitschaft A, Hu K, Hermosillo Reséndiz K et al. Management of hyperglycemia associated with pasireotide (SOM230): healthy volunteer study. Diabetes Res Clin Pract 2014; 103(3): 458–465. Dostupné z DOI: <http://dx.doi.org/10.1016/j.diabres.2013.12.011>.
17. Henry RR, Ciaraldi TP, Armstrong D et al. Hyperglycemia associated with pasireotide: results from a mechanistic study in healthy volunteers. J Clin Endocrinol Metab 2013; 98(8): 3446–3453. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2013–1771>.
18. Van der Lely AJ, Hutson RK, Trainer PJ et al. Long-term treatment of acromegaly with pegvisomant, a growth hormone receptor antagonist. Lancet 2001; 358(9295): 1754–1759.
19. van der Lely AJ, Biller BM, Brue T et al. Long-term safety of pegvisomant in patients with acromegaly: comprehensive review of 1288 subjects in ACROSTUDY. J Clin Endocrinol Metab 2012; 97(5): 1589–1597. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2011–2508>.
20. Neggers SJ, Kopchick JJ, Jørgensen JO et al. Hypothesis: Extra-hepatic acromegaly: a new paradigm? Eur J Endocrinol 2011; 164(1): 11–16. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-10–0969>.
21. Melmed S. New therapeutic agents for acromegaly. Nat Rev Endocrinol 2016; 12(2): 90–98. Dostupné z DOI: <http://dx.doi.org/10.1038/nrendo.2015.196>.
22. Cuevas-Ramos D, Fleseriu M. Pasireotide: a novel treatment for patients with acromegaly. Drug Des Devel Ther 2016; 10 : 227–239. Dostupné z DOI: <http://dx.doi.org/10.2147/DDDT.S77999>.
23. Chieffo C, Cook D, Xiang Q et al. Efficacy and safety of an octreotide implant in the treatment of patients with acromegaly. J Clin Endocrinol Metab 2013; 98(10): 4047–4054. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2013–2262>.
24. Melmed S, Popovic V, Bidlingmaier M et al. Safety and efficacy of oral octreotide in acromegaly: results of a multicenter phase III trial. J Clin Endocrinol Metab 2015; 100(4): 1699–1708. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2014–4113>.
25. Afargan M1, Janson ET, Gelerman G et al. Novel long-acting somatostatin analog with endocrine selectivity: potent suppression of growth hormone but not of insulin. Endocrinology 2001; 142(1): 477–486.
26. Plöckinger U, Hoffmann U, Geese M et al. DG3173 (somatoprim), a unique somatostatin receptor subtypes 2-, 4 - and 5-selective analogue, effectively reduces GH secretion in human GH-secreting pituitary adenomas even in Octreotide non-responsive tumours. Eur J Endocrinol 2012; 166(2): 223–234. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-11–0737>.
27. Somm E, Bonnet N, Zizzari P et al. Comparative inhibition of the GH/IGF-I axis obtained with either the targeted secretion inhibitor SXN101959 or the somatostatin analog octreotide in growing male rats. Endocrinology 2013; 154(11): 4237–4248. Dostupné z DOI: <http://dx.doi.org/10.1210/en.2013–1427>.
28. Trainer PJ, Newell-Price J, Ayuk J et al. A Phase 2 study of antisense oligonucleotide therapy directed at the GH receptor demonstrates lowering of serum IGF‑I in patients with acromegaly. [abstract OR09‑1]. Presented at the Endocrine Society’s 97th Annual Meeting and Exposition (2015). Dostupné z DOI: <http://dx.doi.org/10.1530/endoabs.37.GP.19.10>.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2016 Číslo Suppl 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Zásobení jodem u těhotných žen v České republice
-
Řešení jodového deficitu v České republice – historie a současný stav
20 let práce prof. MUDr. Václava Zamrazila v Meziresortní komisi pro řešení jodového deficitu - Psycho-imuno-endokrinologie štítné žlázy
- Karcinomy štítné žlázy – současné léčebné postupy
- Vitamin D a autoimunitní tyreopatie
- Testosteron a mortalita
- Vrozená adrenální hyperplazie v dospělosti
- Polyfarmakoterapie nahlížená nejen prizmatem multimorbidity, ale jako další geriatrický syndrom
- Mnohočetná endokrinní neoplazie I (Wermerův syndrom) – formy klinické manifestace: 5 kazuistik
- Priebeh ochorenia u pacientov s diferencovaným mikrokarcinómom štítnej žľazy pri použití rôznych liečebných postupov
- Projekt SPACE (Stav Pacientů Akceptovaných diabetologem Cestou Exportu)
- Zásobení jodem a jodurie obyvatel v České republice v letech 1995–2016
- Prof. MUDr. Václav Zamrazil, DrSc., slaví 80. narozeniny
- Jodurie u nemocných s diabetes mellitus 1. typu Vztahy k vybraným parametrům charakterizujícím diabetický syndrom
- Nádory štítné žlázy u dětí a dospívajících a jejich molekulárně genetická podstata
- Endokrinní komplikace moderní onkologické léčby
- Václav Zamrazil osmdesátníkem
- Léčba levotyroxinem – faktory ovlivňující její úspěšnost
- Endokrinní orbitopatie – téma stále živé
- Jsou tyreoidální hormony a tyreotropin asociovány s kardiometabolickými riziky a inzulinovou rezistencí u eutyreoidních jedinců?
- Současnost a perspektivy léčby akromegalie
- Kardiorenální syndrom – biomarkery a mediátory
- TSH produkující adenomy
- Centrální poruchy funkce štítné žlázy
- Vitamín D a syndróm polycystických ovárií
- Tyreoidální hormony a kardiovaskulární systém
- Endokanabinoidný systém a kosť
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Vrozená adrenální hyperplazie v dospělosti
- Mnohočetná endokrinní neoplazie I (Wermerův syndrom) – formy klinické manifestace: 5 kazuistik
- Vitamin D a autoimunitní tyreopatie
- Centrální poruchy funkce štítné žlázy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



