-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
TSH produkující adenomy
TSH secreting adenomas
Adenomas which secrete thyrotropic hormone (thyrotropinomas) are rare and constitute less than 3 % of pituitary adenomas. In laboratory studies there is a typical elevation of thyroid hormones with nonsupressible TSH. In differential diagnostics it is necessary to distinguish above all the syndrome of resistance to thyroid hormones. Clinical symptoms are usually mild and correspond to symptoms of hyperthyroidism. Goiter is a common finding. In 80 % of cases thyrotropinomas are diagnosed in a stage of invasively growing macroadenoma. The primary treatment is neurosurgical removal adenoma which results in cure in 40 % of patients. Other treatment options include radiation therapy and medical treatment (treatment with somatostatin analogues). With regard to the risk of adenoma recurrence, the long-term follow–up is similar to that of cases of other pituitary adenomas necessary.
Key words:
resistance to thyroid hormone – TSH secreting adenoma – thyreotropin
Autoři: Jana Ježková; Josef Marek
Působiště autorů: III. interní klinika 1. LF UK a VFN v Praze
Vyšlo v časopise: Vnitř Lék 2016; 62(Suppl 3): 77-81
Kategorie: Přehledné referáty
Souhrn
Adenomy se sekrecí tyreotopního hormonu jsou vzácné a tvoří méně než 3 % všech hypofyzárních adenomů. Laboratorně je typická elevace tyreoidálních hormonů při nesuprimovaném TSH. Diferenciálně diagnosticky je potřebné odlišit především syndrom rezistence na tyreoidální hormony. Klinické příznaky onemocnění jsou obvykle mírné, odpovídají příznakům hypertyreózy, častým nálezem je struma. Tyreotropinomy jsou v 80 % případů diagnostikovány ve fázi invazivně rostoucího makroadenomu. Primární léčbou je neurochirurgické odstranění adenomu, které vede k vyléčení u 40 % pacientů. K dalším léčebným možnostem patří radioterapie a medikamentózní léčba – léčba somatostatinovými analogy. Podobně jako u jiných hypofyzárních adenomů je vzhledem k riziku recidivy adenomu nutné dlouhodobé sledování.
Klíčová slova:
rezistence na tyreoidální hormony – TSH produkující adenomy – tyreotropinÚvod
Adenomy se sekrecí tyreotropního hormonu jsou vzácnou příčinou tyreotoxikózy a vyskytují se v 0,9–2,8 % hypofyzárních adenomů. Prevalence tyreotropinomů je 1 případ na milion obyvatel, incidence je udávána 0,15–0,3 případů/milion obyvatel/rok [1–4]. První případ adenomu produkujícího tyreotropin byl popsán v roce 1960, tyreotropin byl stanoven bioanalýzou [5]. Diagnostika adenomu se sekrecí tyreotropinu se zakládá na přítomnosti zvýšených nebo jen suprimovaných sérových koncentrací TSH (tyreotropin, hormon stimulující tyreoideu) a zvýšených koncentrací periferních hormonů – volného tyroxinu (fT4) a volného trijodtyroninu (fT3). V minulosti používané radioimunoanalytické metody nebyly schopny rozlišit normální a nesuprimované hodnoty TSH. Zavedením ultrasenzitivních imunoanalýz došlo ke zlepšení citlivosti metod s možností stanovení suprimovaných a nesuprimovaných hodnot TSH, a tím i zlepšení diferenciální diagnostiky stavů spojených s nálezem zvýšených hodnot periferních hormonů štítné žlázy. V posledních letech jsou adenomy produkující tyreotropin diagnostikovány nejen častěji, ale i časněji ve fázi mikroadenomu před rozvojem neurologických a endokrinologických komplikací vyplývajících z lokální expanze adenomu, což vede k lepší dlouhodobé prognóze nemocných [2,3].
Fyziologie
Tyreotropin je glykoprotein složený ze 2 nekovalentně spojených podjednotek α a β produkovaný tyreotropními buňkami předního laloku hypofýzy. Tyreotropní buňky tvoří méně než 5 % všech hypofyzárních buněk [6]. TSH a ostatní glykoproteinové hormony (luteinizační hormon – LH, folikuly stimulující hormon – FSH a lidský choriový gonadotropin – hCG) mají shodnou podjednotku α. Podjednotka β je odlišná a určuje biologickou a imunologickou specificitu. Biologická aktivita je výrazně ovlivněná glykozylací TSH [7]. Syntéza a sekrece TSH je řízena signály z centrálního nervového systému a zpětnou vazbou z periferie. Nejvýznamnější stimulační vliv má hypotalamický TRH (hormon uvolňující tyreotropin). Syntézu TSH pozitivně ovlivňuje i leptin [8]. Inhibiční vliv centrální (hypotalamické) regulace je zprostředkován somatostatinem, dopaminem a neuropeptidem-Y (NPY) [9–11]. V periferní regulaci se uplatňují především zpětnou vazbou inhibičně působící cirkulující hormony štítné žlázy, inhibiční vliv má i nadbytek glukokortikoidů [12] a některé cytokiny (tumor nekrotizující faktor – TNF, interleukin 1 – IL1 a interleukin 6 – IL6) [13–15]. Cirkulující TSH se váže na specifické povrchové receptory buněk štítné žlázy, ve kterých stimuluje tvorbu hormonů: tyroxinu (T4) a trijodtyroninu (T3). Vlastním účinným tyroideálním hormonem je trijodtyronin, který vzniká dejodací tyroxinu, jehož účinky ovlivňují nejrůznější metabolické děje buněk všech orgánů a tkání organizmu.
Patogeneze
Tyreotropinomy jsou složené z chromofobních buněk, ve kterých se při imunohistochemickém vyšetření prokazuje pozitivita TSH podjednotky β, podjednotky α a Pit-1. U tzv. tichých adenomů však tato pozitivita nekoreluje s laboratorním nálezem a klinickým stavem pacientů [16]. TSH se z buněk těchto adenomů nesecernuje vůbec, nebo v klinicky pozměněné neaktivní formě, popřípadě pouze ve formě jednotlivých řetězců.
Většina tyreotropinomů (72 %) secernuje pouze TSH často doprovázené hypersekrecí podjednotky α. Kromě těchto adenomů může být sekrece TSH sdružena s hypersekrecí růstového hormonu nebo prolaktinu. Somatotropní, laktotropní a tyreotropní buňky sdílejí společný transkripční faktor Pit-1. Vzácně se jedná o smíšenou sekreci TSH a gonadotropinů: FSH (hormon stimulující folikuly) a LH (luteinizační hormon). Plurihormonální charakter TSH produkujících adenomů se vyskytuje v 30 % [4].
U TSH produkujících adenomů byl prokázán monoklonální původ [17]. Přesný mechanizmus vzniku transfomace hypofyzárních buněk není znám. U plurihormonálních adenomů není jasné, zda pocházejí z nediferencovaných kmenových buněk nebo dediferencovaných zralých hypofyzárních buněk. Genetické studie zatím neprokázaly, které mutace vedou ke vzniku těchto adenomů, s výjimkou ojedinělých případů, v nichž adenom secernující TSH tvořil součást syndromu mnohočetné endokrinní neoplazie (MEN) [18], McCuneova-Albrightova syndromu [19] nebo syndromu familiárních izolovaných hypofyzárních adenomů (FIPA) [20].
TSH produkující adenomy jsou charakteristické invazivním růstem a často i tuhou, fibrózní konzistencí. Tyto vlastnosti vznikají nejspíše působením bFGF (bazický fibroblastový růstový faktor), který je ve zvýšené míře exprimován buňkami tyreotropinomů [21]. Karcinom se sekrecí TSH s mnohočetným metastatickým postižením byl popsán pouze u 3 pacientů [22–24].
Klinický obraz
Adenomy produkující tyreotropin se mohou vyskytovat v jakémkoliv věku, nejčastěji v 5. a 6. dekádě, se stejným výskytem u žen a mužů [25]. Pro onemocnění jsou typické klinické příznaky hypertyreózy různého stupně. Kardiovaskulární symptomy spojené s tyreotoxikózou, ke kterým patří tachykardie, fibrilace síní a srdeční selhání, jsou popisovány výjimečně [26]. Na rozdíl od imunogenní toxikózy nejsou přítomny extratyreoidální systémové projevy jako endokrinní oftalmopatie a kožní změny, třebaže jednostranný exoftalmus byl opakovaně popsán v důsledku orbitální invaze adenomem [27]. V 90 % se vyskytuje struma, často s uzlovou přestavbou [28]. V několika případech byl prokázán diferencovaný karcinom štítné žlázy. U pacientů s tyreotropinomy je odhadovaná prevalence výskytu karcinomu štítné žlázy 4,8 % [29]. V případě chybné diagnózy při záměně Gravesovy hypertyreózy za TSH secernující adenom s následnou subtotální tyreoidektomií dochází k recidivě strumy a hypertyreózy. V některých případech se adenomy projeví až příznaky z lokální expanze (75 % adenomů se sekrecí TSH je diagnostikováno až ve stadiu makroadenomu) [30]. U nemocných se smíšenou sekrecí TSH a růstového hormonu nebo prolaktinu, může být manifestní pouze klinika akromegalie či hyperprolaktinemie.
Diagnostika
Diagnostika spočívá v hormonálním vyšetření včetně dynamických testů a vyšetření hypofyzární oblasti magnetickou rezonancí.
Laboratorní diagnostika se zakládá na přítomnosti zvýšených (70 % nemocných) nebo jen nesuprimovaných (30 % případů) koncentrací TSH při zvýšených hodnotách periferních hormonů – volného tyroxinu (fT4) a volného trijodtyroninu (fT3). Hladiny celkového tyroxinu mohou být normální. Zvýšení TSH nekoreluje se závažností hypertyreózy. Molekuly TSH secernované adenomem mohou mít normální, snížený nebo zvýšený poměr mezi biologickou a imunologickou aktivitou [31]. Příčinou je rozdílná glykozylace cirkulujících molekul TSH [32]. Hodnoty TSH nekorelují s velikostí adenomu ani s prognózou onemocnění.
Pokud je dostupné, pak je cenné vyšetření podjednotky α. U TSH secernujících adenomů hypofýzy bývá podjednotka α (α-SU) zvýšená v 35–60 % případů [25,33], může být ale zvýšená u afunkčních hypofyzárních tumorů nebo u akromegalie. Normální hodnoty jsou častější u pacientů s mikroadenomy se sekrecí TSH [25,33]. Pro TSH secernující tumor svědčí poměr α-SU⁄TSH > 1 [34], ten se ale může vyskytnout i u postmenopauzálních žen a nemocných s primárním hypogonadizmem. Dalším pomocným laboratorním parametrem je stanovení SHBG (globulin vázající pohlavní hormony), který bývá zvýšený u TSH secernujících adenomů a normální u rezistence na tyreoidální hormony, je však potřebné použít normy s ohledem na věk a pohlaví [35]. SHBG může být falešně nízké u hypofyzárních tumorů se smíšenou nadprodukcí růstového hormonu a TSH, naopak terapie estrogeny SHBG zvyšuje.
V diagnostice tyreotropinomů se využívají i dynamické testy. 80 % pacientů s TSH secernujícími tumory má sníženou odezvu TSH v TRH testu (< 150 % bazálních hodnot) [25,34], normální vzestup TSH ale tyreopinom nevylučuje. Testem s nejvyšší specificitou a senzitivitou je supresní test s trijodtyroninem. Po 10denním podání trijodtyroninu (80–100 µg denně) nedochází téměř u žádného z nemocných k normální supresi TSH, která je vždy přítomna u zdravých [36]. Supresní test je kontraindikován u starších pacientů a nemocných s ischemickou chorobou srdeční.
Zobrazovací metody
Podobně jako u ostatních expanzivních procesů v selární oblasti je vyšetření magnetickou rezonancí metodou volby. Tyreotropinomy jsou v 80 % případů zachyceny jako makroadenomy, v 70 % mají výrazný supraselární růst a šíří se i paraselárně a intrasfenoidálně [25,37,38]. Některé jsou vysoce invazivní a šíří se do hypotalamu, orbit a komprimují mozkový kmen. Invazivně rostoucí makroadenomy jsou často nalézány u nemocných, u kterých byla provedena tyreoidektomie či radioablace štítné žlázy vzhledem k chybné diagnóze primární hypertyreózy. Popisovaný je i ektopicky v nazofaryngu uložený tyreotropinom zjištěný při CT vyšetření [39].
Diferenciální diagnostika
Příčinou elevace tyreoidálních hormonů při nesuprimovaném TSH může být celá řada.
Příčinou elevace celkových hormonů je často vzestup vazebných proteinů (tyroxine binding globulin – TBG, albumin, prealbumin), těhotenství, terapie estrogeny a tamoxifenem, jaterní choroby nebo vzácně jejich vrozený vzestup. Vzhledem k tomu, že se v současné době rutinně stanovují volné hormony štítné žlázy, nedochází k diagnostickým omylům.
Situace je složitější, je-li při nesuprimovaném TSH zvýšený i fT4 (fT3). Výsledné hodnoty fT4 mohou být ovlivněny faktory, které interferují s imunoanalytickým stanovením, ke kterým patří protilátky proti jodotyroninům [40], heterofilní protilátky, které blokují analytické protilátky [41], frakcionovaný a nefrakcionovaný heparin (heparin aktivací lipoproteinové lipázy zvyšuje podíl volných mastných kyselin v séru, které vytěsňují T4 z vazby na proteiny), familiární dysalbuminemická hypertyroxinemie [42]. Podobně může být i stanovení TSH (falešně vysoká hodnota) způsobeno vlivem interferujících protilátek.
Dalšími příčinami podobného laboratorního obrazu jsou odběr krve po požití levotyroxinu, špatná spolupráce pacienta (pacient dlouhodobě léky neužívá nebo je užívá nesprávným způsobem a poté několik dní před odběrem nebo v den odběru užívá vyšší dávku ve snaze kompenzovat předchozí vynechání, v těchto případech bývá TSH často zvýšené více, než je typické pro rezistenci na tyreoidální hormony), léky např. amiodaron, propranolol, jodové kontrastní látky (zvýšení TT4 a fT4 vzestupem vazebných proteinů a inhibicí jaterní dejodázy 1. typu) nebo celková závažná onemocnění. Přechodně zvýšené koncentrace tyroxinu v séru při nesuprimovaném TSH mohou být na začátku léčby L-tyroxinem, dříve než je dosaženo ekvilibrium s potlačeným TSH.
Důležité je odlišení rezistence na tyreoidální hormony (tab.).
Tab. 1. Diferenciální diagnóza TSH produkujících adenomů a rezistence na tyreoidální hormony 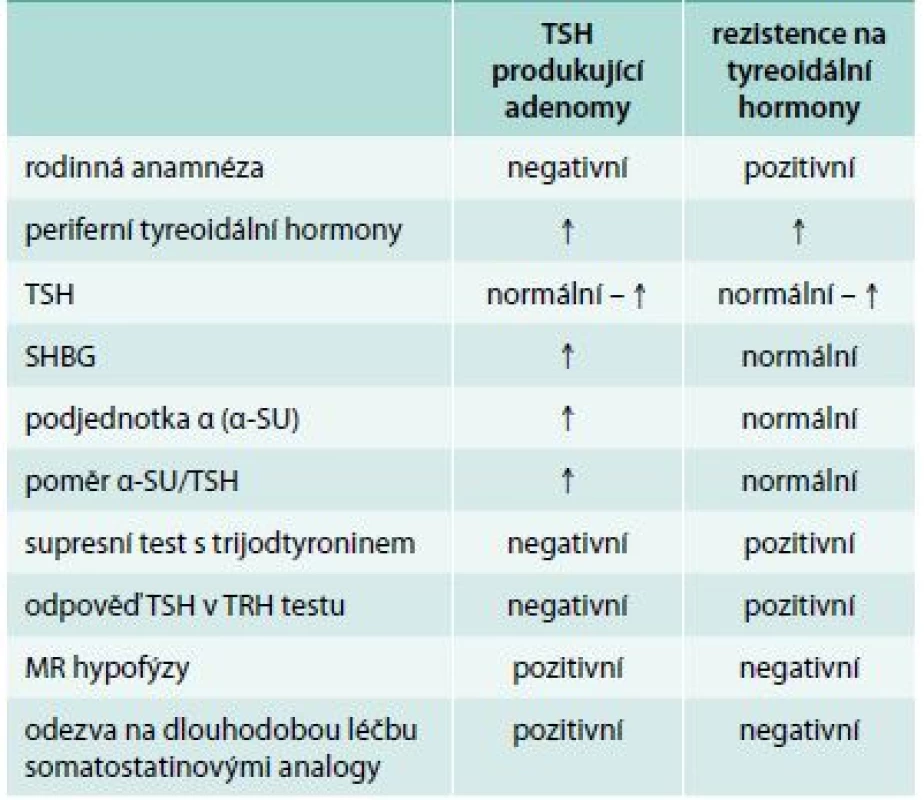
Jedná se o vzácné onemocnění, které je v 85 % případů způsobeno mutací genu pro tyreoidální hormony TRβ [43,44]. Typická je variabilita klinických příznaků, které jsou často mírné, a řada případů je zcela asymptomatická. Na základě klinického obrazu se rozlišuje generalizovaná rezistence (klinicky eutyreoidní či hypotyreoidní nemocný), hypofyzární rezistence (klinicky hypertyreoidní nemocný), event. i periferní rezistence (klinicky hypotyreoidní nemocný). Z patofyziologického hlediska jde o různé vyjádření rezistence v různých tkáních. Pro onemocnění je typická elevace tyreoidálních hormonů při nesuprimovaném TSH, častým nálezem je struma [45]. K záměně s tyreotropinomem může dojít zejména u hypofyzární rezistence. Odlišení je možné pomocí stanovení podjednotky α a SHBG, které jsou u rezistence na tyreoidální hormony normální, a dynamickými testy. Rezistenční syndromy mají normální nebo přehnanou reakci tyreotropinu v TRH testu a normální supresi po trijodtyroninu [46]. Nález při MR selární oblasti je u rezistenčních syndromů normální. Pro rezistenci na tyreoidální hormony je charakteristický familiární výskyt, genetické vyšetření potvrdí diagnózu onemocnění v 85 % případů.
Ještě vzácnější příčinou elevace tyreoidálních hormonů při nesuprimovaném TSH jsou vrozené poruchy transportu a metabolizmu tyreoidálních hormonů, ke kterým patří mutace genu SCL16A2 pro transportér tyreoidálních hormonů přes buněčnou membránu MCT8 a vrozené poruchy dejodace způsobené mutací SECISBP-2 (selenocystein incorporation sequence-binging protein) [45,46].
Adenomy secernující TSH mohou být vyvolány dlouhodobě probíhající těžkou hypotyreózou, zejména v dětském věku, v důsledku negativní zpětné vazby periferie. Charakter těchto adenomů je zcela odlišný od autonomních tyreotropinomů: zmenšují se při substituční léčbě, až nakonec zcela vymizí.
Léčba
Metodou volby je neurochirurgický operační výkon. Pouze přechodně před operací hypofýzy se doporučuje upravit hyperfunkční stav tyreostatiky. Symptomy hypertyreózy je možné ovlivnit podáváním betablokátorů. Tyreotropinomy jsou obvykle velké adenomy, proto bývá úplné odstranění adenomu s dlouhodobou remisí dosaženo u 40 % nemocných [47], recentní studie však udávají úspěšnost až u 80 % pacientů [48,49]. V případě parciálního operačního výkonu nebo recidivy adenomu je doporučována reoperace, medikamentózní léčba nebo radioterapie. Tyreotropinomy jsou obvykle velmi citlivé na léčbu depotními somatostatinovými analogy (SA) – lanreotidem a oktreotidem. K hormonální normalizaci dochází v 85–95 % [30,50], tedy v podstatně vyšším procentu než u akromegalií. Ke zmenšení velikosti adenomu dochází v 50 % [51]. Asi u 20 % nemocných dochází ke snížení účinnosti v průběhu léčby, většinou se dá překonat vystupňováním dávky. Rezistence k léčbě SA se vyskytuje výjimečně. Účinnost léčby mizí s jejím vysazením. Na našem pracovišti dáváme přednost ozáření pooperačních reziduí, pokud je to možné, tak Leksellovým gama nožem. Somatostatinová analoga užíváme v mezidobí mezi ozářením gama nožem a jeho účinkem. Neobáváme se rozvoje hypopituitarizmu, neboť je možné mu předejít, pokud je ozařovací dávka na zdravou hypofýzu < 15 Gy a ozařovací dávka na hypofyzární stopku < 17 Gy. Normalizaci hodnot hormonů štítné žlázy a TSH považujeme za uspokojivý efekt léčby. Definitivního vyléčení je dosaženo v případě, jsou-li koncentrace TSH supresibilní trijodtyroninem a stimulované pomocí TRH.
Podobně jako u jiných hypofyzárních adenomů je s ohledem na riziko recidivy onemocnění nutná dlouhodobá dispenzarizace.
MUDr. Jana Ježková, Ph.D.
fjjezek@cmail.cz
III. interní klinika 1. LF UK a VFN v Praze
www.vfn.cz
Doručeno do redakce 30. 8. 2016
Přijato po recenzi 13. 9. 2016
Zdroje
1. Davis JRE, Farrel WE, Clayton RN. Pituitary tumors. Reproduction 2001; 121(3): 363–371.
2. Raappana A, Koivukangas J, Ebeling T et al. Incidence of pituitary adenomas in Northern Finland in 1992–2007. J Clin Endocrinol Metab 2010; 95(9): 4268–4275. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2010–0537>.
3. Önnestam L, Berinder K, Burman P et al. National incidence and prevalence of TSH-secreting pituitary adenomas in Sweden. J Clin Endocrinol Metab 2013; 98(2): 626–635. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2012–3362>.
4. Saeger W, Lüdecke DK, Buchfelder M et al. Pathohistological classification of pituitary tumors: 10 years of experience with the German Pituitary Tumor Register. Eur J Endocrinol 2007; 156(2): 203–216.
5. Jailer JW, Holub DA. Remission of Graves´ disease following radiotherapy of a pituitary neoplasm. Am J Med 1960; 28 : 497–500.
6. Kovacs K, Horvath E. Tumors of the pituitary gland. In: Harthmann WH, Sobin LH. Atlas of Tumor Pathology, fascicle 21, series 2. Armed Forced Institute of Pathology: Washington, DC 1986.
7. Thotakura NR, LiCalzi L, Weintraub BD. The role of carbohydrate in thyrotropin action assessed by a novel method of enzymatic deglycosylation. J Biol Chem 1990; 265(20): 11527–11534.
8. Friedmann JM, Halaas JL. Leptin and the regulation of body weight in mammals. Nature 1998; 395(6704): 763–770.
9. Urman S, Critchlow V. Long-term elevations in plasma thyrotropin, but not growth hormone, concentrations associated with lesion –induced depletion of median eminence somatostatin. Endocrinology 1983; 112(2): 659–664.
10. Foord SM, Peters JR, Dieguez C et al. Dopamine receptors on intact anterior pituitary cells in culture: Functional association with the inhibition of prolactin and thyrotropin. Endocrinology 1983; 112(5): 1567–1577.
11. Fekete C, Kelly J, Mihaly E et al. Neuropeptide Y has a central inhibitory action on the hypothalamic - pituitary-thyroid axis. Endocrinology 2001; 142(6): 2606–2613.
12. Roelsfema F, Pereira AM, Biermasz NR et al. Diminished and irregular TSH secretion with delayed acrophase in patients with Cushing´s syndrome. Eur J Endocrinol 2009; 161(5): 695–703. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-09–0580>.
13. Hermus RM, Sweep CG, van der Meer MJ et al. Continuous infusion of interleukin-1 induces a non-thyroidal illness syndrome in the rat. Endocrinology 1992; 131(5): 2139 - 2146.
14. Van der Poll T, Romijn JA, Wiersinga WM et al. Tumor necrosis factor: A putative mediator of the sick euthyroid syndrome in man. J Clin Endocrinol Metab 1990; 71(6): 1567–1572.
15. Torpy DJ, Tsigos C, Lotsikas AJ et al. Acute and delayed effects of a single-dose injection of interleukin-6 on thyroid function in healthy humus. Metabolism 1998; 47(10): 1289–1293.
16. Banerjee AK, Sharma BS, Kak VK. Clinically and biochemically silent thyrotroph adenoma with oncocytic change. Neurol India 2000; 48(4): 374–377.
17. Ma W, Ikeda H, Watabe N et al. A plurihomonal TSH –producing pituitary tumor of monoclonal origin in a patient with hypothyroidism. Horm Res 2003; 59(5): 257–261.
18. Taylor TJ, Donlon SS, Bale AE et al. Treatment of a thyrotropinoma with octreotide – LAR in patient with multiple endocrine neoplasia 1. Thyroid 2000; 10(11): 1001–1007.
19. Gessl A, Freissmuth M, Czech T et al. Growth hormone-prolactin-thyrotropin-secreting pituitary adenoma in atypical McCune-Albright syndrome with functionally normal Gs alpha protein. J Clin Endocrinol Metab 1994; 79(4): 1128–1134.
20. Tichomirowa MA, Daly AF, Beckers A. Familiar pituitary adenomas. J Intern Med 2009; 266(1): 5–18. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2796.2009.02109.x>.
21. Ezzat S, Horvath E, Kovacs K et al. Basic fibroblast growth factor expression in two prolactin and thyrotropin-producing pituitary adenomas. Endocr Pathol 1995; 6(2): 125–134.
22. Mixson AJ, Friedman TC, Katz DA et al. Thyrotropin-secreting pituitary carcinoma. J Clin Endocrinol Metab 1993; 76(2): 529–533.
23. Brown RL, Muzzafar T, Wollman R et al. A pituitary carcinoma secreting TSH and prolactin: A non-secreting adenom agone awry. Eur J Endocrinol 2006; 154(5): 639–643.
24. Lee W, Cheung AS, Freilich R. TSH-secreting pituitary carcinoma with intrathecal drop metastase. Clin Endocrinol 2012; 76(4): 604–606. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2265.2011.04288.x>.
25. Socin HV, Chanson P, Delemer B et al. The changing spectrum of TSH-secreting pituitary adenomas: diagnosis and management in 43 patients. Eur J Endocrinol 2003; 148(4): 433–442.
26. George JT, Thow JC, Matthews B et al. Atrial fibrillation associated with a thyroid stimulating hormone-secreting adenoma of the pituitary gland leading to a presentation of acute cardiac decompensation: a case report. J Med Case Rep 2008; 28 : 67. Dostupné z DOI: <http://dx.doi.org/10.1186/1752–1947–2-67>.
27. Yovos JG, Falko JM, O´Dorisio TM et al. Thyrotoxicosis and a thyrotroping-sereting pituitary tumor causing unilateral exophtalmos. J Clin Endocrinol Metab 1981; 53(2): 338–343.
28. Poggi M, Monti S, Pascucci C et al. A rare case of follicular thyroid carcinoma in a patient with thyrotropin-secreting pituitary adenoma. Am J Med Sci 2009; 337(6): 462–465. Dostupné z DOI: <http://dx.doi.org/10.1097/MAJ.0b013e3181949948>.
29. Perticone F, Pigliaru F, Marriotti S et al. Is the incidence of differentiated thyroid cancer increased in patients with thyrotropin-secreting adenomas? Thyroid 2015; 25(4): 417–424. Dostupné z DOI: <http://dx.doi.org/10.1089/thy.2014.0222>.
30. Kuhn JM, Arlot S, Lefebvre H et al. Evaluation of the treatment of thyroid-secreting pituitary adenomas with a slow release of the somatostatin analog lanreotide. J Clin Endocrinol Metab 2000; 85(4): 1487–1491.
31. Beck-Peccoz P, Persani L. Variable biological activity of thyroid-stmulating hormone. Eur J Endocrinol 1994; 131(4): 331–340.
32. Magner JA, Klibanski A, Fein H et al. Ricin and lentil lectin affinity chromatografy reveals oligosaccharide heterogenity of thyrotropin secreted by 12 human pituitary tumors. Metabolism 1992; 41(9): 1009–1015.
33. Losa M, Giovanelli M, Persani L et al. Criteria of cure and follow-up of central hyperthyroidism due to thyrotropin-secreting pituitary adenomas. J Clin Endocrinol Metab 1996; 81(8): 3084–3090.
34. Brucker-Davis F, Oldfield EH, Skarulis MC et al. Thyrotropin-secreting pituitary tumors: Diagnosis criteria, thyroid hormone sensitivity, and treatment outcome in 25 patients followed at the National Institutes of Health. J Clin Endocrinol Metab1999; 84(2): 476–486.
35. Beck-Peccoz P, Roncoroni R, Mariotti S et al. Sex hormone-binding globulin measurement in patients with inappropriate secretion of thyrotropin (IST): evidence against selective pituitary thyroid hormone resistance in nonneoplastic IST. J Clin Endocrinol Metab 1990; 71(1): 19–25.
36. Beck-Peccoz P, Persani L. TSH-producing adenomas. In: Jameson JL, DeGroot LJ (eds). Endocrinology. 5th ed. Saunders USA: 2006 : 324–332. ISBN 9780721603766.
37. Beck-Peccoz P, Persani L, Mannavola D et al. Pituitary tumours: TSH-secretin adenomas. Best Pract Res Clin Endocrinol Metab 2009; 23(5): 597–606. Dostupné z DOI: <http://dx.doi.org/10.1016/j.beem.2009.05.006>.
38. Clarke MJ, Erickson D, Castro MR et al. Thyroid-stimulating hormone pituitary adenomas. J Neurosurg 2008; 109(1): 17–22. Dostupné z DOI: <http://dx.doi.org/10.3171/JNS/2008/109/7/0017>.
39. Cooper DS, Wening BM. Hyperthyroidism caused by an ectopic TSH-secreting pituitary tumor. Thyroid 1996; 6(4): 337–343.
40. Glendenning P, Siriwardhana D, Hoad K et al. Thyroxine autoantibody interference is an uncommon cause of inappropriate TSH secretion using the Immulite 2000 assay. Clin Chim Acta 2009; 403(1–2): 136–138. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cca.2009.02.002>.
41. Tan MJ, Tan F, Hawkins R et al. A hyperthyroid patient with measurable thyroid-stimulating hormone concentration – a trap for the unwary. Ann Acad Med Singapore 2006; 35(7): 500–503.
42. Cartwright D, O´Shea P, Rajanayagam O et al. Familiar dysalbuminemic hyperthyroxinemia: A persistent diagnostic challenge. Clin Chem 2009; 55(5): 1044–1046. Dostupné z DOI: <http://dx.doi.org/10.1373/clinchem.2008.120303>.
43. Slezak R, Lukienczuk T, Noczynska A et al. A novel p.E311K mutation of thyroid receptor beta gene in resistence to thyroid hormone syndrome, inherited in autosomal recessive trait. Horm Metab Res 2012; 44(9): 704–707. Dostupné z DOI: <http://dx.doi.org/10.1055/s-0032–1312666>.
44. Dumitrescu AM, Refetoff S. The syndromes of reduced sensitivity to thyroid hormone. Biochim Biophys Acta 2013; 1830(7): 3987–4003. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bbagen.2012.08.005>.
45. Weiss WR, Refetoff S. Resistance to Thyroid Hormone (RTH) (non TR - RTH). Hot Thyroidol 2009; 9 : 1–11.
46. Gurnell M, Halsall DJ, Chatterjee VK. What should be done when thyroid function tests do not make sense? Clin Endocrinol 2011; 74(6): 673–678. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2265.2011.04023.x>.
47. Beck-Peccoz P, Brucker-Davis F, Persani L et al. Thyrotropin-secreting pituitary tumors. Endocr Rev 1996; 17(6): 610–638.
48. Yamada S, Fukuhara N, Horiguchi K et al. Clinicopathological characteristics and therapeutic outcomes in thyrotropin-secreting pituitary adenomas: a single-center study of 90 cases. J Neurosurg 2014; 121(6): 1462–1473. Dostupné z DOI: <http://dx.doi.org/10.3171/2014.7.JNS1471>.
49. Kirkman MA, Jaunmutkane Z, Brandner S et al. Active and silent thyroid-stimulating hormone-expressing pituitary adenomas: presenting symptoms, treatment, outcomes, and recurrence. World Neurosurg 2014; 82(6): 1224–1231. Dostupné z DOI: <http://dx.doi.org/10.1016/j.wneu.2014.03.031>.
50. Caron P, Arlot S, Bauters C et al. Efficacy of the long-acting octreotide formulation (octreotide-LAR) in patients with thyrotropin-secreting pituitary adenomas. J Clin Endocrinol Metab 2001; 86(6): 2849–2853.
51. Beck-Peccoz P, Persani L. Medical management of thyrotropin-secreting pituitary adenomas. Pituitary 2002; 5(2): 83–88.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2016 Číslo Suppl 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Magnosolv a jeho využití v neurologii
- Pioglitazon jako nákladově efektivní antidiabetikum s prokázaným kardiovaskulárním přínosem
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Zásobení jodem u těhotných žen v České republice
-
Řešení jodového deficitu v České republice – historie a současný stav
20 let práce prof. MUDr. Václava Zamrazila v Meziresortní komisi pro řešení jodového deficitu - Psycho-imuno-endokrinologie štítné žlázy
- Karcinomy štítné žlázy – současné léčebné postupy
- Vitamin D a autoimunitní tyreopatie
- Testosteron a mortalita
- Vrozená adrenální hyperplazie v dospělosti
- Polyfarmakoterapie nahlížená nejen prizmatem multimorbidity, ale jako další geriatrický syndrom
- Mnohočetná endokrinní neoplazie I (Wermerův syndrom) – formy klinické manifestace: 5 kazuistik
- Priebeh ochorenia u pacientov s diferencovaným mikrokarcinómom štítnej žľazy pri použití rôznych liečebných postupov
- Projekt SPACE (Stav Pacientů Akceptovaných diabetologem Cestou Exportu)
- Zásobení jodem a jodurie obyvatel v České republice v letech 1995–2016
- Prof. MUDr. Václav Zamrazil, DrSc., slaví 80. narozeniny
- Jodurie u nemocných s diabetes mellitus 1. typu Vztahy k vybraným parametrům charakterizujícím diabetický syndrom
- Nádory štítné žlázy u dětí a dospívajících a jejich molekulárně genetická podstata
- Endokrinní komplikace moderní onkologické léčby
- Václav Zamrazil osmdesátníkem
- Léčba levotyroxinem – faktory ovlivňující její úspěšnost
- Endokrinní orbitopatie – téma stále živé
- Jsou tyreoidální hormony a tyreotropin asociovány s kardiometabolickými riziky a inzulinovou rezistencí u eutyreoidních jedinců?
- Současnost a perspektivy léčby akromegalie
- Kardiorenální syndrom – biomarkery a mediátory
- TSH produkující adenomy
- Centrální poruchy funkce štítné žlázy
- Vitamín D a syndróm polycystických ovárií
- Tyreoidální hormony a kardiovaskulární systém
- Endokanabinoidný systém a kosť
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Vrozená adrenální hyperplazie v dospělosti
- Mnohočetná endokrinní neoplazie I (Wermerův syndrom) – formy klinické manifestace: 5 kazuistik
- Vitamin D a autoimunitní tyreopatie
- Centrální poruchy funkce štítné žlázy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



