-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Psycho-imuno-endokrinologie štítné žlázy
Psycho-immuno-endocrinology of the thyroid gland
Historically endocrinologists and psychiatrists are aware that disturbances in thyroid disease in beginning or even in clinically intensified states of thyrotoxicosis or hypothyroidism exhibit pathological mental manifestations, masking or potentiating the underlying disease. Immune system disorders cause thyroid organ-specific autoimmune process. This autoimmune thyroid disease binds with a number of disorders in both endocrine or non-endocrine organs. This appears in vascular, neurological, skin, connective tissue, gastrointestinal tract and mental pathology. These disorders are part of autoimmune polyglandular syndromes (APS) type I –III, especially the APS type III. Originally it was assumed that these mental disorders are caused by direct exposure to excess or deficiency of thyroid hormones. Recently, however, it appears that these psycho-immune-endocrine disorders have common etiologic mechanisms of formation and on cellular and molecular level they involve similar, if not in some cases, common mechanisms.
Key words:
antithyroid peroxidase antibody – autoimmune polyglandular syndrome type I., II., III. – autoimmune thyroid disease – bipolar disorder – depression – Hashimoto’s encephalopathy – postpartum psychosis – psycho-immuno-endocrinology – schizophrenia
Autoři: Ivan Šterzl; Karolína Absolonová; Petr Matucha
Působiště autorů: Oddělení klinické imunoendokrinologie Endokrinologického ústavu, Praha
Vyšlo v časopise: Vnitř Lék 2016; 62(Suppl 3): 107-114
Kategorie: Přehledné referáty
Souhrn
Historicky si endokrinologové a psychiatři uvědomují, že poruchy v oblasti štítné žlázy se v začátcích onemocnění nebo i v klinicky vystupňovaných stavech hypotyreózy či tyreotoxikózy projevují patologickými psychickými projevy maskujícími nebo potencujícími základní onemocnění. Poruchy imunitního systému vyvolávají postižení štítné žlázy orgánově specifickým autoimunitním procesem. Toto autoimunitní poškození štítné žlázy se váže s řadou poruch v oblastech jak endokrinních, tak neendokrinních orgánů, a to v oblasti vaskulární, neurologické, kožní, pojivové tkáně, gastrointestinálního traktu, ale také v oblasti psychických poruch. Tyto poruchy jsou součástí autoimunitních polyglandulárních syndromů (APS) I.–III. typu, zvláště pak APS III. typu. Původně se předpokládalo, že psychické poruchy jsou zapříčiněny přímým působením nadbytku nebo nedostatku hormonů štítné žlázy. V poslední době se však ukazuje, že tyto psycho-imunitně-endokrinní poruchy mají společné etiologické mechanizmy vzniku a na buněčné a molekulární úrovni se jich účastní podobné, ne-li v některých případech společné mechanizmy.
Klíčová slova:
autoimunitní onemocnění štítné žlázy – autoimunitní polyglandulární syndromy I., II. a III. typu – bipolární onemocnění – deprese – Hashimotova encefalopatie – laktační-poporodní psychóza – protilátky proti tyreoidální peroxidáze – psycho-imuno-endokrinologie – schizofrenieÚvod
V roce 1874 William W. Gull poprvé při své přednášce popsal hypotyreózu u dospělého jedince v Londýnské klinické společnosti [1]. Na první souvislost mezi hypofunkcí štítné žlázy a psychickými onemocněními upozornil již v roce 1888 Výbor pro myxedém Londýnské klinické společnosti. Výbor informoval o 109 pacientech trpících myxedémem a poznamenal, že „bludy a halucinace se vyskytují u téměř poloviny případů, hlavně těch, u nichž je nemoc již pokročilá“ [2]. Rakouský psychiatr Julius Wagner von Jauregg se zabýval studiem vztahu hypofunkce štítné žlázy (myxedému) a psychických onemocnění. Určil jako příčinu myxedému nedostatek jodu a jako první navrhl jodizaci soli [3]. Také jako první léčil psychiatrická onemocnění aktivací imunitního systému pomocí infekce – malarioterapií [4], za kterou dostal v roce 1927 Nobelovu cenu za medicínu. V roce 1949 Asher potvrdil tento vzájemný vztah mezi psychózou a hypotyreózou a přidal do terminologie pojem „myxedema šílenství“ [5].
Poruchy psychiky u hypofunkce a hyperfunkce štítné žlázy mohou zakrývat i komplikovat klinický projev onemocnění. Psychické projevy u hyperfunkce – tyreotoxikózy – jsou popisovány jako pocity obav, napětí, emoční lability, podrážděnosti, netrpělivosti, nekoordinovaná hyperaktivita, přehnaná přecitlivělost na zvuk a opakující se deprese. Psychické projevy u hypotyreózy jsou popisovány jako výrazné zpomalení všech mentálních procesů, prohlubující se ztráta zájmu a iniciativy, potíže s pamětí, snadné pomatení myšlenek, celkové zhoršení intelektu, deprese s paranoidními znaky a organické psychózy [6].
Jako první kombinaci endokrinních a neendokrinních onemocnění zaznamenal již v roce 1855 Addison. Popsal kombinaci perniciózní anémie, idiopatické nadledvinové insuficience a vitiliga, což dalo základ studiu polyglandulárních onemocnění. Schmidt ve 20. letech minulého století popsal kombinaci adrenalitidy a tyreoiditidy, která byla nazvána Schmidtův syndrom. Významným mezníkem při sledování rozvoje autoimunity štítné žlázy byla pozorování manželů Roittových, kteří jako první v 50. letech 20. století popsali autoprotilátky proti štítné žláze. V 60. letech minulého století Carpenter popsal kombinaci adrenalitidy s diabetes mellitus 1. typu a tyreoiditidou. Tato kombinace byla nazvána Carpenterův syndrom. Schmidtův a Carpenterův syndrom jsou součástí APS II. typu [7]. Představa navzájem se prolínajících autoimunitních poruch endokrinního systému byla definována v roce 1980 Blizzardem a Neufeldem jako autoimunitní polyglandulární (polyendokrinní) syndrom (APS). Blizzard a Neufeld také stanovili kritéria pro APS I., II. a III. typu, která se postupně doplňovala [8] (tab. 1).
Tab. 1. Autoimunitní polyglandulární syndromy I.–III. typu podle Blizzarda a Neufelda 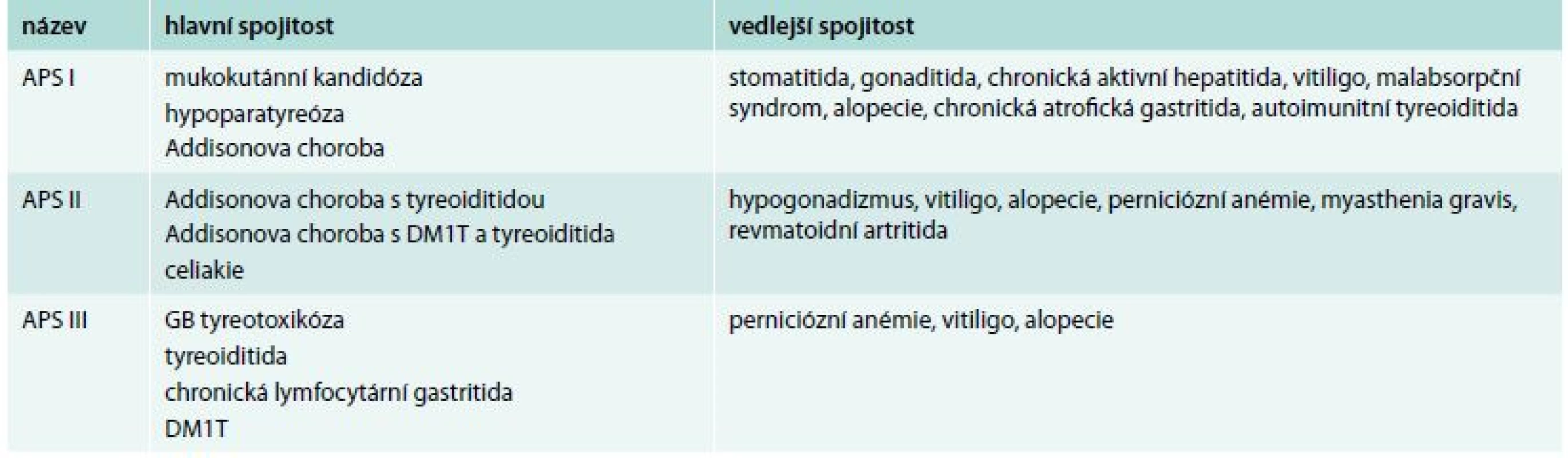
DM1T – diabetes mellitus 1. typu GB – Gravesova-Basedowova Významný předěl v pochopení autoimunitních onemocnění a jejich kombinace nastal v roce 1995, v němž mladý postgraduální student Peterson popsal při studijním pobytu ve Finsku autoreaktivní gen AIRE (autoimunitu regulující gen/autoimmune regulator) a jeho mutace, jako příčinu onemocnění. Tím otevřel řadě badatelů možnost poprvé studovat monogenní autoimunitní onemocnění – APS I. typu [9].
Autoimunitní tyreoiditida je součástí všech tří APS syndromů. Nejvýznamnější pro tuto problematiku je III. typ APS dříve nazývaný „tyreogastrický syndrom“. Je prozatím nejhůře charakterizován, ale nejčastěji popisován. Charakterizuje ho výskyt autoimunitní tyreopatie – autoimunitní tyreoiditida s Gravesovou-Basedowovou (GB) tyreotoxikózou – spolu s autoimunitním poškozením jiných orgánů. V této kombinaci není zahrnuta klinicky plně rozvinutá Addisonova choroba. Od roku 2003 se APS III. typu podle vazby autoimunitní tyreopatie k ostatním endokrinním a neendokrinním orgánům dělí na 4 podskupiny (A–D), a to:
- APS IIIA – je-li vazba s nemocemi endokrinního systému výraznější
- APS IIIB – je-li vazba s autoimunitními onemocněními gastrointestinálního traktu (ulcerózní kolitida, Crohnova choroba)
- APS IIIC – je-li vazba s kožními, hematologickými a nervovými projevy výraznější
- APS IIID – je-li vazba s autoimunitními onemocněními pojivové tkáně – [10] (tab. 2)
Tab. 2. Klasifikace APS III. typu podle Betterle 2001 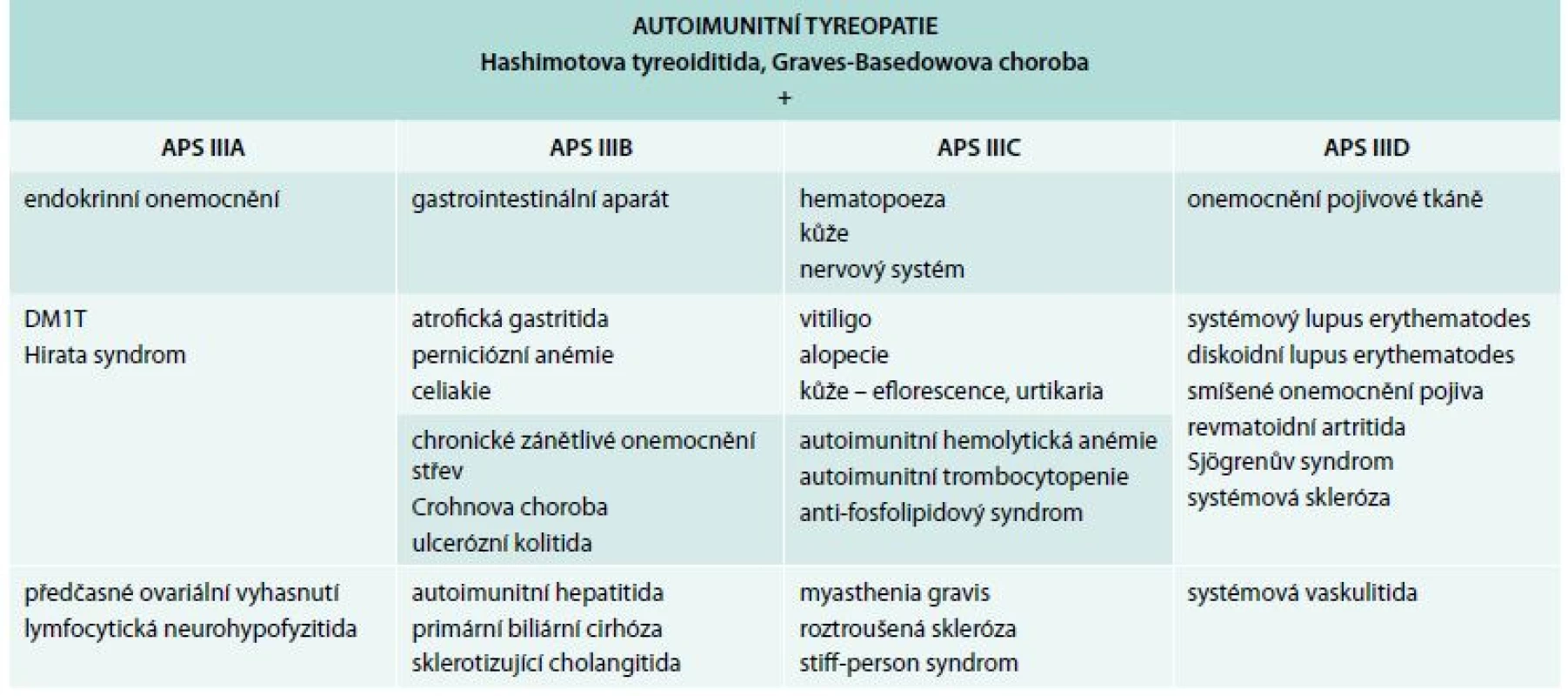
Přesto, že se charakterizovaly jednotlivé podskupiny APS III. typu, ukazuje se, že psychická onemocnění se mohou vázat napříč (A–D) podskupin, a to nejčastěji s podskupinou B.
Etiologie a patogeneze
Vliv hormonů štítné žlázy na psychiku
Autoimunitní tyreoiditida se ve svém počátku projevuje bolestí v oblasti štítné žlázy a systémovými příznaky. Jsou přítomny snížené hladiny TSH, snížené vychytávání radioaktivního jodu a zvýšené sérové autoprotilátky proti tyreoglobulinu (anti-Tgl) a proti tyreoidální peroxidáze (anti-TPO). K běžným příznakům patří nesnášenlivost tepla, nadměrné pocení, úbytek na váze, bušení srdce a gastrointestinální obtíže a různé psychické příznaky [11]. Nicméně, psychóza a náhlá zmatenost jsou v počáteční fázi hypertyreózy vzácností, ale přesto není pochyb, že hormony štítné žlázy hrají významnou roli v regulaci nálady, poznávání a chování [12].
Mozek má jedinečnou citlivost na hormony štítné žlázy a dovede je využít odlišně od jiných orgánů [13]. K tomu slouží v mozku specifické receptory. V limbickém systému, zejména amygdale a hipokampu, se nalézá velká koncentrace T3 receptorů ovlivňující emoce, chování a dlouhodobou paměť. Z dalších mechanizmů ovlivňujících mozek je to např. nadbytek hormonů štítné žlázy, který ovlivňuje neurotransmitery, jako je serotonin a dopamin [14]. Navíc se katecholaminy a hormony štítné žlázy mohou uplatnit ve změněné odezvě β-adrenergních receptorů. Tato interakce mezi katecholaminy a hormony štítné žlázy v CNS je posílena jejich společným původem z aminokyseliny tyrozinu. Jejich synergizmus se uplatňuje v řadě dalších metabolických procesů [15].
Rozvoj autoimunitních poruch štítné žlázy a jejich vliv na psychiku
Při vzniku více než 80 % případů postižení štítné žlázy se uplatňují imunopatologické reakce vyvolávající autoimunitní proces. Ten je důsledkem prolomení tolerance vlastních antigenů. Tato tolerance je zajišťována jak centrálně (v thymu – pozitivní a negativní selekcí T-lymfocytů), tak na periferii (na základě afinity a pevnosti vazby antigenu s B-lymfocyty a T-lymfocyty).
Při rozvoji autoimunitního procesu se uplatňuje řada faktorů. Vnitřním faktorem je především genetická predispozice, dále jsou to zevní (epigenetické) faktory, a to např. virové a bakteriální infekce (antigenní mimikry), dále karence např. vitaminu D, změny koncentrace těžkých kovů a poruchy při udržení homeostázy vnitřního prostředí cílového orgánu. Významný vliv při rozvoji autoimunity a psychických onemocnění má také chronický stres ovlivňující rozvoj imunopatologických reakcí [16].
Genetika a zevní faktory
Hlavním genetickým faktorem pro rozvoj autoimunitních poruch je polymorfizmus hlavního histokompatibilního komplexu HLA (lidský lymfocytární antigen), dále defekty apoptotických genů (Fas/FasL), mikrosatelitních genů (SSLP) a genů pro imunodeficience [17,18]. Imunodeficit je X-vázaná imunologická a vývojová porucha způsobená mutacemi v genu kódujícím nukleární faktor kB (NF-kB). NF-kB je významný transkripční regulátor pro vývoj ektodermální, adaptivní imunitní funkce [18–20].
Ze zevních faktorů v poslední době nabývá největší význam střevní mikrobiota, která je nedílnou součástí osy střevo-mozek. Přítomnost zdravé a různorodé střevní mikroflóry je důležitá pro normální kognitivní a emoční zpracování vjemů [21]. Dále v etiopatogenezi autoimunit je nutné věnovat zvláštní pozornost hygienické hypotéze a tradičním stravovacím zvyklostem, které mohou ovlivnit jak rozvoj autoimunit, tak i duševní zdraví [22]. Jedním z dalších mechanizmů v etiopatogenezi autoimunit je porucha endogenního lipidového signalizačního systému – endokanabinoidního systému (ECB), jehož regulace je při depresi poškozena [23].
Buněčná složka imunity
Významný při regulaci rozvoje autoimunity je stav lokálního mikroprostředí postiženého orgánu, který je reprezentován zastoupením pomocných lymfocytárních subpopulací TH1, TH2, TH3, TH17, Treg a cytotoxických lymfocytů (TC), které mají odlišné, v některých případech i protichůdné funkce [7].
TH1 lymfocyty se za fyziologických podmínek uplatňují především v obraně proti intracelulárním patogenům (virové infekce, nádorové bujení) aktivací makrofágů a především preTC lymfocytů. PreTC lymfocyty se aktivují po rozpoznání antigenu ve vazbě na HLA I. třídy a prostřednictvím cytokinů produkovaných TH1 lymfocyty (IFNγ, IL2, TNFα) dozrávají v plnohodnotný TC lymfocyt. TC lymfocyt se naváže na cílovou buňku, kterou zabíjí uvolněním perforinů a granzymů. V takto poškozené buňce se aktivuje vlastní programovaná smrt – apoptóza. Imunopatologická reakce 4. typu – oddálené přecitlivělosti (buňkami zprostředkovaná autoimunita) aktivuje TC lymfocyty k cílené destrukci vlastní autoantigenem označené tkáně, při rozvoji orgánově specifického autoimunitního onemocnění, jako je např. autoimunitní tyreoiditida, adrenalitida, hypofyzitida atd. [24].
TH2 lymfocyty produkcí cytokinů (IL4, IL5, IL6, IL10, IL13) aktivují B-lymfocyty, které se mění na plazmatické buňky. Ty začnou produkovat množství specifických protilátek proti cílovým antigenům. V případě imunopatologické reakce zprostředkované protilátkami se autoprotilátky proti TSH receptoru naváží na TSH receptor a mohou jej buď stimulovat za rozvoje GB tyreotoxikózy, nebo vyblokovat, jako v případě atrofické tyreoiditidy [25].
TH17 lymfocyty jsou nezávislé na TH1 a TH2 lymfocytech. Produkují cytokiny (IL17, IL17F, IL21, IL22 a IL26), které hrají významnou roli při rozvoji zánětu a autoimunitního procesu [26].
Populace T regulačních lymfocytů (Treg) blokuje působení efektorových B-lymfocytů a T-lymfocytů.
Treg lymfocyty se dělí do 3 skupin:
- TH3
- TR1
- CD4+ CD25+ FoxP3+
Tyto Treg lymfocyty představují asi 0,5–5,5 % periferních mononukleárních buněk. Vlastnosti Treg buněk jsou vázány na morfologii a funkci dendritických buněk ve spádových uzlinách. Treg buňky navozují supresi efektorových lymfocytů, a to jak přímým kontaktem (nikoli cytokiny), tak produkcí TGFα a IL10 cytokinů, které zabraňují antigen prezentujícím buňkám (APC) aktivovat efektorové TH1 a TH2 lymfocyty. Gen FoxP3 (forkhead box P3 – známý také jako scurfin) produkuje povrchový protein, který blokuje aktivaci genu pro IL2. Potom TH1 lymfocyty nejsou schopny mediovat maturaci preTC na TC lymfocyt. Treg buňky zabraňují rozvoji autoimunitního procesu a jsou schopny autoimunitní onemocnění revertovat. Dále umožňují blokaci odhojení transplantátu. Na druhé straně jsou odpovědné za oslabení imunitního dozoru vůči rozvoji nádorů a infekcí [27]. Mezi lymfocyty se supresní aktivitou jsou také zařazovány T-lymfocyty, které neprocházejí maturací v thymu.
Autoprotilátky
O roli autoprotilátek proti štítné žláze, a to především anti-TPO, se dlouhodobě spekuluje ohledně jejich úlohy v etiopatogenezi autoimunitní tyreoiditidy. Poškození buněk štítné žlázy u pacientů s autoimunitní tyreoiditidou je způsobeno především TH1 mediovanou aktivací TC lymfocytů a autoprotilátky přitom mají spíše informační a diagnostický význam. Přesto je úloha autoprotilátek proti štítné žláze nadále studována.
Autoprotilátky mohou za fyziologických podmínek aktivovat komplementovou kaskádu a protilátkami zprostředkovanou buněčnou cytotoxicitu (ADCC). V primární imunitní reakci (v tkáňové kultuře) se mohou uplatnit obě reakce a monocyty, prostřednictvím svého Fcγ RIIA, mohou k destrukci buněk štítné žlázy (ADCC – antibody–dependent cellular cytotoxicity) přispět. Toto působení se však při rozvoji autoimunitní tyreoiditidy u pacienta zatím neprokázalo [28].
U 20 % jedinců s ultrasonografickým obrazem autoimunitní tyreoiditidy jsou protilátky negativní [29]. To odpovídá blokaci TH2 odpovědi a produkci protilátek při převaze tvorby cytokinů TH1 lymfocytů a rozvoje destrukce cílové tkáně [30]. Kromě toho mohou být autoprotilátky proti štítné žláze přítomny u pacientů bez klinických známek tyreoiditidy [31]. Samotná přítomnost anti-Tgl není spojována s destrukcí štítné žlázy [32]. Přesto vliv autoprotilátek nemůžeme vyloučit v etiopatogenezi u polyglandulární autoimunity při vazbě na psychická onemocnění, a to především na APS III. typu [33].
Ve Spojených státech a Nizozemí [34] byla hodnocena prevalence anti-TPO u bipolární psychózy. Anti-TPO byly častější u bipolárních pacientů (28 %) než u kontrolní populace (3–18 %) [35]. Po opakovaných nálezech postižení CNS u pacientů s tyreoiditidou byl navržen termín Hashimotova encefalopatie. Jedním ze zajímavých poznatků byl nález protilátek proti štítné žláze v mozkomíšním moku u pacientů s potvrzenou lézí v bílé hmotě mozku při reverzibilním MRI [36]. Na druhé straně jiní autoři tvrdí, že neexistuje žádný důkaz o patogenní roli protilátek proti štítné žláze u Hashimotovy encefalopatie a předpokládají, že tyto protilátky jsou pravděpodobně markery některých dalších autoimunitních poruch, které ovlivňují mozek [37]. Proto byl navržen termín steroid-responzivní encefalopatie spojená s autoimunitní tyreoiditidou (SREAT) [38]. Klinický nástup SREAT může být akutní nebo subakutní. Projevy mohou zahrnovat změnu úrovně vědomí, křeče, třes, myoklonus, ataxii nebo mrtvici podobnou epizodu [39].
Autoimunitní tyreopatie, psychické poruchy a APS
V etiopatogenezi autoimunitního postižení štítné žlázy, jak jsme se zmínili již výše, se uplatňují 2 imunopatologické reakce. Jednak reakce oddáleného typu, při níž se uplatňuje především buněčná destrukce cílové tkáně na podkladě aktivace TH1 a TC lymfocytů (autoimunitní tyreoiditida) a na druhé straně protilátkami zprostředkovaná imunopatologická reakce, při níž se uplatňují specifické anti-receptorové protilátky proti TSH receptoru (GB tyreotoxikóza). Autoprotilátky proti TPO a Tgl nejsou zaměřeny proti autoantigenu (ten není znám), nýbrž proti uvolněným cílovým antigenním strukturám autoimunitním procesem poškozeného orgánu.
Dále byla nalezena genetická asociace mezi bipolární poruchou a polymorfizmem genu pro Toll-like receptor (TLR) 4, který hraje významnou roli v rozpoznání patogenu v přirozené imunitě [40]. U bipolárních pacientů s autoimunitní tyreoiditidou byly nalezeny 2 specifické alely pro TLR4 a autoři se domnívají, že zvýšená náchylnost k infekcím a/nebo autoimunitním reakcím může být mechanizmem stojícím za rozvojem bipolárních poruch. Navíc při studiu dvojčat se ukázalo, že autoimunitní tyreoiditidu je možno brát jako možný endofenotyp pro bipolární poruchu [41].
Při patogenezi APS III, která je prozatím nejasná, se mohou uplatnit všechny výše zmíněné mechanizmy, ale stále je zde významné (obdobně jako u deprese) snížení reaktivity a počtu Treg lymfocytů. Jejich nedostatek umožňuje rozvoj autoimunitního procesu. Pokles Treg lymfocytů je významný při nedostatku aktivního vitaminu D, a tím se dá částečně vysvětlit, proč nedostatek osvitu ovlivní rozvoj autoimunitních onemocnění a deprese [42].
Hashimotova encefalopatie
Přechod od „Hashimotovy poruchy nálady“ na „Hashimotovou encefalopatii“ je jen otázkou spekulací. Za předpokladu, že by existovala přímá role protilátek proti štítné žláze v patologii CNS, potom každá počínající autoimunitní tyreoiditida s psychiatrickými příznaky může vyústit do závažné neurologické encefalopatie. Toto ovšem zatím nebylo prokázáno.
První případ popsaný jako bipolární porucha v souvislosti s Hashimotovou encefalopatií byl pacient s rozvíjející se hypertyreózou a patologickým EEG nálezem. Pacient reagoval na psychiatrickou léčbu, karbimazol a krátkodobou léčbu vysokými dávkami prednisolonu [43]. První informace o možném propojení mezi bipolárními poruchami a cirkulujícími protilátkami proti štítné žláze byla publikována v práci Haggerty et al [44]. V té době se předpokládalo, že případy Hashimotovy encefalopatie s poruchou nálady mohou představovat pouze špičku ledovce. To přesto nutně neznamená, že protilátky proti štítné žláze hrají přímou roli v patogenezi psychiatrického onemocnění [45]. Yoneda et al [46] poukázali na to, že současně protilátky proti amino-terminální oblasti α-enolázy hrají roli při rozvoji Hashimotovy encefalopatie. Vzhledem k tomu, že α-enoláza je exprimována v buňkách cévního endotelu, mohou být autoprotilátky proti tomuto enzymu spojené i s vaskulitidami v rámci APS IIID typu. Drexhage et al [47] navíc poukazují na význam poklesu Treg lymfocytů u pacientů s bipolární poruchou, u kterých byly také nalezeny anti-TPO protilátky u autoimunitního onemocnění štítné žlázy. Další autoimunitní poruchy CNS, jejichž prezentace může být neurologická a/nebo psychiatrická, jsou spojovány s protilátkami proti podjednotce N-metyl-D-aspartátových receptorů (AbNMDAR) [48]. Protilátky proti NMDAR byly nalezeny u encefalitidy [49] a mánie [50], a jejich hladiny byly vyšší u pacientů s různými psychickými poruchami (schizofrenie, bipolární poruchy, depresivní stavy) [51]. Je zajímavé, že anti-NMDAR protilátky byly nalezeny u psychiatrických pacientů za současného nálezu protilátek proti štítné žláze [52].
Poruchy nálady a nález cirkulujících protilátek proti štítné žláze jsou v populaci časté, jejich souběžný výskyt může být ale dílem náhody. Nicméně, na základě rodinných studií a studií na dvojčatech role protilátek proti štítné žláze u bipolárních poruch musí být brána na zřetel, i když mohou hrát roli jen diagnostického markeru.
Deprese a autoimunitní tyreopatie
Nejčastější psychickou poruchou vázající se na poruchu funkce štítné žlázy je deprese. Při studiu pacientů s významnými depresivními symptomy mělo 20 % pacientů protilátky proti štítné žláze v porovnání s kontrolou obecné populace, u níž činil nález protilátek 5–10 % [53]. U hypotyreózy je k využití zbytkové hladiny hormonů štítné žlázy upřednostňován mozek [54]. Neuro-behaviorální účinek T4 na mozek může mít souvislost s působením na neurotransmitery. Ukázalo se, že v pokusu na zvířeti (u hypotyreózních potkanů) dochází ke zvýšení mozkového dopaminu, které je doprovázeno zvýšením aktivity tyrozinhydroxylázy [55], a naopak u hypertyreózních potkanů dochází k poklesu aktivity tyrozinhydroxylázy v mozku [56].
Etiopatogeneze deprese byla nedávno přehodnocena a blíží se charakteru oddáleného typu přecitlivělosti, obdobně jako u autoimunitní tyreoiditidy vázané na APS III. typu. Deprese je charakterizována jako klinický projev aktivované imunitně-protizánětlivé reakce, a to ve smyslu stresové dráhy oxidu dusného (NO) a kyslíku, včetně aktivace katabolitů tryptofanu. Tato reakce probíhá při současné aktivaci autoimunitního procesu a dráhy střevo-mozek. Stresové dráhy O2 a NO jsou nedílnou součástí patogeneze zánětlivého onemocnění střev, např. Crohnovy choroby nebo ulcerózní kolitidy, které jsou součástí APS III. typu.
Deprese se projevuje zvýšenou hladinou prozánětlivých cytokinů, např. IL1 a TNFα aktivující TH1 a TH17 lymfocytární odpověď (buňkami zprostředkovanou destrukci) za současné přítomnosti neopterinu a volného IL2 receptoru. Také zvýšené hladiny katabolitů tryptofanu zvyšují TH1 imunitní odpověď. Je aktivovaná akutní fáze zánětu, dochází ke zvýšení haptoglobinu a C-reaktivního proteinu a snížení hladiny albuminu, transferinu, zinku a protizánětlivého cytokinu IL10. Navíc se snižuje hladina transformujícího růstového faktoru (TGFβ), zodpovědného za tvorbu Treg lymfocytů. Zvýšená O2 a NO stresová reakce navíc zvyšuje poškození lipidů, narušení tvorby proteinů a DNA [57].
Laktační (poporodní) psychóza a autoimunitní tyreoiditida
Poporodní psychóza je závažná porucha vyskytující se u 0,1 % porodivších žen. Ke klinickým příznakům patří výkyvy nálady doprovázené bludy a halucinacemi, neklidem, nespavostí a kognitivními poruchami. Pacientky často vyžadují okamžitou hospitalizaci pro sebevražedné myšlenky a tendence k zabití dítěte (infanticida). Poporodní autoimunitní onemocnění štítné žlázy se v běžné populaci vyskytuje během 1. roku po porodu s prevalencí 5–7 % [58].
O autoimunitní tyreopatii se uvažuje jako o rizikovém faktoru poporodní deprese [59,60]. U autoimunitního onemocnění štítné žlázy se vyskytuje mnohem častěji poporodní psychóza než u žen v běžné populaci. Tyto rozdíly nejsou v časném poporodním období závislé na antipsychotické terapii nebo terapii lithiem [61]. Celkově vzato, vysoká prevalence klinické dysfunkce štítné žlázy u pacientek s poporodní psychózou je důležitým aspektem pro klinický přístup k pacientce a k porozumění patofyziologii poporodní psychózy [62]. Navíc se ukázalo, že výskyt autoimunitní tyreoiditidy se netýká jen klinických známek psychické poruchy, ale u dvojčat byla prokázána genetická vazba mezi tyreoiditidou a bipolární poruchou a také společné genetické predispozice při rozvoji vzájemně propojených onemocnění [41]. Během těhotenství se rozvíjejí nezbytné změny mateřského imunitního systému pro navození tolerance matky ke geneticky a antigenně odlišné fetální tkáni. Z klinického hlediska se tento stav tolerance odráží ve zlepšení symptomů u pacientek s autoimunitními onemocněními, jako je revmatoidní artritida, autoimunitní tyreoiditida atd [63]. Během těhotenství je také pozorováno snížení sérových koncentrací autoprotilátek [64]. Po porodu se imunosupresivní stav navozený během těhotenství nenavrací do stavu zdraví, ale přejde do terénu již rozvinuté autoimunitní reakce („rebound“ fenomén). To má za následek zhoršení již existujícího autoimunitního onemocnění nebo rozvoj jeho prvních projevů [65]. Poporodní reaktivace autoimunitního procesu vede ke zhoršení projevů jak v oblasti štítné žlázy, tak i v oblasti psychiky. Je tedy možné spekulovat, že buď poporodní psychotický stav sám o sobě může zhoršit skrytou autoimunitní tyreoiditidu, nebo naopak tyreoiditida po porodu může sloužit jako důležitý vyvolávající faktor vedoucí k rozvoji deprese nebo mánie pacientky, v důsledku rozvinuté neuro-biologické citlivosti jedince. Z klinického pohledu je zřejmé, že poporodní dysfunkce štítné žlázy je třeba včas diagnostikovat a léčit [66].
Imunopatologie a schizofrenie
Poznatků v této oblasti je málo. V poslední době existují nepřímé doklady o zapojení autoimunitního procesu v patofyziologii schizofrenie [67–69]. Ale jasný průkaz, že imunitní mechanizmy jsou příčinou schizofrenie, prozatím nebyl podán [70].
Nejvýznamnější popsanou změnou v imunologické odpovědi u pacientů se schizofrenií je posun v poměru cytokinů pomocných TH1/TH2 lymfocytů ve prospěch cytokinů TH2 lymfocytů [71,72]. Tento průkaz je zcela opačný oproti nálezům u deprese. Dále byly popsány změny aktivity přirozených zabíječů (NK) [73,74].
Závěr
Představa některých odborníků, že problematika štítné žlázy je vyřešena, je velký omyl. V poslední době se ukazuje, že poruchy štítné žlázy zasahují do regulací řady procesů interní medicíny, psychiatrie, neurologie, imunologie a endokrinologie.
Autoimunitní tyreopatie a zvláště autoimunitní tyreoiditida vykazují společnou genetickou predispozici, a dokonce společné genetické vazby s psychickými poruchami, zvláště s depresí a poporodní psychózou. Epigenetické mechanizmy vykazují také společné rysy, zvláště při rozvoji autoimunitní polyglandularity APS II.–III. typu. Významnými faktory jsou infekce, mikrobiota a spojení osy mozek-střevo. Vzájemné poruchy regulačních mechanizmů jsou výrazné především u deprese, která je propojena s řadou onemocnění endokrinních a neendokrinních orgánů v rámci APS III. typu.
Propojení štítné žlázy a psychiky se neodehrává jen na podkladě rozvoje imunopatologických reakcí, ale také na základě významného predilekčního vychytávání a působení tyreoidálních hormonů v mozku, který má specifické receptory pro tyreoidální hormony a vychytává je přednostně i při hypofunkčních stavech štítné žlázy. O vlivu autoprotilátek proti štítné žláze na rozvoj poruchy psychiky u tzv. „Hashimotovy encefalopatie“ se nadále spekuluje, ale prozatímní důkazy tuto úvahu zatím nepotvrzují.
Podpořeno MZ ČR – RVO (Endokrinologický ústav – EÚ, 00023761).
prof. MUDr. Ivan Šterzl, CSc.
isterzl@endo.cz
Oddělení klinické imunoendokrinologie Endokrinologický ústav, Praha
www.endo.cz
Doručeno do redakce 28. 6. 2016
Přijato po recenzi 1. 9. 2016
Zdroje
1. Gull WW. On cretinoid state supervening in adult life in women. Trans Clinical Society of London 1874; 7 : 180–185.
2. Report of a Committee of the Clinical Society of London, Nominated December 14, 1883, to Investigate the Subject of Myxoedema. Trans Clinical Society of London 1888; (Suppl 21).
3. Wagner von Jauregg J. Myxödem und Kretinismus. In Handbuch der Psychiatrie. Deuticke: Leipzig – Wien 1912.
4. Wagner-Jauregg J Verhütung und Behandlung der progressiven Paralyse durch Impfmalaria. In: Handbuch der experimentellen Terapie-Ergänzungsband. München 1931.
5. Asher R. Myxoedematous madness. Br Med J 1949; 2(4627): 555–562.
6. Awad AG.The Thyroid and the Mind and Emotions -Thyroid Dysfunction and Mental Disorders. Thyrobulletin 1986; 7. Dostupné z WWW: http://www.thyroid.ca/e10f.php. [Rev. 2000].
7. Šterzl I. Přehledná imunoendokrinologie: patofyziologie, diagnostika, terapie. Maxdorf: Praha 2006. ISBN 80–7345–087–9.
8. Neufeld M, Blizzard R. Polyglandular autoimmune diseases. In: Pinchera A, Doniach D, Fenzi GF et al (eds). Symposium on autoimmune aspects of endocrine disorders. Academic Press: New York 1980 : 357–365.
9. Peterson P, Perheentupa J, Krohn KJ. Detection of candidal antigens in autoimmune polyglandular syndrome type I. Clin Diagn Lab Immunol 1996; 3(3): 290–294.
10. Betterle C, Zanchetta R. Update on autoimmune polyendocrine syndromes (APS). Acta Biomed 2003; 74(1): 9–33.
11. Kyung Ae Lee, Kyung Taek Park, Hea Min Yu et al. Subacute thyroiditis presenting as acute psychosis: a case report and literature review. Korean J Intern Med 2013; 28(2): 242–246. Dostupné z DOI: <http://dx.doi.org/10.3904/kjim.2013.28.2.242>.
12. Bunevicius R, Steibliene V, Prange AJ Jr. Thyroid axis function after in-patient treatment of acute psychosis with antipsychotics: a naturalistic study. BMC Psychiatry 2014; 14 : 279. Dostupné z DOI: <http://dx.doi.org/10.1186/s12888–014–0279–7>.
13. Dratman MB. Cerebral versus peripheral regulation and utilization of thyroid hormones. In: Joffe RT, Levitt AJ (eds). The Thyroid Axis and Psychiatric Illness. American Psychiatric Press: Washington, DC 1993 : 3–94. ISBN 978–0880483643.
14. Stern RA, Prange AJ Neuropsychiatric aspects of endocrine disorders. In: Kaplan HI, Sadock BJ (eds). 2 Voll. 2nd ed. Comprehensive Textbook of Psychiatry. Wiliams & Wilkins: Baltimore: 1995 : 241–251. ISBN 978–0683045321.
15. Whybrow PC, Prange AJ Jr. A hypothesis of thyroid-catecholamine-receptor interaction: its relevance to affective illness. Arch Gen Psychiatry 1981; 38(1): 106–113.
16. Janine A, van Venrooij EM, Sjoerd BA et al. Impaired Neuroendocrine and Immune Response to Acute Stress in Medication-Naive Patients With a First Episode of Psychosis. Schizophr Bull 2012; 38(2): 272–279. Dostupné z DOI: <http://dx.doi.org/10.1093/schbul/sbq062>.
17. Cunningham-Rundles C. Autoimmunity in primary immune deficiency: taking lessons from our patients. Clin Exp Immunol 2011; 164:(Suppl 2): 6–11. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2249.2011.04388.x>.
18. Etzioni A. Immune deficiency and autoimmunity. Autoimmun Rev 2003; 2(6): 364–369.
19. Sterzl I, Sterzl J. The genetic basis of primary, predominantly specific immunodeficiencies. Folia Biol (Praha) 1997; 43(6): 211–218.
20. Temmerman ST, Ma CA, Zhao Y et al. Defective nuclear IKKα function in patients with ectodermal dysplasia with immune deficiency. J Clin Invest 2012; 122(1): 315–326. Dostupné z DOI: <http://dx.doi.org/10.1172/JCI42534>.
21. Yarandi SS, Peterson DA, Treisman GJ et al. Modulatory Effects of Gut Microbiota on the Central Nervous System: How Gut Could Play a Role in Neuropsychiatric Health and Diseases. J Neurogastroenterol Motil 2016; 22(2): 201–212. Dostupné z DOI: <http://dx.doi.org/10.5056/jnm15146>.
22. Logan AC, Jacka FN, Craig JM et al. The Microbiome and Mental Health: Looking Back, Moving Forward with Lessons from Allergic Diseases. Clin Psychopharmacol Neurosci 2016; 14(2): 131–147. Dostupné z DOI: <http://dx.doi.org/10.9758/cpn.2016.14.2.131>.
23. Boorman E, Zajkowska Z, Ahmed R et al. Crosstalk between endocannabinoid and immune systems: a potential dysregulation in depression? Psychopharmacology (Berl) 2016; 233(9): 1591–1604. Dostupné z DOI: <http://dx.doi.org/10.1007/s00213–015–4105–9>.
24. Durinovic-Bello I, Schlosser M, Riedl M et al. Pro - and anti-inflammatory cytokine production by autoimmune T cells against preproinsulin in HLA-DRB1*04, DQ8 Type 1 diabetes. Diabetologia 2004; 47(3): 439–450.
25. Sugenyova A, Itoh N, Kasuga Y et al. Histopathological features of atrophic thyroiditis with blocking type-TSH binding inhibitor immunoglobulins. Endocr J 1995; 42(2): 277–281.
26. Martinez GJ, Nurieva RI, Yang XO et al. Regulation and function of proinflammatory TH17 cells. Ann NY Acad Sci 2008; 1143 : 188–211. Dostupné z DOI: <http://dx.doi.org/10.1196/annals.1443.021>.
27. Miller A, Lider O, Roberts AB et al. Suppressor T cells generated by oral tolerization to myelin basic protein suppress both in vitro and in vivo immune responses by the release of transforming growth factor beta after antigen-specific triggering. Proc Natl Acad Sci USA 1992; 89(1): 421–425.
28. Rebuffat SA, Nguyen B, Robert B et al. Antithyroperoxidase antibody-dependent cytotoxicity in autoimmune thyroid disease. J Clin Endocrinol Metab 2008; 93(3): 929–934.
29. Marcocci C, Vitti P, Cetani F et al. Thyroid ultrasonography helps to identify patients with diffuse lymphocytic thyroiditis who are prone to develop hypothyroidism. J Clin Endocrinol Metab 1991; 72(1): 209–213.
30. Romagnani S. Th1/Th2 cells. Inflamm Bowel Dis 1999; 5(4): 285–294.
31. Biondi B, Cooper DC. The clinical significance of subclinical thyroid dysfunction. Endocr Rev 2008; 29(1): 76–131.
32. Hollowell JG, Staehling NW, Flanders WD et al. Serum TSH, T(4), and thyroid antibodies in the United States population (1988–1994): National Health and Nutrition Examination Survey (NHANES III). J Clin Endocrinol Metab 2002; 87(2): 489–499.
33. Bocchetta A, Traccis F, Mosca E et al. Bipolar disorder and antithyroid antibodies: review and case series. Int J Bipolar Disord 2016; 4(1): 5. Dostupné z DOI: <http://dx.doi.org/10.1186/s40345–016–0046–4>.
34. Kupka RW, Nolen WA, Post RM et al. High rate of autoimmune thyroiditis in bipolar disorder: lack of association with lithium exposure. Biol Psychiatry 2002; 51(4): 305–311.
35. Shaw PJ, Walls TJ, Newman PK et al. Hashimoto’s encephalopathy: a steroid responsive disorder associated with high antithyroid antibody titre: report of 5 cases. Neurology 1991; 41(2 Pt 1): 228–233.
36. Wakai M, Nishikage H, Goshima K. Reversible white matter lesions and antithyroid antibodies in the cerebrospinal fluid in Hashimoto’s encephalopathy: a case report. Rinsho Shinkeigaku 2004; 44(7): 432–437.
37. Fatourechi V. Hashimoto’s encephalopathy: myth or reality? An endocrinologist’s perspective. Best Pract Res Clin Endocrinol Metab 2005; 19(1): 53–66.
38. Castillo P, Woodruff B, Caselli R et al. Steroid-responsive encephalopathy associated with autoimmune thyroiditis. Arch Neurol 2006; 63(2): 197–202.
39. Marshall GA, Doyle JJ. Long-term treatment of Hashimoto’s encephalopathy. J Neuropsychiatry Clin Neurosci 2006; 18(1): 14–20.
40. Oliveira J, Hamdani N, Busson M et al. Association between toll-like receptor 2 gene diversity and early-onset bipolar disorder. J Affect Disord 2014; 165 : 135–141. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jad.2014.04.059>.
41. Vonk R, van der Schot AC, Kahn RS et al. Is autoimmune thyroiditis part of the genetic vulnerability (or an endophenotype) for bipolar disorder? Biol Psychiatry 2007; 62 : 135–140.
42. Šterzl I. Vliv vitaminu D na imunitní mechanismy. Interní Med 2014; 16(3): 110–112.
43. Müssig K, Bartels M, Gallwitz B et al. Hashimoto’s encephalopathy presenting with bipolar affective disorder. Bipolar Disord 2005; 7(3): 292–297.
44. Haggerty jr. JJ, Silva SG, Marquardt M et al. Prevalence of antithyroid antibodies in mood disorders. Depress Anxiety 1997; 5(2): 91–96.
45. Bocchetta A, Cocco F, Velluzzi F et al. Fifteen-year follow-up of thyroid function in lithium patients. J Endocrinol Invest 2007; 30(5): 363–366.
46. Yoneda M, Fujii A, Ito A et al. High prevalence of serum autoantibodies against the amino terminal of alpha-enolase in Hashimoto’s encephalopathy. J Neuroimmunol 2007; 185(-2): 195–200.
47. Drexhage RC, Hoogenboezem TH, Versnel MA et al. The activation of monocyte and T cell networks in patients with bipolar disorder. Brain Behav Immun 2011; 25(6): 1206–1213. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bbi.2011.03.013>.
48. León-Caballero J, Pacchiarotti I, Murru A et al. Bipolar disorder and antibodies against the N-methyl-D-aspartate receptor: a gate to the involvement of autoimmunity in the pathophysiology of bipolar illness. Neurosci Biobehav Rev 2015; 55 : 403–412. Dostupné z DOI: <http://dx.doi.org/10.1016/j.neubiorev.2015.05.012>.
49. Kayser MS, Titulaer MJ, Gresa-Arribas N et al. Frequency and characteristics of isolated psychiatric episodes in anti-N-methyl-D-aspartate receptor encephalitis. JAMA Neurol 2013; 70(9): 1133–1139.
50. Dickerson F, Stallings C, Vaughan C et al. Antibodies to the glutamate receptor in mania. Bipolar Disord 2012; 14 : 547–553. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1399–5618.2012.01028.x>.
51. Pearlman DM, Najjar S. Meta-analysis of the association between N-methyl-D-aspartate receptor antibodies and schizophrenia, schizoaffective disorder, bipolar disorder, and major depressive disorder. Schizophr Res 2014; 157(1–3): 249–258. Dostupné z DOI: <http://dx.doi.org/10.1016/j.schres.2014.05.001>.
52. Chiba Y, Katsuse O, Takahashi Y et al. Anti-glutamate receptor e2 antibodies in psychiatric patients with anti-thyroid autoantibodies – a prevalence study in Japan. Neurosci Lett 2013; 534 : 217–222. Dostupné z DOI: <http://dx.doi.org/10.1016/j.neulet.2012.10.060>.
53. Nemeroff CB, Simon JS, Haggerty JJ et al. Antithyroid antibodies in depressed patients. Am J Psychiatry 1985; 142(7): 840–843.
54. Dratman MB, Crutchfield FL, Gordon JT et al. Idothyronine homeostasis in rat brain during hypo and hyperthyroidism. Am J Physiol 1983; 245(2): E185-E193.
55. Sata T, Imura E, Murata A et al. Thyroid hormone: catecholamine interrelationship during cold acclimation in rats: compensatory role of catecholamine for altered thyroid states. Acta Endocrinology (Copenh) 1986; 113(4): 536–542.
56. Chan BL, Singer W. The hypothalamic-pituitary-thyroid axis: clinical and theoretical principles. In: Joffe RT, Levitt AJ (eds). The Thyroid Axis and Psychiatric Illness. American Psychiatric Press: Washington, DC 1993 : 147–168. ISBN 978–0880483643.
57. Martin-Subero M, Anderson G, Kanchanatawan B et al. Comorbidity between depression and inflammatory bowel disease explained by immune-inflammatory, oxidative, and nitrosative stress; tryptophan catabolite; and gut-brain pathways. CNS Spectr 2016; 21(2): 184–198. Dostupné z DOI: <http://dx.doi.org/10.1017/S1092852915000449>.
58. Muller AF, Drexhage HA, Berghout A. Postpartum thyroiditis and autoimmune thyroiditis in women of childbearing age: recent insights and consequences for antenatal and postnatal care. Endocr Rev 2001; 22(5): 605–630.
59. Harris B, Othman S, Davies JA et al. Association between postpartum thyroid dysfunction and thyroid antibodies and depression. BMJ 1992; 305 (6846): 152–156.
60. Pop VJ, Wijnen HA, Lapkienne L et al. The relation between gestational thyroid parameters and depression: a reflection of the downregulation of the immune system during pregnancy? Thyroid 2006; 16(5): 485–492.
61. Kashyap AS, Anand KP, Kashyap S. Postpartum psychiatric disorders. Lancet 2004; 363(9414): 1077–1078.
62. Bergink V, Kushner SA, Pop V et al. Prevalence of autoimmune thyroid dysfunction in postpartum psychosis. Br J Psychiatry. 2011; 198(4): 264–268. Dostupné z DOI: <http://dx.doi.org/10.1192/bjp.bp.110.082990>.
63. Luppi P. How immune mechanisms are affected by pregnancy. Vaccine 2003; 21(24): 3352–3357.
64. Pop VJ, Wijnen HA, Lapkienne L et al. The relation between gestational thyroid parameters and depression: a reflection of the downregulation of the immune system during pregnancy? Thyroid 2006; 16(5): 485–492.
65. Weetman AP Immunity, thyroid function and pregnancy: molecular mechanisms. Nat Rev Endocrinol 2010; 6(6): 311–318. Dostupné z DOI: <http://dx.doi.org/10.1038/nrendo.2010.46>.
66. Stagnaro-Green A. Postpartum thyroiditis. Best Pract Res Clin Endocrinol Metab 2004; 18(2): 303–316.
67. Jones AL, Mowry BJ, Pender MP et al. Immune dysregulation and self-reactivity in schizophrenia: do some cases of schizophrenia have an autoimmune basis? Immunol Cell Biol 2005; 83(1): 9–17.
68. Strous RD, Shoenfeld Y. Schizophrenia, autoimmunity and immune system dysregulation: a comprehensive model updated and revisited. J Autoimmun 2006; 27(2): 71–80.
69. Rogers DP, Goldsmith CA. Treatment of schizophrenia in the 21st century: beyond the neurotransmitter hypothesis. Expert Rev Neurother 2009; 9(1): 47–54. Dostupné z DOI: <http://dx.doi.org/10.1586/14737175.9.1.47>.
70. Kudoh A, Sakai T, Ishihara H et al. Plasma cytokine response to surgical stress in schizophrenic patients. Clin Exp Immunol 2001; 125(1): 89–93.
71. Goldsmith CA, Rogers DP. The case for autoimmunity in the etiology of schizophrenia. Pharmacotherapy 2008; 28(6): 730–741. Dostupné z DOI: <http://dx.doi.org/10.1592/phco.28.6.730>.
72. Muller N, Schwarz MJ. A psychoneuroimmunological perspective to Emil Kraepelins dichotomy: schizophrenia and major depression as inflammatory CNS disorders. Eur Arch Psychiatry Clin Neurosci 2008; 258(Suppl 2): 97–106. Dostupné z DOI: <http://dx.doi.org/10.1007/s00406–008–2012–3>.
73. Sperner-Unterweger B, Whitworth A, Kemmler G et al. T-cell subsets in schizophrenia: a comparison between drug-naive first episode patients and chronic schizophrenic patients. Schizophr Res 1999; 38(1): 61–70.
74. Yovel G, Sirota P, Mazeh D et al. Higher natural killer cell activity in schizophrenic patients: the impact of serum factors, medication, and smoking. Brain Behav Immun 2000; 14(3): 153–169.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2016 Číslo Suppl 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Magnosolv a jeho využití v neurologii
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Zásobení jodem u těhotných žen v České republice
-
Řešení jodového deficitu v České republice – historie a současný stav
20 let práce prof. MUDr. Václava Zamrazila v Meziresortní komisi pro řešení jodového deficitu - Psycho-imuno-endokrinologie štítné žlázy
- Karcinomy štítné žlázy – současné léčebné postupy
- Vitamin D a autoimunitní tyreopatie
- Testosteron a mortalita
- Vrozená adrenální hyperplazie v dospělosti
- Polyfarmakoterapie nahlížená nejen prizmatem multimorbidity, ale jako další geriatrický syndrom
- Mnohočetná endokrinní neoplazie I (Wermerův syndrom) – formy klinické manifestace: 5 kazuistik
- Priebeh ochorenia u pacientov s diferencovaným mikrokarcinómom štítnej žľazy pri použití rôznych liečebných postupov
- Projekt SPACE (Stav Pacientů Akceptovaných diabetologem Cestou Exportu)
- Zásobení jodem a jodurie obyvatel v České republice v letech 1995–2016
- Prof. MUDr. Václav Zamrazil, DrSc., slaví 80. narozeniny
- Jodurie u nemocných s diabetes mellitus 1. typu Vztahy k vybraným parametrům charakterizujícím diabetický syndrom
- Nádory štítné žlázy u dětí a dospívajících a jejich molekulárně genetická podstata
- Endokrinní komplikace moderní onkologické léčby
- Václav Zamrazil osmdesátníkem
- Léčba levotyroxinem – faktory ovlivňující její úspěšnost
- Endokrinní orbitopatie – téma stále živé
- Jsou tyreoidální hormony a tyreotropin asociovány s kardiometabolickými riziky a inzulinovou rezistencí u eutyreoidních jedinců?
- Současnost a perspektivy léčby akromegalie
- Kardiorenální syndrom – biomarkery a mediátory
- TSH produkující adenomy
- Centrální poruchy funkce štítné žlázy
- Vitamín D a syndróm polycystických ovárií
- Tyreoidální hormony a kardiovaskulární systém
- Endokanabinoidný systém a kosť
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Vrozená adrenální hyperplazie v dospělosti
- Mnohočetná endokrinní neoplazie I (Wermerův syndrom) – formy klinické manifestace: 5 kazuistik
- Vitamin D a autoimunitní tyreopatie
- Centrální poruchy funkce štítné žlázy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



