-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaOptimální způsob podání vysokodávkového i.v. furosemidu – kontinuálně nebo bolusově?
Optimal way of administration of high dose intravenous furosemide – continuous infusion or bolus?
Introduction:
Furosemide is a loop diuretic used in states of volume overload. The need for high doses is due to its reduced efficacy caused by lower concentration of furosemide achieved at the site of action in the renal tubule lumen and adaptation mechanisms. High doses have been associated with the development of ionic dysbalance, direct toxicity and intravascular volume fluctuations. The way of furosemide administration (intermitent versus continuously) to influence efficacy and safety is contradictory evaluated in EBM.Aim:
The aim of this study is to analyze the available data for evaluation of the efficacy and safety of intermittent versus continuous dose regimens.Methods:
A systematic search on PubMed from 1990 to 2013 using the keywords – furosemide, loop diuretic, bolus, continuous infusion, efficacy, safety, heart failure, ICU, critical care.Conclusion:
The pharmacokinetic and pharmacodynamic knowledge of furosemide create a theoretical assumption for the preference of continuous infusions before intermittent boluses. Assessement of available studies, however, yet in clinical practice did not proof the advantage of one over the other route of administration.Key words:
bolus – continuous infusion – critical care – efficacy – furosemide – heart failure – ICU – loop diuretic – safety
Autoři: Jana Gallusová; Milada Halačová; Dalibor Černý
Působiště autorů: Oddělení klinické farmacie Nemocnice Na Homolce Praha, vedoucí oddělení PharmDr. Milada Halačová, Ph. D.
Vyšlo v časopise: Vnitř Lék 2014; 60(10): 885-892
Kategorie: Přehledné referáty
Souhrn
Úvod:
Furosemid je kličkové diuretikum používané při stavech retence tekutin. Nutnost podání vysokých dávek je důsledkem jeho snížené účinnosti způsobené nižší dosaženou koncentrací na místě účinku v lumen ledvinného tubulu a vlivem adaptačních mechanizmů. Vysoké dávky jsou spojovány s rozvojem iontové dysbalance, přímé toxicity a intravaskulární fluktuací objemu. Možnosti ovlivnění účinnosti a bezpečnosti furosemidu jsou v literatuře rozporuplně hodnoceny v souvislosti se způsobem jeho podávání (intermitentně vs kontinuálně).Cíl:
Cílem této práce je analyzovat dostupná literární data týkající se zhodnocení účinnosti a bezpečnosti intermitentních vs kontinuálních dávkových režimů.Metodika:
Systematická literární rešerše v databázi PubMed od roku 1990 do roku 2013 s použitím klíčových slov – furosemid, kličkové diuretikum, bolusové podání, kontinuální infuze, účinnost, bezpečnost, srdeční selhání, intenzivní péče, ICU.Závěr:
Farmakokinetické a farmakodynamické znalosti furosemidu vytvářejí určitý teoretický předpoklad pro preferenci kontinuálních infuzí před intermitentními bolusy. Zhodnocení dostupných literárních dat však zatím v klinické praxi neprokázalo jednoznačné výhody jednoho způsobu podávání oproti druhému.Klíčová slova:
bezpečnost – bolusové podání – furosemid – ICU – účinnost – kličkové diuretikum – kontinuální infuze – srdeční selháníÚvod
Používání furosemidu se opírá o dlouholetou empirickou zkušenost a jednoznačnou úlevu od symptomů u pacientů s retencí tekutin. Podle poznatků medicíny založené na důkazech je dnešní postavení furosemidu v léčbě stále kontroverzní. V observačních studiích byla na jedné straně nalezena asociace vyšší dávky furosemidu s vyšší nemocniční mortalitou a vyšším rizikem renálního selhání [1], ale na druhé straně lze tyto výsledky interpretovat jako závislost účinku furosemidu na závažnosti onemocnění [2].
Stálým předmětem odborných diskusí je nastavení optimální dávky, frekvence a cesty podání v kontextu rizik fluktuace intravaskulárního objemu, toxicity a zvýšené tolerance k léčbě. Obecně je kladen důraz na použití co nejnižší účinné dávky tak, aby nedocházelo k vyvolání deplece tekutin a projevům přímé toxicity [3,4]. Za vysokou dávku furosemidu můžeme považovat dávku nad 250 mg/den. Ve studiích se však toto pojmenování liší a jsou takto označovány dávky 250 mg p.o. až 2 000 mg i.v.
Mechanizmus účinku a farmakologické vlastnosti furosemidu
Furosemid je slabá organická kyselina eliminovaná z 85 % renálně. Normální systémová clearance je přibližně 19 ml/kg/min. Polovina i.v. podané látky je ledvinami metabolizována na neúčinný glukuronid a druhá polovina je aktivně secernována v nezměněné formě pomocí transportéru pro organické kyseliny (OAT1) v proximálních tubulech. V lumen tubulu se furosemid váže na Na/K/Cl2 kotransportér na povrchu membrány luminální strany vzestupného raménka Henleho kličky, a tím blokuje reabsorpci iontů Na+, K+, Cl- a způsobuje akumulaci iontů uvnitř lumen. Tím dochází ke zvýšené natriuréze i ztrátě draslíku, vápníku a magnezia do moči. Ztráty NaCl a tekutin během podávání diuretika jsou limitovány kompenzačními mechanizmy, které zahrnují akutní postdiuretickou rebound reakci, stimulaci sympatiku, aktivaci osy renin-angiotenzin-aldosteron i adaptační změny ve struktuře nefronu při dlouhodobém podávání diuretika [5].
Účinek furosemidu ovlivňuje koncentrace furosemidu v místě účinku, čas dosažení místa účinku a dynamiku odpovědi při vazbě na kotransportér. Pro diuretický účinek je tedy zásadní množství furosemidu, které se dostane do lumen tubulu, ne jeho plazmatická koncentrace.
Základní farmakokinetické charakteristiky furosemidu jsou uvedeny v tab. 1.
Tab. 1. Základní farmakokinetické charakteristiky furosemidu. Upraveno podle [6]. ![Základní farmakokinetické charakteristiky furosemidu. Upraveno podle [6].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/f71eed7d557259f326a9720f2de60ef4.png)
Furosemid má vysokou vazbu na plazmatické bílkoviny (> 98 %), především na sérový albumin, pouze velmi malá část je filtrována přes glomerulus. Zvýšení volné frakce furosemidu při hypoalbuminemii nebo kompetitivním vytěsněním z vazby v přítomnosti jiných léčiv s vysokou afinitou k albuminu (např. warfarin, fenytoin) akceleruje metabolizaci furosemidu a vede k poklesu jeho plazmatických koncentrací. Koncentrace furosemidu v lumen může být dále snížena přítomností jiných organických kyselin, které soutěží o společný transportér v proximálním tubulu. Jde zejména o uremické kyseliny při renálním selhávání nebo o léčiva, jako je probenecid, benzylpenicilin, cefalosporiny, ciprofloxacin, oxypurinol (aktivní metabolit alopurinolu) nebo aktivní metabolity oseltamiviru [2,5].
Čas do dosažení místa účinku může být prodloužen vlivem sníženého srdečního výdeje, sníženého průtoku ledvinami nebo zvolenou cestou podání (p.o. dostupnost 50–60 %). Farmakodynamika odpovědi je snížena aktivací systému RAA při dehydrataci, současným podáním NSAIDs a srdečním selháním [6].
Vzhledem ke krátkému biologickému poločasu furosemidu (2 hod) dochází po periodě natriurézy k poklesu koncentrace diuretika v tubulu pod práh účinnosti, kdy není dostatečně inhibována reabsorpce sodíku. Zvýšená reabsorpce Na po dávce diuretika se nazývá postdiuretická rebound retence NaCl. Pokud je dietní příjem NaCl nadměrný, postdiuretická retence může překonat iniciální natriurézu [6].
Na jedné straně se domníváme, že snížení intravaskulárního objemu po podání diuretik je následováno aktivací sympatiku a RAAS, zvýšením systémové vaskulární rezistence a zvýšením plnícího tlaku komor. Na druhé straně úleva od symptomů u pacientů se srdečním selháním je vysvětlována promptním diuretickým účinkem, snížením objemu cirkulujících tekutin a snížením plnícího tlaku komor [7] i přímou relaxací hladkých svalů cév způsobujících renální a pulmonální vazodilataci [8]. Pouze u kličkových diuretik byly popsány i mechanizmy aktivace RAAS na objemu nezávislé. Systém spojený s kotransportérem Na/K/Cl2 je hlavní součástí cesty pro sekreci reninu v buňkách macula densa a jeho blokováním kličkovými diuretiky dochází k přímé stimulaci sekrece reninu. Kličková diuretika také stimulují renální produkci prostacyklinu [6].
Variabilita účinnosti furosemidu u pacientů s akutní dekompenzací srdečního selhání je dána i vlivem závažnosti onemocnění. Srdeční selhání ovlivňuje jak čas dosažení místa účinku furosemidu, tak farmakodynamickou odpověď (graf). Ta je podle křivky dávka-odpověď u srdečního selhání změněná, posunutá doprava a ukazuje na nutnost použití vyšších dávek diuretika pro dosažení stejné exkrece sodíku [9].
Graf 1. Farmakodynamická odpověď na kličková diuretika 
Obrázek porovnává závislost frakční exkrece Na (osa y) na koncentraci kličkového diuretika vyloučeného do moči (osa x) u normálních pacientů a u pacientů se srdečním selháním. U pacientů se srdečním selháním dochází ke snížení maximální odpovědi na furosemid. Upraveno podle [6]. U pacientů se srdečním selháním dochází také k tzv. brzdícímu fenoménu (braking phenomenon), který vzniká při dlouhodobé terapii diuretiky a je charakteristický výrazně se snižující odpovědí na diuretickou terapii. Primární je vliv sníženého intravaskulárního objemu, který sníží filtraci sodíku glomerulem, a tím se sníží celková nálož sodíku v tubulu. Další příčinou je aktivace sympatiku a RAAS po podání diuretik, která se projeví snížením renálního průtoku krve a zvýšením reabsorpce sodíku v proximálním a distálním tubulu [6]. Dlouhodobá terapie diuretiky vede ke strukturálním změnám ledvin, k hypertrofii epiteliálních buněk distálních tubulů a zesílení distální reabsorpce sodíku [10]. Kombinace změněné účinnosti furosemidu při srdečním selhání s renální insuficiencí, fyziologickým bržděním účinku a funkční adaptační změny nefronu vedou ke klinicky pozorované diuretické rezistenci, která koreluje se závažností onemocnění a pro mírný diuretický účinek je nutná vysoká dávka furosemidu.
Vedle základního diuretického účinku má furosemid také účinky vazodilatační, které nastupují rychle ještě před diuretickým účinkem, ale trvají krátce. Je možné, že na mechanizmu se podílí uvolňování prostaglandinů v ledvině a/nebo přímá venodilatace zprostředkovaná uvolněním NO [8]. Zvýšení produkce prostaglandinů by teoreticky mohlo přispět ke zlepšení krevního průtoku ledvinou. V poslední době je zkoumán potenciální benefit, zda inhibice Na/K/Cl2 pumpy vede ke snížení požadavků tubulárních buněk vzestupného raménka na kyslík [11,12].
Nežádoucí účinky
Nežádoucí účinky furosemidu se projevují jako elektrolytová dysbalance – hyponatremie, hypokalemie, hypomagnezemie, hypokalcemie. Pokud není pacient současně dostatečně hydratován, může dojít k dehydrataci, snížení intravaskulárního objemu a nastartování korekčních neurohumorálních mechanizmů, jako je aktivace sympatiku a RAAS [13].
Literárně udávaná incidence přímé ototoxicity při rychlé i.v. aplikaci je 3–6,4 % [14]. Projevuje se nejčastěji jako reverzibilní krátkodobá ztráta sluchu. Furosemid porušuje homeostázu endokochleární tekutiny a může potencovat nežádoucí účinky jiných látek tím, že zvýší koncentraci ototoxického léčiva v tekutině pokrývající vlasové buňky. Za ototoxický práh je považováno překročení plazmatické koncentrace 100 µg/ml [15], riziko ototoxicity je však vysoké už při koncentraci nad 50 µg/ml [16]. Ve studii srovnávající bolusové a kontinuální podání vysokodávkového furosemidu u 20 pacientů s těžkým srdečním selháním [15] tento práh překročilo 7 pacientů bezprostředně po bolusovém podání dávky a 1 pacient při kontinuální 8hodinové infuzi. 5 pacientů po bolusovém podání uvedlo tinnitus a/nebo krátkodobou ztrátu sluchu, která vymizela do 15 min. Podávané dávky však byly z hlediska běžné praxe velmi vysoké (např. dávka 2 000 mg furosemidu u pacienta s clearance kreatininu 15 ml/min/1,73 m2, maximální plazmatické koncentrace při kontinuální infuzi 119 µg/ml). Za bezpečnou je považována infuzní rychlost až 160 mg/hod při kreatinové clearance > 20 ml/min/1,73 m2 [17].
Předpoklady benefitu kontinuálního podání vysokodávkového furosemidu
Popisované farmakokinetické a farmakodynamické vlastnosti furosemidu a korelace fluktuace hodnot maximálních plazmatických koncentrací s rozvojem nežádoucích účinků vytváří teoretické předpoklady pro výhody kontinuálního podání vysokodávkového furosemidu oproti intermitentnímu. Zdá se logické, že kontinuálně podávaný furosemid je schopen zajistit dosažení dostatečných koncentrací v moči v delším časovém horizontu, konstantnější a vyšší diurézu, nedochází k výraznému kolísání intravaskulárního objemu, a proto předpokládáme nižší neurohumorální aktivaci, nižší postdiuretický rebound fenomén a umožňuje lepší titraci dávky pro optimalizaci diuretické odpovědi. Nižší peakové koncentrace při kontinuální aplikaci redukují riziko ototoxicity. Intermitentní podání má výhodu volnějšího pohybu pacientů a nižší množství přiváděné tekutiny.
Cílem této práce je na základě dostupných literárních dat zhodnocení evidence účinnosti a bezpečnosti intermitentních vs kontinuálních dávkových režimů i.v. furosemidu v klinické praxi.
Metodika
Bylo zvoleno plné vyhledávání v databázi PubMed na základě kombinace klíčových slov furosemid, kličkové diuretikum, bolusové podání, kontinuální infuze, účinnost, bezpečnost, srdeční selhání, intenzivní péče, ICU v časovém období od roku 1990 do roku 2013. Nalezené studie byly následně doplněny o relevantní citované literární zdroje.
Výsledky
Jednou ze základních indikací podávání vysokodávkového furosemidu jsou akutní dekompenzace srdečního selhání (acute decompensated heart failure – ADHF) a retence tekutin u pacientů v akutní péči (sepse, akutní renální selhávání, plicní edém, akutní selhání plic atd). Výsledky u těchto 2 indikací uvádíme zvlášť, protože metoda podávání i.v. furosemidu se liší. Ve studiích pacientů s ADHF byla dávka furosemidu určována podle zvážení ošetřujícího lékaře, u pacientů na ICU byly použity algoritmy úpravy dávky podle dosažené diurézy.
U pacientů se srdečním selháním hodnotí bolusové vs kontinuální podávání furosemidu metaanalýza [18] 6 studií (tab. 2). Nalezli jsme další 3 publikované studie s prospektivním uspořádáním (tab. 3). U pacientů hospitalizovaných na ICU byla publikována metaanalýza [19] 4 studií (tab. 4).
Tab. 2. Randomizované studie srovnávající bolusové vs kontinuální podání furosemidu u pacientů se srdečním selháním zahrnutých v metaanalýze 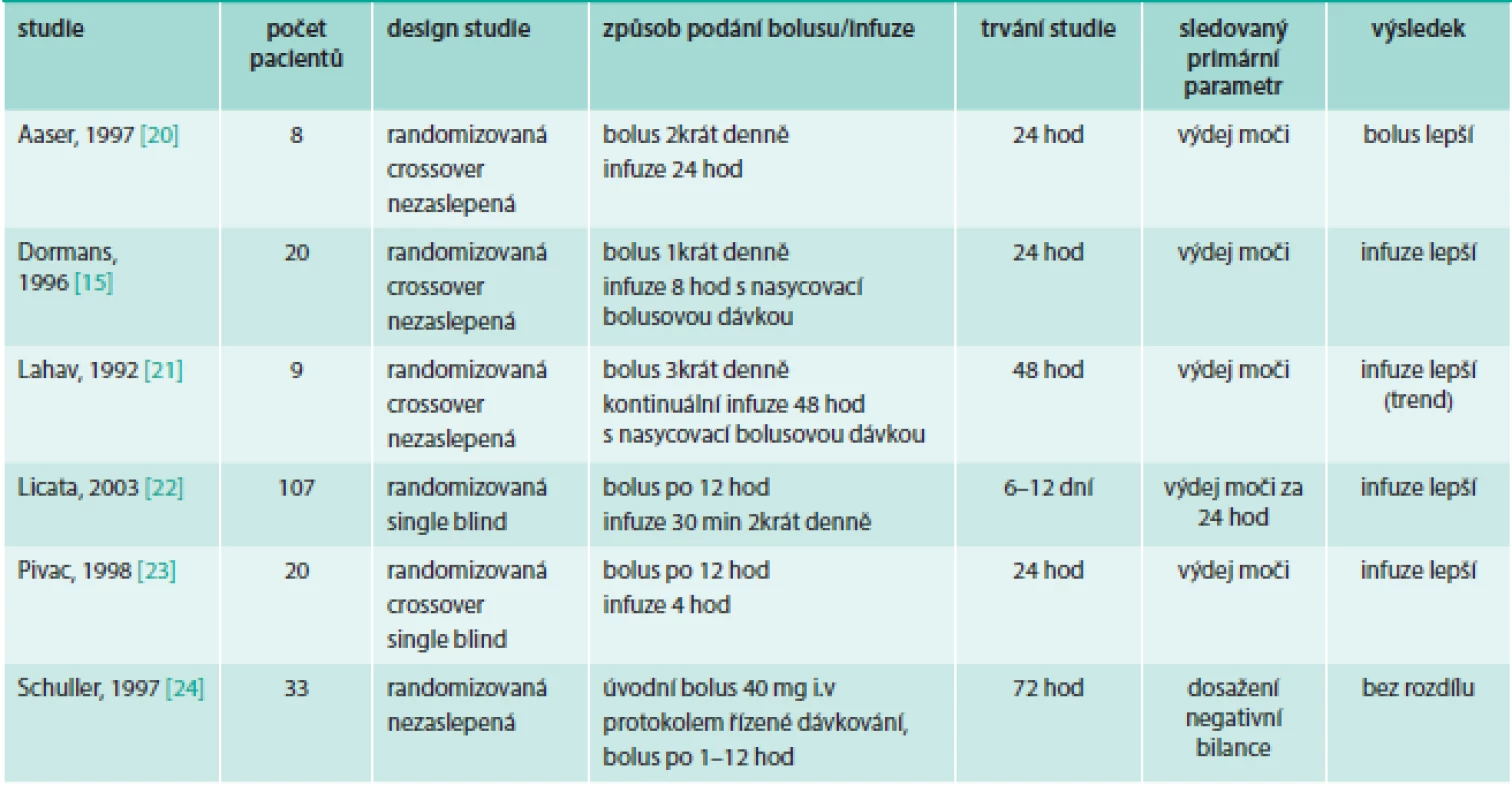
Tab. 3. Prospektivní studie srovnávající bolusové vs kontinuální podání furosemidu u pacientů se srdečním selháním 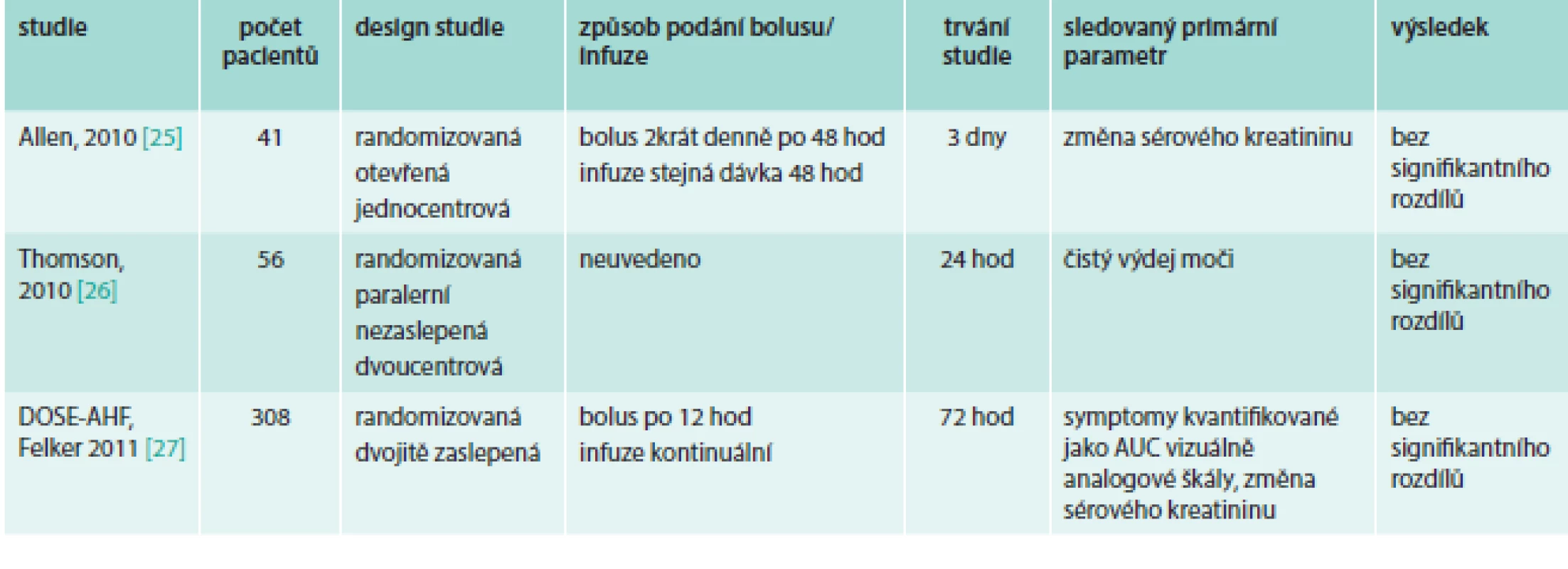
Tab. 4. Přehled studií srovnávajících bolusové vs kontinuální podání furosemidu u pacientů na ICU 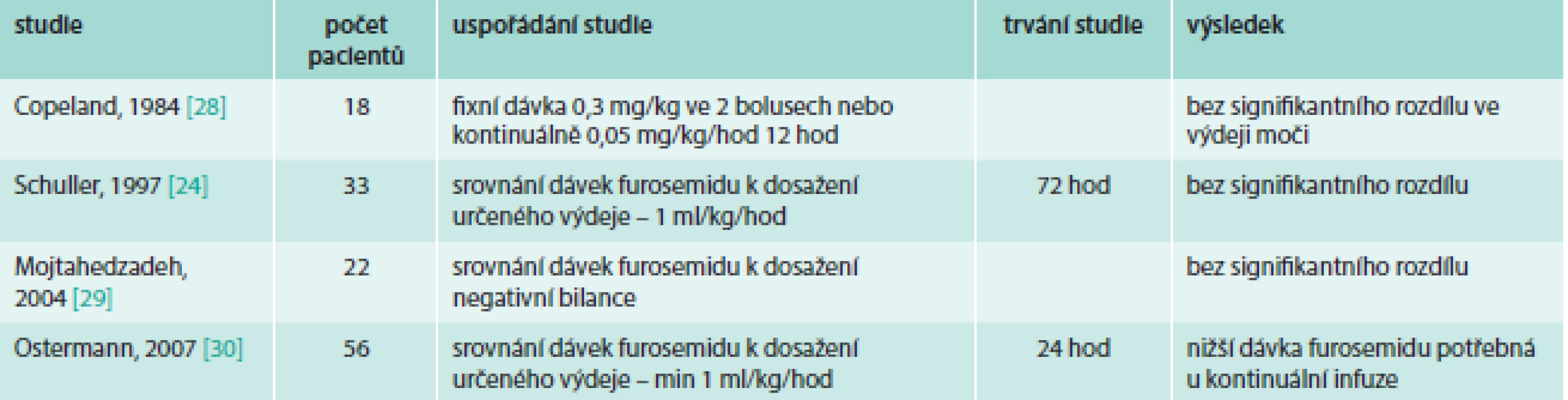
Diskuse
Intravenózní podání vyšších dávek furosemidu je indikováno zejména v léčbě akutně zhoršeného srdečního selhání (ADHF), protože u většiny hospitalizovaných pacientů dochází k objemovému přetížení a městnání a je potřeba rychlý nástup účinku. Obecně se dá říci, že velikost dávky kličkového diuretika je určena dosažením dostatečné diurézy vedoucí k optimálnímu stavu bilance tekutin. Úvodní dávka v léčbě srdečního selhání je doporučena 20–40 mg, obvyklé denní dávky jsou 40–240 mg s individuální titrací dle odezvy na léčbu a dle bilance tekutin [3]. K navyšování dávky furosemidu dochází při diuretické rezistenci, která je jedním z příznaků kardiorenálního syndromu [31,32]. K jejímu překonávání používáme kromě navyšování dávky diuretik také převedení na kontinuální infuzi furosemidu, kombinaci furosemidu s diuretiky, která působí v jiných částech nefronu (s hydrochlorotiazidem, spironolaktonem, eplerenonem, amiloridem, krátkodobě s acetazolamidem), použití dialyzačních technik, restrikci příjmu soli, a naopak při chronické hyponatremii koncentrovaný roztok NaCl s následnou kontinuální dávkou furosemidu, při nefrotickém syndromu podání s albuminem a při sníženém srdečním výdeji použití inotropik [33]. Maximální denní dávky furosemidu jsou individuálně obtížně určitelné, ale lze říci, že závažné nežádoucí účinky lze s vyšší frekvencí očekávat při dávce furosemidu nad 2 000 mg/den. Rychlost kontinuální infuze by neměla překročit 2,5 mg/min, při renální insuficienci 4 mg/min, v maximální denní dávce 1 500–2 000 mg/den [34].
Důležitost funkce diuretik a vazodilatačních látek bude pravděpodobně nabývat na významu lepším poznáním patofyziologických mechanizmů kardiorenálního syndromu. Vedle již známé představy, že ke zhoršení renálních funkcí při srdečním selhání přispívá hypotenze a snížený srdeční výdej s aktivací sympatiku a RAAS, je dnes připojován význam renální venózní kongesce, která zvyšuje venózní a intraabdominální tlak [35].
Menší studie porovnávající kontinuální a bolusové podání u pacientů s ADHF [15,20–24] byly prováděny na malém vzorku pacientů a hlavním sledovaným ukazatelem byl výdej moči v závislosti na dávce furosemidu, případně v závislosti na množství furosemidu v moči. Studie byly krátkodobé (24–72 hod), výrazně se lišily v dávkách furosemidu v rozmezí od 80 mg do 2 000 mg/den. Někdy kontinuálnímu podání předcházela malá nasycovací bolusová dávka [15,21] nebo bolusová dávka nebyla podávána intermitentně, ale celá denní dávka jednorázově [15]. Podle metaanalýzy [18] těchto výsledků byla kontinuální infuze spojena s větším výdejem moči, kratší délkou nemocničního pobytu, menším ovlivněním renálních funkcí oproti bolusovému podání. Celková dávka furosemidu byla srovnatelná v obou režimech podávání. Rozdíly v elektrolytové dysbalanci a v úmrtnosti byly nesignifikantní. Kritizováno [7,25] je však zařazení studie Licata et al [22] se 107 pacienty, v níž byla podávána současně s kontinuální infuzí furosemidu i hypertonická solná infuze a podání kontinuální infuze furosemidu trvalo 30 min 2krát denně. Po vyřazení této studie jsou rozdíly mezi kontinuální infuzí a bolusovým podáním nesignifikantní. Podle této metaanalýzy byla kvalita hodnocených výsledků slabá a data jsou nedostatečná k doporučení pro klinickou praxi [18].
Proto je dnešní výzkum zaměřen na uspořádání prospektivních studií, které by mohly lépe odpovědět na otázku optimálního podání i.v. furosemidu.
Prospektivní randomizovaná otevřená jednocentrová studie se 41 pacienty Allen et al [25] porovnávala podávání bolusu furosemidu po 12 hod se stejnou dávkou v kontinuální infuzi v délce ≥ 48 hod. Nebyl nalezen signifikantní rozdíl ve výdeji moči ani v délce hospitalizace. Ve změně kreatininu nebyl signifikantní rozdíl, pouze byl naznačený trend ve zvýšení kreatininu oproti vstupním hodnotám překvapivě po kontinuálním podávání furosemidu. Také celkový výdej moči byl nesignifikantně vyšší po bolusovém podání, což neodpovídá hypotéze a výsledkům ostatních studií. Souhrnně, při stejné celkové dávce podaného furosemidu v obou větvích nebyl nalezen podstatný rozdíl.
V menší prospektivní nezaslepené paralelní studii Thompson et al [26] srovnávající kontinuální a intermitentní podání furosemidu u 57 pacientů průměrně 4 dny byla kontinuální infuze signifikantně efektivnější měřeno celkovým denním výdejem moči, byla vyšší efektivita diurézy (výdej moči/mg furosemidu) a menší zvýšení sérového kreatininu. Signifikantní bylo i zkrácení hospitalizace (p = 0,006). Byla také pozorována tendence ke kratší délce léčby i.v. furosemidem a vyšší snížení hmotnosti. Design studie dovoloval individuální přídatnou léčbu, která sice může ovlivnit výdej moči, ale více odpovídá reálným podmínkám. Skupina s kontinuální infuzí měla vyšší hladinu průměrného sérového kreatininu a dostala vyšší dávky furosemidu, tedy byla náchylnější k diuretické rezistenci a kardiorenálnímu syndromu. V bolusové skupině dostávalo více pacientů inotropní podporu. Bohužel není uvedeno, jak frekventně byly podávány bolusové dávky.
Prozatím největší prospektivní studie (randomizovaná, dvojitě zaslepená DOSE-AHF [27]) zařadila 308 pacientů s ADHF a srovnávala bolusy po 12 hod s kontinuální infuzí v dávce nízké – tedy ekvivalentní pacientově předešlé p.o. dávce (rozmezí 80–240 mg furosemidu) nebo v dávce vyšší (2,5krát násobek předešlé p.o. dávky). Hodnocena byla úleva od symptomů v průběhu 72 hod jako plocha pod křivkou AUC skórovacího systému vizuální analogové škály a změna sérového kreatininu po 72 hod (průměrná změna při bolusech 4,4 ± 26,5 µmol/l vs 6,2 ± 26,5 µmol/l při kontinuálním podání; p = 0,45). V obou sledovaných parametrech byly rozdíly nesignifikantní. Nebyl nalezen rozdíl ve výskytu závažných vedlejších účinků (bolus/kontinuální podání: komorové tachykardie 7/4, IM 4/1, renální selhání 8/11) ani v hodnocení rehospitalizace a kompozitní mortality po 60 dnech sledování. Nevýhodou uspořádání této studie je podávání placebo kontinuálních infuzí u pacientů s bolusovým podáním furosemidu, tedy delší čas strávený v poloze vleže, která potencuje diurézu. Navýšit dávku po 48 hod podávání bylo potřeba spíše u bolusového podání a při nízkodávkovém režimu. Bolusová skupina vykázala vyšší průměrné dávky furosemidu (průměrná celková dávka po 72 hod – 592 mg bolus vs 480 mg kontinuální infuze). Zhoršení renálních funkcí po 3 dnech podávání furosemidu se vyskytlo častěji ve skupině s vyšším dávkováním furosemidu, ale navzdory tomu nebylo pozorováno klinické zhoršení po 60 dnech v porovnání s nižší dávkou.
U pacientů s akutním renálním poškozením (AKI) je diuretická terapie kontroverzní. Protože oligurie je považována za špatný prognostický znak, kličková diuretika jsou často používána pro zvýšení výdeje moči při riziku vzniku AKI, pro léčbu AKI a pro snížení potřeby dialýzy. Existují experimentální práce předpokládající prospěšný vliv furosemidu na renální funkce, redukci poškození tubulů, ale klinické studie zaměřené na profylaktické podávání ukazují spíše na zhoršení parametrů funkce ledvin [12]. Použití diuretik v léčbě AKI je asociováno se zvýšeným rizikem neobnovy renálních funkcí a zvýšenou mortalitou [36,37]. Žádná z těchto studií však nepotvrdila kauzalitu pozorované asociace kličkového diuretika a mortality [12]. Podle metaanalýz [2,38] furosemid není účinný v prevenci a léčbě AKI, potenciální benefit se neprokázal. Furosemid neredukoval nemocniční mortalitu, potřebu dialýzy, počet dialýz do obnovy renálních funkcí, ani délku hospitalizace. Spíše se zdá, že pozitivní diuretická odpověď na podání furosemidu je známkou mírnější formy AKI, než že by furosemid byl schopen zvrátit závažnější formu onemocnění do méně závažné a zlepšit prognózu pacienta. Závažnost AKI určuje, zda pacient odpoví na podání furosemidu [2,38]. Proto může být dlouhé podávání vysokých dávek infuzí furosemidu pro oddálení dialýzy spojeno s vyšší mortalitou než časná dialýza [39]. Přestože pravděpodobně chybí přímý vliv na mortalitu a nebyl klinicky prokázán renoprotektivní vliv, podávání furosemidu má v terapii důležité místo pro zvládání retence tekutin a objemového přetížení, hyperkalemie, acidózy a zkrácení doby ventilace [12].
Studie porovnávající kontinuální a bolusové podání furosemidu u kriticky nemocných pacientů na jednotce intenzivní péče byly dosud publikovány 4 celkem se 129 pacienty a byly shrnuty v metaanalýze Zangrillo et al [19]. Zařazené studie prokázaly stejnou efektivitu intermitentního bolusového podání a kontinuální infuze furosemidu. Furosemid podaný kontinuálně nebyl asociován se signifikantní redukcí nemocniční mortality oproti bolusovému podání (6/55 vs 10/56). Zároveň je nutno konstatovat, že současná data jsou nedostatečná k jednoznačnému závěru, který by vedl k doporučení konkrétního způsobu podávání furosemidu u dospělých pacientů na jednotce intenzivní péče.
Randomizovaná nezaslepená studie Ostermann et al [30], která byla také zahrnuta do metaanalýzy, srovnávala účinnost kontinuálního a bolusového podání u 59 kriticky nemocných pacientů s retencí tekutin. Dávkování bylo titrováno po 3 hod, podle dosažené diurézy. Nebyl nalezen signifikantní rozdíl v diuretické odpovědi po 24 hod (5,3 l u bolusového podání vs 5,4 l u infuze), což je logické vzhledem k cílení dávkování podle diurézy. Nebyl nalezen rozdíl v nemocniční mortalitě, počtu pacientů na ventilační podpoře, ve změně kreatininu nebo kalkulované GFR. V bolusové skupině bylo potřeba signifikantně vyšších dávek furosemidu pro dosažení diurézy (24,1 mg/hod bolus vs 9,2 mg/hod infuze; p = 0,0002). Průměrné množství vydané moči bylo vyšší u infuzního podání (31,6 vs 18 ml/mg u bolusového podání; p = 0,014). Tedy oba postupy byly účinné pro dosažení algoritmem vedené diurézy, kontinuální infuze však byla efektivnější než intermitentní bolusové podání, protože bylo potřeba signifikantně menší množství furosemidu. Rozdíl v podání inotropní podpory autoři uvádějí jako nesignifikantní, přesto za povšimnutí stojí, že v bolusové skupině byla podávána u 1 pacienta (3,7 %) a ve skupině infuzního podání u 6 pacientů (19 %).
Ve studii Schuller et al [24] nebyl nalezen rozdíl v dávce furosemidu mezi kontinuálním a bolusovým podáním. Ve srovnání se studií Ostermann et al [30] byla v této studii vyšší průměrná dávka furosemidu při kontinuálním podání (450 mg/24 hod, tedy 18,8 mg/hod), dávky při bolusovém podání se tolik nelišily (447 mg/24 hod, tedy 18,6 mg/hod). Zajímavé je pozorování, že pacienti, kteří splnili kritéria, ale do studie nebyli zařazeni a volba dávky furosemidu tak nebyla vedena podle předem daného algoritmu, dostali kumulativně nižší dávku furosemidu, dosáhli nižší diurézy a měli delší pobyt na jednotce intenzivní péče a delší hospitalizaci.
Závěr
Přestože se podle farmakologických vlastností zdá z hlediska účinnosti i bezpečnosti výhodnější použití vysokých dávek furosemidu v kontinuální infuzi, současná evidence u pacientů se srdečním selháním a u kriticky nemocných pacientů vyšší účinnost kontinuální infuze jednoznačně nepotvrdila. Ve většině studií nebyl nalezen signifikantní rozdíl mezi oběma způsoby podání ve výdeji moči nebo v dávkách furosemidu k dosažení cílové diurézy. Z hlediska bezpečnosti byly sledovány především změny sérového kreatininu, které se ve většině studií signifikantně nelišily. Pro malý rozsah prospektivních studií nelze výsledky považovat za dostatečné pro doporučení v klinické praxi. V případě nutnosti použít extrémně vysoké dávky furosemidu k překonání diuretické rezistence bychom se kvůli přímé toxicitě přikláněli spíše ke kontinuálnímu podání.
Reálná praxe se od evidence liší v častějším podávání intermitentních bolusů blížících se, především při renální insuficienci, více kontinuálnímu podání než bolus podaný po 12 hod nebo 1krát denně. Podávané dávky furosemidu v ČR většinou nebývají tak vysoké jako dávky používané ve studiích.
Nejsou zodpovězeny všechny otázky týkající se optimální strategie podávání vysokodávkového furosemidu. Jeho prokazatelný účinek při snížení městnání a dlouhé klinické zkušenosti mu ponechávají zásadní místo v léčbě pacientů s retencí tekutin při akutní dekompenzaci srdečního selhání a akutní renální insuficienci. Furosemid navíc není nikdy podáván pacientům samostatně. Do budoucna je třeba hledat optimální strategie v kombinaci s jinými léčivy, jak bylo prokázáno ve studii u pacientů s plicním edémem, u nichž kombinace vysokodávkového nitrátu s nízkodávkovým furosemidem byla superioritní nad vysokodávkovým furosemidem s nízkodávkovým nitrátem [40] nebo u pacientů s ADHF byla kombinace nízkodávkového furosemidu (kontinuální infuze 5 mg/hod) s nízkodávkovým dopaminem (5 µg/kg/min) stejně účinná jako vysokodávkový furosemid (20 mg/hod) ve výdeji moči a snížení dyspnoe s lepším bezpečnostním profilem na renální funkce [41]. Jako slibné se jeví jiné metody snížení retence tekutin, např. použití venovenózní ultrafiltrace. Data, která máme zatím k dispozici (studie RAPID-CHF, UNLOAD), ukazují na snížení rehospitalizace, vyšší odstranění sodíku a tekutin bez elektrolytových abnormalit nebo neurohumorální aktivace, které jsou problémem při podávání diuretik [42].
Mgr. Jana Gallusová
jana.gallusova@homolka.cz
Oddělení klinické farmacie Nemocnice Na Homolce, Praha
www.homolka.cz
Doručeno do redakce 17. 4. 2014
Přijato po recenzi 7. 7. 2014
Zdroje
1. Peacock WF, Costanzo MR, De Marco T et al. Impact of intravenous loop diuretics on outcomes of patients hospitalizes with acute decompensated heart failure: insights from the ADHERE registry. Cardiology 2009; 113(1): 12 -19.
2. Ho KM, Power BM Benefits and risks of furosemide in acute kidney injury. Anaesthesia 2010; 65(3): 283–293.
3. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. European Heart Journal 2012; 33(14): 1787–1847.
4. HFSA 2010 Comprehensive heart failure practice guideline. J Card Fail 2010; 16(6): e1-e194. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cardfail.2010.04.004>.
5. Wilcox CS. New insights into diuretic use in patients with chronic renal disease. J Am Soc Nephrol 2002; 13(3): 798–805.
6. Ellison DH. Diuretic therapy and resistence in congestive heart failure. Cardiology 2001; 96(3–4): 132–143.
7. Felker GM, O´Connor ChM, Braunwald E. Loop diuretics in acute decompensated heart failure. Necessary? Evil? A necessary evil? Circ Heart Fail 2009; 2(1): 56–62.
8. Dormans TP, Pickkers P, Russel FG et al. Vascular effects of loop diuretics. Cardiovasc Res 1996; 32(6): 988–997.
9. Brater DC, Polavat C, Selwell R. Furosemide in patients with heart failure: shift in dose-response curves. Clin Pharmacol Ther 1980; 28(2): 182–186.
10. Kaissling B, Bachmann S, Kriz W. Structural adaptation of the distal convoluted tubule to prolonged furosemide treatment. Am J Physiol 1985; 248(3 Pt 2): F374-F381.
11. Aravindan N, Shaw A. Effect of Furosemide Infusion on Renal Hemodynamics and Angiogenesis Gene Expression in Acute Renal Ischemia/Reperfusion. Renal Failure 2006; 28(1): 25–35.
12. Townsend DR, Bagshaw SM. New insights on intravenous fluids, diuretics and acute kidney injury. Nephron Clin Pract 2008; 109(4): c206-c216. Dostupné z DOI: <http://doi: 10.1159/000142930>.
13. Francis GS, Siegel RM, Goldsmith SR et al. Acute vasoconstrictor response to intravenous furosemide in patients with chronic congestive heart failure. Activation of the neurohumoral axis. Ann Intern Med 1985, 103(1): 1–6.
14. Miller ML, Blankenship CS. Ototoxicity. In: Tisdale JE, Miller DA. Drug-Induced Diseases: Prevention, Detection, and Management 2nd ed. American Society of Health-System Pharmacist: Bethesda, Maryland 2010 : 1051. ISBN 978–1585282050.
15. Dormans TPJ, van Meyel JJM, Gerlag PGG et al. Diuretic efficacy of high dose furosemide in severe heart failure: bolus injection versus continuous infusion. J Am Coll Cardiol 1996; 28(2): 376–382.
16. Rybak LP. Pathophysiology of furosemide ototoxicity. Journal of Otolaryngology 1982; 11(2): 127–133.
17. van Meyel JJ, Smits P, Dormans T et al. Continuous infusion of furosemide in the treatment of patients with congestive heart failure and diuretic resistence. J Intern Med 1994; 235(4): 329–334.
18. Salvador DRK, Punzalan FE, Ramos GC et al. Continuous infusion versus bolus injection of loop diuretics in congestive heart failure. Cochrane Database Syst Rev 2005; (3): CD003178.
19. Zangrillo A, Cabrini L, Monti G et al. Continuous infusion versus bolus injection of furosemide in critically ill patients. A systematic review and meta-analysis. Signa Vitae 2011; 6(2): 58–63.
20. Aaser E, Gullestad L, Tollofsrud S et al. Effect of bolus injection versus continuous infusion of furosemide on diuresis and neurohormonal activation in patients with severe congestive heart failure. Scandinavian J Clin Lab Invest 1997; 57(4): 361–367.
21. Lahav M, Regev A, Raanani P et al. Intermittent administration of furosemide vs continuous infusion preceded by a loading dose for congestive heart failure. Chest 1992; 102(3): 725–731.
22. Licata G, DiPasquale P, Parinello G et al. Effects of high-dose furosemide and small-volume hypertonic saline solution infusion in comparison with a high dose of furosemide as bolus in refractory congestive heart failure: long-term effects. Am Heart J 2003; 145(3): 459–466.
23. Pivac N, Rumboldt Z, Sardelic S et al. Diuretic effects of furosemide infusion versus bolus injection in congestive heart failure. Int J Clin Pharmacol Res 1998; 18(3): 121–128.
24. Schuller D, Lynch JP, Fine D. Protocol-guided diuretic management: comparison of furosemide by continuous infusion and intermittent bolus. Crit Care Med 1997; 25(12): 1969–1975.
25. Allen LA, Turer AT, DeWald T et al. Continuous versus bolus dosing of Furosemide for patients hospitalized for heart failure. Am J Cardiol 2010; 105(12): 1794–1797.
26. Thomson MR, Nappi JM, Dunn SP et al. Continuous versus intermittent infusion of furosemide in acute decompensated heart failure. J Cardiac Fail 2010; 16(3): 188–193.
27. Felker GM, Lee KL, Bull DA et al. Diuretic strategies in patients with acute decompensated heart failure. N Engl J Med 2011; 364(9): 797–805.
28. Copeland JG, Campbell DW, Plachetka JR et al. Diuresis with continuous infusion of furosemide after cardiac surgery. Am J Surg 1983; 146(6): 796–799.
29. Mojtahedzadeh M, Salehifar E, Vazin A et al. Comparison of hemodynamic and biochemical effects of furosemide by continuous infusion and intermittent bolus in critically ill patients. J Infus Nurs 2004; 27(4):255–261.
30. Ostermann M, Alvarez G, Sharpe MD et al. Frusemide administration in critically ill patients by continuous compared to bolus therapy. Nephron Clin Pract 2007; 107(2): c70-c76.
31. Ronco C, Cicoira M, McCullough PA. Cardiorenal syndrome type 1. J AmColl Cardiol 2012; 60(12): 1031–1042.
32. House AA, Haapio M, Lassus J et al. Therapeutic strategies for heart failure in cardiorenal syndromes. Am J Kidney Dis 2010; 56(4): 759–773.
33. Tůma P, Hrdý P Diuretika v terapii ,,diuretické rezistence“ u pacientů s městnavou srdeční slabostí. Vnitř Lék 2006; 52(9): 782–789.
34. Micromedex Drug Summary Information. Version 2.0. Truven Health Anylytics 2014. Dostupnné z WWW: <http://www.micromedexsolutions.com/micromedex2/4.34.0/WebHelp/Search_Results/360_View/Drug_Dashboards.htm>.
35. Mullens W, Abrahams Z, Skouri HN et al. Elevated intra-abdominal pressure in acute decompensated heart failure: a potential contributor to worsening renal function? J Am Coll Cardiol 2008; 51(3): 300–306.
36. Mehta RL, Pascual MT, Soroko S et al. Diuretics, mortality, and nonrecovery of renal function in acute renal failure. JAMA 2002; 288(20): 2547–2553.
37. Uchino S, Doig GS, Bellomo R et al. Diuretics and mortality in acute renal failure. Crit Care Med 2004; 32(8): 1669–1677.
38. Ho KM, Sheridan DJ. Meta-analysis of frusemide to prevent or treat acute renal failure. BMJ 2006; 333 : 420. Dostupné z DOI: < http://dx.doi.org/10.1136/bmj.38902.605347.7C>.
39. Seabra VF, Balk EM, Liangos O et al. Timing of renal replacement therapy initiation in acute renal failure: a meta-analysis. Am J Kidney Dis 2008; 52(2): 272–284.
40. Cotter G, Metzkor E, Kaluski E Randomised trial of high-dose isosorbide dinitrate plus low-dose furosemide versus high-dose furosemide plus low-dose isosorbide dinitrate in severe pulmonary oedema. Lancet 1998; 351(9100): 389–393.
41. Giamouzis G, Butler J, Starling RC et al. Impact of dopamine infusion on renal function in hospitalized heart failure patients: results of the dopamine in acute decompensated heart failure (DAD-HF) trial. J Card Fail 2010; 16(12): 922–930.
42. Felker GM, Mentz RJ Diuretics and ultrafiltration in acute decompensated heart failure. J Am Coll Cardiol 2012; 59(24): 2145–2153. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2011.10.910>.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2014 Číslo 10- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Výskyt agranulocytózy po tyreostaticích v kohortě pacientů s Gravesovou nemocí léčených radioaktivním jodem 131I v průběhu 14 let – editorial
- Czech TAVI Registry. Potrebujeme registre? – editorial
- Léčba obezity u osob s diabetem 2. typu – editorial
- Léčba bortezomibem u pacientů s onemocněním z depozice lehkých řetězců imunoglobulinu
- Infekční endokarditidy v okrese Tábor v letech 2009–2013
- Výskyt agranulocytózy po tyreostaticích v kohortě pacientů s Gravesovou nemocí léčených radioaktivním jodem 131I v průběhu 14 let
- Uživatelské výstupy z národního registru katetrových implantací aortální chlopně (Czech TAVI Registry): možnosti analytických výstupů založených na databázovém systému TrialDB2
- Terapeutické monitorování vankomycinu v rutinní klinické praxi
- Plicní hypertenze – patofyziologické mechanizmy
- Monoklonální gamapatie nejistého významu a asymptomatický mnohočetný myelom z pohledu roku 2014
- Asociace aterotrombózy a trombofilie – genetické aspekty
- Optimální způsob podání vysokodávkového i.v. furosemidu – kontinuálně nebo bolusově?
- Dna a kardiovaskulární riziko
- Jak se mění možnosti léčby obézních diabetiků 2. typu
- Aktualizované stanovisko České společnosti pro hypertenzi k provádění renálních denervací u rezistentní hypertenze
- Jiří Gallo. Osteoartróza. Průvodce pro každodenní praxi.
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Terapeutické monitorování vankomycinu v rutinní klinické praxi
- Optimální způsob podání vysokodávkového i.v. furosemidu – kontinuálně nebo bolusově?
- Monoklonální gamapatie nejistého významu a asymptomatický mnohočetný myelom z pohledu roku 2014
- Dna a kardiovaskulární riziko
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



