-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Endokrinné zmeny pri chorobách pečene
Endocrine changes in liver disease
Liver diseases have an influence on function and morphology of all endocrine glands. Knowledge of these specific changes is important in correct interpretation of pathological clinical and laboratory hormonal symptoms and signs induced by liver disease. We analyze the influence on the thyroid, bone metabolism, adrenocorticotropic axis, gonadal hormones, prolactin and growth hormone.
Key words:
liver – liver disease – thyroid disease – bone changes – cortisol – gonadal hormones – prolactin – growth hormone
Autoři: J. Kollerová; T. Koller; J. Payer
Působiště autorů: V. interná klinika Lekárskej fakulty UK a UNB Bratislava, Slovenská republika, prednosta prof. MUDr. Juraj Payer, CSc.
Vyšlo v časopise: Vnitř Lék 2012; 58(1): 24-30
Kategorie: Přehledné referáty
Souhrn
Choroby pečene vplývajú na funkciu alebo morfológiu všetkých endokrinných orgánov. Znalosť jednotlivých zmien má význam pri správnej interpretácii patologických klinických alebo laboratórnych hormonálnych prejavov podmienených hepatopatiou. Súčasťou práce je analýza vplyvu na štítnu žľazu, kostný metabolizmus, adrenokortikotropnú os, pohlavné hormóny, koncentráciu prolaktínu a rastového hormónu.
Kľúčové slová:
pečeň – hepatopatia – tyreopatia – kostné zmeny – kortizol – pohlavné hormóny – prolaktín – rastový hormónPráca s rovnakým názvom bola prezentovaná vo forme prednášky dňa 16. 10. 2010 v Košiciach na XXXIII. endokrinologických dňoch s medzinárodnou účasťou.
Úvod
Choroby pečene patria medzi najrozšírenejšie ochorenia v populácii. Môžu roky prebiehať latentne, nerozpoznané, alebo sa môžu manifestovať rôznymi klinickými a laboratórnymi prejavmi. Pečeň zohráva centrálnu úlohu v produkcii hormónov, v metabolizme steroidných aj proteínových hormónov, v tvorbe väzbových proteínov, je cieľovým tkanivom mnohých hormónov a zúčastňuje sa ich degradácie a vylučovania. Poruchy jej funkcie sa odrazia v endokrinnom systéme organizmu, v jeho fungovaní, hladinách hormónov, môžu sa prejavovať aj ako endokrinné poruchy. Alkohol i lieky používané v hepatológii môžu vplývať na hormonálne parametre a funkciu. Je známy vplyv chorôb pečene na nasledovné žľazy s vnútorným vylučovaním a hormóny – štítnu žľazu, prištítne telieska a kostný metabolizmus, adrenokortikotropnú os, hladinu mineralokortikoidov, hladiny antidiuretického hormónu, pohlavné hormóny u muža i ženy, hladinu prolaktínu, os rastového hormónu, metabolizmus glukózy.
Funkčné a morfologické zmeny štítnej žľazy
Na alterácii tyreoidálnych hormónov v plazme sa pri hepatálnych ochoreniach podieľajú zmeny tyreoidálnych väzbových proteínov, poruchy väzby T3 a T4 na väzbové proteíny, porušená hepatálna konverzia T4 na T3, poruchy hepatálneho klírensu rT3. Hodnoty sa menia v závislosti od etiológie a štádia pečeňového ochorenia, v závislosti od akútneho alebo chronického priebehu, súvisia s interkurentnými ochoreniami a výživou.
Hladina celkového T4 pri cirhóze závisí od produkcie tyroxín viažuceho globulínu. Denná produkcia T4 býva v norme alebo mierne znížená. V dôsledku zníženej hepatálnej konverzie T4 na T3 je znížená hladina celkového aj voľného T3 a vyššia hladina rT3 pre poruchy jeho vylučovania pečeňou. Býva prítomná subnormálna reakcia tyreostimulačného hormónu (TSH) na tyreoliberín (TRH), zrejme v dôsledku dopaminergnej inhibície na uvoľňovanie TSH hypofýzou. Abnormality plazmatického T3 a rT3 súvisia so závažnosťou alkoholovej cirhózy. Pomer rT3/T3 odráža poruchu hepatálneho vychytávania a konverzie T4 na T3 a zhoršené hepatálne vylučovanie rT3. Profil plazmatických tyreoidálnych hormónov pri cirhóze pripomína syndróm nízkeho T3, ktorý nachádzame pri ťažko chorých pacientoch a pri kalorickej deprivácii. Status nízkeho T3 pri cirhóze súvisí so zníženou hepatocelulárnou funkciou, môže ale súvisieť i so zníženým kalorickým príjmom a ostatnými faktormi u ťažko chorých pacientov a môže byť adaptačným mechanizmom hypotyreózy na zachovanie zásob proteínov v organizme [1].
U pacientov s akútnou vírusovou hepatitídou nachádzame v dôsledku zvýšených plazmatických hladín tyroxín viažuceho globulínu zvýšené hladiny celkového T4, pričom hodnoty voľného tyroxínu (fT4) môžu byť v norme alebo zvýšené. Súvisí to i s poruchou hepatálnej konverzie T4 na T3. Hladiny voľného trijódtyronínu (fT3) bývajú významne redukované. Biologicky inaktívny rT3 je tak ako pri cirhóze v dôsledku poruchy hepatálneho odbúravania zvýšený. Potreba zvýšenej produkcie T4 môže spôsobiť nárast objemu štítnej žľazy a rozvoj strumy v priebehu akútnej vírusovej hepatitídy [2].
Pri chronickej vírusovej hepatitíde (histologicky chronická aktívna alebo chronická perzistujúca hepatitída) bez prejavu dekompenzácie bývajú hladiny celkového T4 a tyroxín viažuceho globulínu (TBG) zvýšené, hodnoty fT4, TSH, fT3 a rT3 sú ale v norme. Pri fulminantnom priebehu dochádza ku poruche syntézy väzbových proteínov, hodnoty celkového T4 a T3 sú veľmi nízke a hodnota rT3 býva vysoká. Nárast pomeru rT3/T4 a T4/T3 je spojený s obzvlášť zlou prognózou [3,4].
Bolo publikovaných 17 štúdií, z ktorých 12 potvrdilo asociáciu vírusovej hepatitídy C s autoimunitným ochorením štítnej žľazy alebo s tyreoidálnou dysfunkciou, čo potvrdila aj metaanalýza týchto štúdií. Frekvencia výskytu tyreoidálnych autoprotilátok u HCV pozitívnych pacientov sa popisuje v 8–48 % prípadov. Prevalencia autoimunitného ochorenia štítnej žľazy je vyššia u pacientov HCV infekciou ako pri VHB, VHD alebo u neinfikovaných pacientov. Vplyv na rozvoj autoimunitnej tyreoidálnej dysfunkcie má genetická predispozícia, faktory prostredia vrátane deficitu jódu, ženské pohlavie má tiež vyššiu prevalenciu autoimunitného ochorenia štítnej žľazy. Niekoľko štúdií ukázalo zvýšenú expresiu IFN γ a chemokínov hepatocytmi pri VHC. Infekcia HCV zvyšuje expresiu génu CXCL 10 a tým následnú sekréciu chemokínu v tyreocytoch, hepatocytoch aj β bunkách pankreatických ostrovčekov. CXCL 10 aktivuje TH1 lymfocyty, tie produkujú IFN γ a TNF a tie indukujú ďalšiu CXCL 10 expresiu. Tento proces podporuje rozvoj autoimunitného procesu, obzvlášť u geneticky predisponovaných jedincov. TH1 lymfocytárna imunitná odpoveď je zahrnutá v indukcii autoimunitnej tyreoiditídy, Gravesovej choroby, endokrinnej orbitopatie. Uvažuje sa aj o priamom infikovaní štítnej žľazy vírusom hepatitídy C, v tyreocytoch sa dokázala HCV RNA [5–7].
U pacientov s autoimunitnou chronickou aktívnou hepatitídou alebo primárnou biliárnou cirhózou (PBC) sa dokázala zvýšená prevalencia autoimunitného ochorenia štítnej žľazy. Títo pacienti majú vysoké titre tyreoidál-nych autoprotilátok, asi u 10–25 % pacientov s PBC dochádza k rozvoju hypotyreózy. Tyreotoxikóza je v spojení s PBC zriedkavá, častejšie sa vyskytuje pri autoimunitnej chronickej aktívnej hepatitíde. Aj pri PBC aj pri chronickej aktívnej hepatitíde pri zvýšenej hladine TBG zaznamenávame zvýšené hladiny celkového T4, fT4 býva v norme, pre poruchu konverzie T4 na T3 však bývajú nízke hladiny celkového a voľného T3 [3]. Hladiny TSH a vychytávanie rádiojódu štítnou žľazou sú znížené, odpoveď TSH na podanie TRH býva znížená, obzvlášť u pacientov s aktívnou formou hepatopatie. Na diagnózu hypotyreózy je preto potrebné vždy vyšetriť TSH i fT4, hladina celkového T4 môže byť zvýšená. Pacienti s primárnou sklerotizujúcou cholangoitídou mávajú častejšie Riedlovu tyreoiditídu [1].
U pacientov s hepatocelulárnym karcinómom zaznamenávame zvýšenú hladinu TBG, predpokladá sa jeho nadprodukcia, keďže v tumore priamo i v okolí sa zistil jeho vyšší obsah. V dôsledku toho je hladina celkového T4 zvýšená, fT4 a T3 sú ale v norme a pacienti sú klinicky v eutyreóze. TBG máva v dôsledku poruchy glykozylácie zníženú afinitu ku T4. Medzi ďalšie endokrinné prejavy primárnych hepatálnych tumorov patrí hypertyreóza spôsobená nadprodukciou humánneho choriogonadotropínu (hCG) hepatocelulárnym karcinómom. hCG pri identickej α podjednotke so štruktúrou hormónu TSH môže stimulovať receptory na štítnej žľaze a vyvolávať nadprodukciu hormónov štítnej žľazy [8,9].
V poslednom roku sa objavili údaje o tom, že dlhotrvajúca hypotyreóza (> 10 rokov) u žien môže byť rizikovým faktorom vývoja hepatocelulárneho karcinómu s RR 2–3-násobným oproti zdravej populácii. Tento vzťah platil aj po vylúčení pacientov so známymi rizikovými faktormi HCC (obezita, diabetes, alkohol, vírusová infekcia) [10].
Pri depozícii železa do tkaniva štítnej žľazy pri hemochromatóze dochádza často k poruche funkcie (8–20 % pacientov), prevažne zaznamenávame hypotyreózu. Častejšie ako v bežnej populácii sú prítomné i vysoké titre autoprotilátok, expozícia celulárnych antigénov pri toxickom účinku železa vedie k autoimunitnému poškodeniu štítnej žľazy. Hladiny TSH bývajú zvýšené, v súlade s primárnou hypotyreózou, zriedkavo dochádza ku centrálnej hypotyreóze pri poruche sekrécie TSH.
Určité lieky používané v hepatológii interferujú s metabolizmom a distribúciou tyreoidálnych hormónov. Patrí medzi ne furosemid vo vysokých dávkach, zvyšuje hladinu fT4 jeho vytesňovaním z väzby na TBG, pričom hladiny celkového T4 a T3 sú redukované. Podanie glukokortikoidov suprimuje sekréciu TSH, a tým aj hladiny T4 a T3. Propranolol inhibuje hepatálnu konverziu T4 na T3, pri dávkach prekračujúcich 200 mg propranololu dochádza k miernej elevácii fT4 a redukcii T3. Najlepšie preskúmaný efekt s praktickým dopadom na manažment pacientov má interferón α. Pri jeho podávaní pri chronickej vírusovej hepatitíde dochádza asi u 10 % pacientov k poruche funkcie v zmysle hypo - alebo hypertyreózy. Pomer výskytu zníženej a zvýšenej funkcie sa líši v jednotlivých zdrojoch, hypotyreóze môže predchádzať prechodná tyreotoxikóza. Riziko rozvoja tyreoidálnej dysfunkcie nezávisí od dávky, súvisí však s dĺžkou trvania terapie a zriedka sa objaví skôr ako po 8 týždňoch terapie, priemerný výskyt bol popísaný 6 mesiacov po začatí antivírusovej liečby. Predpokladá sa autoimunitný pôvod tyreopatie, v 30–50 % prípadov sa dokázala indukcia tvorby tyreoidálnych autoprotilátok. Interferón môže indukovať expresiu MHC triedy II antigénov na tyreocytoch s následnou aktiváciou cytotoxických T-bu-niek voči tyreoidálnym bunkám. Pred zahájením a v priebehu liečby je teda nevyhnutné hodnoty tyreoidálnych hormónov aj autoprotilátok sledovať. Po prerušení terapie dochádza asi v 50 % pacientov k úprave funkcie štítnej žľazy, u tyreotoxických pacientov by sa preto radikálna liečba ako podanie rádiojódu alebo strumektómia nemala zvažovať a liečba IFN by sa mala prerušiť. Poruchu funkcie korigujeme po zhodnotení klinického stavu a laboratórnych výsledkov prípadnou substitučnou alebo tyreostatickou liečbou. V literatúre sa však diskutuje o prerušení alebo pokračovaní v terapii INF α po zistení tyreopatie. Uvažuje sa najmä o negatívnom vplyve predčasného ukončenia terapie antivirotikami na eradikáciu vírusu hepatitídy C, ktorý okrem poškodenia pečene môže následne ovplyvniť aj ďalší priebeh poruchy funkcie štítnej žľazy. Pri objavení tyreopatie je potrebné individuálne zhodnotiť šancu pacienta na eradikáciu vírusu hepatitídy C na jednej strane a riziko z pretrvávania a progresie poruchy funkcie štítnej žľazy na strane druhej [11] (tab. 1).
Tab. 1. Zmeny funkčných parametrov štítnej žľazy v sére pri chorobách pečene a syndrómem nízkeho T<sub>3</sub> 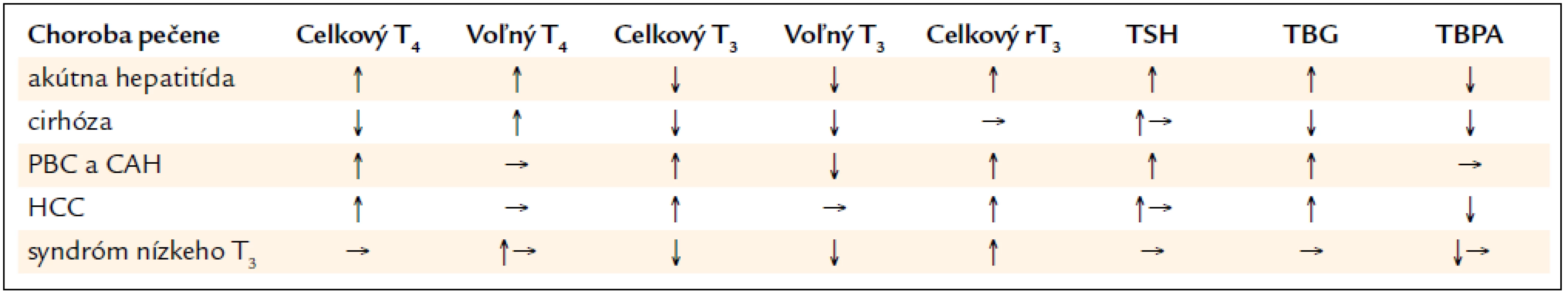
Zmeny kostného metabolizmu
Chronické ochorenia pečene sú asociované s poruchou metabolizmu a transportu kalcia a fosforu, čo priamo ovplyvňuje kostný metabolizmus. Reprezentujú preto rizikovú skupinu, u ktorej častejšie ako v bežnej populácii nachádzame osteoporózu.
U pacientov s ochorením pečene asociovaným s hypoalbuminémiou býva redukovaná celková hladina kalcia. Ionizované kalcium býva prevažne v norme, môže byť ale znížené pri abúze alkoholu a fulminantnom zlyhaní pečene. U väčšiny pacientov s chronickým ochorením pečene je negatívna kalciová bilancia. Spôsobuje ho malnutrícia, malabsorpcia kalcia a fosforu. Pacienti s cholestatickým ochorením majú poruchy vstrebávania vitamínov rozpustných v tukoch. Neadekvátny príjem kalcia alebo vitamínu D a porucha jeho metabolizmu spôsobí, že pri udržiavaní stabilnej hladiny extracelulárneho kalcia ho parathormón čerpá z kostí. Porušené je prepojenie medzi kostnou resorpciou a formáciou. Osteokalcín je peptid syntetizovaný a secernovaný osteoblastami, predpokladá sa, že jeho hladina odráža rýchlosť osteoformácie a osteoblastickú aktivitu. Aktivovaný je vitamín K – dependentnou karboxyláciou. Znížené hladiny osteokalcínu sa zistili nielen u pacientov s primárnou biliárnou cirhózou, ale i pri alkoholovom ochorení pečene, cholestatickej hepatopatii, hemochromatóze a chronickej aktívnej hepatitíde. Pokles hladiny pritom koreluje s poklesom funkcie pečene. Znížená kostná formácia je teda hlavnou príčinou kostného ochorenia pri cholestatickom a hepatocelulárnom ochorení pečene. Dôležitými faktormi poruchy kostného metabolizmu sú i znížená fyzická aktivita, priame účinky alkoholu, hypogonadizmus, znížená hladina hepatálneho „inzulínu podobného faktora 1“ (IGF-1), účinky glukokortikoidov u pacientov s autoimunitným ochorením pečene alebo po transplantácii. Porovnaním denzitometrie pacientov s cirhózou a pacientov bez hepatopatie sa potvrdili signifikantné rozdiely v hodnotách kostnej denzity.
Konzum alkoholu akútne inhibuje sekréciu PTH, čo spôsobí redukciu hladiny ionizovaného kalcia, hyperkalciúriu, vyššie straty magnézia v moči. Výsledkom je reaktívny výstup PTH na vyrovnanie kalciémie. Existuje predpoklad, že práve striedanie hypo - a hyperparatyreózy sa podieľa na s alkoholom asociovanej chorobe kostí. Ťažká hypomagneziémia pri chronickom alkoholizme sa takisto môže podieľať na funkčnej hypoparatyreóze a hypokalciémii [12].
U pacientov s hemochromatózou sa znížená kostná denzita vyskytuje taktiež významne častejšie ako v bežnej populácii. Osteoporóza je multifaktoriálne podmienená, vplýva na ňu androgénový deficit, porucha mineralizácie osteoidu pri interferencii železa, znížené hladiny vitamínu D, zle kontrolovaný diabetes, poruchy produkcie IGF-1 pri cirhóze.
Hyperkalciémia sa môže vyskytnúť u pacientov s cholangiocelulárnym karcinómom, menej často u pacientov s hepatocelulárnym karcinómom. Vyskytuje sa i pri absencii osteolytických metastáz, je spôsobená prítomnosťou „parathormónu podobného peptidu“ (PTHrP), ktorý má časť peptidu, zodpovedajúcu za humorálnu hyperkalciémiu, pri úspešnej liečbe sa jedná o reverzibilný stav.
Zmena funkcie nadobličiek pri hepatopatiách
Pri cirhóze pečene a poruche proteosyntetickej funkcie bývajú hladiny celkového kortizolu ráno nízke, v dôsledku zníženej tvorby albumínu a kortizol viažúceho globulínu, ale hladiny voľného kortizolu sú v norme alebo dokonca vyššie. Môže dôjsť ku strate alebo otupeniu diurnálneho profilu kortizolu pri alkoholovej chorobe pečene, dekompenzovanej cirhóze a dokonca i u alkoholikov bez signifikantného ochorenia pečene. Vo večerných hodinách majú títo pacienti vyššie hladiny kortizolu ako zdraví jedinci. Pri dôležitej úlohe pečene v metabolizme kortizolu je pri cirhóze redukovaný klírens kortizolu aj syntetických glukokortikoidov. Profil metabolitov kortizolu v moči býva pri cirhóze zmenený, v dôsledku deficitu enzýmu 11β-steroid dehydrogenázy. Narušenie metabolizmu kortizolu ale nespôsobuje jeho zvýšenú hladinu, vzhľadom ku fungujúcej spätnej väzbe na ACTH sa znižuje jeho produkcia.
Pacienti s autoimunitnou chronickou aktívnou hepatitídou, tak ako i pacienti s neautoimunitnou chronickou aktívnou hepatitídou, majú zvýšené hladiny kortizol viažúceho globulínu a následne spomalený klírens kortizolu, čo v krátkom nočnom dexametazónovom supresnom teste môže znamenať poruchu supresie ranného kortizolu. Pri liečbe autoimunitného ochorenia pečene glukokortikoidmi navyše môžme zaznamenať klinické prejavy iatrogénneho Cushingovho syndrómu.
Porucha spätnej väzby kortizolu na hypotalamo-hypofyzárne regulačné centrá u niektorých pacientov s abúzom alkoholu môže vyvolať tzv. pseudo-Cushingov syndróm. Etanol zrejme vyvoláva rezistenciu sekrécie ACTH na supresívny efekt glukokortikoidov. Okrem klinických prejavov sa vyskytujú i biochemické nálezy, typické pre Cushingovu chorobu. Zvýšená je hladina kortizolu aj ACTH, dochádza ku strate diurnálneho profilu kortizolu, poruche supresie hladiny kortizolu aj ACTH v dexametazónovom teste. Na rozlíšenie pseudo-Cushingovho od Cushingovho syndrómu je vhodné použiť test s dexametazónom (2 mg/deň 2 dni) a následným podaním kortikoliberínu (CRH). U pacientov so skutočným Cushingovým syndrómom 15 min po podaní CRH hladina sérového kortizolu presiahne 38 nmol/l. Pri prerušení konzumpcie alkoholu v priebehu dní až týždňov dochádza k úprave abnormalít kortizolového metabolizmu, čo môže byť niekedy pri opakovanom testovaní mätúce pri diagnostike [13].
U pacientov s terminálnym ochorením pečene, resp. u pacientov s pokročilou cirhózou v stresových situáciách (ako napr. sepsa, krvácanie) sa zistila porušená reakcia v tvorbe ACTH, čo značí poruchu na hypotalamo-hypofyzárnej úrovni, i zhoršená odpoveď nadobličiek na stres. Skupina autorov vyšetrila v priebehu 2 rokov na Oddelení pečeňových transplantácií na jednotke intenzívnej starostlivosti 340 pacientov. Až u 72 % pacientov dokázali prítomnosť adrenálnej insuficiencie. Zistili, že liečba glukokortikoidmi u týchto pacientov redukovala dávky vazopresorov a zlepšila prežívanie, zaznamenali mortalitu 26 % z pacientov s adrenálnou insuficienciou liečených glukokortikoidmi voči 46 % pacientov s hepatoadrenálnym syndrómom bez substitúcie glukokortikoidmi [14–16]. Predpokladá sa, že na patogenéze sa podieľa zvýšená hladina endotoxínu a prozápalových mediátorov, ako i redukovaná hladina apoproteín-1/HDL (high density lipoprotein). U každého kriticky chorého hypotenzného pacienta s hepatopatiou by sme teda mali myslieť na riziko neadekvátnej reakcie kortizolu na stres, t.j. hepatoadrenálneho syndrómu.
Hyperaldosteronizmus pri hepatopatii, podobne ako i zmeny hladiny antidiuretického hormónu spadajú medzi známe endokrinné zmeny v rámci portálnej hypertenzie, predstavujú ale rozsiahlu kapitolu vyžadujúcu samostatný článok a sú podrobne opísané v hepatologických publikáciách.
Zmeny pohlavných hormónov pri hepatopatiách
Cirhóza, najmä etyltoxická s prejavmi vaskulárnej dekompenzácie, býva u mužov spojená s hypogonadizmom a prejavmi feminizácie. U pacientov s kompenzovanou cirhózou na nealkoholovom podklade sú gynekomastia a sexuálna dysfunkcia zriedkavé. Výnimkou je hemochromatóza, pri ktorej môže gonadálne zlyhanie predchádzať vývoj cirhózy.
Hypogonadizmus sa prejavuje ako testikulárna atrofia, impotencia a strata libida. Popisuje sa až u 70–80 % mužov s cirhózou a testikulárna atrofia je klinicky a histologicky prítomná asi v 50 % pacientov. Gonadálna atrofia je spôsobená redukciou masy seminiferných tubulov a abnormalitami seminálnej tekutiny. Zlyhanie Leidigových buniek spôsobuje výraznú redukciu hladiny testosterónu (TST). Hladina testosterónu závisí od štádia cirhózy. Časť cirkulujúceho testosterónu vzniká periférnou konverziou androstendiónu, produkovaného nadobličkami, tvorí vyššie percento z testosterónu ako u zdravých. Znížená je odpoveď v produkcii testosterónu na podanie humánneho choriogonadotropínu (hCG), ktorý simuluje LH aktivitu. Pri cirhóze je zvýšená konverzia androstendiónu na estrón a testosterónu na estradiol v tukovom tkanive. Hladiny LH a FSH sú pri počiatočných štádiách cirhózy v norme alebo zvýšené, pri postupujúcej redukcii funkcie pečene (Child Pugh B a C) postupne klesajú, dochádza k hypotalamo-hypofyzárnej poruche. V terminálnom štádiu hepatopatie je hypogonadizmus ovplyvnený aj nutričným stavom, redukciou hmotnosti a komplikáciami. Aj samotný alkohol postihuje gonadálnu a hypotalamo-hypofyzárnu funkciu. Inhibuje kľúčové enzýmy v produkcii TST. Prechodne narastá hladina luteinizačného hormónu (LH), po 1–2 týždňoch nadmerného príjmu alkoholu ale klesá aj hladina LH. Etanol priamo inhibuje aj spermatogenézu. Znamená to, že pri alkoholickej cirhóze je hypogonadizmus sumáciou účinkov hepatopatie aj priameho účinku alkoholu, sexuálne funkcie sa abstinenciou môžu zlepšiť [17].
Feminizácia sa pri cirhóze prejavuje ako gynekomastia, strata telesného ochlpenia, redistribúcia telesného tuku. Objavuje sa asi u 20–50 % pacientov s cirhózou. Za znaky feminizácie sa s určitými výhradami považujú aj pavúčikovité névy a palmárny erytém. Na rozdiel od hypogonadizmu sa feminizácia vyskytuje len pri cirhóze, častejšia je pri alkoholickej cirhóze a k jej prejavom prispieva aj užívanie spironolaktónu. Keďže sa prejavy feminizácie zistili aj u cirhotikov s nezvýšenými hladinami estradiolu, uvažuje sa, že dôležitejším je pomer voľného TST a estradiolu (E2). Zmeny SHBG pri cirhóze zodpovedajú za vyššiu periférnu dostupnosť E2. Na feminizácii sa môže podieľať i zvýšená citlivosť cieľových orgánov na pohlavné hormóny. Spironolaktón, používaný v liečbe cirhózy, samostatne spôsobuje gynekomastiu a impotenciu. Redukuje syntézu TST, inhibuje cytochróm C-450 dependentnú 17-hydroxylázu. Obsadzuje tiež tkanivové androgénové receptory. Výsledkom je znížená hladina TST a vyššia hladina E2. Ku hypogonadizmu môžu prispievať i iné lieky používané v hepatológii, ako propranolol, thiazidové diuretiká, glukokortikoidy, sulfasalazín a lieky stimulujúce sekréciu prolaktínu.
Porucha funkcie pohlavných hormónov u žien s alkoholovou cirhózou sa prejavuje ako strata libida, nepravidelná menštruácia až amenorea, strata sekundárnych pohlavných znakov a ovariálne zlyhanie. Dochádza k predčasnej menopauze [18]. Je zrejmý aj priamy toxický efekt alkoholu na ováriá, podobne ako vplyv na testes u mužov. Ku amenoree dochádza i pri autoimunitnej chronickej aktívnej hepatitíde, i bez cirhózy, liečba glukokortikoidmi však dokáže tento stav zvrátiť a niektoré pacientky môžu otehotnieť. Zmeny pohlavných hormónov u žien s hepatopatiou sú menej preskúmané ako u mužov. Je prítomný deficit estrogénov a progesterónu u premenopauzálnych žien, pričom hladiny estrónu sú zvýšené. Plazmatické hladiny TST a androstendiónu sú väčšinou v norme. U týchto žien napriek nízkym hladinám estradiolu nie je adekvátne zvýšená hladina LH a FSH, pre - i postmenopauzálne. Po úspešnej transplantácii pečene u veľkej časti premenopauzálnych žien dochádza k obnoveniu menštruácie a fertility [19].
Poruchy gonadálnych funkcií pri VHC boli popísané v menšom množstve štúdií. Zvýšená je prevalencia erektilnej dysfunkcie, hladiny adrenálnych androgénov sú abnormálne nízke. Tieto nálezy vyžadujú potvrdenie na skúmaní väčšieho množstva pacientov, ďalšie štúdie budú nevyhnutné i na zhodnotenie možného prispenia diabetes mellitus na erektilnej dysfunkcii u HCV pozitívnych pacientov.
Poruchy pohlavných funkcií sa u mužov s hemochromatózou často manifestujú skôr ako hepatálne prejavy a veľa ráz predchádzajú stanoveniu diagnózy hemochromatózy. Hypogonadizmus je centrálny, v dôsledku deficitu gonadotropínov pri depozícii železa v gonadotropných bunkách hypofýzy. Zmeny sa dajú demonštrovať i na MRI mozgu. Primárne postihnutie testes je zriedkavejšie, skôr v dôsledku pokročilej cirhózy. Impotencia je závažnejšia aj častejšia u diabetikov s hemochromatózou. Venesekcie zriedka prispievajú ku obnove sexuálnych funkcií, vyššiu šancu na zlepšenie majú pacienti do 45 rokov. K úprave symptómov hypogonadizmu a normálnej sexuálnej funkcii dochádza pri substitúcii androgénmi. Výsledkom je nielen udržanie sekundárnych pohlavných znakov, sexuálnych funkcií, svalovej hmoty, ale i zabezpečenie normálnej erytropoézy, nutnej na pravidelné venesekcie. Podávanie testosterónu taktiež zabráni rozvoju osteoporózy, častej u pacientov s hemochromatózou. Počas liečby môže dochádzať k vývoju gynekomastie, v dôsledku aromatizácie testosterónu na estradiol v periférnych tkanivách, a testosterón u pacientov s poruchou pečeňovej funkcie pri cirhóze môže zvýrazniť retenciu tekutín. Priamo gonadotropíny sa zriedkavo podávajú mužom na zabezpečenie plodnosti.
Hepatoblastóm a hepatocelulárny karcinóm u chlapcov môžu zriedka vyvolávať predčasnú pubertu, hCG produkcia v tumore (podobne ako LH) stimuluje testikulárnu produkciu testosterónu, u dievčat ku predčasnej puberte nedochádza, ku stimulácii syntézy pohlavných periférnych hormónov je nevyhnutný i vplyv FSH. U dospelých mužov sa môže objaviť gynekomastia z nadprodukcie hCG tumorom alebo v dôsledku konverzie dehydroepiandrosterónu na estrón a estradiol. U žien boli popísané zväčšenia prsníkov a galaktorea z nadprodukcie hCG a prolaktínu. Po resekcii tumoru dochádza k úprave (tab. 2).
Tab. 2. Zmeny pohlavných hormónov pri cirhóze. 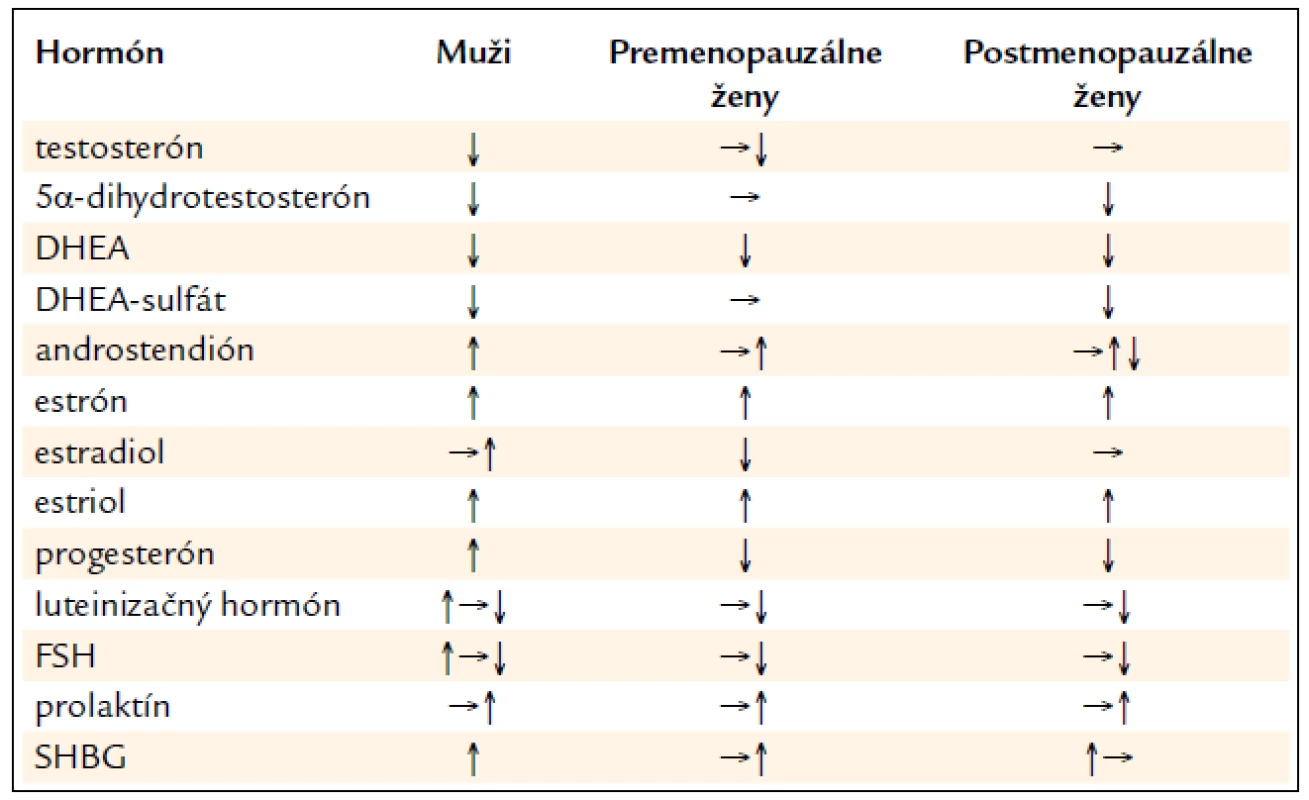
Prolaktín a cirhóza pečene
Pri hepatopatiách môže byť hladina prolaktínu v norme, sledovaním pacientov s cirhózou sa však zistila vyššia hladina ako u necirhotikov. Je známa vyššia hladina prolaktínu u pacientov s ascitom a hepatálnou encefalopatiou. Uvádza sa tiež korelácia hladiny prolaktínu so štádiom cirhózy podľa Child-Pugh klasifikácie. Presný mechanizmus nie je plne objasnený, príčinou môže byť strata inhibičného dopaminergného tonusu, vplývajúca na sekréciu prolaktínu. Vylučovanie dopamínu môže byť narušené pri poruche astrocytov v rámci encefalopatie, uvažuje sa i o vplyve hyperestrogenizmu. Klinický dopad zvýšenej hladiny prolaktínu pri cirhóze nie je jasný, hypogonadizmus a gynekomastia nekorelujú vždy s hladinou prolaktínu. Pri hepatopatii sa na hepatocytoch zistila zvýšená expresia PRL receptorov, uvažuje sa o možnej regeneračnej funkcii PRL pri poškodení pečene [20,21].
Rastový hormón a choroby pečene
Bazálne hladiny rastového hormónu (GH) sú u cirhotikov zvýšené. Elevácia hladiny rastového hormónu je prítomná i pri akútnej vírusovej hepatitíde, chronickej aktívnej hepatitíde, u pacientov so schistozomiálnou hepatálnou fibrózou a významnou portálnou hypertenziou. Narušený je i diurnálny charakter sekrécie, so zvýšenou frekvenciou pulzov aj zvýšenou amplitúdou u niektorých pacientov. U cirhotikov dochádza k paradoxnému nárastu hladiny rastového hormónu po podaní glukózy, hodnoty pri hypoglykémii môžu byť nadmerné, normálne alebo redukované. Porušenú odpoveď GH na inzulínom indukovanú hypoglykémiu pozorujeme aj u chronických alkoholikov bez signifikantného ochorenia pečene, s abstinenciou dochádza ku spontánnej úprave. Predpokladá sa, že porucha hepatálnej produkcie IGF-1 s nízkymi hladinami zodpovedá za „up-reguláciu“ sekrécie GH. U mužov k tomu môže prispievať i vyššia hladina estrogénov pri portosystémových skratoch (u žien pulzy majú vyššiu frekvenciu aj amplitúdu). Pri hepatopatii pozorujeme napriek zvýšenej hladine GH nízku produkciu IGF-1. Na hepatálnu rezistenciu na pôsobenie GH vplýva malnutrícia a hepatálna hypoinzulinémia pri portosystémových skratoch pri cirhóze. Je redukovaná hladina väzbového proteínu pre rastový hormón (GHBP) a expresia receptorov pre rastový hormón v cirhotickej pečeni. Dochádza k poruche hladiny väzbových proteínov pre IGF, a to k poklesu IGFBP-3 a nárastu IGFBP-1 a IGFBP-2. Zvýšené hladiny väzbových proteínov môžu ešte viac limitovať dostupnosť IGF-1 tkanivám. Vo veľkej skupine pacientov s alkoholovou chorobou pečene zistili významnú koreláciu hladiny IGF-1 a skóre proteínovo-energetickej malnutrície [22–26].
Záver
Ochorenia pečene sú v populácii veľmi časté a alkoholová choroba pečene sa môže zaradiť medzi civilizačné choroby. Pečeň zohráva centrálnu úlohu v metabolizme a regulácii procesov v organizme, jej funkcia je nevyhnutná pre správne fungovanie endokrinného systému celého organizmu. Jej zmeny tým majú významný dopad aj na hormonálne procesy. Pri hodnotení hormónov štítnej žľazy pri cirhóze pečene môžu byť patologické funkčné parametre štítnej žľazy podmienené ich zmeneným metabolizmom a tvorbou väzbových proteínov a nie samotným ochorením štítnej žľazy, čo je podstatné v ich interpretácii, v pokročilých štádiách hepatopatie majú aj určitú prognostickú hodnotu. Vplyv vírusových hepatitíd na morfológiu a funkciu štítnej žľazy závisí od priebehu a štádia ochorenia. O vzájomnej súvislosti vírusovej hepatitídy C a autoimunitných ochoreniach exitujú dôkazy v podobe publikovaných štúdií a súčasťou manažmentu pacienta by mal byť pravidelný screening funkčných parametrov a autoprotilátok. V súvislosti s infekciou VHC treba na tyreoidálnu dysfunkciu myslieť i pri liečbe interferónom α. Pacienti s ochorením pečene a alkoholici sú viac ako bežná populácia ohrození rizikom fraktúr pri osteopénii alebo osteoporóze v dôsledku zníženej kostnej formácie, hypogonadizmu, nutričného deficitu, prípadne i alkoholizmu. Abúzus alkoholu môže u pacientov navodiť klinické a laboratórne prejavy hyperkortizolizmu – tzv. pseudo-Cushingov syndróm, lekár by mal vziať túto možnosť do úvahy skôr, ako naordinuje rozsiahlu laboratórnu a zobrazovaciu diagnostiku hormonálnej nadprodukcie. V súčasnosti pribúdajú dôkazy o adrenokortikálnej insuficiencii pacientov s pokročilou cirhózou pečene v záťažových situáciách, o výskyte komplikácií a prežívaní v závislosti od adekvátnej substitúcie glukokortikoidmi. Pri každom, kriticky chorom, hypotenznom pacientovi s hepatopatiou by sme mali myslieť na riziko neadekvátnej reakcie kortizolu na stres. Hypogonadizmus môže byť prvým prejavom ochorenia pečene, pre ktorý pacient vyhľadá lekára a je častým endokrinným prejavom alkoholizmu. K plnému pochopeniu významu zmien koncentrácie prolaktínu a rastového hormónu u pacientov s cirhózou je potrebné doplniť ďalšie sledovania, hladina IGF-1 však predstavuje dobrý marker výživy pacientov, napr. pri plánovanej transplantácii pečene.
Pri vyšetrení pacienta s endokrinnými zmenami je nevyhnutné komplexne zhodnotiť jeho zdravotný stav a do úvahy vziať i prípadné známe alebo suspektné ochorenia, ktoré môžu endokrinopatiu vyvolávať, resp. ovplyvňovať jej priebeh – ako choroby pečene. Správna interpretácia klinických a laboratórnych endokrinných prejavov a správne stanovená diagnóza napomôže k adekvátnemu manažmentu pacienta. Spolupráca endokrinológa a hepatológa je pri zhodnotení a liečbe jednotlivých prejavov chorôb pečene prínosom pre ďalší osud a prognózu pacienta.
MUDr. Jana Kollerová
www.unb.sk
e-mail: jana.kollerova@gmail.com
Doručeno do redakce: 16. 3. 2011
Přijato po recenzi: 17. 4. 2011
Zdroje
1. Liewendahl K, Helenius T, Tanner P et al. Serum free thyroid hormone concentrations and indices in alcoholic liver cirrhosis, primary biliary cirrhosis and chronic active hepatitis. Acta Endocrinol Suppl (Copenh) 1983; 251 : 21–26.
2. Antonelli A, Ferri C, Ferrari SM et al. Endocrine manifestations of hepatitis C virus infection. Nat Clin Pract Endocrinol Metab 2009; 5 : 26–34.
3. Pateron D, Hartmann DJ, Duclos-Vallée JC et al. Latent autoimmune thyroid disease in patients with chronic HCV hepatitis. J Hepatol 1993; 17 : 417–419.
4. Antonelli A, Ferri C, Fallahi P et al. Thyroid disorders in chronic hepatitis C virus infection. Thyroid 2006; 16 : 563–572.
5. Antonelli A, Ferri C, Pampana A et al. Thyroid disorders in chronic hepatitis C. Am J Med 2004; 117 : 10–13.
6. Matskevich AA, Strayer DS. Exploiting hepatitis C virus activation of NFkappaB to deliver HCV-responsive expression of interferons alpha and gamma. Gene Ther 2003; 10 : 1861–1873.
7. Murata M, Nabeshima S, Maeda N et al. Increased frequency of IFN-gamma-producing peripheral CD8+ T cells with memory-phenotype in patients with chronic hepatitis C. J Med Virol 2002; 67 : 162–170.
8. Antonelli A, Ferri C, Fallahi P et al. Thyroid cancer in HCV-related chronic hepatitis patients: a case-control study. Thyroid 2007; 17 : 447–451.
9. Giordano TP, Henderson L, Landgren O et al. Risk of non-Hodgkin lymphoma and lymphoproliferative precursor diseases in US veterans with hepatitis C virus. JAMA 2007; 297 : 2010–2017.
10. Güven K, Kelestimur F, Yücesoy M. Thyroid function tests in non-alcoholic cirrhotic patients with hepatic encephalopathy. Eur J Med 1993; 2 : 83–85.
11. Gelu-Simeon M, Burlaud A, Young J et al. Evolution and predictive factors of thyroid disorder due to interferon alpha in the treatment of hepatitis C. World J Gastroenterol 2009; 15 : 328–333.
12. Kirch W, Höfig M, Ledendecker T et al. Parathyroid hormone and cirrhosis of the liver. J Clin Endocrinol Metab 1990; 71 : 1561–1566.
13. Groote Veldman R, Meinders AE. On the mechanism of alcohol-induced pseudo-Cushing’s syndrome. Endocr Rev 1996; 17 : 262–268.
14. Marik PE, Gayowski T, Starzl TE. Hepatic Cortisol Research and Adrenal Pathophysiology Study Group. The hepatoadrenal syndrome: a common yet unrecognized clinical condition. Crit Care Med 2005; 33 : 1254–1259.
15. Triantos C, Marzigie M, Fede G et al. Adrenal insufficiency in patients with cirrhosis and variceal bleeding. J Hepatol 2010; 52 (Suppl 1): S174.
16. Tan T, Chang L, Woodward A et al. Characterising adrenal function using directly measured plasma free cortisol in stable severe liver disease. J Hepatol 2010; 53 : 841–853.
17. Becker U, Gluud C, Farholt S et al. Menopausal age and sex hormones in postmenopausal women with alcoholic and non-alcoholic liver disease. J Hepatol 1991; 13 : 25–32.
18. Cundy TF, O’Grady JG, Williams R. Recovery of menstruation and pregnancy after liver transplantation. Gut 1990; 31 : 337–338.
19. Koller T, Kollerová J, Huorka M et al. Vplyv bazálnej koncentrácie prolaktínu na výskyt komplikácií a na prognózu pacientov s cirhózou pečene. Vnitř Lék 2009; 55 : 468–473.
20. Koller T, Payer J. Endokrinné prejavy chorôb pečene. Čes a Slov Gastroent a Hepatol 2007; 61 : 150–154.
21. Zietz B, Lock G, Plach B et al. Dysfunction of the hypothalamic-pituitary-glandular axes and relation to Child-Pugh classification in male patients with alcoholic and virus-related cirrhosis. Eur J Gastroenterol Hepatol 2003; 5 : 495–501.
22. Cuneo RC, Hickman PE, Wallace JD et al. Altered endogenous growth hormone secretory kinetics and diurnal GH-binding protein profiles in adults with chronic liver disease. Clin Endocrinol (Oxf) 1995; 43 : 265–275.
23. Ketelslegers JM, Maiter D, Maes M et al. Nutritional regulation of the growth hormone and insulin-like growth factor-binding proteins. Horm Res 1996; 45 : 252–257.
24. Picardi A, Gentilucci UV, Zardi EM et al. TNF-alpha and growth hormone resistance in patients with chronic liver disease. J Interferon Cytokine Res 2003; 23 : 229–235.
25. Møller S, Becker U, Juul A et al. Prognostic value of insulinlike growth factor I and its binding protein in patients with alcohol-induced liver disease. EMALD group. Hepatology 1996; 23 : 1073–1078.
26. Kruszynska YT, Bouloux BM. The effect of liver disease on the endocrine system. In: Rodés J, Benhamou JP, Blei A (eds). Textbook of Hepatology. Oxford: Blackwell Publishing 2008 : 1732–1766.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2012 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Septický šok v důsledku infekční endokarditidy stimulačního systému implantabilního kardioverter-defibrilátoru – editorial
- Význam globálnej kontraktilnej rezervy u pacientov s resynchronizačnou liečbou
- Podrobná studie o polypech tlustého střeva
- Endokrinné zmeny pri chorobách pečene
- Běžné, standardizované a doporučené postupy v diagnostice a monitorování paroxysmální noční hemoglobinurie průtokovou cytometrií
- Nemoc z ukládání lehkých řetězců imunoglobulinu (light chain deposition disease)
- Způsoby hodnocení krevní perfuze tkání pomocí intersticiální mikrodialýzy – přehled současných znalostí
- Diagnostické metody k predikci respondentů srdeční resynchronizační terapie – editorial
- Hyponatriémia pri syndróme neprimeranej sekrécie vazopresínu (SIADH) – možnosti liečby
- Doporučený postup k posouzení kardiovaskulárního rizika a prevenci kardiovaskulárních onemocnění a diabetes mellitus 2. typu u žen se syndromem polycystických ovarií
- Septický šok v dôsledku infekčnej endokarditídy stimulačného systému implantabilného kardioverter defibrilátora
- Lenalidomid indukoval léčebnou odpověď u pacienta s agresivní multisystémovou formou histiocytózy z Langerhansových buněk (LCH), rezistentní ke 2-chlorodeoxyadenosinu a časně relabující po vysokodávkované chemoterapii BEAM s autologní transplantací kmenových hemopoetických buněk
- Diagnóza nemoci z ukládání lehkých řetězců imunoglobulinů (LCDD) v bioptické praxi – editorial
- Hyponatrémia – komplikácia liečby karbamazepínom
- 50-ročná publikačná činnosť v časopise Vnitřní lékařství
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Endokrinné zmeny pri chorobách pečene
- Hyponatriémia pri syndróme neprimeranej sekrécie vazopresínu (SIADH) – možnosti liečby
- Podrobná studie o polypech tlustého střeva
- Hyponatrémia – komplikácia liečby karbamazepínom
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



