-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Diagnóza nemoci z ukládání lehkých řetězců imunoglobulinů (LCDD) v bioptické praxi – editorial
Autoři: E. Honsová
Působiště autorů: Pracoviště klinické a transplantační patologie, Transplantcentrum IKEM Praha, vedoucí pracoviště prim. MUDr. Eva Honsová, Ph. D.
Vyšlo v časopise: Vnitř Lék 2012; 58(1): 7-10
Kategorie: Editorialy
Ščudla V et al. Nemoc z ukládání lehkých řetězců imunoglobulinu (light chain deposition disease). Vnitř Lék 2012; 58(1): 38–43.
Plasma cell dyscrasie představují klonální expanzi abnormálních plazmocytů, které produkují monoklonální protein, což může být buď celý imunoglobulin, nebo jeho fragment (monoklonální volný lehký nebo těžký řetězec). Protože lehké řetězce jsou „odfiltrovány“ z cirkulace v ledvinách, stává se poškození ledvin běžnou komplikací těchto chorob. Morfologie poškození ledvin při klonálních proliferacích plazmocytů je velmi různorodá a zahrnuje poškození glomerulů, tubulů, intersticia i cév, a to buď samostatně, nebo v různých kombinacích. Projev poškození v ledvinách závisí na mechanizmu poškození, který je ovlivňován interakcí lehkých řetězců (LC) s buňkami sídlícími v ledvinách a také odlišnými fyzikálně-chemickými vlastnostmi paraproteinu. Průměrně 85 % LC je nefrotoxických; většina z nich poškozuje tubulointersticium a jsou označovány jako tubulopatické. Zbývající část postihuje především glomeruly a ty jsou označovány za glomerulopatické. Glomerulopatické řetězce nepostihují pouze ledviny, ale pravidelně způsobují systémová onemocnění s postižením mnoha orgánů. Na základě klinicko-patologických charakteristik rozlišujeme 2 typy glomerulopatických řetězců: jedním z nich jsou řetězce způsobující amyloidózu (AL-amyloidóza) a druhým jsou řetězce vedoucí k LCDD. Obě onemocnění mohou mít vzácně variantu, kdy jsou depozita odvozena od těžkých řetězců, nebo může jít o kombinaci lehkých a těžkých řetězců. AL-amyloidóza obvykle doprovází řetězce λ (hlavně VI), LCDD je nejčastěji součástí onemocnění s κ řetězci (hlavně I a IV).
V plně vyvinutých případech jsou morfologické charakteristiky obou chorob odlišné a představují zmnožení mezangia s nodulárními formacemi u LCDD a nahrazení mezangiální matrix depozity amyloidu v případě AL-amyloidózy (obr. 1, 2). Depozita amyloidu jsou pozitivní v barvení kongo červení a vykazují zelený dvojlom v polarizačním světle (v takto obarvených řezech) (obr. 3). Depozita při LCDD se kongo červení nebarví. Pokročilá stadia obou onemocnění mají charakteristickou morfologii, ale v případě časných fází je situace zcela odlišná. Časná stadia onemocnění nelze rozpoznat pouze na základě světelné mikroskopie a pro stanovení diagnózy jsou nezbytné další postupy (především imunofluorescence).
Obr. 1. Glomerulus s mezangiální proliferací, se zmnožením mezangiální matrix a nodulárními formacemi při LCDD. Ztluštělé tubulární bazální membrány. Barvení PAS, objektiv 40krát. 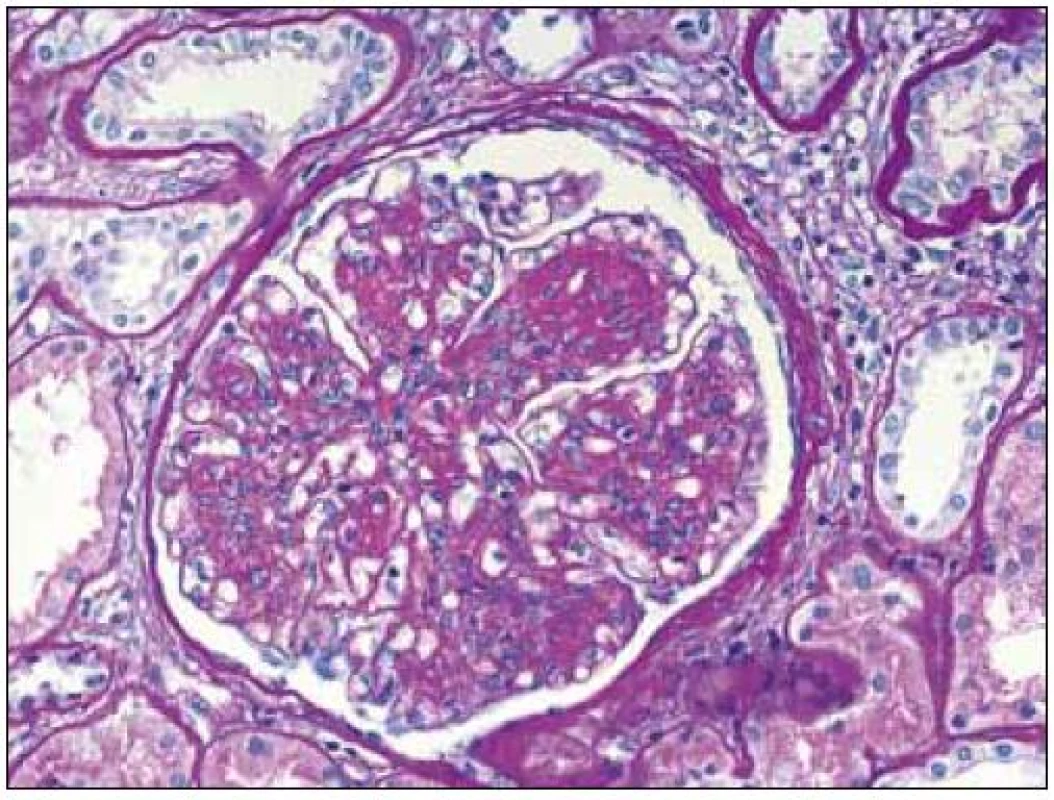
Obr. 2. Rozšíření mezangia s amorfními depozity amyloidu, bez proliferace, bez zánětu. Aby mohla být depozita označena za amyloid, musí být kongo červeň pozitivní. Barvení PAS, objektiv 20krát. 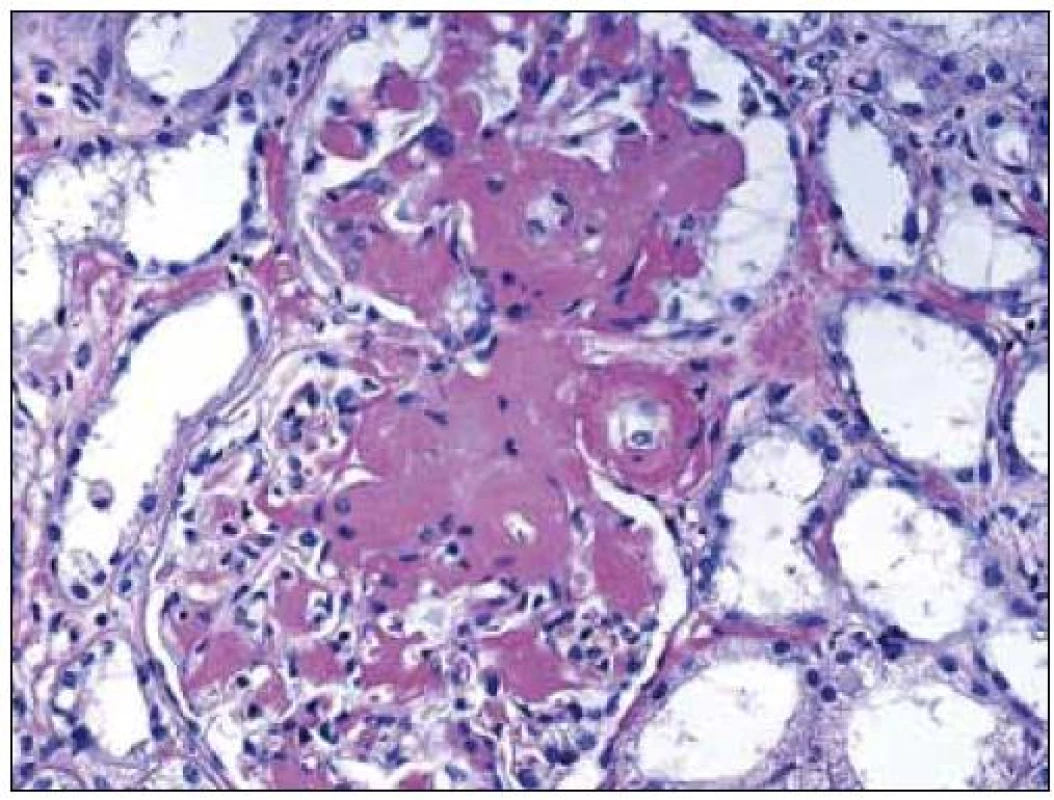
Obr. 3. Kongo červeň pozitivní depozita amyloidu v glomerulu. Barvení kongo červeň, zvětšení 40krát. 
Experimentální práce skupiny prof. Herrery přispěly k pochopení rozdílné patofyziologie a následně morfologie u obou chorob [1,2]. Autoři v experimentu prokázali, že LC dokážou měnit fenotyp mezangiálních buněk. V případě AL-amyloidózy se fenotyp mění směrem k makrofágům s vývojem lysozomů, uvnitř kterých probíhá degradace a přetvoření LC do fibril amyloidu. Současně jsou aktivovány metaloproteinázy, které rozštípou, destruují mezangium, a tím vytvoří místo pro fibrily amyloidu. Dalším krokem je inhibice TGF-β a apoptóza mezangiálních buněk. Výsledkem jsou depozita amyloidu v mezangiu, bez proliferace a bez zánětlivé reakce.
Na druhé straně v případě LCDD se mezangiální buňky mění směrem k myofibroblastům a pod vlivem plateled-derived growth factor mezangiální buňky proliferují a spolu s aktivací TGF-β je výsledkem tvorba mezangiálních nodulů. Hlavní komponentou rozšířeného mezangia se stane tenascin, který nemůže být odbourán mezangiálními buňkami, a tak je v pokročilých stadiích výsledkem nodulární glomeruloskleróza, která je ve světelné mikroskopii prakticky totožná s diabetickou glomerulosklerózou (Kimmelstiehl-Wilson).
Morfologické změny při LCDD jsou velmi různorodé, kromě jiného i v závislosti na pokročilosti onemocnění, a zahrnují stavy s morfologií normálních glomerulů přes morfologii mezangioproliferativních po membranoproliferativní glomerulonefritidy. V některých případech mohou být součástí glomerulární patologie srpky. V časných stadiích LCDD mají glomeruly normální vzhled, nebo jsou změny velmi mírné, diskrétní a jejich diagnóza je velmi komplikovaná (obr. 4). Také rozpoznání LCDD u pacienta s diabetes mellitus představuje pro patologa opravdovou výzvu (v obou případech jde o noduly, v obou případech jsou PAS pozitivní, obě onemocnění mají jako svoji součást PAS pozitivní ztluštělé bazální membrány glomerulů i tubulů a abnormální LC jsou navíc glykozylovány, což zcela mění jejich imunofluorescenční vlastnosti).
Obr. 4. LCDD s minimálními depozity a glomerulem s prakticky normální morfologií v časné fázi onemocnění. Barvení PAS, zvětšení 20krát. 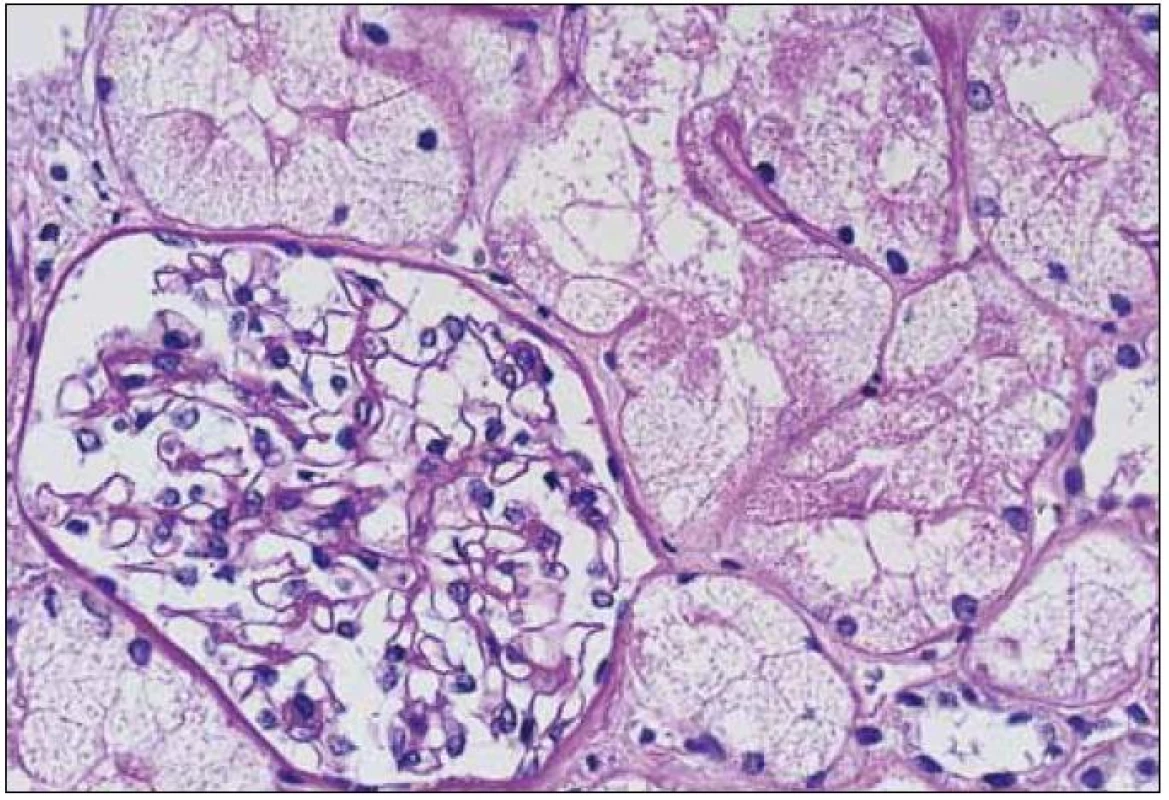
Diagnosticky nejpřínosnější je imunofluorescenční vyšetření s charakteristickým lineárním nebo semilineárním pozitivním průkazem obvykle IgG κ (obr. 5) podél glomerulárních (GBM) a/nebo podél tubulárních bazálních membrán (TBM). Depozita mohou být izolovaně pouze podél TBM nebo GBM nebo mohou být přítomna v obou lokalitách a výjimečně též v intersticiu nebo v cévách (obr. 6). V elektronovém mikroskopu (ELMI) jsou depozita granulární, s různým stupněm elektron-denzity a lemují v různě široké vrstvě bazální membrány (obr. 7, 8). Méně často mohou být depozita rozpoznatelná i v mezangiu. V běžně prováděném ELMI nejsou depozita u LCDD nijak specifická a ničím se neliší od depozit v rámci imunokomplexových GN. Intenzita průkazu a lokalizace depozit v imunofluorescenci neodpovídá jejich distribuci v elektronovém mikroskopu. Obecně je imunofluorescence citlivější a depozita lze lépe rozpoznat v imunofluorescenci než v ELMI. Pouze raritně je situace obrácená, kdy jsou depozita negativní v imunofluorescenci a přitom jsou rozpoznatelná v ELMI. To, že v části případů komerčně dostupné protilátky nereagují s lehkými řetězci, je dobře známým faktem, který komplikuje nejenom diagnostiku LCDD, ale také AL-amyloidózy [3]. Až 20 % případů AL-amyloidózy nereaguje s imunofluorescenčními protilátkami a v případě imunohistochemie tato hodnota dosahuje 50 %. Je to dáno velkou variabilitou lehkých řetězců, kdy výroba nepostihne variabilní antigeny. Proto AL-amyloidózu ani LCDD nelze na základě imunohistochemie z parafinových řezů diagnostikovat [4]. Přínosem by bylo imunoELMI, tj. technika, kdy je zlatem značená protilátka detekovaná v ELMI [5]. Vyšetření je metodologicky velmi náročné a má také další limitace; především v imunoELMI jsou daleko hůř patrné struktury tkáně. Navíc jde o odlišnou techniku zpracování, včetně odlišné fixace následované odlišnými typy zalévacích pryskyřic. To je vedle větší náročnosti jedním z důvodů, proč se vyšetření běžně nepoužívá a v ČR není rutinně dostupné. Pokud jde o autorem zmíněné „nutné“ odlišení depozit těžkých řetězců, rozhodně se to lépe řekne, než udělá. Jde o vzácné onemocnění, nejběžnější je γ-heavy chain disease (γ1 a γ3 subtyp); u těchto pacientů je často hypokomplementemie a aktivace C3, což značně ovlivňuje výsledek imunofluorescence a komplikuje diagnózu. Problematika komerčních protilátek je zde stejná jako v případě LCDD. Teoreticky by speciálně na heavy chain disease měli být vyšetřeni pacienti s ledvinnou lézí a monoklonální gamapatií v klinickém obraze a současně s negativním průkazem κ i λ řetězců v imunofluorescenci. Onemocnění je velmi pravděpodobně poddiagnostikované. Podle mých informací nikdo v ČR dosud takové onemocnění nediagnostikoval.
Obr. 5. Imunofluorescence s pozitivním průkazem kappa v tubulárních bazálních membránách při LCDD. Onemocnění je pokročilé, pozitivní průkaz (zelená barva) je lineární. Imunofluorescence, lehký řetězec κ, zvětšení 20krát. 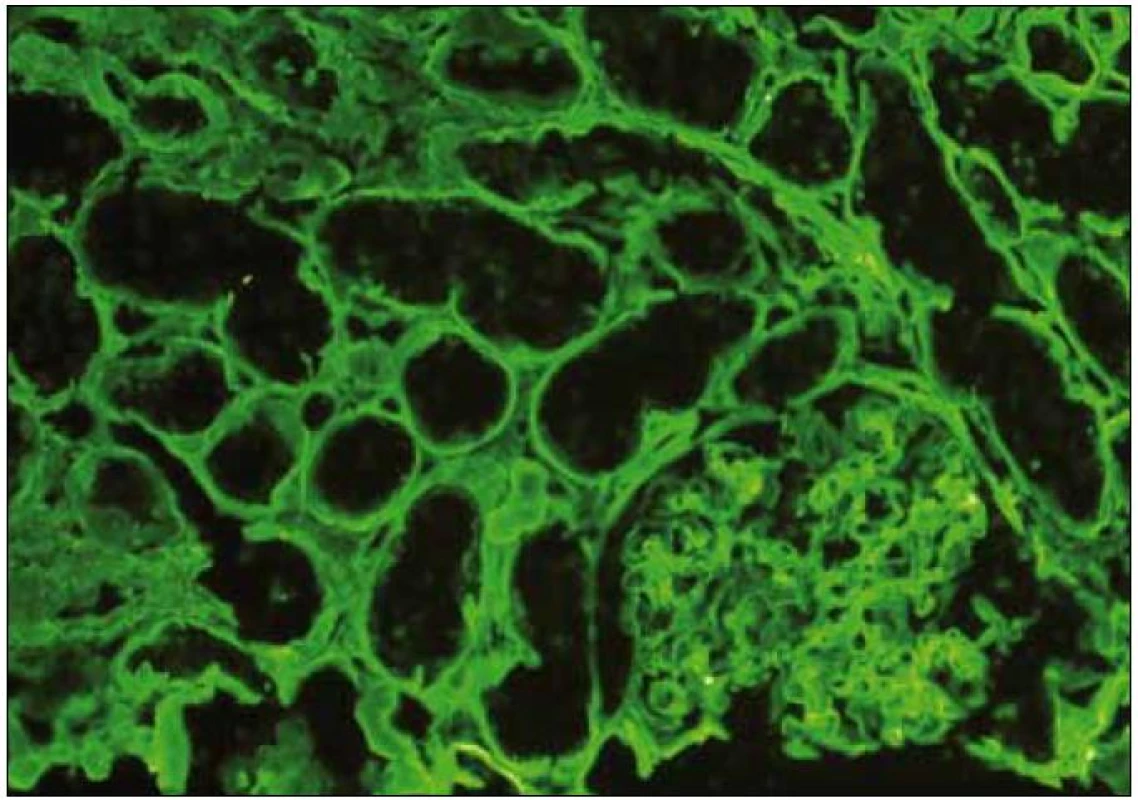
Obr. 6. Ztluštělé PAS pozitivní bazální membrány tubulů při pokročilém LCDD. Barvení PAS, zvětšení 20krát. 
Obr. 7. ELMI: granulární depozita lemují ze zevní strany tubulární bazální membránu. Vrstvu elektron-denzního materiálu (depozit) označují šipky. Obr. 8. ELMI: granulární depozita ve velmi tenké vrstvě lemují vnitřní stranu glomerulární bazální membrány, označeno šipkami. 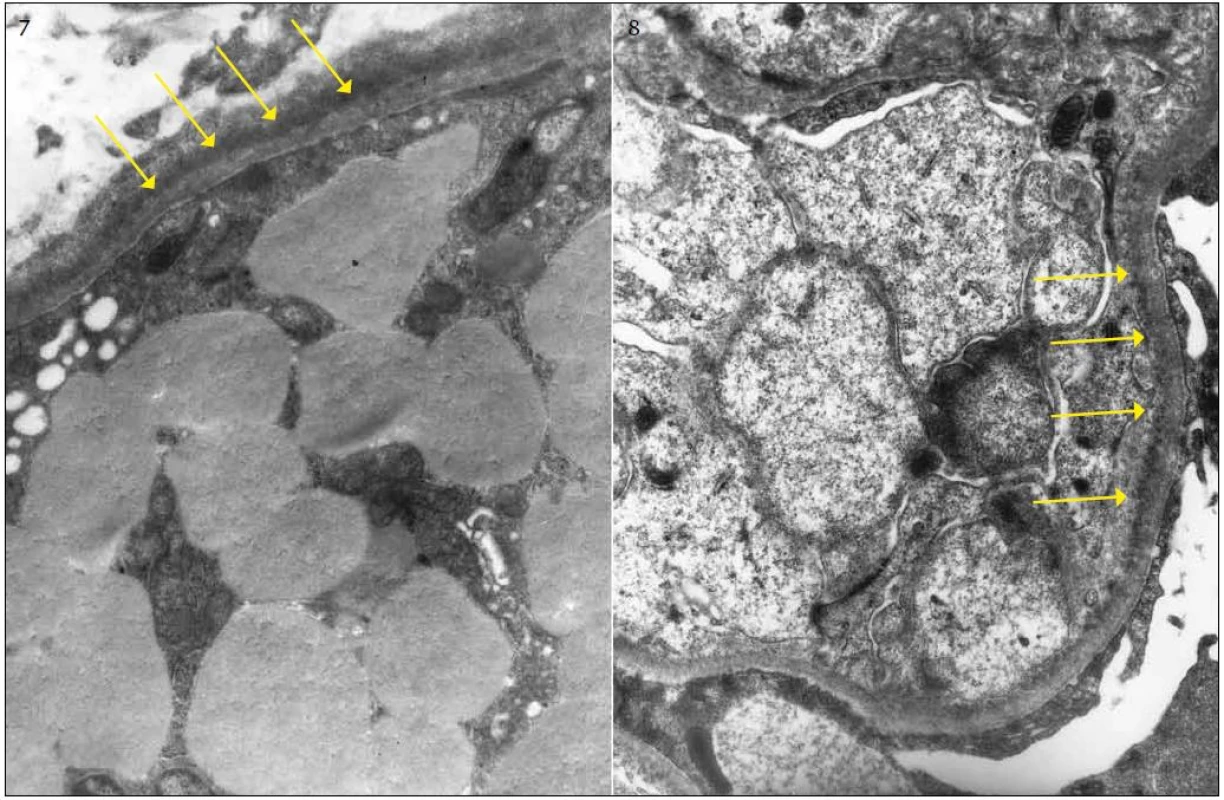
Do diferenciální diagnostiky patří různá onemocnění, která nedoprovází monoklonální gamapatie, především diabetes mellitus a různé pokročilé GN s membranoproliferativními rysy v morfologii. Zvažujeme-li pouze onemocnění související s monoklonální gamapatií, pak jsou v diferenciální diagnóze proliferativní GN s monoklonálními depozity (IgG1 nebo IgG3) i nepříliš vzácné různé kombinace onemocnění, jako kombinace amyloidózy a LCDD, LCDD a cast nephropathy (tzv. myelomová ledvina), amyloidózy a cast nephropathy atd. V praxi je nejčastější kombinace AL-amyloidózy a cast nephropathy.
Závěrem lze shrnout, že LCDD je většinou diagnostikováno v biopsiích ledvin, kde má patolog vedle světelné mikroskopie rutinně k dispozici imunofluorescenci a ELMI. I přesto jde o jednu z nejtěžších diagnóz, protože morfologie může být velmi různorodá a používané komerčně dostupné protilátky s částí řetězců vzhledem k jejich variabilitě nereagují. V současné době nejsou rutinně dostupné další postupy, které by umožnily přesnou identifikaci deponovaných proteinů. Použití sofistikovaných technologií je stále ještě problematické, protože obvykle nedostačuje množství reziduální tkáně v biopsii, zvláště v časných stadiích onemocnění, kdy depozit je málo a jsou distribuována velmi fokálně. Jako nejslibnější se do budoucna zdá využití hmotnostní spektrometrie.
prim. MUDr. Eva Honsová, Ph.D.
www.ikem.cz
e-mail: eva.honsova@ikem.cz
Doručeno do redakce: 7. 7. 2011
Zdroje
1. Keeling J, Teng J, Herrera GA et al. AL-amyloidosis and light-chain deposition disease light chains induce divergent phenotypic transformations of human mesangial cells. Lab Invest 2004; 84 : 1322–1338.
2. Keeling J, Herrera GA. Matrix metalloproteinases and mesangial remodeling in light chain-related glomerular damage. Kidney Int 2005; 68 : 1590–1603.
3. Picken MM. Amyloidosis-where are we now and where are we heading? Arch Pathol Lab Med 2010; 134 : 545–551.
4. Picken MM. New insights into systemic amyloidosis: the importance of diagnosis of specific type. Curr Opin Nephrol Hypertens 2007; 16 : 196–203.
5. Herrera GA. The contributions of electron microscopy to the understanding and diagnosis of plasma cell dyscrasia-related renal lesions. Med Electron Microsc 2001; 34 : 1–18.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2012 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Septický šok v důsledku infekční endokarditidy stimulačního systému implantabilního kardioverter-defibrilátoru – editorial
- Význam globálnej kontraktilnej rezervy u pacientov s resynchronizačnou liečbou
- Podrobná studie o polypech tlustého střeva
- Endokrinné zmeny pri chorobách pečene
- Běžné, standardizované a doporučené postupy v diagnostice a monitorování paroxysmální noční hemoglobinurie průtokovou cytometrií
- Nemoc z ukládání lehkých řetězců imunoglobulinu (light chain deposition disease)
- Způsoby hodnocení krevní perfuze tkání pomocí intersticiální mikrodialýzy – přehled současných znalostí
- Diagnostické metody k predikci respondentů srdeční resynchronizační terapie – editorial
- Hyponatriémia pri syndróme neprimeranej sekrécie vazopresínu (SIADH) – možnosti liečby
- Doporučený postup k posouzení kardiovaskulárního rizika a prevenci kardiovaskulárních onemocnění a diabetes mellitus 2. typu u žen se syndromem polycystických ovarií
- Septický šok v dôsledku infekčnej endokarditídy stimulačného systému implantabilného kardioverter defibrilátora
- Lenalidomid indukoval léčebnou odpověď u pacienta s agresivní multisystémovou formou histiocytózy z Langerhansových buněk (LCH), rezistentní ke 2-chlorodeoxyadenosinu a časně relabující po vysokodávkované chemoterapii BEAM s autologní transplantací kmenových hemopoetických buněk
- Diagnóza nemoci z ukládání lehkých řetězců imunoglobulinů (LCDD) v bioptické praxi – editorial
- Hyponatrémia – komplikácia liečby karbamazepínom
- 50-ročná publikačná činnosť v časopise Vnitřní lékařství
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Endokrinné zmeny pri chorobách pečene
- Hyponatriémia pri syndróme neprimeranej sekrécie vazopresínu (SIADH) – možnosti liečby
- Podrobná studie o polypech tlustého střeva
- Hyponatrémia – komplikácia liečby karbamazepínom
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



