-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kardiotoxicita onkologické léčby
Cardiotoxicity of cancer therapy
Due to advances in oncological care, the number of patients exposed to and surviving after anticancer chemotherapy is steadily increasing. Anticancer agents, however, are often associated with side-effects including cardiotoxicity which has been identified as one of the most serious and potentially life threatening complications. Cardiotoxicity manifestations range from asymptomatic alterations of heart and vasculature function to arterial hypertension, myocardial ischemia, arrhythmias (including QT-prolongation) and overt heart failure. Post-chemotherapy cardiovascular impairment has been associated with increased morbidity and may also contribute to increased mortality in these patients, both early and late after chemotherapy. This review article describes pathophysiology, clinical manifestation, diagnostic algorithms, monitoring and therapy of cardiotoxicity caused by anticancer agents. We also outline and discuss a variety of problems associated with patient management from the viewpoint of clinical cardiology according to latest published findings.
Key words:
cardiotoxicity of cancer therapy – heart failure – myocardial ischemia – arrhythmias – arterial hypertension
Autoři: J. Marek 1; A. Linhart 1; Z. Rucklová 1; J. Haber 2; J. Kořínek 1
Působiště autorů: II. interní klinika – klinika kardiologie a angiologie 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Aleš Linhart, DrSc. 1; I. interní klinika – klinika hematologie 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Marek Trněný, CSc. 2
Vyšlo v časopise: Vnitř Lék 2011; 57(5): 472-484
Kategorie: Přehledné referáty
Souhrn
Úspěchy protinádorové chemoterapie jsou na jedné straně doloženy vysokým procentem vyléčených nemocných, na straně druhé však provázeny vyšším výskytem závažných projevů toxicity této léčby. Mezi nejzávažnější z nich patří postižení srdce. Projevy kardiotoxicity sahají od asymptomatických změn srdeční či cévní funkce přes rozvoj arteriální hypertenze, myokardiální ischemie a arytmií včetně prodloužení QT intervalu až po těžké srdeční selhání. Postižení srdce je spojené s nárůstem morbidity a jednou z možných příčin neuspokojivého ovlivnění mortality. Tento přehledový článek se zabývá patofyziologií, projevy, diagnostikou, monitorací i terapií kardiotoxických účinků onkologických preparátů. Našim cílem je rovněž nastínit spektrum problémů spojených s managementem těchto poruch z pohledu klinické kardiologie s důrazem na nejnovější publikované poznatky.
Klíčová slova:
kardiotoxicita onkologické léčby – srdeční selhání – ischemie myokardu – arytmie – arteriální hypertenzeÚvod
Každý rok je v České republice diagnostikováno zhruba 70 000 zhoubných nádorů a ročně na onemocnění z této skupiny umírá přibližně 30 000 lidí [1]. Za posledních 10 let zaznamenala onkologická léčba bouřlivý rozvoj spojený se zavedením nových léčiv a terapeutických schémat. Příkladem může být vývoj nových přípravků cíleně zasahujících do signalizačních kaskád nádorových buněk, ale i jiných léčiv s rozdílným mechanizmem působení. Onkologická léčba s sebou nicméně přináší řadu méně či více závažných nežádoucích účinků. Jedním z prognosticky nejzávažnějších je kardiotoxicita vyskytující se u řady onkologických preparátů.
Poškození kardiovaskulárního systému onkologickou léčbou zahrnuje přímé toxické působení na myokardiální buňky a endotel, postižení buněk převodního systému i interferenci s koagulační kaskádou organizmu [2]. Klinicky se nežádoucí účinky onkologické léčby na kardiovaskulární systém mohou projevit asymptomatickou dysfunkcí levé komory (asymptomatic left ventricular dysfunction – ALVD) či městnavým srdečním selháním (congestive heart failure – CHF) [3–12], arteriální hypertenzí [5,13,14], ischemickým postižením myokardu včetně infarktu myokardu [15,16], arytmiemi včetně prodloužení QT intervalu [17] a trombotickými komplikacemi v arteriálním řečišti [18].
Diagnóza kardiálního postižení způsobeného onkologickou léčbou je poměrně náročná. Obvykle je stanovena na základě znalosti kardiotoxického potenciálu použitého onkologického preparátu, anamnézy, klinického obrazu a dalších vyšetřovacích metod, z nichž je nejčastěji využívána echokardiografie.
Terapie kardiovaskulárních následků onkologické léčby je většinou nespecifická, často je jediným „kauzálním“ přístupem vysazení preparátu. U některých onkologických léků bylo testováno podávání léčiv s cílem potlačit nežádoucí účinky, avšak pouze s částečným úspěchem.
Cílem tohoto článku je nastínit spektrum nejčastějších kardiotoxických projevů vázaných k jednotlivým onkologickým preparátům, problémy spojené se screeningem a diagnostikou kardiovaskulárních komplikací a management těchto poruch. Údaje o kardiotoxicitě jsou nicméně nezřídka odvozeny sekundárně z výsledků studií, které byly navrženy k hodnocení účinnosti onkologické terapie a ne k hodnocení kardiotoxicity, což ztěžuje jejich interpretaci.
Srdeční selhání
Srdeční selhání (CHF) je nejčastěji popisovaným nežádoucím kardiovaskulárním účinkem onkologické léčby. Řada níže uvedených onkologických preparátů (tab. 1) je schopna způsobit asymptomatickou dysfunkci levé komory (ALVD), která může vyústit až v plně rozvinuté CHF [3–12]. Seznam potenciálně kardiotoxických preparátů zahrnuje antracykliny (doxorubicin, epirubicin, daunorubicin, idarubicin a další), alkylační látky (cyklofosfamid a ifosfamid), inhibitory tyrozinkinázových signálních kaskád (sunitinib, imatinib a lapatinib), monoklonální protilátky (trastuzumab, bevacizumab) a imunomodulancia (interferon-α a interleukin-2). O řadě z nich však máme k dispozici pouze omezené údaje.
Tab. 1. Srdeční selhání způsobené protinádorovou léčbou – incidence a prognóza. 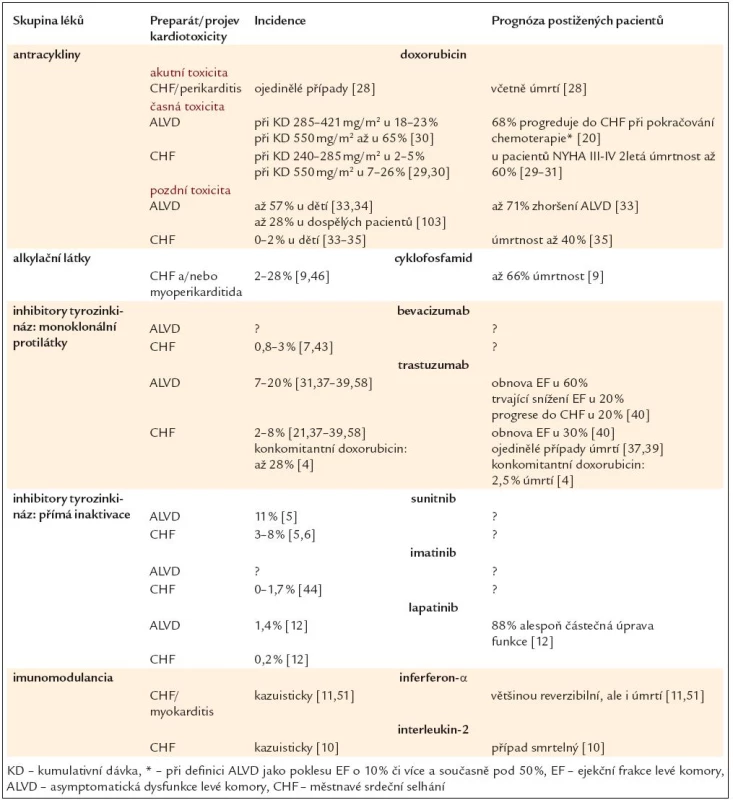
Patogenetické mechanizmy vyvolávající myokardiální dysfunkci, která může vést až k CHF, se u jednotlivých preparátů liší a mohou se vzájemně kombinovat. Zahrnují široké spektrum projevů: od oxidativního stresu přes inhibici transkripčních faktorů, inhibici topoizomerázy a inhibici růstových faktorů a jejich receptorů až po poškození endotelu a kapilární sítě myokardu. Výsledkem mohou být pouze funkční změny myokardu, ale i změny ireverzibilní spojené s apoptózou či nekrózou kardiomyocytů.
Incidence ALVD a CHF se liší v závislosti na použitém preparátu. ALVD a CHF se nejčastěji vyskytují u antracyklinů (při kumulativní dávce doxorubicinu nad 550 mg/m2 je CHF popisováno až ve 30 %) [3]. Obdobně se liší mortalita i prognóza a také v tomto případě jsou nejnebezpečnější antracykliny.
Péče o nemocné sestává z průběžného pozorování s cílem včas rozpoznat počátek srdeční dysfunkce (většinou pomocí zobrazovacích metod). V diagnostice ALVD a CHF se uplatňuje zejména echokardiografie [19], dále radionuklidová ventrikulografie [20] a stále častěji je používána také magnetická rezonance [21]. Bylo popsáno i využití biochemických markerů, jako je troponin či natriuretické peptidy, ale jejich role v diagnostice zatím není přesně stanovena [22]. Za zlatý standard je považována endomyokardiální biopsie [23], která však byla používána především u antracyklinů a má své limitace. K diagnostice kardiotoxicity byly navrženy i další metody, jako je např. scintigrafie antimyozinovými protilátkami [24].
Jak již bylo zmíněno v úvodu, terapeutické možnosti jsou v daných případech velmi omezené. Spočívají v symptomatické léčbě CHF spolu s vysazením onkologického preparátu. Ideálním způsobem terapie by byla prevence vzniku CHF. Avšak jedinou známou cílenou preventivní léčbou je podávání dexrazoxanu, které má omezenou účinnost a u kterého zároveň není zcela vyloučeno, že by mohl snižovat účinek antracyklinů [25].
Srdeční selhání u antracyklinů
Antracykliny, používané již od 60. let minulého století, jsou skupinou chemoterapeutik s širokým spektrem protinádorové aktivity. Mezi nejběžnější látky patří doxorubicin, daunorubicin, idarubicin a epirubicin. Hlavní mechanizmus protinádorové aktivity spočívá v interkalaci molekuly antracyklinu do DNA dvoušroubovice, inhibici topoizomerázy II a produkci hydroxylových radikálů. Antracykliny způsobují ultrastrukturální a současně funkční změny myokardu s následným zánikem myokardiálních buněk apoptózou i nekrózou. Kromě zániku buněk se ale vyskytuje i disrupce sarkomerické struktury s degradací sarkomerických proteinů včetně titinu. Dominantní úlohu zřejmě hraje oxidativní stres, ale i potlačení exprese některých kardiálních transkripčních faktorů [26].
Kardiotoxický účinek antracyklinů se klinicky projevuje různými formami. Z časového hlediska vzniku kardiálního postižení byla určena arbitrárně 3 období: „akutní“ forma, která se vyskytuje již při podání cytostatika, „časná“ forma s projevy do 1 roku od ukončení chemoterapie a „pozdní“ forma s manifestací v horizontu 1 a více let po léčbě [27].
Akutní toxicita se projeví ve většině případů pouze prchavě asymptomatickou dysfunkcí levé komory, vzácně akutním CHF a ojediněle byla popsána i perikarditida [28].
Při časné toxicitě nastupuje CHF často během 1. měsíce po ukončení terapie [29]. Jeho incidence je závislá na kumulativní dávce (KD) antracyklinů. Při KD doxorubicinu 240–285 mg/m2 je udávána incidence mezi 2–5 %. Při podrobnějších analýze dat se odhadovaná kumulativní incidence u KD 550 mg/m2 pohybuje v rozsahu 7–26 % [29,30]. U pacientů s KD nad 550 mg/m2 nastává CHF až u 1/3 pacientů [3]. Výrazně častěji než CHF se vyskytuje ALVD. Při průměrné KD 285 mg/m2 nastává u 18–23 % pacientů, u KD 550 mg/m2 dle analýz až u 39–65 % pacientů [30]. Na relativně vysoké variabilitě incidencí se zřejmě výrazně podílí rozdílný design publikovaných studií. Prognóza časného CHF způsobeného antracykliny je závažná. Je závislá na závažnosti CHF a zřejmě také na podávaném typu antracyklinu. Navíc je ovlivněna možnostmi terapie CHF v dané době. Stejně jako údaje o incidenci jsou údaje o mortalitě velmi variabilní, a navíc výrazně ovlivněné prognózou primárního onemocnění. U CHF při užití doxorubicinu dosahovala ve starších studiích úmrtnost během 70 dnů od prvních projevů až 41 % [29] a u pacientů s tíží selhání NYHA III-IV až 60 % během 2 let [31]. Jiná recentní prospektivní studie udává mortalitu pacientů s CHF 18,7 %, v převážné většině v kombinaci s progresí primárního nádoru (doba sledování však nebyla jasně udána) [30]. Lepší prognóza byla popsána u epirubicinu, s pouze 1 úmrtím z 10 pacientů s CHF NYHA III a IV při mediánu sledování 3 roky [32]. Nicméně v této studii byly již základem terapie CHF ACE inhibitory, na rozdíl od studií ze 70. a 80. let minulého století, ve kterých byli pacienti s CHF léčeni kombinací digitalis – diuretika.
Pozdní toxicita, která se objevuje s odstupem 1 a více let, je typická u pacientů léčených antracykliny v dětství. Je charakterizována rozvojem systolické a/nebo diastolické ALVD s možným postupným přechodem do CHF. Manifestní CHF se vyskytuje méně často než ALVD [33,34]. CHF se může objevit brzy po terapii v dětství (v rámci časné kardiotoxicity) s přechodnou stabilizací, avšak s odstupem několika let může dojít k další kardiální dekompenzaci. Takový průběh byl popsán zhruba u 2 % pacientů. U dalších 2 % pacientů probíhala první fáze v dětství asymptomaticky a k CHF došlo až po letech (dle sledování 12–18 let) od ukončení terapie [33]. Kumulativní incidence časného i pozdního CHF u dětí (76 % mělo toxicitu časnou) je v jiné studii odhadována na 5,5 % v průběhu 20 let, nicméně při dávkách nad 300 mg/m2 jde až o přibližně 10 % [35]. I když je incidence pozdní kardiotoxicity relativně nízká, prognóza pacientů s pozdním CHF je pravděpodobně nepříznivá: současná data dokládají úmrtnost až 40 % (nicméně na velmi malém vzorku postižených pacientů) [35].
Srdeční selhání u inhibitorů tyrozinkináz
Inhibice signálních kaskád, kterých se účastní tyrozinkinázy, je relativně novou metodou v onkologické terapii. Inhibitory tyrozinkináz se dle struktury rozdělují do 2 typů. Prvním typem jsou monoklonální protilátky, které buď vyvazují ligand receptoru (bevacizumab vyvazující vaskulární endoteliální růstový faktor – VEGF), nebo se vážou na extracelulární receptorovou doménu (trastuzumab, který se váže na receptor lidského epidermálního růstového faktoru 2 – ErbB2, dříve Her2). Jejich charakteristikou je nutnost parenterálního podání a vysoká specificita pro jednu molekulu. Druhým typem inhibitorů jsou malé molekuly s přímou vazbou na tyrozinkinázu s její inaktivací. Jejich výhodou je perorální podání a v porovnání s protilátkami inhibují širší spektrum tyrozinkináz [36].
Trastuzumab je tyrozinkinázový inhibitor typu monoklonální protilátky, která se váže na receptor ErbB2. Používá se v adjuvantní i paliativní léčbě karcinomů prsu zvýšeně exprimujícím ErbB2 receptory [4]. Trastuzumab zřejmě způsobuje pouze funkční postižení kardiomyocytů, které není provázeno nekrózou, a až na výjimky nejsou popisovány žádné ultrastrukturální změny [37].
Toxicita trastuzumabu se objevuje během jeho podávání, které je na rozdíl od antracyklinů dlouhodobější (rok i více). Časná nebo pozdní kardiotoxicita, tak jak ji známe u antracyklinů, není u trastuzumabu rozlišována. Důvodem může být relativně krátká klinická zkušenost s podáváním tohoto preparátu. CHF více než jeden rok od počátku léčby se objevuje zhruba u 10 % postižených pacientů [38].
Výskyt ALVD je udáván až okolo 20 % [21] a CHF, v závislosti na studii, až u 8 % pacientů léčených trastuzumabem [37,38]. Otázkou je reverzibilita srdeční dysfunkce způsobená trastuzumabem. Na základě studie se sledováním (včetně echokardiografie) 6 měsíců po ukončení terapie trastuzumabem lze odhadnout, že u 60 % pacientů s ALVD se ejekční frakce levé komory (EF) zlepší nad 50 %. U 20 % ALVD nedochází k normalizaci EF, avšak nemocní zůstávají asymptomatičtí. U zbylých 20 % s ALVD dojde k rozvoji CHF. U pacientů s manifestním CHF dojde k obnově EF pouze ve zhruba 30 % případů. U zbylých pacientů se EF buď plně neobnoví, nebo se zhoršuje. I přesto, že u části pacientů dochází ke zhoršení EF, je úmrtí z kardiálních příčin hlášeno zcela výjimečně [38–40]. Ale i pokud dojde k normalizaci EF, může poškození myokardu zřejmě přetrvávat, pro což svědčí pozdní gadoliniový enhancement subendokardiálně v oblasti laterální stěny při vyšetření magnetickou rezonancí [21].
Současné podání trastuzumabu s antracykliny může umocňovat kardiotoxicitu. Na toto podezření poukazovala iniciální data výskytu CHF u dané kombinace (až u 28 % pacientů). Na podkladě získaných výsledků bylo doporučeno nepodávat trastuzumab současně s antracykliny nebo jejich kombinaci podávat jen velmi opatrně [4]. Při redukci dávky doxorubicinu je nicméně výskyt kardiotoxicity výrazně nižší, což implikuje, že podávání těchto preparátů současně není vyloučené [41]. Kombinace trastuzumabu s dalším antracyklinem epirubicinem by mohla být vhodnou alternativou vzhledem k udávanému nižšímu výskytu kardiotoxicity [42]. Tyto výsledky je nutno potvrdit v dalších studiích.
Bevacizumab je monoklonální protilátka, která se váže na VEGF a inhibuje tak tyrozinkinázovou signální kaskádu, jež ve výsledku potlačuje angiogenezi. Bevacizumab je používán v terapii nádorů tlustého střeva, prsu, plic, ledvin i ovarií. Přesný mechanizmus indukce CHF u tohoto preparátu není znám, nicméně bevacizumab je schopen navodit hypertenzi a inhibicí VEGF zabraňuje kompenzatorní hypertrofii levé komory. Toto může teoreticky vést k dilataci LK se snížením EF s rozvojem ALVD a poté CHF [36]. Výskyt CHF je pravděpodobně velmi nízký. Ve srovnání pacientů s bevacizumabem a kontrolní skupiny bez tohoto preparátu byl výskyt CHF pouze nesignifikantně vyšší (okolo 0,8 %) [43]. Starší údaj o výskytu CHF až u 3 % pacientů mohl být ovlivněn předchozí léčbou pacientů antracykliny a také ozářením hrudní stěny, které bylo provedeno u části z nich [7]. Asociace CHF a bevacizumabu tedy zatím nebyla potvrzena. Data o incidenci ALVD nejsou v současné době k dispozici. Terapie měla na většinu pacientů s CHF příznivý účinek, ale dlouhodobá prognóza je vzhledem k nedostatku údajů neznámá.
Imatinib je dalším malým tyrozinkinázovým inhibitorem. Interferuje s několika signálními kaskádami včetně tyrozinkinázy Abl (účastnící se patogeneze chronické myeloidní leukemie), receptoru C-kit (overexprese či mutace se podílí na patogenezi gastrointestinálních stromálních tumorů), ale i receptoru pro destičkový růstový faktor (PDGF). Na mechanizmu kardiotoxicity se pravděpodobně podílí poškození endoplazmatického retikula a mitochondrií s indukcí apoptózy, která však může být díky poškozené energetice provázena i nekrózou kardiomyocytů [8]. Výskyt CHF u léčby imatinibem je pravděpodobně velmi malý (do 1,7 %), avšak údaje jsou retrospektivní [44]. K dispozici nejsou ani prospektivní ani retrospektivní data o prognóze CHF ani o incidenci a prognóze ALVD.
Sunitinib je malá molekula inhibující tyrozinkinázy asociované s receptory pro růstové faktory (včetně receptorů pro VEGF, PDGF, C-kit receptoru a jiných). Je používán v terapii renálního karcinomu a gastrointestinálních stromálních tumorů. Mechanizmus kardiotoxicity není zcela jasný. Může se na něm podílet indukce hypertenze s inhibicí kompenzatorní hypertrofie levé komory [6], ale i interference s energetickým metabolizmem kardiomyocytů při postižení mitochondrií s deplecí adenozintrifosfátu a apoptózou [5]. Nástup CHF je udáván v širokém časovém rozmezí od několika dnů až po více než 1,5 roku u 3–8 % pacientů léčených sunitinibem. Navíc až u 11 % asymptomatických pacientů došlo ke snížení EF o více než 15 %. U většiny pacientů se obnovuje EF a mnozí mohou pokračovat s terapií sunitinibem. Bylo zaznamenáno jen jedno úmrtí kvůli CHF [5,6].
Lapatinib je inhibitor stejné signální kaskády jako trastuzumab – ErbB2, má ale podobu malé molekuly. Obdobně jako trastuzumab je užíván v terapii ErbB2 pozitivních karcinomů prsu. Oproti trastuzumabu má lehce širší spektrum účinnosti díky inhibici další signální dráhy – ErbB1 (signální kaskáda epidermálního růstového faktoru a jeho receptoru – EGFR). Mechanizmus kardiotoxicity je pravděpodobně podobný jako u trastuzumabu. Oproti trastuzumabu je popisován značně nižší výskyt CHF (0,2 % oproti 2–8 %) i ALVD (1,4 % oproti 7–20 %), přičemž u téměř 90 % postižených pacientů došlo minimálně k částečné úpravě funkce levé komory [12].
Srdeční selhání u alkylačních látek
Kardiotoxicita cyklofosfamidu je asociována s režimy o vysokých dávkách léků, které jsou součástí přípravných režimů k transplantaci kostní dřeně. Kromě toho je konkomitantní terapie cyklofosfamidem možným rizikovým faktorem vývoje antracyklinové kardiotoxicity [45]. Mechanizmus kardiotoxicity zůstává nejasný. Ve starších pracích se CHF (i s případy hemoragické myoperikarditidy) během chemoterapie s vysokými dávkami léků vyskytovalo až u 28 % pacientů. Zhruba 1/3 pacientů měla perikardiální výpotky, u části pacientů se tyto příznaky kombinovaly a až u 2/3 pacientů bylo CHF příčinou smrti [9]. U novějších dávkovacích schémat je však popisována výrazně menší incidence CHF, a to kolem 2 % [46].
Srdeční selhání u imunomodulační léčby
Imunomodulační terapie založená na aplikaci interferonu-α a interleukinu-2 je používána u některých tumorů, obzvláště renálního karcinomu a maligního melanomu.
Interleukin-2 (IL-2) je látka s relativně vysokým toxickým potenciálem pro kardiorespirační systém. Mezi typické projevy patří syndrom úniku tekutin z intravaskulárního kompartmentu s edémem, pleurálními výpotky a ascitem (capillary leak syndrome). Dalším projevem je periferní vazodilatace s hypotenzí a tachykardií. U 2,5 % pacientů po skončení terapie IL-2 byla popsána asymptomatická zvýšená hladina CK-MB, někdy provázená lokálními i difuzními poruchami kinetiky levé komory, většinou pouze přechodnými. Koronární příčina je nepravděpodobná vzhledem k negativním koronarografiím provedeným u některých pacientů [47,48]. Vlastní rozvoj CHF je popisován pouze kazuisticky a byl asociován s nálezem těžké lymfocytární a eozinofilní myokarditidy z bioptických vzorků [10]. Přesné údaje o výskytu a mortalitě CHF a ALVD chybí.
U interferonu-α je popisována kardiomyopatie s projevy CHF pouze kazuisticky [11]. Konkrétní mechanizmus toxicity je neznámý. Dle dostupných prací se na toxicitě může podílet poškození endotelu [49], přičemž přímé toxické působení na myokardiální buňky je méně pravděpodobné [50]. CHF se objevovalo nezávisle na dávce a po vysazení preparátu došlo ve většině případů ke zlepšení srdeční funkce [11,51]. Kardiotoxicita se pravděpodobně zvyšuje, pokud se interferon-α a IL-2 kombinují [52], současné poznatky jsou nicméně limitované. Přesná data o incidenci a eventuální prognóze CHF či ALVD nejsou u terapie interferonem-α k dispozici.
Management pacientů léčených kardiotoxickými preparáty potenciálně způsobujícími CHF
Ideální postup u pacientů, kterým má být nasazen kardiotoxický preparát, se skládá z několika kroků zahrnujících prevenci, monitoraci, diagnózu a konečně léčbu kardiotoxických účinků.
Diagnostika předchozího kardiovaskulárního postižení a prevence kardiotoxicity
Vzhledem ke známé kardiotoxicitě výše uvedených preparátů je velmi důležité diagnostikovat před zahájením onkologické léčby možné dřívější postižení kardiovaskulárního systému, které je často rizikovým faktorem kardiotoxicity. Od tohoto okamžiku je vhodná těsná spolupráce onkologa s kardiologem a provedení interního kardiologického vyšetření včetně vstupního EKG, echokardiografie, a pokud je to nutné, tak i dalších vyšetření. Znalost dřívějšího kardiálního postižení nám umožňuje upravit onkologickou léčbu tak, abychom našli vhodnou rovnováhu mezi únosnou mírou kardiotoxicity a terapeutickým účinkem onkologické léčby. Možností, jak upravit onkologickou léčbu se snížením kardiotoxicity, je několik, včetně použití nižších kumulativních dávek chemoterapie [3,30], úpravy způsobu aplikace [53], použití jiného dávkovacího schématu [54], zvolení analogického preparátu nebo jiné farmakologické formy (lipozomální doxorubicin) [55], popřípadě použití úplně jiné chemoterapie, která bude lépe tolerována kardiovaskulárním systémem. Další výhodou důkladného kardiologického vyšetření před terapií je fakt, že pokud dojde ke kardiální dekompenzaci a pacient netrpěl dřívějším kardiálním onemocněním, lze zhoršení s větší pravděpodobností přičíst danému onkologickému preparátu. V obou případech je pak nutné zvážit další podávání onkologického preparátu, snížení dávky či výběr alternativní terapie.
Vyjma dřívějšího kardiálního postižení a použití kardiotoxických léků v minulosti je vhodné zachytit i další rizikové faktory, které jsou spojeny s vyšším výskytem kardiotoxicity. U některých výše zmiňovaných preparátů byly s různou mírou jistoty identifikovány následující rizikové faktory (tab. 2): pozitivní rodinná anamnéza z důvodu ischemické choroby srdeční (ICHS) [21], kouření [21], hypertenze [21,56], vyšší věk [4,29,38,39], ženské pohlaví [57], vyšší BMI [58], předchozí iradiace mediastina [45].
Tab. 2. Některé rizikové faktory kardiotoxicity. 
Dalším tématem je použití kardioprotektivních přípravků – tedy medikace, která by při preventivním použití snižovala riziko vývoje srdečního postižení a přitom nesnižovala účinek chemoterapie. Zatím se používá pouze jediný preparát – chelační látka dexrazoxan, která prokazatelně snižuje riziko rozvoje CHF u antracyklinů [59]. Na druhé straně nelze zcela vyloučit obavy, že by dexrazoxan mohl snižovat účinnost terapie [60]. A to i přesto, že recentní metaanalýza negativní působení dexrazoxanu na účinnost chemoterapie neprokázala [59]. Proto je zatím doporučováno podávat dexrazoxan hlavně při metastatickém postižení a až po kumulativní dávce 300 mg/m2 doxorubicinu [25]. Často se diskutuje o možném kardioprotektivním efektu karvedilolu [61], ACE inhibitorů (u asymptomatických pacientů se zvýšeným troponinem po onkologické léčbě) [62] a AT1 blokátorů [63] při léčbě kardiotoxickými preparáty. Avšak současné poznatky jsou velmi limitované a k jejich ověření je potřeba provést v této oblasti další výzkum.
Diagnostika kardiotoxických účinků
Základem diagnostiky kardiotoxických účinků jsou pravidelné kontroly s pečlivou anamnézou a interním vyšetřením, které by mělo být cílené zejména na diagnózu CHF a eventuálně na další projevy v závislosti na použitém kardiotoxickém preparátu.
Jako „zlatý standard“ hodnocení kardiotoxicity zejména u antracyklinů je považována endomyokardiální biopsie [23], která se však k monitoraci v praxi příliš nehodí. Histologické nálezy poměrně dobře korespondují s kumulativní dávkou antracyklinů, nicméně ne vždy přesně odpovídají klinickým obrazům a ne zcela spolehlivě predikují změny EF [64,65].
Nezbytnou součástí monitoringu pacientů jsou kardiologické zobrazovací metody včetně radionuklidové ventrikulografie, echokardiografie a magnetické rezonance.
Uplatnění radionuklidové ventrikulografie při hodnocení kardiotoxického postižení je popsáno v mnoha publikacích [20,66–69]. Standardně se u této metody používá EF k popisu systolické funkce levé komory. Dle některých studií využívajících radionuklidovou ventrikulografii zvyšuje citlivost detekce raných stadií kardiotoxicity hodnocení diastolických parametrů [70].
Lze nicméně předpokládat, že vzhledem k dostupnosti, ceně a radiační zátěži bude radionuklidová ventrikulografie v klinické praxi využívána stále méně a bude postupně nahrazována echokardiografií. Echokardiografie je široce dostupná a relativně levná metoda, jejíž význam i v detekci kardiotoxicity stále roste [19]. Používají se echokardiografické parametry hodnotící systolickou funkci levé komory včetně EF a frakčního zkrácení levé komory charakterizující kontraktilitu myokardu levé komory. Je pravděpodobné, že pomocí echokardiografických diastolických parametrů lze rozpoznat časnější stadia kardiotoxicity než pomocí systolických, nicméně odborná literatura není v tomto ohledu jednotná [27]. V každodenní praxi je však nejvíce používáno měření EF i vzhledem k tomu, že role hodnocení diastolické dysfunkce není přesně vymezena. V posledních letech jsou stále častěji publikovány výsledky studií analyzujících srdeční myokardiální mechaniku u onkologické terapie pomocí dopplerovské tkáňové echokardiografie a deformační analýzy (strainová echokargiografie – strain imaging). Tyto metody mají pravděpodobně větší potenciál k detekci ranějších stadií kardiotoxicity, ale v budoucnu je potřeba definovat jejich roli v diagnostických a monitorovacích schématech [19,71]. Např. strainová echokardiografie může být zatížena určitými restrikcemi vyplývajícími z omezené reprodukovatelnosti metody, které se týkají zejména strainové echokardiografie založené na dopplerovské tkáňové echokardiografii, ale i závislosti výsledků na použitém přístroji.
Určitý přínos by mohla mít i zátěžová echokardiografie, ale i zde platí, že její praktické využití v budoucnu vyžaduje důkladnější validaci [72].
Alternativou k radionuklidovým metodám a echokardiografii je magnetická rezonance. Její dostupnost je však omezená a cena vyšší než u echokardiografie. Její použití je proto zvažováno pouze u obtížně echokardiograficky vyšetřitelných pacientů. Navíc je magnetická rezonance s gadoliniovým enhancementem schopna poskytnout informaci o perzistujícím poškození myokardu [21].
Scintigrafie s antimyozinovými protilátkami [24], která by teoreticky přímo identifikovala myokardiální postižení, se v praxi příliš neujala a její role v budoucnu zůstává otázkou.
Doplňující význam má stanovení hladin natriuretických peptidů (BNP a NT-proBNP) v rámci diagnostiky zejména systolického CHF [73,74] a stanovení troponinů [75] jako indikátoru myokardiální nekrózy. Nicméně k rutinnímu monitorování hladiny natriuretických peptidů [76] nebo troponinů (s úmyslem nahradit vyšetření zobrazovacími technikami) se zatím nepřistupuje [19], přestože možné využití troponinů do budoucna vypadá nadějně [22]. Dalším slibným markerem by mohla být glykogenfosforyláza BB, jejíž hladina korelovala s myokardiálním poškozením u doxorubicinové kardiotoxicity [77].
Doporučené postupy pro sledování nemocných
Postupy, jak monitorovat srdeční funkce během terapie cytotoxickými preparáty, nebyly dosud uspokojivě stanoveny. Existuje však několik návrhů, které se týkají jednotlivých preparátů a zahrnují opakovaná měření systolické funkce LK pomocí EF spolu s kardiologickým vyšetřením [20,78–80].
Schwarz s kolegy navrhli na základě zjištění, že opakovaná monitorace EF se včasným vysazením doxorubicinu snižovala až 4násobně pravděpodobnost výskytu CHF, monitorovací schéma (tab. 3) [20], které bylo s úpravami použito i v dalších studiích [66–69]. U doxorubicinu doporučují 1. měření EF před terapií, po dosažení kumulativní dávky 250–300 mg/m2, 2. kontrolní měření při dosažení 400–450 mg/m2 dle rizikovosti pacienta a poté před každým cyklem. Doxorubicin je doporučeno vysadit, pokud dojde ke snížení EF o 10 % a zároveň je EF pod 50 % u pacientů s normální EF před léčbou. Pacienti se vstupní EF pod 30 % by doxorubicin dostat neměli. U pacientů s EF 30–50 % je doporučeno měření před každým cyklem a vysazení doxorubicinu při snížení EF o 10 % či pod hranici 30 %.
Tab. 3. Doporučení monitorace při terapii doxorubicinem [20]. ![Doporučení monitorace při terapii doxorubicinem [20].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/0a854b39d3266b90e9741bd9777c0d3c.jpeg)
Trastuzumab je 2. preparátem, pro který byla navržena schémata monitorace během terapie. Britská echokardiografická společnost vydala prohlášení [79], ve kterém doporučuje hodnocení EF před počátkem terapie trastuzumabem a dále každé 3 měsíce během terapie. Pacienti se vstupní EF pod 55 % by neměli být trastuzumabem léčeni a u pacientů, kterým v průběhu terapie poklesne EF o více než 10 % či pod 55 %, by mělo být zváženo vysazení trastuzumabu.
Nověji bylo publikováno i komplexní doporučení britského National Cancer Research Institute k managementu kardiovaskulárních rizik během terapie karcinomu prsu trastuzumabem (tab. 4), s některými odlišnostmi od dokumentu britské echokardiografické společnosti. Nověji je doporučováno zhodnocení EF před úvodní chemoterapií, poté po chemoterapii před terapií trastuzumabem a dále po 4 a 8 měsících. U nekomplikovaných pacientů se tedy počet nutných vyšetření snížil z 5 na 4. Při metastatickém postižení u pacientek na terapii trastuzumabem by mělo být monitorování prováděno ve stejných intervalech. Dále jsou jasněji stanovena kritéria započetí terapie ACE inhibitory a vysazování trastuzumabu [80]. U dalších preparátů návrhy monitorovacích schémat prakticky chybí.
Tab. 4. Doporučení pro terapii trastuzumabem dle NCRI [80]. ![Doporučení pro terapii trastuzumabem dle NCRI [80].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/f1cd2d10d763f3c6c0161a52e2f79242.jpeg)
Terapie srdečního selhání indukovaného kardiotoxickou léčbou
Specifická léčba CHF indukovaného antracykliny neexistuje. Proto je u těchto pacientů doporučována standardní léčba CHF [81] zahrnující beta-blokátory [82] včetně karvedilolu [83], ACE inhibitory/AT1 blokátory [32], kličková či thiazidová diuretika a antagonisty aldosteronu. Za určitých okolností se doporučuje digitalis či resynchronizační terapie [84]. U trastuzumabu a ostatních preparátů CHF důkazy o specifické terapii, stejně jako u antracyklinů, chybí. I u těchto pacientů je doporučována standardní léčba CHF, jak je zmíněno výše, přičemž dominantní roli pravděpodobně hrají ACE inhibitory, nasazované časně při objevu asymptomatické dysfunkce [80].
Ischemie
V průběhu podávání některých preparátů (5-fluorouracil, kapecitabin, sorafenib a bevacizumab – tab. 5) nebo těsně po něm může docházet k symptomům typicky provázejícím myokardiální ischemii [15,16,18,85]. Jako nejčastější příčina je udávána nejen skutečná myokardiální ischemie, ale u některých preparátů i toxická myokarditida napodobující příznaky ischemie [86]. Mechanizmus, jakým tyto preparáty indukují ischemii v tepnách nepostižených aterosklerózou, není zcela jasný, nicméně se z patogenetického hlediska nabízí vazospasmus či trombóza při poškození endotelu onkologickým preparátem. Pokud dochází k aterosklerotickému postižení, mohou tyto preparáty zvyšovat pravděpodobnost vazospasmu či trombózy. Zvažována je i přímá interference s energetickým metabolizmem srdečního svalu [87]. Myokardiální ischemie může být zřejmě v některých případech asymptomatická, projevující se pouze změnami na EKG, jako například u 5-fluorouracilu. Na druhé straně se ischemie může projevit klasickými anginózními bolestmi, při malé námaze nebo i v klidu, a v určitých případech může vyústit v akutní infarkt myokardu.
Tab. 5. Ischemie u kardiotoxické léčby – incidence a prognóza. 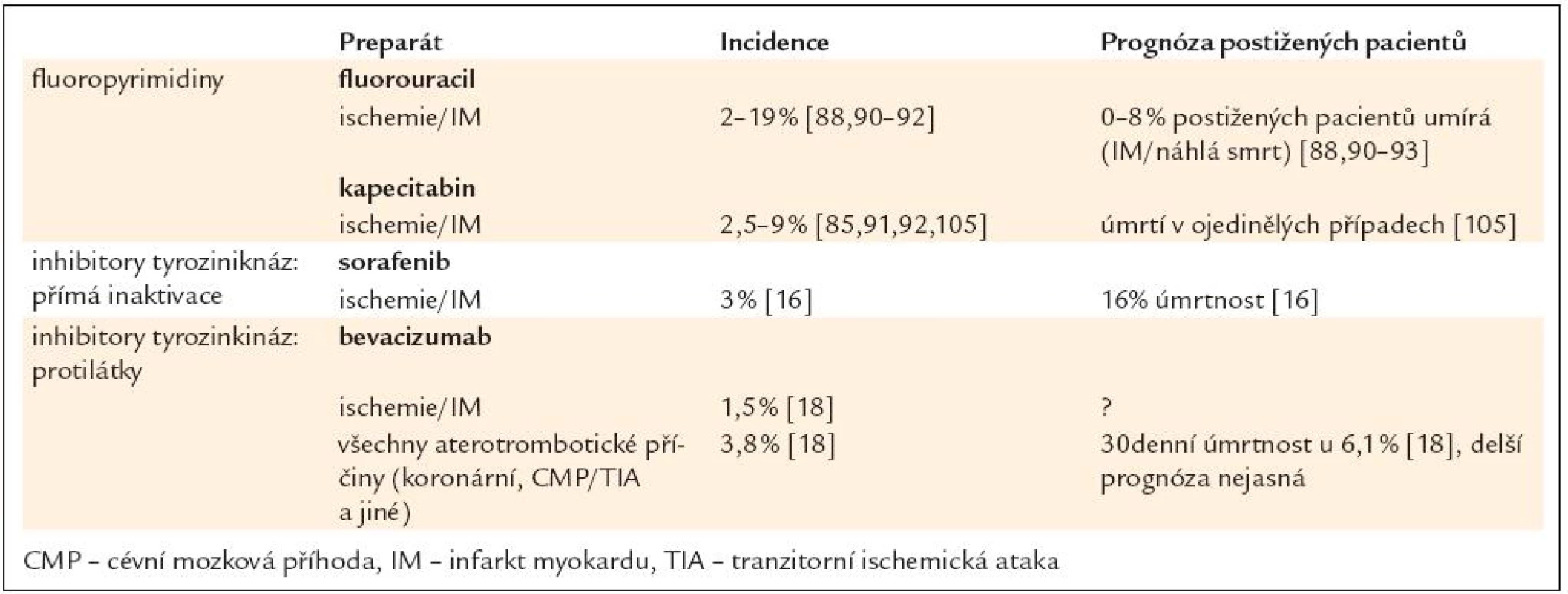
Ischemie u fluoropyrimidinových preparátů
Fluoropyrimidinové antimetabolity 5-fluorouracil a jeho perorálně podávaný prodrug kapecitabin jsou užívány zvláště u adenokarcinomů různých lokalizací (žaludku, pankreatu, kolorekta, prsu) a u dlaždicobuněčných karcinomů hlavy a krku. Velmi pravděpodobně navozují vazospastické příhody, které jsou zřejmě mechanizmem myokardiální ischemie [15,88]. U pacientů s podezřením na infarkt myokardu léčených těmito preparáty totiž koronarografie neukázaly trombotické uzávěry [88]. Napodobovat příznaky myokardiální ischemie může toxická myokarditida, která byla u tohoto preparátu popsána kazuisticky a u jednoho pacienta vyústila v kardiogenní šok [86]. Dalším navrhovaným mechanizmem je poškození mikrocirkulace s formací destičkových trombů [89], ale je možná i interference s energetickým metabolizmem [87]. Výskyt symptomatických ischemických příhod, případně toxické myokarditidy napodobující příznaky ischemie se udává mezi 2–19 % [88,90–92] s mortalitou až kolem 8 % u symptomatických pacientů [93]. Asymptomatické změny ST segmentu potenciálně svědčící pro ischemii se ale vyskytují zřejmě ještě častěji, až u 68 % pacientů [94]. 5-fluorouracil může také způsobit přechodné asymptomatické poruchy systolické i diastolické funkce komory [95], které mohou být teoreticky navozeny ischemií. Rizikovým faktorem kardiotoxicity 5-fluorouracilu (tab. 2) je jeho kontinuální infuzní podání oproti bolusovému a pravděpodobně leukovorin u pacientů s dlouhodobým infuzním podáváním [91]. Jako další rizikové faktory byly identifikovány předchozí kardiální postižení [90] včetně ICHS [94] a renální postižení [92]. V terapii ischemie u 5-fluorouracilu a kapecitabinu jsou vzhledem k předpokládanému vazospastickému působení často používány kalciové blokátory a nitráty [15]. Jejich profylaktický účinek na vznik příznaků je však sporný [92]. Po výskytu ischemie není opětovné nasazení fluoropyrimidinů zcela kontraindikováno, dobré výsledky se zdá mít redukce dávky fluorouracilu v prevenci dalších ischemických příhod [85,91,92].
Ischemie u inhibitorů tyrozinkináz
Inhibitory tyrozinkináz mohou nejen navodit CHF, ale v některých případech i indukovat myokardiální ischemii (bevacizumab a sorafenib). Patogeneze ischemie u bevacizumabu není zcela jasná. Prostřednictvím blokády VEGF pravděpodobně dochází k poruše funkce endotelu s potenciací protrombotického stavu [96]. Tento efekt se zřejmě týká zejména arteriálního řečiště, protože nebyla pozorována signifikantně vyšší incidence žilních trombóz. Incidence infarktu myokardu či anginy pectoris je u pacientů léčených bevacizumabem relativně malá (kolem 1,5 %) [18]. V této analýze, zahrnující téměř dva tisíce pacientů, dosáhl statistické významnosti oproti kontrolní skupině pouze kombinovaný cíl studie (endpoint – u 3,8 % pacientů), do kterého byly zařazeny jak infarkt myokardu a angina pectoris, tak i cerebrovaskulární příhody, akutní mezenterická ischemie a akutní ischemie dolních končetin. Mortalita přímo na ischemickou chorobu srdeční nebyla popsána, 30denní úmrtnost u kombinovaného endpointu byla 0,62 % pacientů léčených bevacizumabem (6,1 % z postižených pacientů). Jako rizikové faktory arteriálních trombotických příhod byly identifikovány věk nad 65 let a předchozí arteriální tromboembolické příhody.
Dalším preparátem spojovaným s myokardiální ischemií je sorafenib, tyrozinkinázový inhibitor používaný v terapii metastatického renálního karcinomu a maligního melanomu. Vzhledem k tomu, že sorafenib působí obdobným způsobem jako bevacizumab, předpokládá se, že i patogeneze myokardiální ischemie bude obdobná. Ischemické komplikace u sorafenibu jsou rovněž relativně vzácné (okolo 3 % léčených pacientů), přičemž celková mortalita pacientů s ischemickou příhodou je udávána 16 %, avšak bez jasné specifikace příčiny úmrtí [16]. Mortalitní data jsou však odvozena z relativně malého souboru pacientů (2 úmrtí z 11 postižených pacientů).
Arytmie
Poruchy rytmu jsou často uváděny jako nežádoucí účinky onkologické léčby. Na druhou stranu incidence arytmií v populaci před léčbou není běžně zjišťována. Navíc sama přítomnost nádorového onemocnění by mohla být rizikovým faktorem vzniku některých srdečních arytmií. Tomu napovídá asociace fibrilace síní a nádoru prsu či kolorekta u pacientů ještě před započetím jakékoli onkologické léčby [97]. Z těchto důvodů je také poměrně obtížné prokázat kauzální souvislost mezi chemoterapií a arytmiemi. Většinou tedy není jasné, zda je příčinou arytmie onkologická léčba nebo sama přítomnost nádoru, jiné komorbidity či kombinace těchto faktorů. Situaci dále komplikuje fakt, že onkologičtí pacienti jsou málokdy léčeni monoterapií, a tak je obtížné dohledat, který konkrétní preparát by mohl být (a pokud vůbec) za arytmii zodpovědný [17].
Mezi arytmické projevy chemoterapie popisované v literatuře mimo jiné patří: u antracyklinů supraventrikulární i ventrikulární tachykardie, u fluoropyrimidinů tachyarytmie, ale i A-V blokády, u paclitaxelu a thalidomidu bradykardie a A-V bloky a u imunomodulační léčby tachyarytmie (včetně setrvalých ventrikulárních). S arytmiemi jsou vzácněji spojovány i další onkologické preparáty včetně alkylačních látek (cisplatina, melfalan a cyklofosfamid), antimetabolitů (gemcitabin a cytarabin) a kazuisticky tyrozinkinázových inhibitorů (trastuzumab, sunitinib, cetuximab a alemtuzumab), arzenu a inhibitoru histondeacetylázy vorinostatu [17].
U některých onkologických preparátů je popisováno prodloužení QT-intervalu. Mezi preparáty indukující QT-prolongaci patří mimo antracyklinů [98] také arzen, thalidomid a některé tyrozinkinázové inhibitory (dasatinib, sunitinib, nilotinib). V extrémní podobě může QT-prolongace způsobit i komorové arytmie typu torsade de pointes, které byly ojediněle popsány u arzenu [99] a antracyklinů [100]. Na patogenezi torsade de pointes u antracyklinů se však velmi pravděpodobně významnou měrou podílela současná hypokalemie [17].
Život ohrožující arytmie či úmrtí způsobené poruchami srdečního rytmu jsou však popisovány pouze ojediněle [11,91,101]. U rizikových pacientů je doporučováno zvážit EKG monitoraci během aplikace onkologických preparátů podávaných během hospitalizace a asociovaných s arytmiemi.
Arteriální hypertenze
Arteriální hypertenze je dalším poměrně častým průvodním jevem nádorové léčby, ať již jako komplikace onkologické terapie, nebo jako četná běžná komorbitida pacientů s onkologickým onemocněním. Na patogenezi systémové arteriální hypertenze se mohou podílet inhibitory tyrozinkináz, které interferují s VEGF signální kaskádou, vedou k alteraci NO signalizace a paralelně inhibují abiogenezi [96].
Hypertenze je u těchto přípravků velmi běžnou komplikací, v závislosti na studii se vyskytuje až v 35 % u bevacizumabu [14], v 47 % u sunitinibu [5] a okolo 25 % u sorafenibu [13].
Je zajímavé, že vyšší odpověď na chemoterapii byla asociována s častějším rozvojem arteriální hypertenze. Rozvoj hypertenze by tedy bylo možno považovat za určitý marker úspěšnosti onkologické léčby. Proto je rozhodnutí vysadit sunitinib při rozvoji hypertenze poněkud sporné a měla by být zvážena korekce hypertenze antihypertenzivy [102].
Z klasických antihypertenzních léků se zdají být ACE inhibitory ve srovnání s beta-blokátory či kalciovými antagonisty účinnější v terapii hypertenze způsobené inhibitory angiogeneze [14].
Limitace současných poznatků o kardiotoxicitě
Z výše uvedeného přehledu je zřejmé, že naše znalosti o kardiotoxické léčbě jsou do značné míry omezené. Limituje nás nedostatek prospektivních dat, heterogenní populace onkologických pacientů s komplexní terapií a komorbiditami a v neposlední řadě často pouze bazální kardiologické sledování v průběhu mnoha onkologických studií.
Již samotná data týkající se různých populací onkologických pacientů jsou obtížná ke zpracování a interpretaci. Skupiny jsou z kardiovaskulárního hlediska nehomogenní, se širokým věkovým rozptylem i spektrem kardiovaskulárních komorbidit. Často se jedná o pacienty s potenciálně kardiotoxickou chemoterapií či radioterapií v anamnéze, běžná je kombinovaná léčba více chemoterapeutiky. Dlouhodobá kardiovaskulární monitorace pacientů je také často ztížená či nemožná kvůli progresi primárního onemocnění.
Další obtíže spočívají v designu onkologických studií. V mnoha případech se logicky jedná o studie primárně zaměřené na onkologický benefit a nežádoucí kardiovaskulární účinky jsou analyzovány pouze jako vedlejší cíl v celém spektru nežádoucích účinků. V těchto případech nemusí být vždy znám stav kardiovaskulárního systému pacienta před počátkem terapie. Příznaky kardiovaskulárních onemocnění mohou být navíc mylně připisovány jiné příčině. Naopak v situaci, kdy je kardiotoxicita preparátu známa a ve studiích adekvátně sledována (studie u trastuzumabu [38,39,58]), nejsou často pacienti s vážnějšími kardiovaskulárními komorbiditami do studií zařazováni. Proto je tedy obtížnější data z těchto studií extrapolovat na běžnou onkologickou populaci, kde jsou kardiovaskulární komorbidity obzvláště ve vyšším věku běžné.
Problematická mohou být i některá data z retrospektivních studií. Především retrospektivní hodnocení příznaků CHF u onkologické populace může být velmi obtížné, stejně tak posouzení podílu srdečních komorbidit na případném úmrtí.
U „kardiologických studií“ onkologických pacientů je naopak dopad znalostí jiných echokardiografických parametrů než EF (např. diastolické funkce) na management onkologické léčby nejasný. Příkladem jsou otázky případné redukce dávek, vysazení či nasazení jiného preparátu.
Proto jsou údaje o incidenci, mortalitě a morbiditě u mnoha preparátů neúplné, a často tedy neumožňují standardizovatelné zhodnocení benefitu vůči riziku. Dále, jak bylo zmíněno výše, není vždy znám optimální způsob sledování a terapie nežádoucích účinků.
Závěr
Pacienti léčení onkologickými preparáty s kardiotoxickými účinky vyžadují komplexní přístup založený na spolupráci onkologa a kardiologa, pečlivé monitoraci stavu a aplikaci zobrazovacích technik sloužících k odhalení kardiálního postižení. V dnešní době jsou však naše poznatky o kardiotoxickém působení preparátů, jejich mechanizmu působení, incidenci/prevalenci a morbiditě/mortalitě stále nedostatečné. To se odráží v nedostatku doporučení, jakým způsobem a jak často tyto pacienty monitorovat. Specifická léčba kardiotoxicity v podstatě neexistuje a v této oblasti je nezbytný další výzkum. Dostupná data ukazují, že tuto problematiku nelze podceňovat. Při vzrůstajícím počtu onkologických pacientů, kteří na léčbě přežívají delší dobu, popřípadě dosáhnou i plného vyléčení, se bude množství pacientů ohrožených kardiotoxicitou stále zvyšovat.
MUDr. Josef Marek
int2.lf1.cuni.cz
e - mail: josef.marek2@vfn.czDoručeno do redakce: 6. 10. 2010
Přijato po recenzi: 26. 11. 2010
Zdroje
1. ÚZIS ČR. Zhoubné nádory v roce 2006. Aktuální informace Ústavu zdravotnických informací a statistiky České republiky 2009; 1 : 1–9.
2. Yeh ET, Bickford CL. Cardiovascular complications of cancer therapy: incidence, pathogenesis, diagnosis, and management. J Am Coll Cardiol 2009; 53 : 2231–2247.
3. Lefrak EA, Pitha J, Rosenheim S et al. A clinicopathologic analysis of adriamycin cardiotoxicity. Cancer 1973; 32 : 302–314.
4. Slamon DJ, Leyland-Jones B, Shak S et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med 2001; 344 : 783–792.
5. Chu TF, Rupnick MA, Kerkela R et al. Cardiotoxicity associated with tyrosine kinase inhibitor sunitinib. Lancet 2007; 370 : 2011–2019.
6. Khakoo AY, Kassiotis CM, Tannir N et al. Heart failure associated with sunitinib malate: a multitargeted receptor tyrosine kinase inhibitor. Cancer 2008; 112 : 2500–2508.
7. Miller KD, Chap LI, Holmes FA et al. Randomized phase III trial of capecitabine compared with bevacizumab plus capecitabine in patients with previously treated metastatic breast cancer. J Clin Oncol 2005; 23 : 792–799.
8. Kerkelä R, Grazette L, Yacobi R et al. Cardiotoxicity of the cancer therapeutic agent imatinib mesylate. Nat Med 2006; 12 : 908–916.
9. Gottdiener JS, Appelbaum FR, Ferrans VJ et al. Cardiotoxicity associated with high-dose cyclophosphamide therapy. Arch Intern Med 1981; 141 : 758–763.
10. Samlowski WE, Ward JH, Craven CM et al. Severe myocarditis following high-dose interleukin-2 administration. Arch Pathol Lab Med 1989; 113 : 838–841.
11. Sonnenblick M, Rosin A. Cardiotoxicity of interferon. A review of 44 cases. Chest 1991; 99 : 557–561.
12. Perez EA, Koehler M, Byrne J et al. Cardiac safety of lapatinib: pooled analysis of 3689 patients enrolled in clinical trials. Mayo Clin Proc 2008; 83 : 679–686.
13. Wu S, Chen JJ, Kudelka A et al. Incidence and risk of hypertension with sorafenib in patients with cancer: a systematic review and meta-analysis. Lancet Oncol 2008; 9 : 117–123.
14. Pande A, Lombardo J, Spangenthal E et al. Hypertension secondary to anti-angiogenic therapy: experience with bevacizumab. Anticancer Res 2007; 27 : 3465–3470.
15. Alter P, Herzum M, Soufi M et al. Cardiotoxicity of 5-fluorouracil. Cardiovasc Hematol Agents Med Chem 2006; 4 : 1–5.
16. Escudier B, Eisen T, Stadler WM et al. Sorafenib in advanced clear-cell renal-cell carcinoma. N Engl J Med 2007; 356 : 125–134.
17. Guglin M, Aljayeh M, Saiyad S et al. Introducing a new entity: chemotherapy-induced arrhythmia. Europace 2009; 11 : 1579–1586.
18. Scappaticci FA, Skillings JR, Holden SN et al. Arterial thromboembolic events in patients with metastatic carcinoma treated with chemotherapy and bevacizumab. J Natl Cancer Inst 2007; 99 : 1232–1239.
19. Jurcut R, Wildiers H, Ganame J et al. Detection and monitoring of cardiotoxicity-what does modern cardiology offer? Support Care Cancer 2008; 16 : 437–445.
20. Schwartz RG, McKenzie WB, Alexander J et al. Congestive heart failure and left ventricular dysfunction complicating doxorubicin therapy. Seven-year experience using serial radionuclide angiocardiography. Am J Med 1987; 82 : 1109–1118.
21. Wadhwa D, Fallah-Rad N, Grenier D et al. Trastuzumab mediated cardiotoxicity in the setting of adjuvant chemotherapy for breast cancer: a retrospective study. Breast Cancer Res Treat 2009; 117 : 357–364.
22. Dolci A, Dominici R, Cardinale D et al. Biochemical markers for prediction of chemotherapy-induced cardiotoxicity: systematic review of the literature and recommendations for use. Am J Clin Pathol 2008; 130 : 688–695.
23. Billingham ME, Mason JW, Bristow MR et al. Anthracycline cardiomyopathy monitored by morphologic changes. Cancer Treat Rep 1978; 62 : 865–872.
24. Valdés Olmos RA, Carrió I, Hoefnagel CA et al. High sensitivity of radiolabelled antimyosin scintigraphy in assessing anthracycline related early myocyte damage preceding cardiac dysfunction. Nucl Med Commun 2002; 23 : 871–877.
25. Hensley ML, Hagerty KL, Kewalramani T et al. American Society of Clinical Oncology 2008 clinical practice guideline update: use of chemotherapy and radiation therapy protectants. J Clin Oncol 2009; 27 : 127–145.
26. Chen B, Peng X, Pentassuglia L et al. Molecular and cellular mechanisms of anthracycline cardiotoxicity. Cardiovasc Toxicol 2007; 7 : 114–121.
27. Shan K, Lincoff AM, Young JB. Anthracycline-induced cardiotoxicity. Ann Intern Med 1996; 125 : 47–58.
28. Bristow MR, Thompson PD, Martin RP et al. Early anthracycline cardiotoxicity. Am J Med 1978; 65 : 823–832.
29. Von Hoff DD, Layard MW, Basa P et al. Risk factors for doxorubicin-induced congestive heart failure. Ann Intern Med 1979; 91 : 710–717.
30. Swain SM, Whaley FS, Ewer MS. Congestive heart failure in patients treated with doxorubicin: a retrospective analysis of three trials. Cancer 2003; 97 : 2869–2879.
31. Haq MM, Legha SS, Choksi J et al. Doxorubicin-induced congestive heart failure in adults. Cancer 1985; 56 : 1361–1365.
32. Jensen BV, Skovsgaard T, Nielsen SL. Functional monitoring of anthracycline cardiotoxicity: a prospective, blinded, long-term observational study of outcome in 120 patients. Ann Oncol 2002; 13 : 699–709.
33. Steinherz LJ, Steinherz PG, Tan CT et al. Cardiac toxicity 4 to 20 years after completing anthracycline therapy. JAMA 1991; 266 : 1672–1677.
34. Lipshultz SE, Colan SD, Gelber RD et al. Late cardiac effects of doxorubicin therapy for acute lymphoblastic leukemia in childhood. N Engl J Med 1991; 324 : 808–815.
35. van Dalen EC, van der Pal HJ, Kok WE et al. Clinical heart failure in a cohort of children treated with anthracyclines: a long-term follow-up study. Eur J Cancer 2006; 42 : 3191–3198.
36. Chen MH, Kerkelä R, Force T. Mechanisms of cardiac dysfunction associated with tyrosine kinase inhibitor cancer therapeutics. Circulation 2008; 118 : 84–95.
37. Guarneri V, Lenihan DJ, Valero V et al. Long-term cardiac tolerability of trastuzumab in metastatic breast cancer: the M.D. Anderson Cancer Center experience. J Clin Oncol 2006; 24 : 4107–4115.
38. Tan-Chiu E, Yothers G, Romond E et al. Assessment of cardiac dysfunction in a randomized trial comparing doxorubicin and cyclophosphamide followed by paclitaxel, with or without trastuzumab as adjuvant therapy in node-positive, human epidermal growth factor receptor 2-overexpressing breast cancer: NSABP B-31. J Clin Oncol 2005; 23 : 7811–7819.
39. Perez EA, Suman VJ, Davidson NE et al. Cardiac safety analysis of doxorubicin and cyclophosphamide followed by paclitaxel with or without trastuzumab in the North Central Cancer Treatment Group N9831 adjuvant breast cancer trial. J Clin Oncol 2008; 26 : 1231–1238.
40. Telli ML, Hunt SA, Carlson RW et al. Trastuzumab-related cardiotoxicity: calling into question the concept of reversibility. J Clin Oncol 2007; 25 : 3525–3533.
41. Bianchi G, Albanell J, Eiermann W et al. Pilot trial of trastuzumab starting with or after the doxorubicin component of a doxorubicin plus paclitaxel regimen for women with HER2-positive advanced breast cancer. Clin Cancer Res 2003; 9 : 5944–5951.
42. Untch M, Muscholl M, Tjulandin S et al. First-line trastuzumab plus epirubicin and cyclophosphamide therapy in patients with human epidermal growth factor receptor 2-positive metastatic breast cancer: cardiac safety and efficacy data from the Herceptin, Cyclophosphamide, and Epirubicin (HERCULES) trial. J Clin Oncol 2010; 28 : 1473–1480.
43. Miller K, Wang M, Gralow J et al. Paclitaxel plus bevacizumab versus paclitaxel alone for metastatic breast cancer. N Engl J Med 2007; 357 : 2666–2676.
44. Atallah E, Durand JB, Kantarjian H et al. Congestive heart failure is a rare event in patients receiving imatinib therapy. Blood 2007; 110 : 1233–1237.
45. Minow RA, Benjamin RS, Lee ET et al. Adriamycin cardiomyopathy – risk factors. Cancer 1977; 39 : 1397–1402.
46. Braverman AC, Antin JH, Plappert MT et al. Cyclophosphamide cardiotoxicity in bone marrow transplantation: a prospective evaluation of new dosing regimens. J Clin Oncol 1991; 9 : 1215–1223.
47. Lee RE, Lotze MT, Skibber JM et al. Cardiorespiratory effects of immunotherapy with interleukin-2. J Clin Oncol 1989; 7 : 7–20.
48. White RL Jr, Schwartzentruber DJ, Guleria A et al. Cardiopulmonary toxicity of treatment with high dose interleukin-2 in 199 consecutive patients with metastatic melanoma or renal cell carcinoma. Cancer 1994; 74 : 3212–3222.
49. Salman H, Bergman M, Bessler H et al. The effect of interferon on mouse myocardial capillaries: an ultrastructural study. Cancer 1999; 85 : 1375–1379.
50. Dorr RT, Shipp NG. Effect of interferon, interleukin-2 and tumor necrosis factor on myocardial cell viability and doxorubicin cardiotoxicity in vitro. Immunopharmacology 1989; 18 : 31–38.
51. Zimmerman S, Adkins D, Graham M et al. Irreversible, severe congestive cardiomyopathy occurring in association with interferon alpha therapy. Cancer Biother 1994; 9 : 291–299.
52. Kruit WH, Punt KJ, Goey SH et al. Cardiotoxicity as a dose-limiting factor in a schedule of high dose bolus therapy with interleukin-2 and alpha-interferon. An unexpectedly frequent complication. Cancer 1994; 74 : 2850–2856.
53. van Dalen EC, van der Pal HJ, Caron HN et al. Different dosage schedules for reducing cardiotoxicity in cancer patients receiving anthracycline chemotherapy. Cochrane Database Syst Rev 2009; 7: CD005008.
54. Weiss AJ, Metter GE, Fletcher WS et al. Studies on adriamycin using a weekly regimen demonstrating its clinical effectiveness and lack of cardiac toxicity. Cancer Treat Rep 1976; 60 : 813–822.
55. van Dalen EC, Michiels EM, Caron HN et al. Different anthracycline derivates for reducing cardiotoxicity in cancer patients. Cochrane Database Syst Rev 2006; 4: CD005006.
56. Hershman DL, McBride RB, Eisenberger A et al. Doxorubicin, cardiac risk factors, and cardiac toxicity in elderly patients with diffuse B-cell non-Hodgkin’s lymphoma. J Clin Oncol 2008; 26 : 3159–3165.
57. Lipshultz SE, Lipsitz SR, Mone SM et al.Female sex and drug dose as risk factors for late cardiotoxic effects of doxorubicin therapy for childhood cancer. N Engl J Med 1995; 332 : 1738–1743.
58. Suter TM, Procter M, van Veldhuisen DJ et al. Trastuzumab-associated cardiac adverse effects in the herceptin adjuvant trial. J Clin Oncol 2007; 25 : 3859–3865.
59. van Dalen EC, Caron HN, Dickinson HO et al. Cardioprotective interventions for cancer patients receiving anthracyclines. Cochrane Database Syst Rev 2008; 2: CD003917.
60. Swain SM, Whaley FS, Gerber MC et al. Cardioprotection with dexrazoxane for doxorubicin-containing therapy in advanced breast cancer. J Clin Oncol 1997; 15 : 1318–1332.
61. Kalay N, Basar E, Ozdogru I et al. Protective effects of carvedilol against anthracycline-induced cardiomyopathy. J Am Coll Cardiol 2006; 48 : 2258–2262.
62. Cardinale D, Colombo A, Sandri MT et al. Prevention of high-dose chemotherapy-induced cardiotoxicity in high-risk patients by angiotensin-converting enzyme inhibition. Circulation 2006; 114 : 2474–2481.
63. Nakamae H, Tsumura K, Terada Y et al. Notable effects of angiotensin II receptor blocker, valsartan, on acute cardiotoxic changes after standard chemotherapy with cyclophosphamide, doxorubicin, vincristine, and prednisolone. Cancer 2005; 104 : 2492–2498.
64. Isner JM, Ferrans VJ, Cohen SR et al. Clinical and morphologic cardiac findings after anthracycline chemotherapy. Analysis of 64 patients studied at necropsy. Am J Cardiol 1983; 51 : 1167–1174.
65. Ewer MS, Ali MK, Mackay B et al. A comparison of cardiac biopsy grades and ejection fraction estimations in patients receiving Adriamycin. J Clin Oncol 1984; 2 : 112–117.
66. Mitani I, Jain D, Joska TM et al. Doxorubicin cardiotoxicity: prevention of congestive heart failure with serial cardiac function monitoring with equilibrium radionuclide angiocardiography in the current era. J Nucl Cardiol 2003; 10 : 132–139.
67. O’Brien ME, Wigler N, Inbar M et al. Reduced cardiotoxicity and comparable efficacy in a phase III trial of pegylated liposomal doxorubicin HCl (CAELYX/Doxil) versus conventional doxorubicin for first-line treatment of metastatic breast cancer. Ann Oncol 2004; 15 : 440–449.
68. Harris L, Batist G, Belt R et al. Liposome-encapsulated doxorubicin compared with conventional doxorubicin in a randomized multicenter trial as first-line therapy of metastatic breast carcinoma. Cancer 2002; 94 : 25–36.
69. Batist G, Ramakrishnan G, Rao CS et al. Reduced cardiotoxicity and preserved antitumor efficacy of liposome-encapsulated doxorubicin and cyclophosphamide compared with conventional doxorubicin and cyclophosphamide in a randomized, multicenter trial of metastatic breast cancer. J Clin Oncol 2001; 19 : 1444–1454.
70. Suzuki J, Yanagisawa A, Shigeyama T et al. Early detection of anthracycline-induced cardiotoxicity by radionuclide angiocardiography. Angiology 1999; 50 : 37–45.
71. Hare JL, Brown JK, Leano R et al. Use of myocardial deformation imaging to detect preclinical myocardial dysfunction before conventional measures in patients undergoing breast cancer treatment with trastuzumab. Am Heart J 2009; 158 : 294–301.
72. Elbl L, Hrstkova H, Chaloupka V et al. The evaluation of left ventricular function in childhood cancer survivors by pharmacological stress echocardiography. Neoplasma 2003; 50 : 191–197.
73. Horacek JM, Pudil R, Jebavy L et al. Assessment of anthracycline-induced cardiotoxicity with biochemical markers. Exp Oncol 2007; 29 : 309–313.
74. Elbl L, Vasova I, Navratil M et al. Comparison of plasmatic levels of B-natriuretic peptide with echocardiographic indicators of left ventricle function after doxorubicin therapy. Vnitř Lék 2006; 52 : 563–570.
75. Cardinale D, Sandri MT, Martinoni A et al. Left ventricular dysfunction predicted by early troponin I release after high-dose chemotherapy. J Am Coll Cardiol 2000; 36 : 517–522.
76. Vogelsang TW, Jensen RJ, Hesse B et al. BNP cannot replace gated equilibrium radionuclide ventriculography in monitoring of anthracycline-induced cardiotoxity. Int J Cardiol 2008; 124 : 193–197.
77. Horacek JM, Vasatova M, Tichy M et al. The use of cardiac biomarkers in detection of cardiotoxicity associated with conventional and high-dose chemotherapy for acute leukemia. Exp Oncol 2010; 32 : 97–99.
78. Steinherz LJ, Graham T, Hurwitz R et al. Guidelines for cardiac monitoring of children during and after anthracycline therapy: report of the Cardiology Committee of the Childrens Cancer Study Group. Pediatrics 1992; 89 : 942–949.
79. Fox KF. The evaluation of left ventricular function for patients being considered for, or receiving Trastuzumab (Herceptin) therapy. Br J Cancer 2006; 95 : 1454.
80. Jones AL, Barlow M, Barrett-Lee PJ et al. Management of cardiac health in trastuzumab-treated patients with breast cancer: updated United Kingdom National Cancer Research Institute recommendations for monitoring. Br J Cancer 2009; 100 : 684–692.
81. Špinar J, Hradec J, Meluzín J et al. Doporučení pro diagnostiku a léčbu chronického srdečního selhání ČKS 2006. Cor Vasa 2007; 49: K5–K34.
82. Noori A, Lindenfeld J, Wolfel E et al. Beta-blockade in adriamycin-induced cardiomyopathy. J Card Fail 2000; 6 : 115–119.
83. Oliveira PJ, Bjork JA, Santos MS et al. Carvedilol-mediated antioxidant protection against doxorubicin-induced cardiac mitochondrial toxicity. Toxicol Appl Pharmacol 2004; 200 : 159–168.
84. Ajijola OA, Nandigam KV, Chabner BA et al. Usefulness of cardiac resynchronization therapy in the management of Doxorubicin-induced cardiomyopathy. Am J Cardiol 2008; 101 : 1371–1372.
85. Saif MW, Tomita M, Ledbetter L et al. Capecitabine-related cardiotoxicity: recognition and management. J Support Oncol 2008; 6 : 41–48.
86. Sasson Z, Morgan CD, Wang B et al. 5-Fluorouracil related toxic myocarditis: case reports and pathological confirmation. Can J Cardiol 1994; 10 : 861–864.
87. Matsubara I, Kamiya J, Imai S. Cardiotoxic effects of 5-fluorouracil in the guinea pig. Jpn J Pharmacol 1980; 30 : 871–879.
88. Wacker A, Lersch C, Scherpinski U et al. High incidence of angina pectoris in patients treated with 5-fluorouracil. A planned surveillance study with 102 patients. Oncology 2003; 65 : 108–112.
89. Cwikiel M, Eskilsson J, Wieslander JB et al. The appearance of endothelium in small arteries after treatment with 5-fluorouracil. An electron microscopic study of late effects in rabbits. Scanning Microsc 1996; 10 : 805–819.
90. Labianca R, Beretta G, Clerici M et al. Cardiac toxicity of 5-fluorouracil: a study on 1083 patients. Tumori 1982; 68 : 505–510.
91. Kosmas C, Kallistratos MS, Kopterides P et al. Cardiotoxicity of fluoropyrimidines in different schedules of administration: a prospective study. J Cancer Res Clin Oncol 2008; 134 : 75–82.
92. Jensen SA, Sørensen JB. Risk factors and prevention of cardiotoxicity induced by 5-fluorouracil or capecitabine. Cancer Chemother Pharmacol 2006; 58 : 487–493.
93. Saif MW, Shah MM, Shah AR. Fluoropyrimidine-associated cardiotoxicity: revisited. Expert Opin Drug Saf 2009; 8 : 191–202.
94. Rezkalla S, Kloner RA, Ensley J et al. Continuous ambulatory ECG monitoring during fluorouracil therapy: a prospective study. J Clin Oncol 1989; 7 : 509–514.
95. Grandi AM, Pinotti G, Morandi E et al. Noninvasive evaluation of cardiotoxicity of 5-fluorouracil and low doses of folinic acid: a one-year follow-up study. Ann Oncol 1997; 8 : 705–708.
96. Kamba T, McDonald DM. Mechanisms of adverse effects of anti-VEGF therapy for cancer. Br J Cancer 2007; 96 : 1788–1795.
97. Guzzetti S, Costantino G, Vernocchi A et al. First diagnosis of colorectal or breast cancer and prevalence of atrial fibrillation. Intern Emerg Med 2008; 3 : 227–231.
98. Pudil R, Horacek JM, Horackova J et al. Anthracycline therapy can induce very early increase in QT dispersion and QTc prolongation. Leuk Res 2008; 32 : 998–999.
99. Naito K, Kobayashi M, Sahara N et al. Two cases of acute promyelocytic leukemia complicated by torsade de pointes during arsenic trioxide therapy. Int J Hematol 2006; 83 : 318–323.
100. Kishi S, Yoshida A, Yamauchi T et al. Torsade de pointes associated with hypokalemia after anthracycline treatment in a patient with acute lymphocytic leukemia. Int J Hematol 2000; 71 : 172–179.
101. Wortman JE, Lucas VS Jr, Schuster E et al. Sudden death during doxorubicin administration. Cancer 1979; 44 : 1588–1591.
102. Rixe O, Billemont B, Izzedine H. Hypertension as a predictive factor of Sunitinib activity. Ann Oncol 2007; 18 : 1117.
103. Hequet O, Le QH, Moullet I et al. Subclinical late cardiomyopathy after doxorubicin therapy for lymphoma in adults. J Clin Oncol 2004; 22 : 1864–1871.
104. Singal PK, Iliskovic N. Doxorubicin--induced cardiomyopathy. N Engl J Med 1998; 339 : 900–905.
105. Van Cutsem E, Hoff PM, Blum JL et al. Incidence of cardiotoxicity with the oral fluoropyrimidine capecitabine is typical of that reported with 5-fluorouracil. Ann Oncol 2002; 13 : 484–485.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2011 Číslo 5- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Magnosolv a jeho využití v neurologii
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Co přináší našim pacientům katetrizační ablace u fibrilace síní? – editorial
- Co způsobuje pokles úmrtnosti na ischemickou chorobu srdeční? – editorial
- Co způsobuje pokles úmrtnosti na ischemickou chorobu srdeční? – editorial
- Idiopatická retroperitoneální fibróza – editorial
- Porucha syntézy cholesterolu a jeho prekurzorů u klinicky závažných stavů
- Terapie kritické končetinové ischemie u pacientů se syndromem diabetické nohy pomocí autologních kmenových buněk
- Zlepšení kvality života po ablaci dlouhodobě perzistentní versus paroxysmální fibrilace síní: výsledky dvouletého sledování
- Změny krevních lipidů při dlouhodobé antiretrovirové léčbě
- Kardiotoxicita onkologické léčby
- Sorafenib v léčbě hepatocelulárního karcinomu
- Infekční komplikace u pacientů po srdeční zástavě při terapeutické hypotermii
- Snížení morbidity a mortality nemocných s chronickými formami ischemické choroby srdeční je výsledkem konzervativní léčby
- Faktory ovlivňující vznik a průběh kognitivních poruch u seniorů
- Sulodexid a nefrotický syndróm pri diabetickej nefropatii
- Ormondova choroba (idiopatická retroperitoneálna fibróza)
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Ormondova choroba (idiopatická retroperitoneálna fibróza)
- Kardiotoxicita onkologické léčby
- Faktory ovlivňující vznik a průběh kognitivních poruch u seniorů
- Porucha syntézy cholesterolu a jeho prekurzorů u klinicky závažných stavů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



