-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Osteoporóza pri chronickej obštrukčnej chorobe pľúc
Osteoporosis in chronic obstructive pulmonary disease
Patients with chronic obstructive pulmonary disease (COPD) are at increased risk of osteoporosis because of their age, limited physical activity, low body mass index, smoking, hypogonadism, malnutrition, and use of corticosteroids. Systemic inflammation represents an additional pathomechanism contributing to the development of osteoporosis in COPD patients. Males in their mid to late 60s with a smoking history of greater than 60 pack‑years have a prevalence rate of vertebral fractures similar to, and possibly greater than, postmenopausal women greater than or equal to 65 years old: in patients with severe COPD, up to 50 – 70% have osteoporosis or osteopenia, and up to 24 – 30% have compression vertebral fractures. Correlates of osteoporosis in COPD are mainly measures of body composition, disease severity and the use of corticosteroids, although causality has not been proven. Systemic corticosteroids remain the most common cause of drug‑related osteoporosis, and a meta‑analysis concluded that the use of more than 6.25 mg prednisone daily led to decreased bone mineral density (BMD) and increased fracture risk. In contrast, the effects of the long‑term use of inhaled corticosteroids on BMD remain debatable. Effects of treatment of osteoporosis have not been investigated in samples consisting of COPD patients only but the recommendations follow the general recommendations for the diagnosis and treatment of osteoporosis. Early recognition of BMD loss is essential, and assumes close interdisciplinary cooperation between respirologists and reumatologists. Longitudinal follow‑up to assess determinants of osteoporosis in COPD and randomised placebo ‑ controlled trials on the effects of treatment of osteoporosis in patients with COPD only are warranted. In the future, novel therapeutical strategies such as monoclonal antibodies against osteoclasts activators may prove their benefitial effects in the treatment of COPD‑related osteoporosis.
Key words:
osteoporosis – bone mineral density – chronic obstructive pulmonary disease – systemic inflammation – corticosteroids
Autoři: P. Pobeha 1; I. Lazúrová 2; R. Tkáčová 1
Působiště autorů: Klinika pneumológie a ftizeológie Lekárskej fakulty UPJŠ a FN L. Pasteura Košice, Slovenská republika, prednostka prof. MU Dr. Ružena Tkáčová, DrSc. 1; I. interná klinika Lekárskej fakulty UPJŠ a FN L. Pasteura Košice, Slovenská republika, prednostka prof. MU Dr. Ivica Lazúrová, Ph. D. 2
Vyšlo v časopise: Vnitř Lék 2010; 56(11): 1142-1149
Kategorie: Přehledné referáty
Souhrn
Pacienti s chronickou obštrukčnou chorobou pľúc (CHOCHP) majú vyššie riziko rozvoja osteoporózy v porovnaní s osobami bez pľúcneho postihnutia, a to v dôsledku zníženia fyzickej aktivity, nízkeho body mass indexu, fajčenia, hypogonadizmu, malnutrície a užívania systémových kortikosteroidov. Systémový zápal predstavuje významný aditívny patomechanizmus rozvoja osteoporózy u týchto chorých, ktorý je v súčasnosti predmetom extenzívneho výskumu. Muži starší ako 60 rokov s anamnézou fajčenia viac ako 60 balíčkorokov majú prevalenciu výskytu zlomenín stavcov podobnú, a podľa niektorých sledovaní dokonca vyššiu ako postmenopauzálne ženy staršie ako 65 rokov. Osteoporózu alebo osteopéniu možno diagnostikovať u 50 – 70 % pacientov s ťažkou CHOCHP, pričom 24 – 30 % má kompresívnu zlomeninu stavca. Osteoporóza koreluje u pacientov s CHOCHP s parametrami telesného zloženia, závažnosťou pľúcneho postihnutia a užívaním kortikosteroidov. Výsledky metaanalýzy ukázali, že užívanie viac ako 6,25 mg prednizonu denne vedie k poklesu kostnej denzity a zvýšenému riziku fraktúr. Naproti tomu vplyv užívania kortikosteroidov inhalačne na kostnú denzitu je diskutabilný. Zásady diagnostiky a liečby osteoporózy sú totožné so všeobecnými doporučeniami pre toto ochorenie, keďže vplyv jednotlivých liečebných stratégií nebol sledovaný selektívne u pacientov s CHOCHP. Kľúčovým faktorom je včasné rozpoznanie úbytku kostnej hmoty u pacientov s CHOCHP, ktoré vyžaduje úzku medziodborovú spoluprácu medzi pneumológmi a reumatológmi. Je potrebné uskutočniť longitudinálne štúdie zamerané na sledovanie patomechanizmov prispievajúcich k rozvoju osteoporózy u pacientov s CHOCHP a randomizované placebom kontrolované štúdie sledujúce vplyv liečby u tejto špecifickej skupiny chorých. V budúcnosti možno očakávať prínos vo farmakologickej liečbe osteoporózy používaním nových liečebných preparátov vrátane monoklonálnych protilátok proti aktivátorom osteoklastov.
Kľúčové slová:
osteoporóza – kostná denzita – chronická obštrukčná choroba pľúc – systémový zápal – kortikosteroidyÚvod
Chronická obštrukčná choroba pľúc (CHOCHP) je závažným chronickým pľúcnym ochorením vyvolaným prevažne fajčením. Svetová iniciatíva proti chronickej obštrukčnej chorobe pľúc (Global Initiative for Chronic Obstructive Lung Disease – GOLD) definuje chronickú obštrukčnú chorobu pľúc ako chronické respiračné preventabilné a liečiteľné ochorenie s niektorými signifikantnými extrapulmonálnymi prejavmi, ktoré môžu participovať na závažnosti choroby u individuálnych pacientov. Pľúcne postihnutie je charakterizované obštrukciou dýchacích ciest, ktorá nie je úplne reverzibilná. Obštrukcia dýchacích ciest vo väčšine prípadov progreduje a je podmienená abnormálnou zápalovou odpoveďou pľúc na prítomnosť škodlivých častíc a plynov vo vdychovanom vzduchu [1].
Liečba pacientov s CHOCHP sa primárne zameriava na zmiernenie respiračných symptómov a zlepšenie pľúcnych funkcií. Pacienti s CHOCHP sú však často postihnutí ďalšími ochoreniami, z ktorých sa dnes mnohé považujú za komplikácie základného pľúcneho ochorenia. Všeobecne uznávanými mimopľúcnymi účinkami CHOCHP sú chudnutie (kachexia), nutričné a metabolické abnormality a dysfunkcia kostrových svalov. Chorí s CHOCHP majú zvýšené riziko vzniku infarktu myokardu, angíny pectoris, osteoporózy, zlomenín kostí, respiračných infekcií, depresií, diabetu, porúch spánku a anémie [2]. Práve tieto komorbidity sú častou príčinou celkového zhoršovania zdravotného stavu, poklesu výkonnosti, zhoršenia kvality života a taktiež predčasného úmrtia pacientov s CHOCHP. Významnou systémovou komorbiditou pri CHOCHP je osteoporóza. Etiológia jej vzniku je pravdepodobne komplexná a viacero faktorov môže prispievať k patogenéze tohto procesu. Na vznik osteoporózy môžu vplývať ostatné systémové následky chronického zápalového pľúcneho ochorenia (znížená fyzická aktivita v dôsledku dýchavice, úbytok kostrového svalstva, zmeny telesného zloženia, systémový zápal), liečba pľúcneho ochorenia (užívanie kortikosteroidov) a tiež prirodzené zmeny v organizme súvisiace so starnutím (hypogonadizmus, úbytok svalovej hmoty, inaktivita).
Osteoporóza je systémové kostné ochorenie charakterizované mikroarchitektonickou redukciou kostného tkaniva vedúcou k zníženiu kostnej hmoty, zvýšenej lámavosti kostí, a teda aj zvýšenému riziku zlomenín [3]. Na stanovenie diagnózy môžu byť použité viaceré metódy, v súčasnosti sa však za štandard považuje vyšetrenie dvojenergiovou RTG absorpciometriou (dual energy X-ray absorptiometry – DXA) v oblasti driekovej chrbtice a proximálneho femuru. Jedná sa o presné, opakovateľné vyšetrenie, sprevádzané len veľmi nízkou dávkou žiarenia. Pre diagnostiku osteoporózy sa používa hodnota kostnej minerálnej hustoty (bone mineral density – BMD) a hodnoty Z-skóre a T-skóre. Z-skóre je násobok štandardnej odchýlky od priemeru BMD normálnej zdravej populácie rovnakého veku a pohlavia a T-skóre je násobok štandardnej odchýlky od priemeru BMD normálnej mladej zdravej populácie. Svetová zdravotnícka organizácia vytvorila diagnostické kritériá pre ženy v postmenopauze, u ktorých sa za fyziologické považujú hodnoty T-skóre ≥ –1. Osteopénia je definovaná ako T-skóre < –1 a > –2,5. Osteoporóza je diagnostikovaná pri hodnote BMD 2,5 štandardných odchýlok alebo viac pod hodnotu BMD normálnej mladej zdravej populácie, čiže T-skóre ≤ –2,5. Závažná alebo manifestná osteoporóza má kritérium T-skóre rovnaké, ale naviac prítomnosť aspoň 1 fraktúry. Tieto kritériá boli vytvorené pre postmenopauzálne ženy, ale sú rovnako použiteľné i u mužov [3,4].
Epidemiológia osteoporózy u pacientov s CHOCHP
Epidemiologické štúdie dokumentujú vysoký výskyt osteoporózy pri CHOCHP, pričom v priemere má 25–72 % pacientov osteopéniu a 36–60 % osteoporózu [5,6]. Graat-Verboom et al [7] analýzou doterajších štúdií u pacientov s CHOCHP dokumentovali prevalenciu osteoporózy od 9 do 69 %. Výskyt osteoporózy je signifikantne vyšší u pacientov s CHOCHP oproti zdravým jedincom (32,5 % oproti 11,4 %). Ako faktory determinujúce výskyt osteoporózy boli identifikované body mass index (BMI), fat-free mass index (FFMI) a pokles objemu úsilného výdychu za 1 sekundu (FEV1) [8]. Prevalencia osteoporózy u pacientov s CHOCHP významne stúpa so závažnosťou ochorenia a tiež s užívaním kortikosteroidov. Pacienti vyžadujúci systémové podávanie kortikosteroidov majú nižšie T-skóre a vyšší výskyt fraktúr ako pacienti s výlučne inhalačnou bronchodilatačnou liečbou [5].
Rizikové faktory a patogenetické mechanizmy rozvoja osteoporózy pri CHOCHP
Je pravdepodobné, že vznik osteoporózy u pacientov s CHOCHP je výsledkom vplyvu rôznych faktorov, akými sú rizikové faktory vplývajúce na pacienta počas jeho života, ďalej samotné ochorenie pľúc a taktiež vplyv liečby pľúcneho ochorenia [9] (tab. 1).
Tab. 1. Rizikové faktory vzniku osteoporózy u pacientov s CHOCHP. 
Fajčenie a iné faktory životosprávy
Fajčenie je známy faktor prispievajúci k úbytku kostnej hmoty u mužov aj žien. Riziko vzniku osteoporózy stavcov je vyššie u mužov fajčiarov ako u nefajčiarov a zvyšuje sa s počtom vyfajčených cigariet za deň [10]. U fajčiarov s počtom vyfajčených krabičiek viac ako 2 za deň bola strata kostnej hmoty vyššia v porovnaní s fajčiarmi menšieho počtu cigariet [11]. Fajčiari majú zvýšené riziko zlomenín stavcov aj krčka bedrovej kosti. Mechanizmus vplyvu fajčenia na úbytok kostnej hmoty nie je celkom jasný. Niektorí autori poukazujú na nižšie hladiny estrogénu u žien fajčiarok a tiež na zníženú absorpciu vápnika v gastrointestinálnom trakte fajčiarov oproti nefajčiarom [12].
Ďalším nezávislým faktorom prispievajúcim k osteoporóze je užívanie alkoholu vo zvýšenej miere. Slemenda et al [11] dokázali najvyšší úbytok kostnej hmoty práve u pacientov s abúzom alkoholu a cigariet. Vplyv faktorov životného štýlu v ranej dospelosti môže vysvetľovať rozdiely v rizikách vzniku komplikácií závažnej osteoporózy pri expozícii ďalším rizikovým faktorom, napr. liečbou kortikosteroidmi v strednom veku a séniu.
Nedostatok vitamínu D
Vitamín D má dôležitú úlohu v normálnej mineralizácii kostnej hmoty, reguluje absorpciu kalcia, sekréciu parathormónu a rezorpciu kostí. Jeho nedostatok, ktorý môže viesť k poklesu mineralizácie kostí, sa javí ako faktor prispievajúci k úbytku kostnej hmoty asociovanému s CHOCHP. Riancho et al [13] zaznamenali signifikantný pokles hladín 25-hydroxyvitamínu D v skupine mužských pacientov s CHOCHP, pričom hladina 25-hydroxyvitamínu D korelovala s dĺžkou expozície na slnku. V inej skupine pacientov s veľmi ťažkou CHOCHP spĺňajúcich indikačné kritériá na transplantáciu pľúc malo 35 % pacientov významne zníženú hladinu tohto vitamínu. Dá sa predpokladať, že nedostatok vitamínu Dje u pacientov s ťažkou a veľmi ťažkou CHOCHP spôsobený poruchami výživy ako aj kratším pobytom na slnku v dôsledku zníženia funkčného stavu.
Liečba systémovými a inhalačnými kortikosteroidmi
Liečba inhalačnými kortikosteroidmi je u pacientov s CHOCHP podávaná za účelom zmiernenia bronchiálnej obštrukcie, a tým aj zmiernenia symptómov ochorenia, predovšetkým dýchavice. Dlhodobé podávanie orálnych alebo parenterálnych kortikosteroidov nie je pri liečbe CHOCHP odporúčané pre vysoký výskyt nežiadúcich účinkov ako aj pre zvýšené riziko mortality. Systémové podanie kortikosteroidov sa odporúča len v krátkodobom režime pri exacerbáciách CHOCHP [1]. Dlhodobé užívanie perorálnych kortikosteroidov je známou príčinou vzniku osteoporózy. Kortikosteroidy znižujú absorpciu kalcia v črevách, zvyšujú jeho renálnu exkréciu a stimulujú rezorpciu kostí. Okrem toho znižujú aj novotvorbu kostí priamou inhibíciou osteoblastov, ako aj sekundárne v dôsledku hypogonadizmu asociovanému s nadbytkom kortikosteroidov [14]. Inhibícia kostnej formácie bola dokázaná na základe histomorfometrickej analýzy bioptických vzoriek a poklesu cirkulujúcich hladín osteokalcínu, biochemického markeru kostnej formácie. Pacienti s CHOCHP však perorálne, prípadne parenterálne kortikosteroidy užívajú len prechodne v období exacerbácií, nie v kľudovej fáze ochorenia. V rámci liečby sú však vystavení vplyvu inhalačných kortikosteroidov, ktoré boli v minulosti považované za možnú príčinu úbytku kostnej hmoty [15], viaceré súčasné analýzy však dokumentovali bezpečnosť podávania inhalačných kortikosteroidov [16,17]. Multicentrická dvojito slepá randomizovaná placebom kontrolovaná štúdia u pacientov s ľahkou CHOCHP nepreukázala významný vplyv inhalačného kortikosteroidu budesonidu na hustotu kostí oproti placebu [16].
V inej práci de Vries et al dokumentovali, že užívanie inhalačných kortikosteroidov nepredstavovalo u pacientov s CHOCHP zvýšené riziko zlomenín [17]. Rovnako analýza vypracovaná použitím Cochranovej databázy so zameraním na riziko fraktúr pri používaní inhalačných kortikosteroidov nedokumentovala vplyv tejto liečby na riziko fraktúr [18]. Naproti tomu negatívny vplyv systémového užívania kortikosteroidov na kostnú denzitu je nespochybniteľný. Avšak napriek rozpoznanému vplyvu perorálnych kortikosteroidov na kostnú hustotu nemožno vysokú prevalenciu osteoporózy u pacientov s CHOCHP vysvetliť len ich užívaním, pretože vyššiu prevalenciu osteoporózy a nižšie sérové hladiny osteokalcínu majú aj tí chorí, ktorí systémové kortikosteroidy nikdy neužívali [5].
Úbytok svalovej hmoty a sily
Pacienti s ťažkou a veľmi ťažkou CHOCHPpociťujú výrazný pokles funkčného stavu a pohyblivosti. K poklesu pohyblivosti prispieva dýchavica, myopatia spôsobená liečbou kortikosteroidmi, úbytok svalovej hmoty a sily ako i metabolické faktory, ktoré takto tvoria bludný kruh [19]. Primeraná fyzická aktivita je nevyhnutná pre udržanie kostnej hmoty. Pokles aktivity zvyšuje riziko vzniku osteoporózy, pádov a zlomenín i u pacientov s CHOCHP [6]. Výskum by sa v budúcnosti mal zamerať na otázku, či tréning určitých skupín kostrových svalov u pacientov s CHOCHP môže ovplyvniť ako svalovú silu a hmotu, tak aj hustotu kostí.
Kachexia a zmeny telesného zloženia
Staršie definície popisovali kachexiu ako patologický stav charakterizovaný stratou telesnej hmotnosti, anorexiou, prítomnou anémiou a asténiou. Novšia definícia uvádza, že kachexia je komplexný metabolický syndróm podmienený sprevádzajúcim ochorením a charakterizovaný úbytkom svalovej hmoty s prítomnosťou alebo neprítomnosťou úbytku tukového tkaniva [20]. V patogenéze kachexie sa uplatňuje predovšetkým negatívna energetická bilancia a katabolizmus bielkovín svalstva. Parametre body mass index (BMI) a fat free mass (FFM) charakterizujú dva kľúčové prejavy kachektického syndrómu – pokles telesnej hmotnosti a úbytok svalovej hmoty. Hustota kostí priamo koreluje s BMI [8]. Muži aj ženy s vyšším BMI majú vyššiu hustotu kostí. Tento fenomén sa dá čiastočne vysvetliť efektom vyššej záťaže vyvíjanej na kosť vplyvom vyššej hmotnosti. Okrem toho hladina estrogénu býva u obéznych osôb vyššia, čo je spôsobené zvýšenou aromatizáciou testosterónu na estrogén v tukovom tkanive. Zvýšená hladina estradiolu by tak mohla prispievať k vyššej BMD u obéznych osôb. Strata hmotnosti a nízky BMI sú prediktormi mortality u pacientov s CHOCHP [21] a strata FFM pri CHOCHP je asociovaná s zvýšeným počtom exacerbácií a hospitalizácií. Iqbal et al [5] ukázali, že u pacientov s chronickým pľúcnym ochorením sú BMI i FFM silnými prediktormi osteoporózy. V inej štúdii mali pacienti s CHOCHP zaradení do rehabilitačného programu nižšie hodnoty FFM aj kostnú hustotu ako kontrolná skupina zdravých osôb rovnakého veku a BMI [22]. Tieto údaje naznačujú, že kachexia doprevádzaná stratou hmotnosti a úbytkom prevažne beztukovej hmoty významne prispievajú k strate hustoty kostí u pacientov s CHOCHP.
Poruchy acidobázickej rovnováhy
Významnou poruchou acidobázickej rovnováhy je metabolická acidóza. Je charakterizovaná poklesom hladiny plazmatického bikarbonátu a je výsledkom nadprodukcie organických kyselín (napr. ketoacidóza), narušením renálnej exkrécie kyselín (zlyhanie obličiek) alebo straty báz (hnačka). Metabolická acidóza významne ovplyvňuje metabolizmus vápnika a fosfátov navodením negatívnej bilancie vápnika (rezorbciou z kostí) s hyperkalciúriou a sklonom k tvorbe obličkových kameňov. Hyperkalciúria je výsledkom zvýšenia filtrácie a poklesu tubulárnej rezorbcie vápnika. Negatívna bilancia vápnika a nedostatok fosfátov indukuje metabolické kostné ochorenie vykazujúce znaky osteoporózy aj osteomalácie. Okrem toho metabolická acidóza ovplyvňuje metabolizmus proteínov znížením syntézy a akceleráciou proteolýzy a oxidácie aminokyselín [23]. Jednou z príčin vzniku metabolickej acidózy môže byť aj stravovanie: strava bohatá na živočíšne bielkoviny sa považuje za možnú príčinu celoživotnej chronickej miernej metabolickej acidózy spojenej so sekundárnym kostným katabolizmom. Tá je zodpovedná za zvýšenú endogénnu tvorbu kyselín v dôsledku vystupňovanej oxidácie aminokyselín [24]. Je však potrebné zdôrazniť, že u pacientov s CHOCHP nebol doteraz sledovaný vplyv acidobázickej rovnováhy na vznik osteoporózy. Možnou príčinou je skutočnosť, že pokles pH sa u pacientov s CHOCHP spravidla vyskytuje len vo veľmi pokročilých štádiách ochorenia, a to v čase dekompenzácie respiračnej insuficiencie s následným rozvojom respiračnej acidózy.
Hypogonadizmus a iné endokrinné poruchy
Hypogonadizmus a nedostatok pohlavných hormónov patria k ďalším faktorom prispievajúcim k rozvoju osteoporózy. Nedostatok estrogénu u žien zvyšuje úbytok kostí po menopauze. U dospelých mužov bol taktiež dokázaný vzťah medzi poklesom cirkulujúcich koncentrácií estrogénu a redukciou kostnej hmoty [25]. Estrogén reguluje kostnú resorpciu aj tvorbu kostí, zatiaľ čo testosterón reguluje iba novotvorbu kostí. Plazmatické hladiny pohlavných hormónov sú ovplyvňované vekom, chronickými ochoreniami, ale aj liečbou kortikosteroidmi. Štúdie vplyvu orálnych kortikosteroidov na zdravých mladých mužov dokázali významný pokles plazmatických hladín testosterónu. Rovnako u mužských pacientov so závažnou CHOCHP užívajúcich perorálne kortikosteroidy boli hladiny voľného testosterónu v plazme znížené [26]. Porovnaním v skupinách pacientov s CHOCHP a zdravých jedincov bolo zistené, že pacienti s CHOCHP majú signifikantne nižšie plazmatické hladiny celkového i voľného testosterónu ako zdraví jedinci [27]. Hladiny folikulostimulačného hormónu (FSH) a luteinizačného hormónu (LH) boli u týchto pacientov zvýšené, čo naznačuje aktiváciu kompenzačného mechanizmu hypotalamo-hypofyzárnej osi pri poklese hladiny testosterónu. Ďalšia skupina hormónov s potenciálnou úlohou v patogenéze osteoporózy sú inzulínový rastový faktor (IGF-1), jeho tkanivové ligandy a väzbové proteíny [28], ktoré stimulujú diferenciáciu a proliferáciu osteoblastov. Ich koncentrácie v kostiach klesajú s vekom. Počas hladovania a katabolizmu dochádza k poklesu expresie génu pre IGF-1. Niektorí autori predpokladajú, že down regulácia expresie mRNA pre IGF-1 je asociovaná so svalovou atrofiou u niektorých pacientov s CHOCHP [29]. U starších ľudí s fraktúrami krčka bedrovej kosti a nízkou hustotou kostí boli dokázané nízke sérové hladiny IGF-1. Tieto výsledky naznačujú, že IGF-1 môže ovplyvňovať hustotu kostí priamo alebo nepriamo cestou podpory tvorby a udržania kostrového svalstva.
Systémový zápal
CHOCHP je sprevádzaná zápalovou reakciou dýchacích ciest. Fyziologická zápalová odpoveď ako obrana voči inhalovanému cigaretovému dymu a škodlivým časticiam sa pri tomto ochorení mení na patologickú a v konečnom dôsledku spôsobuje deštrukciu pľúcneho parenchýmu s následným rozvojom emfyzému so sprievodnou poruchou reparačných a obranných mechanizmov s rozvojom fibrózy na úrovni malých bronchov. Široké spektrum zápalových mediátorov v pľúcnom tkanive priťahuje zápalové bunky z cirkulácie (chemotaktické faktory), zosilňuje zápalové procesy (prozápalové cytokíny) a vyvoláva štrukturálne zmeny (rastové faktory) [30]. Sledovania v minulých rokoch ukázali, že u pacientov s CHOCHP sú známky zápalovej aktivity prítomné nielen lokálne v dýchacom systéme, ale aj v cirkulácii. Počas stabilnej fázy CHOCHP bol popísaný vzostup viacerých cirkulujúcich zápalových proteínov, napr. C reaktívneho proteínu (CRP), tumor nekrotizujúceho faktora α (TNF-α), interleukínov 6 a 8 (IL-6 a IL-8) a intracelulárnych signálnych polypeptidov produkovaných aktivovanými zápalovými bunkami. Exacerbácie CHOCHP vedú k potenciácii zápalových procesov a k zosilneniu systémovej zápalovej odpovede, čo dokumentujú zvýšené hladiny sérových proteínov akútnej fázy, ako sú α1-antitrypsín a CRP. Z týchto zápalových proteínov je to práve TNF-α a IL-6, ktorým je pripisovaná potenciálne dôležitá úloha v patogenéze systémových dôsledkov CHOCHP. TNF-α a IL-6 sú napr. zvýšene exprimované v sére u pacientov s CHOCHP a poruchou metabolizmu cukrov a inzulínovou rezistenciou [31].
Vzťah systémového zápalu k rozvoju osteoporózy bol popísaný pri viacerých systémových ochoreniach. Osteoporóza je často asociovaná s mnohými zápalovými ochoreniami, napr. reumatoidnou artritídou, zápalovými ochoreniami čreva či niektorými nádorovými ochoreniami [32]. Sabit et al [33] poukázali na vzťah medzi závažnosťou bronchiálnej obštrukcie, osteoporózou a sérovými hladinami IL-6 u pacientov s CHOCHP. Molekulárne mechanizmy účinku jednotlivých zápalových cytokínov v kostnom tkanive sú rozmanité. IL-6 stimuluje diferenciáciu a aktiváciu osteoklastov, pričom IL-1 je tiež silným stimulátorom kostnej resorpcie. Jedným z najvýznamnejších cytokínov ovplyvňujúcich proces rozvoja osteoporózy sa zdá byť TNF-α. TNF-α je asociovaný s množstvom ďalších molekúl, solubilných aj membránových receptorov vytvárajúcich takzvanú TNF receptorovú superrodinu, v rámci ktorej sa v procese prestavby kostí uplatňujú predovšetkým nasledujúce proteíny: ligand receptorového aktivátora NF-κ B (RANKL), receptorový aktivátor NF-κ B (RANK) a osteoprotegerín (OPG). RANK je membránový receptor z rodiny TNF nachádzajúci sa na prekurzoroch osteoklastov. RANKL je ligand receptora, pričom je tvorený osteoblastami a stromálnymi bunkami. Naviazaním RANKL na RANK na prekurzoroch osteoklastov dochádza k aktivácii signálnej transdukčnej kaskády vedúcej k diferenciácii osteoklastických prekurzorov na zrelé osteoklasty. OPG funguje ako solubilný falošný receptor, ktorý vyviazaním RANKL inhibuje jeho väzbu s RANK, a tým inhibuje osteoklastogenézu. OPG pôsobí teda ako významný ochranný faktor kostnej štruktúry a denzity. Systémový zápal, a to predovšetkým cytokíny IL-1, IL-11 a TNF-α, ako aj parathormón (PTH), 1,25-dihydroxyvitamín D3 a tiež glukokortikosteroidy ovplyvňujú rovnováhu systému RANK-RANKL-OPG, a tým aj resorpciu kostí [32] (obr. 1).
Obr. 1. Aktivácia signálnej transdukčnej cesty väzbou RANKL na RANK a jej inhibícia sprostredkovaná OPG. 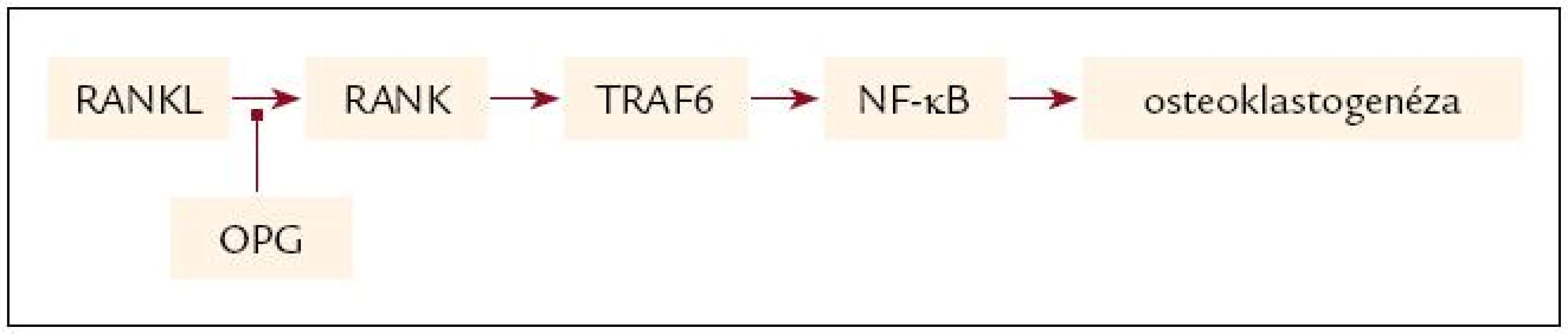
NFκB – nuclear factor κ B, RANKL – receptor activator of NF- κ B ligand (ligand receptorového aktivátora NF-κ B), RANK – receptor activator of NF-&kappa B (receptorový aktivátor NF-&kappa B), OPG – osteoprotegerín, TRAF 6 – tumor necrosis factor receptor‑associated factor 6 (faktor 6 asociovaný s tumor nekrotizujúcim faktorom) Prevencia a liečba osteoporózy u pacientov s CHOCHP
Diagnostika a liečba osteoporózy je vo vnútornom lekárstve v kompetencii reumatológa a u pacientov s pľúcnymi ochoreniami vyžaduje medziodborovú spoluprácu. Prevencia rozvoja osteoporózy u pacientov s CHOCHP závisí na uvedomení si rozsahu problému. V súčasnosti sa nekladie dostatočný dôraz na skríning a preventívnu liečbu osteoporózy, pretože pacienti bývajú často asymptomatickí až do okamihu vzniku zlomenín. K zabráneniu vzniku fraktúr sú nevyhnutné skoré rozpoznanie osteoporózy a prijatie potrebných preventívnych opatrení. Tieto opatrenia by mali byť realizované u všetkých pacientov užívajúcich dlhodobo inhalačné alebo perorálne kortikosteroidy. Niektorí autori navrhujú, aby všetci pacienti s CHOCHP boli skrínovaní na prítomnosť osteoporózy meraním kostnej hustoty štandardnou metódou DXA [5]. Existujú dôkazy podporujúce tieto odporúčania. Prevalencia osteoporózy u mužov a žien s CHOCHP, bez ohľadu na liečbu, je podobná ako u postmenopauzálnych žien. Ak takmer polovica pacientov môže mať zníženú kostnú hustotu, potom skríning všetkých pacientov pre rozpoznanie chorých s vysokým rizikom fraktúr by mal byť indikovaný. Napriek nedostatku intervenčných randomizovaných štúdií týkajúcich sa liečby osteoporózy u pacientov s CHOCHP je možné viaceré prístupy a odporúčania prevziať zo smerníc upravujúcich diagnostické a liečebné postupy pri osteoporóze vzniknutej v súvislosti s liečbou kortikosteroidmi a/alebo postmenopauzálnej osteoporóze.
Nefarmakologická liečba
Medzi nefarmakologické liečebné modality patrí fyzikálna terapia, ktorá je prínosom v prevencii pádov a zlomenín. Pacienti s CHOCHP majú spravidla nižšiu fyzickú aktivitu v dôsledku úbytku svalovej hmoty a sily. Fyzikálna liečba má byť preto zameraná na zvýšenie výdrže, svalovej sily a zlepšenie rovnováhy, čo prinesie nielen zlepšenie kvality života a funkčného stavu pacientov, ale tiež zníženie rizika pádov a následných zlomenín. Medzi ďalšie aspekty nefarmakologickej liečby patrí dostatočná výživa a prevencia straty hmotnosti, zanechanie fajčenia a pravidelná expozícia slnečnému žiareniu [34].
Farmakologická liečba
Medikamentózna liečba je indikovaná vo všeobecnosti pacientom s osteoporózou, verifikovanou predovšetkým poklesom kostnej denzity v osovom skelete pod hodnoty –2,5 T-skóre alebo u osôb s dokázanou osteoporotickou fraktúrou. Takáto liečba má byť individualizovaná podľa stavu pacienta a v prípade sekundárnej osteoporózy zahŕňa aj liečbu a odstránenie známych príčin [35].
Kalcium a vitamín D. Nedávna metaanalýza viacerých štúdií preukázala prospešnosť náhrady kalcia a vitamínu D u pacientov užívajúcich dlhodobo kortikosteroidy [36]. Pokiaľ nie je u pacienta prítomná kontraindikácia (napr. hyperkalciúria), potom pridávame obvykle 1 000–1 500 mg kalcia per os denne. Druhou súčasťou liečby je vitamín D, ktorého doporučená denná dávka je 800 IU. Kombinácia s vitamínom A nie je vhodná, pretože vitamín A stimuluje aktivitu osteoklastov. Suplementácia kalcia a vitamínu Dje trvalá [37]. Podávanie kalcia a vitamínu D inhibuje sekréciu parathormónu a mierne stimuluje endogénnu sekréciu kalcitonínu a spolu s príjmom aspoň 1g proteínov/kg hmotnosti je odporúčané vo všeobecnom manažmente pacientov s osteoporózou [38].
Hormonálna substitučná terapia. Hormonálna substitučná terapia (HRT – hormone replacement therapy) estrogénmi bola v minulosti využívaná v liečbe postmenopauzálnej osteoporózy. Hlavnou účinnou zložkou v preparátoch HRT je 17β-estradiol, ktorý má pozitívny efekt nielen na aktivitu kostných buniek, ale aj na tlmenie menopauzálnych príznakov. Jeho nevýhodou je stimulačný vplyv na endometrium, pocit napätia v prsníkoch, zvýšenie telesnej hmotnosti a zvýšené riziko tromboembolickej choroby. K ďalším nežiadúcim účinkom hormonálnych preparátov patria zvýšené riziko náhlych cievnych mozgových príhod a vzostup rizika karcinómu prsníka. Vzhľadom na uvedené riziká nežiadúcich účinkov HRT nie je v súčasnosti táto liečba indikovaná na prevenciu a liečbu postmenopauzálnej osteoporózy. Indikáciou na začatie liečby HRT je komplexný klimakterický syndróm, pričom prevencia osteoporózy je významným aditívnym účinkom tejto liečby [37]. Mnohé z nevýhod HRT odstraňujú prípravky typu SERM (selektívne modulátory estrogénových receptorov). Sú to nesteroidné chemicky štruktúrované preparáty viazané na estrogénové receptory, ktoré fungujú ako estrogénové agonisty alebo antagonisty v závislosti od cieľového tkaniva, kde pôsobia. Ich selektivita je daná tým, že žiadúcim spôsobom ovplyvňujú receptory pre estrogén v kostnom tkanive, pritom nestimulujú endometrium a naviac preukázateľne znižujú riziko karcinómu prsníka. Ich nevýhodou je zvýšenie rizika tromboembolickej choroby. Z tejto skupiny je jediný používaný prípravok raloxifén, ktorého užívanie vedie k zníženiu straty kostnej hmoty a rizika zlomenín stavcov o 30–50 %.
Kalcitonín. Kalcitonín je hormón produkovaný C-bunkami štítnej žľazy, ktorý ma výrazný inhibičný vplyv na osteoklasty. Lososí kalcitonín má 40–50-krát vyššiu účinnosť ako ľudský. V klinickej praxi môže byť aplikovaný vo forme injekcie alebo ako nosový sprej o dávke 200 IU. Je dokázaný jeho efekt na zvýšenie kostnej denzity, znižuje hyperkalcémiu a má tiež silný analgetický efekt vyvolaný centrálnou stimuláciou endorfínového systému. Súčasne s kalcitonínom je nevyhnutné suplementovať kalcium, čo má okrem podpory novotvorby kosti brániť potenciálnej stimulácii príštítnych teliesok hypokalcemickým efektom kalcitonínu.
Bisfosfonáty. Bisfosfonáty patria v súčasnosti k najviac používaným preparátom v liečbe nielen postmenopauzálnej, ale aj kortikosteroidmi indukovanej osteoporózy. Jedná sa o metabolicky stabilné analógy kyseliny pyrofosfátovej s afinitou k hydroxyapatitu v kostnom tkanive, kde inhibujú činnosť osteoklastov, a tým aj resorpciu kostí [39]. Ich mechanizmus účinku je komplexný. Po naviazaní na kostnú štruktúru sa počas kostnej rezorpcie uvoľňujú a akumulujú v osteoklastoch. V nich interferujú s viacerými biochemickými procesmi, čo vedie k strate viacerých funkcií osteoklastov – od schopnosti adherovať na povrch kostí, cez stratu funkčnosti bunkovej membrány až po deštrukciu cytoskeletu. Na molekulárnej úrovni majú dvojaký účinok. Slabšie preparáty etidronát a klodronát inhibujú ATP-dependentné intracelulárne procesy. Účinnejšie preparáty alendronát a risendronát inhibujú enzýmy mevalonátovej cesty a blokujú syntézu pre bunky esenciálnych isoprenoidov, čo vedie k apoptóze osteoklastov. Jednotlivé preparáty sa líšia nielen dávkovaním a frekvenciou podávania, ale aj účinnosťou a spektrom nežiadúcich účinkov. Medzi dnes najčastejšie používané preparáty patria alendronát a ibandronát. Alendronát sa podáva perorálne, ibandronát aj v intravenóznej forme. Klinický výskum vplyvu na rast kostnej denzity dokázal, že účinnosť týždenných orálnych dávkovacích režimov s alendronátom 70 mg, risendronátom 35 mg a tiež orálnym ibandronátom 150 mg raz mesačne je rovnaká alebo dokonca vyššia ako pri denných dávkovacích režimoch. Zaujímavým preparátom je zoledronát, najnovší z bisfosfonátov. Pôvodne bol vyvinutý k liečbe hyperkalcémie a postihnutia kostí u malígnych ochorení, ale dokázaný je aj jeho vplyv na zvýšenie kostnej denzity nielen u postmenopauzálnych osteoporotických žien, ale aj u mužov s osteoporózou [40]. Jeho výhodou by malo byť podávanie raz ročne intravenózne v dávke 4 mg. Etidronát je slabý bisfosfonát, ktorého použitie nepatrí do prvej línie liečby v európskych krajinách. Relatívne nízku účinnosť má aj klodronát, ktorý sa využíva skôr pri nádorových ochoreniach kostí sprevádzaných zvýšenou rezorpciou kostí. Orálne bisfosfonáty majú v porovnaní so systémovo podávanými bifosfonátmi nižšiu biologickú dostupnosť, pričom ich maximálne dávkovanie je limitované rizikom rozvoja gastrointestinálnych ťažkostí. Výhodou intravenózne podávaných bisfosfonátov ibandronátu a zoledronátu je teda ich predĺžená účinnosť a dlhšie dávkovacie intervaly; nevýhodou je vyššia cena, pričom ich podanie je niekedy sprevádzané chrípke podobnými symptómami [41].
Peptidy z rodiny parathormónu. Kontinuálne zvýšená endogénna tvorba PTH má pri sekundárnom hyperparatyroidizme zhubný vplyv na kortikálnu kosť. Naopak intermitentné podávanie PTH (napr. denná subkutánna aplikácia) má osteostimulačný efekt, vedie k vzostupu počtu osteoblastov, kostnej hmoty a zlepšeniu architektoniky kortikálnej aj spongióznej kosti. PTH a jeho N terminálny fragment (teriparatid) sú používané v manažmente osteoporózy. Odporúčané dávky sú 20 μg teriparatidu alebo 100 μg PTH aplikované denne subkutánne po dobu 18–24 mesiacov. Účinok v prevencii zlomenín pretrváva až 30 mesiacov po skončení liečby. Medzi najčastejšie nežiaduce účinky patria nauzea, bolesť končatín, nevoľnosť a bolesť hlavy. U pacientov k anamnézou urolitiázy musia byť podávané obozretne, pretože môžu zhoršiť ochorenie. Kontraindikáciou podávania sú preexistujúca hyperkalcémia, metabolické kostné ochorenia vrátane hyperparatyroidizmu a Pagetovej choroby, nevysvetlené zvýšenie alkalickej fosfatázy a kostné malignity vrátane kostných metastáz.
Stroncium ranelát. Stroncium ranelát je nedávno registrovaný preparát s obsahom solí stroncia, ktorý vykazuje duálny mechanizmus účinku [39,42]. Má antiresorpčné aj osteosteostimulačné vlastnosti. Jeho účinnosť v prevencii fraktúr stavcov aj dlhých kostí bola preukázaná predovšetkým u postmenopauzálnej osteoporózy a je porovnateľná s účinnosťou orálnych bisfosfonátov. Odporúčaná denná perorálna dávka je 2g v práškovej forme aspoň 2 hod po poslednom jedle. Nie je odporúčaný u pacientov so závažným postihnutím obličiek. Nežiadúce účinky sú zriedkavé, najčastejšia je nauzea, hnačka a bol popisovaný zvýšený výskyt venózneho tromboembolizmu.
Nové možnosti liečby – anti RANKL protilátky. Denosumab je ľudská monoklonálna protilátka proti RANKL, členovi TNF receptorovej superrodiny, ktorý je hlavným mediátorom aktivácie a diferenciácie osteoklastov, a teda aj kostnej resorpcie. Posledné fázy klinického skúšania ukazujú, že bezpečnostný profil denosumabu je porovnateľný s profilom bisfosfonátov, pričom denosumab môže byť rovnako účinný, alebo dokonca účinnejší ako bisfosfonáty v prevencii straty kostnej hmoty. Preto je možné očakávať, že v budúcnosti sa denosumab stane sľubným preparátom v prevencii a liečbe osteoporózy [43].
Záver
Záverom možno skonštatovať, že osteoporóza je významnou komorbiditou u pacientov s CHOCHP. Jej asymptomatický priebeh vedie k jej neskorému rozpoznaniu, a to často až po objavení sa komplikácií vo forme fraktúr. Popri známych rizikových faktoroch rozvoja osteoporózy zohráva u pacientov s CHOCHP významnú patogenetickú úlohu systémový zápal. Zásady diagnostiky a liečby osteoporózy sú totožné so všeobecnými smernicami pre osteoporózu. Kľúčovým faktorom je včasné rozpoznanie úbytku kostnej hmoty u pacientov s CHOCHP, ktoré vyžaduje úzku medziodborovú spoluprácu medzi pneumológmi a reumatológmi. V budúcnosti možno očakávať prínos vo farmakologickej liečbe osteoporózy používaním nových liečebných preparátov – monoklonálnych protilátok proti aktivátorom osteoklastov, ktoré sú v súčasnosti v štádiu klinických skúšaní.
Poďakovanie
Táto publikácia bola vytvorená realizáciou projektu „Centrum excelentnosti pre výskum aterosklerózy a jej komplikácií – srdcového a mozgového infarktu (CEVA)“, na základe podpory operačného programu Výskum a vývoj financovaného z Európskeho fondu regionálneho rozvoja (005/2009/2.1/OPR&D).
prof. MU Dr. Ružena Tkáčová, DrSc.
www.fnlp.sk
e-mail: ruzena.tkacova@upjs.sk
Zdroje
1. Global Initiative for Chronic Obstructive Lung Disease. Global strategy for the diagnosis management and prevention of COPD [on‑line]. Updated 2008; accessed 2010 Mar 12. Available from: http:/ / www.goldcopd.org.
2. van Weel C, Schellevis FG. Comorbidity and guidelines: conflicting interests. Lancet 2006; 367 : 550 – 551.
3. WHO Scientific Group on the Prevention and management of Osteoporosis. Prevention an Management of Osteoporosis: report of a WHO scientific group. Geneva 2003. Date last accessed: June 10, 2010. Available from: http:/ / whqlibdoc.who.int/ trs/ WHO_TRS_921.pdf.
4. Legrand E, Chappard D, Pascaretti C et al. Bone mineral density and vertebral fractures in men. Osteoporos Int 1999; 10 : 265 – 270.
5. Iqbal F, Michaelson J, Thaler L et al. Declining bone mass in men with chronic pulmonary disease: contribution of glucocorticoid treatment, body mass index, and gonadal function. Chest 1999; 116 : 1616 – 1624.
6. Incalzi RA, Caradonna P, Ranieri P et al. Correlates of osteoporosis in chronic obstructive pulmonary disease. Respir Med 2000; 94 : 1079 – 7084.
7. Graat - Verboom L, Wouters EF, Smeenk FW et al. Current status of research on osteoporosis in COPD: a systematic review. Eur Respir J 2009; 34 : 209 – 218.
8. Vrieze A, de Greef MH, Wijkstra PJ et al. Low bone mineral density in COPD patients related to worse lung function, low weight and decreased fat‑free mass. Osteoporos Int 2007; 18 : 1197 – 1202.
9. Ionescu AA, Schoon E. Osteoporosis in chronic obstructive pulmonary disease. Eur Respir J 2003; 46 : 64s – 75s.
10. Seeman E, Melton LJ 3rd, O’Fallon WM et al. Risk factors for spinal osteoporosis in men. Am J Med 1983; 75 : 977 – 983.
11. Slemenda CW, Christian JC, Reed T et al. Long‑term bone loss in men: effects of genetic and environmental factors. Ann Intern Med 1992; 117 : 286 – 291.
12. Seeman E. The effects of tobacco and alcohol use on bone. In: Marcus R, Feldman D, Kelsey J (eds). Osteoporosis. New York: Academy press 1996 : 577 – 597.
13. Riancho JA, González - Macías J, Del Arco C et al. Vertebral compression fractures and mineral metabolism in chronic obstructive lung disease. Thorax 1987; 42 : 962 – 966.
14. Canalis E. Clinical review 83: Mechanisms of glucocorticoid action in bone: implications to glucocorticoid‑induced osteoporosis. J Clin Endocrinol Metab 1996; 81 : 2441 – 3447.
15. Scanlon PD, Connett JE, Wise RA et al. Loss of bone density with inhaled triamcinolone in Lung Health Study II. Am J Respir Crit Care Med 2004; 170 : 1302 – 1309.
16. Pauwels RA, Löfdahl CG, Laitinen LA et al. Long‑term treatment with inhaled budesonide in persons with mild chronic obstructive pulmonary disease who continue smoking. N Engl J Med 1999; 340 : 1948 – 1953.
17. de Vries F, Pouwels S, Lammers JW et al. Use of inhaled and oral glucocorticoids, severity of inflammatory disease and risk of hip/ femur fracture: a population‑based case - control study. J Intern Med 2007; 261 : 170 – 177.
18. Yang IA, Fong KM, Sim EH et al. Inhaled corticosteroids for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2007; 2: CD002991.
19. American Thoracic Society and European Thoracic Society. Skeletal muscle dysfunction in chronic obstructive disease. Am J Respir Crit Care Med 1999; 159 (Suppl 4): S1 – S40.
20. Evans WJ, Morley JE, Argilés J et al. Cachexia: a new definition. Clin Nutr 2008; 27 : 793 – 799.
21. Wouters EF, Creutzberg EC, Schols AM. Systemic effects in COPD. Chest 2002; 121 (Suppl 5): 127S – 130S.
22. Engelen MP, Schols AM, Heidendal GA et al. Dual - energy X‑ray absorptiometry in the clinical evaluation of body composition and bone mineral density in patients with chronic obstructive pulmonary disease. Am J Clin Nutr 1998; 68 : 1298 – 1303.
23. Wiederkehr M, Krapf R. Metabolic and endocrine effects of metabolic acidosis in humans. Swiss Med Wkly 2001; 131 : 127 – 132.
24. Wynn E, Krieg M, Lanham - New SA et al. Postgraduate symposium: positive influence of nutritional alkalinity on bone health. Proc Nutr Soc 2010; 69 : 166 – 173.
25. Szulc P, Munoz F, Claustrat B et al. Bioavailable estradiol may be an important determinant of osteoporosis in men: the MINOS study. J Clin Endocrinol Metab 2001; 86 : 192 – 199.
26. Pearce G, Tabensky DA, Delmas PD et al. Corticosteroid induced bone loss in men. J Clin Endocrinol Metab 1998; 83 : 801 – 806.
27. Van Vliet M, Spruit MA, Verleden G et al. Hypogonadism, quadriceps weakness, and exercise intolerance in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2005; 172 : 1105 – 1111.
28. Rosen CJ, Donahue LR. Insulin‑like growth factors and bone: the osteoporosis connection revisited. Proc Soc Exp Biol Med 1998; 219 : 1 – 7.
29. Decramer M. Respiratory muscles in COPD: regulation of trophical status. Verh K Acad Geneeskd Belg 2001; 63 : 577 – 602.
30. Barnes PJ. Mediators of chronic obstructive pulmonary disease. Pharmacol Rev 2004; 56 : 515 – 548.
31. Bolton CE, Evans M, Ionescu AA et al. Insulin resistance and inflammation: a further systemic complication of COPD. COPD 2007; 4 : 121 – 126.
32. Ginaldi L, Di Benedetto MC, De Martinis M. Osteoporosis, inflammation and ageing. Immun Ageing 2005; 2 : 14.
33. Sabit R, Bolton CE, Edwards PH et al. Arterial stiffness and osteoporosis in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2007; 175 : 1259 – 1265.
34. Odborné usmernenie MZ SR pre diagnostiku a liečbu glukokortikoidmi indukovanej osteoporózy. In: Vestník Ministerstva zdravotníctva Slovenskej republiky [online]. 2009, vol. 57 [cit.2010 – 06 – 23]. Available from: http:/ / www.osteoporoza.sk/ lekari/ legislativa/ files/ GIOP.pdf.
35. Palička V, Pohlídal A, Živný P. Terapie osteoporózy. Intern Med 2002; 4 : 381 – 385.
36. Tang BM, Eslick GD, Nowson C et al. Use of calcium or calcium in combination with Vitamin D supplementation to prevent fractures and bone loss in people aged 50 years and older: a meta‑analysis. Lancet 2007; 370 : 657 – 666.
37. Odborné usmernenie MZ SR pre diagnostiku a liečbu osteoporózy. In: Vestník Ministerstva zdravotníctva Slovenskej republiky [online]. 2006, vol. 54 [cit.2010 – 06 – 23]. Available from: http:/ / www.osteoporoza.sk/ lekari/ legislativa/ files/ usmernenie.pdf.
38. Kanis JA, Burlet N, Cooper C et al. European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int 2008; 19 : 399 – 428.
39. Ebetino FH, Francis MD, Rogers MJ et al. Mechanisms of action of etidronate and other bisphosphonates. Rev Contemp Pharmacother 1998; 9 : 233 – 243.
40. Johnson DA, Williams MI, Petkov VI et al. Zoledronic acid treatment of osteoporosis: effects in men. Endocr Pract 2010; 24 : 1 – 23.
41. Lewiecki EM. Current and emerging pharmacologic therapies for the management of postmenopausal osteoporosis. J Womans Health 2009; 18 : 1615 – 1626.
42. Horák P, Píka T. Současné možnosti diagnostiky a léčby osteoporózy. Vnitř Lék 2006; 52 : 749 – 755.
43. Lewiecki EM. Denosumab – an emerging treatment for postmenopausal osteoporosis. Expert Opin Biol Ther 2010; 10 : 467 – 476.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2010 Číslo 11- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Magnosolv a jeho využití v neurologii
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Autoimunitný polyglandulárny syndróm
- Lymfomu podobný průběh agresivní multisystémové histiocytózy z Langerhansových buněk
- Jiný pohled na akutní krvácení do horního trávicího traktu u pacientů s jaterní cirhózou
- Stratifikace rizika pomocí zátěžového SPECT zobrazení myokardu v kombinaci se stanovením koronárního kalciového skóre u rizikových pacientů s diabetem a/ nebo ledvinným selháním
- Stanovenie progresie karcinómu prostaty využitím metodiky RT‑PCR
- Inhibitory angiotenzin konvertujícího enzymu a blokátory receptorů pro angiotenzin II v léčbě fibrilace síní
- Osteoporóza pri chronickej obštrukčnej chorobe pľúc
- Doporučený postup pro diagnostiku a léčbu chronické obstrukční plicní nemoci (CHOPN) – stabilní fáze
- Metastatické postihnutie srdca a perikardu – MR kazuistiky
- Difuzní plošná normolipemická xantomatóza a nekrobiotický xantogranulom, asociované s monoklonální gamapatií – přínos PET‑ CT pro stanovení rozsahu nemoci a zkušenosti s léčbou. Popis dvou případů a přehled literatury
- Autoimunitný polyglandulárny syndróm typ 2 asociovaný s autoimunitnou hypofyzitídou a coeliakiou
- Lymfomu podobný průběh agresivní multisystémové histiocytózy z Langerhansových buněk v dospělosti a přínos PET/ CT vyšetření při hodnocení difuzní metabolické aktivity v plicním parenchymu
- Centrální pravostranná hemiparéza jako dominující projev systémové vaskulitidy
- Profesor MU Dr. František Pór a profesor Dr. Med. Robert Klopstock, poslucháči Lekárskych fakúlt v Budapešti a v Prahe
- Pokroky ve výzkumu aterosklerózy
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Centrální pravostranná hemiparéza jako dominující projev systémové vaskulitidy
- Autoimunitný polyglandulárny syndróm typ 2 asociovaný s autoimunitnou hypofyzitídou a coeliakiou
- Lymfomu podobný průběh agresivní multisystémové histiocytózy z Langerhansových buněk v dospělosti a přínos PET/ CT vyšetření při hodnocení difuzní metabolické aktivity v plicním parenchymu
- Autoimunitný polyglandulárny syndróm
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



