-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Lymfomu podobný průběh agresivní multisystémové histiocytózy z Langerhansových buněk v dospělosti a přínos PET/ CT vyšetření při hodnocení difuzní metabolické aktivity v plicním parenchymu
Lymphoma‑like course in aggressive adult multisystem Langerhans cell histiocytosis and the benefit of PET/ CT imaging in evaluation of diffuse metabolic activity of lung parenchyma
The case report given here describes an unusual case of a 35‑year-old otherwise healthy male diagnosed with aggressive form of Langerhans cell histiocytosis initially taking course under the form of lymphoma with expressed B symptoms (night sweats, fever and weight loss) and generalized peripheral lymphadenopathy. Also present were productive cough and perianal itching. The diagnosis was determined from lymph node and perianal skin biopsies. Furthermore, by a typical finding on HRCT (high‑resolution computed tomography), pulmonary involvement was confirmed the gradual development of which we succeeded to document through a series of several HRCT and PET/ CT scans from its initial florid phase characterized by disseminated nodularities up to the terminal phase with the decline of activity and development of cystic formations. After the collection of peripheral blood stem cells, the planned patient’s therapy started which in all consisted of three monotherapy cycles with cladribine followed by three cycles of combined chemotherapy (cladribine + cyclophosphamide + methylprednisolone) and complemented with curative radiotherapy of the perianal area. This treatment put the disease into complete remission. However, in two months the initial B ‑ symptoms occurred again, along with the pulmonary symptomatology, perianal pruritus and newly also hip bone pains. The suspected LCH relapse was proved histologically by lymph node biopsy and confirmed at a restaging PET/ CT examination which also showed disease dissemination into the hip bones. Consequently, an aggressive form of the disease with early relapse had been the case, which was indicated for administering 4 cycles of CHOEP (cyclophosphamide + doxorubicin + vincristine + etoposide + prednisone) as salvage regimen completed in March 2010 with autologous peripheral blood stem cell transplantation after high‑dose BEAM (carmustine + etoposide + cytarabine + melphalan) chemotherapy. Thus, the generalized involvement of nodes doesn’t always need to be malignant lymphoma or metastatic dissemination of a tumour but also LCH may be the case. The presence of B symptoms may very likely stand for an aggressive form of the disease course. Histological evaluation of the proliferative characteristic (given by Ki ‑ 67 immunohistochemical proliferative index marker and also morphologically by the number of mitosis) may draw attention to an aggressive form of this disease. However, therapy with cladribine (2-chlorodeoxyadenosine) which proves beneficial in classic forms of LCH, in cases of highly aggressive forms of LCH doesn’t need to have the same effect as in LCH with low proliferative activity, which conforms to the present experience in the treatment of indolent and aggressive lymphomas. In our study, the hybrid PET/ CT imaging proved high sensitivity in evaluating the activity of the disease, including its early relapse. We are presenting here a new method for description and evaluation of diffuse increased activity of pulmonary parenchyma by means of PET/ CT examination and for using this method within the framework of monitoring the curative response.
Key words:
Langerhans cell histiocytosis – lymphadenopathy – B symptoms – PET/ CT – HRCT – cladribine – 2 - chlorodeoxyadenosine
Autoři: P. Szturz 1; Z. Adam 1; Z. Řehák 2; R. Koukalová 2; R. Kodet 3; T. Nebeský 4; J. Neubauer 4; M. Moulis 5; L. Šmardová 1; J. Mayer 1
Působiště autorů: Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Jiří Vorlíček, CSc. 2 PET Centrum Oddělení nukleární medicíny Masarykova onkologického ústavu Brno, přednosta prim. MU Dr. Karol Bolčák3 Ústav pat 1
Vyšlo v časopise: Vnitř Lék 2010; 56(11): 1177-1193
Kategorie: Kazuistiky
Souhrn
Tato kazuistika popisuje neobvyklý případ agresivní formy histiocytózy z Langerhansových buněk (LCH) u jinak zdravého 35letého muže, která zpočátku probíhala pod obrazem lymfomu s vyjádřenými B symptomy (noční poty, febrilie, hubnutí) a generalizovanou periferní lymfadenopatií. Přítomen byl rovněž produktivní kašel a svědění kůže v oblasti konečníku. Diagnóza byla stanovena z biopsie lymfatické uzliny a kůže perianální oblasti. Typickým nálezem na HRCT (zobrazení výpočetní tomografií s vysokým rozlišením) bylo dále potvrzeno plicní postižení, jehož postupný vývoj z počátečního floridního stadia charakterizovaného diseminovanými nodularitami až po konečnou fázi s poklesem aktivity a rozvojem cystických formací se nám sérií několika HRCT a PET/ CT skenů podařilo zdokumentovat. Po sběru periferních kmenových buněk byla u pacienta zahájena plánovaná léčba, která sestávala celkem ze 3 cyklů monoterapie s kladribinem, následovaná 3 cykly kombinované chemoterapie (kladribin + cyklofosfamid + metylprednisolon) a doplněná o kurativní radioterapii perianální oblasti. Tato léčba uvedla onemocnění do kompletní remise. Za 2 měsíce se však znovu objevily původní B příznaky, plicní symptomatologie, perianální pruritus a nově i bolesti kyčlí. Předpokládaný relaps LCH byl histologicky ověřen biopsií lymfatické uzliny a potvrzen na restagingovém PET/ CT vyšetření, které rovněž ukázalo diseminaci onemocnění do kyčelních kostí. Jednalo se tedy o agresivní, časně relabující onemocnění indikované k podání 4 cyklů záchranného režimu CHOEP (cyklofosfamid + doxorubicin + vinkristin + etoposid + prednison), které byly v březnu roku 2010 zakončeny autologní transplantací periferních kmenových buněk po přípravě vysokodávkovou chemoterapií HD BEAM (karmustin + etoposid + cytarabin + melfalan). Generalizované postižení uzlin tedy nemusí být vždy jen maligní lymfom či metastatický rozsev tumoru, ale může se jednat i o LCH. Pokud jsou přítomny B symptomy, znamená to velmi pravděpodobně agresivní průběh. Histologické hodnocení proliferační charakteristiky (dané imunohistochemicky proliferačním markerem Ki ‑ 67 i morfologicky počtem mitóz) může upozornit na agresivní formu této nemoci. Léčba kladribinem (2-chlorodeoxyadenosinem), která se osvědčuje u klasických forem LCH, však nemusí mít v případě vysoce agresivní formy LCH stejný účinek jako u LCH s nízkou proliferační aktivitou, což je v souladu s dosavadními zkušenostmi s léčbou indolentních a vysoce agresivních lymfomů. Hybridní PET/ CT zobrazení prokázalo v naší studii vysokou citlivost při hodnocení aktivity onemocnění včetně jejího časného relapsu. V této práci představujeme novou metodiku popisu a hodnocení difuzně zvýšené metabolické aktivity plicního parenchymu pomocí PET/ CT vyšetření a využití této metodiky v rámci sledování léčebné odpovědi.
Klíčová slova:
histiocytóza z Langerhansových buněk – lymfadenopatie – B příznaky – PET/ CT – HRCT – kladribin – 2-chlorodeoxyadenosinÚvod
Histiocytóza z Langerhansových buněk (LCH) je vzácné idiopatické onemocnění s tvorbou morfologicky charakteristických infiltrátů s přítomností Langerhansových dendritických buněk a dalších buněčných elementů, typicky eozinofilních leukocytů a lymfocytů. Takovéto infiltráty mohou postihnout jeden nebo více orgánů v podobě tumorózních ložisek. Ve více než 1/ 2 pří-padů postihuje jedince v dětském věku. V dospělosti se incidence odhaduje na 1 – 5 nemocných na 1 milion obyvatel. Jedná se tedy o natolik raritní onemocnění, že zkušenosti s průběhem a léčbou přináší literatura dominantně ve formě malých souborů pacientů a popisů případů [1,2].
Typickou vlastností této nosologické jednotky je pestrost, neboť klinická manifestace sahá na jedné straně od benigních spontánně regredujících oligosymptomatických ložisek až po multisystémové chemorezistentní onemocnění s infaustní prognózou. U dospělých osob se specifické léze s Langerhansovými buňkami nejčastěji vyskytují v kostech (tato forma se nazývá eozinofilní kostní granulom). Mezi další častá místa prvních manifestací nemoci patří kůže a plíce. Lokality jako lymfatické uzliny, hypofýza, játra, slezina, orbita, kostní dřeň jsou méně frekventní, ale je s nimi, zejména u multisystémového postižení, třeba počítat [1 – 8].
Tato kazuistika popisuje případ LCH u dospělého muže, jehož průběh je neobvyklý svou agresivitou, časným relapsem a generalizovanou lymfadenopatií s nápadnými B příznaky, klinicky se tedy zpočátku chovající jako lymfom.Agresivita tohoto onemocnění byla patology správně predikována, když z bioptovaného vzorku stanovili vysokou proliferační aktivitu, která s sebou přinášela potenciál rychle progredující choroby.
V článku uvádíme celou historii onemocnění od prvních příznaků přes jeho diagnostiku a léčbu až k relapsu, po němž byl pacient indikován k provedení autologní transplantace periferních kmenových buněk. Rovněž se nám podařilo popsat význam PET/ CT vyšetření (hybridní zobrazení pozitronovou emisní tomografií v kombinaci s výpočetní tomografií) při hodnocení difuzní metabolické aktivity plicního parenchymu, která dobře odráží vývoj onemocnění v této lokalizaci. Cílem této práce je tedy poukázat na velmi neobvyklý průběh LCH podobný lymfomu, zdůraznit význam stanovení proliferačního indexu a demonstrovat přínos HRCT a PET/ CT zobrazení pro sledování aktivity této nemoci.
Popis případu
Od příznaků k diagnóze
První příznaky nemoci se u našeho pacienta, 35letého muže, začaly objevovat asi od poloviny léta roku 2008 a jednalo se již od počátku o typické B příznaky, tedy nadměrné noční pocení a neinfekční zvýšení tělesné teploty. Klinicky byla při lékařském vyšetření zjištěna generalizovaná periferní lymfadenopatie s postižením cervikálních, supraklavikulárních, axilárních a ingvinálních lymfatických uzlin, které submandibulárně vlevo a v pravém třísle srůstaly v tuhé pakety velikosti 3 × 2 cm, játra a slezina hmatné nebyly. Pacient rovněž udával silné svědění kůže v oblasti konečníku. Anamnesticky byl zjištěn úbytek tělesné hmotnosti, který postupně dosáhl až ztráty 12 kg za 1/ 2 roku. Ve výsledcích krevních odběrů byla kromě zvýšené sedimentace erytrocytů (31 mm/ hod) a lehké elevace CRP (24 mg/ l) patrná pouze mírná normochromní normocytární anémie (Hb 127 g/ l) a leukocytóza (13,6 × 109/ l) s neutrofilií (11,2 × 109/ 1). Na ultrasonografickém vyšetření břicha byly popsány ojedinělé drobné uzliny nad bifurkací abdominální aorty a v mezenteriu benigního vzhledu, bez hepato i splenomegalie. Muž se do té doby nikdy s ničím vážnějším neléčil, netrpěl ani žádnými chronickými chorobami, v předchorobí byl nápadný pouze jeho náruživý nikotinizmus s průměrnou spotřebou 15 cigaret denně od 18 let.
Po vyloučení infekční příčiny (negativní základní screening fokusů i sérologické vyšetření) byl pacient s podezřením na hematoonkologickou etiologii potíží (lymfadenopatie, noční poty, febrilie, hubnutí) odeslán k provedení diagnostické exstirpace krční mízní uzliny a dle histomorfologické a imunohistochemické analýzy (prosinec roku 2008) byl nález uzavřen jako histiocytóza z Langerhansových buněk.
K zahájení léčby byl pacient na naše pracoviště odeslán v únoru roku 2009. V té době přichází muž již s anamnézou stupňujících se obtíží, kterým dominuje každonoční profuzní pocení s nutností opakovaného převlékání, horečky provázené zimnicí, třesavkou a ztíženým dýcháním a celková prostrace. Tělesná teplota prakticky neklesla pod 37 °C. Postupně se přidával silný dráždivý kašel, často trvající celou noc s masivní expektorací hustého, čirého hlenu.
Staging onemocnění
Před zahájením cílené léčby podstoupil pacient pro nezvyklou manifestaci vzácně se vyskytujícího onemocnění opakovaná histologická vyšetření (únor roku 2009) jednak mízní uzliny exstirpované tentokrát z pravého třísla, jednak také bioptického vzorku kůže z oblasti konečníku. Oba nálezy vzácnou hematologickou diagnózu s následujícím výsledkem potvrzují (dle druhého čtení z pražského pracoviště): „Lymfatická uzlina je prostoupena patologickým infiltrátem z kompaktně uspořádaných středně velkých a velkých histiocytárních buněk s příměsí buněk mnohojaderných. Jádra četných histiocytů jsou cerebriformní se zářezy, cytoplazma je eozinofilní. Běžná je mitotická aktivita. Příměsí jsou eozinofilní leukocyty, místy s masivní akumulací a tvorbou eozinofilních abscesů.
Doplněn je imunohistochemický rozbor verifikující histiocytární buňky: CD1a povšechně membránově 3+; S100 protein povšechně jaderně a cytoplazmaticky 3+ a 2+; Ki 67 intenzitou kolísavě 1+ až 2+, ojediněle až 3+, frakce od 10 % ke 30 % fokálně. Proliferační marker Ki 67 je tedy silně pozitivní ve významné proporci buněk. V porovnání s výsledkem předcházejícího, 2 měsíce starého histologického čtení první vyšetřované uzliny je nápadný výrazný růstový potenciál a progresi onemocnění rovněž dokládá i morfologické vyšetření tkáně s velkým množstvím mitóz.
V kožní excizi perianálně je frustní nález téhož. Není sice patrný souvislý histiocytární infiltrát, ale přítomen je jasný epidermotropizmus s účastí jednotlivých histiocytárních buněk i ve vyšších vrstvách akantotické a výrazně proliferující epidermis. V horním koriu jsou zastiženy lymfocytární infiltráty, novotvořené cévy a ojedinělé roztroušené histiocytární elementy. Je tedy velmi pravděpodobné, že kožní projev je součástí celkového systémového onemocnění, multiorgánové LCH. Věk na progresivní LCH je však velmi neobvyklý. Multiorgánové akutní onemocnění se dost blíží sarkomu z Langerhansových buněk.“
HRCT plic (únor roku 2009), indikované pro neustupující plicní symptomatologii s podezřením na progresi choroby do této lokalizace, ukázalo obraz drobných nodulů a cyst, typický pro maligní histiocytózu [9] (obr. 1). Potenciál přínosné stagingové zobrazovací modality prokázalo PET/ CT vyšetření (leden roku 2009) s nálezem generalizované lymfadenopatie v oblasti krku, obou axil a třísel a také v retroperitoneální lokalizaci s patologickou akumulací radiofarmaka (obr. 2 a 3). Vstupní vyšetření doplnila celotělová scintigrafie (leden roku 2009) s normálními scintigramy skeletu a dále pak i trepanobiopsie (leden roku 2009) s popsanou fyziologickou trilineární krvetvorbou bez přesvědčivých dysplastických změn.
Obr. 1. Přehled HRCT skenů, detaily na pravé plicní křídlo ve dvou různých rovinách. Patrný je vývoj plicního postižení LCH, kdy z nodulárních opacit postupně vznikají cysty (označeny červenými šipkami). 
Měli jsme před sebou pacienta s multisystémovou formou LCH s dominantním postižením lymfatických uzlin, histologicky prokázanou vysokou mitotickou aktivitou, s takřka patognomickým nálezem na HRCT plic a progresivní klinickou manifestací, tedy pacienta vyžadujícího neodkladné zahájení hematoonkologické léčby.
Obr. 2. Přehled sumovaných obrazů (MIP) rozložení <sup>18</sup>F-FDG v trupu. Aktivitu v zachycené mozkové kůře, slinných žlázách, myokardu, žaludku, varlatech, ledvinách a močovém měchýři považujeme za fyziologickou. Studie I (leden roku 2009): jsou patrná četná ložiska patologické akumulace radiofarmaka v krčních uzlinách i periklavikulárně oboustranně, v uzlinách obou axil (více vlevo) a dále i v retroperitoneálních, ilických i tříselných uzlinách oboustranně. Maximální aktivitu detekujeme v ilických uzlinách vpravo (SUV<sub>max</sub> 12,3). Relativně je lehce difuzně vyšší akumulace radiofarmaka v celém zachyceném skeletu. Studie III (listopad roku 2009): jsou patrná drobná ložiska patologické akumulace radiofarmaka v uzlinách submandibulárně vlevo i na obou stranách krku, nově ale 2 ložiska vyšší akumulace radiofarmaka v kyčelních kostech oboustranně. Studie IV (leden roku 2010): ložiska patologického hypermetabolizmu glukózy tč. nenacházíme, a to ani ve skeletu, v uzlinách krku nebo plicích. 
Primoléčba a remise choroby
V březnu roku 2009 byl u pacienta pro-veden sběr periferních kmenových buněk (celková výtěžnost 37,29 × 106/ l CD34+ bb/ kg) po přípravné stimulační chemoterapii (cyklofosfamid 2 g/ m2 i.v. 1. den a vepesid 200 mg/ m2 i.v. 1. až 3. den). Již na tento režim zareagoval nemocný subjektivně zlepšením celkového stavu s postupným odezníváním nočního pocení, horečnatých stavů, plicní symptomatologie a perianálního pruritu. Následovala plánovaná léčba s kladribinem (2-chlorodeoxyadenosin) v pulzní monoterapii v dávce 0,14 mg/ kg (Litac 10 mg s.c. inj., 5 dnů po sobě, opakování po 28 dnech), při které byla klinicky patrná regrese zduřených mízních uzlin. Po absolvování 2 cyklů, v květnu roku 2009, se však u pacienta znovu objevilo pálení konečníku s hmatným perianálním infiltrátem a ultrasonografie prokázala přetrvávající periferní lymfadenopatii bilaterálně v tříslech a v pravé axile. Na interim PET/ CT z června roku 2009 jednoznačná ložiska patologického hypermetabolizmu glukózy prokázána sice nebyla, ale četná drobná ložiska s vyšší akumulací radiofarmaka na krku, šíji, periklavikulárně, v axilách a bilaterálně paravertebrálně odpovídající tzv. aktivaci hnědého tuku (varianta fyziologického zobrazení), stejně tak jako artefakty v lymfatických cévách na pravé paži a v pravé axile (v důsledku paravenózní extravazace při aplikaci radiofarmaka do fragilní žíly pravé horní končetiny) značně ztěžují interpretaci celého vyšetření, zejména hodnocení případné maligní lymfadenopatie v pravé axile.
Obr. 3. PET/low dose CT (leden roku 2009). Krk: ložiska vysoké akumulace radiofarmaka (SUV<sub>max</sub> 9,47) korelující s pakety zvětšených lymfatických uzlin na obou stranách krku. Axila: ložiska vysoké akumulace radiofarmaka (SUV<sub>max</sub> 8,2) korelující s pakety zvětšených uzlin v obou axilách, vlevo dosahující velikosti až 5 cm v delší příčné ose. Plíce: četné drobné nodularity s maximem výskytu ve středních a dolních polích. Hodnocení ovlivněno dýchacími artefakty. Difuzně je nepatrně vyšší akumulace radiofarmaka v parenchymu obou plic. Kyčel: ložiska vysoké akumulace radiofarmaka (SUV<sub>max</sub> 12,3) korelující s pakety ilických uzlin oboustranně. V kyčelní kosti vlevo bez ložisek hypermetabolizmu glukózy i ložiskových změn na CT. 
Účinnost zavedeného režimu chemoterapie byla pro přítomnost perianálního pruritu s indurací a suspektní histiocytární infiltrace lymfatických uzlin pravé axily zhodnocena jako nedostatečná a léčba se od 4. cyklu rozšířila o přidání cyklofosfamidu (300 mg i.v., 1. – 5. den) a metylprednisolonu (250 mg i.v., 1. – 5. den) k výše uvedené dávce kladribinu 5 mg/ m2 a dále o kurativní radioterapii na oblast kožního ložiska (10 × 2,0 Gy). Po ukončení chemoterapie v srpnu roku 2009, která sestávala celkem ze 3 cyklů monoterapie s kladribinem následované 3 cykly kombinované chemoterapie (kladribin + cyklofosfamid + metylprednisolon) a doplněné o kurativní radioterapii perianální oblasti, po níž tento infiltrát téměř úplně vymizel, byl pacient více než 2 měsíce zcela bez obtíží, klinicky a ultrasonograficky bez patologické periferní lymfadenopatie. Primoléčba tedy uvedla onemocnění do kompletní remise.
Obr. 4. Lymfatická uzlina, hematoxylin‑eozin, původní zvětšení 50krát. Uzlina je extenzivně infiltrovaná splývajícími nádorovými ložisky s převažující sinusoidální distribucí. Neoplastické infiltráty fokálně nekrotizují. a – nádorový infiltrát s převažující sinusoidální distribucí, b – lymfatická tkáň uzliny, c – ložisko nekrózy, d – pouzdro uzliny. 
Relaps onemocnění
Začátkem října roku 2009 se však objevily příznaky respirační infekce s kašlem, subfebriliemi, postupně až febriliemi, silná únava, rekurence nočních potů a perianálního pruritu a nově i tupé, lokalizované pobolívání levé kyčle dosahující na vizuálně analogové škále intenzity až 5/ 10. S anamnézou asi 4 týdnů trvajících obtíží se pacient dostavil v rámci pravidelné dispenzarizace po ukončení onkologické léčby na naši ambulanci, kde jsme mu doporučili dovyšetření za hospitalizace pro podezření na oportunní infekci (předcházející vysoce imunokompromitující léčba cytostatiky), ale i pro důvodné podezření na relaps základního onemocnění (svědění v oblasti konečníku, noční poty, palpační nález dvou drobných, tuhých uzlinek vpravo supraklavikulárně a plicní symptomatologie, která se podobala vstupním obtížím před zahájením léčby).
Obr. 5. Lymfatická uzlina, hematoxylin‑eozin, původní zvětšení 200krát. Nádorové buňky mají blandní lobulizovaná jádra často se zářezy, jemným chromatinem a nenápadnými nukleoly. Cytoplazma nádorových buněk je poměrně abundantní, světle eozinofilní. Reaktivní příměs neoplastického infiltrátu tvoří četné eozinofily, místy nakupené do drobných eozinofilních abscesů. Ojediněle jsou zastiženy také obrovské mnohojaderné buňky. a – nádorové Langerhansovy buňky s reaktivní příměsí eozinofilů, b – eozinofilní absces s nekrózou, c – obrovské mnohojaderné buňky. 
Pacient byl odeslán na HRCT vyšetření plic (listopad roku 2009) s nálezem difuzního postižení intersticia s mnohočetnými nodularitami a místy s tvorbou drobných cystických formací (obr. 1). Obraz tedy při srovnání s prvním HRCT mohl odpovídat progresi plicního postižení LCH, stav však nebylo možné jasně oddiferencovat od případné konkomitantní infekce (např. pneumocystové nebo atypické pneumonie), která by se rovněž projevila jako intersticiální proces. Fibrobronchoskopické vyšetření s provedením bronchoalveolární laváže a odesláním získaných vzorků na mikrobiologickou a cytologickou analýzu ani laboratorní parametry (CRP 24,4 mg/ l, prokalcitonin méně než 0,02 ng/ ml) však přesvědčivé známky vlivu infekčního agens neukázaly, slabě pozitivní byly pouze sérové IgA protilátky proti antigenům Chlamydia pneumonie. Vzhledem k rizikovosti pacienta a s ohledem na případnou falešnou negativitu provedených vyšetřovacích modalit byla u pacienta zahájena léčba klaritromycinem s částečným klinickým (snížení četnosti teplotních špiček) a laboratorním (pokles CRP) efektem.
Obr. 6. Lymfatická uzlina, imunohistochemické barvení s protilátkou proti antigenu CD1a: nádorové buňky vykazují pozitivitu CD1a, což způsobuje hnědé membránové zbarvení (viz detail vpravo). 
Po antibiotickém přeléčení se však i nadále občas vyskytly zvýšené teploty a noční pocení, přetrvával perianální pruritus a bolesti v levé kyčli a pravděpodobný relaps LCH byl histologicky ověřen (listopad roku 2009) nálezem nádorové infiltrace v drobných pravostranných supraklavikulárních uzlinkách (obr. 4 – 7) a potvrzen na restagingovém PET/ CT vyšetření (listopad roku 2009) s popsanými patologickými ložisky v krčních mízních uzlinách a téměř symetricky v obou kyčelních kostech (obr. 2, 8). Osteolytické defekty v kyčelních kostech se zobrazily rovněž na MRI skenech (prosinec roku 2009) (obr. 9) a pacient byl indikován k pravidelné léčbě perorálními bisfosfonáty (klodronát 1 600 mg denně).
Obr. 7. Lymfatická uzlina, imunohistochemické barvení s protilátkou proti S100 proteinu: nádorové buňky vykazují rovněž pozitivitu S100 proteinu, což způsobuje hnědé nukleární i cytoplazmatické zbarvení (viz detail vpravo). 
Cesta k autologní transplantaci periferních kmenových buněk
Systémová léčba relapsu LCH byla zahájena v prosinci roku 2009 režimem CHOEP (cyklofosfamid 750 mg/ m2, doxorubicin 50 mg/ m2 a vinkristin 1,4 mg/ m2 i.v. 1. den, etoposid 100 mg/ m2 i.v. 1. – 3. den, prednison 100 mg p.o. 1. – 5. den, opakování po 4 týdnech) s podporou růstovými faktory v dávce 5 μg filgrastimu/ kg a s nutností redukce dávek cytostatik v dalších cyklech pro hluboký dřeňový útlum, takže ve 3. a 4. cyklu chemoterapie byl podán pouze etoposid a prednison. Po 1. cyklu udával pacient ještě přechodný výskyt nočního pocení, produktivního kašle, svědění v oblasti konečníku a zhoršených kostních bolestí, které nově postihovaly i pravou kyčel. Tyto obtíže však po 2. cyklu vymizely a nadále přetrvávalo pouze lehké pobolívání v obou kyčelních kostech, dobře tolerované na zavedené analgoterapii.
Obr. 8. PET/ low dose CT (listopad roku 2009). Krk: ložisko zvýšené akumulace radiofarmaka (SUV<sub>max</sub> 4,8) korelující s uzlinou velikosti 14 × 5 mm na bazi krku vpravo. Axila: v levé axile jednotlivé reziduální uzliny do 1 cm s hraniční mírou akumulace radiofarmaka. Plíce: četné drobné nodularity – ve srovnání se vstupním vyšetřením pravděpodobně došlo k regresi velikosti opacit. Difuzně je nepatrně vyšší akumulace radiofarmaka v parenchymu obou plic. Kyčel: ložisko zvýšené akumulace radiofarmaka (SUV<sub>max</sub> 9,8) korelující s drobným osteolytickým defektem asi 12 mm v delší ose. 
Před podáním 3. cyklu byla radiodiagnosticky zhodnocena účinnost dosavadní chemoterapie. PET/ CT vyšetření (leden roku 2010) neprokázala žádná ložiska patologického hypermetabolizmu glukózy a popsáno bylo i snížení difuzní aktivity plicního parenchymu oproti předcházejícím vyšetřením (obr. 2, 10). HRCT plic (leden roku 2010) ukázalo sice úbytek nodulů, ale patrná byla progrese plicního postižení ve smyslu pokročilého zastoupení cystických formací (obr. 1). Nejednalo se však o aktivitu onemocnění, kterou negativní nález na PET/ CT vyšetření vyloučil, ale o přirozený vývoj plicního postižení LCH, kdy z nodulů vznikají kavitované noduly, později cysty, až se celý útvar přemění na reziduální, metabolicky inaktivní jizvu. Celotělové MRI vyšetření (leden roku 2010) zobrazilo stacionární rozsah osteolytických ložisek bilaterálně v obou kyčelních kostech.
Obr. 9. Osteolytická ložiska v kyčelních kostech na MRI vyšetření (prosinec roku 2009) jsou hypersignální (tj. světlá) ve vážené sekvenci T1, STIR i T2, což však neodpovídá typickému nálezu lytického ložiska, které je v T1 vážené sekvenci hyposignální (tj. tmavé). Tento nález se u kostních lézí LCH vyskytuje výjimečně, eozinofilní granulomy jsou totiž v T1 vážené sekvenci většinou hyposignální [67,68]. ![Obr. 9. Osteolytická ložiska v kyčelních kostech na MRI vyšetření (prosinec roku 2009) jsou hypersignální (tj. světlá) ve vážené sekvenci T1, STIR i T2, což však neodpovídá typickému nálezu lytického ložiska, které je v T1 vážené sekvenci hyposignální (tj. tmavé). Tento nález se u kostních lézí LCH vyskytuje výjimečně, eozinofilní granulomy jsou totiž v T1 vážené sekvenci většinou hyposignální [67,68].](https://pl-master.mdcdn.cz/media/image/b32a9c036c9ebd6eb20d922947009e46.jpeg?version=1537790307)
Nyní, po 4 cyklech záchranné chemoterapie CHOEP, byl pacient objednán na termín vysokodávkového přípravného režimu HD BEAM (karmustin + etoposid + cytarabin + melfalan) před plánovanou autologní transplantací periferních kmenových buněk. Pacient je toho času bez subjektivních obtíží (vyjma lehkého pobolívání v kyčlích intenzity na vizuálně analogové škále asi 2/ 10), klinicky není periferní lymfadenopatie hmatná a ani PET nezobrazuje žádná patologická ložiska hypermetabolizmu. S ohledem na vzácný výskyt tohoto onemocnění lze jen těžko odhadovat terapeutický přínos autotransplantace. Léčba relapsu však dosud probíhá uspokojivě, o čemž svědčí především ústup subjektivních obtíží a negativní nález na interim PET/ CT vyšetření. Pacient má bratra, dvojče, a v současnosti probíhá HLA typizace pro případnou alogenní transplantaci. Terapeutické možnosti tedy vyčerpány ještě nejsou, věříme však, že aktuální léčebný plán uvede onemocnění do dlouhodobé remise a pacient se bude moci vrátit ke svým dřívějším aktivitám.
Obr. 10. PET/ low dose CT (leden roku 2010). Krk: ložiska zvýšené akumulace radiofarmaka ani zvětšené uzliny tč. nenacházíme. Axila: ložiska zvýšené akumulace radiofarmaka ani zvětšené uzliny tč. nenacházíme. Plíce: v parenchymu plicním mnohočetné drobné nodularity do 8 mm v průměru. Některé z nich nabývají prstenčitý, cystoidní charakter. Ve srovnání s vyšetřením z listopadu roku 2009 mírná progrese velikosti některých opacit. Vzhledem k mnohočetnému postižení je téměř nemožné objektivně zhodnotit vývoj počtu lézí (lépe patrně na HRCT plic). V mediastinu jen drobné uzliny bez čerstvých změn (největší uzlina asi 11 mm v průměru v předním mediastinu). Kyčel: osteolytický defekt v levé kyčelní kosti v CT obrazu bez podstatných změn, nově ale již nevykazuje hypermetabolizmus glukózy. 
Nová metoda hodnocení difuzní metabolické aktivity LCH v plicním parenchymu
Popis metodiky
Vyhodnocování difuzní metabolické aktivity LCH v plicním parenchymu se opíralo o výsledky získané pomocí PET/ CT vyšetření, tedy hybridního zobrazování pozitronovou emisní tomografií (PET) v kombinaci se současně snímanými celotělovými skeny výpočetní tomografií (CT). Obrázky získané touto zobrazovací modalitou předkládáme čtenářům jak ve formě celotělových MIP (Maximum Intensity Projections) rekonstrukcí, kterými lze získat trojrozměrnou představu o distribuci radiofarmaka 2 - 18F - fluoro-2 - deoxy - D - glukózy (18F - FDG) v těle pacienta, tak i jako axiální řezy v různých úrovních (krk, axily, plíce, pánve) vizualizované v PET, ve fuzním a v LD CT (low dose CT) zobrazení. Míra hromadění radiofarmaka je stanovena pomocí parametru SUV (Standardized Uptake Value), který určuje naměřenou aktivitu v cílové tkáni vztaženou k podané aktivitě, glykemii a tělesným parametrům vyšetřované osoby, jedná se o poměrný, nikoliv absolutní údaj.
PET/ CT vyšetření byla prováděna po 6hodinovém lačnění v euglykemii. Aplikovaná aktivita byla v rozmezí 312 – 409 MBq 18F FDG i.v. Akumulační fáze byla 60 min. Akvizice byla prováděna na hybridním PET/ CT skeneru True Point PET/ CT Biograph 64 SIEMENS, a to vždy v rozsahu proximální stehna – baze lební. Snímána byla emisní i transmisní data s korekcí absorpce a iterativní rekonstrukcí dat. Při akvizici na PET/ CT skeneru byl použit, vzhledem k opakovaným kontrolám, režim low dose CT (LD CT), díky kterému jsme výrazně zredukovali radiační zátěž. CT data byla rekonstruována v poli o šíři 500 mm. Parametry LD CT protokolu byly tyto: slice 5 mm, kolimace 24 × 1,2 mm, faktor stoupání (pitch) 0,8 mm. Pro zvýraznění struktur plicního parenchymu byl použit rekonstrukční algoritmus: slice 1,5 – 2,0 mm, kernel B 80 f (ultra sharp), reconstruction increment 2 mm, window – lung.
Míru metabolické aktivity jsme stanovovali semikvantitativní analýzou SUVmax (maximum Standardized Uptake Value) v měřitelné lézi (např. lymfatické uzlině, ložisku). Vzhledem k tomu, že drobné plicní noduly byly pod rozlišovacími možnostmi PET komponenty hybridního PET/ CT skeneru, která se obvykle udává kolem 6 – 8 mm, a nejedná se tedy o měření aktivity v jednotlivých dobře zobrazitelných lézích (tak jak je tomu např. u zvětšených uzlin, osteolytických kostních defektů v kyčelní kosti apod.), stanovovali jsme difuzní metabolickou aktivitu v plíci jako orgánu a tuto jsme vztahovali vždy k aktuální metabolické aktivitě referenčního jaterního parenchymu, tedy poměr SUVmax PULM/ SUVmax HEP. Obvyklým případem u nás byly rovněž cystické léze velikosti 5 – 8 mm, u nichž je aktivita jen ve stěně tloušťky asi 1 – 2 mm, tedy hluboce pod rozlišením.
Metabolickou aktivitu jsme měřili v horním a středním plicním poli vpravo. V horním i středním plicním poli jsme předpokládali maximum změn u dané diagnózy, navíc v dolním poli dochází k četným pohybovým artefaktům (PET snímání během dýchání, CT v zadrženém středním nádechu), vpravo proto, že se zde oblasti zájmu lépe vymezují (vzhledem k absenci perikardu a srdce) jen s vyloučením hilových struktur a pleury (kde aktivita může být vyšší i fyziologicky). S přihlédnutím k anatomickým poměrům jsme volili objem zájmu VOI (Volume of Interest) tvaru koule o průměru 6 – 8 cm, v játrech pak 8 – 10 cm. Při stanovení poměru aktivity plicní/ jaterní dochází i ke snížení variability mezi jednotlivými studiemi a navíc jen tak lze porovnat i měření z různých přístrojů.
Rozhodovací analýza
V tab. 1 jsou uvedena rozmezí poměrných hodnot SUVmax PULM/ SUVmax HEP, která jsme označili za negativní, slabě pozitivní a pozitivní. Hodnoty v rozmezí 0,2 – 0,4 zpravidla běžně vídáme u vyšetření bez onkologických i neonkologických plicních chorob, mohli bychom je považovat za fyziologické, ale žádná normálová databáze takto stanovena dosud nebyla. Při zpětné analýze vzorku 100 náhodně vybraných PET/ CT studií bez známé plicní onkologické nebo i neonkologické choroby jsme zjistili hodnoty menší než 0,3 u 79 % a menší než 0,4 u 96 % studií.
Tab. 1. Vývoj změn poměrné aktivity SUV<sub>max</sub> PULM/ SUV<sub>max</sub> HEP, která dokládá aktivitu LCH v plicním parenchymu, a příslušná rozhodovací analýza. 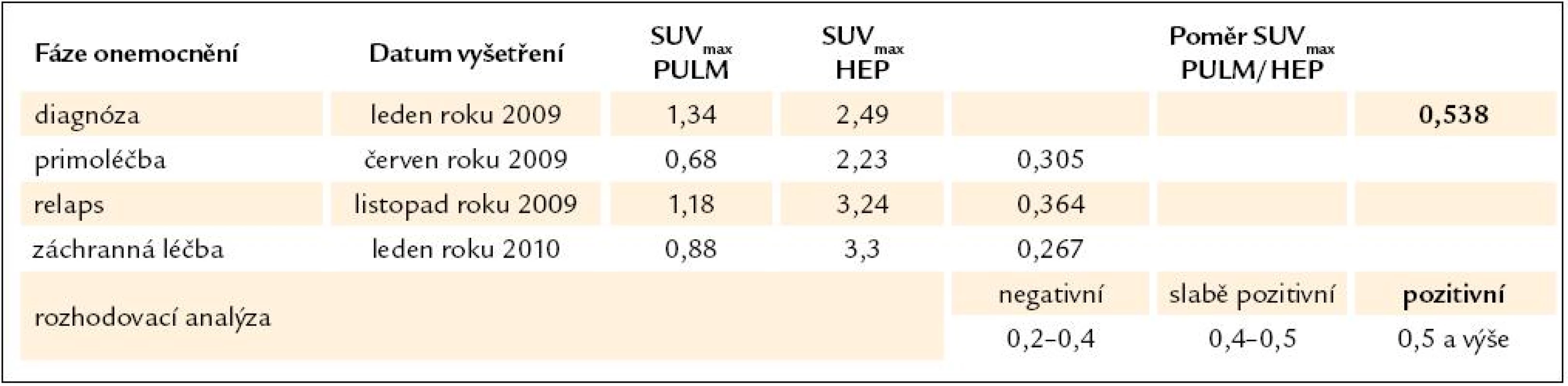
U sledovaného pacienta je difuzní metabolická aktivita plicního parenchymu při 1. vyšetření z ledna roku 2009 (před zahájením léčby) více než dvojnásobná ve srovnání s posledním PET/ CT, provedeném v odstupu jednoho roku v lednu roku 2010 (po 2 cyklech záchranné chemoterapie CHOEP), kdy je aktivita ze všech 4 měření nejnižší a odpovídá absenci jakékoli plicní symptomatologie. Rovněž je patrný pokles aktivity v průběhu primoléčby v červnu roku 2009 a opětovný nárůst po relapsu choroby v listopadu roku 2010. Tato hodnocení by však mohla být zkreslena případnou infekční noxou vyvolávající zánětlivý plicní infiltrát s hypermetabolizmem glukózy. Plicní symptomatologie přítomná vstupně na začátku roku 2009 s největší pravděpodobností infekční etiologie nebyla, a to pro promptní zlepšení po stimulační chemoterapii před sběrem periferních kmenových buněk. Vstupní PET vyšetření z ledna roku 2009 proto odráží pouze aktivitu choroby. Infekční komplikace však mohly sehrát jistou roli při 3. vyšetření v listopadu roku 2009. Pro negativní nález při bronchoskopickém vyšetření, přetrvávání kašle i po antibiotickém zaléčení a takřka patognomický vývoj na HRCT plic, ale i při tomto měření připadá maximum změn na vrub plicnímu postižení při LCH. Vývoj změn poměrné aktivity SUVmax PULM/ SUVmax HEP, která dokládá aktivitu LCH v plicním parenchymu, ilustruje tab. 1 a obr. 11.
Obr. 11. Semikvantitativní hodnocení SUV<sub>max</sub> PULM/ SUV<sub>max</sub> HEP: Studie I (leden roku 2009): 0,538. Studie II (červen roku 2009): 0,305. Studie III (listopad roku 2009): 0,364. Studie IV (leden roku 2010): 0,267. 
Diskuze
Překvapující pestrost klinických projevů
Postižení skeletu
Histiocytóza z Langerhansových buněk v dospělosti postihuje dominantně skelet, vytváří osteolytická ložiska ne nepodobná osteolýze při mnohočetném myelomu. Nejčastěji je uváděno postižení kalvy, následuje pak osteolytické postižení žeber. S menší frekvencí bývají postiženy další části skeletu [10 – 12]. Kostní ložiska často způsobují zvýšený metabolický kostní obrat, a proto jsou znázornitelná metodou scintigrafie skeletu pomocí technecium pyrofosfátu [13]. Velmi citlivou metodou zobrazení patologického děje v kosti je rovněž magnetická rezonance (MRI) [14], která je optimální pro plánování rozsahu radioterapie [15]. Novou metodu, která detekuje ložiska LCH v kostech i jinde, představuje PET vyšetření [16]. Tato metoda vypovídá o aktivitě či neaktivitě ložiska a může pomoci při plánování radioterapie a vyhodnocování léčebné odpovědi [17,18].
Postižení dýchacího ústrojí
Respirační cesty jsou postiženy častěji u dospělých než u dětí, 60 – 100 % pacientů s plicní formou jsou kuřáci [19,20]. Incidence plicního postižení mezi všemi pacienty s uvedenou chorobou se udává kolem 20 % a popsána byla i rekurence onemocnění v transplantovaných plicích [21]. Pacienti přicházejí s anamnestickým údajem dušnosti, ale i bolestí na hrudníku, neproduktivním kašlem, někdy udávají teploty a úbytek hmotnosti. Infiltrace vyvolává restrikční změny, které předcházejí RTG změnám. Radiografický nález je tvořen cystami a intersticiálními nodulárními opacitami obvykle blíže k hilům. Optimálním prostředkem pro diagnostiku plicní formy histiocytózy je HRCT (zobrazení výpočetní tomografií s vysokým rozlišením) [9,22,23], s jehož pomocí je možno rozpoznat tenkostěnné cysty, mikronoduly, opacity a zesílení intersticiálních prostorů. Cysty jsou přitom více koncentrované v horních lalocích, méně jich je ve středních a vynechávají kostodiafragmatický úhel, mohou nabývat bizarních tvarů a v pokročilých formách onemocnění až splývat pod obrazem emfyzému. Mikronoduly jsou miliární velikosti 0,5 – 4,0 mm. Někdy můžeme pozorovat typický až téměř patognomický nález cystických lézí kombinovaných s noduly, z nichž některé mohou být kavitované. Zesílení intersticia je při HRCT vyšetření zřetelné hlavně bazálně [24,25].
Prasknutí cyst a jejich komunikace s pleurální dutinou způsobí spontánní pneumotorax [26,27]. Postižení plic při LCH často komplikuje nasedající oportunní infekce. Odlišit ji může být problém, neboť teplota a váhový úbytek mohou být jak prvními projevy plicní histiocytózy, tak mohou mít i jiné (infekční) příčiny [28 – 35]. V diferenciální diagnostice pak pomůže buď bronchoalveolární laváž, nebo torakoskopie s excizí materiálu na histologické vyšetření.
Bronchoalveolární laváž je přínosná jedině v tom případě, pokud se provedou odpovídající imunohistochemické vyšetřovací metody, samotná bronchoskopie s biopsií bronchiální sliznice je pro průkaz této nemoci zcela nepřínosná. Langerhansovy buňky lze identifikovat flowcytometricky anebo imunohistochemicky v sedimentu z laváže průkazem makrofágů s pozitivitou znaku CD1a a proteinu S100 [36,37]. Udává se, že v případě plicní formy histiocytózy bývá v laváži více než 5 % CD1a+ buněk, zatímco u zdravých pacientů je počet CD1a+ menší než 1 %. Dále bývá zvýšen počet buněk v aspirované tekutině nad 106/ ml s prevalencí alveolárních makrofágů. Makrofágová alveolitis je přítomna u kuřáků s LCH a chybí u vzácných případů plicní LCH nekuřáků [38].
Další formy postižení
Infiltrace kůže buňkami Langerhansovy histiocytózy dominuje u dospělých v oblasti mediánní roviny a často postihuje intertriginózní oblasti jako třísla, pupek, vulvu či perianální krajinu [39 – 46], popsány jsou i případy postižení nehtů [47].
Játra i slezina mohou být touto chorobou postiženy, což se projeví jejich zvětšením. Velmi silná infiltrace jater pak může vyvolat příznaky jaterního selhání, tedy pokles albuminu, snížení aktivity koagulačních faktorů, žloutenku bez výrazného zvýšení jaterních enzymů [48 – 53].
Velmi vzácnou manifestací v dospělosti je postižení CNS. Poruchy sluchu mohou nastat jak postižením zevního sluchového kanálu, tak poruchou středního či vnitřního ucha propagací choroby z processus mastoideus. Infiltrace je nebolestivá a postupně vede k hluchotě. Časté jsou sekundární infekce, které jsou příčinou záměny za chronickou otitidu [54,55]. Diabetes insipidus je také jedním z projevů a může být i prvním příznakem onemocnění v dospělosti [56 – 59].
Generalizovaná lymfadenopatie
LCH však obvykle nezpůsobuje generalizovanou lymfadenopatii. Postižení uzlin je v literatuře popsáno, ale v uvedených případech šlo pouze o postižení lokalizované na jednu lymfatickou oblast. Již dříve jsme popsali pacienta s izolovaným postižením jedné uzliny, které vyřešila exstirpace postižené uzliny bez další léčby [1]. Podobné případy lze nalézt v literatuře [60]. Popis LCH, která by se projevila generalizovaným zvětšením uzliny a typickými B příznaky, tedy LCH připomínající svým klinickým průběhem maligní lymfom, jsme v literatuře nenašli.
Histologické vyšetření a hodnocení proliferace
Zásadním vyšetřením nutným pro stanovení diagnózy je samozřejmě bioptická excize. Pro nepatologa je vhodné jen vědět, že v době akutní choroby jsou v ložisku přítomny četné Langerhansovy buňky, exprimující v různé míře proliferační markery, a eozinofily. Později v ložisku ubývá Langerhansových buněk, přibývá makrofágů a fibrocytů a nakonec obraz odpovídá postnekrotické fibróze. Někdy může být obtížné rozlišení osteomyelitidy od kostních ložisek histiocytózy, stejně tak jako odlišení plicní formy histiocytózy od jiných fibrózujících či granulomatózních plicních procesů.
Diagnózu je možné ověřit také imunofenotypizací. Pro Langerhansovu histiocytózu je patognomický nález antigenů II. HLA třídy, přítomnost CD1a antigenu a často i přítomnost antigenů fyziologicky se nacházejících na fagocytujících histiocytech: CD11c a CD14. Dále jsou uváděny následující znaky CD1a++, CD11c++, CD44++, CD54++, CD58++. Znaky CD2, CD11a, CD11b jsou na těchto patologických buňkách výjimečně a ve slabé intenzitě [2,60,61].
WHO klasifikace uvádí dále termín Langerhans cell sarkoma, který je vyhrazen pro maligní proliferaci Langerhansových buněk, které dle své morfologie mají známky dediferenciace a obvykle také agresivnější sarkomatózní růst a přitom imunofenotyp Langerhansových buněk.
Mikroskopické změny v ložisku v průběhu času, k nimž nutno přihlížet při interpretaci histologického nálezu, a morfologické znaky LCH shrnuje tab. 2.
Tab. 2. Mikroskopické změny v ložisku v průběhu času, k nimž nutno přihlížet při interpretaci histologického nálezu, a morfologické znaky LCH. 
U dospělých nemocných má nemoc ve většině případů neagresivní průběh a proliferační charakteristiky (Ki 67 a počet mitóz) nebývají vysoké.
U popisovaného nemocného je morfologický a imunofenotypický obraz charakteristický pro LCH. Důvod vysoké proliferační frakce a progrese však z dostupných diagnostických modalit není možné objektivně doložit. Nepochybně jde o vykolejení buněčného cyklu postupnou deregulací. Proto současný nález kódujeme jako maligní formu LCH. Proces je výrazně proliferačně aktivní a tím vybočuje z běžných nálezů LCH u starších dětí a dospělých nemocných [4,5,60].
Korelace intenzivní proliferace detekované v histologickém vzorku s dalšími známkami agresivity nemoci
U maligních lymfomů signalizují B sym-ptomy vždy nepříznivou prognózu, agresivnější průběh nemoci. V tomto případě LCH měly B symptomy stejný význam, korelovaly také s velmi agresivní formou nemoci.
Agresivita nemoci se projevila malou léčebnou odpovědí na jinak účinnou monoterapii 2-chlorodeoxyadenosinem [62,63]. Léčebná odpověď se dostavila až po kombinaci 2-chlorodeoxyadenosinu s cyklofosfamidem a metylprendisolonem. Agresivitu onemocnění potvrdil časný relaps nemoci.
Nemoc postihovala v době diagnózy 3 systémy (lymfatické uzliny, plíce a kůži perianální oblasti), při recidivě se přidalo i kostní postižení.
Hodnocení léčebné odpovědi
Při každé léčbě je důležité průběžně vyhodnocovat její efekt. Obvykle po 2 – 3 cyklech je nutné vyhodnotit léčebnou účinnost, a pokud se nedostavuje, tak se pokusit najít jinou účinnější léčbu. Sledování léčebné odpovědi se u našeho pacienta opíralo o subjektivní vnímání potíží pacientem, fyzikální vyšetření, radiodiagnostiku (RTG, ultrasonografii, CT, HRCT a MRI) a metody nukleární medicíny (scintigrafie, PET).
Hodnocení lymfatických uzlin
Vyhodnocovat vývoj lymfadenopatie je možné jak palpačně, tak zobrazovacími metodami (sonografie, CT a PET/ CT). Výhodou PET/ CT vyšetření je to, že informuje nejen o velikosti, ale také o metabolické aktivitě. Při hodnocení metabolické aktivity je však nutno brát v úvahu, že odvisí jak od metabolické aktivity maligního procesu (od rychlosti proliferace maligních buněk), tak od velikosti ložiska. Zcela malá ložiska, byť vysoce maligní, nemusí být při PET zobrazení zřetelná, u většiny dnešních PET skenerů se totiž dolní mez rozlišení ložisek pohybuje kolem 6 – 8 mm.
Všechna tato zobrazovací vyšetření byla použita k vyhodnocování vlivu chemoterapie na lymfadenopatii. Přínos PET/ CT pro hodnocení účinnosti léčby ložiskových LCH procesů je doložen několika studiemi [64,65].
Vyhodnocování účinnosti na kůži
Dále můžeme říci, že aktivitu nemoci a větší či menší účinnost léčby odrážela subjektivně vnímaná měnící se intenzita svědění perianální kůže a její makroskopické změny, tedy zarudnutí a indurace. Ústup svědění po stimulační intenzivní chemoterapii s cyklofosfamidem a etoposidem, recidiva svědění v průběhu monoterapie 2-chlorodeoxyadenosinem a zmenšení svědění po doplnění cyklofosfamidu a metylprednisolonu do kombinace odpovídalo i změnám velikosti uzlin.
V případě, že pacient má infiltraci kůže a zřetelné morfy, je vysoce pravděpodobné, že účinnost léčby v této oblasti bude obdobná jako účinnost v jiných tkáních a změny kožního postižení nám tak dávají velmi levnou a poměrně přesnou informaci o účinnosti léčby.
Vyhodnocování plicní aktivity
Metodicky obtížným problémem je vyhodnocování aktivity nemoci v plicní tkáni. Obecně víme, že nemoc začíná proliferací Langerhansových buněk v terminálních bronchiolech, kde vytvoří uzlík – nodulus. A jakmile se tento nodulus vytvoří, dochází v něm ke změnám, které vedou k destrukci stěny bronchiolu a k vytvoření cysty. To je v první fázi zřetelné jako přechod do kavitovaného nodulu, dále do silnostěnné a posléze tenkostěnné cysty.
Tento proces je sledovatelný na HCRT plic. Přibývání nodularit signalizuje přibývání aktivity, ubývaní nodularit signalizuje zastavení další progrese nemoci. Vytváření cyst znamená již jen přechod do end stage disease, zvyšování počtu cyst nesignalizuje tedy progresi nemoci, ale jen přechod již vytvořené nemoci do její terminální podoby. Přesné vyhodnocování počtu nodularit však při běžném HRCT hodnocení není proveditelné. Proto hledali specialisté na PET/ CT možnost hodnotit plicní aktivitu nemoci pomocí měření difuzní aktivity plicního parenchymu.
Na PET/ CT skenech bylo možné diferencovat patologická ložiska s hypermetabolizmem glukózy, která se u našeho pacienta soustředila do oblastí lymfatických uzlin a skeletu. S ohledem na přítomnost plicního postižení LCH, prokázaného charakteristickým vývojem změn na HRCT plic, nás zajímalo, zdali má plicní patologie korelát v PET obrazu. V případě plicní LCH jde často téměř o difuzní proces, o četné drobné opacity, je tedy ve srovnání s normou difuzně zvýšená aktivita v plicním parenchymu, ale jasná ložiska patologického hypermetabolizmu na PET skutečně nelze najít. Toto platí obecně pro léze menší než 8 mm (ty však na CT patrné být mohou).
Přínos PET/ CT pro hodnocení ložiskové infiltrace orgánů je popsán asi ve 22 publikacích, ale doposud se pouze studie autorské skupiny Krajicek et al [65] věnuje možnosti hodnotit aktivitu LCH nemoci v plicích. Jako pozitivní označili její autoři nález zvýšeného metabolizmu radiofarmaka (18F FDG) v místech výskytu jednotlivých solidních nodulů, silnostěnných cyst a extrapulmonálních ložisek, ale také v oblastech hustého nahromadění drobných nodularit o průměru méně než 8 mm s difuzně mírně zvýšenou metabolickou aktivitou. V našich studiích byla v oblasti plicního parenchymu veškerá patologie pod rozlišením PET komponenty přístroje, velké aktivní léze jsme nenacházeli. Nezávisle na pozorování autorů Krajicek et al rozvádí námi popsaná nová metodika hodnocení difuzní metabolické aktivity plicního parenchymu dále jejich pozorování, představuje čtenářům možnost objektivizace výsledků porovnáním se současně měřenou aktivitou jaterního parenchymu a definuje jasná kritéria pro rozhodovací analýzu získaných dat (tab. 1). Jsme si vědomi, že námi zvolený způsob hodnocení není obvyklý a je při tak malých ložiscích i negativně zatížen tzv. „partial volume“ efektem, při kterém se větší ložisko zobrazí lépe než ložisko drobné se stejnou objemovou aktivitou.
Takto popsaná metodika hodnocení difuzní metabolické aktivity v plicích pomocí PET/ CT zobrazení s přesně definovanou rozhodovací analýzou je dle bibliografické databáze MEDLINE v českém i zahraničním odborném písemnictví zatím ojedinělá a nese v sobě velký potenciál pro další rozvoj a využití zejména v hodnocení diseminovaných drobnoložiskových plicních procesů.
Role kladribinu (2-chlorodeoxyadenosinu) v léčbě LCH
Účinnost kladribinu u této nemoci byla potvrzena mnoha popisy případů i menšími soubory pacientů a také dle našich předchozích zkušeností dosáhl tento lék vždy dlouhodobé léčebné odpovědi. První větší analýzu přínosu kladribinu pro tyto nemocné přinesla až první multicentrická studie, která analyzovala přínos kladribinu v souboru 92 pacientů. V případech, kdy pacienti měli nemocí postižené takzvané „rizikové orgány“ (plíce, játra, slezinu a krvetvorný systém), bylo léčebné odpovědi pomocí kladribinu (5 mg/ m2 i.v. 5 dní po sobě v 21denních intervalech) dosaženo u 22 %, zatímco 44 % pacientů při léčbě progredovalo. Dvouleté přežití bylo v této rizikové skupině dosaženo jen u 48 %.
Oproti tomu pacienti druhé skupiny, bez postižení rizikových orgánů, ale s opakovanými recidivami této nemoci v jiných orgánech, dosáhli léčebné odpovědi ve 62 % případech a pouze 11 % pacientů při léčbě progredovalo. Dvouleté přežití bylo dosaženo v této nízce rizikové skupině v 97 % případů. Vysoký počet léčebných odpovědí byl dosažen u pacientů s recidivujícím kostním postižením [66].
Námi popisovaný pacient měl dle výše uvedené definice multisystémové onemocnění s postižením jednoho rizikového orgánu – plic – a mimoto měla nemoc klinicky agresivní projevy a známky vyšší malignity při hodnocení proliferačních parametrů. Kladribin měl u této nemoci při monoterapii nedostatečný efekt, výraznějšího efektu bylo dosaženo při kombinaci kladribinu s cyklofosfamidem a kortikoidy. Ale i tak byl léčebný efekt velmi krátkodobý, do 2 měsíců od ukončení léčby nemoc progredovala. Proto jsme zvolili režim obsahující etoposid, režim, který se používá u agresivních lymfomů – CHOEP (cyklofosfamid, doxorubicin, vinkristin, etoposid a prednison). Po druhém podání tohoto režimu příznaky vymizely a při hodnocení léčebné odpovědi po 2 cyklech byla dle PET/ CT zřetelná výraznější odpověď, než byla dosažena po kladribinu. Také perianální pruritus, velmi citlivý indikátor aktivity nemoci, po druhém cyklu CHOEP vymizel. V průběhu zcela odpovídajícím výše citované studii u pacienta s agresivní formu LCH a s postižením nejméně jednoho z výše jmenovaných rizikových orgánů měl kladribin nedostatečný efekt.
Je to obdobné jako u maligních ne-hodgkinských lymfomů, u nichž kladribin dosahuje ve skupině nízce agresivních (indolentních) lymfomů (vla-satobuněčná leukemie, lymfoplazmocytární lymfom, lymfocytární lymfom) vysokého počtu léčebných odpovědí, zatímco u agresivních lymfomů (difuzní velkobuněčný B lymfom) není dostatečně účinný.
Závěry pro praxi
- Generalizované postižení uzlin nemusí být vždy jen maligní lymfom či metastatický rozsev tumoru, ale může se jednat i o histiocytózu z Langerhansových buněk. Pokud jsou přítomny B symptomy, znamená to velmi pravděpodobně agresivní průběh.
- Histologické hodnocení proliferační charakteristiky může upozornit na agresivní formu této nemoci.
- Práce popisuje novou metodiku PET/ CT vyhodnocování, které přináší sumární informaci o aktivitě této nemoci v plicích. Tato metoda je velmi vítaným přínosem, neboť v praxi nemáme jinou metodu, která by tímto způsobem dokumentovala vývoj plicní aktivity LCH.
- Léčba kladribinem (2-chlorodeoxyadenosinem) se osvědčuje u pacientů s LCH s nízkým rizikem, tj. např. při recidivujícím postižení skeletu, případně dalších tkání, ale bez prokazatelného postižení rizikových orgánů (plíce, játra, slezina, hemopoetická tkáň) [66]. V našem případě s postižením alespoň jednoho z výše jmenovaných rizikových orgánů a dále při vyšším proliferačním indexu a přítomných B symptomech měla léčba kladribinem nedostatečný efekt.
Tato publikace byla připravena v rámci projektu MUNI/ A/ 1012/ 2009 s názvem „Optimalizace diagnostiky a terapie maligních chorob a komplikací, které tyto maligní nemoci provázejí, s využitím nových molekulárně biologických metod” a také je součástí aktivit v rámci grantů IGA MZ: NR9225, NS10387 a NS10406.
MUDr. Petr Szturz
www.fnbrno.cz
e-mail: petr.szturz@fnbrno.czDoručeno do redakce: 8. 4. 2010
Přijato po recenzi: 30. 5. 2010
Zdroje
1. Adam Z, Pour L, Krejčí M et al. Histiocytóza z Langerhansových buněk u osob dospělého věku – nemoc s mnoha tvářemi. Zkušenosti jednoho pracoviště a přehled projevů nemoci. Vnitř Lék 2008; 54 : 1063 – 1081.
2. Adam Z, Krejčí M, Vorlíček J. Hematologie: přehled maligních hematologických nemocí. Praha: Grada Publishing 2008.
3. Ščudla V, Roček V, Dušek B et al. Multifokální eozinofilní granulom v dospělosti. Vnitř Lék 1987; 33 : 1078 – 1086.
4. Kodet R, Elleder M, Smelhaus V et al. Disseminated histiocytosis X. Česk Patol 1984; 20 : 19 – 26.
5. Kodet R, Zitková M. Morphologic and roentgenologic pulmonary findings in disseminated histiocytosis X. Česk Pediatr 1985; 40 : 634 – 638.
6. Howarth DM, Gilchrist GS, Mullan BP et al. Langerhans cell histiocytosis: diagnosis, natural history, management, and outcome. Cancer 1999; 85 : 2278 – 2290.
7. Liu YH, Fan XH, Fang K. Langerhans’ cell histiocytosis with multisystem involvement in an adult. Clin Exp Dermatol 2007; 32 : 765 – 768.
8. Takahashi T, Yoshimoto M, Kondoh N. Spontaneously regressed Langerhans cell histiocytosis of lymph nodes in an elderly patient. Intern Med 2007; 46 : 1757 – 1760.
9. Vassallo R, Ryu JH. Pulmonary Langerhans’ cell histiocytosis. Clin Chest Med 2004; 25 : 561 – 571.
10. Cheung N, Selva D, McNab AA. Orbital Langerhans cell histiocytosis in adults. Ophthalmology 2007; 114 : 1569 – 1573.
11. Smilek P, Krejčová B, Čada K et al. Histiocytóza z Langerhansových buněk, případ postižení spánkové kosti. Otorinolaryng Foniat 1994; 43 : 263 – 265.
12. Srikulmontree T, Massey HD, Roberts WN. Treatment of skeletal Erdheim ‑ Chester disease with zoledronic acid: case report and proposed mechanisms of action. Rheumatol Int 2007; 27 : 303 – 307.
13. Dogan AS, Conway JJ, Miller JH et al. Detection of bone lesions in Langerhans cell histiocytosis: complementary roles of scintigraphy and conventional radiography. J Pediatr Hematol Oncol 1996; 18 : 51 – 58.
14. Goo HW, Yang DH, Ra YS et al. Whole ‑ body MRI of Langerhans cell histiocytosis: comparison with radiography and bone scintigraphy. Pediatr Radiol 2006; 36 : 1019 – 1031.
15. Olschewski T, Seegenschmiedt MH. Radiotherapy for bony manifestations of Langerhans cell histiocytosis. Review and proposal for an international registry. Strahlenther Onkol 2006; 182 : 72 – 79.
16. Blum R, Seymour JF, Hicks RJ. Role of 18FDG ‑ positron emission tomography scanning in the management of histiocytosis. Leukem Lymphoma 2002; 43 : 2155 – 2157.
17. Weiss SE, O’Connor L, Welsh JS. Refinement of radiation therapy based on PET data in an adult with Langerhans cell histiocytosis of soft tissues. Clin Adv Hematol Oncol 2006; 4 : 290 – 294.
18. Kaste SC, Rodriguez ‑ Galindo C, McCarville ME et al. PET ‑ CT in pediatric Langerhans cell histiocytosis. Pediatr Radiol 2007; 37 : 615 – 622.
19. Hance AJ, Basset F, Saumon G et al. Smoking and interstitial lung disease. The effect of cigarette smoking on the incidence of pulmonary histiocytosis X and sarcoidosis. Ann N Y Acad Sci 1986; 465 : 643 – 656.
20. Mogulkoc N, Veral A, Bishop PW et al. Pulmonary Langerhans’ cell histiocytosis: radiologic resolution following smoking cessation. Chest 1999; 115 : 1452 – 1455.
21. Habib SB, Congleton J, Carr D et al. Recurrence of recipient Langerhans’ cell histiocytosis following bilateral lung transplantation. Thorax 1998; 53 : 323 – 325.
22. Brauner MW, Grenier P, Mouelhi MM et al. Pulmonary histiocytosis X: evaluation with high‑resolution CT. Radiology 1989; 172 : 255 – 258.
23. Soler P, Bergeron A, Kambouchner M et al. Is high‑resolution computed tomography a reliable tool to predict the histopathological activity of pulmonary Langerhans cell histiocytosis? Am J Respir Crit Care Med 2000; 162 : 264 – 270.
24. Canuet M, Kessler R, Jeung MY et al. Correlation between high‑resolution computed tomography findings and lung function in pulmonary Langerhans cell histiocytosis. Respiration 2007; 74 : 640 – 646.’
25. Leatherwood DL, Heitkamp DE, Emerson RE. Best cases from the AFIP: Pulmonary Langerhans cell histiocytosis. Radiographics 2007; 27 : 265 – 268.
26. Kim CK, Park CB, Jin U et al. Pulmonary Langerhans’ cell histiocytosis presented with recurrent pneumothorax. Interact Cardiovasc Thorac Surg 2006; 5 : 512 – 513.
27. Mendez JL, Nadrous HF, Vassallo R et al. Pneumothorax in pulmonary Langerhans cell histiocytosis. Chest 2004; 125 : 1028 – 1032.
28. Adams EP, Sauceda D, Oliver J et al. Isolated pulmonary Langerhans cell histiocytosis in a 17‑year ‑ old male. J Pediatr Hematol Oncol 2007; 29 : 121 – 124.
29. Aerni MR, Aubry MC, Myers JL et al. Complete remission of nodular pulmonary Langerhans cell histiocytosis lesions induced by 2’odeoxyadenosine in a non‑smoker. Respir Med 2008; 102 : 316 – 319.
30. Bernstrand C, Cederlund K, Sandstedt B et al. Pulmonary abnormalities at long term follow up of patients with Langerhans cell histiocytosis. Med Pediatr Oncol 2001; 36 : 459 – 468.
31. Bittenglova R, Pešek M, Mukenšnabl P et al. Granulomatóza z Langerhansových buněk. Stud Pneumol Phtiseol 2002; 62 : 196 – 202.
32. Green MB, Allen JN. Cough, dyspnea, and reticulonodular opacities in a 58‑year ‑ old smoker. Chest 2007; 132 : 700 – 703.
33. Rožánek P, Molnar V, Rešl M. Tři případy plicní granulomatózy z Langerhansových buněk. Lék Zpr Lék Fak Univ Karlovy Hr Králové 1998; 43 : 127 – 132.
34. Sundar KM, Gosselin MV, Chung HL et al. Pulmonary Langerhans cell histiocytosis: emerging concepts in pathobiology, radiology and clinical evolution of the disease. Chest 2003; 123 : 1673 – 1683.
35. Tazi A. Adult pulmonary Langerhans’ cell histiocytosis. Eur Respir J 2006; 27 : 1272 – 1285.
36. Zeppa P, Cozzolino I, Russo M et al. Pulmonary Langerhans cell histiocytosis (histiocytosis X) on bronchoalveolar lavage: a report of 2 cases. Acta Cytol 2007; 51 : 480 – 482.
37. Auerswald U, Barth J, Magnussen H. Value of CD ‑ 1 - positive cells in bronchoalveolar lavage fluid for the diagnosis of pulmonary histiocytosis X. Lung 1991; 169 : 305 – 309.
38. Tötsch M, Guzman J, Theegarten D et al. Bronchoalveolar lavage. Pathologe 2007; 28 : 346 – 353.
39. Fernandez Flores A, Mallo S. Langerhans cell histiocytosis of vulva. Dermatol Online J 2006; 12 : 15.
40. Ferreli C, Aste N, Pinna LA et al. Langerhans cell histiocytosis in an adult. J Eur Acad Dermatol Venereol 1997; 9 : 253 – 255.
41. Ferringer T, Banks PM, Metcalf JS. Langerhans cell sarcoma. Am J Dermatopathol 2006; 28 : 36 – 39.
42. Hagiuda J, Ueno M, Ashimine S et al. Langerhans cell histiocytosis on the penis: a case report. BMC Urol 2006; 6 : 28.
43. Mlyncek M, Uharcek P, Durcanský D. Vulvar Langerhans’ cell histiocytosis: a case report. Acta Obstet Gynecol Scand 2006; 85 : 753 – 755.
44. Tzung TY, Wu JC. Nonhealing perianal ulcers. Arch Dermatol 2005; 141 : 1161 – 1166.
45. Venizelos ID, Mandala E, Tatsiou ZA et al. Primary langerhans cell histiocytosis of the vulva. Int J Gynecol Pathol 2006; 25 : 48 – 51.
46. Munn S, Chu AC. Langerhans cell histiocytosis of the skin. Hematol Oncol Clin North Am 1998; 12 : 269 – 286.
47. Ashena Z, Alavi S, Arzanian MT et al. Nail involvement in langerhans cell histiocytosis. Pediatr Hematol Oncol 2007; 24 : 45 – 51.
48. Dina I, Copaescu C, Herlea V et al. Liver involvement in Langerhans’ cell histiocytosis. Case report. J Gastrointestin Liver Dis 2006; 15 : 57 – 59.
49. Griffiths W, Davies S, Gibbs P et al. Liver transplantation in an adult with sclerosing cholangitis due to Langerhans cell histiocytosis. J Hepatol 2006; 44 : 829 – 831.
50. Guthery SL, Heubi JE. Liver involvement in childhood histiocytic syndromes. Curr Opin Gastroenterol 2001; 17 : 474 – 478.
51. Hait E, Liang M, Degar B et al. Gastrointestinal tract involvement in Langerhans cell histiocytosis: case report and literature review. Pediatrics 2006; 118 : 1593 – 1599.
52. Choi SW, Bangaru BS, Wu CD et al. Gastrointestinal involvement in disseminated Langerhans cell histiocytosis (LCH) with durable complete response to 2-chlorodeoxyadenosine and high‑dose cytarabine. J Pediatr Hematol Oncol 2003; 25 : 503 – 506.
53. Konno S, Hizawa N, Betsuyaku T et al. Adult Langerhans cell histiocytosis with independently relapsing lung and liver lesions that was successfully treated with etoposide. Intern Med 2007; 46 : 1231 – 1235.
54. Baumann C, Reschke K, Jungehülsing M et al. Destruction of the vestibular organ by Langerhans’ cell histiocytosis. Eur Radiol 2006; 16 : 1177 – 1178.
55. Kürten T, Groeger M, Angerstein W. Frequency of hearing disorders in children with Langerhans’ cell histiocytosis. Laryngorhinootologie 2008; 87 : 96 – 99.
56. Amato MC, Elias LL, Elias J et al. Endocrine disorders in pediatric – onset Langerhans Cell Histiocytosis. Horm Metab Res 2006; 38 : 746 – 751.
57. Donadieu J, Rolon MA, Pion I et al. Incidence of growth hormone deficiency in pediatric onset Langerhans cell histiocytosis: efficacy and safety of growth hormone treatment. J Clin Endocrinol Metab 2004; 89 : 604 – 609.
58. Makras P, Alexandraki KI, Chrousos GP et al. Endocrine manifestations in Langerhans cell histiocytosis. Trends Endocrinol Metab 2007; 18 : 252 – 257.
59. Ottaviano F, Finlay JL. Diabetes insipidus and Langerhans cell histiocytosis: a case report of reversibility with 2-chlorodeoxyadenosine. J Pediatr Hematol Oncol 2003; 25 : 575 – 577.
60. Edelweiss M, Medeiros LJ, Suster S et al. Lymph node involvement by Langerhans cell histiocytosis: a clinicopathologic and immunohistochemical study of 20 cases. Hum Pathol 2007; 38 : 1463 – 1469.
61. Ornvold K, Ralfkiaer E, Carstensen H. Immunohistochemical study of the abnormal cells in Langerhans cell histiocytosis (histiocytosis x). Virchows Arch A Pathol Anat Histopathol 1990; 416 : 403 – 410.
62. Goh NS, McDonald CE, MacGregor DP et al. Successful treatment of Langerhans cell histiocytosis with 2-chlorodeoxyadenosine. Respirology 2003; 8 : 91 – 94.
63. Lazor R, Etienne ‑ Mastroianni B, Khouatra C et al. Progressive diffuse pulmonary Langerhans cell histiocytosis improved by cladribine chemotherapy. Thorax 2009; 64 : 274 – 275.
64. Büchler T, Cervinek L, Belohlavek O et al. Langerhans cell histiocytosis with central nervous system involvement: follow‑up by FDG ‑ PET during treatment with cladribine. Pediatr Blood Cancer 2005; 44 : 286 – 288.
65. Krajicek BJ, Ryu JH, Hartman TE et al. Abnormal fluorodeoxyglucose PET in pulmonary Langerhans cell histiocytosis. Chest 2009; 135 : 1542 – 1549.
66. Weitzman S, Braier J, Donadieu J et al. 2’ chlordeoxyadenosine (2 - Cda) as salvage therapy for Langerhans cell histiocytosis (LCH). Result of LCH ‑ S ‑ 98 protocol of the histiocyte society. Pediatr Blood Cancer 2009; 53 : 1271 – 1276.
67. George JC, Buckwalter KA, Cohen MD et al. Langerhans cell histiocytosis of bone: MR imaging. Pediatr Radiol 1994; 24 : 29 – 32.
68. Bruno MC, Del Basso De Caro ML, Panagiotopoulos K et al. Aggressive eosinophilic granuloma of the parietal bone. An immunohystochemical study of Ki ‑ 67 expression. J Neurosurg Sci 2006; 50 : 111 – 117.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2010 Číslo 11- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Autoimunitný polyglandulárny syndróm
- Lymfomu podobný průběh agresivní multisystémové histiocytózy z Langerhansových buněk
- Jiný pohled na akutní krvácení do horního trávicího traktu u pacientů s jaterní cirhózou
- Stratifikace rizika pomocí zátěžového SPECT zobrazení myokardu v kombinaci se stanovením koronárního kalciového skóre u rizikových pacientů s diabetem a/ nebo ledvinným selháním
- Stanovenie progresie karcinómu prostaty využitím metodiky RT‑PCR
- Inhibitory angiotenzin konvertujícího enzymu a blokátory receptorů pro angiotenzin II v léčbě fibrilace síní
- Osteoporóza pri chronickej obštrukčnej chorobe pľúc
- Doporučený postup pro diagnostiku a léčbu chronické obstrukční plicní nemoci (CHOPN) – stabilní fáze
- Metastatické postihnutie srdca a perikardu – MR kazuistiky
- Difuzní plošná normolipemická xantomatóza a nekrobiotický xantogranulom, asociované s monoklonální gamapatií – přínos PET‑ CT pro stanovení rozsahu nemoci a zkušenosti s léčbou. Popis dvou případů a přehled literatury
- Autoimunitný polyglandulárny syndróm typ 2 asociovaný s autoimunitnou hypofyzitídou a coeliakiou
- Lymfomu podobný průběh agresivní multisystémové histiocytózy z Langerhansových buněk v dospělosti a přínos PET/ CT vyšetření při hodnocení difuzní metabolické aktivity v plicním parenchymu
- Centrální pravostranná hemiparéza jako dominující projev systémové vaskulitidy
- Profesor MU Dr. František Pór a profesor Dr. Med. Robert Klopstock, poslucháči Lekárskych fakúlt v Budapešti a v Prahe
- Pokroky ve výzkumu aterosklerózy
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Centrální pravostranná hemiparéza jako dominující projev systémové vaskulitidy
- Autoimunitný polyglandulárny syndróm typ 2 asociovaný s autoimunitnou hypofyzitídou a coeliakiou
- Lymfomu podobný průběh agresivní multisystémové histiocytózy z Langerhansových buněk v dospělosti a přínos PET/ CT vyšetření při hodnocení difuzní metabolické aktivity v plicním parenchymu
- Autoimunitný polyglandulárny syndróm
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



