-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Neuroendokrinní nádory žaludku
Gastric neuroendocrine tumors
The aim of the article is to present the state ‑ of ‑ the art in terms of diagnosis and therapy of these rare, usually biologically inactive neuroendocrine tumors, being classified into three main types. They differ from each other according to the conditions of their origin, biological properties and management. Recent classification according to WHO and ENETS (European Neuroendocrine Tumor Society) and proposal of TNM classification are presented. Diagnostic methods and therapeutical procedures, including experimental approaches, are outlined.
Key words:
endoscopic mucosal resection – neuroendocrine tumors – proliferation index – somatostatin analogues
Autoři: O. Louthan
Působiště autorů: Ambulance pro neuroendokrinní nádory IV. interní kliniky 1. lékařské fakulty UK a VFN Praha, přednosta prof. MU Dr. Aleš Žák, DrSc.
Vyšlo v časopise: Vnitř Lék 2009; 55(10): 961-966
Kategorie: Přehledné referáty
Souhrn
Článek předkládá současný pohled na klasifikaci a diagnostiku a léčbu těchto relativně vzácných, většinou endokrinně nefunkčních nádorů. Neuroendokrinní tumory žaludku se dělí do tří hlavních skupin, lišících se podmínkami vzniku, biologickými vlastnosti, prognózou a léčbou. Článek prezentuje recentní klasifikaci tumorů podle kritérií WHO a ENETS (European Neuroendocrine Tumor Society), návrh TNM klasifikace a uvádí přehled diagnostiky a léčby včetně experimentálních, dosud rutinně neužívaných postupů.
Klíčová slova:
analoga somatostatinu – endoskopická slizniční resekce – neuroendokrinní nádory – proliferační indexÚvod
Termínem neuroendokrinní nádory (NET) označujeme podle nomenklatury WHO nádory dříve označované jako karcinoidy. Podle této novější terminologie [1] má být termín karcinoid používán pouze pro NET vycházející z tenkého střeva a manifestující se typickým karcinoidovým syndromem (tab. 3). Nicméně v literatuře se stále udržuje termín karcinoid i pro NET jiných lokalizací. Podle starší terminologie Williamse a Sandlera z roku 1963 [2] se karcinoidy dělí na 3 skupiny podle toho, z jaké části embryonálního střeva se vyvinuly orgány, ve kterých se objevil karcinoid jako primární nádor – na foregut karcinoidy (z přední části střeva), midgut karcinoidy (střední část střeva) a hindgut karcinoidy (zadní část embryonálního střeva). Podle starší terminologie patří tedy NET žaludku k foregut karcinoidům. Základní klasifikační schéma pro všechny gastroenteropankreatické neuroendokrinní nádory podle WHO z roku 2000 dělí tyto nádory do 3 skupin bez ohledu na lokalizaci [1,4]:
- skupina 1: dobře diferencované endokrinní nádory s
- a) benigním nebo
- b) nejistým chováním v době diagnózy
- skupina 2: dobře diferencované endokrinní karcinomy s nízkým stupněm malignity
- skupina 3: špatně diferencované endokrinní karcinomy s vysokým stupněm malignity
Četnost a rozdělení neuroendokrinních tumorů žaludku
Žaludeční neuroendokrinní tumory (GNET) tvoří v Evropě 2–8% neuroendokrinních tumorů (NET) zažívacího traktu, v Japonsku až 30% všech gastrointestinálních NET. Roční incidence všech NET je uváděna 2/100 000, ale tyto nádory jsou nezřídka poddiagnostikované [3]. V zásadě vznikají
- a) pod dlouhodobým vlivem gastrinu anebo
- b) sporadicky, bez vlivu tohoto hormonu
GNET se rozdělují na 3 typy (tab. 1), pokud započítáme i vzácnou formu špatně diferencovaného neuroendokrinního karcinomu, pak rozeznáváme 4 typy. Typ 1 představuje 70–80% všech případů NET žaludku, následovaný typy 3, 2 a 4, jak je uvedeno dále.
Tab. 1. Typy žaludečních neuroendokrinních tumorů – přehled. 
Tab. 2. Obecné charakteristiky žaludečních neuroendokrinních nádorů typu 1–3. 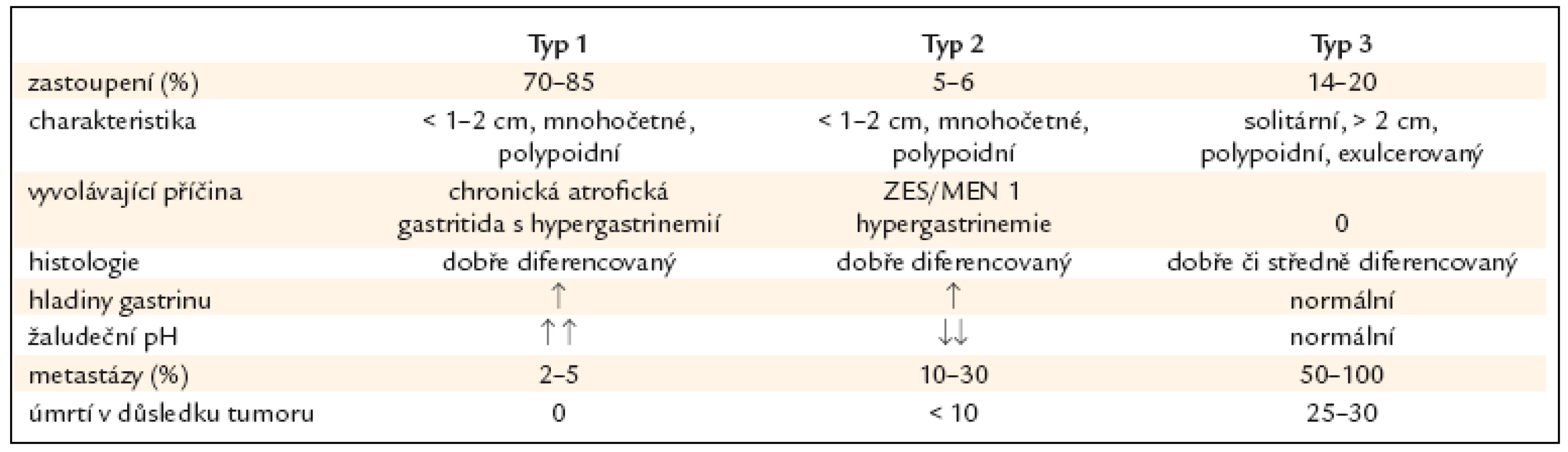
Tab. 3. WHO klasifikace žaludečních neuroendokrinních nádorů. 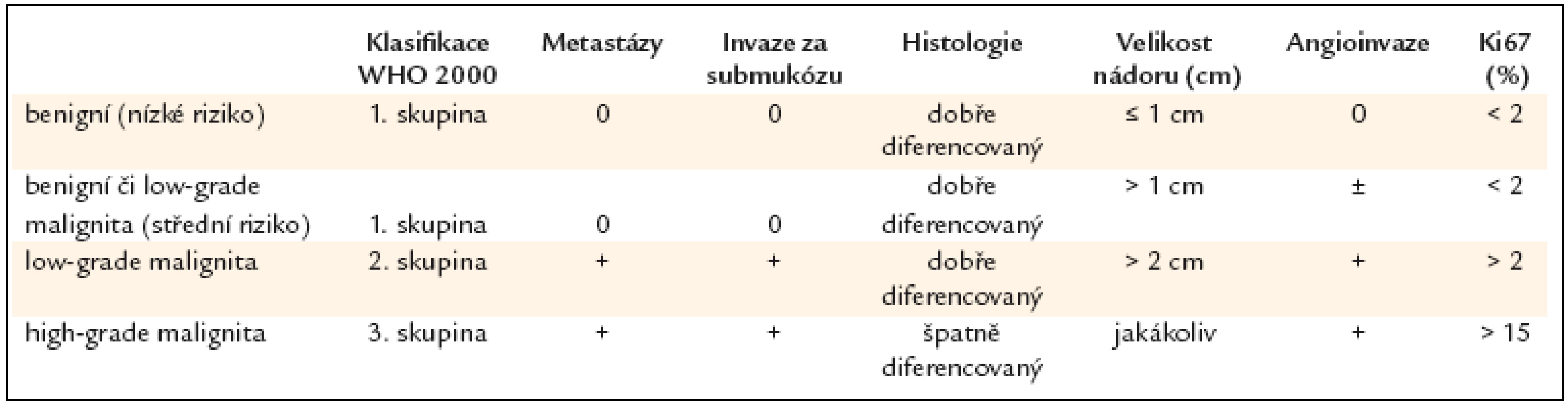
Typy 1 a 2 jsou žaludeční NET vycházející z enterochromafinních buněk (ECL buňky) pod dlouhodobým vlivem gastrinu, nádory vycházející z těchto buněk se ligvisticky ne zcela ideálně označují jako ECLomy [4,5].
Přehled a klinika neuroendokrinních nádorů žaludku
Typ 1 (ECLomy, vznikající pod vlivem atrofické gastritidy) se vyskytují většinou u žen v 5.–7. životní dekádě. Jde o nejčastější endokrinní žaludeční nádory, jež představují 70–85% endokrinních žaludečních tumorů. Jsou endokrinně nefunkční, nejsou tedy provázeny symptomy z hormonální nadprodukce, bývají zjištěné náhodně při endoskopickém vyšetření provedeném pro různé zažívací obtíže [5,7,27]. ECLomy se vyskytují v žaludečním fundu jako mnohočetné, drobné polypoidní útvary menší nežli 1cm v počtu 2–20 ložisek.
Vznikají v terénu atrofické gastritidy,s vymizením žlázek s parietálními buňkami. Důsledek je deficitní produkce HCl, stimulující antrální G buňky k dlouhodobé nadprodukci gastrinu. Předpokládá se, že hypergastrinemie stimuluje růst EC buněk, takže dochází k mikronodulární hyperplazii a později ke vzniku tumoru. Nicméně se zdá, že gastrin sám o sobě není odpovědný za vznik těchto tumorů, neboť tumor může vzniknout i v terénu parciální atrofické gastritidy [6]. Na vzniku těchto NET zřejmě participují i růstové faktory, jako jsou bázický fibroblastový růstový faktor (bFGF) a faktor B cell leukemia/lymphoma 2.
Nádory tohoto typu patří podle WHO klasifikace z roku 2000 k 1. skupině (tab. 3), tj. k tumorům s benigním nebo nejistým chováním, jsou to v naprosté většině prakticky benigní léze s nízkým rizikem hlubší invaze do žaludeční stěny [7,8]. Toto riziko je vztaženo k velikosti nádoru. Klinicky jsou asymptomatické. Jejich prognóza je většinou dobrá, dají se odstranit endoskopicky, problémem je někdy jejich značný počet. Metastázy se ve vzácných případech vyskytují u těch tumorů, které infiltrují muscularis propria anebo které jsou větší než 2cm.
Typ 2 jsou ECLomy vyskytující se v průběhu Zollinger-Ellisonova syndromu (ZES) prakticky výlučně v rámci mnohočetné endokrinní neoplazie 1. typu (MEN1) zhruba u 1/4 všech případů MEN1 [9–11]. U sporadických gastrinomů bez MEN1 se naproti tomu ECLomy vyskytují jen u 1–3%. Genetické změny podmiňující vznik MEN1 jsou zřejmě nutné pro vznik těchto tumorů. Nádor postihuje obě pohlaví stejně často, nejčastěji osoby kolem 50. roku věku. Objevuje se v 6% případů žaludečních NET. Jde o menší, mnohočetné polypy o velikosti 1–2cm, které mohou postihovat téměř celou sliznici fundu. Tumory vycházejí z parietálních buněk žlázek žaludeční sliznice, které nejsou atrofické, ale hypertrofické [12]. Nádory jsou většinou asymptomatické. V porovnání s typem 1 má typ 2 až ve 35% případů v době diagnózy založeny metastázy, hlavně u větších primárních nádorů.
Typ 3. Tumory tohoto typu jsou sporadické, obvykle jsou solitární, bez vazby na chronickou atrofickou gastritidu a gastrin. Vyskytují se u osob starších 50 let. Představují 14–20% žaludečních NET. Nádory patří většinou k dobře diferencovaným neuroendokrinním karcinomům, tedy ke 2. skupině podle WHO klasifikace z roku 2000 (tab. 3). Jsou větší než 2cm, vyznačují se infiltrativním růstem a jejich proliferační index podle markeru Ki67 je > 2%. Mohou postihnout jakoukoli část žaludku bez predilekce, ale převážně se nachází ve fundu a v těle žaludku. V 70% případů jsou zjištěny metastázy v lymfatických uzlinách.
Klinicky se manifestují bolestmi břicha, nechutenstvím, hubnutím, krvácením s hematemezou či melénou, anemizací, někdy se zjistí náhodně při vyšetření indikovaném z jiných důvodů [24,27]. Velmi vzácné jsou nádory s produkcí histaminu, které se pak manifestují atypickým karcinoidovým syndromem. Tento syndrom se projevuje světle červeným flushem postihujícím obličej, krk a trup, průjmy, epizodami tachykardie, bronchokonstrikcí. Navíc v porovnání s typickým karcinoidovým syndromem přítomným u karcinoidů tenkého střeva dochází u žaludečního NET typu 3 vlivem produkce histaminu k otokům obličeje, očních víček a k lakrimaci.
Typ 4 je špatně diferencovaný, malobuněčný neuroendokrinní karcinom, řazený do 3. skupiny podle klasifikace WHO z roku 2000. Jde o vzácný nádor, některé práce jej proto jako 4. typ neuvádějí. Není vztah k chronické atrofické gastritidě. Imunohistochemicky lze prokázat synaptophysin a v určitém rozsahu i chromogranin A. Nádory se vyskytují ve věku od 60 do 70 let, častěji u mužů než žen. V době diagnózy jde o velké (> 4cm), obvykle exulcerované nádory se symptomy podobnými žaludečním adenokarcinomům, s krvácením, případně obstrukcí žlučových cest, hubnutím. Jejich prognóza je špatná, 3/4 pacientů zemřou do 1 roku od diagnózy.
Mimo uvedené typy se zcela výjimečně vyskytují velkobuněčné špatně diferencované neuroendokrinní karcinomy anebo smíšené endokrinní-exokrinní karcinomy (endokrinní diferenciace je větší než 30%).
Patologie
Histologie je nezbytná pro stanovení správné diagnózy, samotná cytologie nepostačuje. Histologické vyšetření se provádí z bioptického materiálu získaného při gastroskopii anebo z malých karcinoidů typu 1 a 2 odstraněných pomocí endoskopické slizniční resekce (endoscopic mucosal resection – EMR). Jsou li polypy mnohočetné, pak je třeba též provést biopsii ze sliznice fundu i mimo oblast polypů s cílem potvrdit případnou asociovanou atrofickou gastritidu. V případě atrofické gastritidy mohou být přítomny polypy různého původu, může jít o zánětlivé či hyperplastické polypy, časné adenokarcinomy či ECLomy, proto je nutno vzít bioptické vzorky z více nádorových lézí, zejména když makroskopický vzhled je vzájemně odlišný. Mimo konvenční barvení hematoxylin eozinem je potřebné imunohistochemické vyšetření na chromogranin a synaptofyzin, což je podle ENETS minimální požadavek na imunohistochemické vyšetření. Tumor je třeba zhodnotit podle WHO klasifikace (tab. 3). Je nutný výpočet proliferačního indexu Ki67. Některá pracoviště provádí zhodnocení mitotického indexu spočítáním 10 HPF (high power field – 2 mm2). U typů 1 a 2 je index Ki67 většinou nízký, nepřesahuje 1–2%, mitotická aktivita je rovněž nízká. Nezvýšená mitotická aktivita je hodnocena jako počet mitóz nepřevyšující hodnotu 0,3/10 HPF (2 mm2). Pokud jde o izolované GNET (typ 3), Ki67 je u nich často zvýšen nad 2%.
Tab. 4. Návrh gradingu NET tumorů podle ENETS. 
1 10 HPF (high power field = 2 mm2), alespoň 40 polí hodnocených v oblasti s nejvyšší mitotickou aktivitou, 2 protilátka MIB 1; procento z 2 000 buněk v oblastech s nejvyšším jaderným značením Asi 80% všech žaludečních NET vykazuje grading G1, 5% NET grading G2 a G3 zhruba v 15% [14].
U typů 1 nebo 2 není nutno provést vyšetření na p53 nebo na přítomnost somatostatinových receptorů typu 2A. Výskyt většiny ECLomů je předcházen či provázen lineární nebo mikronodulární hyperplazií či dysplazií ECL buněk. Tento stav znamená u nemocných s chronickou atrofickou gastritidou 26násobné riziko vzniku ECLomů [11].
K 1. typu GNET: tumory jsou malé, 0,3–1cm, dobře diferencované, solidní, jsou složeny z ECL buněk silně pozitivních na synaptofyzin a chromogranin A, proliferační index Ki67 < 2%. Pokud vzácně tyto buňky produkují histamin, lze je specificky detekovat pomocí VMAT2 (vesicular monoamine transporter 2). I mimo oblast nádoru je vždy přítomna hyperplazie ECL buněk v oblasti parietálních buněk.
K typu 3: Jde o dobře diferencovaný tumor skládající se většinou z ECL buněk, má histologicky solidní nebo trabekulární strukturu a proliferační index 2–5%. Tumory z EC buněk, produkující serotonin, jsou velmi vzácné. Pokud je tumor větší než 2cm, invaduje do svalové vrstvy a projevuje známky angioinvaze. Metastázy jsou časté, zejména do jater.
Genetické vyšetření
Testování zárodečných mutací DNA se doporučuje při pozitivní rodinné anamnéze MEN1, anebo pokud jsou v žaludku přítomny mnohočetné tumory bez průvodní chronické atrofické gastritidy. Genetické vyšetření je nutno provést i při podezření na MEN1 [13].
V případě suspekce nebo přítomnosti ZES je třeba též provést genetické vyšetření na uvedený hereditární nádorový syndrom. Jak bylo zmíněno, ECLomy u nemocných se Zollinger Ellisonovým syndromem velmi často vyskytují v rámci MEN1.
Genetické vyšetření by mělo zahrnovat mutační screening a sekvenování s analýzou celého kódujícího genu, sestřihových míst. Detekce somatických mutací DNA není nutná.
TNM klasifikace
Nově byla v návrhu vypracována TNM klasifikace neuroendokrinních tumorů žaludku (tab. 5 a 6) [14].
Tab. 5. Návrh na TNM klasifikací neuroendokrinních tumorů žaludku podle ENETS. 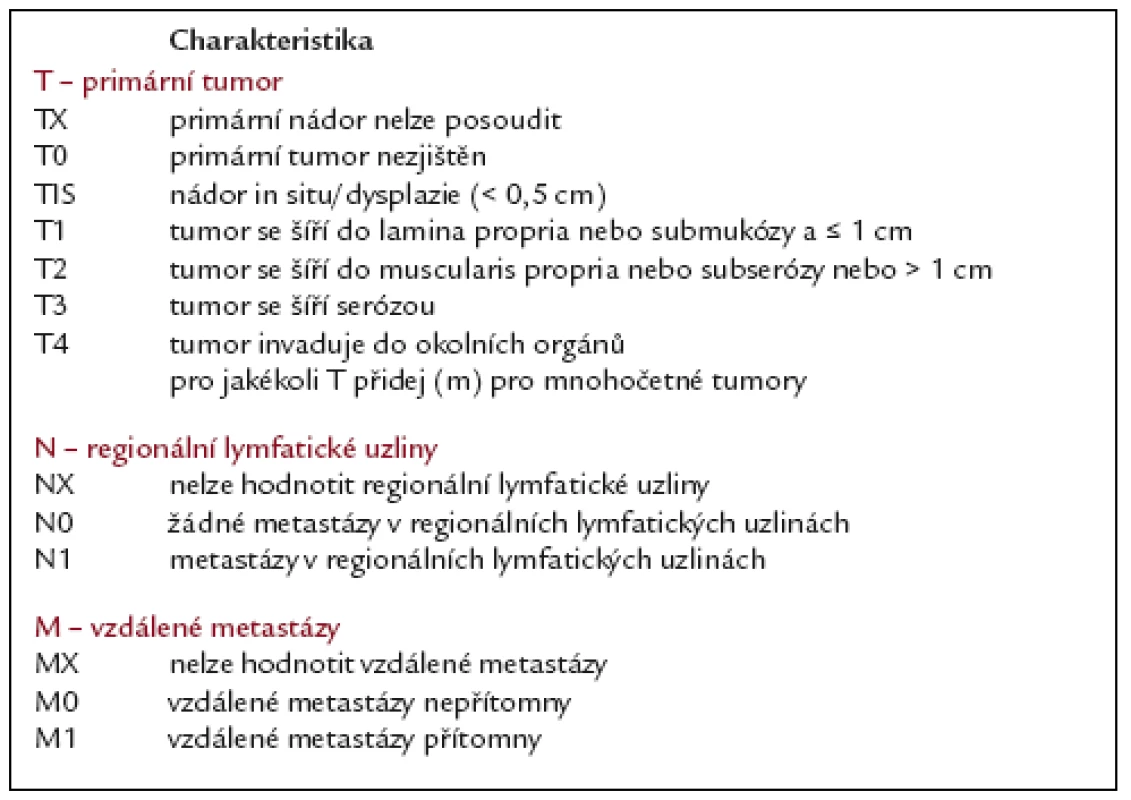
Tab. 6. Návrh stagingu neuroendokrinních tumorů žaludku podle ENETS. 
Diagnostika
Lokalizační vyšetření
V diagnostice GNET je zásadní horní endoskopie. Transabdominální sonografie, CT a MRI mají v detekci těchto primárních nádorů omezený přínos. V případě malých tumorů o velikosti < 1cm je endoskopie postačující lokalizační technikou. Endosonografie umožňuje posoudit hloubku invaze do žaludeční stěny.
V případě větších GNET s vyšším rizikem metastazování a zejména v případě sporadického typu 3 je třeba provést pečlivý staging. Endosonografie je vhodná i k detekci metastáz v regionálních lymfatických uzlinách a popřípadě k provedení biopsie. K průkazu jaterních metastáz slouží CT, MRI anebo transabdominální sonografie, jinak tato vyšetření nejsou u GNET typu 1 a u malých tumorů typu 2 nutná. Ke stagingu nezbytně patří somatostatinová receptorová scintigrafie (octreoscan s 111Indiem), jež je vhodná u diferencovaných nádorů s expresí somatostatinových receptorů k průkazu intraabdominálních i extraabdominálních (např. kostních) metastatických ložisek a k predikci možného léčebného efektu somatostatinových analogů.
Biochemická vyšetření
U žaludečních karcinoidů je též třeba provést vyšetření gastrinu s cílem zjistit, o jaký subtyp NET žaludku se jedná (tab. 1). Dále se u všech subtypů GNET provádí vyšetření sérového chromograninu A [13,14]. Jeho hladina je zvýšena u dobře diferencovaných forem, ale může být i normální u špatně diferencovaných neoplazií. U chronické atrofické gastritidy se doporučuje provést vyšetření protilátek proti parietálním buňkám a intrinsic faktoru.
Odpady 5-hydroxyindoloctové kyseliny (5-HIO) bývají u žaludečních NET v normě. Při nadprodukci serotoninu je možno jej biochemicky prokázat v séru či v trombocytech, nicméně vlivem enzymatické blokády na úrovni dekarboxylázy aromatických L-aminokyselin (AADC), měnící 5-hydroxytryptofan na serotonin, jde o poměrné vzácné případy.
Minimální požadavky na diagnostiku GNET podle konsensu ENETS
GNET jsou diagnostikovány pomocí gastroskopie s biopsií (2 vzorky z antra, 4 vzorky z fundu a biopsie z největšího polypu). U nádorů typu 1 a malých tumorů typu 2 je gastroskopie postačující. U tumorů typu 1 a 2 větších než 1cm se doporučuje provedení endosonografie. CT, MRI a octreoscan nejsou zde požadovány, s výjimkou invazivních forem tumorů, zejména typu 3, potvrzených endosonograficky a s výjimkou větších nádorů. Minimální požadavky na biochemické testy je vyšetření gastrinu a chromograninu A v séru. Mimo vstupního vyšetření se doporučuje provádět testy v rámci pravidelných kontrol.
Léčba
Radikální endoskopická a chirurgická léčba
U pacientů s ECLomy typu 1 a 2 menších než 10mm se obvykle doporučuje endoskopické odstranění. Pokud jsou nádory větší, je nutná endoskopická resekce až u 6 polypů nezasahujících do muscularis propria (podle endosonografie) [15]. U ostatních pacientů se doporučuje chirurgické odstranění. Antrální resekce s cílem zamezit opakované, chronické stimulaci ECL buněk gastrinem je efektivní u 80% tumorů typu 1. V případě maligního vývoje nebo v případě rekurence, ke které dochází i přes lokální resekci, je třeba provést parciální nebo totální gastrektomii s resekcí lymfatických uzlin. U nemocných s typem 3 je chirurgický výkon a jeho potřebný rozsah v principu stejný jako u adenokarcinomů (parciální nebo totální gastrektomie s odstraněním lymfatických uzlin). Není li možno operovat radikálně, přichází podle situace v úvahu paliativní chirurgický výkon.
Paliativní léčba
Somatostatinová analoga [16–18]
Na ECL buňky mají antiproliferativní vliv somatostatinová analoga (octreotid, lanreotid a nověji pasireotid neboli SOM230). Podmínkou zahájení léčby analogy somatostatinu je pozitivita somatostatinových receptorů na nádorových buňkách, potvrzená octreoscanem. Po léčbě analogy byla prokázána cytoredukce nádoru, nicméně podle současného konsensu se v praxi analoga u GNET paušálně nedoporučují. Jsou indikována, pokud se manifestují karcinoidovým syndromem, což je u GNET ovšem vzácné. Analoga se proto nedoporučují u typu 1 a u typu 2, které jsou endokrinně nefunkční, doporučují se jen tehdy, pokud je tumor spojen se Zollinger Ellisonovým syndromem. Vhodnější by byly GNET 3. typu, zejména asociovaného s karcinoidovým syndromem.
Chemoterapie
Chemoterapie je indikována u metastazujícího nádoru 3. typu. U typů 1 a 2chemoterapie jen v těch vzácných případech, kdy metastazují a nejsou radikálně operabilní [19–21]. Výběr cytostatické kombinace závisí na stupni diferenciace nádoru, response rate je však nízký (10–20% podle různých literárních údajů), větší zkušenosti s touto léčbou nejsou [22].
Aktinoterapie
Generalizované neuroendokrinní nádory žaludku nejsou indikovány k externí radioterapii [23,24]. Slibné paliativní účinky u NET nabízí peptidová receptorová radionuklidová terapie (PRRT) [25]. V řadě evropských zemí je používána v rámci klinických studií. V České republice není tato léčba zatím zavedena. První pacienti v ČR byli ošetřeni ve spolupráci s pracovištěm v Bad Berka v Německu. PRRT se provádí čistými β zářiči 90Yttrium nebo 177Lutetium, navázanými na analoga somatostatinu prostřednictvím tetra-aza-cyklo-dodekan-tetraoctové kyseliny (DOTA), tedy 90Y-DOTA, Tyr3 – octreotid a 177Lu-DOTA, Tyr3 – octreotate. Tím je zajištěno ozáření přímo v nádorové tkáni. Podmínkou zahájení léčby je pozitivita somatostatinové receptorové scintigrafie (octreoscan). Experimentálně se provádí i cílené ozáření jaterních metastáz metodou SIRT (Selective Internal Radiation Therapy) se zavedením mikrosfér s navázaným 90Yttriem do větví a. hepatica zásobujícím jaterní metastázy. Zde pozitivita octreoscanu není ovšem nutná. Nevýhodou metody SIRT je finanční náročnost a nutnost speciálního proškolení týmu invazivních radiologů.
Kontroly
V případě ECLomů typu 1 a 2 není dosud jasné, jaký je optimální interval pro provádění endoskopických kontrol v závislosti na počtu a velikosti nádorů a efektivitě předchozí EMR (endoscopic mucosal resection). Vzhledem k dobré prognóze se [26] obvykle doporučují kontroly každé 2 roky u typu 1a každoročně u typu 2 s provedením EMR u polypů větších 10mm. U nemocných s chronickou atrofickou gastritidou je riziko adenokarcinomu žaludku vznikajícího z intestinální metaplazie též důvodem k biopsii žaludeční sliznice. U karcinoidu typu 3, tedy u maligní, sporadické formy, s významně horší prognózou nežli u typů 1 a 2 [27,28], závisí četnost kontrol na subtypu nádoru. U dobře diferencovaných subtypu nádoru typu 3 po kurativní resekci se provádí zobrazovací vyšetření a vyšetření sérového chromograninu A v 6měsíčních intervalech po dobu 2 let a poté 1krát ročně po dobu nejméně 3 roků. U dobře diferencovaných metastazujících NET se provádějí kontroly pomocí CT nebo MRI každé 3 měsíce, s průvodní paliativní nebo symptomatickou léčbou.
Závěr
Neuroendokrinní tumory žaludku, dle starší nomenklatury karcinoidyžaludku, se dělí na 4 typy, z nichž typ 1 vzniká na podkladě hypergastrinemie a dalších vlivů při autoimunitní gastritidě, typ 2 v rámci Zollinger-Elisonova syndromu. Patří mezi nádory hraničně maligní, nemanifestují se karcinoidovým syndromem. Léčba spočívá v bioptickém snesení nádorového ložiska. Sporadický typ 3 roste bez vlivu gastrinu a je maligní, typ 4 je vzácný malobuněčný maligní typ. Článek prezentuje diagnostiku a léčebné možnosti pro tyto nádory v různém stupni pokročilosti a zmiňuje též perspektivy léčby.
Podpořeno výzkumným záměrem MŠMT 00216200808.
MUDr. Oldřich Louthan
www.vfn.cz
e mail: louthan@post.cz
Zdroje
1. Solcia E, Klöppel G, Sobin, LH. Histological Typing of Endocrine Tumours. Second Edition, World Health Organisation, International Histological Classification of Tumours. Berlin, New York: Springer 2000.
2. Williams ED, Sandler M. The classification of carcinoid tumours. Lancet 1963; 281 : 238 – 239.
3. Modlin IM, Kidd M, Latich I et al. Current status of gastrointestinal carcinoids. Gastroenterology 2005; 128 : 1717 – 1751.
4. Kloppel G, Perren A, Heitz PU. The gastroenteropatic neuroendocrine cell system and its tumors: the WHO classification. Ann NY Acad Sci 2004; 1014 : 13 – 27.
5. Thomas RM, Baybick JH, Elsayed AM et al. Gastric carcinoids: an immunohistochemical and clinicopathological study of 104 patients. Cancer 1994; 73 : 2053 – 2058.
6. Varro A, Kenny S, Pritchard DM et al. Functional Regulation of the ECL Cell. 172 – 177. In: A Century of Advanced in Neuroendocrine Tumor Biology and Treatment. Managing Editor Irvin Modlin. Published by Felsenstein C.C.C.P. 463.
7. Ruszniewski P, Delle Fave G, Cadiot Get al. Well‑Differentiated Gastric Tumors/Carcinomas. In: Neuroendocrinology, Basel: Karger AS 2006, Vol. 84, No. 3, 158 – 164.
8. Modlin IM, Lye KD, Kidd M. A 50‑year analysis of 13,715 carcinoid tumors. Cancer 2003; 97 : 934 – 959.
9. Norton JA, Melcher ML, Gibril F et al. Gastric carcinoid tumors in multiple endocrine neoplasia - 1 patients with Zollinger - Ellison syndrome can be symptomatic, demonstrate aggressive growth, and require surgical treatment. Surgery 2004; 136 : 1267 – 1274.
10. Lehy T, Cadiot G, Mignon G et al. Influence of multiple endocrine neoplasia type 1 on gastric endocrine cells in patients with Zollinger ‑ Ellison syndrome. Gut 1992; 33 : 1275 – 1279.
11. Klöppel G, Rindi G, Anlauf M et al. Site ‑ specific biology and pathology of gastroenteropancreatic neuroendocrine tumors. Virchows Arch 2007; 451 (Suppl 1): S9 – S27.
12. Bordi C, D’Adda T, Azzoni C et al. Hypergastrinemia and gastric enterochromaffin‑like cells. Am J Surg 1995; 19 (Suppl 1): S8 – S19.
13. Leotlela PD, Jauch A, Holtgreve - Grez H et al. Genetics of neuroendocrine and carcinoid tumours. Endocrine‑related Cancer 2003; 10 : 437 – 450.
14. Rindi G, Klöppel G, Ahlman H et al. TNM staging of foregut (neuro)endocrine tumors: a consensus proposal including a grading system. Virchows Arch 2006; 449 : 395 – 401.
13. Peracchi M, Gebbia C, Basilisco G et al. Plasma chromogranin A in patients with autoimmune chronic atrophic gastritis, enterochromaffin‑like cell lesion and gastric carcinoids. Eur J Endocrinol 2005; 152 : 443 – 448.
14. Granberg D, Stridsberg M, Seensalu Ret al. Plasma chromogranin A in patientswith multiple endocrine neoplasia type 1.J Clin Endocrin Metab 1999; 84 : 2712 – 2717.
15. Brugge WR. The Role of Endoscopy and Endoscopic Ultrasound in the Management of Upper GI and Pancreatic Neuroendocrine Tumors. In: A Century of Advances in Neuroendocrine Tumor Biology and Treatment 2006, 308 – 315.
16. Tomassetti P, Migliori M, Caletti GC et al. Treatment of type II gastric carcinoid tumors with somatostatin analogues. N Engl J Med 2000; 343 : 551 – 554.
17. Tomassetti P, Migliori M, Caletti GC et al. Treatment of type II gastric carcinoid tumors with somatostatin analogues. N Engl J Med 2000; 343 : 551 – 554.
18. Arnold R, Simon B, Wied M et al. Treatment of Neuroendocrine GEP Tumours with Somatostatin Analogues. Digestion 2000; 62 (Suppl 1): 84 – 91.
19. Rindi G, Solcia E Gastric Neuroendocrine Tumors – Carcinoid and Poorly Differentiated Carcinoma, 246 – 253. In: A Century of Advanced in Neuroendocrine Tumor Biology and Treatment. Managing Editor Irvin Modlin. Published by Felsenstein C.C.C.P., 463.
20. Ahlman H, Kolby L, Lundell L et al. Clinical management of gastric carcinoid tumors. Digestion 1994; 55 (Suppl 3): 77 – 85.
21. Gustafsson BI, Kidd M, Drozdov I et al. The Enterochromaffine Cell. 178 – 191. In: A Century of Advanced in Neuroendocrine Tumor Biology and Treatment. Managing Editor Irvin Modlin. Published by Felsenstein C.C.C.P., 463.
22. Tiensuu Janson EM, Öberg K. Carcinoid tumours. Bailliere’s Clinical Gastroenterology. 1996; Vol. 10, No. 4.
23. Becker HD, Gabriel A. Therapy of carcinoids of the stomach. Langenbecks Arch. Chir 1996; 381 : 18 – 22.
24. Modlin IM, Lye KD, Kidd M. Carcinoid tumors of the stomach. Surg Oncol 2003; 12 : 153 – 172.
25. Lewington WJ. Targeted radionuclide therapy for neuroendocrine tumour. Endocrine - Related Cancer 2003; 10 : 497 – 501.
26. Rindi G, Azzoni C, La Rose S et al. ECL cell tumor and poorly differentiated endocrine carcinoma of the stomach: prognostic evaluation by pathological analysis. Gastroenterology 1999; 116 : 532 – 542.
27. Granberg D, Wilander E, Stridsberg M et al. Clinical symptoms, hormone profiles, treatment, and prognosis in patients with gastric carcinoids. Gut 1998; 43 : 223 – 228.
28. Rindi G, Azzoni C, La Rose S et al. ECL cell tumor and poorly differentiated endocrine carcinoma of the stomach: prognostic evaluation by pathological analysis. Gastroenterology 1999; 116 : 532 – 542.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2009 Číslo 10- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Prim. MUDr. Jiří Spáčil, CSc., sedmdesátiletý
-
Kopřiva F et al. Neurogenní zánět.
Praha: Maxdorf Jessenius 2009. 244 stran. ISBN 978- 80- 7345- 174-5. - Natriuretické peptidy, porucha funkce ledvin a vznik kardiovaskulárních komplikací – editorial
- IgA pemfigus provázející mnohočetný myelom – editorial
- Charakteristika ulceráci í na nohách u diabetikov
- Plazmatické hladiny neuropeptidu Y, ghrelinu a leptinu u pacientek s anorexia nervosa a jejich změny po šestitýdenní realimentaci
- Sekundární dyslipidemie navozená současnými perorálními kontraceptivy
- BNP a echokardiografické parametre u pacientov s chronickými chorobami obličiek a dialyzovaných chorých
- Vztah mezi kvalito u života a BODE indexem u bývalých kuřáků ve stabilní fázi chronické obstrukční plicní nemoci
- Léčba refluxní choroby jícnu – současný stav
- Polohový test – víme o něm opravdu všechno?
- Neuroendokrinní nádory žaludku
- Refluxní choroba jícnu. Standardy České gastroenterologické společnosti – aktualizace 2009
- Nežádo ucí účinky amiodaronu na kůži
- IgA pemfigus provázející mnohočetný myelom vymizel při léčbě bortezomibem (Velcade), cyklofosfamidem a dexametazonem. Popis případu a přehled literatury
- 24letý muž s horečkami, multiorgánovou dysfunkcí a rychle progredujícím ARDS
- Cielené vysvetľovani e ci evnych chorôb a ci evnych porúch
- Sympozium firmy Abbott na XVI. kongresu České internistické společnosti ČLS J. E. Purkyně 2009
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Refluxní choroba jícnu. Standardy České gastroenterologické společnosti – aktualizace 2009
- Léčba refluxní choroby jícnu – současný stav
- Polohový test – víme o něm opravdu všechno?
- Neuroendokrinní nádory žaludku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



