-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nežádo ucí účinky amiodaronu na kůži
Skin adverse effects of amiodarone
Backgro und:
Ami odarone has belonged to frequently used anti arrhythmic in the tre atment of supraventricular and ventricular tachyarrhytmi as since the sixti es of the twenti eth century. Ami odarone is a chemically i odinated benzofuran derivative with mono - N--desethylami odarone as its major metabolite. Objective: This revi ew is focused on numero us adverse re acti ons. The incidence of ami odarone induced side - effects ranges from 16 – 98% of pati ents receiving ami odarone and it appe ars to be dose related. Case reports: We describe three cases of hyperpigmentati on after using ami odarone in elder men. Conclusi on: Skin side effects are common, they usu ally occur as photosensitivity, more rarely as a slate - grey discolorati on of the skin. Ami odarone induced slate - grey pigmentati on is commonly observed in unprotected light exposed skin. Its incidence ranges from 2 – 57%. Hyperpigmentati on is due to accumulati on of ami odarone and its metabolites in the skin.Key words:
ami odarone – photosensitivity – hyperpigmentati on – adverse effects
Autoři: S. Zgažarová; H. Jedličková; V. Vašků
Působiště autorů: I. dermatovenerologická klinika Lékařské fakulty MU a FN u sv. Anny Brno, přednosta doc. MU Dr. Vladimír Vašků, CSc.
Vyšlo v časopise: Vnitř Lék 2009; 55(10): 976-980
Kategorie: Kazuistiky
Souhrn
Úvod:
Ami odaron patří již od 60. let 20. století k nejvíce předepisovaným anti arytmikům v léčbě komorových a supraventrikulárních tachyarytmi í. Chemicky se jedná o jodovaný derivát benzofuranu, hlavním metabolitem je mono - N - desethylami odaron. Cíl: Cílem práce je upozornit na možný rozvoj nežádo ucích účinků. Četnost výskytu se pohybuje mezi 16 a 98 % u paci entů užívajících ami odaron, dle výše kumulativní dávky. Kazuistiky: Popisujeme případy tří paci entů s hyperpigmentací po ami odaronu s pomalým ústupem barevných změn po vysazení léku. Závěr: Kožní nežádo ucí účinky jso u běžné, obvykle se projevují jako fotosenzitivita nebo méně často jako modrošedé až břidlicovitě šedé zbarvení kůže. Ami odaronem indukované modrošedé zbarvení kůže je pozorováno především na sluncem nechráněných místech pokožky. Jeho četnost se pohybuje mezi 2 a 57 %. Podkladem pro tuto hyperpigmentaci je akumulace ami odaronu a jeho metabolitů v kůži.Klíčová slova:
ami odaron – fotosenzitivita – hyperpigmentace – nežádo ucí účinkyÚvod
Amiodaron se v lékařství používá již od roku 1962 jako antianginózum [2,6,20]. Snižuje spotřebu kyslíku v myokardu poklesem cévního odporu a zpomalením srdeční frekvence [1]. V roce 1986 byl registrován i jako antiarytmikum (III. třídy dle klasifikace Vaughan-Williamse) [1,2]. V současnosti je indikován k léčbě komorových a supraventrikulárních tachyarytmií [1,2,7,8].
Po chemické stránce se jedná o jodovaný derivát benzofuranu [2,3,9,11]. Molekula amiodaronu obsahuje dva atomy jodu, které se mohou uvolnit do organizmu (7,5mg jodu z 200mg tablety) [1].
Jeho farmakokinetické vlastnosti jsou odlišné od většiny farmak. Amiodaron a jeho sloučeniny jsou lipofilní, špatně rozpustné ve vodě, proto se z 99% vážou na sérové bílkoviny. Důsledkem toho je velmi dlouhý biologický poločas s individuální variabilitou v rozmezí 20–60 dnů (až 103 dnů). Biotransformace probíhá v játrech přes cytochrom P 450 3A4, hlavním metabolitem je mono-N-desethylamiodaron. Vylučuje se žlučí, dále též kožní a lakrimální exkrecí [1,2,8]. Míra vylučování ledvinami je zanedbatelná. V moči lze detekovat jod, který se z molekuly amiodaronu částečně uvolňuje (6mg za 24 hod při denní dávce 200mg amiodaronu). Již během prvních dnů léčby se látka akumuluje téměř ve všech tkáních, zvláště ve tkáni tukové.
Negativem léku je relativně častý výskyt nežádoucích účinků (NÚ) s četností výskytu 16–98%. V České republice, kde je amiodaron používán v nízkých dávkách, je referován výskyt NÚ léku do 25% [1,2].
Patří mezi ně tyreopatie (hypotyreóza i tyreotoxikóza). Kromě velkého příjmu jodu zde působí také přímý cytotoxický vliv amiodaronu na buněčné membrány, případná aktivace autoimunitních procesů, strukturální podobnost mezi amiodaronem a molekulou trijodtyroninu a tyroxinu [1,10]. Poruchy funkce štítné žlázy se objevují při léčbě amiodaronem u 3–25% léčených za 2–6 měsíců trvání léčby, častěji u mužů (4–6 : 1) [1–3].
Závažným NÚ je toxické postižení plic (0,5–10%) [1–3,7], které vede k široké škále klinických projevů (alveolitidě, plicním infiltrátům, pneumoniím, plicní fibróze, pleuritidě, pleuropulmonální adhezi, vzácně bronchospazmu).
Nejčastějším NÚ je akumulace korneálních depozit, tzv. cornea verticillata, v epiteliálních buňkách přední Bowmanovy membrány (až u 98% pa-cientů). Ustupuje spontánně do 6 až12 měsíců po ukončení terapie [2,3].
Reverzibilní hepatopatie indukovaná terapií amiodaronem se objevuje až u 30% nemocných; progrese do fatálního jaterního selhání je možná [1–3].
Neurologické komplikace se dělí na časné (parestezie, vertigo, tremor, bolesti hlavy, poruchy spánku a paměti) a pozdní, které souvisí s poškozením lipidových membrán lékem s následným vznikem demyelinizace a axonální degenerace, což vede k periferní neuropatii, ataxii, neuritidě optického nervu [1–3].
Z gastrointestinálních obtíží se popisuje nechutenství, nauzea, zvracení, bolesti břicha, hypersalivace, změna vnímání chuti, zácpa, pankreatitida.
Kardiovaskulární NÚ amiodaronu jsou vzácné a souvisí nejčastěji s vlastním proarytmickým potenciálem (sinusová bradykardie, zhoršení chronického srdečního selhání, hypotenze) [1–3,7].
Kožní NÚ jsou popisovány často. Zpravidla nevyžadují ukončení léčby. Projevují se jako fotosenzitivita, méně často jako modrošedé až břidlicovitě šedé zabarvení kůže. Vzácně byla popsána i další kožní onemocnění (leukocytoklastická vaskulitida, angioedém, Lyellův syndrom, reverzibilní alopecie, jododerm, manifestace psoriázy, lineární IgA dermatóza a lupus erythematosus) [1,3,6].
Fotosenzitivita je popisována až u 50% pacientů [4,9,12]. Vzniká asi po čtyřech měsících léčby amiodaronem při minimální kumulativní dávce 40g. Pravděpodobně není na dávce závislá zcela; a zdá se, že nesouvisí s fototypem kůže [4]. Vzniká na podkladě fototoxické reakce s UVA o vlnové délce 350–380 nm (mechanizmem dehalogenace a fotoionizace za vzniku volných kyslíkových radikálů) [13]. Amiodaron může indukovat i reakci fotoalergickou, která je překryta změnami vzniklými fototoxickými mechanizmy. Má různý klinický obraz (subjektivní pocity pálení, erytém, edém, papulózní exantém) v solární lokalizaci. Příznaky se typicky rozvíjejí během 2 hod po sluneční expozici a ustupují během 36 hod [12]. Fotosenzitivita je reverzibilní, obvykle odezní po 4–12 měsících od vysazení, méně často až po několika letech [4,5,9,14].
Šedá hyperpigmentace byla poprvé popsána v roce 1971 [5]. Četnost výskytu je uváděna v rozmezí 3–10% [4,6,10,14], ale i v 57% [3]. Vzniká spíše při středních a vysokých dávkách (od 400mg denně) a po dosažení kumulativní dávky 160g, což odpovídá asi 20 měsícům kontinuální terapie. Nejčastěji se popisuje u fototypu I [4]. Je reverzibilní, regreduje za 2–24 měsíců po ukončení léčby. Vznik je nesporně spojený s expozicí UV světlem, hyperpigmentace se nachází především v solární lokalizaci, kde se nachází až 10násobně vyšší koncentrace depozit léku oproti nepostižené kůži. Pomalou rychlostí eliminace amiodaronu a jeho zvýšenou absorpcí tukovou tkání lze vysvětlit pozdní vymizení jak fotosenzitivity, tak i opožděný rozklad pigmentu.
Popis případů
Kazuistika 1
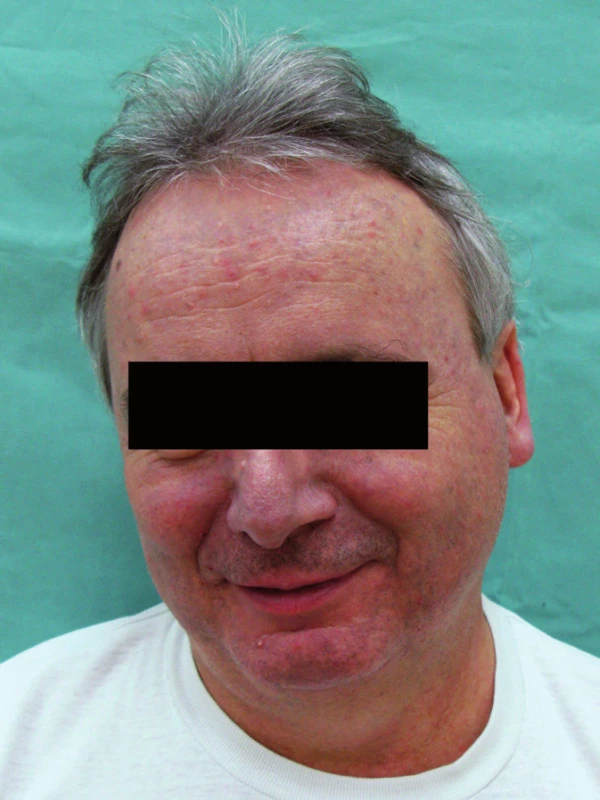
Muž, 50 let, léčen pro fibrilaci a flutter síní od června roku 2003. Cordarone (amiodaron) užíval od července roku 2004 v dávce 200–400mg denně s přibližnou kumulativní dávkou 270g. Dále užíval warfarin, kalium chloratum, spirapril, simvastatin, metoprolol, amilorid s hydrochlorothiazidem. Pacient byl fototyp III, časté přímořské pobyty snášel dobře.
Od konce léta roku 2007 došlo k postupnému rozvoji šedomodrého zbarvení obličeje, uší a krku (obr. 1, 2). Současně s hyperpigmentací byly v obličeji ještě patrné papulózní projevy odpovídající diagnóze rosacea a zbytnění mazových žlázek. Oční vyšetření potvrdilo diagnózu cornea verticillata II. stadia na obou očích. Pro zřejmou souvislost hyperpigmentace s Cordaronem byl lék v únoru roku 2008 postupně vysazen. V průběhu dalších měsíců došlo k mírné regresi hyperpigmentace.
Obr. 2. Pacient č. 1 – detail čela. 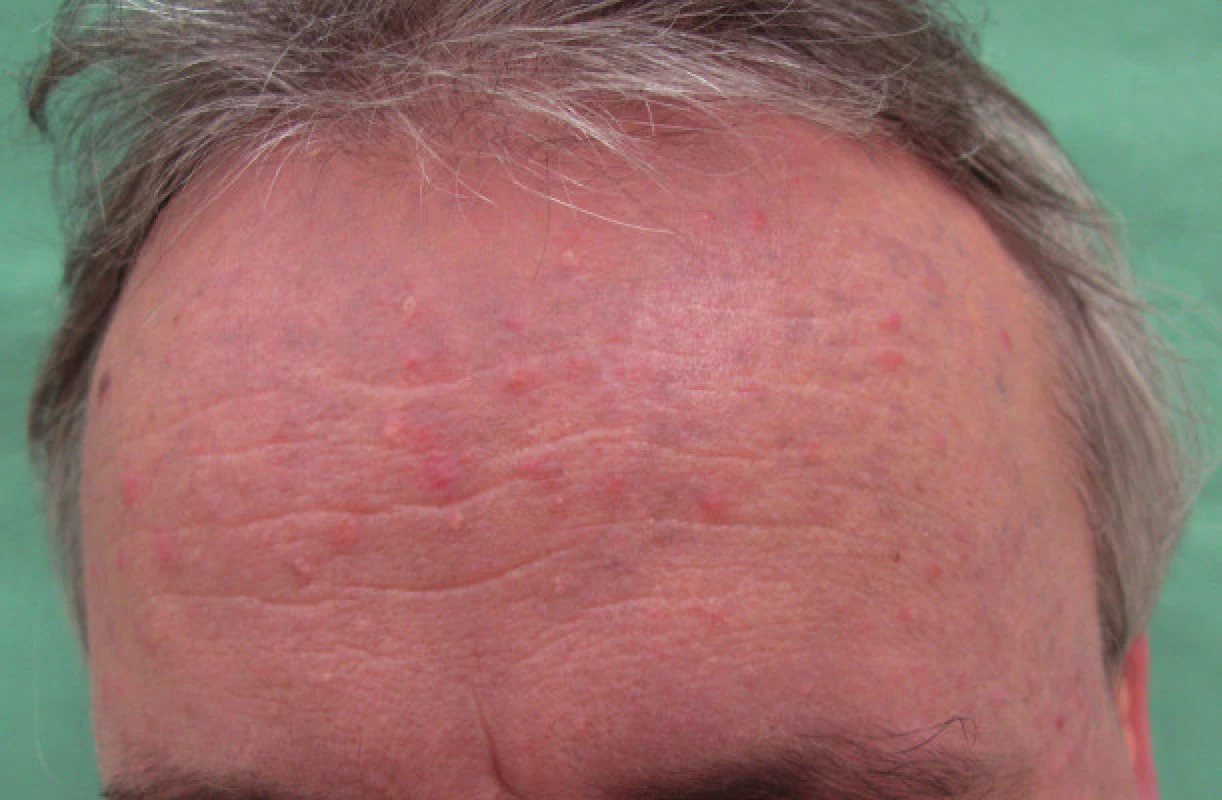
Kazuistika 2
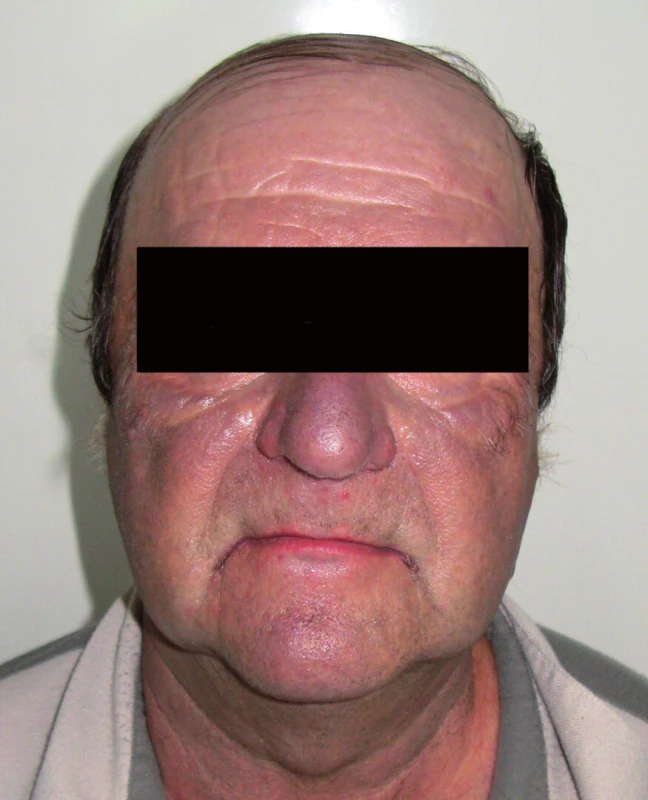
Muž, 61 let, sledován pro ischemickou chorobu srdeční s tachyarytmií, prokterou byl léčen Amiokordinem (amiodaronem) od roku 2003 v dávce 400mg denně s přibližnou kumulativní dávkou 730g. Ostatními užívanými léky byly kyselina acetylsalicylová, trandolapril, atorvastatin, metoprolol, amilorid s chlortalidonem a amlodipin. Fototyp kůže III.
Šedomodré zbarvení kůže v oblasti obličeje, krku a ušních boltců se objevilo po dvou letech. Ke zhoršení potíží došlo v průběhu března roku 2008 (obr. 3, 4). Ačkoli posuny pigmentu byly také ojediněle popsány u beta blokátorů a inhibitorů angiotenzin konvertujícího enzymu (metoprolol a trandolapril, obdobně i u pacienta 1), klinický obraz byl typický pro amiodaron. Proto byl v dubnu roku 2008 po doporučení dermatologa vysazen. Při další dermatologické kontrole v červnu roku 2008 bylo již patrno mírné problednutí pigmentace v obličeji i na ušních boltcích.
Obr. 4. Pacient č. 2 – profil. 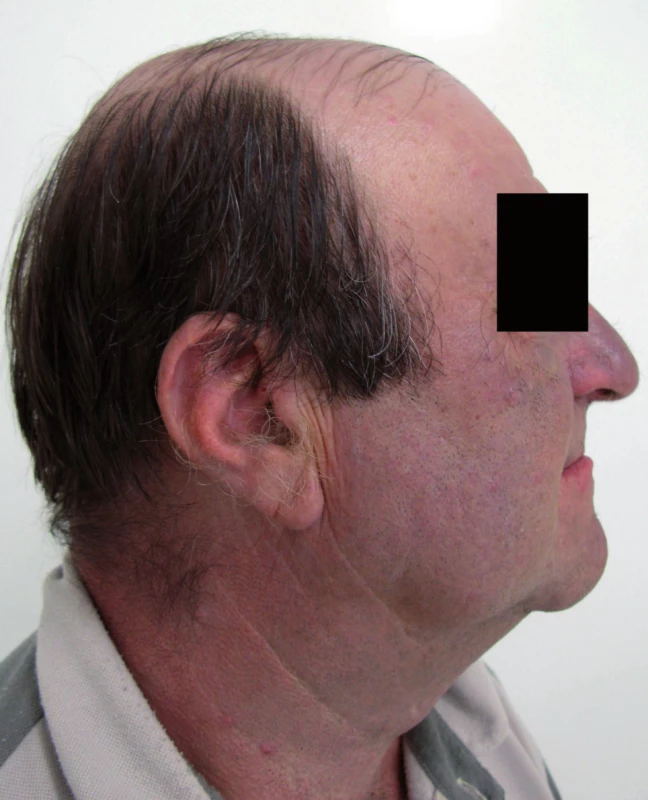
Kazuistika 3
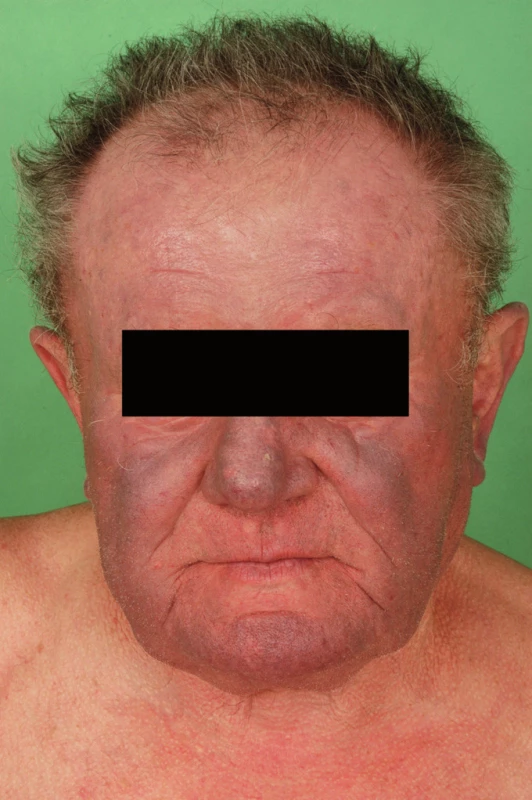
Muž ve věku 70 let s fototypem II–III, léčen pro paroxyzmální fibrilaci síní s komorovými extrasystolami Lown IVa, chronickou ischemickou chorobu srdeční a hepatopatii toxonutritivní etiologie. Cordarone (amiodaron) užíval od roku 2004 v dávce 200mg denně, v přibližné kumulativní dávce 220g, dále užíval amilorid s chlortalidonem a atorvastatin.
Pacient byl sledován v dermatologické ambulanci v místě bydliště pro hyperpigmentace v obličeji, na dorzech rukou a předloktích od dubna roku 2006, tj. po dobu 1,5 roku (obr. 5, 6). Dále v anamnéze uvedl erytém v obličeji vyskytující se již od mládí, zhoršující se po oslunění.
Obr. 6. Pacient č. 3 – dorzum ruky. 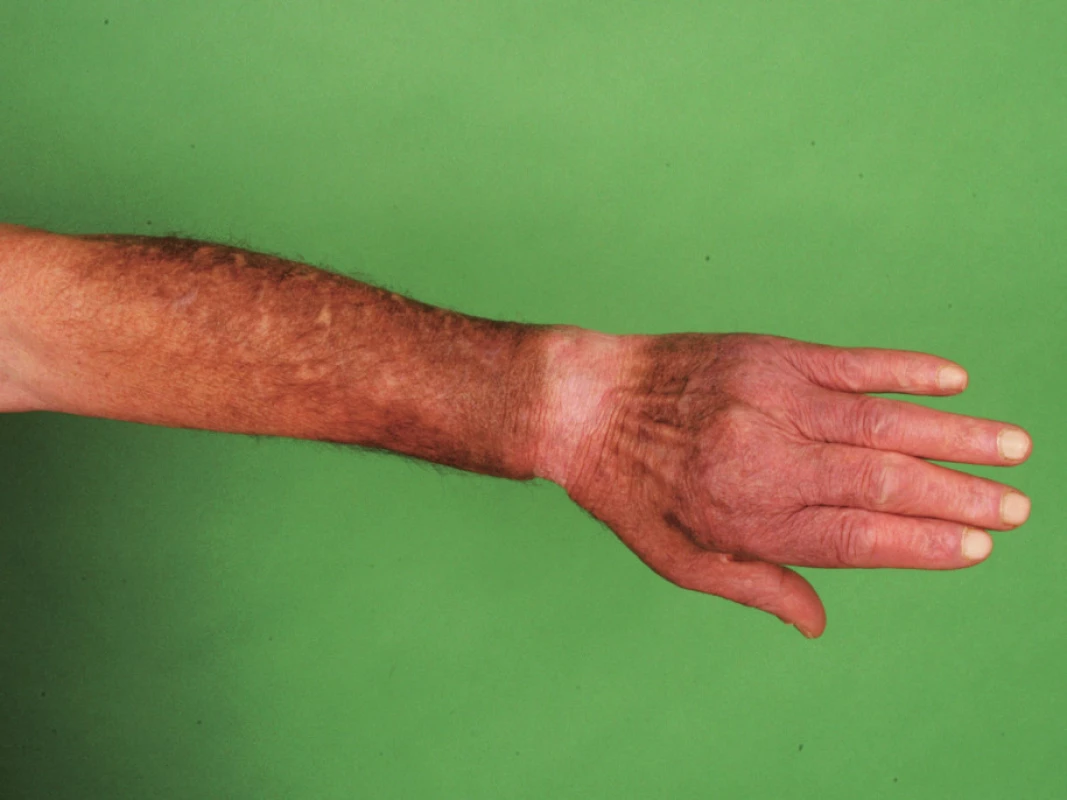
V červenci roku 2007 byla provedena probatorní excize z kůže nosu bez diagnostického závěru. Vzhledem k hepatopatii byla v diferenciální diagnóze zvažována i porfyrie, ale přítomnost porfyrinů v moči nebyla prokázána ani při opakovaném vyšetření. Po celkovém přešetření v říjnu roku 2007 byl stav hodnocen jako hyperpigmentace po Cordaronu v terénu rosacey, bylo doporučeno vysazení léku. Na další kontroly se již pacient nedostavil.
Diskuze
Hyperpigmentace způsobená toxickými látkami nebo léky tvoří 10–20% všech získaných hyperpigmentací. Nejčastěji ji vyvolávají léky ovlivňující CNS, chemoterapeutika, antibiotika a antimykotika, antihypertenziva, hormony a těžké kovy. Patogeneze polékových hyperpigmentací zahrnuje několik mechanizmů: akumulace melaninu podmíněná stimulací epidermálních melanocytů nebo jeho nedostatečným odklízením makrofágy, lékem navozená syntéza pigmentu (jiného než melanin), ukládání depozit léku, jeho metabolitů nebo uloženin železa v důsledku poškození dermálních cév zánětem. Tyto mechanizmy se mohou kombinovat [15,16,18].
Patogeneze hyperpigmentace způsobená amiodaronem není zcela jasná. Předpokládá se akcelerace normální fagocytózy depozit léku makrofágy v dermis. Amiodaron a jeho metabolity se hromadí (jakožto amfifilní látky) v kyselých buněčných složkách (v endosomech a lyzosomech) a zde vytvářejí komplexy s polárními lipidy a fosfolipidy (lipofuscinem). Tyto komplexy se již nemohou rozložit účinkem lyzosomálních enzymů [8,11]. Akumulace pigmentu v lyzosomech je důsledkem deficitu lyzosomálních lipolytických enzymů. Tento deficit by vysvětloval, proč hyperpigmentace vzniká jen u některých pacientů léčených amiodaronem [5].
UV záření způsobuje vazbu léku a jeho metabolitů na buněčné membrány nejen v perivaskulární tkáni, ale i v cévních stěnách spojenou s vazodilatací a následně zvýšenou difúzí amiodaronu do perivaskulární tkáně. To přispívá k jeho akumulaci.
Uplatňuje se i toxické působení na buněčné membrány. Vlivem UV záření dochází k dehalogenaci (dejodaci) amiodaronu a v přítomnosti kyslíku se vytváří singletový kyslík. Podléhá také fotoionizaci, účinkem fotonu a kyslíku vzniká superoxidový radikál. Volné kyslíkové radikály reagují s polynenasycenými mastnými kyselinami, což vede k lékově fotoindukované peroxidaci lipidů membrán. Z konečných produktů peroxidace mastných kyselin vzniká lipofuscin, který je ve zvýšené míře produkován a následně se hromadí [13].
Dochází také k metabolickému poškození buňky a akceleraci fyziologického stárnutí [4]. Pro svou amfipatickou povahu má amiodaron zvýšenou afinitu k membránám. Inkorporuje se do středu lipidové dvojvrstvy, kde převáží hydrofóbní síly a ty vyvolají změny v uspořádání a fluiditě fosfolipidové dvojvrstvy. Navíc jsou ovlivněny biochemické procesy v membránových systémech, převážně na vnitřní mitochondriální membráně. Amiodaron stimuluje mitochondriální respiraci, inhibuje oxidativní fosforylaci a transhydrogenaci [17,19].
Patogeneze hyperpigmentace indukované amiodaronem byla tedy z výše uvedeného po řadu let přisuzována kožní lipofuscinóze [4]. Tato teorie vychází z obrazu elektronové mikroskopie, kde jsou patrna v cytoplazmě makrofágů v okolí dermálních cév granula, která se v elektronovém mikroskopu jeví jako denzní tělíska o průměru 250–2 500 nm s jednoduchou membránou. Jde o lyzosomy obsahující degradační produkty amiodaronu vázané na lipofuscin, případně jiný pigment. Zánětlivá odpověď je minimální [5]. Nový pohled na problematiku přináší Ammoury s vyšetřením bioptické tkáně pomocí elektronového mikroskopu a HPLC (high performance liquid chromatography). V elektronovém mikroskopu Ammoury přítomnost lipofuscinu neprokázal. Byla patrná jen intracelulární elektrodenzní granula obklopená membránou. V řadě buněčných populací v dermis (fibroblasty, makrofágy, endotelie, Schwannovy buňky, pericyty) byla tato granula po extrakci identifikována chromatograficky jako depozita amiodaronu. Z toho vyplývá přímá patogenetická role depozit amiodaronu v dermis, hyperpigmentace je tedy možno považovat i za střádací onemocnění vznikající sekundárně na podkladě akumulace depozit léku [4].
Optické vnímání hyperpigmentace je způsobeno Tyndallovým efektem, který je založen na difuzním rozptylu světla procházejícím opticky heterogenní soustavou. Z bílého světla se rozptylují nejvíce záření o kratších vlnových délkách (modré spektrum) a rozptýlené světlo pak nese namodralý nádech, kožní pigment je tedy vnímán jako modrý nebo šedý.
V léčbě kožních NÚ po amiodaronu je na prvním místě jeho vysazení. Ostatní metody byly popsány jako alternativní (Q-switched ruby laser – 694 nm, dermabraze, lokální aplikace hydrochinonu, retinoidů, chemického peelingu, kyseliny azelainové). Doplňkově lze podat vitamin E, celkové užívání pyridoxinu a β-karotenů je diskutabilní a často neúspěšné [6].
Závěr
Kožní nežádoucí účinky amiodaronu jsou časté, ale ve většině případů reverzibilní. Ve světě i v České republice dochází k postupnému narůstání užívání tohoto léku. Společně s počtem pacientů a délkou jejich léčby se zvyšuje počet nežádoucích účinků.
Kosmetický dopad tmavošedého zbarvení v obličeji je ovšem pro pacienta neúnosný a vede k vysazení léku. Je tedy nutné pacienty při zahájení terapie amiodaronem upozornit na tento možný nežádoucí účinek, doporučit opatrnost při pobytu na slunci, omezení opalování s preventivní aplikací krémů s vysokým ochranným faktorem proti UVB i UVA. Klinický obraz sám je pro stanovení správné diagnózy typický.
MUDr. Simona Zgažarová
www.fnusa.cz
e mail: simonazg@seznam.cz
Zdroje
1. Hrčková Y, Šarapatková H, Lukl J. Vedlejší účinky ami odaronu. Interní Med 2005; 6 : 288 – 290.
2. Jiravská Godula B, Jiravský O, Vávra P et al. Nežádo ucí účinky ami odaronu. Klin Farmakol Farm 2004; 18 : 171 – 174.
3. Jafari - Fesharaki M, Scheinman MM. Adverse effects of ami odarone. Pacing Clin Electrophysi ol 1998; 21 : 108 – 120.
4. Ammo ury A, Micha ud S, Pa ul C et al. Photodistributi on of blue - gray hyperpigmentati on after ami odarone tre atment. Arch Dermatol 2008; 144 : 92 – 96.
5. Delage C, Lagacé R, Hu ard J. Pse udocyanotic pigmentati on of the skin induced by ami odarone: a light and electron microscopic study. Can Med Assoc J 1975; 112 : 1205 – 1208.
6. Dissemond J, Franckson T, Fitz G et al. Hyperpigmenti erung des Gesichts. Ha utarzt 2003; 54 : 994 – 998.
7. Janota T, Malík J, Holaj R et al. Méně obvyklé nežádo ucí účinky ami odaronu. Interní Med 2006; 11 : 513 – 514.
8. Lüllmann H, Mohr K, Wehling M. Farmakologi e a toxikologi e. 2. vyd. Praha: Grada 2004 : 192 – 194.
9. Shah N, Warnakulasuriya S. Ami odarone‑induced peri - oral photosensitivity. J Oral Pathol Med 2004; 33 : 56 – 58.
10. Bahadir S, Apaydin R, Cobano ilu Ü et al. Ami odarone pigmentati on, eye and thyro id alterati ons. J Eur Acad Dermatol Venere ol 2000; 14 : 194 – 195.
11. Ettler K, Gregor J, Pidrman V et al. Skin side - effects of ami odarone therapy. Sb Ved Pr Lek Fak Karlovy University Hradec Králové 1993; 36 : 305 – 315.
12. Lee A, Thomson J. Drug‑induced skin re acti ons. In: Lee A (ed). Adverse drug re acti ons. 2nd ed. London: Pharmace utical Press 2006 : 143 – 147.
13. Li AS, Chignell CF. Spectroscopic studies of cutane o us photosensitizing agents - ix. A spin trapping study of the photolysis of ami odarone and desethylami odarone. Photochem Photobi ol 1987; 45 : 191 – 197.
14. Yones SS, O’Donoghue NB, Palmer RA et al. Persistent severe ami odarone‑induced photosensitivity. Clin Exp Dermatol 2005; 30 : 500 – 502.
15. Boyer M, Katta R, Markus R. Diltiazem‑induced photodistributed hyperpigmentati on. Dermatol Online J 2003; 9 : 10.
16. Jhirwal OP, Parsad D, Basu D. Skin hyperpigmentati on induced by olanzapine, a novel antipsychotic agent. Int J Dermatol 2004; 43 : 778 – 779.
17. Mansani FP, Dinis TC, Carni eri EG et al. Ne utrality of ami odarone on the initi ati on and propagati on of membrane lipid peroxidati on. Cell Bi ochem Funct 1999; 17 : 131 – 142.
18. Ramírez - Hernández M, Martínez - Escribano JA, Martínez - Barba E et al. Cutane o us hyperpigmentati on induced by omeprazole mimicking ashy dermatosis. J Eur Acad Dermatol Venere ol 2006; 20 : 584 – 587.
19. Ribeiro SM, Campello AP, Nascimento AJ et al. Effect of ami odarone (AMD) on the anti oxidant enzymes, lipid peroxidati on and mitochondri al metabolism. Cell Bi ochem Funct 1997; 15 : 145 – 152.
20. Trappe HJ. Ami odaron. Intensivmed 2001; 38 : 169 – 178.
21. Jung T, Bader N, Grune T. Lipofuscin: formati on, distributi on, and metabolic consequences. Ann NY Acad Sci 2007; 1119 : 97 – 111.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2009 Číslo 10- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Prim. MUDr. Jiří Spáčil, CSc., sedmdesátiletý
-
Kopřiva F et al. Neurogenní zánět.
Praha: Maxdorf Jessenius 2009. 244 stran. ISBN 978- 80- 7345- 174-5. - Natriuretické peptidy, porucha funkce ledvin a vznik kardiovaskulárních komplikací – editorial
- IgA pemfigus provázející mnohočetný myelom – editorial
- Charakteristika ulceráci í na nohách u diabetikov
- Plazmatické hladiny neuropeptidu Y, ghrelinu a leptinu u pacientek s anorexia nervosa a jejich změny po šestitýdenní realimentaci
- Sekundární dyslipidemie navozená současnými perorálními kontraceptivy
- BNP a echokardiografické parametre u pacientov s chronickými chorobami obličiek a dialyzovaných chorých
- Vztah mezi kvalito u života a BODE indexem u bývalých kuřáků ve stabilní fázi chronické obstrukční plicní nemoci
- Léčba refluxní choroby jícnu – současný stav
- Polohový test – víme o něm opravdu všechno?
- Neuroendokrinní nádory žaludku
- Refluxní choroba jícnu. Standardy České gastroenterologické společnosti – aktualizace 2009
- Nežádo ucí účinky amiodaronu na kůži
- IgA pemfigus provázející mnohočetný myelom vymizel při léčbě bortezomibem (Velcade), cyklofosfamidem a dexametazonem. Popis případu a přehled literatury
- 24letý muž s horečkami, multiorgánovou dysfunkcí a rychle progredujícím ARDS
- Cielené vysvetľovani e ci evnych chorôb a ci evnych porúch
- Sympozium firmy Abbott na XVI. kongresu České internistické společnosti ČLS J. E. Purkyně 2009
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Refluxní choroba jícnu. Standardy České gastroenterologické společnosti – aktualizace 2009
- Léčba refluxní choroby jícnu – současný stav
- Polohový test – víme o něm opravdu všechno?
- Neuroendokrinní nádory žaludku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání