-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Klinicky manifestní gastrointestinální krvácení u koronarografovaných nemocných
Clinically manifest gastrointestinal bleeding in patients subject to coronary angiography
Patient set and methodology:
The authors evaluated the incidence of acute bleeding from the upper gastrointestinal tract in 5,955 patients (of which 3,684 men and 2,271 women) during hospitalisation for coronary angiography, and the incidence of
potential sources of bleeding from the upper gastrointestinal tract in the patients without bleeding.Results:
Bleeding occurred in 9 persons, within 3.4 ± 3.6 days of the coronary angiography (the median of 1.0 day), with a 33 % mortality rate. An ulcer of the duodenal bulbus or bulbitis were detected in four cases (44 %), esophagitis in one case (11 %), esophageal varices in one case, stomach carcinoma in one case, and the source of bleeding could not be detected in 2 cases. Patients with bleeding were significantly older than those without bleeding (73.6 ± 4.4 years vs. 65.8 ± 10.6 years, p < 0.001). Treatment with clopidogrel or abciximab was not associated with a higher incidence of bleeding (p > 0.05). In 42 patients without bleeding, the following pathologies were detected by gastroscopy: esophagitis (31 %), mouth and stomach ulcers (36 %), duodenal ulcers (21 %), (12 %), esophageal varices (2 %) The incidence of mouth ulcers, stomach ulcers and duodenal ulcers was significantly higher in patients taking acetylsalicylic acid on a regular basis (p < 0.025).Conclusion:
Bleeding from the upper gastrointestinal tract is not frequent shortly after coronary angiography, but the related mortality is high. The most frequent source of bleeding are duodenal peptic lesions most likely caused by previous treatment by acetylsalicylic acid.Key words:
bleeding from gastrointestinal tract – coronary angiography – acetylsalicylic acid
Autoři: V. Kojecký; Z. Coufal
Působiště autorů: Interní klinika IPVZ Praha, Krajská nemocnice T. Bati, a. s., Zlín, přednosta doc. MUDr. Čestmír Číhalík, CSc.
Vyšlo v časopise: Vnitř Lék 2007; 53(2): 147-150
Kategorie: Původní práce
Souhrn
Cíl:
Cílem práce bylo zhodnotit výskyt akutního krvácení do horní části zažívacího traktu u nemocných po koronarografii a jeho možné zdroje.Soubor nemocných a metodika:
Autoři retrospektivně hodnotili výskyt akutního krvácení do horní části zažívacího traktu u 5 955 osob (3 684 mužů, 2 271 žen) po dobu hospitalizace pro koronarografii a výskyt potenciálních zdrojů krvácení v horní části zažívacího traktu u části nekrvácejících.Výsledky:
Ke krvácení do GIT došlo u 9 osob, průměrně za 3,4 ± 3,6 dne od výkonu (medián 1,0 dne) s 33% mortalitou. Ve 4 případech (44 %) byl nalezen vřed bulbu duodena nebo bulbitida, 1krát ezofagitida (11 %), 1krát varixy jícnu, 1krát karcinom žaludku a ve 2 případech nebylo možno zdroj zjistit. Osoby s krvácením byly významně starší než nekrvácející (73,6 ± -4,4 roku vs 65,8 ± 10,6 roku, p < 0,001). Léčba klopidogrelem nebo abciximabem nebyla spojena s vyšším výskytem krvácení (p > 0,05). U 42 osob bez krvácení byla gastroskopicky nalezena patologie: ezofagitida (31 %), afty a vředy žaludku (36 %), vředy duodena (21 %), polypy žaludku (12 %), varixy jícnu (2 %). Afty, vředy žaludku i duodena byly významně častější u osob užívajících pravidelně kyselinu acetylsalicylovou (p < 0,025).Závěr:
Krvácení do horní části zažívacího traktu není u osob v krátkém odstupu po koronarografii časté, má však vysokou mortalitu. Nejčastějším zdrojem časného krvácení jsou peptické léze gastroduodena vzniklé nejspíše v důsledku předchozí léčby kyselinou acetylsalicylovou.Klíčová slova:
krvácení do gastrointestinálního traktu - koronarografie - kyselina acetylsalicylováÚvod
Koronarografie patří mezi základní diagnostické metody moderní kardiologie. Asi ve 40 % případů nejde o výkon pouze diagnostický, protože následuje implantace stentu či jiný zákrok na koronární tepně. Ke snížení rizika trombotického uzávěru intervenovaného místa je používána řada farmak s antiagregačním a antikoagulačním účinkem, kyselina acetylsalicylová (ASA), tiklopidin, klopidogrel, hepariny, abciximab aj. Jejich působení na hemostázi je systémové, spojené se zvýšeným nebezpečím nežádoucího krvácení, včetně krvácení do zažívacího traktu [9]. Riziko gastrointestinálního krvácení u koronarografovaných může dále zvyšovat skutečnost, že výkony jsou často prováděny u starých nemocných, hemodynamicky nestabilních s humorální stresovou odezvou, která zhoršuje prokrvení splanchniku.
Cílem práce je zhodnotit výskyt akutního krvácení do horní části zažívacího traktu (GIK) u nemocných po koronarografii a jeho možné zdroje.
Soubor nemocných a metodika
Autoři retrospektivně hodnotili výskyt manifestního GIK (projevujícího se jako hematemeze nebo melena) po dobu hospitalizace u osob po koronarografii. Vyhodnocována byla dále případná souvislost mezi krvácením a podáním klopidogrelu, abciximabu a věkem nemocných. Využito bylo údajů z registru centra Intervenční kardiologie Krajské nemocnice T. Bati ve Zlíně z let 2003-2005. Soubor tvořilo celkem 5 955 osob, 3 684 mužů a 2 271 žen. Průměrný věk souboru byl 65,8 ± 10,6 roku (20-97 let). Čistě diagnostický výkon byl proveden u 3 644 osob (61 %), u 241 osob (4 %) byl doplněn angioplastikou a u 2 070 (35 %) byl implantován minimálně 1 koronární stent. U 945 osob byl výkon proveden jako direktní, pro infarkt myokardu. Po intervenčním výkonu byli nemocní léčeni ASA (100 mg/den), klopidogrelem (75 mg/den, 2 032 osob), abciximabem (bolus 0,25 mg/kg, následně 0,125 µg/kg/min, po 12 hod, 123 osob) či nízkomolekulárním heparinem a jejich kombinacemi. Doba hospitalizace po výkonu činila 3-21 dní.
Ze skupiny koronarografovaných bez manifestního krvácení bylo během hospitalizace endoskopicky vyšetřeno 85 osob. Důvodem byly zažívací obtíže, diferenciální diagnóza bolesti na hrudi, váhového úbytku, vysoká sedimentace, anémie. V této skupině byla hodnocena souvislost mezi endoskopickým nálezem a léčbou ASA nebo jinými nesteroidními antiflogistiky (NSA).
Ke statistickému vyhodnocení byl použit χ2 - a T-test. Hodnoty p < 0,05 byly považovány za statisticky významné.
Výsledky
Gastrointestinální krvácení se po výkonu objevilo celkem u 9 osob (0,15 %). K jeho manifestaci došlo průměrně za 3,4 ± 3,6 dne od výkonu, s mediánem 1,0 dne. U 7 krvácejících byla provedena gastroskopie. Ve 4 případech (44 %) byl příčinou krvácení vřed bulbu duodena nebo bulbitida, u 1 nemocného ezofagitida (11 %), 1krát varixy jícnu, 1krát karcinom žaludku. Ve 2 případech nebyl zdroj zjištěn pro krátký časový odstup od krvácení do úmrtí a z provozně-technických důvodů nebylo možné ani sekční ověření. 3 osoby (33,3 %) na krvácení zemřely (tab. 1). Acetylsalicylovou kyselinu pravidelně užívaly 3 osoby, z toho 2 se zjištěným vředem duodena. Anamnéza vředové choroby gastroduodena byla přítomna u 1 osoby. Osoby s krvácením byly významně starší (73,6 ± 4,4 roku, p < 0,001) než osoby nekrvácející (65,8 ± 10,6 roku). Nezjistili jsme, že by u léčených klopidogrelem nebo abciximabem bylo krvácení významně častější (p > 0,05).
Tab. 1. Příčiny krvácení a úmrtí u osob s krvácením. 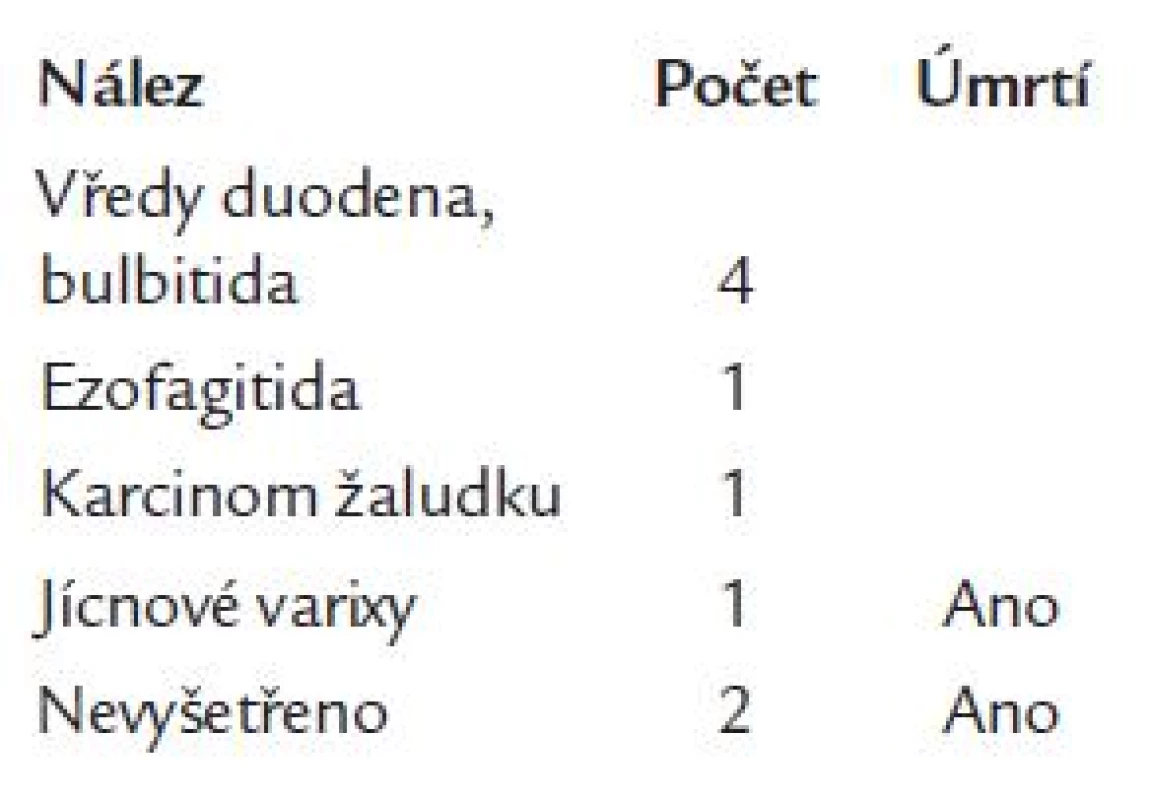
Skupina bez gastrointestinálního krvácení
35 osob ze všech vyšetřených bez GIK (45,8 %) užívalo před koronarografií pravidelně ASA (100 mg/den), 5 osob (5,8 %) NSA a kombinaci ASA a NSA 2 osoby (2,3 %). Anamnéza vředové choroby byla zjištěna u 11 (12 %) osob a 8 z nich (9 %) užívalo pravidelně ASA. Přesto u 6 z nich byl endoskopický nález na gastroduodenu normální. Inhibitory protonové pumpy pravidelně užívalo celkem 5 osob, z toho ve skupině nemocných s anamnézou vředové choroby osoby 3.
Patologický nález na gastroduodenu byl nalezen u 42 nemocných (49,4 %). Přehled nálezů je uveden v tab. 2. U 1 nemocného se vyskytl současně vřed bulbu duodena a ezofagitida.
Tab. 2. Endoskopické nálezy u nekrvácejících a jejich vztah k léčbě kyselinou acetylsalicylovou. 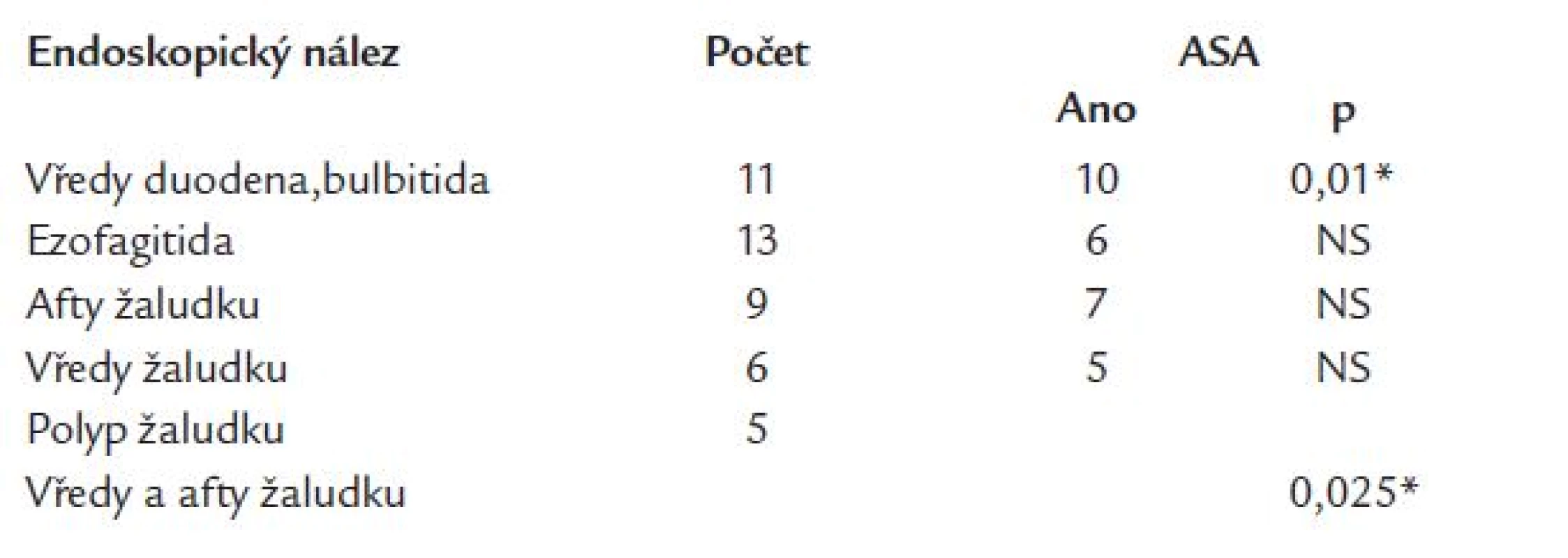
* – významné ASA – kyselina acetylsalicylová U osob léčených ASA se významně častěji vyskytla bulbitida, vředy duodena (p = 0,01) a vředy žaludku, aftózní gastropatie (p = 0,025). Ještě výraznější byla souvislost s medikací ASA, pokud byla hodnocena na sloučené skupině diagnóz - vředy duodena, bulbitida, afty žaludku a vředy žaludku (p < 0,005). Přítomnost ezofagitidy s medikací ASA nekorelovala (p > 0,05). Osoby s ulcerací duodena, bulbitidou byly nejmladší (46,0 ± 16,7 roku), nejstarší byla skupina s aftami žaludku (63,0 ± 13,6 roku). Rozdíly ve věku nebyly mezi skupinami v žádném z případů významné (obr. 1).
Diskuse
Při zmínce o krvácení záhy po koronarografii se všeobecně předpokládá lokální komplikace, krvácení z místa punkce tepny. Krvácení do zažívacího traktu není vnímáno jako komplikace častá. Jaký je jeho výskyt záhy po výkonu, není přesně známo. U osob po kardiochirurgickém výkonu (např. bypass) je v pooperačním období gastrointestinální krvácení zaznamenáno v 0,3-3 % [21]. U osob užívajících kombinovanou antikoagulační terapii, ať duální (kyselina acetylsalicylová, klopidogrel) nebo trojkombinaci s warfarinem, je popisováno až u 1/10 léčených [14]. Výskyt krvácení je v těchto pracích však hodnocen za delší časový interval, minimálně několika měsíců, což znemožňuje porovnání s našimi údaji. Sami jsme sledovali výskyt gastrointestinálního krvácení po dobu maximálně 3 týdny od výkonu. Oproti výchozím předpokladům není námi zjištěná četnost GIK za tuto dobu vysoká. Pokud však ke krvácení došlo, mělo vysokou mortalitu, významně vyšší než má krvácení v běžné populaci (1/3 vs 1/10) [5,16] a obdobnou, jako má krvácení vzniklé za hospitalizace u kriticky nemocných [2,3].
Graf 1. Věkové rozložení (medián ± 1 SD) podle endoskopického nálezu u nekrvácejících. 
Hlavní rizikové faktory krvácení do horní části gastrointestinálního traktu jsou všeobecně známy. Vyšší věk (nad 70 let), komorbidity, anamnéza vředové choroby gastroduodena, anamnéza gastrointestinálního krvácení, kouření, konzumace alkoholu, užívání nesteroidních antiflogistik. U hospitalizovaných osob riziko krvácení dále zvyšuje přítomnost koagulopatie, pobyt na jednotce intenzivní péče, umělá ventilace [2,17], více jsou ohroženy osoby se srdečním selháním a hypotenzí [7]. Společným etiologickým momentem tohoto typu gastrointestinálního krvácení je různý stupeň orgánové hypoperfuze a splanchnické ischemie. V našem souboru je tato příčina krvácení málo pravděpodobná. Ve skupině krvácejících nebylo významné srdeční selhání přítomno (max. stupně NYHA II) a direktní koronarografie, při níž lze předpokládat významnější hemodynamickou nestabilitu s hypotenzí, byla provedena jen u 1 krvácejícího.
Za druhý nejvýznamnější rizikový faktor, po krvácení v anamnéze, jsou považována nesteroidní antiflogistika. Relativní riziko kolísá podle druhu NSA od 2,5 do 8,0 [12]. Nejčastěji užívaným lékem této skupiny, zvláště u nemocných s ischemickou chorobou srdeční, je kyselina acetylsalicylová. Při dlouhodobém užívání ASA riziko gastrointestinálního krvácení stoupá 2-3násobně [4]. Pokud ji užívají osoby s anamnézou GIK, až u 15 % z nich krvácení do roku recidivuje [10]. Nežádoucí gastrointestinální působení lze omezit snížením dávky ASA, ale bez toho, že by existovala prahová bezpečná dávka, se zachovalým antiagregačním účinkem. Ještě v množství 75 mg/den je riziko krvácení dvojnásobné [19]. Podávání dalších antikoagulancií, klopidogrelu, tiklopidinu či warfarinu pravděpodobnost krvácení dále zvyšuje. Např. kombinace warfarinu a NSA zvyšuje relativní riziko krvácení na 9,4 a kombinace ASA a thienopyridinů až na 16,4 [12,20]. Ze studie CURE vyplývá, že rizikovost takové kombinace, klopidogrel/ASA, je dána ulcerogenním efektem ASA, závislým na dávce [15]. Proto byla, zvláště pro ohrožené osoby, doporučena jako bezpečná alternativa léčba pouze klopidogrelem [1].
Objevují se však práce, které ukazují, že ani monoterapie klopidogrelem nemusí být bezpečná. U osob s anamnézou gastrointestinálního krvácení, léčených dlouhodobě klopidogrelem, byl zjištěn významně vyšší výskyt GIK (22 % vs 0 %) [13]. Vyšší riziko krvácení po léčbě klopidogrelem (relativní riziko 2,8) bylo pozorováno i v další studii [12]. Příčina není jasná. Mimo antikoagulačního působení klopidogrelu, které odkryje asymptomatické vředy, se spekuluje o jeho negativním vlivu na hojení vředů [3].
V naší práci jsme souvislost mezi krvácením a podáváním klopidogrelu nenalezli. Tento výsledek ji však nevylučuje. Zvýšené riziko krvácení bylo ve studiích zjištěno za delší období léčby. Doba našeho sledování byla krátká a celkový počet hodnocených krvácení nízký.
Průměrná doba do krvácení byla v našem případě 3 dny s mediánem jen 1 den. Je to interval velmi krátký pro krvácení z nově vzniklých lézí. Spíše půjde o krvácení z už přítomných zdrojů, které kombinovaná antikoagulace může demaskovat. Tuto představu podporují endoskopické nálezy u nekrvácejících. Jde o selektovanou skupinu symptomatických nemocných, čemuž odpovídá i vysoký výskyt nálezů na gastroduodenu. Četnost patologických nálezů bude u asymptomatických osob nižší. Jednoznačně zde dominovaly peptické léze gastroduodena a afty žaludku. Všechny se významně častěji vyskytly u osob pravidelně užívajících ASA.
Nápadná je podobnost ve výskytu peptických mezí gastroduodena mezi krvácejícími a nekrvácejícími. Nabízí se proto domněnka, že u našich nemocných došlo ke krvácení z už preexistujících lézí gastroduodena, vzniklých následkem předchozí léčby ASA.
Pro prevenci vzniku a krvácení bylo v těchto případech navrhováno více strategií. Doplnění H2-blokátorů, kombinace s prostaglandiny, záměna ASA za klopidogrel, či kombinační léčba ASA a inhibitoru protonové pumpy. V současnosti se jako nejefektivnější jeví kombinace ASA s inhibitorem protonové pumpy [8,11].
Problematiku vztahu Helicobacter pylori (HP) a NSA indukovaných lézí provází řada nedostatečně zodpovězených otázek. Je HP dispozičním faktorem vzniku vředů a krvácení z nich? Má eradikace HP protektivní účinek? Výsledky jednotlivých studií konzistentní výsledky nepřinesly. V metaanalýze Huanga et al [6] hodnotící výsledky 463 prací se HP ukázal spolu s NSA jako nezávislý rizikový faktor zvyšující pravděpodobnost vzniku vředu a krvácení z něj. Nezdá se, že by eradikace HP zásadně zlepšovala hojení vředů a její preventivní vliv na vznik NSA vředů je menší, než při podávání inhibitorů protonové pumpy [18].
Námi zjištěný výskyt krvácení do horní části zažívacího traktu u osob po koronarografii není vysoký. Velká mortalita tohoto krvácení ukazuje na nutnost pečlivého zvažování indikace kombinační terapie ASA a antikoagulancií u osob s anamnézou GIK a rizikem NSA gastropatie a na jejich další pečlivé monitorování.
MUDr. Vladimír Kojecký, Ph.D.
www.bnzlin.cz
e-mail: kojecky@bnzlin.cz
Doručeno do redakce: 11. 9. 2006
Přijhato po recenzi: 14. 12. 2006
Zdroje
1. Braunwald E, Altman EM, Beasley JW et al. ACC/AHA Guideline update for the management of patients with unstable angina and non-ST segment elevation myocardial infarction. Circulation 202; 106 : 1893-1900.
2. Cook DJ, Fuller HJ, Guyatt GH et al. Risk factors for gastrointestinal bleeding in critically ill patients. Canadian Critical Care Trials Group. N Engl J Med 1994; 6 : 377-381.
3. Cryer B. Reducing the risk of gastrointestinal bleeding with antiplatelet therapies. N Engl J Med 2005; 3 : 287-289.
4. Derry S, Kong LY. Risk of gastrointestinal haemorrhage with long term use of aspirin: meta-analysis. BMJ 2000; 321 : 1183-1187.
5. Dítě P et al. Akutní stavy v gastroenterologii. 1. ed. Praha: Galén 2005.
6. Huang JQ, Sridhar S, Hunt RH. Role of Helicobacter pylori infection and non-steroidal anti-inflamatory drugs in peptic-ulcer disease: a meta-analysis. The Lancet 2002; 359 : 14-22.
7. Christenson JT, Schnuziger M, Maurice J et al. Gastrointestinal complications after coronary artery bypass grafting. J Thorac Cardiovasc Surg 1994; 108 : 899-906.
8. Chan FKL, Ching JYL, Hung LCT et al. Clopidogrel versus Aspirin and Esomeprazole to Prevent Recurrent Ulcer Bleeding. N Engl J Med 2005; 352 : 238-449.
9. Krč I, Krčová V. Antitrombotická léčba v etiologii akutní posthemoragické anémie. Vnitř Lék 2005; 51 : 873 - 877.
10. Lai KC, Lam SK, Chu KM et al. Lansoprasole for the prevention of recurrences of ulcer complications from long-term low-dose aspirin use. N Engl J Med 2002; 346 : 2033-2038.
11. Lai KC, Chu KM, Hui WM et al. Esomeprazole with aspirin versus clopidogrel for prevention of recurrent gastrointestinal ulcer complications. Clin Gastroenterol Hepatol 2006; 7 : 860-865.
12. Lanas A, Garcia-Rordigues LA, Arroyo M et al. Risk of upper gastrointestinal ulcer bleeding associated with selective COX-2 inhibitors, traditional non-aspirin NSAIDs, aspirin, and combinations. Gut 2006; 12 : 1731-1738.
13. Ng FH, Wong SY, Chany CM et al. High incidence of clopidogrel-associated gastrointestinal bleeding in patients with previous peptic ulcer disease. Aliment Pharmacol Ther 2003; 4 : 443-449.
14. Orford JL, Fasseas P, Melby S et al. Safety and efficacy of aspirin, clopidogrel, and warfarin after cornary stent placement in patients with an indication for anticoagulation. Am Heart J 2004; 3 : 463-467.
15. Peters RJG, Mehta SR, Keith AA et al. Effect of aspirin dose when used alone or in combination with clopidogrel in patients with acute coronary syndromes: observations from the Clopidogrel in Unstable angina to prevent Recurrent Events (CURE) study. Circulation 2003; 108 : 1682-1687.
16. Rockall TA, Logan RFA, Delvin HB et al. Incidence and mortality from acute upper gastrointestinal hemorrhage in the United Kingdom. BMJ 1995; 311 : 222-226.
17. Schuster DP, Eowley H, Feinstein S et al. Risk of the upper gastrointestinal bleeding after admission to a medical intensive care unit. Am J Med 1984; 4 : 623-630.
18. Vergara M, Catalan M, Gisbert JP et al. Meta-analysis: role of Helicobacter pylori eradication in the prevention of peptic ulcer in NSAID users. Aliment Pharmacol Ther 2005; 12 : 1411-1418.
19. Weil J, Collin-Jones D, Langman M et al. Prophylactic aspirin and risk of peptic ulcer bleeding. BMJ 1995; 310 : 827-830.
20. Younossi ZM, Strum WB, Schatz RA et al. Effect of combined anticoagulation and low-dose aspirin treatment on upper gastrointestinal bleeding. Dig Dis Sci 1997; 1 : 79-82.
21. Zacharias A, Schwann TA, Parenteau GL et al. Predictors of gastrointestinal complications in cardiac surgery. Tex Heart Inst J 2000; 33 : 93-99.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Pankreatikopleurální píštěleČlánek Indrák K et al. Hematologie.
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2007 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Pankreatikopleurální píštěle - editorial
- Chirurgická ablace fibrilace síní: budoucnost kardiochirurgie? - editorial
- Reziduální echokardiografické nálezy a NT-proBNP u asymptomatických dospělých pacientů po radikální korekci Fallotovy tetralogie
- Vliv sekundárního zavedení ePTFE potahovaného stentu na udržení průchodnosti TIPS
- Nízkodávkovaný talidomid u refrakterního a relabujícího mnohočetného myelomu
- Pankreatikopleurální píštěle
- Paradoxní embolizace při foramen ovale patens u potápěčů: možnosti screeningu
- Klinicky manifestní gastrointestinální krvácení u koronarografovaných nemocných
- Dlouhodobá účinnost chirurgické kryoablace chronické fibrilace síní provedené při operaci pro závažnou mitrální regurgitaci
- Dysfunkce transjugulární intrahepatální portosystémové spojky (TIPS) a její řešení
- Enkapsulující peritoneální skleróza
- Teplota nejasné etiologie: příčiny a diagnostický postup
- Doporučení pro diagnostiku a léčbu dyslipidemií v dospělosti, vypracované výborem České společnosti pro aterosklerózu
- Dialog hematologa a internisty: problém specializace a informací v medicíně
- Kalita Z et al. Akutní cévní mozkové příhody. Diagnostika, patofyziologie, management.
- Safar ME, O’Rourke MF (eds). Arterial stiffness in hypertension.
- Veselka J et al. Hypertrofická kardiomyopatie a příbuzná témata.
- Válek V, Kala Z, Kiss I et al. Maligní ložiskové procesy jater. Diagnostika a léčba včetně minimálně invazivních metod.
- Krajsová I. Melanom. Klasifikace, diagnostika, terapie, prevence.
- Tesař V, Schück O et al. Klinická nefrologie.
- Klener P et al. Propedeutika ve vnitřním lékařství.
- Goldberg E. Paradox moudrosti. Jak být duševně výkonnější, přestože mozek stárne.
- Štejfa M et al. Kardiologie. 3. přepracování a doplněné vydání.
- Indrák K et al. Hematologie.
- Šafránková A, Nejedlá M. Interní ošetřovatelství I a II.
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Teplota nejasné etiologie: příčiny a diagnostický postup
- Doporučení pro diagnostiku a léčbu dyslipidemií v dospělosti, vypracované výborem České společnosti pro aterosklerózu
- Enkapsulující peritoneální skleróza
- Dlouhodobá účinnost chirurgické kryoablace chronické fibrilace síní provedené při operaci pro závažnou mitrální regurgitaci
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



