Polymyalgia rheumatica a obrovskobunková arteritída: prvé výsledky ročného sledovania.
Polymyalgia rheumatica and giant cell arteritis – first results of a year-long study
Introduction:
Due to ageing of population, gerontorheumatology becomes more and more important. Both polymyalgia rheumatica (PMR) and giant cell arteritis (GCA) typically develop in later life and they have many other common features. The aim of our study was to explore diagnostic and prognostic markers and, prospectively, establish diagnostic and therapeutic algorithm for patients with PMR and GCA.
Sample and methods:
We examined 27 patients with suspected PMR or OBA. The diagnosis was verified in 22 patients. Three of them were in a long-term clinical remission. Besides examination for basic clinical and laboratory parameters all other patients were subjected to ultrasonography of temporal artery and peripheral joints to detect any exudates. Also, they were examined for T-cell subpopulations in peripheral blood and HLA antigens.
Results:
Exudate was confirmed in 7 patients; some of them had exudate in multiple joints. Puncture of synovial fluid was done in 4 patients. Increased resistance index of temporal artery was found in 2 patients with GCA and 4 patients with PMR. GCA patients showed lower level of T-cells and increased activation of CD8-cells. Decreased count of CD8+ T-cells was observed in 56 % of PMR patients. Analysis of HLA and increased activation of CD8-cells. Decreased count of CD8+ T-cells was observed in 56 % of PMR patients. Analysis of HLA antigens indicates that GCA, rheumatoid arthritis and, probably, PMR are associated with HLA-DR4 antigen in Slovak population.
Conclusion:
The importance of assessment of disease activity and its prognosis in PMR or GCA patients via ultrasonographic evaluation of exudate in peripheral joints and resistance index of temporal artery as well as the analysis of T-cell distribution in peripheral blood and incidence of HLA-antigens has not been proved yet. Practical significance of monitoring the above-mentioned parameters can be verified only by further prospective study performed with a larger sample of patients.
Key words:
polymyalgia rheumatica – giant cell arteritis – synovitis – HLA antigens – T-cell subpopulations
Autoři:
J. Rovenský 1; A. Tuchyňová 1; P. Poprac 1; S. Blažíčková 1; V. Bošák 1; V. Štvrtinová 2
Působiště autorů:
Národný ústav reumatických chorôb, Piešťany, Slovenská republika, riaditeľ prof. MUDr. Jozef Rovenský, DrSc., FRCP
1; II. interná klinika Lekárskej fakulty UK FN Bratislava, Slovenská republika, prednosta prof. MUDr. Andrej Dukát, DrSc., FESC
2
Vyšlo v časopise:
Vnitř Lék 2006; 52(7-8): 691-696
Kategorie:
130. internistický den – Revmatologie v klinické praxi
Souhrn
Úvod:
Vzhľadom k vzrastajúcemu zastúpeniu starších ľudí v populácii sa dostáva stále viac do popredia aj problematika gerontoreumatológie. Polymyalgia rheumatica (PMR) a obrovskobunková arteritída (OBA) sú typické svojim začiatkom u pacientov vyššieho veku a majú aj ďalšie spoločné charakteristiky. Cieľom nášho sledovania je hľadanie diagnostických a prognostických markerov ochorenia s perspektívnym vytvorením diagnostického a terapeutického algoritmu u pacientov s PMR a OBA.
Súbor a metódy:
Vyšetrili sme 27 pacientov s podozrením na PMR alebo OBA. Diagnózu sme potvrdili u 22 pacientov, pričom 3 z nich už boli dlhodobo v klinickej remisii. U ostatných pacientov sme okrem základných klinických a laboratórnych parametrov realizovali ultrasonografické vyšetrenie a. temporalis a periférnych kĺbov so zameraním na prítomnosť výpotku, vyšetrenie subpopulácií T-lymfocytov v periférnej krvi a HLA-antigénov.
Výsledky:
Výpotok sme potvrdili u 7 pacientov, pričom u niektorých pacientov bol výpotok prítomný vo viacerých kĺboch. U 4 pacientov sme realizovali aj punkciu synoviálnej tekutiny. Zvýšený index rezistencie v a. temporalis sme zistili u 2 pacientov s OBA s 4 pacientov s PMR. Pacienti s OBA mali nižšie zastúpenie T-lymfocytov a zvýšenú aktiváciu CD8 lymfocytov. U 56 % pacientov s PMR sme zistili znížený počet CD8+ T-lymfocytov. Zastúpenie sledovaných HLA-antigénov naznačuje, že v slovenskej populácii je OBA, reumatoidná artritída a pravdepodobne aj PMR asociovaná s antigénom HLA-DR4.
Záver:
Význam ultrasonografického sledovania prítomnosti výpotku v periférnych kĺbov, indexu rezistencie v a. temporalis, ako aj zastúpenia subpopulácií T-lymfocytov v periférnej krvi a výskyt HLA-antigénov stále hľadá svoje uplatnenie pri hodnotení aktivity ochorenia, prípadne jeho prognózy u pacientov s PMR a OBA. Len ďalšie prospektívne sledovanie uvedených parametrov na širšom súbore pacientov môže ukázať ich uplatnenie v praxi.
Kľúčové slová:
polymyalgia rheumatica - obrovskobunková arteritída - synovitída - HLA-antigény - subpopulácie T-lymfocytov
Úvod
Vzhľadom k predlžovaniu priemernej dĺžky života a stále vzrastajúcemu zastúpeniu starších ľudí v populácii sa v poslednej dobe dostáva do popredia aj problematika gerontoreumatológie. Viaceré zápalové reumatické ochorenia začínajú v mladom alebo strednom veku a pacienta sprevádzajú až do konca života. Na druhej strane sú však aj také ochorenia, ktoré sa objavujú až vo vyššom veku. Typickými predstaviteľmi práve tejto skupiny ochorení sú polymyalgia rheumatica (PMR) a obrovskobunková arteritída (OBA) (obr. 1). Ide o dve nozologické jednotky, ktoré sa však často navzájom kombinujú a majú viaceré spoločné charakteristiky. Ich etiopatogenéza nie je presne známa. Obe začínajú vo veku nad 50 rokov, pričom ich výskyt so zvyšujúcim sa vekom stúpa. Často sa manifestujú celkovými príznakmi, typická je prítomnosť vysokej sedimentácie erytrocytov a dobrá odpoveď na liečbu glukokortikoidmi. Z prognostického hľadiska sa zdá byť závažnejšou OBA pre jej orgánové komplikácie, ktoré môžu viesť až k strate sebestačnosti pacienta.
V klinickej praxi zatiaľ chýbajú jednoznačné kritériá hodnotiace aktivitu ochorenia a tým aj efektivitu liečby. O aktivite ochorenia sa t.č. možno orientovať len na základe klinického obrazu a prítomnosti zápalových parametrov (sedimentácia erytrocytov, C-reaktívny proteín). Preto na jednej strane včasná redukcia dávky kortikoidov môže viesť k reaktivácii ochorenia, na strane druhej dlhodobá liečba vysokými dávkami môže viesť k zvýrazneniu nežiadúcich účinkov liečby glukokortikoidmi.
Cieľom nášho sledovania bolo hľadanie diagnostických a prognostických markerov ochorenia s perspektívnym vytvorením diagnostického a terapeutického algoritmu u pacientov s PMR a OBA, v snahe predísť závažným komplikáciám vyplývajúcim zo samotného ochorenia alebo jeho liečby.
Súbor a metódy
V priebehu roka 2005 sme vyšetrili 27 pacientov s priemerným vekom 69,7 rokov (50-82 rokov) s podozrením na PMR alebo OBA.
Sledovanú diagnózu sme potvrdili u 22 pacientov (17 - PMR, 3 - OBA, 2 - PMR/OBA). Čas od objavenia prvých príznakov po stanovenie diagnózy bol v priemere 3 mesiace (2 týždne-10 mesiacov). Osem pacientov v čase prvého vyšetrenia u nás už užívalo prednison v rôznej dávke a rôznej dĺžke trvania liečby. U 11 pacientov bola liečba zavedená až po zaradení do sledovania. Traja pacienti s diagnózou PMR boli už v dlhodobej remisii a klinický stav nevyžadoval znovuzavedenie glukokortikoidov do liečby (tab. 1).

U pacientov sme okrem anamnézy a fyzikálneho vyšetrenia realizovali röntgenové (RTG) snímky a ultrasonogarfické (USG) vyšetrenie periférnych kĺbov, elektrokardiogram, echokardiografické vyšetrenie, duplexné USG-vyšetrenie temporálnych artérií v oblasti tragu a distálne v oblasti temporálnej kosti. USG-vyšetrením sme hodnotili charakter cievnej steny - jej echogenitu, hrúbku a okolie, intraluminálne irregularity, index rezistencie (RI) kalkulovaný prístrojom Acuson 128XP/10C s lineárnou sondou s frekvenciou 7,5-10 MHz. U pacientov s podozrením na OBA sme robili v lokálnej anestézii biopsiu temporálnej artérie.
HLA-A, -B, -C, -DR, -DQ antigény sa sledovali v súbore 28 pacientov (21 žien, 7 mužov) vo veku 52-81 rokov. 15 pacientov malo PMR, 9 pacientov OBA a 4 pacienti PMR/OBA. Ako kontrolné súbory slúžili nepríbuzné osoby zdravej slovenskej populácie (n = 143) a chorí s reumatoidnou artritídou (RA) (n = 132). HLA antigény (spolu 87 antigénov) sa určovali IMB mikrolymfocytotoxickým testom vo fluorescenčnej modifikácii.
Výsledky
V objektívnom náleze sme u 5 pacientov s PMR zaznamenali epizodické opuchy periférnych kĺbov. V 3 prípadoch opuch kolena, v 1 prípade opuch kolena a zápästia a u jednej pacientky izolovaný opuch zápästia. U všetkých vyšetrených pacientov, vrátane pacientov s opuchmi kĺbov, v RTG-obraze dominovali artrotické zmeny rôzneho stupňa závažnosti. U žiadneho z nich sme nezistili RTG-obraz štrukturálnych zmien charakteristických pre reumatoidnú artritídu.
Po prítomnosti výpotku sme pátrali nielen fyzikálnym vyšetrením, ale aj ultrasonografickým vyšetrením ramenných, kolenných a bedrových kĺbov. USG-vyšetrením sme u 8 pacientov zistili malé množstvá výpotku v ramenom kĺbe alebo priľahlých periartikulárnych štruktúrach (šľachové pošvy a burzy), u 4 pacientov v bedrových kĺboch a u 4 pacientov výpotok v kolene, pričom u väčšiny z nich sa nezachytila významnejšia synoviálna reakcia v zmysle zhrubnutia - proliferácie synóvie. Len u 4 pacientov s PMR sme vzhľadom na väčšie množstvo výpotku zrealizovali punkciu a vyšetrenie synoviálneho výpotku s nasledovnými nálezmi: u 2 pacientov nezápalový výpotok s počtom jadrových buniek do 300 v 1 µl, u 1 pacientky bol výpotok na hranici zápalovosti počtom 1300 buniek/1 μl a u 1 pacientky stredne zápalový výpotok s obsahom 10400 buniek v 1 μl. U ostatných pacientov išlo o malé množstvo výpotku a chýbal klinický korelát opuchu kĺbu.
Po fyzikálnom vyšetrení temporálnych artérií sme realizovali duplexné utrasonografické vyšetrenie uvedených ciev s farebným kódovaním a využitím Power Dopplera. Hypoechogénny lem svedčiaci pre edém cievnej steny a zvýšený index rezistencie (RI > 0,7) sme zistili u 1 pacienta s PMR/OBA a postihnutím zraku na pravom oku, ktorý v čase vyšetrenia nemal v liečbe kortikoidy a klinické ťažkosti trvali asi 14 dní. Zvýšený index rezistencie v temporálne artérie bez edému cievnej steny sme zistili u jednej pacientky s OBA a očnou komplikáciou, ktorá v čase prvého USG-vyšetrenia už užívala Prednison. Aj 4 pacienti s PMR mali zvýšený index rezistencie - 1 pacientka unilaterálne, zvyšný 3 pacienti bilaterálne. Až na mierne zvýšenú echogenitu cievnej steny sme zmenu prietoku detekovanú farebným mapovaním nepozorovali. U žiadneho z týchto 4 pacientov sme nezistili klinické prejavy svedčiace pre OBA.
Z 5 pacientov s OBA (ev. PMR/OBA) bola biopsia realizovaná u 4 pacientov. U 2 pacientiek bol histologický nález hodnotený ako typický obraz OBA a u 1 pacientky bol nález trombu v zachytenej cieve. Vzhľadom na anamnézu bolestí hlavy, poruchy zraku, prednej ischemickej neuropatie n. opticus a vysokej humorálnej aktivity bol stav hodnotený ako OBA. U štvrtého pacienta bol histologický nález negatívny v zmysle OBA, avšak vzhľadom na anamnézu myalgií pletencov, pridruženú cefaleu, výpadky zorného poľa na pravom oku, USG-nález edematóznej cievnej steny a. temporalis a vysokú humorálnu aktivitu sme stav hodnotili ako PMR/OBA.
Všetci pacienti mali v úvode ťažkostí vysoké hodnoty sedimentácie erytrocytov a/alebo C-reaktívneho proteínu. Trombocytózu sme pozorovali u 5 pacientov, pričom u všetkých z nich sa počet trombocytov počas liečby prednizónom normalizoval.
Priemerná úvodná dávka prednisonu u pacientov s PMR bola 12 mg (5-15 mg). Úvodnú dávku menšiu ako 15 mg mali piati pacienti s PMR, pričom u 2 z nich sa musela po niekoľkých dňoch zvýšiť pre nedostatočný terapeutický efekt. Optimálnou úvodnou dávkou pre liečbu PMR sa zdá byť 15 mg prednisonu. U pacientov s OBA a PMR/OBA bola priemerná úvodná dávka prednisonu 40 mg (20-60 mg), pričom u jedného pacienta s diagnózou PMR/OBA a 14 dňovou anamnézou poruchy zraku sme v úvode podali pulz metylprednisolonu 3krát 500 mg a pokračovali v perorálnej dávke 40 mg prednisonu denne. U dvoch pacientov sa do liečby pridali antimalariká v dávke 200 mg denne (1 pacientka s PMR a 1 pacient s PMR/OBA).
Sledovaním základných subpopulácií lymfocytov v periférnej krvi u pacientov s PMR, OBA a PMR/OBA sme zistili rozdiely medzi jednotlivými skupinami pacientov. Pacienti s OBA mali nižšie zastúpenie T-lymfocytov ako ďalšie 2 skupiny, čo sa odzrkadlilo v zníženom počte pomocných T-lymfocytov. V tejto skupine pacientov sme zaznamenali i zvýšenú aktiváciu CD8+ T-lymfocytov, ale nie zvýšenie, a naopak mierne zníženie receptoru pre IL-2. Nepozorovali sme rozdiely v zastúpení CD8+ T-lymfocytov v jednotlivých skupinách. V najširšej skupine pacientov s PMR (n = 14) sme celkovo nepotvrdili literárnej údaje o zníženom počte CD8+ lymfocytov, ale u jednotlivých pacientov toto zníženie potvrdzujeme. Až u 56 % pacientov (10 zo 16) sme našli znížený počet CD8+ lymfocytov. U všetkých skupín pacientov pozorujeme zníženú hodnotu expresivity HLA-DR (tab. 2).
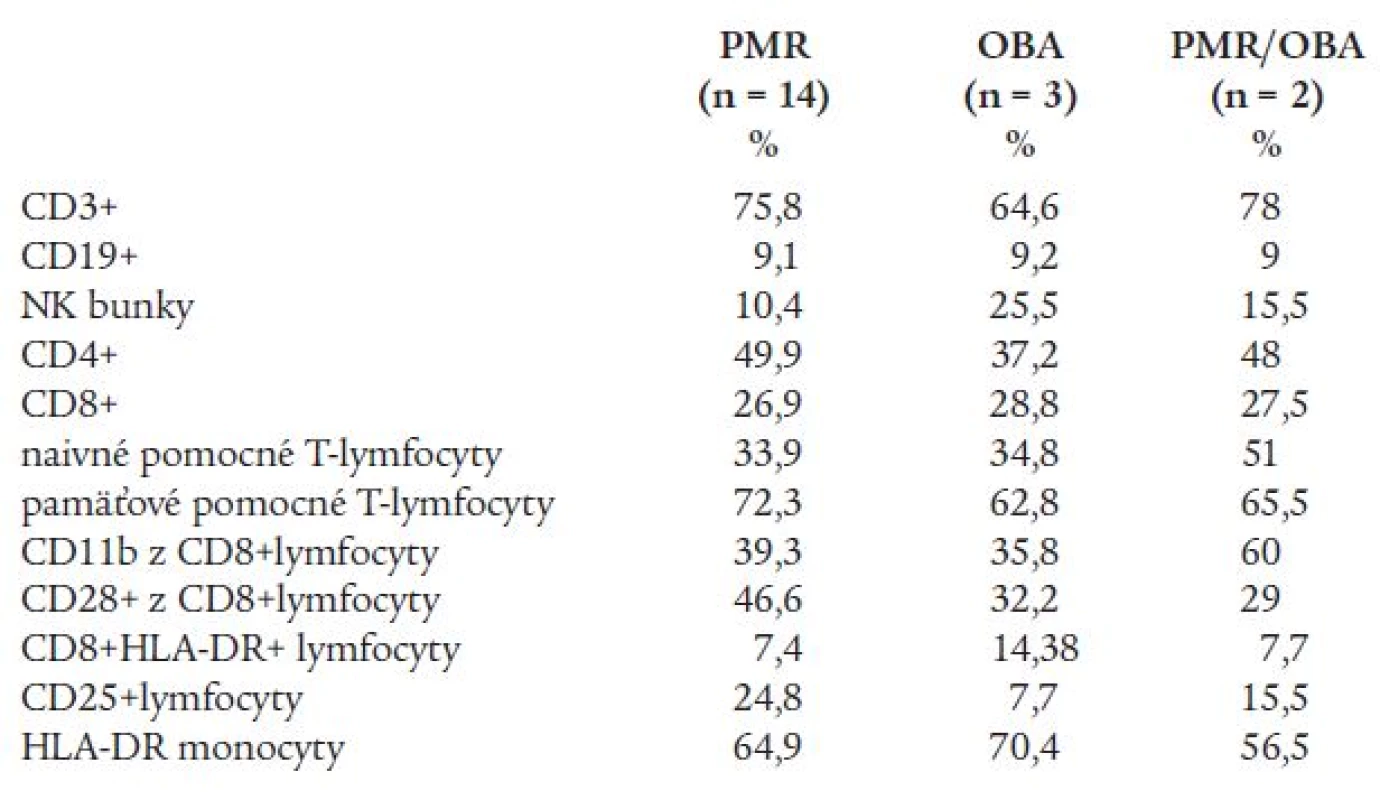
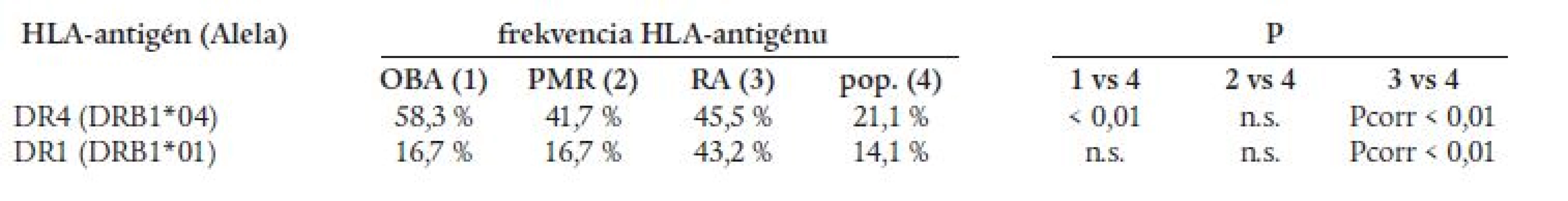
U chorých s OBA sa zistila štatisticky významne zvýšená frekvencia antigénu HLA-DR4 oproti populácii (tab. 3). Najvyššia frekvencia HLA-DR4 sa pozorovala pri OBA kombinovanej s PMR (75 %). Prítomnosť antigénu HLA-DR4 nekorelovala so zvýšenou sedimentáciou erytrocytov, trombocytózou, zvýšenou aktivitou alkalickej fosfatázy a postihnutím očí pri OBA. V slovenskej populácii je HLA-DR4 asociovaný s RA [1], pričom vzťah s DR4 je silnejší pri OBA (relatívne riziko RR = 5) než pri RA (RR = 3). Zvýšená frekvencia antigénu HLA-DR4 sa zistila aj u chorých s PMR, ale rozdiel nebol štatisticky významný. Asociácia s antigénom HLA-DR1 typická pre RA v slovenskej populácii sa pri OBA a GCA nepozorovala (tab. 3). Získané výsledky naznačujú, že v slovenskej populácii je OBA, RA a pravdepodobne aj PMR asociovaná s antigénom HLA-DR4.
U 5 pacientov sme diagnózu PMR alebo OBA nepotvrdili. U 4 pacientov sme diagnostikovali reumatoidnú artritídu s následným zahájením liečby antimalarikami, metotrexátom, resp. sulfasalazinom. V poslednom prípade sme stav hodnotili ako chronický cervikobrachiálny syndróm.
Diskusia
Typickým klinickým obrazom PMR sú symetrické bolesti a stuhnutosť ramenných a panvových pletencov, prípadne krčných svalov. Klinický obraz našich pacientov sa nelíšil od všeobecne známych prejavov opísaných v literatúre. Všetci pacienti s PMR mali symetrické postihnutie aspoň jedného z pletencov. PMR sa však môže manifestovať aj prítomnosťou synovitídy. U 10-60 % pacientov sa v začiatočnom štádiu ochorenia môže vyskytnúť synovitída niektorých periférnych kĺbov [2], ktorá postihuje najmä kolená a zápästia, ale môže sa vyskytnúť aj na ramenách, sternoklavikulárnych kĺboch, prípade aj drobných kĺbov rúk [3,4]. Najčastejšie ide o epizodické a asymetrické postihnutie periférnych kĺbov, ktoré rýchlo regreduje pri liečbe nízkymi dávkami glukokortikoidov. V našom súbore sme synovitídu kolien alebo zápästia pozorovali u takmer štvrtiny pacientov, pričom u 4 z nich sme realizovali aj punkciu synoviálnej tekutiny. U 3 pacientov išlo o nezápalový výpotok, ktorý mohol byť aj prejavom koincidujúcej dekompenzovanej gonartrózy. V poslednom prípade sme zistili stredne zápalový výpotok, avšak vzhľadom na negatívny RTG-nález v štrukturálnych zmien charakteristických pre reumatoidnú artritídu a rýchly ústup ťažkostí pri malej dávke prednizónu sme uvedený nález hodnotili ako prejav PMR. Napriek tomu tento stav vyžaduje ďalšie sledovanie so zreteľom na možný vývoj reumatoidnej artritídy. Pre diagnostické rozpaky pri stanovení diagnózy PMR a reumatoidnej artritídy na základe v úvode ochorenia poukazuje aj fakt, že u 4 pacientov odoslaných na vyšetrenie s podozrením na PMR, sme diagnostikovali reumatoidnú artritídu.
Prítomnosť výpotkov v periférnych kĺboch však nemusí byť zistiteľná len klinických vyšetrením pacienta. Ide o malé množstvo výpotku, ktoré zvyčajne nie je vhodné na punkciu, a možno ho detekovať USG-vyšetrením [5]. Sonografickým vyšetrením sme pátrali po prítomnosti výpotkov v periférnych kĺboch aj u tých pacientov, u ktorých sme prítomnosť výpotku nezistili klinickým vyšetrením. Takmer u polovice pacientov sme zistili prítomnosť malého množstva tekutiny v bedrových, ramenných a kolenných kĺboch, prípade v ich periartikulárnych štruktúrach. U väčšiny z nich sa v USG-obraze nezachytila významnejšia synoviálna reakcia. Sonograficky detekovanú prítomnosť malého množstva tekutiny v periférnych kĺboch sme však pozorovali aj u niektorých pacientov liečených prednizónom. Na určenie klinického významu uvedeného nálezu bude nutné dlhodobejšie sledovanie väčšej skupiny pacientov s PMR a porovnanie s kontrolnou skupinou pacientov vyššieho veku s nezápalovým reumatickým ochorením.
Závažnejším ochorením ako PMR, najmä čo sa týka klinického priebehu a prognózy, je OBA. Medzi najzávažnejšie a najčastejšie komplikácie OBA patrí postihnutie zraku, ktoré môže končiť oslepnutím. Vyskytuje sa približne u jednej tretiny pacientov. Môže sa manifestovať prechodným oslepnutím, diplopiou, prípadne zhoršením zraku rôznej závažnosti [6]. U 14-17 % pacientov dochádza k trvalej strate zraku [7]. Len včas stanovená diagnóza a zahájená adekvátna liečba môže predísť týmto komplikáciám. Jednoznačným potvrdením diagnózy OBA je pozitívny histologický nález, ktorý je aj súčasťou diagnostických kritérií [8]. Hľadajú sa však ďalšie metódy určené nielen k stanoveniu diagnózy OBA, ale aj prípadnému ďalšiemu monitorovanie efektu liečby. Neinvazívnym a pomerne dostupným vyšetrením je farebná dopplerovská ultrasonografia. Medzi utrasonografické nálezy OBA na povrchovo uloženej temporálnej artérii patrí hypoechogénne haló predstavujúce edém steny postihnutej cievy, ako aj zmeny prietokových rýchlostí v tejto cieve. Špecifickosť týchto nálezov pre diagnózu OBA sa u jednotlivých autorov líši [9-12]. Edém cievy sme pozorovali len u jedného pacienta s OBA, ktorého sme vyšetrovali vo včasnom štádiu ochorenia. U ďalších pacientov sme pozorovali zvýšený index rezistencie v a. temporalis. Vzhľadom k tomu, že išlo aj o pacientov s PMR bez akýchkoľvek anamnestických a klinických prejavov svedčiacich pre OBA, nemožno vylúčiť aj podiel aterosklerotických zmien na tomto náleze. Taktiež pre posúdenie významu pravidelného sledovania indexu rezistencie temporálnej artérie či už z diagnostického alebo prognostického hľadiska vyžaduje ďalšie sledovanie.
Liekom voľby pre PMR ako aj OBA sú glukokortikoidy. Efekt liečby posudzujeme podľa ústupu klinických ťažkostí a poklesu zápalových reaktantov. Dlhodobé podávanie glukokortikoidov vedie k vzostupu výskytu nežiadúcich účinkov, na druhej strane predčasné ukončenie liečby alebo zníženie dávky prednizónu môže viesť k reaktivácii ochorenia. Hľadajú sa preto ďalšie parametre, ktoré by pomohli nielen diagnostikovať ochorenia, ale aj monitorovať jeho aktivitu počas liečby. V priebehu posledných rokoch viaceré štúdie venovali pozornosť úlohe T-lymfocytov a makrofágov v etiopatogéze týchto ochorení. Názory na subpopulácie T-lymfocytov u PMR a OBA sa navzájom podľa jednotlivých autorov rozchádzajú. Naše doterajšie výsledky o normálnom zastúpení CD8+ lymfocytov u PMR sú v súlade so štúdiami Banksa, Anderssona, Uddhammara, Pountaina a Martinéz-Taboada et al [13-17]. Väčšina názorov o zníženom počte CD8+ u PMR pochádza z obdobia, kedy sa lymfocyty z periférnej krvi izolovali na hustotnom gradiente a až potom sa detekovali monoklónovými protilátkami, čo mohlo ovplyvniť zastúpenie jednotlivých subpopulácií. Zníženie počtu CD8+ T-lymfocytov ako i expresivita HLA-DR na monocytoch klesá s priebehom fyziologického starnutia, takže by mohlo byť spôsobené i vekom pacientov [18].
Sledovaniu HLA-antigénov pri OBA a PMR sa venuje pozornosť od roku 1975, kedy sa publikovala prvá štúdia [19]. V súčasnosti v literatúre možno nájsť viac ako 30 prác zameraných na túto problematiku. Z publikovaných údajov vyplýva, že antigény HLA-A, -B, -C, teda HLA-antigény triedy I nie sú asociované s PMR a OBA [1,20,21]. Negatívne výsledky sa zistili aj pri štúdiu antigénov HLA-DQ a HLA-DP [1,22]. Pozitívne nálezy prinieslo až sledovanie antigénov HLA-DR. Vo väčšine štúdií sa potvrdila asociácia medzi PMR, OBA a antigénom HLA-DR4, resp. alelami HLA-DRB1*04 [1,20,21]. Táto asociácia je typická predovšetkým pre belošské populácie kaukazoidného pôvodu v Európe a Severnej Amerike. V mediteránnych populáciách (Taliansko, Francúzsko) sa vzťah s HLA-DR4 nepotvrdil [23,24]. U černochov je zriedkavá PMR, aj antigén HLA-DR4. V kaukazoidných populáciách sa frekvencia HLA-DR4 u chorých s PMR a OBA pohybuje v rozmedzí 36-71 % v závislosti od sledovanej populácie. Podobne to bolo aj v našej zostave chorých slovenskej populácie, kde bola frekvencia HLA-DR4 58 % u OBA, resp. 42 % u PMR. Treba upozorniť, že nie je všeobecná zhoda, či sú s HLA-DR4 asociované PMR aj OBA, pretože niektorí autori zistili asociáciu len s jedným z uvedených ochorení. Pozornosť sa venovala aj sledovaniu vzťahov s klinickými príznakmi a laboratórnymi nálezmi PMR a OBA. I keď väčšina štúdií priniesla negatívne výsledky, ako napr. aj naša, niektorí autori zistili vzťah medzi antigénom HLA-DR4 a postihnutím očí pri OBA a rezistenciou OBA na terapiu kortikosteroidmi. Teda nemožno vylúčiť, že HLA-DR4 môže byť markerom závažnosti ochorenia [25]. V súvislosti s antigénom HLA-DR4 treba pripomenúť, že tento antigén je asociovaný aj s reumatoidnou artritídou (RA), predovšetkým s prognosticky závažnejšími formami ochorenia. RA začínajúca vo vyššom veku (≥ 60 rokov) je zase klinicky príbuzná PMR, dokonca sa zdá, že má aj podobnú imunogenetickú charakteristiku - asociácia s antigénmi HLA-DR1 a HLA-DR13/14 [26]. Údaje v literatúre naznačujú, že PMR, OBA a RA môžu mať rozdielne imunogenetické pozadie, resp. asociácia s HLA-DR4 postihuje iný epitop molekuly DR4 [22].
Záver
PMR i OBA sú závažné ochorenia jednak svojim priebehom a výskytom ischemických komplikácií, ale aj komplikáciami z nežiadúcich účinkov podávanej liečby. Z tohto dôvodu sa stále hľadajú diagnostické a prognostické parametre, ktoré by nám pomohli liečiť pacientov adekvátne, a s čo najmenším množstvom vedľajších účinkov. Postavenie ultrasonografického vyšetrenia kĺbov a temporálnych artérií, sledovanie subpopulácií lymfocytov v periférnej krvi či HLA-antigénov z tohto aspektu stále hľadá svoje miesto. Len dlhodobé sledovanie uvedených parametrov na väčšom súbore pacientov nám v budúcnosti môže dať na toto odpoveď.
Táto práca bola publikovaná s podporou agentúry APVT, číslo projektu 21-032 304.
prof. MUDr. Jozef Rovenský, DrSc., FRCP
www.nurch.sk
e-mail: rovensky.jozef@nurch.sk
Doručeno do redakce: 28. 3. 2006
Zdroje
1. Bošák V. HLA-systém a jeho význam v reumatológii. In: Bošák V. Klinická reumatológia. Martin: Osveta 2000 : 127-144.
2. Chaoaut D. Peripheral joint involvement in polymyalgia rheumatica. Rev Rhum (Engl Ed) 1997; 64 : 184-188.
3. Chou Ch, Schumacher HR. Clinical and pathologic studies of synovitis in polymyalgia rheumatica. Arthritis Rheum 1984; 27 : 1107-1117.
4. Gerster JC. Treatment of polymyalgia rehumatica. Rheumatol Eur 1996; 25 : 30-32.
5. Koski JM. Ultrasonographic evidence of synovitis in axial joints in patients with polymyalgia rheumatica. Br J Rheumatol 1992; 31 : 201-203.
6. Hayreh SS. Giant cell arteritis, diagnostic parameters. www.webeye.ophth.uiowa.edu/dept/GCA/03-diagnostic.
7. Font C, Cid MC, Coll-Vincent B et al. Clinical features in patients with permanent visual loss due to biopsy-proven giant cell arteritis. Br J Rheumatol 1997; 36 : 251-254.
8. Hunder GG, Bloch DA, Michel BA et al. The American College of Rheumatology 1990 criteria for classification of giant cell arteritis. Arthritis Rheum 1990; 33 : 1122-1128.
9. Lauwerys BR, Puttemans T, Houssiau FA et al. Color Doppler sonography of the temporal arteries in giant cell arteritis and polymyalgia rheumatica. J Rheumatol 1997; 24 : 1570-1574.
10. Murgatroyd H, Nimmo M, Evans A et al. The use of ultrasound as an aid in the diagnosis of giant cell arteritis: a pilot study comparing histological features with ultrasound findings. Eye 2003; 17 : 415-419.
11. Nesher G, Shemenh D, Mates M et al. The predictive value of the halo sign in color Doppler ultrasonography of the temporal arteries for the diagnosing giant cell arteritis. J Rheumatol 2002; 29 : 1224-1226.
12. Schmidt WA. Doppler ultrasonography in the diagnosis of giant cell arteritis. Clin Exp Rheumatol 2000; 18(Suppl 20): S40-S42.
13. Banks PM, Cohen MD, Ginsburg WW et al. Immunohistologic and cytochemical studies of temporal arteritis. Arthritis Rheum 1983; 26 : 1201-1207.
14. Andersson R, Hansson GK, Soderstrom T et al. HLA-DR expression in the vascular lesion and circulating T-lymphocytes of patients with giant cell arteritis. Clin Exp Immunol 1988; 73 : 8287.
15. Uddhammar A, Roos G, Näsman B et al. Peripheral blood lymphocytes subsets in polymyalgia reumatica. Clin Rheumatol 1995; 14 : 62-67.
16. Pountain GD, Keogan MT, Brown DL et al. Circulating T cell subtypes in polymyalgia reumatica and giant cell arteritis: variation in the proportion of CD8+ with prednisolone treatment. Ann Rheum Dis 1993; 52 : 730-733.
17. Martinéz-Taboada VM, Gorozny JJ, Weyand CM. Clonally expanded CD8 T cells inpatients with polymyalgia reumatica and giant cell arteritis. Clin Immunol Immunopathol 1996; 79 : 263-270.
18. Martinéz-Taboada VM, Blanco R, Fito C et al. Circulationg CD8+ T cell in polymyalgia reumatica and giant cell arteritis: a rewiew. Seminars in Arthritis and Rheum 2001; 30 : 257-271.
19. Rosenthal M, Mullen W, Albert ED et al. HL-A antigens in 15 patients with polymyalgia rheumatica and in 1142 controls. N Eng J Med 1975; 292 : 595.
20. Gonzalez-Guy MA. Genetic epidemioliogy of GCA and PMR. Arthritis Res 2001; 3 : 1554-1157.
21. Weyand MC, Goronzy JJ. Molecular approaches toward pathologic mechanism in GCA and Takayasu´s arteritis. Curr Opin Rheumatol 1995; 7 : 30-36.
22. Dababneh A, Gonzalez-Gay MA, Garcia-Porrua C et al. GCA and PMR can be differentiated by distinct patterns of HLA class II association. J Rheumatol 1998; 25 : 2140-2145.
23. Salvarani C, Boiardi L, Mantovani V et al. HLA-DRB1 alleles associated with PMR in northern Italy. Ann Rheum Dis 1999; 58 : 303-308.
24. Reviron D, Foutrier C, Gula S et al. DRB1 alleles in PMR and rheumatoid arthritis in southern France. Eur J Immunogenet 2001; 28 : 83-87.
25. Gonzalez-Guy MA, Garcia-Porrua C, Hajeer AH et al. HLA-DRB1*04 may be a marker of severity in GCA. Ann Rheum Dis 2000; 59 : 574-575.
26. Gonzalez-Guy MA, Hajeer AH, Dababneh A et al. Seronegative rheumatoid arthritis in elderly and PMR have similar patterns of HLA association. J Rheumatol 2001; 28, 122-125.
Štítky
Diabetologie Endokrinologie Interní lékařstvíČlánek vyšel v časopise
Vnitřní lékařství

2006 Číslo 7-8
- Neuropatie u diabetu: Proč ji nepřehlédnout a kdy myslet i na deficit vitaminů B?
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Tirzepatid – nová éra v léčbě nadváhy a obezity
Nejčtenější v tomto čísle
- Nesteroidní antirevmatika a ledviny
- Systémový lupus erytematózus
- Ankylozujúca spondylitída - súčasný stav a nové možnosti liečby
- Antifosfolipidový syndrom


