-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nové trendy v diagnostice a léčbě systémové sklerodermie
New Trends in Diagnosis and Treatment of Systemic Sclerosis
Systemic sclerosis (SSc) is a generalised connective tissue disease of unknown origin, which clinically shows by skin thickening and sclerosis of different extent (scleroderma) and by typical involvement of visceral organs. At the same time fibrotic and sclerotic changes occur in the blood vesel walls. SSc usually involves females at young and middle age. Myalgias, arthralgias and arthritis are nonspecific, tendon friction rubs in fingers are more typical for this diagnosis. Gastrointestinal involvement starts early in the oropharyngeal part, esophagus and proceeds into the distal parts. Fibrotic changes lead to slow transit dysmotility and pseudoobstruction and/or dilation of the bowels. The main symptoms are dysphagia, pyrosis, malabsorption and constipation. SSc produces two major patterns of abnormality within the lungs - a fibrosing alveolitis or a primary pulmonary vascular disease. More frequently an insterstitial process develops which can be followed by pulmonary arterial hypertension. Cardiac involvement can also have different forms. Myocardial fibrosis usually appears at first in the conduction system by arrhythmias and various conduction blocks while pericarditis is mostly asymptomatic. Renal manifestation of SSc is observed in 8 - 10 % patients. The most severe form - scleroderma renal crisis is characterised by the new onset of accelerated hypertension and rapidly progressive oliguric renal failure. No therapies have been proven to modify the course of SSc. Some of the drugs can affect only the skin changes. Majority of the currently applied agents have only a symptomatic effect.
Key words:
systemic sclerosis - Raynaud‘s phenomenon - fibrosis - sclerosis - alveolitis - hypertension
Autoři: R. Bečvář; J. Štork; P. Jansa
Působiště autorů: Revmatologický ústav, Praha, ředitel prof. MUDr. Karel Pavelka, DrSc.
Vyšlo v časopise: Vnitř Lék 2006; 52(7-8): 712-717
Kategorie: 130. internistický den – Revmatologie v klinické praxi
Souhrn
Systémová sklerodermie (SSc) je generalizované onemocnění pojivové tkáně nejasného původu, které se klinicky projevuje ztluštěním - fibrózou a sklerotizací kůže různého rozsahu (sklerodermie) a typickým postižením řady viscerálních orgánů. Současně dochází k fibrotickým a sklerotickým změnám ve stěně cév. Postihuje častěji ženy v mladším a středním věku. Myalgie, artralgie a artritidy jsou nespecifické, pro diagnózu spíše svědčí třecí šelesty šlachových pochev flexorů prstů horních končetin. Postižení trávicího traktu se projevuje časně v orofaryngeální části, jícnu a později i v distálních partiích. Fibrotické změny vedou ke zpomalení pasáže až stáze obsahu a dilataci trávicí trubice. To se projevuje dysfagií, pyrózou, malabsorpcí a poruchami vyprazdňování. Plicní postižení mívá formu intersticiální nebo jako plicní arteriální hypertenze. Ta může být samostatná nebo se rozvíjí sekundárně při pokročilé difuzní fibróze. Častější je postižení alveolů - alveolitida s následnou fibrózou. Postižení srdce může mít několik forem. Fibróza myokardu se manifestuje na vodivém systému poruchami rytmu a síňokomorovými bloky. Perikarditida je častým sekčním nálezem. Renální manifestace se zjišťuje u 8 - 10 % nemocných. Nejvážnější formou je sklerodermická renální krize s náhle vzniklou hypertenzí a rychlým rozvojem anurie. Nejsou dosud k dispozici žádné léky, které by spolehlivě ovlivnily průběh SSc, některé z nich působí jen na kožní složku nemoci. Ostatní podávané léky mají pouze symptomatické účinky. Budoucností terapie jsou nesporně biologické léky.
Klíčová slova:
systémová sklerodermie - Raynaudův fenomén - fibróza - sklerotizace - alveolitida - hypertenzeÚvod
Systémová sklerodermie (SSc) je definována jako difuzní choroba pojivové tkáně nejasného původu postihující kůži a některé vnitřní orgány. Je charakterizována fibrotickou sklerotizací periferních a viscerálních cév [1]. Je provázena výskytem specifických autoprotilátek.
Incidence a prevalence
Postiženy bývají ženy (4-8krát častěji než muži) ve věku 45-55 let. Prevalence dosahuje 3-10 nemocných na 100 000 obyvatel a incidence SSc podle různých autorů kolísá mezi 2-10 případy na milion obyvatel.
Klasifikace
Základní klasifikační kritéria SSc zaručující určitou srovnatelnost výsledků klinických hodnocení byla publikována v roce 1988 (tab. 1) [2]. Tato klasifikační kritéria plně nevystihují pestrý obraz této nemoci.
Tab. 1. Klasifikační kritéria systémové sklerodermie [2]. ![Klasifikační kritéria systémové sklerodermie [2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b79eb1ab7890862628e6372605fb1399.jpg)
Etiologie a patogeneze
Etiologie nemoci je neznámá. Sekundární SSc může být vyvolána dlouhodobou prací s vibračními nástroji, rozpouštědly a silikonem. Generalizovaný charakter a podobnost strukturálních změn v patogeneze svědčí pro významnou úlohu určitých látek cirkulujících v oběhu a některých buněk, jako jsou endotelie, buňky hladké svaloviny, lymfocyty, monocyty, eozinofily a mastocyty [3]. Nesporně významnou úlohu mají interakce mezi buňkami a extracelulární matrix, buď přímé nebo zprostředkované cytokiny a jejich receptory. Výsledkem těchto složitých interakcí je aktivace fibroblastů zprostředkovaná zejména transformujícím růstovým faktorem β [4] a růstovým faktorem odvozeným od destiček vedoucí k jejich zvýšené proliferaci a syntéze složek mezibuněčné hmoty. Tvoří se především kolagenní vlákna, která jsou ukládána ve stěnách cév a parenchymu řady orgánů.
Klinický obraz
SSc je heterogenní choroba, zejména v iniciálních stadiích, co se týká průběhu i rozsahu postižení. Má obvykle celkové projevy - hubnutí, únavnost a reaktivní deprese.
Cévní abnormality - řadí se k nim zejména Raynaudův fenomén postihující až 96 % nemocných SSc [5]. Tento příznak je definován jako epizodické barevné změny od bílé až po fialovou vyvolané chladem nebo stresem. Kromě prstů se objevuje na uších, nose i jazyku. Ve fázi zbělení je vnímán jako pocit tuposti až necitlivosti, při hyperemii jako pálení a brnění. Při SSc vzniká však i strukturální zúžení cév, které může způsobit úplný uzávěr lumen. Na závažnosti Raynaudova fenoménu také závisejí ischemické změny prstů, u třetiny nemocných dochází ke vzniku ulcerací a někdy k nekróze až gangréně článků prstů (obr. 1). Raynaudův fenomén ve vnitřních orgánech (plicích, srdci a ledvinách) vede k vazivovým změnám jejich hlavních tepen. Do obrazu nemoci patří také změny mikrovaskulatury [6].
Obr. 1. Raynaudův fenomén při systémové sklerodermii s trofickými defekty po amputacích distálních falang. 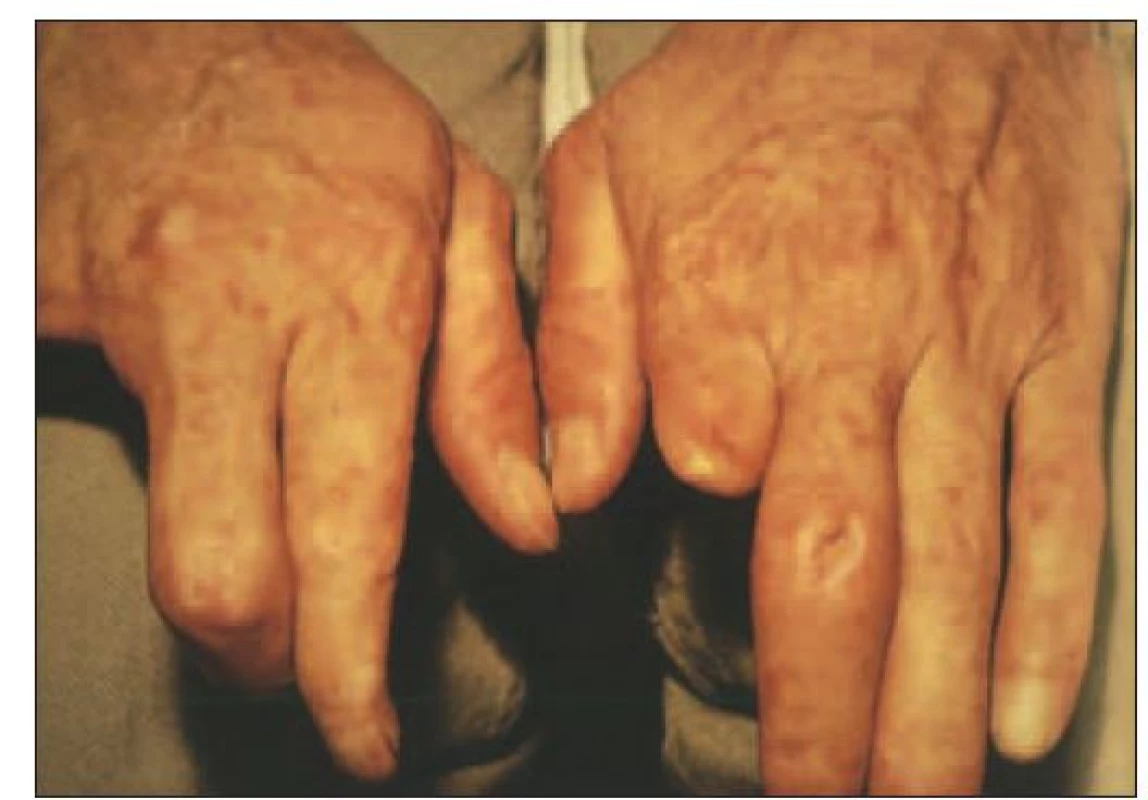
Kožní postižení je nejtypičtějším projevem SSc. Výsledkem zánětlivého procesu je tuhnutí a ztluštění kůže. V počáteční fázi dochází k edematózním změnám zejména na prstech rukou, které jsou subjektivně vnímány jako artralgie a ranní ztuhlost. Následuje fáze indurace - sklerodermické ztluštění, kdy je pokožka lesklá, ztrácejí se adnexa a kůže může svědit [7]. Obličej nabývá maskovitého vzhledu, ztrácí se mimika a objevují se radiální rýhy kolem ústního otvoru. Lokalizace sklerodermických změn je základem pro klasifikaci SSc. Rozhodujícím měřítkem jsou změny přesahující metakarpofalangeální klouby.
Postižení trávicího ústrojí je nejčastějším viscerálním projevem SSc. Jde především o postižení jícnu: dochází k dysfagii a rozvíjí se nedostatečnost dolního svěrače vyvolávající regurgitaci žaludečního obsahu, a tedy úporné pálení žáhy. Může vzniknout erozivní ezofagitida s krvácením a následnou pozánětlivou strikturou [8]. Postižení žaludku je časté, může se projevit zvracením, ale většinou je asymptomatické. Postižení tenkého střeva se manifestuje nadýmáním, křečemi, intermitentními nebo chronickými průjmy a projevy malabsorpce. Stáza střevního obsahu vyvolává nadýmání, nauzeu, bakteriální dysmikrobie a posléze steatoreu. Méně častým příznakem je adynamický ileus s dystenzí, vzácněji nacházíme pneumatosis cystoides intestinalis a benigní pneumoperitoneum. Hypomotilita tlustého střeva vyvolává střídavé stolice, po delším průběhu se může vyvinout divertikulóza s obstrukcí, někdy i perforací. Deprimující je pro nemocné postižení análního sfinkteru vyvolávající chronickou inkontinenci.
Plicní postižení je nejčastější příčinou smrti nemocných SSc. Rozlišujeme dva typy plicního postižení - intersticiální plicní proces neboli fibrotizující alveolitidu a primární plicní vaskulární chorobu [9]. Klinickým projevem intersticiálního procesu je pomalu progredující dušnost a suchý kašel, přičemž intenzita těchto příznaků nemusí korelovat s výsledky funkčních testů a RTG-obrazem. Nejčastějším poslechovým nálezem je inspirační krepitus při bazích, dále se může zachytit pleurální třecí šelest a omezené dechové exkurze. U difuzní formy nemoci vzniká plicní fibróza a sekundární plicní arteriální hypertenze poměrně rychle po začátku nemoci. U limitované formy se plicní postižení vyvíjí později a pomaleji a tento proces zůstává řadu let stabilizovaný bez výraznější alterace plicních funkcí. Jen u malé části dochází k rychlejšímu rozvoji klidové dušnosti a globální kardiopulmonální insuficience, která končí fatálně.
Plicní arteriální hypertenze je velmi závažným projevem a vyskytuje ve 12 % případů SSc [10]. Nemocní se stěžují na dušnost, únavnost a bolesti na hrudi, auskultačně pozorujeme akcentaci druhé ozvy nad arteria pulmonalis a krepitus při bazích. O plicní hypertenzi hovoříme, když tlak v plicnici v klidu je vyšší než 20 mm Hg nebo při zátěži vyšší než 30 mm Hg a současné zvýšení plicní rezistence nad 3 Woodovy jednotky. Plicní arteriální hypertenze je primární onemocnění plicních arteriol, které se vyskytuje buď samostatně, nebo provází intersticiální plicní fibrózu. Může se také projevit pasivním přenosem elevovaných tlaků při dysfunkci levé komory.
Muskuloskeletální příznaky zahrnují artralgie drobných kloubů ruky s ranní ztuhlostí, specifičtějším příznakem jsou třecí šelesty šlachových pouzder obvykle na flexorech prstů horních končetin [11]. U překryvných syndromů vídáme slabost proximálních svalových skupin.
Postižení srdce se klinicky projevuje nevýkonností, palpitacemi a dušností. Objektivní vyšetření prokazuje poruchy rytmu a známky městnaného selhávání. Perikarditida je symptomatická asi v 7-20 % případů, ale je častým sekčním nálezem. Postižení myokardu se manifestuje na vodivém systému poruchami srdečního rytmu a bloky [12]. Při větším rozsahu fibrózy nemocní trpí přechodnými ischemickými projevy až chronickou kardiální insuficiencí.
Renální postižení. Renální manifestace SSc se zjišťuje u 8-10 % nemocných. Jedná se buď o rychle progredující selhání u normotenzních nemocných, nebo progredující renální selhání u jedinců s náhle vzniklou maligní hypertenzí, a nebo proteinurii s azotemií s chronickým průběhem [13]. Nejvážnější formou je sklerodermická renální krize s náhle vzniklou hypertenzí a rychlým rozvojem anurie.
Neurologická manifestace zahrnuje častěji postižení periferních nervů ve formě mononeuropatie nebo polyneuropatie, někdy se manifestuje syndrom karpálního tunelu [14]. Vzácněji se může objevit postižení mozkových tepen, zejména v povodí karotid.
Laboratorní nálezy
Obvykle zjišťujeme mírnou normochromní normocytovou anémii, často trombocytopenii, vzácně hemolytickou anémii. Hodnoty reaktantů akutní fáze bývají lehce zvýšené nebo normální, a tedy nevystihují aktivitu choroby. Proto trvá úsilí najít jiné vhodnější markery k monitorování aktivity a účinnosti léčby (tab. 2) [15-17], ale žádný z nich nebyl dosud obecně přijat. Z imunologických vyšetření se popisuje přítomnost revmatoidních faktorů a kryoglobulinů až u 40 % nemocných. Antinukleární protilátky jsou pozitivní až v 90 % případů obvykle se zrnitým typem imunofluorescence [18]. Specifičtějším testem je přítomnost anticentromerových protilátek, které bývají pozitivní u 70 % nemocných s kožně limitovanou formou choroby [19]. Naproti tomu až u 40 % nemocných s kožně difuzní formou se zjišťují protilátky proti DNA topoizomeráze I označované jako anti-Scl-70.
Tab. 2. Potenciální ukazatele aktivity systémové sklerodermie a jejich klinické koreláty. 
SSc – systémová sklerodermie, vWFAg – sérová hladina antigenu von Willebrandova faktoru, VCAM-1 – plazmatická hladina vaskulární celulární adhezní molekuly-1, VEGF – plazmatická hladina vaskulárního endoteliálního růstového faktoru Další vyšetření
Při nevyhraněném kožním nálezu se provádí kožní excize s histologickým vyšetřením včetně imunofluorescenčního vyšetření. K objektivnímu hodnocení kožních změn se obvykle užívá modifikované Rodnanovo skóre [20]. Poruchy mikrocirkulace je vhodné ověřit již v časné fázi kapilaroskopickým vyšetřením nehtových valů prstů horních končetin [6].
K diagnostice postižení trávicího ústrojí se provádí radiologické vyšetření pasáže pomocí baryové kontrastní látky, gastrofibroskopie, scintigrafie jícnu, ezofageální manometrie, monitorování ezofageálního pH, scintigrafie jícnu pomocí radionuklidu 99mTc, nativní skiagram břicha, výpočetní tomografie, analýza stolice a testy na malabsorpci [21].
Muskuloskeletální postižení může dobře dokumentovat skiagrafické vyšetření rukou s obrazem resorpce distálních falang prstů horních končetin a mnohočetných podkožních kalcifikací.
Ke zjištění rozsahu a závažnosti plicního postižení se provádí kromě základního fyzikálního vyšetření funkční vyšetření plic včetně DLCO. Nezbytný je skiagram a vysokorozlišovací výpočetní tomografie (HRCT). Při postižení intersticia plic může ukázat typické obrazy: mlhovité zvýšení intenzity - obraz mléčného skla (ground glass) - alveolitida a/nebo voštinovité plíce - obraz medové plástve (honeycombing) - fibróza. Při těchto nálezech se provádí bronchoskopické vyšetření s bronchoalveolární laváží a cytologickým vyšetřením získané tekutiny [22]. K méně užívaným metodám patří epiteliální clearance pomocí radionuklidu 99mTc dietylentriaminu (DTPA), vyšetření krevních plynů podle Astrupa a otevřená plicní biopsie.
Klíčovým neinvazivním vyšetřením v diagnostice plicní arteriální hypertenze je echokardiografie, která slouží k odhadu tlaku v plicnici. Pro odhad stupně plicní hypertenze je rozhodující dopplerovské echokadiografické vyšetření. K definitivnímu průkazu slouží pravostranná katetrizace srdce s hemodynamickým vyšetřením [10].
Pro postižení srdce svědčí patologický EKG-záznam, který vždy doplňujeme transtorakálním nebo i ezofageálním echokardiografickým vyšetřením a při zjištění významnější dysrytmie také monitorováním EKG podle Holtera. Přesnější informaci nám může dát perfuzní scintigrafie myokardu s radionuklidem thalia. Zřídka se indikuje ventrikulografie, která může verifikovat dysfunkci levé komory.
Renální změny signalizuje nález významné proteinurie často s arteriální hypertenzí. Tento nález je nutno verifikovat biopticky, v histologickém obraze nacházíme zánětlivé změny na interlobárních tepnách a aferentních arteriolách. Při podrobnějším vyšetření nacházíme zvýšení plazmatické reninové aktivity a angiograficky redukci perfuze kortexu.
Diagnóza
Stanovení diagnózy vychází z klinického obrazu - kožního postižení, Raynaudova fenoménu, orgánových změn, průkazu specifických autoprotilátek a dalších vyšetření. Americká revmatologická asociace vypracovala obecně přijatá diagnostická kriteria SSc (tab. 3) [23], která však zcela nevystihují pestrost klinického obrazu této nemoci. Pro stanovení diagnózy a určení stupně a rozsahu postižení jednotlivých orgánů je nutná spolupráce s dermatologem, pneumologem, gastroenterologem, kardiologem, angiologem a někdy také nefrologem a neurologem.
Tab. 3. Diagnostická kritéria podvýboru Americké revmatologické asociace pro klasifikaci systémové sklerodermie [23]. ![Diagnostická kritéria podvýboru Americké revmatologické asociace pro klasifikaci systémové sklerodermie [23].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/5c55f9357461a91c5d887f0dde4c72f0.jpg)
Průběh a prognóza
Průběh SSc je značně variabilní, obvykle pozorujeme různě dlouhá období nízké aktivity, která střídají fáze exacerbace. U některých nemocných však dochází k progresivnímu zhoršování funkcí jednotlivých orgánů, zejména plic a trávicího ústrojí. Jelikož běžné reaktanty zánětu a další vyšetření nevystihují aktivitu choroby, byly navrženy několika autory potenciální ukazatele aktivity a zhoršení průběhu nemoci (tab. 4) [24,25]. Náš pracovní tým se v rámci řešení zadání výzkumných záměrů věnoval problematice ukazatelů metabolizmu kolagenu (N-terminálního propeptidu prokolagenu typu III, pyridinolinu a deoxypyridinolinu), interleukinů (interleukinu-6 a receptoru pro interleukin-2), adhezních molekul (intercelulární adhezní molekuly-1 a vaskulární adhezní molekuly-1), antigenu von Willebrandtova faktoru a endotelinu. Byla zjištěna korelace markerů kolagenního metabolizmu s ukazateli kožního postižení a funkčním dotazníkem. Koncentrace endotelinu korelovaly s poklesem DLCO. Došli jsme k závěru, že markery metabolizmu kolagenu jsou pro sledování fibrotických změn použitelné [26].
Tab. 4. Faktory zhoršení systémové sklerodermie [24,25]. ![Faktory zhoršení systémové sklerodermie [24,25].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/c4a57bca453a6d7664612ab95180e400.jpg)
RNP – ribonukleoprotein Prognóza nemocných je většinou dána závažností plicního postižení - intersticiální proces vede obvykle pomalu k rozvoji globální respirační insuficience s infaustním koncem. Plicní arteriální hypertenze se naopak vyznačuje rychlou progresí s velmi špatnou prognózou. Renální postižení nezřídka nastupuje akutně po obrazem sklerodermické renální krize, která mívá fatální vyústění. Dva roky od stanovení této diagnózy přežívá jen 40 % pacientů. Velmi špatná prognóza bývá také u jedinců s pokročilým multiorgánovým postižením [27].
Terapie
Léčba SSc musí být vždy komplexní [27]. Základem je edukace nemocného a vysvětlení základních režimových opatření. Je nutný zákaz kouření, práce s vibračními nástroji, kontakt s organickými rozpouštědly, silikonem a halogenovodíky a pobyt v prašném prostředí s částicemi křemíku.
Medikamentózní léčba se dělí na celkovou a lokální. Celkově bylo dosud vyzkoušeno asi 40 různých preparátů, avšak bez přesvědčivého výsledku. Ovlivnit základní proces se zpravidla nedaří, pokud byl pozorován nějaký účinek, tak pouze na kožní složku onemocnění. V současnosti se užívají nejčastěji dvě léčebná schémata. V edematózní fázi choroby se podává prednison 10-20 mg spolu s d-penicilaminem 300-750 mg denně. Při rozsáhlejší aktivní alveolitidě (ne samotné fibróze) podáváme dlouhodobě prednison 10-25 mg (metylprednisolon 8-20 mg) a cyklofosfamid ve formě intravenózních pulzů 10-15 mg/kg po 3-5 týdnech. Nadějnou metodou při multiorgánovém postižení se jeví autologní transplantace kmenových buněk po imunoablaci pomocí cytostatik. U naší nemocné byl tento výkon komplikován plicní hemoragií, po dvou měsících však došlo k ústupu alveolitidy v obraze HRCT [29]. Budoucnost celkové léčby jistě spočívá v biologických preparátech, které budou více či méně zaměřené na jednotlivé fáze imunopatologického děje (tab. 5).
Tab. 5. Potenciální cíle léčby SSc. 
IL – interleukin, IFN – interferon, TGF – transformující růstový faktor, PDGF – růstový faktor odvozený od destiček, bFGF – bázický růstový faktor fibroblastů Další postupy jsou orgánově specifické a mají pouze symptomatický efekt. Cévní změny, jako je Raynaudův fenomén, může zmírnit dlouhodobé podávání pentoxyfylinu, blokátorů kalciových kanálů, inhibitorů angiotenzin-konvertujícího enzymu (ACE) a antiagregancií. Lokální léčbu trofických změn na akrech obvykle vylepší širokospektrá antibiotika, infuze analogů prostaglandinů s následnou hyperbaroxickou terapií. Poruchy pasáže trávicím traktem, dyspeptické obtíže a gastroezofageální reflux zmírňují antacida, prokinetika a blokátory protonové pumpy. Léčba plicní hypertenze je poměrně komplikovaná a ekonomicky náročná. Ve specializovaných centrech se užívají prostanoidy aplikované inhalačně, intravenózně a subkutánně, dále pak antagonisté receptorů pro endotelin. Sklerodermická renální krize se léčí pomocí inhibitorů ACE, často je nutná hemodialyzační léčba.
Lokální terapie zahrnuje aplikace mastí s antibiotiky a nitroglycerinem, dále antipruritika, prostředky ke krytí ran a různá emoliencia. Ke zlepšení kožní složky slouží extrakorporální fotoforéza (ultrafialové ozáření periferních lymfocytů) a lymfoplazmaferéza.
Chirurgická intervence je nutná u nehojících se nekrotických a gangrenózních změn na akrech a k vynětí mnohočetných podkožních kalcifikací. V některých případech závažné pozánětlivé stenózy je nutná implantace protézy jícnu. Mezi další opatření patří speciální rehabilitační léčba, stomatologická péče, paruky a další pomůcky.
Kdy by měl internista uvažovat o diagnóze SSc?
Na toto onemocnění je třeba pomýšlet u nemocného s Raynaudovým fenoménem, u něhož se objeví difuzní otok prstů a hřbetů rukou spojené bolestmi drobných kloubů a ranní ztuhlostí. Časným příznakem bývá také pyróza, váznutí suché potravy a námahová dušnost. Pocity tuhosti v rukou a předloktích, únavnost, palpitace, dráždivý kašel a nauzea jsou již známkami pokročilejšího stavu.
V tomto přehledném referátu byly uvedeny výsledky získané při řešení Výzkumných záměrů MZd ČR č. 0002372801 a grantu IGA MZd ČR č. NR 7886-3.
doc. MUDr. Radim Bečvář, CSc.
www.revma.cz
e-mail: becv@revma.cz
Doručeno do redakce: 11. 5. 2006
Zdroje
1. Medsger TA. Comment on scleroderma criteria cooperative study. In: Black CM, Myers AR (eds). Systemic sclerosis (Scleroderma). New York: Glower Med 1985 : 235-249.
2. LeRoy EC, Black C, Fleischmajer R et al. Scleroderma (systemic sclerosis): classification, subsets and pathogenesis. J Rheumatol 1988; 15 : 202-205.
3. Furst DE, Clements PJ. Pathogenesis of scleroderma. In: Clements PJ, Furst DE. Systemic sclerosis. Baltimore: Williams&Wilkins 1996 : 275-286.
4. Roberts AB, Sporn MB, Assoian RK et al. Transforming growth factor type beta: rapid induction of fibrosis and angiogenesis in vivo and stimulation of collagen formation in vitro. Proc Natl Acad Sci 1986; 83 : 4167-4171.
5. Wigley FM, Wise RA, Mikdashi J et al. The postocclusive hyperemic response in patients with systemic sclerosis. Arthritis Rheum 1990; 33 : 1620-1625.
6. Maricq HR. Widefield capillary microscopy. Technique and rating scale for abnormalities seen in scleroderma and related disorders. Arthritis Rheum 1981; 24 : 1159-1165.
7. Rodnan GP, Lipinski E, Luksick J. Skin thickness and collagen content in progressive systemic sclerosis and localized scleroderma. Arthritis Rheum 1979; 22 : 130-140.
8. Jiranek GC, Bredfelt JE. Organ involvement: Gut and hepatic manifestations. In: Clements PJ, Furst DE Systemic sclerosis. Baltimore: Williams&Wilkins 1996 : 453-482.
9. Zatloukal P, Bečvář R, Štork J et al. Plicní postižení u progresivní systémové sklerózy. Čes Revmatol 1999; 7 : 16-21.
10. Jansa P, Aschermann M, Ambrož D et al. Plicní arteriální hypertenze u systémových onemocnění pojiva. Rheumatologia 2006; 20 : 13-18.
11. Shulman LE, Kurban AK, Harvey ABL. Tendon friction rubs in progressive sclerosis (scleroderma). Arthritis Rheum 1961; 4 : 438-445.
12. Follansbee WP, Miller TR, Curtis EI et al. A controlled clinicopathologic study of myocardial fibrosis in systemic sclerosis (scleroderma). J Rheumatol 1990; 17 : 656-662.
13. Steen VD. Organ involvement: renal. In: Clements PJ, Furst DE. Systemic sclerosis. Baltimore: Williams&Wilkins 1996 : 425-440.
14. Lukáč J. Systémová skleróza. Púchov: Lubor Šeba 1998 : 135-136.
15. Degiannis D, Seibold JR, Czarnecki M. Soluble and cellular markers of immune activation in patients with systemic sclerosis. Clin Immunol Immunopathol 1990; 56 : 259-266.
16. Greaves M, Malia RG, Milford WA et al. Elevated von Willebrand factor antigen in systemic sclerosis: relationship to visceral disease. Br J Rheumatol 1988; 27 : 281-285.
17. Kadono T, Kikuchi K, Sato S et al. Elevated plasma endothelin levels in systemic sclerosis. Arch Dermatol Res 1995; 287 : 439-442.
18. Tan EM, Rodnan GP. Profile of antinuclear antibodies in progressive systemic sclerosis (PSS). Arthritis Rheum 1975; 18 : 430-442.
19. Weiner ES, Hildebrandt S, Senecal JL. Prognostic significance of anticentromere antibodies and anti-topoisomerase I antibodies in Raynaud's disease. Arthritis Rheum 1991; 34 : 68-75.
20. Brennan P, Silman A, Black C et al. Reliability of skin involvement measures in scleroderma. Br J Rheumatol 1992; 31 : 457-460.
21. Clements PJ, Bečvář R, Drosos AA et al. Assessment of gastrointestinal involvement. Clin Exp Rheumatol 2003; 21 (Suppl 29): S15-S18.
22. Reynolds HY, Newbal L. Analysis of protein and respiratory cells obtained from human lungs by bronchial lavage. J Lab Clin Med 1974; 84 : 559-730.
23. Subcommittee for Scleroderma Criteria of the American Rheumatism Association. Diagnostic and Therapeutic Criteria Committee: Preliminary Criteria for the classification of systemic sclerosis (scleroderma). Arthritis Rheum 1980; 23 : 581-590.
24. Munves EF, Schur PH. Antibodies to Sm and RNP. Prognosticators of disease involvement. Arthritis Rheum 1983; 26 : 848-859.
25. Kahaleh MB, LeRoy EC. Interleukin-2 in scleroderma: correlation of serum levels with extent of skin involvement and disease duration. Ann Intern Med 1989; 110 : 446-450.
26. Bečvář R, Štork J, Pešáková V et al. Clinical correlations of potential activity markers in systemic sclerosis. Ann NY Acad Sci 2005; 1051 : 404-412.
27. Štork J, Bečvář R. Hodnocení závažnosti a aktivity systémové sklerodermie. Čes Slov Derm 2004; 70 : 213-217.
28. Lukáč J. Systémová skleróza. Púchov: Lubor Šeba 1998 : 256-316.
29. Bečvář R, Kozák T, Forejtová Š et al. Autologní transplantace kmenových buněk u nemocné systémovou sklerodermií s refrakterním intersticiálním plicním procesem. Čes Revmatol 2005; 13 : 73-76.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2006 Číslo 7-8- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
-
Česká a Slovenská internistická společnost ČLS JEP
Spolek lékařů Olomouc
130. INTERNISTICKÝ DEN REVMATOLOGIE V KLINICKÉ PRAXI - Úvodní slovo k přednáškám ze 130. internistického dne „Revmatologie v klinické praxi“
- Léčba časné artritidy - doporučení EULAR
- Podiel GD komplikácií vo vzťahu k liečbe NSA vo Slovenskej republike. Ročná prospektívna štúdia.
- Problematika kardiovaskulární toxicity koxibů a neselektivních NSA
- Nesteroidní antirevmatika a ledviny
- Polymyalgia rheumatica a obrovskobunková arteritída: prvé výsledky ročného sledovania.
- Jak pomáhá vyšetřování autoprotilátek v diagnostice a hodnocení autoimunitních revmatických chorob?
- Systémový lupus erytematózus
- Nové trendy v diagnostice a léčbě systémové sklerodermie
- Antifosfolipidový syndrom
- Časná diagnostika ankylozující spondylitidy
- Ankylozujúca spondylitída - súčasný stav a nové možnosti liečby
- Patogeneze, diagnostika a léčba dny
- Muskuloskeletální projevy diabetes mellitus
- Současné možnosti diagnostiky a léčby osteoporózy
-
Česká a Slovenská internistická společnost ČLS JEP
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Nesteroidní antirevmatika a ledviny
- Systémový lupus erytematózus
- Ankylozujúca spondylitída - súčasný stav a nové možnosti liečby
- Antifosfolipidový syndrom
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



