-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Riziková medikace a kontrastní látkou indukovaná nefropatie u pacientů s diabetem a hypertenzí
Risky medication and contrast media-induced nephropathy in patients with diabetes and hypertension
Contrast media-induced nephropathy (CMIN) is accompanied by high morbidity, lengthy hospitalization, and a higher mortality rate. In proportion to the rising number of diagnostic and interventional radiological procedures, the prevalence of this complication is also rising The study briefly tackles the currently known pathophysiological mechanisms that lead to CMIN and deals with various risk factors which increase the probability of development of contrast nephropathy. Among these factors are, in the first place, diabetes mellitus, a pre-existing renal illness and hypertension. In addition, the risk of developing CMIN significantly increases in patients on risky medication. In our study, this medication was a combination of ACEinhibitors (ACEI) and furosemide. Even though none of the patients met the criteria defined for CMIN, radiocontrast examination showed a significant statistical decline in glomerular filtration (GFR) and a rise in proteinuria (PU) in the sub-group which used this combination of medication. The risk level of this medication especially in patients with pre-existing nephropathy is also underlined by the suggested dependency of the relative rise in the serum levels of creatinine in terms of its input value. It is necessary, as early as the radiocontrast examination is being done, to bare in mind the possibility of CMIN occurring and avoid it also through the modification of the risk factors which can be influenced, e.g. elimination of risky medication and in indicated cases, taking preventive measures.
Key words:
nephropathy – contrast media-induced nephropathy – risk factors – preventive measures – ACE-inhibitors – furosemide
Autoři: D. Krusová; K. Ševela; D. Králová; P. Žák; V. Olšovská
Působiště autorů: II. interní klinika Lékařské fakulty MU a FN u sv. Anny, Brno, přednosta doc. MUDr. Miroslav Souček, CSc.
Vyšlo v časopise: Vnitř Lék 2006; 52(11): 1014-1020
Kategorie: Původní práce
Souhrn
Kontrastní látkou indukovaná nefropatie (contrast medium induced nephropathy – CMIN) je spojena s vyšší morbiditou, prodloužením doby hospitalizace a také s celkově zvýšenou mortalitou nemocných. V závislosti na narůstajícím počtu diagnostických a intervenčních radiologických zákroků stoupá prevalence této komplikace. V článku jsou shrnuty dnes známé patofyziologické mechanizmy odpovědné za vznik CMIN a rozebrána řada rizikových faktorů, které s sebou nesou možnost častějšího rozvoje kontrastní nefropatie. Jedná se zejména o diabetes mellitus, preexistující renální onemocnění a hypertenzi. Riziko vzniku CMIN se navíc výrazně zvyšuje u pacientů s rizikovou medikací. V naší práci byla touto medikací kombinace ACEinhibitory (ACEI) a furosemidu. I když u žádného z pacientů nedošlo ke splnění kritérií pro definici CMIN, prokázali jsme po radiokontrastním vyšetření u podskupiny s touto lékovou kombinací statisticky významný pokles glomerulární filtrace (GFR) a nárůst proteinurie (PU). Rizikovost této léčby zejména u pacientů s preexistující nefropatií podtrhuje i naznačená závislost relativního nárůstu sérových hladin kreatininu na jeho vstupní hodnotě. Již při indikaci radiokontrastních vyšetření je nutno na možnost vzniku CMIN myslet a předcházet jí také modifikací ovlivnitelných rizikových faktorů, např. eliminací rizikové medikace a v indikovaných případech zavedením preventivních opatření.
Klíčová slova:
nefropatie – kontrastní látkou indukovaná nefropatie – rizikové faktory – preventivní opatření – ACE-inhibitory – furosemidÚvod
Použití jodových kontrastních látek při kontrastních diagnostických vyšetřeních či intervenčních výkonech přináší vedle nesporného profitu pro pacienta i možnost vzniku komplikací spojených s podáním kontrastní látky. Nefrotoxický účinek radiokontrastních látek je znám více než 70 let. Přestože se jejich vlastnosti od té doby výrazně změnily, vyšetření spojené s jejich aplikací je stále spojeno s možností orgánového poškození.
Kontrastní látkou indukovaná nefropatie (contrast medium induced nephropathy – CMIN) představuje vážnou komplikaci, protože je spojena s podstatným zvýšením morbidity, zahrnující i potřebu krátkodobé hemodialýzy, s prodloužením doby hospitalizace a často i trvalým zhoršením ledvinných funkcí. Je odpovědna za více než 10 % případů získaného selhání ledvin za hospitalizace. Závažné je, že akutní tubulární nekróza jako morfologický podklad CMIN je nezávisle spojena se zvýšenou hospitalizační i dlouhodobou mortalitou [1,16].
Údaje o incidenci CMIN se v jednotlivých studiích liší v závislosti na poměru vysoce rizikových pacientů, typu použité kontrastní látky a také na použité preventivní metodě. Údaje se pohybují zhruba mezi 2 – 16,5 % případů [2–4]. Je zřejmé, že vzhledem k rostoucímu počtu radiokontrastních vyšetření jeví také výskyt kontrastní nefropatie stoupající tendenci.
Definice CMIN
Dříve byla CMIN definována různými způsoby. Většina klinických studií používala k definici manifestaci ledvinného selhání 48 hod po podání kontrastní látky (KL). Přesto je prokázáno, že u řady pacientů může dojít k renálnímu selhání po radiokontrastním vyšetření i týden po výkonu [2]. Vrchol vzestupu hladiny kreatininu v séru (S–krea) typicky nastupuje 3 – 5 dnů po podání kontrastní látky a vrací se k výchozí hodnotě asi po 1 – 3 týdnech, v některých případech se však renální funkce nemusí obnovit.
Pro výzkumné účely bylo dosaženo shody v kritériích pro stanovení definice CMIN [2,5,6]:
- akutní zhoršení renální funkce kvantifikované buď absolutním zvýšením hladiny kreatininu v séru o více než 44,2 umol/l nebo relativním zvýšením o více než 25 % nad hodnotu před podáním kontrastní látky
- akutní vzestup S–krea během 24 – 48 hodin, s maximem po 3 – 5 dnech po podání kontrastní látky
- vyloučení jiných příčin renálního selhání
Patofyziologické mechanizmy
Přesný mechanizmus renálního poškození nebyl dosud plně vysvětlen. Jedná se však o komplexní mechanizmus zahrnující intrarenální vazokonstrikci vedoucí ke snížené perfuzi dřeně ledvin a její ischemii, přímou tubulotoxicitu kontrastní látky, intratubulární obstrukci, oxidativní poškození tkáně a apoptózu. Hlavním místem poškození renální tkáně je zevní zóna dřeně, jde tedy o nefrotoxickou akutní tubulární nekrózu [7].
Ledvinná dřeň je k ischemickému postižení extrémně náchylná pro nízký stupeň perfuze již za normálních podmínek. Na zvířecích modelech je prokázáno, že po expozici kontrastní látce dochází k bifázické odezvě průtoku krve ledvinami. Změny v mikrocirkulaci začínají přechodnou několikahodinovou vazodilatací s charakteristickým zvýšením průtoku krve a pokračují následnou intenzivní vazokonstrikcí s prolongovaným snížením perfuze dřeně, což zhoršuje hypoxii [2,5,8,9]. Tento stav může přetrvávat i několik dnů.
Významnou roli v možném rozvoji CMIN hraje jak zvýšená vazokonstrikce, tak i snížená kompenzatorní vazodilatace. Působí zde řada vazoaktivních substancí jako angiotenzin II (AII), adenozin, renální prostaglandiny, kalciové ionty, NO a endotelin, které působí navzájem provázanými mechanizmy.
Kontrastní látka při své vysoké osmolalitě způsobuje osmotickou diurézu, a pokud nedojde k dostatečné hydrataci, může dojít k poklesu intravaskulárního objemu. Následná aktivace systému renin–angiotenzin–aldosteron (RAS) vede ke kompenzatorní reabsorpci Na a vazokonstrikci. AII způsobuje přednostně vazokonstrikci v. efferens, čímž udržuje filtrační tlak, ale snižuje průtok krve ke dřeni. AII může rovněž způsobit oxidativní stres a apoptózu nezávisle na vazokonstrikci [9]. Za normálních okolností kompenzuje redukci průtoku vazodilatace dřeně, zprostředkovaná vazodilatačně působícími prostaglandiny a endoteliálním NO. Pokud je produkce endoteliálních vazodilatačních působků snížena (u pacientů s vaskulárním onemocněním, s chronickou renální insuficiencí – CHRI, nebo u pacientů užívajících nesteroidní antirevmatika – antiflogistika – NSA), může následovat ischemie.
Ve vývoji CMIN hraje důležitou roli adenozin, jehož efekt závisí na aktivovaném receptoru [10]. Ukazuje se, že vazodilatace po podání kontrastní látky je zprostředkovaná A2–receptory, a upřednostňuje tak perfuzi dřeně. Naproti tomu přetrvávající vazokonstrikce a pokles glomerulární filtrace (GFR) u pacientů s renální dysfunkcí a objemovou deplecí je zprostředkována receptory A1 v aferentní arteriole. Receptor A1 tedy má významnou úlohu v předpokládané ischemii [5,11].
Dalším prostředníkem, který přispívá k ischemii zejména sestupných vasa recta zevní zóny dřeně a regionální hypoxii, je silný endoteliální vazokonstriktor endotelin (ET–1) [2,11]. Jeho hladiny v séru i v moči jsou po podání KL zvýšeny, o mechanizmech aktivace zatím není jasno.
Zatímco počáteční pokles GFR po podání kontrastní látky pravděpodobně souvisí se změnami v renální hemodynamice, zdá se, že pozdější pokles do jisté míry souvisí se zvýšenou intrarenální tvorbou volných kyslíkových radikálů. Vznikají v důsledku ischemie, během intrarenálního katabolizmu adenozinu na xantin [10]. Přirozená obrana před poškozením kyslíkovými radikály je zprostředkována substancemi, jako je kataláza, superoxiddizmutáza (SOD), glutathion, a nadto je negativně ovlivněna i kyselým pH. Také volumová deplece, rizikový faktor pro rozvoj CMIN, a nižší hladina Mg je spojena se sníženou oxidační obranou [10]. Kyslíkové radikály mohou měnit jak renální hemodynamiku, tak mají i cytotoxický efekt. Inaktivují lokálně v proximálním tubulu tvořený NO, což vede k aferentní vazokonstrikci s redukcí GFR a k inhibici kompenzatorní dřeňové vazodilatace [12–14].
Radiokontrastní látky také zapříčiňují přímé poškození tubulárních buněk [15]. Je pravděpodobné, že toxické poškození může v tubulárních buňkách působit samostatně, paralelně s mechanizmem oxidačního stresu [16,17]. Pro poškození tubulárních buněk svědčí nález nízkomolekulárních proteinů v moči u pacientů po kontrastním vyšetření.
Poškození tkáně u akutního renálního často není způsobeno buněčnou nekrózou, ale spíše subletálním poškozením a apoptózou, programovanou smrtí buňky, tedy reverzibilním procesem, který lze terapeuticky ovlivnit. Apoptóza je způsobena skupinou cysteinových proteáz nazývaných kaspázy, které mohou být spuštěny různými mechanizmy, k nimž např. patří nedostatek energie, oxidační stres, bakteriální nebo virové produkty, změna tonu arterií, cytokiny a léky [18]. Může být také spuštěna poškozením buněčné membrány, čímž se aktivují speciální tzv. Bax–proteiny umožňující uvolňování cytochromu C z mitochondrií do cytosolu, v němž může dojít k inicializaci aktivace kaspáz [12].
Rizikové faktory
Výskyt CMIN u pacientů s normálními renálními funkcemi je nízký, rozvine se v méně než 2 % případů. Existuje však řada specifických faktorů, které zvyšují riziko rozvoje CMIN. Jsou závislé na osobě pacienta, podané kontrastní látce a k výkonu samotnému [3,19,21]. Tři nejzávažnější rizikové faktory pro rozvoj CMIN představují preexistující renální dysfunkce, přítomnost diabetu a typ a množství použité kontrastní látky [5].
Za specifických klinických podmínek, jako je dehydratace, cévní nemoci, pokročilý věk a srdeční poruchy nebo hypertenze, incidence CMIN dále stoupá [20]. V těchto podmínkách jsou vystupňovány vazokonstrikční nebo toxické efekty CMIN, a to pro sníženou renální perfuzi, snížení počtu funkčních glomerulů nebo snížení antioxidační obrany. Konkomitující používání NSA nebo jiných nefrotoxických látek ještě více zvyšuje riziko renálního poškození [3].
Preventivní opatření
Pro prevenci rozvoje CMIN má prvořadý význam rozhodnutí, zda pacient patří do některé z rizikových skupin. Není-li rizikový, nemusí se provádět žádná specifická opatření. Je-li rizikový, je nutno nejdříve posoudit, zda nelze zvolit některé jiné zobrazovací metody bez použití kontrastní látky. Pokud je přesto nezbytné vyšetření s použitím kontrastní látky provést, musí být použita následující preventivní opatření k prevenci vzniku CMIN [8]:
- a) Vysadit všechny nefrotoxické léky 24 hod před vyšetřením (NSA, dipyridamol, acetaminofen, aminoglykosidy). ACEI nebo blokátory AII jsou povoleny, pokud je zajištěna adekvátní hydratace [8]. Pro prevenci možného vzniku laktátové acidózy je nutno vysadit metformin po kontrastním vyšetření alespoň na 2 dny, dokud není vyloučen rozvoj renálního selhání [21,22].
- b) Pokud je možno, vysadit kličková diuretika a dopamin. Pokud musí být podávány z jiných důvodů, striktně předcházet dehydrataci [5,8,10,11,23].
- c) Důsledně pečovat o dostatečnou hydrataci [24–27].
- d) Podat N–acetylcystein (NAC) 600 mg p.o. 2krát denně den před vyšetřením a v den podání kontrastní látky. Podat Aminophylin 250 mg (teofylin 200 mg) i.v. pomalu 30 min předem, zejména v případě akutní intervence nebo když jsou možnosti hydratace před zákrokem limitovány. Upravit hladinu Mg [11,28–31].
- e) Profylaktická hemofiltrace by mohla být prospěšná u pacientů s těžkou kardiální a renální dysfunkcí [6,8].
- f) Použít nízko – nebo izoosmolální kontrastní látku a podat ji v co nejmenším objemu [3,5,18,24,32,33].
Metody
Cíle
Cílem naší práce bylo zjistit možný negativní vliv radiokontrastního vyšetření na stav ledvinných funkcí u potenciálně rizikových pacientů s diabetes mellitus (DM) a hypertenzí. Současně jsme chtěli zjistit možný spolupodíl podávané rizikové medikace (ACEI a diuretika) na eventuální ledvinnou dysfunkci vzniklou po podání kontrastní látky.
Materiál a metody
Soubor tvořilo 30 pacientů, z toho 18 mužů a 12 žen v průměrném věku 65,6 roků. Jednalo se o diabetiky 2. typu s přítomnou diabetickou nefropatií. Zařazeni byli pacienti ve stadiu mikroalbuminurie (MAU) nebo manifestní proteinurie (PU), nejvýše do 500 mg/24 hod, normální azotemií nebo CHRI s hodnotami S–krea do 150 umol/l, S–urea do 15,0 mmol/l. Současně byla u pacientů přítomna hypertenze korigovaná medikací s průměrnou hodnotou středního tlaku 102,7 mm Hg. Chronicky bylo medikováno 19 pacientů ACEI, z toho 5 v kombinaci s furosemidem. U všech pacientů bylo prováděno radiokontrastní vyšetření (angiografie cév dolních končetin).
U všech pacientů jsme vyšetřili před radiokontrastním výkonem renální funkce včetně GFR stanovené pomocí clearance endogenního kreatininu, MAU a PU, hladinu N–látek v séru, iontogram a lipidogram (tab. 1). Po provedeném kontrastním vyšetření se denně monitorovala hladina urey a kreatininu v séru a 2. – 3.den po zákroku byla sbírána moč na GFR a odpady bílkovin v moči, současně s kontrolním kompletním biochemickým vyšetřením séra.
Tab. 1. Charakteristika souboru. 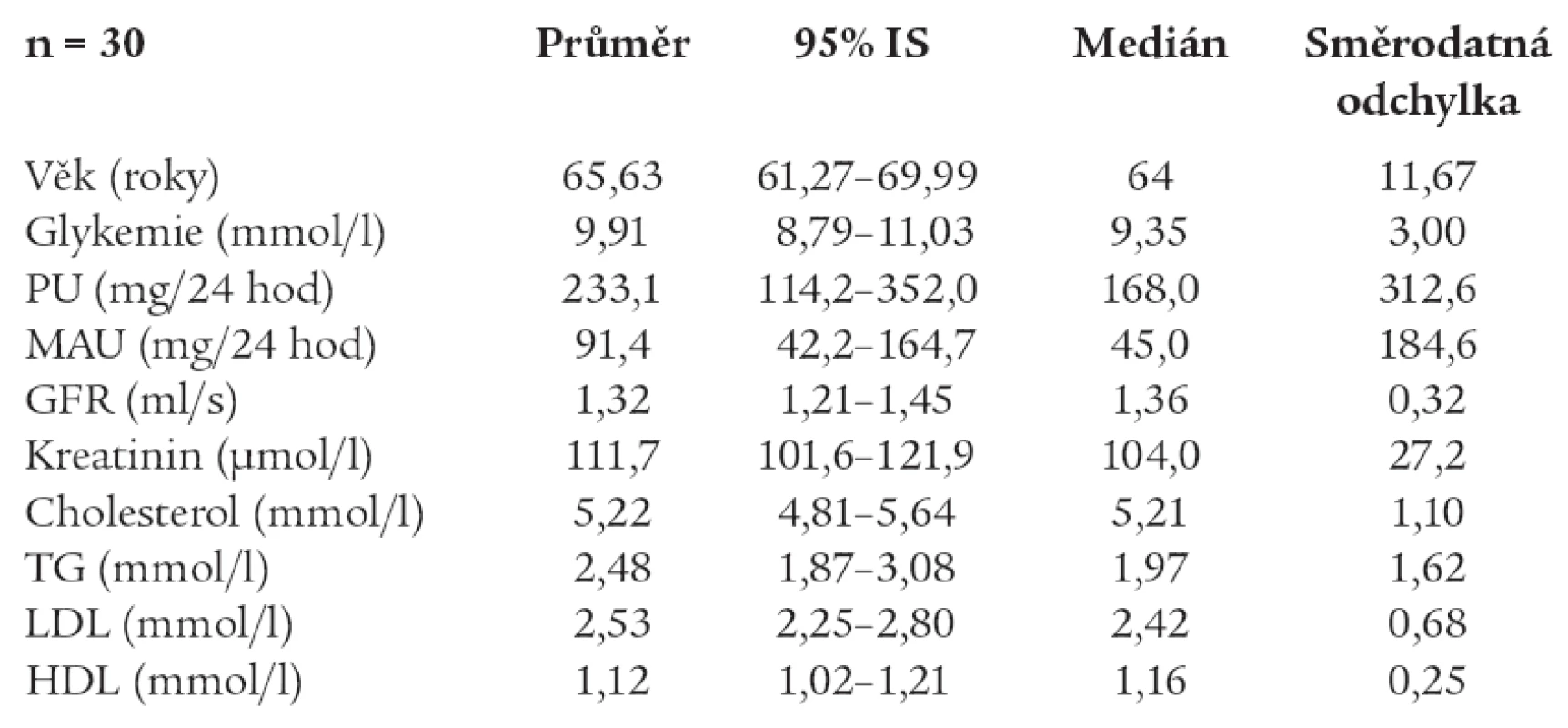
V souboru jako celku jsme hodnotili změny, ke kterým došlo u sledovaných parametrů před a po podání KL Dále jsme rozdělili celý soubor na (1) podskupinu pacientů užívajících ACEI a ostatní pacienty bez této lékové skupiny a (2) na podskupinu s kombinovanou léčbou ACEI s furosemidem a bez této kombinace. Tyto podskupiny jsme navzájem porovnávali z hlediska rozdílů relativních změn sledovaných parametrů v procentech, tedy rozdílů, ke kterým došlo po podání kontrastní látky vztaženo ke vstupní hodnotě. Současně jsme zkoumali možnou závislost těchto změn na věku pacienta, stavu kompenzace diabetu, vyjádřeném ukazatelem aktuální kompenzace (glykemie), na lipidogramu a hodnotách středního tlaku. Posuzovali jsme rovněž možný vztah deteriorace renálních funkcí na vstupní hodnotě GFR a S–krea.
Výsledky byly zpracovány programem Statistika 7.0, StatSoft, Inc. (2004). STATISTICA (data analysis software system), version 7. Protože bylo u všech sledovaných souborů dat prokázáno normální rozložení hodnot, byly pro hodnocení použity parametrické testy. Pro zjištění, zda se hodnoty parametrů během léčby změnily, byl použit párový t–test. Rozdíl v hodnotách parametrů mezi skupinami pacientů s různou léčbou byl hodnocen dvouvýběrovým t–testem. Použitá hladina statistické významnosti byla 5 %. Korelace parametrů byly spočítány využitím Pearsonova korelačního koeficientu (R).
Výsledky
Při hodnocení souboru jako celku jsme u žádného ze sledovaných renálních ukazatelů (S–urea, S–krea, GFR, MAU nebo PU) nenalezli statisticky signifikantní změny před a po podání kontrastní látky.
Iontogram ani lipidogram rovněž neprokazoval statisticky významné změny před a po provedeném radiokontrastním vyšetření ani nebyly nalezeny statisticky významné změny v hodnotách středního tlaku.
Zjistili jsme pouze statisticky významné snížení hladiny glykemie, ke kterému došlo po vyšetření kontrastní látkou u souboru jako celku (p = 0,023).
Co se týče možné závislosti relativních změn parametrů renálních funkcí na věku, aktuální kompenzaci diabetu, hodnotách středního tlaku a stavu lipidového spektra, nepodařilo se prokázat statisticky významnou závislost.
Při hodnocení možného podílu medikace ACEI na změnách renálních funkcí jsme neprokázali statisticky významné rozdíly v relativních změnách reálních funkcí mezi podskupinou s ACEI a bez nich.
Avšak u podskupiny pacientů, u kterých byla v medikaci kombinace ACEI s furosemidem, byl nalezen statisticky významný pokles GFR (p = 0,001) a nárůst PU (p = 0,015) oproti ostatním pacientům (tab. 2 a 3).
Tab. 2. Srovnání skupiny s kombinací ACEI a furosemid s ostatními. 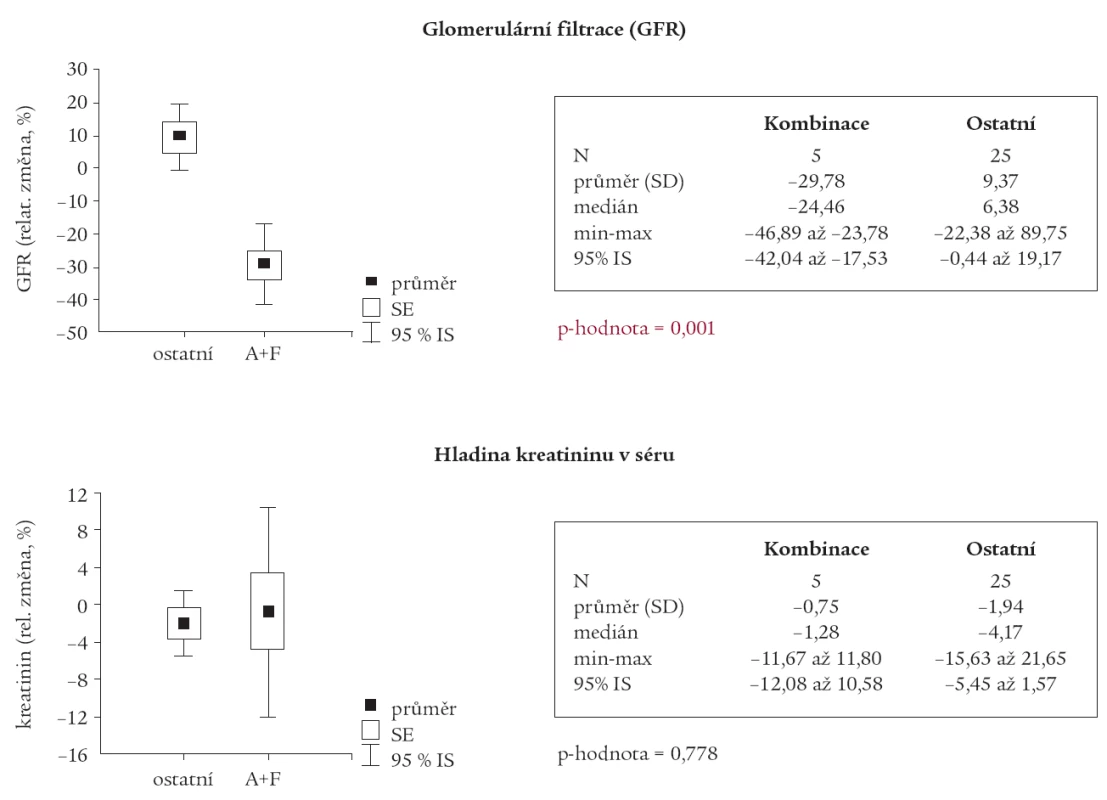
Tab. 3. Srovnání skupiny s kombinací ACEI a furosemid s ostatními. 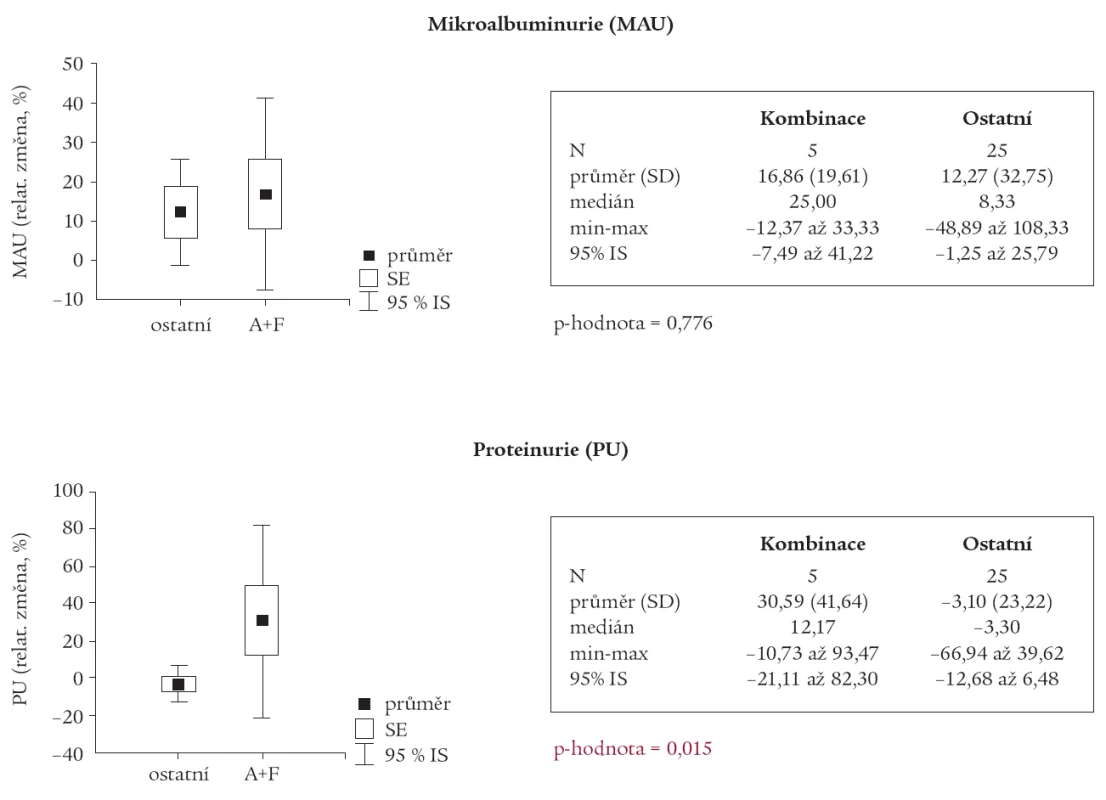
Závislost mezi relativní změnou GFR a S–krea a vstupními hodnotami těchto parametrů nebyla prokázána jako statisticky významná u žádné ze skupin pacientů. Pouze u skupiny pacientů s kombinací ACEI s furosemidem je naznačen vztah, za nějž se vzrůstajícími vstupními hodnotami S–krea se relativní pokles zmenšuje a dochází k relativnímu nárůstu sérových hladin kreatininu (R = 0,824; p = 0,086).
Diskuse
Do našeho souboru jsme zařazovali pacienty, kteří přicházeli z ambulantní terénní péče k přípravě a provedení angiografického vyšetření cév dolních končetin. Více než třetina z nich (11/30) neměla chronicky medikován ACEI, i když vzhledem k přítomnosti diabetické nefropatii (DN) u nich byla k této léčbě indikace. Měli jsme tedy možnost porovnat, zda je eventuální změna renálních funkcí po radiokontrastním vyšetření ovlivněna přítomností této lékové skupiny. Při dimisi byly těmto pacientů ACEI do medikace doplněny.
Záměrně jsme do souboru nezařadili pacienty mající ve své medikaci metformin. Tuto lékovou skupinu je při postupu lege artis nutno vysadit na dobu 48 hodin po podání radiokontrastní látky pro riziko vzniku laktátové acidózy při eventuálním rozvoji renálního selhání po aplikaci KL.
Statisticky významné zlepšení ukazatele krátkodobé kompenzace diabetu v našem souboru bylo bezpochyby ovlivněno intenzivní glykemickou kontrolou, dietními opatřeními i aktuální úpravou inzulinové terapie během krátkodobé hospitalizace pacienta.
Je nutno konstatovat, že i když došlo u některých pacientů po podání KL k elevaci S–kreatininu a poklesu GFR, ani u jednoho z nich nebyla naplněna kritéria pro výše uvedenou definici CMIN.
Nález statisticky významného poklesu GFR, a naopak zvýšení PU v podskupině pacientů užívající kombinaci ACEI s furosemidem oproti zbytku souboru by bylo možno považovat za projev tubulotoxického působení KL. Pro poruchu resorpční funkce tubulárních buněk by svědčil i ten fakt, že rozdíl MAU před a po radiokontrastním vyšetření nevykazoval statisticky signifikantní rozdíl mezi oběma podskupinami. Na definitivní závěr je však náš soubor příliš malý, a je nutno tento předpoklad potvrdit na větším počtu pacientů.
Jedním z mechanizmů spolupodílejících se na výraznějším zhoršení renálních funkcí u pacientů s kombinací terapie ACEI a furosemidu bude představovat vedle samotného nefrotoxického působení i možnost snížené hydratace při chronické diuretické terapii. Současně je nutno brát v úvahu i možný nedostatečný perorální příjem tekutin v rámci přípravy před radiokontrastním vyšetřením.
Námi zjištěná tendence k závislosti relativního nárůstu S–krea na vstupních hladinách S–krea u podskupiny pacientů s kombinací ACEI s furosemidem oproti ostatním by vypovídala o větším riziku vyplývajícím z této lékové kombinace, zejména pro pacienty s preexistující chronickou renální insuficiencí. Bezpochyby je nutné další vyšetření většího počtu pacientů.
V patofyziologii rozvoje CMIN hraje aktivace systému renin–angiotenzin důležitou úlohu. Lze předpokládat, že by podání ACEI mohlo ovlivněním hemodynamiky v ledvinách působit preventivně z hlediska rozvoje CMIN. V literatuře jsou citovány studie, v nichž byl jednorázově podán kaptopril pacientům s renální dysfunkcí a jejichž výsledky prokázaly částečnou redukci poklesu GFR. Obdobné výsledky byly nalezeny i u diabetických pacientů [8,34]. Obecně však je doporučováno u pacientů s již zavedenou medikací ACEI pečlivě dbát o dostatečnou hydrataci v období před i po provedení kontrastního vyšetření [8].
Do poloviny 90. let minulého století byl furosemid lékem volby v rámci prevence kontrastní nefrotoxicity. Furosemid by měl vlivem svého působení redukovat ischemické postižení ledvin jednak tím, že udržuje GFR a diurézu, a také tím, že snižuje spotřebu kyslíku redukcí aktivního transportu chloridu i natria a kalia v ascendentním raménku Henleovy kličky. I když na základě farmakologického účinku furosemidu by se dal předpokládat jeho protektivní účinek, neexistují odpovídající klinické studie, které by jeho užití doporučily [2,5,11]. Randomizované studie ukazují dokonce možné poškození ledvin. Prokazují, že u pacientů trpících CHRI a diabetem léčených hydratační léčbou fyziologickým roztokem byla incidence CMIN nižší oproti těm, kteří dostávali hydrataci v kombinaci s furosemidem (p = 0,05). Stejně tak byl statisticky signifikantně vyšší vzestup S–krea u pacientů s hydratací a furosemidem oproti skupině pouze s hydratací (p = 0,01) [35].
Nežádoucí účinky furosemidu by mohly být připisovány jeho vazodilatačnímu efektu v oblasti ledvinné kůry, což zapříčiňuje redistribuci krevního průtoku v neprospěch dřeně [8]. V dnešní době převažují názory, že by furosemid jako preventivní opatření proti rozvoji CMIN podáván být neměl [23].
Závěr
Kontrastní látkou indukovaná nefropatie je závažnou komplikací vznikající na podkladě expozice kontrastní látce. Je spojena s podstatně zvýšenou morbiditou, prodloužením hospitalizace a zvýšením dlouhodobé mortality. Prevalence tohoto postižení v posledních letech stoupá se současně narůstajícím počtem diagnostických a intervenčních radiologických zákroků. Hlavní roli v rozvoji renálního postižení hrají hemodynamické a cytotoxické mechanizmy. U pacientů s přítomností rizikových faktorů, jako je diabetes mellitus, preexistující renální onemocnění a hypertenze, je provedení radiokontrastního vyšetření spojeno s výrazně vyšším rizikem vzniku CMIN, a to zejména u pacientů s rizikovou medikací. V naší práci byla rizikovou medikací kombinace ACEI a furosemidu. I když u žádného ze sledovaných pacientů nedošlo ke splnění kritérií pro definici CMIN, prokázali jsme po radiokontrastním vyšetření u podskupiny s touto lékovou kombinací statisticky významný pokles GFR a nárůst PU. Rizikovost této kombinace podtrhuje i naznačený trend k závislosti relativního nárůstu sérových hladin kreatininu na jeho vstupní hodnotě. Na možnost vzniku CMIN je nutno myslet a předcházet jí také modifikací ovlivnitelných rizikových faktorů, např. eliminací rizikové medikace a zavedením preventivních opatření v indikovaných případech.
Práce vznikla za podpory grantu MŠMT č. MSM0021622402.
odb. as. MUDr. Darja Krusová, Ph.D.
www.fnusa.cz
e-mail: darja.krusova@fnusa.cz
www.med.muni.cz
Doručeno do redakce: 1. 2. 2006
Přijato po recenzi: 26. 5. 2006
Zdroje
1. Merten GJ, Burgess WP, Gray LV et al. Prevention of contrast-induced nephropathy with sodium bicarbonate: A randomized controlled trial. JAMA 2004; 291 : 2328–2334.
2. Kandzari DE, Rebeiz AG, Wang A et al. Contrast nephropathy: an evidence-based approach to prevention. Am J Cardiovasc Drugs 2003; 3 : 395–405.
3. Gami AS, Garovic VD. Contrast nephropathy after coronary angiography. Mayo Clin Proc 2004; 79 : 211–219.
4. Rihal CS, Textor SC, Grill DE et al. Incidence and prognostic importance of acute renal failure after percutaneous coronary intervention. Circulation 2002; 105 : 2259–2264.
5. Cavusoglu E, Chhabra S, Marmur JD et al. The prevention of contrastinduced nephropathy in patients undergoing percutaneous coronary intervention. Minerva Cardioangiol 2004; 52 : 419–432.
6. Brendan J, Barrett MB, Parfey PS. Preventing nephropathy induced by contrast medium. N Engl J Med 2006; 354 : 379–386.
7. Soma VR, Cavusoglu E, Vidhun R et al. Contrast-associated nephropathy. Heart Dis 2002; 4 : 372–379.
8. Oudemans-van Straaten HM Contrast nephropathy, pathophysiology and prevention. Int J Artif Organs 2004; 27 : 1054–1065.
9. Johnson RJ, Feehalby J. Comprehensive Clinical Nephrology. London: Mosby 2003 : 13–26, 215–216.
10. Katholi RE, Woods WT jr, Taylor GJ et al. Oxygen free radicals and contrast nephropathy. Am J Kidney Dis 1998; 32 : 64–71.
11. Idée JM, Lancelot E, Pines E et al. Prophylaxis of iodinated contrast mediainduced nephropathy: a pharmacological point of view. Invest Radiol 2004; 39 : 155–170.
12. Štípek S et al. Antioxidanty a volné radikály ve zdraví a nemoci. 1. ed. Praha: Grada Publishing 2000 : 77–92.
13. Welch WJ, Tojo AB, Wilcox CS. Roles of NO and oxygen radicals in tubuloglomerular feedback in SHR. Am J Physiol Renal Physiol 2000; 278: F769–F776.
14. Liang M, Knox FG. Production and functional roles of nitric oxide in the proximal tubule. Am J Physiol 2000; 278 : 47.
15. Goldenberg I, Matetzky S. Nephropathy induced by contrast media: Pathogenesis, risk factors and preventive strategies. Can Med Assoc J 2005; 172 : 1461–1471.
16. Schück O, Tesař V, Teplan V. Klinická nefrologie. 1.ed. Praha: Medprint 1995 : 266.
17. Zager RA, Johnson AC, Hanson SY. Radiographic contrast media-induced tubular injury: Evaluation of oxidant stress and plasma membrane integrity. Kid Int 2003; 64 : 128–139.
18. Harwood SM, Yaqoob MM, Allen DA. Caspase and calpain function in cell death: Bridging the gap between apoptosis and necrosis. Ann Clin Biochem 2005; 42 : 415–431.
19. Krusová D, Ševela K. Kontrastní látkou indukovaná nefropatie. Vnitř Lék 2006; 52(9): 805–811.
20. Chertow GM. Prevention of radiocontrast nephropathy: Back to basics. JAMA 2004; 291 : 2376–2377.
21. Bader BD, Berger ED, Heede MB et al. What is the best hydration regimen to prevent contrast media-induced nephrotoxicity? Clin Nephrol 2004; 62 : 1–7.
22. The Royal Australian and New Zealand College of Radiologists: Guidelines for Metformin Hydrochloride and Intravascular Contrast, 2006; http://www.ranzcr.edu.au/collegegroups/reference/EBM/mhicm_guidel ines.cfm
23. Murphy SW, Barrett BJ, Parfrey PS. Contrast nephropathy. J Am Soc Nephrol 2000; 11 : 177–182.
24. Haglund M, Hesselstrand R, Nyman U et al. Contrast-induced nephropathy after computer tomography. Hydration and adapted contrast media dosage for the best prophylaxis. Lakartidningen 2005; 102 : 2864–2866 a 2869–2870.
25. McCullough PA, Soman SS. Contrast-induced nephropathy. Critical Care Clinics 2005; 21 : 261–280.
26. Stříbrná J, Peregrin JH, Teplan V. Radiocontrast induced nephropathy. Prakt Lék 2003; 83 : 270–272.
27. Bridges JM, Feldstein DA. Preventing contrast-induced nephropathy: a basic solution. WMJ 2005; 104 : 9–10.
28. Asher I, Hammerman A, Sthoeger Z. New usage for an old drug: acetylcysteine for contrast-induced nephropathy. Harefuah 2005; 144 : 642–646, 675.
29. Guru V, Fremes SE. The role of Nacetylcysteine in preventing radiographic contrast-induced nephropathy. Clin Nephrol 2004; 62 : 77–83.
30. Birck R, Krzossok S, Markowetz F. Acetylcysteine for prevention of contrast nephropathy: Meta-analysis. Lancet 2003; 362 : 598–603.
31. Shjalansky SJ, Vu T, Pate GE et al. N-acetylcysteine for prevention of radiographic contrast material-induced nephropathy: is the intravenous route best? Pharmacotherapy 2005; 25 : 1095–1103.
32. Spinazzi A, Pozzi Mucelli R Administration of iodinated contrast in patients with pre–existing renal failure. Radiol Med (Torino) 2004; 107 : 88–97.
33. Briguiori C, Tavano D, Colombo A. Contrast agent-associated nephrotoxicity. Prog Cardiovasc Dis 2003; 45 : 493–503.
34. Gupta RK, Kapoor A, Tewari S et al. Captopril for Prevention of Contrast - Induced Nephropathy in Diabetic Patients: A Randomised Study. Indian Heart J 1999; 51 : 521–526.
35. Solomon R, Werner C, Mann D et al. Effects of saline, mannitol, and furosemide on acute decreases in renal function induced by radiocontrast agents. N Engl J Med 1994; 331 : 1416–1420.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Mým kolegům!Článek Mitrální regurgitace 2006
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2006 Číslo 11- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Mým kolegům!
- Pozitronová emisní tomografie v diagnostice vaskulitid velkých cév – jedné z příčin horeček neznámého původu: editorial
- C−reaktivní protein – editorial
- Mitrální regurgitace 2006
- Mužská hormonální antikoncepce – editorial
- Klinické důsledky TRIM (Transfusion related immunomodulation) - editorial
- Riziková medikace a kontrastní látkou indukovaná nefropatie u pacientů s diabetem a hypertenzí
- Pozdní komplikace chronických zánětů respiračního traktu u nemocných s běžnou variabilní imunodeficiencí
- Význam anamnézy v diferenciálnej diagnostike reflexných a kardiogénnych synkopálnych stavov
- 18F-FDG PET v diagnostice vaskulitid velkých cév
- Prevalence hladin C−reaktivního proteinu u dospělé populace dvou regionů České republiky a jejich vztah k tělesnému složení
- Dyslipidemie u nemocných léčených peritoneální dialýzou
- Mitrální regurgitace: umíme správně načasovat chirurgické řešení?
- Tako tsubo syndrom - nový přírůstek do rodiny akutních stavů v kardiologii: aktuální sdělení
- Postihnutie kardiovaskulárneho systému u diabetikov so súčasne prítomnou poruchou funkcie štítnej žľazy
- Mužská hormonální antikoncepce
- Transfúziou navodená imunomodulácia a infekčné komplikácie
- Masivní plicní embolizace – pokus o embolektomii po selhání trombolytické léčby
-
XIII. sjezd České internistické společnosti, Brno, 1.–4. listopadu 2006
Sborník abstrakt k přednáškám
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Mužská hormonální antikoncepce
- Transfúziou navodená imunomodulácia a infekčné komplikácie
- Mitrální regurgitace: umíme správně načasovat chirurgické řešení?
- Masivní plicní embolizace – pokus o embolektomii po selhání trombolytické léčby
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



