-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
REAL/WHO klasifikace nádorů lymfatické tkáně: 10 let fungování společného jazyka z pohledu klinické praxe
The REAL/WHO classification of neoplastic disease of the lymphoid tissues: 10 years of common language function from the clinical practice view point
Neoplasms of lymphoid tissues represent relatively great and heterogeneous group of human tumors. The expansion of data on lymphomagenesis could help us to understand similarities and also differences among various subgroups of malignant lymphomas. Hence there has been an increasing need to exactly define, differentiate and classify individual lymphoma entities. Previous classification systems were based on a neoplastic cell and tissue morphology, only a few information about physiology and pathophysiology of immune system were incorporated in them. These lymphoma classifications have been a source of confusion for many years for both clinicians and pathologists. The construction of a new lymphoma classification was started in early 90th years of 20th century. The classification was publicated in 1994 as „A Revisited European-American Classification of Lymphoid Neoplasms“. For the first time in a history it has worked consistently with morphologic, immunophenotypic, genetic and clinical information together. The philosophy and form of REAL classification have been adopted by the new WHO Classification of Neoplastic Diseases of the Hematopoietic and Lymphoid Tissues. This scheme is now accepted as a modern and universal language of communication on the field of hemato–oncology.
Key words:
cytogenetics – immunophenotype – lymphoid neoplasms – non-Hodgkin’s lymphomas – REAL classification – WHO classification
Autoři: T. Papajík; L. Raida; K. Indrák
Působiště autorů: Hemato-onkologická klinika Lékařské fakulty UP a FN, Olomouc, přednosta prof. MUDr. Karel Indrák, DrSc.
Vyšlo v časopise: Vnitř Lék 2005; 51(6): 690-698
Kategorie: Přehledné referáty
Souhrn
Nádory lymfatické tkáně představují relativně velkou a různorodou skupinu lidských novotvarů. Nárůst údajů o lymfomagenezi pomohl pochopit podobnosti i rozdíly mezi různými subtypy maligních lymfomů. Z těchto poznatků narůstala potřeba přesně definovat, oddělit a utřídit jednotlivé chorobné jednotky. Klasifikační systémy byly v minulosti založeny velkou měrou na buněčné a tkáňové morfologii a odrážely jen málo dostupných informací o fyziologii a patofyziologii imunitního systému. Tyto klasifikace lymfomů byly mnoho let zdrojem rozčarování a zmatení jazyka mezi kliniky a patology. Vznik nové klasifikace byl iniciován na počátku 90. let 20. století. Klasifikace byla zveřejněna v roce 1994 jako Revidovaná evropsko-americká klasifikace lymfoidních nádorů (REAL). Poprvé v historii pracovala klasifikace nádorů dohromady jak s morfologickými, imunofenotypovými, genetickými, tak i s klinickými údaji. Filozofii a strukturu REAL klasifikace převzala nová WHO klasifikace nádorových chorob hemopoetické a lymfoidní tkáně. Její schéma nyní všeobecně slouží jako moderní a univerzální jazyk komunikace na poli hematoonkologie.
Klíčová slova:
cytogenetika – imunofenotyp – lymfoidní malignity – ne-hodgkinské lymfomy – REAL klasifikace – WHO klasifikace„Klasifikace představuje jazyk medicíny. Onemocnění musí být definováno a pojmenováno před tím, než může být diagnostikováno a léčeno.“
Nancy Lee Harris, profesorka patologie, Massachusetts General Hospital, Boston
Úvod
Druhá polovina 20. století byla obdobím exponenciálního nárůstu informací o imunitním systému, jeho fyziologii a patofyziologii. Rozvoj laboratorních technik dovolil přesnější popis chorob postihujících tento systém, zvláště pak nádorů vycházejících z lymfatických buněk a jejich prekurzorů. Ty tvoří poměrně velkou relativně nesourodou skupinu nozologických jednotek, lišících se svým biologickým chováním, morfologickými rysy, klinickým obrazem a prognózou. Již na počátku zmíněného období bylo zřejmé, že bude potřeba ustavit společný, všeobecně použitelný a srozumitelný model komunikace mezi patology a klinickými lékaři, resp. uvnitř těchto odborností navzájem. Takový model měl umožnit srozumitelnou interpretaci morfologických dat a srovnání výsledků léčby v mezinárodním měřítku a svou flexibilitou reagovat na nové poznatky laboratorního i klinického výzkumu. První snahy o sestavení klasifikace maligních lymfomů, zejména nonhodgkinských lymfomů (NHL) se datují do poloviny 30. let minulého století a během následujících 10 let vzniklo 5 velkých a velmi rozdílných klasifikací lymfoidních malignit [2,5,25]. Již v roce 1948 proto americký profesor patologie R. A. Willis ve své knize „Tumours of lymfoid tissue“ konstatuje: „Nikde v patologii není takový chaos názvů, jež zamlžují jasné pojmy, jako je tomu v případě lymfoidních nádorů“ [27]. Jeho slova nabyla na významu ještě mnohokrát v průběhu dalších let, kdy téměř každá nová klasifikace tumorů lymfatického systému byla zdrojem zmatení a frustrace jak patologů, tak i kliniků. Nicméně, jak vystihuje ve svém tvrzení A. T. Hopwood (1957): „Potřeba klasifikovat je základním lidským instinktem; jako sklon k hříchu nás provází tímto světem od narození a zůstává s námi až do smrti.“
Z mnoha hledisek odráží vývoj klasifikací maligních lymfomů pokrok, jehož bylo dosaženo v diagnostice, klasifikaci a léčbě nádorových chorob jako celku. V roce 2004 tomu bylo právě 10 let, kdy byl v časopise Blood (1. září 1994) publikován návrh Revidované evropsko-americké klasifikace lymfoidních neoplazií (REAL klasifikace), který předložila „International lymphoma study group (ILSG)“ – skupina 19 patologů převážně z Evropy a Spojených států [11]. Tento zcela nový koncept klasifikace maligních lymfomů totiž znamenal významný předěl v celém procesu konstrukce klasifikací lidských nádorů.
Pohled do historie klasifikací maligních lymfomů
V roce 1832, v době, kdy nebylo dostupné mikroskopické vyšetření a kdy zvětšení lymfatických uzlin způsobovaly nejčastěji infekční choroby, popsal Thomas Hodgkin ve svém článku „On some morbid appearances of the absorbant glands and the spleen“ chorobnou jednotku, o níž si myslel, že je nepochybně známa i jeho kolegům [14]. Nicméně jeho práce na více než 30 let upadla v zapomnění a až v roce 1856 Sir Samuel Wilks, pracující v Guy’s Hospital stejně jako před léty Thomas Hodgkin, objevil a detailněji popsal patologický materiál, tvořící základ Hodgkinova historického objevu [26]. Wilksova publikace zajistila Thomasi Hodgkinovi vědeckou nesmrtelnost a jeho jméno se časem stalo obecně používaným základem názvů Hodgkinovy choroby a ne-hodgkinských lymfomů.
V roce 1845 popsali nezávisle na sobě Virchow a Bennet první případy leukemie. Virchow v roce 1863 rozdělil leukemie na leukemické a aleukemické typy a mezi aleukemickými podtypy popsal lymfosarkom. V roce 1871 slavný chirurg T. Billroth použil poprvé označení maligní lymfom. V roce 1878 se o první popis buněk Hodgkinovy choroby pokusil Greenfield, ale přesná charakteristika těchto buněk vyžadovala nové histologické techniky. Teprve Ehrlichova metoda barvení histologických preparátů umožnila úplný popis buněk lymfogranulomu K. Sternbergovi (1898) a D. M. Reedové (1902) [2,25].
Roku 1934 došlo k prvnímu pokusu o utřídění spektra lymfatických nádorů v režii „American Registry of Pathology“ (ARP). V roce 1938 se o vytvoření další klasifikace pokouší Robb-Smith. O čtyři roky později (1942) kritizují Gall a Mallory ARP klasifikaci a označují ji za nepraktickou [25]. Sami vidí maligní lymfomy spíše jako jedno onemocnění s řadou různých morfologických variací než jako skupinu samostatně definovatelných chorob a navrhují třídění lymfomů podle morfologických kritérií, ale také upozorňují na to, že jednotlivé kategorie odrážejí odlišné klinické chování lymfomů.
Moderní historie klasifikací lymfomů začíná v druhé polovině 20. století u jména profesora Henryho Rappaporta. Ten se spolupracovníky (časopisecky poprvé v roce 1956, komplexně v roce 1966 v publikaci Atlas of tumor pathology vydané Armed Forces Institute of Pathology – AFIP) formuloval první klinicky relevantní histologickou klasifikaci nonhodgkinských lymfomů. Ta dělila všechny lymfomy dle typu infiltrace lymfatické tkáně (folikulární a difúzní) a podle velikosti nádorových buněk. Stejně jako ostatní patologové té doby i on věřil, že velkobuněčné lymfomy vznikají z nelymfatických buněk stromatu, a proto je uváděl jako histiocytární lymfomy [12,15,25].
Paralelně se patologická obec snažila o subklasifikaci Hodgkinova lymfomu. Ten v roce 1947 rozdělili Jackson a Parker na paragranulom, granulom a sarkom. V roce 1966 Lukes a Butler systém upravili a přidali kategorii nodulární sklerózy. Systém byl dopracován téhož roku na konferenci v Rye (USA) a obsahoval 4 známé jednotky (lymfocytární převaha, nodulární skleróza, smíšená buněčnost a lymfocytární deplece) [2,25].
Výrazný impulz pro další zpřesnění klasifikací a celého výzkumu lymfomů znamenala práce De Vita et al z roku 1975 [6]. Tato publikace demonstrovala fakt, že nezanedbatelná část nemocných s pokročilým difuzním histiocytárním lymfomem může po aplikaci konvenční protinádorové chemoterapie (kombinace mechloretaminu, vinkristinu, prokarbazinu a prednisonu – MOPP) dosáhnout kompletní remise choroby a velké procento z nich může být dokonce vyléčeno. Publikované zjištění zásadním způsobem měnilo pohled na biologickou a prognostickou vypovídací hodnotu předchozích klasifikací. Difuzní histiocytární lymfom řazený mezi lymfomy s nepříznivou histologií se náhle stal jednotkou, která bořila ucelenou systematiku morfologických klasifikací a jejich prognostickou relevanci.
V 60. letech 20. století bylo zjištěno, že terminálně diferencované lymfocyty se mohou po antigenní či mitogenní stimulaci transformovat ve velké proliferující elementy a že zřejmě existuje několik odlišných lymfocytárních linií. V 70. letech minulého století bylo již možno rutinně určit základní fenotyp lymfatických buněk (B a T lymfocyty, NK buňky) a pomocí dalších výzkumů bylo potvrzeno, že lymfomy mohou odrážet a kopírovat morfologii a fyziologii přirozeného vývoje buněk lymfatického aparátu a jsou tudíž nádory lymfatického systému [1,5]. Tento koncept zahrnuli do svých klasifikací Lennert v Evropě (1974 – Kielská klasifikace) a v Americe Lukes a Collins (1974) [18,19]. Obě klasifikace se používaly různou měrou především na kontinentech svého vzniku, což spolu s používáním různých „národních“ i dalších klasifikací (např. BNLI klasifikace ve Velké Británii – 1974, první WHO klasifikace – 1976) výrazně ztěžovalo komunikaci v odborné literatuře a praktickou interpretaci výsledků klinických studií hemato-onkology [2,5,7,12,15,17, 25]. Celý problém ústil mnohdy do různých komicky vyhlížejících situací, jež vedly dokonce ke zdařilým karikaturám problému. Jednu z těchto zdařilých komických napodobenin – klasifikaci D. J. Higbyho, publikovanou roku 1979 v New England Journal of Medicine uvádíme pro dokreslení (tab. 1) [13].
Tab. 1. Tab. 1. Higbyho klasifikace maligních lymfomů z roku 1979. 
Od poloviny 70. let 20. století proto hemato-onkologové zorganizovali několik konferencí ve Spojených státech a v Evropě s cílem dosáhnout shody s patology a nalézt jednotný přístup ke klasifikaci lymfomů. V roce 1982 pod hlavičkou National Cancer Institute v USA vychází klasifikace nazvaná „The Working Formulation for Clinical Usage“ (WF) [20]. Ta se snaží být pojítkem mezi různými klasifikacemi a má dovolit onu tolik žádanou vzájemnou komunikaci různých konceptů a stát se určitým esperantem patologů a kliniků. I když byl systém založený na morfologii (cytologie a histologická struktura) a korelaci s prognózou poměrně široce přijat hlavně v USA, v Evropě příliš akceptován nebyl [7,15,17,25]. Zásadněji totiž neřešil problémy klasifikace ve světle nově dostupných diagnostických metod, nedělil lymfomy dle fenotypu a nepojmenovával reálné, samostatně stojící jednotky, ale skupiny lymfomů, majících podobnou morfologii. Klinik v praxi často na první pohled nedovedl interpretovat patologické klasifikační označení lymfom „WF B-D“ a často se dotazoval, zda se tento lymfom bude chovat indolentně či agresivně. Pokud šifra „WF B-D“ byla převedena na termín folikulární lymfom, ihned si bylo možné představit biologickou podstatu nádoru, jeho možné klinické chování i léčbu, kterou bude vyžadovat. Working Formulation tak brzy ztratila nárok na svou existenci jak v obci patologů, tak i kliniků. Bylo jasné, že příští klasifikační schéma musí být postaveno na zcela nových principech, reflektujících pokrok v molekulární genetice, cytogenetice, imunocytologii, imunohistologii, ale také v oblasti klinické praxe.
REAL/WHO klasifikace lymfoidních nádorů
V roce 1991 založilo 19 patologů převážně z Evropy a Spojených států mezinárodní skupinu nazvanou „International lymphoma study group (ILSG)“, která se ročně scházela, aby diskutovala problémy spojené s vytvořením nové klasifikace lymfoidních nádorů. Bylo nutné se rozhodnout, zda vytvořit systém založený na principu „Working formulation“ nebo Kielské klasifikace či zkonstruovat zcela novou nomenklaturu melymfomů. Po souhlase všech členů skupiny byla zvolena vlastní cesta vytvoření zcela nového modelu podle následujících postulátů:
- Nejlepším přístupem k přesné klasifikaci lymfomů je vyjmenování všech samostatných klinicko-patologických jednotek (REALné jednotky), které lze identifikovat dostupnými metodami.
- Klasifikace by měla zahrnovat všechny lymfoidní neoplazie, včetně plazmocytomu, leukemií a Hodgkinova lymfomu.
- Nádory lymfoidního systému by měly být rozděleny do 3 hlavních kategorií: nádory pocházející z B-buněk, z T-buněk a Hodgkinův lymfom.
- Lymfomy z B - a T-buněk by měly být rozděleny na nádory z prekurzorů a periferních lymfocytů.
- Každá samostatná jednotka by měla být definována pomocí všech dostupných informací – histomorfologie, imunofenotypu, genetických znaků, klinických rysů a vztahu k fyziologickému buněčnému protějšku.
První návrh byl připomínkován v dubnu 1993 na konferenci v Berlíně a definitivní návrh byl otištěn 1. září 1994 v časopise Blood [11]. Zahrnoval jak nodální, tak extranodální formy a nezabýval se patologickými stupni nádoru, jež by mohly být zavádějícím a ne zcela objektivním, samostatně podaným parametrem. Struktura klasifikace byla v minulosti již opakovaně publikována, proto zde přehledně uvádíme až její aktualizovanou verzi – WHO klasifikaci (tab. 2). Během přípravy REAL-klasifikace a posléze i v publikované podobě byl rozdiskutován přínos jednotlivých parametrů v konstrukci konečné diagnózy maligního lymfomu.
Tab. 2. WHO klasifikace lymfoidních nádorů. 
Morfologie
Morfologie je obecně jakýmsi prvotním zdrojem informace o povaze lymfomu a může s jistým zjednodušením odrážet jeho biologické vlastnosti (genotyp, fenotyp, metabolickou aktivitu). Proto zůstává jako základní kámen v mozaice diagnostických metod lymfoidních nádorů.
Imunofenotyp
V REAL klasifikaci se lymfomy dělí na 2 velké skupiny – lymfomy vycházející z B lymfocytu a z T a NK lymfocytů. Tento základní krok musí být dále doplněn detailní detekcí ostatních významných antigenů. Imunofenotyp pak může sloužit jako velmi cenný údaj k přesnému zařazení některých lymfomů (lymfom z plášťových buněk, některé T-lymfomy aj) [22].
Genotyp
Lymfom, stejně jako každý další nádor, můžeme již dnes považovat s určitou nadsázkou za získanou genetickou chorobu. Spolu se zvyšujícím se poznáním nenáhodných genových změn u určitých skupin lymfomů, stoupá i význam genetické amolekulárně-genetické analýzy jejich buněk. Reciproké chromozomové translokace – t(14;18), t(11;14) a t(8;14) se nacházejí u folikulárních lymfomů, lymfomu z plášťových buněk, resp. Burkittova lymfomu a často mohou výraznou měrou přispět k upřesnění diagnózy.
Klinické rysy
Klinické vlastnosti lymfomů se staly integrální a praktickou pomůckou definice lymfoidních podjednotek. Jde zejména o místo vzniku lymfomu – v uzlinách (nodální formy) a mimo ně (extranodální formy), jímž jsou primárně definovány určité lymfomy – některé kožní lymfomy, splenický lymfom marginální zóny, T-buněčný lymfom spojený s enteropatií a jiné. Další klinickou informací je agresivita lymfomu a jeho prognóza. Cytologický a histologický stupeň agresivity není v REAL klasifikaci samostatně uváděn, posouzení agresivity je ponecháno na celkovém klinickém obraze choroby. Zároveň není možné klást rovnítko mezi agresivitu choroby a její prognózu. Díky moderně vedené terapii se totiž některé agresivní jednotky lymfoidních nádorů staly úspěšně léčitelnými chorobami s dobrou prognózou – Burkittův lymfom, T-anaplastický velkobuněčný lymfom aj. K posouzení prognózy je nutno použít komplex parametrů, klinicky užitečným základem se jeví Mezinárodní prognostický index (International Prognostic Index – IPI), který uvádíme v tabulce (tab. 3) [24].
Tab. 3. Mezinárodní prognostický index (IPI). 
LDH – laktát-dehydrogenáza, PS – performance status, ECOG – Eastern Cooperative Oncology Group
Fyziologický protějšek nádorových buněk
Srovnání nádorových buněk s jejich fyziologickým protějškem pomáhá charakterizovat morfologii a fenotyp lymfomu a může také vést k pochopení jeho klinického chování.
Reprodukovatelnost REAL klasifikace a její význam pro kliniku
Již v redakčním článku v časopise Blood 1. září 1994 poukazuje prof. S. A. Rosenberg na některá úskalí nového návrhu [23]. Autor zdůrazňuje, že v první etapě jde o návrh klasifikace, a ne o klasifikaci jako takovou. K tomu, aby byla definitivně přijata jako klasifikační schéma, je nutné otestovat několik faktorů. Jde zejména o její širší přijetí obcí patologů, pro něž by měla být srozumitelná a lehce reprodukovatelná a měla by umožnit zařazení většiny vyšetřovaných případů lymfoidních nádorů. Navíc by její přínos pro klinickou praxi měl být ověřen analýzou většího souboru nemocných s lymfomy, klasifikovaných dle REAL návrhu.
Na základě těchto doporučení se ILSG rozhodla podrobit návrh REAL klasifikace praktickému testování jak z hlediska histopatologie, tak i z hlediska klinického použití [12].
Bylo stanoveno 6 základních cílů:
- Zhodnotit schopnost hematopatologů retrospektivně aplikovat REAL návrh na skupiny nemocných s lymfomy ve všech částech světa.
- Určit roli imunotypizace a klinických údajů v diagnostice různých jednotek.
- Zjistit klinickou důležitost imunofenotypu.
- Určit intrapersonální a interpersonální reprodukovatelnost diagnózy jednotlivých typů lymfomů.
- Popsat klinické rysy a chování jednotlivých subtypů s ohledem na prognózu a přežití.
- Zjistit, zda by určité jednotky mohly být uspořádány do skupin se zhruba stejnou prognózou a terapeutickým přístupem.
Tyto úkoly byly testovány na retrospektivním souboru 1378 případů lymfomů z 8 světových center během let 1995 a 1996 [3,4]. Výsledky ukázaly, že REAL návrh umožňuje nejvyšší stupeň shody v diagnóze mezi názorem jednotlivého patologa a konsenzuálně přijatou diagnózou. Tento stupeň shody dosahoval hranice 86–95 %, což je o 20–40 % více než tomu bylo u Kielské či u WF klasifikace. Početně nejvíce byly v celém spektru lymfoidních nádorů zastoupeny difuzní velkobuněčné lymfomy (31 %) a folikulární lymfomy (22 %). Zatímco některé NHL mohou být diagnostikovány s vysokým stupněm jistoty i bez použití imunotypizace (folikulární lymfom), u dalších tato metoda představuje klíč k diagnóze (periferní T-lymfomy, T-anaplastický velkobuněčný lymfom) či diagnózu významně zpřesňuje (lymfom z plášťových buněk). Na základě rozboru prognostických faktorů bylo konstatováno, že nelze stanovit prognózu jen z histologického subtypu lymfomu, jelikož průběh choroby u nemocných s jedním a tímtéž nádorem může výrazně kolísat. Z tohoto hlediska se zdá důležité přihlédnout k dalším parametrům, jako je například IPI. Pro názornost – ačkoliv nemocní s folikulárním lymfomem mají většinou IPI skóre 1–3 a jejich medián celkového přežití se pohybuje v mnoha studiích nad 10 let, nemocní se stejným histologickým obrazem, ale IPI skóre 4–5 mají medián celkového přežití jen kolem 18 měsíců.
Přes tato fakta lze s určitou mírou zjednodušení a zobecnění vyčlenit 4 „prognostické“ skupiny lymfomů podle jejich diagnózy [4]:
- a) skupina s celkovým pětiletým přežitím větším než 70 % – lymfom marginální zóny MALT typu, T-anaplastický velkobuněčný lymfom, folikulární lymfom;
- b) skupina s celkovým pětiletým přežitím od 50 % do 70 % – lymfom z malých lymfocytů/B-chronická lymfatická leukemie, lymfoplazmocytární lymfom, nodální lymfom marginální zóny;
- c) skupina s celkovým pětiletým přežitím mezi 30–50 % – B-difuzní velkobuněčný lymfom (včetně primárně mediastinálního velkobuněčného lymfomu);
- d) skupina s celkovým pětiletým přežitím pod 30 % – lymfom z plášťových buněk, T-lymfoblastický lymfom a periferní T-lymfom.
Jednotlivé zastoupení lymfomů a jejich charakteristiky z „The non-Hodgkin’s lymphoma classification project“ ILSG skupiny shrnujeme v grafu a tabulce (tab. 4, graf 1).
Graf 1. Graf 1. Proporcionální zastoupení jednotlivých subtypů nonhodgkinských lymfomů podle The non-Hodgkin’s lymphoma classification project. 
Tab. 4. Jednotlivé zastoupení nejčastěji se vyskytujících lymfomů a jejich charakteristiky z The non-Hodgkin’s lymphoma classification project. 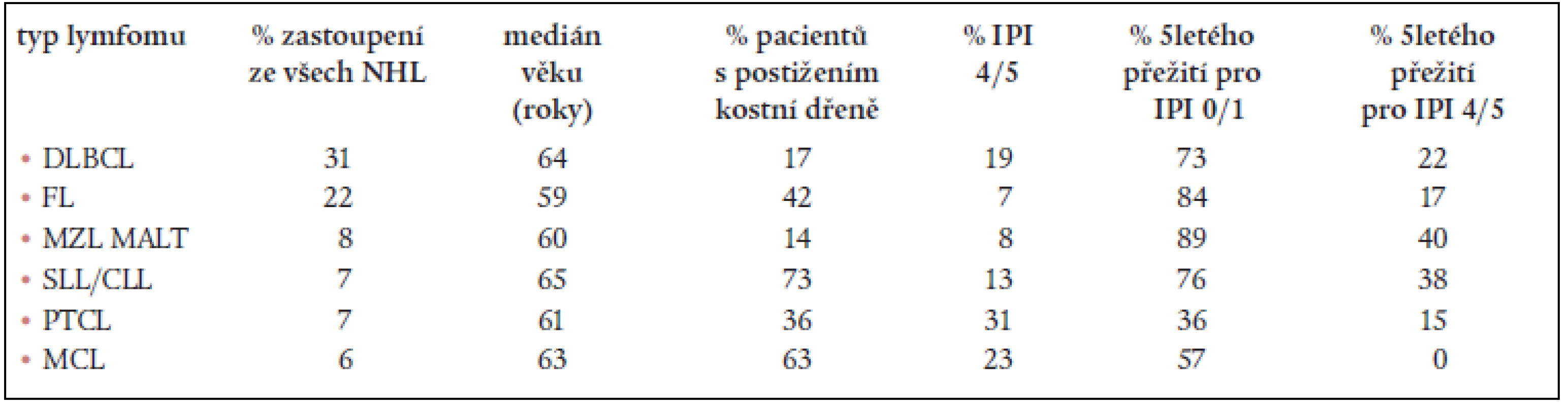
IPI – Mezinárodní prognostický index, DLBCL – difuzní B-velkobuněnčný lymfom, FL – folikulární lymfom, SLL/CLL – lymfom z malých lymfocytů/B-chronická lymfatická leukemie, MCL – mantle cell lymfom, PTCL – periferní T-buněčný lymfom, MZL MALT – lymfom marginální zóny MALT typu Výše uvedené závěry potvrdila také většina nezávisle probíhajících a posléze publikovaných studií. Návrh REAL klasifikace byl tedy široce a obecně přijat, neboť slovy jednoho z členů skupiny – prof. D. Masona – vyjadřoval to, co hematopatologové a hematoonkologové ve své praxi dělají, a ne, co by dělat měli [7].
WHO klasifikace lymfoidních malignit
V roce 1993 se Světová zdravotnická organizace rozhodla zmodernizovat svoji „modrou knihu“ nádorů hematopoetické a lymfoidní tkáně, která byla naposledy publikována v roce 1975 a která nebyla téměř nikdy klinicky používaná. Proto americká Společnost pro hematopatologii a Evropská asociace hematopatologů spojily své síly a pro zamýšlený WHO projekt začaly vytvářet odpovídající klasifikaci. Členové ILSG a úspěšný REAL model se stali krystalizačním jádrem WHO klasifikace. Skupina více než 50 patologů z celého světa začala od roku 1995 pracovat na projektu, který měl pojmenovat a roztřídit všechny nádory pocházející z krvetvorných buněk. Koncept WHO klasifikace počítal s rozdělením do 4 hlavních skupin: myeloidní neoplazie, lymfoidní nádory, choroby vycházející z mastocytů a histiocytární neoplazie. Stejně jako u REAL klasifikace byly k definici každé samostatné jednotky použity všechny dostupné údaje morfologické, fenotypové, genetické a klinické. Bylo znovu zdůrazněno, že každé výše zmíněné kritérium má u jednotlivé chorobné jednotky svou odlišnou váhu a důležitost, a tudíž u hematologických malignit nemůže existovat zlatý standard klasifikačních kroků. Aby konečné znění návrhu bylo maximálně užitečné pro klinicky orientovanou část odborné veřejnosti, byli přizváni hematologové a onkologové, aby zformovali klinický poradní výbor [7]. Mezi těmito odborníky kolovaly návrhy a připomínky a nakonec se participující skupiny setkaly na tzv. „Consensus Conference“ konané v listopadu 1997 v Airlie House ve Virginii, USA. První literární zprávy o zrodu WHO klasifikace byly publikovány od roku 1998, zpráva z konference v Airlie House ve Virginii v roce 1999 a 2000 [8,9,10,21]. Konečná podoba klasifikace se objevila v knize World Health Organization classification of tumors vydané v roce 2001 [16].
Pokud se týká části určené klasifikaci lymfoidních nádorů, byly využity zkušenosti předchozích let s aplikací REAL klasifikace. Výbor vzal do úvahy připomínky členů komise a do WHO schématu byly vloženy některé změny, které přehledně uvádí tabulka WHO klasifikace lymfoidních neoplazií (tab. 2). Nejdůležitější z nich bychom chtěli blížeji komentovat:
- Lymfoblastický lymfom a akutní lymfoblastická leukemie (ALL) tvoří jednu chorobu jen s rozdílnou klinickou manifestací. FAB klasifikace ALL (dělení na typy L1, L2, L3) není v dnešní době adekvátní a nevystihuje přesně biologickou podstatu a klinické chování jednotlivých subtypů. Výsledek cytogenetického vyšetření by měl tvořit podstatnou součást definice (určení) jednotlivých subtypů ALL pro svou výraznou prognostickou váhu (tab. 5).
- WHO klasifikace změnila název lymfomu folikulárního centra na folikulární lymfom (FL). Patolog by měl i nadále uvádět ve svém popisu cytologický stupeň („grading“) tohoto lymfomu. Z hlediska klinického významu by bylo důležité nadále odlišovat 2 stupně FL – stupeň 1 (malé buňky, nebo smíšené malé a velké buňky) a stupeň 2 (velké folikulární buňky, více než 15 centroblastů na jedno pole v nátěru při velkém zvětšení mikroskopu), počítání těchto buněk by se mělo i nadále provádět Berardem navrženou metodou (tzn. spočítat 10 až 20 odlišných polí v různých folikulech). V popisu by měly být také uváděny okrsky difuzního růstu nádoru s pokusem o jejich kvantitativní vyjádření. Tento údaj má svůj prognostický význam a v některých případech upozorňuje na nutnost intenzivní léčby nádoru.
- Termín B-buněčný extranodální lymfom marginální zóny MALT typu (MZL MALT) by měl být vyhrazen pro nádory vznikající z malých lymfocytů. Velkobuněčné lymfomy v MALT lokalizaci bychom měli označovat jako B-difuzní velkobuněčné lymfomy (DLBCL), a ne jako „high-grade“ MALT lymfomy. Otázkou zůstává, zda u klasických MZL MALT uvádět cytologický stupeň, jako je tomu u FL. Některé studie totiž poukázaly na to, že výrazně horší prognózu mají ty MZL MALT, které mají v nádorové tkáni přítomnu větší část transformovaných buněk (velké, blastické elementy). Nodální a splenický MZL tvoří samostatné jednotky, které se svou podstatou a chováním odlišují od MZL MALT subtypu.
- B-chronická lymfatická leukemie (B-CLL) a lymfom z malých B-lymfocytů představují jednu chorobu s odlišným stupněm postižení jednotlivých orgánů, resp. odlišným projevem. Případy B-CLL s plazmocytoidní diferenciací nemohou být považovány za samostatnou klinickou jednotku, když navíc není jasné, zda má tato diferenciace prognostický význam. Lymfoplazmocytoidní lymfom/imunocytom byl měl být uváděn jen jako lymfoplazmocytoidní lymfom. B-prolymfocytární leukemie se stala samostatnou kategorií.
- Lymfom z plášťových buněk by neměl být dále cytologicky stupňován ani histologicky dělen – není k tomu důvod hlavně z klinického hlediska, v případě blastické varianty by tato morfologická varianta měla být zmíněna.
- Difuzní velkobuněčný B-lymfom (DLBCL) by také neměl být dále cytologicky specifikován (v Kielské klasifikaci dělení na centroblastický a imunoblastický subtyp), protože neexistují zatím spolehlivá standardní biologická ani patologická kritéria pro subklasifikaci (i když WHO klasifikace připouští uvádění morfologických variant v patologickém závěru). Také z klinického hlediska není toto dělení výrazněji přínosné. Naděje je vkládána do klasifikace těchto lymfomů pomocí detekce jejich genetických změn, nejnověji metodami stanovení genové exprese pomocí tzv. mikročipů. Na druhé straně v popisu DLBCL by měla být uváděna lokalizace lymfomu (mediastinální – thymický, primárně ve výpotku, intravaskulární).
- Burkittově lymfomu podobný DLBCL by měl být napříště uváděn jako varianta Burkittova lymfomu, u těchto lymfomů je důležité provedení genetického vyšetření a zjištění podílu proliferujících buněk pomocí antigenu Ki-67 (frakce by měla být vyšší jak 99 %). Protože klinickým chováním se tento NHL výrazně podobá klasickému Burkittovu lymfomu, terapie by měla být vedena adekvátním způsobem.
- Lymfomy v terénu imunodeficitního stavu (s HIV spojené lymfomy) nepotřebují samostatnou klasifikaci a mohou být klasifikovány stejně jako ostatní jednotky. EBV status může být důležitý v určení prognózy a navržení léčebného postupu. Naproti tomu potransplantační lymfoproliferativní choroby tvoří samostatnou, ohraničenou skupinu chorob a vyžadují vlastní klasifikaci. Tu uvádíme v tabulce (tab. 6).
- V klasifikaci periferních T/NK-buněčných lymfomů hraje důležitou roli popis klinických příznaků a lokalizace. Periferní T-NHL jinak necharakterizované nemusí být podrobněji cytologicky děleny, z hlediska klinického to nepřináší podstatnější informaci, důležitější se jeví určení místa vzniku (nodální vs extranodální). Termín T-chronická lymfatická leukemie/prolymfocytární leukemie byl změněn na T-prolymfocytární leukemie z důvodu klinického průběhu a agresivity choroby. Angiocentrický T-lymfom je nyní uváděn jako extranodální T/NK-buněčný lymfom nazálního typu.
- Primárně kožní anaplastický velkobuněčný lymfom (ALCL) dnes musíme brát jako samostatnou jednotku, lišící se od nodálního typu ALCL. Nodální ALCL by měly být děleny podle výskytu reciproké translokace t(2;5), respektive ALK (anaplastic large kinase) proteinu na ALK+ a ALK – formy. Toto dělení má zřejmý prognostický význam (lepší prognóza ALK+ forem).
- Ve WHO klasifikaci bylo navrženo používat názvu Hodgkinův lymfom, nicméně označení Hodgkinova choroba může být uváděno taktéž. Dělení nodulárně-sklerotické varianty na 2 stupně (stupeň 1 s řídkými RS buňkami, stupeň 2 s velkým množstvím RS buněk) nemá jasná kritéria a z klinických důvodů větší opodstatnění.
- Bylo rozhodnuto nepřizpůsobovat klasifikaci klinickému hledisku a nevytvářet klinicky-podobné skupiny. To v minulosti vedlo k nepřípustnému zjednodušování a k mnoha omylům. Také není možné vytvářet zkrácené verze klasifikace s výčtem častěji se vyskytujících jednotek.
- Některé lymfomy i přes dostupnost veškerých diagnostických metod nebude možné zařadit do žádné z navržených skupin. Proto by měly být uváděny jako B/T-buněčný lymfom, neklasifikovaný nebo Hodgkinův lymfom, neklasifikovaný.
Tab. 5. Rozdělení akutních lymfoblastických leukemií. 
Tab. 6. Kategorie potransplantačních lymfoproliferativních chorob (PTLD). 
Závěr
REAL/WHO klasifikace hematologických nádorů není uzavřeným a neměnným schématem. Naopak, jak sami autoři opakovaně zdůrazňují, je návrhem s předpokladem dynamického vývoje a určitého stálého procesu revize a doplňování, tak jak se budou množit a vyvíjet poznatky o biologii a chování neoplazií z krvetvorných buněk. Rozvoj nových technologií, jako je například stanovení genové exprese pomocí cDNA mikročipů, dovolí hlouběji pochopit proces vzniku a progrese různých typů lymfomů a poskytnou dostatek podkladů pro detailnější třídění jednotlivých lymfoidních malignit, které bude odrážet nejen biologickou (genetickou) podstatu nádoru, ale bude také spoluurčovat i jeho – pokud možno – cílenou léčbu.
MUDr. Tomáš Papajík, CSc.
www.fnol.cz
e-mail: papajik@fnol.cz
Doručeno do redakce: 12. 7. 2004
Přijato po recenzi: 26. 10. 2004
Zdroje
1. Aisenberg AC. Coherent view of non-Hodgkin’s lymphoma. J Clin Oncol 1995; 13 : 2656–2675.
2. Aisenberg AC. Historical review of lymphomas. Br J Haematol 2000; 109 : 466–476.
3. Armitage JO, Weisenburger DD. New approach to classifying non-Hodgkin’s lymphomas: Clinical features of the major histologic subtypes. J Clin Oncol 1998; 16 : 2780–2795.
4. Armitage JO for the non-Hodgkin’s lymphoma classification project. A clinical evaluation of the international lymphoma study group classification of non-Hodgkin’s lymphoma. Blood 1997; 89 : 3909–3918.
5. DeVita VT, Canellos GP. The lymphomas. Sem Hematol 1999; 36 : 84–94.
6. DeVita VT, Canellos GP, Chabner B et al. Advanced diffuse histiocytic lymphoma, a potentially curable disease. Lancet 1975; 1 : 249–250.
7. Harris NL. Revised European – American and World Health Organization classification of non-Hodgkin’s lymphomas. In: Mauch PM, Armitage JO, Coiffier B et al. non-Hodgkin’s Lymphomas. Philadelphia: Lippincott Williams and Wilkins 2004.
8. Harris NL, Jaffe ES, Diebold J et al. World Health Organization classification of neoplastic disease of the hematopoietic and lymphoid tissues: Report of the clinical advisory committee Meeting – Airlie House, Virginia, November 1997. J Clin Oncol 1999; 17 : 3835–3849.
9. Harris NL, Jaffe ES, Diebold J et al. World Health Organization classification of neoplastic disease of the hematopoietic and lymphoid tissues. Report of the clinical advisory committee Meeting – Airlie House, Virginia, November 1997. Ann Oncol 1999; 10 : 1419–1432.
10. Harris NL, Jaffe ES, Diebold J et al. World Health Organization classification of neoplastic disease of the hematopoietic and lymphoid tissues: report of the clinical advisory committee Meeting, Airlie House, Virginia, November 1997. Histopatology 2000; 36 : 69–86.
11. Harris NL, Jaffe ES, Stein H et al. A revised European-American classification of lymphoid neoplasms: A proposal from the international lymphoma study group. Blood 1994; 84 : 1361–1392.
12. Hiddemann W, Longo DL, Coiffier B et al. Lymphoma classification – the gap between biology and clinical management is closing. Blood 1996; 88 : 4085–4089.
13. Higby DJ. A practical classification of lymphomas. N Engl J Med 1979; 300 : 1283.
14. Hodgkin T. On some morbid appearances of absorbant glands and spleen. Medico – Chirurgical Transactions 1832; 17 : 68–114.
15. Isaacson PG. The current status of lymphoma classification. Br J Haematol 2000; 109 : 258–266.
16. Jaffe ES, Harris NL, Stein H et al. Pathology and genetics of tumors of hematopoietic and lymphoid tissues. In: Kleihues P, Sobin L (eds). World Health Organization classification of tumors, Vol. 3. Lyon: IARC Press 2001.
17. Koeppen H, Vardiman JW. New entities, issues, and controversies in the classification of malignant lymphoma. Semin Oncol 1998; 25 : 421–434.
18. Lennert K, Mohri N, Stein H. The histopathology of malignant lymphoma. Br J Haematol 1975; 31 (Suppl): 193–203.
19. Lukes RJ, Collins RD. Immunologic characterization of human malignant lymphomas. Cancer 1974; 34 : 1488–1503.
20. National Cancer Institute sponsored study of classification of non-Hodgkin’s lymphomas. Summary and description of a working formulation for clinical usage. The non-Hodgkin’s Lymphoma Pathologic Classification Project. Cancer 1982; 49 : 2112–2135.
21. Pileri SA, Milani M, Fraternali–Orcioni G et al. From the R.E.A.L. Classification to the upcoming WHO scheme: A step toward universal categorization of lymphoma entities? Ann Oncol 1998; 9 : 607–612.
22. Prausová D, Krejsek J, Žák P et al. Význam imunofenotypového vyšetření v diagnostice B-lymfoproliferativních onemocnění. Vnitř Lék 2004; 50(1): 45–53.
23. Rosenberg SA. Classification of lymphoid Neoplasms. Blood 1994; 84 : 1359–1360.
24. Shipp M, Harrington D. A predictive model for aggressive non-Hodgkin’s lymphoma: The International NHL Prognostic Factors Project. N Engl J Med. 1993; 329 : 987–994.
25. Trümper LH, Brittinger G, Diehl V et al. non-Hodgkin’s lymphoma: A history of classifications and clinical observations. In: Mauch PM, Armitage JO, Coiffier B et al. non-Hodgkin’s Lymphomas. Philadelphia: Lippincott Williams and Wilkins 2004.
26. Wilks S. Cases of enlargement of the lymphatic glands and spleen (or, Hodgkin disease). With remarks. Guy’s Hosp Rep 1865; 11 : 56–67.
27. Willis RA. Tumours of lymphoid tissue. In: Willis RA (ed). Pathology of tumours. St. Louis: Mosby 1948.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2005 Číslo 6- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- BNP – zdroj informací o funkci srdce a o kardiovaskulárním riziku nemocného
- Vliv předchozí dlouhodobé léčby aspirinem na klinický průběh akutního koronárního syndromu
- Hrozba světové pandemie obezity
- Je třeba pátrat po maskované hypertenzi a jak?
- Sérová koncentrace kreatininu a funkce ledvin
- Prediktivní faktory rozvoje známek tyreoidální orbitopatie u pacientů po léčbě radiojodem nebo totální tyreoidektomií
- Natriuretický peptid typu B (BNP) – použitelnost v diferenciální diagnostice dušnosti
- Vliv předchozí dlouhodobé léčby aspirinem na klinický průběh akutního koronárního syndromu
- Poškodenie pečene a obličiek po akútnych otravách
- Výsledky multicentrického sledování léčby sibutraminem u obézních diabetiků v České republice
- Poruchy metabolizmu železa I. Regulace homeostázy železa
- REAL/WHO klasifikace nádorů lymfatické tkáně: 10 let fungování společného jazyka z pohledu klinické praxe
- Maskovaná hypertenze
- Achalázia pažeráka
- Význam elektrokardiografie v diagnóze a manažmente akútneho koronárneho syndrómu
- Možnosti prevencie aterosklerózy pri diabetes mellitus 2. typu
- Sérová koncentrace kreatininu a funkce ledvin (nový vhled do staré problematiky)
- Léčba hypertenze při diabetu a diuretika
- Akutní masivní plicní embolie – indikace k tromboembolektomii
- Doporučený postup diagnostiky a terapie esenciální trombocytemie a trombocytemie provázející jiné myeloproliferativní choroby
- 105. výročie narodenia a XI. Memoriál profesora MUDr. Františka Póra
- XXIV. dny mladých internistů České republiky a Slovenska v Olomouci
- Prof. MUDr. Jaroslav Blahoš, DrSc. pětasedmdesátiletý
- Redakční pošta
- Aschermann M et al. Kardiologie
- Lukáš J et al. Tracheostomie v intenzivní péči
- Tate P. Příručka komunikace pro lékaře. Jak získat důvěru pacienta
- Josef Kořenek. Lékařská etika
- Block B. Průvodce sonografií – kapesní atlas
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Achalázia pažeráka
- Natriuretický peptid typu B (BNP) – použitelnost v diferenciální diagnostice dušnosti
- Doporučený postup diagnostiky a terapie esenciální trombocytemie a trombocytemie provázející jiné myeloproliferativní choroby
- Poruchy metabolizmu železa I. Regulace homeostázy železa
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



