-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Prediktivní faktory rozvoje známek tyreoidální orbitopatie u pacientů po léčbě radiojodem nebo totální tyreoidektomií
Predictive factors for symptoms of thyroid ophthalmopathy development in patients after either radioiodine therapy or thyroidectomy
The aim of the study was to investigate whether patients with Graves-Basedow thyrotoxicosis developing into endocrine ophthalmopathy of diverse severity after treatment by radioiodine or total thyroidectomy are different in their pre-treatment parameters from Graves-Basedow patients without any signs of ophthalmopathy development. 42 patients were divided into 2 groups: a group of 26 patients treated by radioiodine and a group of 16 patients treated by thyroidectomy. All patients were without symptoms of ophthalmopathy and were examined clinically, on laboratory markers and by ultrasound of the thyroid and of the orbit. The patients were divided according to the orbit response after treatment into three groups: group 1 without symptoms of ophthalmopathy, group 2 with newly arisen symptoms of irritation and signs of ophthalmopathy activation, group 3 patients with diplopia. No difference was found among groups 1–3 of patients treated by radioiodine in the dosis and in the thyroid volume. In patients treated by thyroidectomy higher levels of anti thyroglobulin autoantibodies were found in joined groups 2 + 3 compared to group 1 (p = 0.044). In patients treated by radioiodine higher levels of anti TSH receptor antibodies were found in group 3 compared to the joined groups 1 + 2 (p = 0.033). In all patients (treated by radioiodine and thyroidectomy) were found higher levels of anti thyroglobulin antibodies in joined groups 2 + 3 compared to group 1 (p = 0.019), higher levels of anti TSH receptor antibodies in group 3 compared to joined groups 1 + 2 (p = 0.015) and increased thickness of the eye muscles in group 3 compared to joined groups 1 + 2 (p = 0.013). As predictive marker of ophthalmopathy anti thyroglobulin antibodies were found, elevated levels of anti TSH receptor antibodies and the sum of orbit muscle thickness served also for the prediction of the development of diplopia.
Key words:
Graves-Basedow thyrotoxicosis – endocrine ophthalmopathy – total thyroidectomy – radioiodine – autoantibodies
Autoři: Z. Novák 1; P. Hrdá1ihash2 ,2 ,2
Působiště autorů: Endokrinologický ústav, Praha, ředitel doc. MUDr. Vojtěch Hainer, CSc. 1; Ústav imunologie a mikrobiologie 1. lékařské fakulty UK a VFN, Praha, přednosta doc. MUDr. Ivan Šterzl, CSc. 2
Vyšlo v časopise: Vnitř Lék 2005; 51(6): 650-657
Kategorie: Původní práce
Souhrn
Cílem práce bylo zjistit, zda se pacienti s Graves-Basedowovou tyreotoxikózou, u kterých se po léčbě tyreoidektomií či radiojodem vyvíjí endokrinní orbitopatie různé závažnosti, liší v některých vstupních parametrech od pacientů s Graves-Basedowovou tyreotoxikózou, u kterých se po léčbě endokrinní orbitopatie nerozvíjí. 42 pacientů bylo rozděleno do 2 skupin – skupina 26 nemocných léčených radiojodem a 16 pacientů léčených totální tyreoidektomií. U nikoho nebyla přítomna klinicky významná orbitopatie. Všichni byli vyšetřeni klinicky, laboratorně a bylo provedeno sonografické vyšetření štítné žlázy a orbit. Podle reakce orbit po terapii byli probandi rozděleni do 3 skupin: skupina 1 – bez příznaků endokrinní orbitopatie, skupina 2 – pacienti s nově vzniklými iritačními příznaky a známkami aktivace endokrinní orbitopatie, skupina 3 – pacienti s diplopií. Mezi skupinami 1–3 léčenými radiojodem nebyl nalezen rozdíl v terapeutické dávce a v objemu štítné žlázy. U léčených totální tyreoidektomií byly nalezeny vyšší titry autoprotilátek proti tyreoglobulinu (p = 0,044) u spojených skupin 2 + 3 oproti skupině 1. U léčených radiojodem byly nalezeny vyšší titry autoprotilátek proti TSH receptoru (p = 0,033) u skupiny 3 oproti spojeným skupinám 1 + 2. U všech pacientů (totální tyreoidektomie + radiojod) byly nalezeny vyšší titry autoprotilátek proti tyreoglobulinu (p = 0,019) u spojené skupiny 2 + 3 oproti skupině 1, vyšší titry autoprotilátek proti TSH receptoru (p = 0,015) u skupiny 3 oproti spojené skupině 1 + 2 a větší tloušťka svalů (p = 0,013) u skupiny 3 oproti spojené skupině 1 + 2. Jako prediktivní marker endokrinní orbitopatie se ukázaly autoprotilátky proti tyreoglobulinu, vzestup autoprotilátek proti TSH receptoru a součet tlouštěk svalů v orbitách navíc predikovaly vývoj diplopie.
Klíčová slova:
Graves–Basedowova tyreotoxikóza – endokrinní orbitopatie – totální tyreoidektomie – radiojod – autoprotilátkyÚvod
Endokrinní orbitopatie je oční onemocnění, charakterizované zánětem v parabulbárním a retrobulbárním prostoru, postihující pojivou tkáň, tukovou tkáň a svaly orbity [16]. Endokrinní orbitopatie je jednou z klinických manifestací Graves-Basedowovy tyreotoxikózy (GB tyreotoxikózy), klinicky evidentní je u 25–50 % pacientů [21], ale při použití dosti citlivých metod, jako je počítačová tomografie, magnetická rezonance či ultrasonografie nacházíme asymptomatické postižení, zvláště změny na svalech orbity, u většiny nemocných [27]. Dále se vyskytuje, ačkoliv zřídka, u pacientů s Hashimotovou tyreoiditidou (chronickou autoimunitní tyreoiditidou), u GB nemoci bez hypertyreózy a u pacientů bez evidentního tyreoidálního onemocnění a nebo se subklinickou tyreoidální autoimunitou [3,6,28]. Histologicky je endokrinní orbitopatie charakterizována akumulací glykosaminoglykanů (kyselina hyaluronová, chondroitin sulfát B a chondroitin sulfát C) v orbitě a lymfocytární infiltrací orbity [7].
Co způsobuje vznik endokrinní orbitopatie je stále záhadou, ale je jasné, že vznik tohoto onemocnění je výsledkem souhry genetických a zevních faktorů. Různé geny, jako například HLA geny, mohou určovat pacientovu vnímavost k onemocnění a jeho závažnost, zevní faktory, často neznámé, mohou určovat průběh onemocnění [18]. Ze zevních faktorů se ukazuje jako jeden z nejvýznamnějších kouření [31]. Ani patogeneze onemocnění není doposud zcela objasněná. Je široce akceptováno, že se jedná o autoimunitní onemocnění, kdy cílem autoimunitní reakce je společně sdílený antigen štítnou žlázou a tkání orbity. Podstata autoantigenní vazby mezi štítnou žlázou a orbitou nebyla zatím definitivně popsána [17]. Jedním potencionálním antigenem je TSH receptor (TSHR). TSHR je exprimován ve štítné žláze a zvýšená exprese TSHR byla popsána u GB štítných žláz [30]. Orbitální exprese TSHR byla demonstrována v kultuře retrobulbárních fibroblastů od pacientů s endokrinní orbitopatií [15], v orbitálním tukové tkáni a zevních očních svalech pacientů s endokrinní orbitopatií [19]. Dalším možným společně sdíleným antigenem je 1D protein, klonovaný a charakterizovaný Dongem a spolupracovníky [10]. U tohoto membránově vázaného 64 kDa proteinu byla popsána exprese v lidské štítné žláze a ve tkáních očních svalů u lidí [10, 29]. Další možné popisované společně sdílené antigeny jsou např. G2s protein [14], kolagen typu XIII [38] a tyreoglobulin [24].
Spektrum očních potíží v rámci endokrinní orbitopatie zahrnuje jemné abnormality až dramatické oční změny [6]. Pacienti s endokrinní orbitopatií typicky popisují pocit písku v očích, rozmazané vidění, fotofobii, zvýšené slzení, dvojité vidění nebo tlaky v orbitě [2]. Nálezy při klinickém vyšetření zahrnují exoftalmus, dysfunkci zevních očních svalů, periorbitální edém a edém víček, chemózu a injekci spojivek, retrakci víček, lagoftalmus s keratitidou. Vzácně se u pacientů vyvíjí neuropatie optického nervu s poklesem zrakové ostrosti, s otupením vnímání barev a defekty zorného pole [3].
O terapii rozvinutých endokrinních orbitopatií existuje řada prací, s výsledky a stanovisky často zcela protichůdnými [1,3,5,23,32,36,37]. Prakticky žádné údaje však neexistují o frekvenci, době nástupu a trvání endokrinní orbitopatie u nemocných léčených různými způsoby (totální tyreoidektomie, terapie radiojodem a dlouhodobá udržovací terapie tyreostatiky), kteří před začátkem léčby měli zcela minimální (nepatrné pálení očí či občasné slzení) nebo vůbec žádné oční obtíže.
Cílem naší práce je zjistit, zda se skupina pacientů s GB tyreotoxikózou, u které se po léčbě tyreoidektomií či radiojodem vyvíjí endokrinní orbitopatie různé závažnosti, liší v některých vstupních parametrech od skupiny pacientů s GB tyreotoxikózou, u kterých se po léčbě endokrinní orbitopatie nerozvíjí.
Soubor vyšetřovaných a metodika
Soubor
Během tří let jsme shromáždili z pacientů Endokrinologického ústavu v Praze dvě skupiny nemocných s aktivní GB tyreotoxikózou, kteří byli nejprve léčeni tyreostatiky do eutyreózy, poté byli náhodně rozděleni na skupinu 26 pacientů léčených radiojodem bez clony kortikoidy (RI) a 16 nemocných léčených totální tyreoidektomií (TTE). Volba typu léčby (TTE nebo RI) se řídila pouze rozhodnutím ošetřujícího lékaře. U žádného z těchto pacientů nebyly před léčbou RI a TTE přítomny klinicky významná orbitopatie a subjektivní příznaky (mírné slzení a či lehké pálení), nebo byly jen velmi mírné a přechodné, nezávažné a často patrně jiného původu (prašné prostředí, nevhodné osvětlení apod).
Podle reakce orbit po léčbě jsme pacienty rozdělili na tři skupiny:
Skupina 1 – pacienti bez jakýchkoli klinických obtíží typu endokrinní orbitopatie.
Skupina 2 – pacienti s nově vzniklými iritačními příznaky a známkami aktivace endokrinní orbitopatie, tedy injekce spojivek a/nebo otoky víček, téměř vždy současně s pálením a řezáním pod víčky, často i s tlaky za bulby.
Skupina 3 – pacienti s méně či více klinicky závažnou avšak nepochybnou diplopií.
Klinické vyšetření probandů
Probandy jsme vyšetřili před terapií, poté za 3, 6 a 12 měsíců po terapii. U každého bylo provedeno klinické vyšetření se zvláštním zaměřením na příznaky endokrinní orbitopatie – tedy otoky víček a jejich tuhost, injekce nebo vyhřezávání spojivek, subjektivní obtíže typu pálení a řezání pod víčky, zvýšené slzení, tlaky za bulby a trvalá či občasná diplopie, orientačně byla ověřena pohyblivost bulbů. Až při tomto vyšetření si někteří nemocní uvědomili klinicky nezávažnou, ale přítomnou diplopii. U všech byla měřena protruze Hertelovým exoftalmometrem, a to jedním jediným přístrojem a jediným vyšetřujícím.
Sonografické vyšetření
Sonografická vyšetření byla prováděna na přístroji Medison SA8800, v posledních několika měsících i na přístroji Medusin SA 800, používajícím identické sondy i identické zpracování obrazu, a to jediným vyšetřujícím. Lineární sondou 7,5 MHZ byla vyšetřena štítná žláza, změřeny její rozměry a vypočten objem laloků obvyklým způsobem, vycházejícím ze vzorce pro prostorový elipsoid [22], orbity byly vyšetřovány ostře konvexní sondou, též 7,5 MHz. Byla měřena jednak vzdálenost mezi bulbem a apexem orbity, jednak tloušťky mediálního, laterálního a dolního přímého očního svalu a tloušťky horní svalové skupiny (horní přímý s levátorem víčka), podle námi vypracované arbitrární stupnice byla odhadována i echogenita svalů (I až IV, kde I je normální sval orbity, tedy hluboce hypoechogenní, IV je echogenita tak vysoká, že často je jen obtížně odlišitelná od okolního vaziva).
Tyreoidální parametry
Autoprotilátky proti tyreoidální peroxidáze a proti tyreoglobulinu byly stanovovány metodou ELISA (firma Aeskulab). Hladiny autoprotilátek proti TSH receptoru (TSHRAb) byly měřeny radioreceptorovou esejí TRAK (Brahms, Germany). Normální hladiny jsou < 9 IU/l. Hladiny fT4 byly měřeny pomocí radioimunoanalýzy (Immunotech, UK). Normální rozmezí je od 11,5 do 23 pmol/l. Bazální hladiny ssTSH byly měřeny imunoluminescenční esejí ILMA (Immunotech, UK). Normální rozmezí je od 0,17 do 4,05 mIU/l.
Statistické zpracování dat
Ke statistickému zpracování dat byly použity Kruskal-Wallisův test aMann-Whitneyův test. Kruskal-Wallisův test byl použit v případě porovnání 3 skupin navzájem, Mann-Whitneyův test v případě porovnání 2 skupin. Oba neparametrické testy byly použity z důvodu nenormálního rozložení dat. Za statisticky významný rozdíl byl považován takový rozdíl, při kterém bylo možno zamítnout nulovou hypotézu na hladině významnosti 0,05. Použitý statistický software: Statgraphics 5.0 Professional, výrobce: Manugistics, Inc.
Výsledky
Skupina pacientů léčených RI a skupina léčených TTE se statisticky nelišily věkem, pohlavím, ani v žádném z klinických, biochemických nebo sonografických parametrů (tab. 1).
Tab. 1. Jednotlivé parametry sledované u probandů. 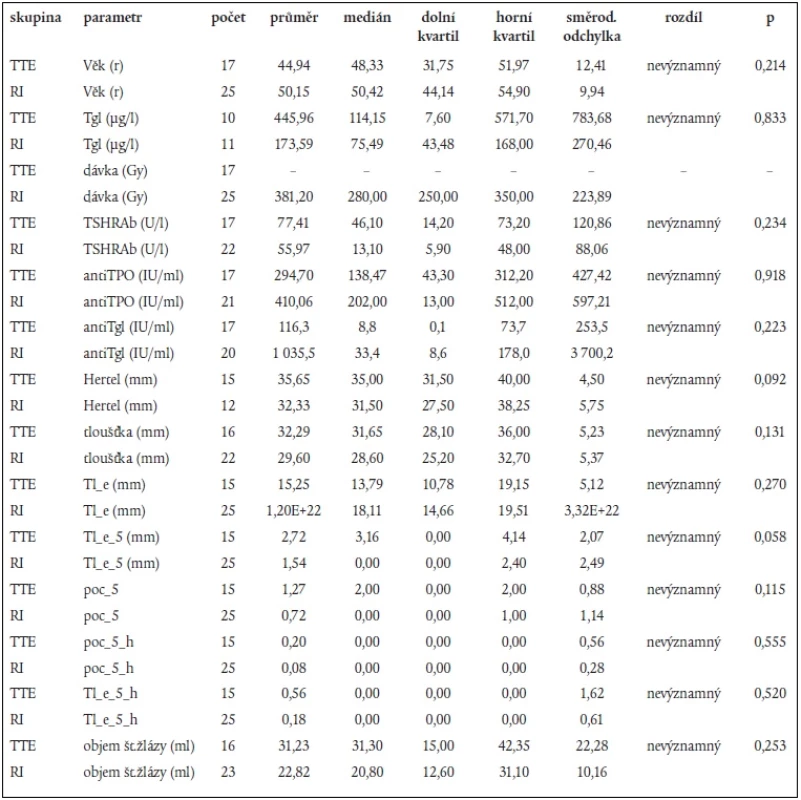
Tgl – tyreoglobulin, TSHRAb – protilátky proti TSH receptoru, antiTPO – protilátky proti tyreoidální peroxidáze, antiTgl – protilátky proti Tgl, Hertel – protruze bulbu měřená Hertelovým exoftalmometrem, tloušťka – součet tlouštěk všech měřených extraokulárních svalů z obou orbit (s výjimkou šikmých svalů, které nebyly měřeny), Tl_e – součet poměrů tloušťka svalu/echogenita (arbitrárně odhadnutá stupni 1 až 4), Tl_e_5 – součet poměrů tloušťka svalu/echogenita pro svaly tloušťky větší než 5 mm, poc_5 – počet svalů tloušťky větší než 5 mm (v obou orbitách), poc_5_h – počet svalů tloušťky větší než 5 mm s echogenitou odhadnutou na stupeň < 3, Tl_e_5_h – součet parametrů tloušťka svalu/odhadnutá echogenita pro svaly širší než 5 mm s echogenitou odhadnutou stupněm < 3. Použitý test: Mann-Whitneyův test Ve skupině léčené radiojodem nebyl mezi skupinami 1, 2, 3 nalezen statisticky významný rozdíl v podané dávce 131I.
Mezi jednotlivými skupinami 1, 2, 3 v oddělených skupinách RI a TTE nebyly zjištěny statisticky významné rozdíly v objemu štítné žlázy, hodnotách TSHRAb, anti TPO a anti Tgl, v protruzi, tloušťce svalů.
U skupiny TTE jsme nalezli statisticky významně vyšší titry anti Tgl (p = 0,044) u spojených skupin 2 + 3 oproti skupině 1 (graf 1).
Graf 1. Rozdíly v hladinách anti Tgl mezi spojenými skupinami 2 + 3 a skupinou 1 u pacientů léčených TTE (vrubový krabicový graf). 
U skupiny RI jsme nalezli statisticky významně vyšší titry TSHRAb (p = 0,033) u skupiny 3 oproti spojeným skupinám 1 + 2 (graf 2).
Graf 2. Rozdíly v hladinách TSHRAb mezi skupinou 3 a spojenými skupinami 1 + 2 u pacientů léčených RI (vrubový krabicový graf). 
Při spojení skupin TTE a RI jsme nalezli statisticky významně vyšší TSHRAb (p = 0,046) u skupiny 3 oproti skupinám 1 a 2 (graf 3) a rozdíl v tloušťce svalů na hranici statistické významnosti (p = 0,053) u skupiny 3 oproti skupinám 1 a 2 (graf 4).
Graf 3. Rozdíly v hladinách TSHRAb mezi jednotlivými skupinami u všech pacientů (léčených TTE a RI) (vrubový krabicový graf). 
Graf 4. Rozdíly v tloušťce svalů mezi jednotlivými skupinami u všech pacientů (léčených TTE a RI) (vrubový krabicový graf). 
Při spojení skupin TTE a RI jsme nalezli statisticky významně vyšší titry anti Tgl (p = 0,019) u spojené skupiny 2 + 3 oproti skupině 1 (graf 5), statisticky významně vyšší TSHRAb (p = 0,015) u skupiny 3 oproti spojené skupině 1 + 2 (graf 6) a statisticky významně větší tloušťku svalů (p = 0,013) u skupiny 3 oproti spojené skupině 1 + 2 (graf 7).
Graf 5. Rozdíly v hladinách anti Tgl mezi spojenými skupinami 2 + 3 a skupinou 1 u všech pacientů (léčených TTE a RI) (vrubový krabicový graf). 
Graf 6. Rozdíly v hladinách TSHRAb mezi skupinou 3 a spojenými skupinami 1 + 2 u všech pacientů (léčených TTE a RI) (vrubový krabicový graf). 
Graf 7. Rozdíly v tloušťce svalů mezi spojenými skupinami 1 + 2 a skupinou 3 u všech pacientů (léčených TTE a RI) (vrubový krabicový graf). 
Diskuse
V naší práci jsme se soustředili na pacienty léčené radiojodem, a to dávkou 200–1 000 Gy, většinou však do 350 Gy, to znamená, že se nejednalo o úplnou radioeliminací žlázy, kterou doporučují pro léčbu rozvinuté tyreoidální orbitopatie jiní autoři, jako např. DeGroot [8], a na pacienty léčené chirurgicky (totální tyreoidektomií). Dlouhodobá terapie tyreostatiky, která má četné vedlejší účinky, se užívá zejména u stařeckých tyreotoxikóz, které mají většinou autonomníetiologii. Protože jsme léčili pacienty mladého a středního věku, pacienty léčené dlouhodobou terapií tyreostatiky jsme do naší studie nezařadili. Původně rozšířený názor, že léčba radiojodem zhoršuje příznaky endokrinní orbitopatie ve srovnání s operací nebo jen terapií útočnými dávkami kortikoidy, byl posléze korigován při současném užití Prednisonu při terapii radiojodem [4,9]. Patogeneticky by odstranění žlázy mělo být prospěšné, protože je dnes široce akceptováno, že endokrinní orbitopatie je autoimunitní onemocnění, kde se v patogenezi uplatňuje antigen společně sdílený štítnou žlázou a tkání orbity [17].
U většiny nemocných s GB toxikózou je již před odstraněním štítné žlázy přítomna kolonizace orbity senzibilizovanými lymfocyty (i jejich přítomnost v dalších lymfoidní buňky obsahujících tkáních), a proto lze předpokládat, že v době odstranění žlázy, ať už jakýmkoli způsobem, se autoimunitní proces již různě dlouhou dobu rozvíjí (někdy předcházejí navíc neléčené subklinické ataky). Z rizikových faktorů závažné endokrinní orbitopatie je uváděno hlavně kouření.
Protože jsme mezi pacienty léčenými tyreoidektomií a radiojodem nenalezli rozdíly v námi sledovaných parametrech (tab. 1), a navíc se u pacientů léčených těmito dvěma způsoby vyskytovalo podobné poměrné zastoupení, pokud jde o závažnost postižení tkání orbity, skupiny pacientů léčených TTE a RI jsme sloučili do jediné. Položili jsme si otázku, zda přítomnost či hodnota některého ze vstupních parametrů nezvyšuje pravděpodobnost vzniku endokrinní orbitopatie po terapii a zda tedy lze některý ze vstupních parametrů použít jako prediktivní faktor zvýšeného rizika rozvoje orbitopatie po terapii tyreotoxikózy.
Odhadování „závažnosti“ orbitopatie je velmi obtížné. Klasifikace NOSPECS [35] slouží hlavně k popisu závažných následků autoimunitního procesu v orbitě: např. stupeň IV je popisován jako těžké a pacienta obtěžující postižení svalů orbity, stupeň V jako postižení rohovky a stupeň VI jako neuropatie. Stupeň V a VI jsou naštěstí dosti vzácné. Avšak i u endokrinní orbitopatie, kde klinický projev autoimunitního procesu již vyhasl, může přetrvávat diplopie, poškození rohovky, výrazná protruze a útlak optiku, protože apoptóza tukových buněk orbity probíhá velmi pomalu, v řádu let, a fibrózní změny svalů orbity přetrvávají též. Léčebné efekty, až již jde o terapii kortikoidy, ozáření orbity, či o totální tyreoidektomii či ablaci štítné žlázy radiojodem, mají efekt pouze ve fázi počáteční, tedy ve fázi imunologicky aktivního procesu. Po skončení imunologické aktivity mají smysl jen chirurgické korekce typu dekomprese, plastik svalů orbity při diplopii či plastických úprav krytí oka víčkem. Proto bylo vytvořeno skóre klinické aktivity (CAS) [12], které by mělo odlišit procesy aktivní od neaktivních. Přitom však některé znaky CAS, jako spontánní tlak za bulbem, bolestivost při pohybu bulbu, jsou subjektivním sdělením nemocného, míra otoku víčka či míra chemózy zase subjektivním dojmem vyšetřujícího. Osvědčilo se pravidelné fotografování nemocného [11], do praxe však neproniklo. V řadě prací se NOSPECS a CAS překrývají. I v naší práci je přítomnost injekce spojivek a otoků víček, tedy spíše známky aktivity dle CAS ve skupině nemocných klasifikovaných jako 2, kdežto skupina 3, tedy diplopie, je známkou pokročilosti onemocnění.
Dle našich výsledků se ukázalo, že u pacientů, u kterých se po terapii vyvinula nově diplopie, byla před terapií signifikantně vyšší hladina autoprotilátek proti TSH receptoru. Autoprotilátky proti TSH receptoru jsou heterogenní, jedná se o všeobecný termín zahrnující všechny autoprotilátky, které rozpoznávají TSH receptor. Definice užívané pro různé TSHRAb zahrnují termíny popisující metodu jejich stanovení nebo funkci. Termín TBII označuje protilátky, které se váží na TSHR a zabraňují navázaní TSH, jejich stanovení probíhá na základě radioreceptorové analýzy, tato stanovená nedává informaci o bioaktivitě autoprotilátek. Termín TSAb označuje protilátky, které stimulují tyreoidální buňky, jejich detekce je založena na měření akumulace tyreoidální cAMP [33]. Řada autorů prokazovala, že hladina TBII, tedy autoprotilátek, které jsme měřili my, nekoreluje ani se závažností, ani s aktivitou endokrinní orbitopatie. Vztah jak k závažnosti, tak ke klinické aktivitě orbitopatie našli u TSAb [20,26]. Jiní autoři sice prokázali signifikantní změny v sérové koncentraci adhezních molekul (zvýšený sérový ICAM–1 a snížený VCAM-1 jak u pacientů s GB, tak u zdravých kuřáků), opět však nacházejí negativní korelaci aktivity a závažnosti onemocnění s koncentrací TBII [34]. Méně časté jsou práce, které popisují těsnou korelaci skóre klinické aktivity s TSAb a současně vysoce signifikantní korelaci skóre klinické aktivity a titrů TBII [13]. Ač je tady vztah jak aktivity, tak i závažnosti onemocnění endokrinní orbitopatie a konvenčně měřených autoprotilátek proti TSH receptoru zatím nejasný či kontroverzní, v naší práci se překvapivě potvrzuje jako prediktivní faktor ještě nerozvinuté endokrinní orbitopatie (tedy predikujeme vznik aktivity onemocnění), tak současně predikujeme i rozvoj závažnosti, tedy vznik diplopie, což znamená stadium IV v NOSPECS klasifikaci. Skutečností je, že jak známky aktivity orbitopatie, tak i diplopie, u našich nemocných byly ve většině případů sice nepochybné, ale mírné. Diplopie byla někdy tranzitorní, většinou se spontánně upravila. Terapii kortikoidy si zatím vyžádal jen jeden nemocný ve skupině po RI a jeden nemocný po TTE.
Rovněž součet tloušťek námi měřených svalů na obou očích před terapií byl signifikantně vyšší u skupiny, u které se po terapii objevila nově diplopie. Tento náš nález prozatím nelze porovnat s nálezy jiných autorů. Ultrazvuk byl jistě široce testován ve vyšetřování již rozvinutých endokrinních orbitopatií, avšak nikdy, pokud je nám známo, nebyl zkoušen jako prediktivní faktor.
Skupina, u níž se nevyvinuly žádné známky orbitopatie, se signifikantně lišila od obou dalších skupin nižší hladinou autoprotilátek proti tyreoglobulinu. V literatuře jsme nenašli práce sledující obdobnou tematiku. Řada prací však ukazuje, že tyreoglobulin hraje významnou roli v patogenezi endokrinní orbitopatie [24,25]. Tyreoglobulin je nacházen v pojivové tkáni orbity, jeho množství stoupá po terapii tyreotoxikózy radiojodem [24], vazba na glykosaminoglykany v orbitě postižené orbitopatií je zvyšována jak nadbytkem těchto glykosaminoglykanů, tak především přítomností autoprotilátek proti tyreoglobulinu [25]. Náš nález tedy podporuje představu tyreoglobulinu jako antigenu, který se uplatňuje v patogenezi endokrinní orbitopatie a autoprotilátek proti tyreoglobulinu jako významného prediktivního faktoru. Hladiny samotného tyreoglobulinu v séru se mezi jednotlivými skupinami nelišily. Titry autoprotilátek proti tyreoidální peroxidáze se mezi skupinami nelišily.
Skupiny probandů budeme sledovat i nadále, neboť analýza dynamiky jednotlivých parametrů vyžaduje dlouhodobější sledování.
V naší práci se jako prediktivní marker endokrinní orbitopatie se ukázaly autoprotilátky proti tyreoglobulinu, vzestup autoprotilátek proti TSH receptoru a součet tlouštěk svalů orbitách navíc predikovaly vývoj diplopie.
Práce vznikla díky podpoře grantu IGA MZ ČR NB 6725-3.
MUDr. Zdeněk Novák, CSc.
www.endo.cz
e-mail: znovak@endo.cz
Doručeno do redakce: 26. 1. 2004
Přijato po recenzi: 18. 10. 2004
Zdroje
1. Asman P. Ophthalmological evulation in thyroid-associated ophthalmopathy. Acta Ophthalmol Scand 2003; 81 : 437–448.
2. Bahn RS, Garrity JA, Gorman CA. Diagnosis and management of Grave’s ophthalmopathy. J Clin Endocrinol Metab 1990; 71 : 559–563.
3. Bahn RS, Heufelder AE. Pathogenesis of Grave’s ophthalmopathy. N Engl J Med 1993; 329 : 1468–1475.
4. Bartalena L, Marcocci C, Bogazzi F et al Relation between therapy for hyperthyroidism and the course of Grave’s ophthalmopathy. N Engl J Med 1998; 338 : 73–78.
5. Bartalena L, Marcocci C, Gorman CA et al. Orbital radiotherapy for Grave’s ophthalmopathy: useful or useless? Safe or dangerous? J Endocrinol Invest 2003; 26 : 5–16.
6. Burch, HB, Wartofsky L. Grave’s opthalmopathy: Current concepts regarding pathogenesis and management. Endocr Rev 1993; 14 : 747–793.
7. Cambell RJ. Pathology of Grave’s opthalmopathy. In: Gorman CA, Waller RR, Dyer JA (eds). The eye and orbit in thyroid disesae. New York: Raven Press 1984 : 25–31.
8. DeGroot LJ. Retro-orbital radiation and radioactive iodide ablation of the thyroid may be good for Grave’s ophthalmopathy. J Clin Endocrinol Metab 1995; 80 : 339–340.
9. Dietlein M, Dederichs B, Wiegand A et al. Radioiodine therapy and thyroidassociated orbitopathy: risk factors and preventive effects of glucocorticoids. Exp Clin Endocrinol Diab 1999; 107: Suppl. 5 : 190–194.
10. Dong Q, Ludgate M, Vassart G. Cloning and sequencing of a novel 64-kDa autoantigen recognized by patients with autoimmune thyroid disease. J Clin Endocrinol Metab 1991; 72 : 1375–1381.
11. Gerding MN, Prummel MF, Kalmann R et al. The use of colour slides in the assessment of changes in soft-tissue involvement in Grave’s ophthalmopathy. J Endocrinol Invest 1998; 21 : 459–462.
12. Gerding MN, Prummel MF, Wiersinga WM. Assessment of disease activity in Grave’s ophthalmopathy by orbital ultrasonography and clinical parameters. Clin Endocrinol (Oxf) 2000; 52 : 641–646.
13. Gerding MN, van der Meer JW, Brovnink M et al. Association of thyrotrophin receptor antibodies with clinical features of Grave’s ophthalmopathy. Clin Endocrinol (Oxf.) 2000; 52 : 267–277.
14. Gunji K, De Bellis A, Li AW et al. Cloning and charakterization of the novel thyroid and eye muscle shared protein G2s: autoantibodies against G2s are closely associated with ophthalmopathy in patients with Grave’s hyperthyroidism. J Clin Endocrinol Metab 2000; 85 : 1341–1347.
15. Heufelder AE, Dutton CM, Sarkar G et al. Detection of TSH receptor RNA in cultured fibroblasts from patients with Grave’s ophthalmopathy and pretibial dermopathy. Thyroid 1993; 3 : 297–300.
16. Heufelder AE, Spitzweg C. Pathogenesis of immunogentic hyperthyroidsm and endocrine orbitopathy. Internist 1998; 39 : 599–606.
17. Heufelder AE, Joba W. Cellular immunity and orbital antigens in thyroid associated orbitopathy. Exp Clin Endocrinol Diabetes 1999; 107(Suppl 5): 152–157.
18. Heufelder AE. Pathogenesis of ophthalmopathy in autoimmune thyroid disease. Rev Endocr Metab Disord 2000; 1 : 87–95.
19. Hiromatsu Y, Sato M, Inoue Y et al. Localization and clinical significance of thyrotropin receptor mRNA expression in orbital fat and eye muscle tissue from patients with thyroid-associated ophthalmopathy. Thyroid 1996; 6 : 553–562.
20. Hsu SY, Chany CH, Su MY et al. Correlation between clinical activity score and thyroid autoantibodies in patients with thyroid ophthalmopathy. Kaohsiung J Med Sci 2000; 16 : 533–538.
21. Jacobson DII, Gorman CA. Clinical review 13: Diagnosis and management of endocrine opthalmopathy. Med Clin North Am 1996; 69 : 973–988.
22. Knudsen N, Bols B, Bülow I et al. Validation of ultrasonography of the thyroid gland for epidemiological purposes. Thyroid 1999; 9 : 1069–1074.
23. Lind P. Strategies of radioiodine therapy for Grave’s disease. Eur J Nucl Med Mol Imaging 2002; 29(Suppl 2): 453–457.
24. Lisi S, Marino M, Pinchera A et al. Thyroglobulin in orbital tissues from patients with thyroid-associated ophthalmopathy: predominant localization in fibroadipose tissue. Thyroid 2002; 12 : 351–360.
25. Marino M, Lisi S, Pinchera A et al. Glycosaminoglycans provide a binding site for thyroglobulin in orbital tissues of patients with thyroid-associated opthalmopathy. Thyroid 2003; 9 : 851–859.
26. Noh JY, Hamada N, Inoue Y et al. Thyroid-stimulating antibody is related to Grave’s ophthalmopathy, but thyrotropin-binding inhibitor immunoglobulin is related to hyperthyroidism in patiens with Grave’s disease. Thyroid 2000; 10 : 809–813.
27. Noth D, Gebauer M, Müller H et al. Grave’s ophthalmopathy natural history and treatment outcomes. Swiss Med Wkly 2001; 131 : 603–609.
28. Prummel MF. Pathogenesis and clinical aspects of endocrine ophthalmopathy. Exp Clin Endocrinol Diabetes 1999; 107(Suppl 3): 75–78.
29. Ross PV, Koening RJ, Arscott P et al. Tissue specificity and serologic reactivity of an autoantigen associated with autoimmune thyroid disease. J Clin Endocrinol Metab 1993; 77 : 433–438.
30. Schuppert F, Hiller WFA, Weinland G et al. Iodide, cytokines and TSH receptor expression in Grave’s disease. Exp Clin Endocrinol Diabetes 1996; 104 (Suppl 4): 68–74.
31. Shine B, Fells P, Edwards OM et al. Association between Grave’s opthalmopathy and smoking. Lancet 1990; 335 : 1261–1264.
32. Váňa S, Němec J, Rezek P et al. Léčba endokrinní orbitopatie eliminací štítní žlázy. Vliv nezdařené eliminace, velkého pretibiálního myxedému a trvání hypotyreózy po eliminaci na dlouhodobé výsledky. Vnitř Lék 1998; 44 : 387–390.
33. Volpe R. Immunology of the thyroid. In: Volpe R (ed). Autoimmune diseases of the endocrine system. Boca Raton: CRC Press, 1990 : 73–240.
34. Wakelkamp IM, Gerding MN, van der Meer JW et al. Smoking and disease severity are independent determinants of serum adhesion molocule levels in Grave’s ophthalmopathy. Cln Exp Immunol 2002; 127 : 316–320.
35. Werner SC. Modification of the Classification of the Eye Changes of Grave’s Disease: Recommendations of the Ad Hoc Committee of The American Thyroid Association. The Journal Clinical Endocrinology and Metabolism 1977; 44 : 201–203.
36. Wiersinga WM, Bartalena L. Epidemiology and prevention of Grave’s ophthalmopathy. Thyroid 2002; 12 : 855–860.
37. Wiersinga WM, Prummel MF. Grave’s ophthalmopathy: a rational approach to treatment. Trends Endocrinol Metab 2002; 13 : 280–287.
38. Yamada M, Li AW, Wall JR. Thyroidassociated ophthalmopathy: clinical features, pathogenesis and management. Crit Rev Clin Lab Sci 2000; 37 : 253–549.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2005 Číslo 6- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- BNP – zdroj informací o funkci srdce a o kardiovaskulárním riziku nemocného
- Vliv předchozí dlouhodobé léčby aspirinem na klinický průběh akutního koronárního syndromu
- Hrozba světové pandemie obezity
- Je třeba pátrat po maskované hypertenzi a jak?
- Sérová koncentrace kreatininu a funkce ledvin
- Prediktivní faktory rozvoje známek tyreoidální orbitopatie u pacientů po léčbě radiojodem nebo totální tyreoidektomií
- Natriuretický peptid typu B (BNP) – použitelnost v diferenciální diagnostice dušnosti
- Vliv předchozí dlouhodobé léčby aspirinem na klinický průběh akutního koronárního syndromu
- Poškodenie pečene a obličiek po akútnych otravách
- Výsledky multicentrického sledování léčby sibutraminem u obézních diabetiků v České republice
- Poruchy metabolizmu železa I. Regulace homeostázy železa
- REAL/WHO klasifikace nádorů lymfatické tkáně: 10 let fungování společného jazyka z pohledu klinické praxe
- Maskovaná hypertenze
- Achalázia pažeráka
- Význam elektrokardiografie v diagnóze a manažmente akútneho koronárneho syndrómu
- Možnosti prevencie aterosklerózy pri diabetes mellitus 2. typu
- Sérová koncentrace kreatininu a funkce ledvin (nový vhled do staré problematiky)
- Léčba hypertenze při diabetu a diuretika
- Akutní masivní plicní embolie – indikace k tromboembolektomii
- Doporučený postup diagnostiky a terapie esenciální trombocytemie a trombocytemie provázející jiné myeloproliferativní choroby
- 105. výročie narodenia a XI. Memoriál profesora MUDr. Františka Póra
- XXIV. dny mladých internistů České republiky a Slovenska v Olomouci
- Prof. MUDr. Jaroslav Blahoš, DrSc. pětasedmdesátiletý
- Redakční pošta
- Aschermann M et al. Kardiologie
- Lukáš J et al. Tracheostomie v intenzivní péči
- Tate P. Příručka komunikace pro lékaře. Jak získat důvěru pacienta
- Josef Kořenek. Lékařská etika
- Block B. Průvodce sonografií – kapesní atlas
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Achalázia pažeráka
- Natriuretický peptid typu B (BNP) – použitelnost v diferenciální diagnostice dušnosti
- Doporučený postup diagnostiky a terapie esenciální trombocytemie a trombocytemie provázející jiné myeloproliferativní choroby
- Poruchy metabolizmu železa I. Regulace homeostázy železa
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




