-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Objemná nefrolitiáza – perkutánní litotrypse, nebo retrográdní intrarenální operace?
Renal calculi burden – percutaneous lithitripsy or retrograde surgery?
In this article the author evaluates various modalities for management of staghorn renal calculi or massive stone burden. He discusses advantages and potential complications of these methods in terms of stone removal and assesses the options of less standard approaches – retrograde intrarenal surgery (RIRS). He evaluates the efficiency of stone removal depending on its localization in kidney and its size.
According to published data it is obvious that retrograde intrarenal surgery represents prospective method of choice for renal calculi treatment. This method is minimally invasive and can achieve a significant rate of stone fragmentation. The simultaneous combination of outpatient RIRS and extracorporeal lithotripsy (ESWL) in one session can lead to significant fragmentation (even stone burden fragmentation) during one intervention, possibly requiring the second session (URS, ESWL or both) with minimal morbidity.Key words:
nephrolithiasis, percutaneous lithotripsy, RIRS
Autoři: MUDr. Vítězslav Vít
Působiště autorů: Urologická klinika FN Brno
Vyšlo v časopise: Urol List 2008; 6(3): 31-37
Souhrn
Autor se ve své práci zabývá jednotlivými možnými modalitami při řešení objemné nebo odlitkové nefrolitiázy. Zvažuje výhody a možné komplikace jednotlivých metod ve vztahu k odstranění litiázy a především hodnotí možnosti méně standardních přístupů – retrográdní intrarenální řešení (RIRS). Hodnotí efektivitu řešení litiázy jednak podle její lokalizace v ledvině, jednak podle její velikosti.
Z uvedených údajů je patrné, že retrográdní intrarenální operace je potenciálně možnou metodou volby při léčbě nefrolitiázy. Metoda je všeobecně minimálně invazivní a může dosáhnout signifikantní fragmentace konkrementů. Spojení ambulantního provedení RIRS a extrakorporální litotrypse (ESWL) v jedné době může vést k signifikantní jednorázové fragmentaci objemné nefrolitiázy, s eventuální nutností následné druhé doby (ureteroskopie – URS, ESWL nebo obojí) při minimální celkové morbiditě.Klíčová slova:
nefrolitiáza, perkutánní litotrypse, RIRSÚVOD
V současné době standardní léčba nefrolitiázy zahrnuje:
- mimotělní litotrypsi rázovou vlnou (ESWL) s dezintegrací konkrementu na fragmenty o velikosti umožňující jejich spontánní odchod
- perkutánní techniky, kdy provádíme extrakci a dezintegraci litiázy za optické kontroly
- otevřený chirurgický výkon.
ESWL představuje léčbu první linie pro většinu kamenů menší velikosti, tj. do 2 cm, a stále zůstává nejběžnější metodou při odstraňování většiny ledvinových konkrementů. Existuje množství faktorů, které mohou změnit četnost dosažení stavu bez litiázy při monoterapii litotrypsí – velikost konkrementu, jeho složení a lokalizace, anatomie dutého systému (infundibulopelvický úhel dolního kalichu > 45 °, délka kalichu, šířka krčku kalichu), body mass index pacienta.
V současné době stále přetrvávají diskuze o optimální léčbě konkrementů lokalizovaných především v dolním pólu ledviny, kde efektivita ESWL může být ovlivněna špatným odchodem fragmentů z dolního kalichu ledviny, což vede k nízkému „stone-free rate“ [1,2].
Perkutánní nefrolitotomie – PCNL – se stále považuje za primární způsob léčby a „zlatý standard“ v případech zejména větších a odlitkových konkrementů.
Je to vysoce efektivní metoda léčby objemné nefrolitiázy, výhodnější ve srovnání s otevřenými operačními výkony jednak z hlediska efektivity, kdy má PCNL vysoké procento úspěšnosti v odstraňování kamenů, tak i z hlediska morbidity pacientů [3,4].
Zpráva americké urologické asociace z roku 2005 doporučovala PCNL jako primární léčbu u konkrementů větších než 500 mm2. Bylo zjištěno, že PCNL má účinnost přibližně 78 % (74–83 %) vyžadující v průměru 1,9 výkonů.
část pacientů však tento zákrok nemůže podstoupit, např. z důvodu patologické obezity, pohyblivé ledviny, tělesné konstituce anebo zvýšené krvácivosti, dále je zde riziko podání krevní transfuze. Bylo zaznamenáno 18 % (14–24 %) transfuzí a 15 % (7–27 %) významných komplikací včetně akutní ztráty ledviny, chronického renálního selhání, vaskulárního poškození, poškození tlustého střeva, hydrothoraxu, pneumotoraxu, dlouhodobějšího úniku moči, „steinstrasse“, zaklíněných uretrálních konkrementů, koliky vyžadující hospitalizaci, pyelonefritidy, sepse, hluboké žilní trombózy a plicní embolie [5].
Pro některé pacienty s objemnou nefrolitiázou tak PCNL může představovat nepřijatelný stupeň invazivity spojené s morbiditou, u řady pacientů, zejména z řad Svědků Jehovových, je riziko podání krevní transfuze naprosto nepřijatelné a právě u takových pacientů je nutno hledat přijatelnou alternativu PCNL.
V posledních letech jsou publikovány stále častější údaje o použití další modality v řešení nefrolitiázy, kterou je retrográdní intrarenální chirurgie – RIRS.
Inovace endoskopů a endoskopických litotryptorů a dalších pomůcek umožňují nejenom retrográdní přístup do celého dutého systému, ale také léčbu i objemné nefrolitiázy, pro niž byly dříve vyhrazeny pouze perkutánní postupy, eventuálně otevřené operace.
Vývoj holmiového laseru představuje významné zlepšení oproti dřívějším technologiím v tom, že dokáže dezintegrovat litiázu bez ohledu na její složení a velikosti [14,15]. Velkou výhodou je i možnost kombinované litotrypse pomocí EHL a Ho:Yag laseru.
Zdokonalení konstrukce endoskopu a zejména možnost využití aktivně směrovatelného, flexibilního ureteropyeloskopu malého průměru umožnilo přístup ke všem kalichům dutého systému ledviny. Kombinace flexibilního ureteroskopu a holmiového laserového vlákna o síle 200 µm umožňuje léčbu prakticky všech intrarenálních kamenů.
RIRS se postupně stává možnou alternativou především perkutánních výkonů, ale i ESWL, především u konkrementů nacházejících se v renálním divertiklu [6], při obstrukci PUJ, u některých velkých nefrolitiáz (> 20 mm), a dokonce i v některých případech menších odlitkových konkrementů [7-9].
Retrográdní přístup lze také použít u pacientů, kteří nemohou podstoupit ESWL nebo které ESWL nevyléčilo.
Myšlenka retrográdní ureterorenoskopie při léčbě velkých ledvinových kamenů není nová. Huffman et al [10] v roce 1983 popsali léčbu objemné ureterolitiázy a pyelolitiázy pomocí rigidního ureteroskopu a ultrazvukového litotryptoru. Jejich úspěch se však omezoval pouze na léčbu těch kamenů, k nimž se bylo možné dostat pomocí rigidního nástroje.
V roce 1990 Aso et al zveřejnili významný soubor 34 odlitkových konkrementů léčených flexibilní ureteroskopickou EHL monoterapií [11] a v roce 1994 Dretler [12] publikoval výsledky léčby 8 pacientů s odlitkovou litiázou, kdy použil litotrypsi s flexibilním ureteroskopem a pulzním laserem (pulsed-dye laser) a následně ESWL pro malé reziduální kamínky. Patel a Fuchs přišli koncem 90. let s kombinací ambulantní URS s použitím holmium laseru a ESWL [13]. Elashry et al [34] oznámili úspěšnost dosahující 92 % při řešení nefrolitiázy pomocí flexibilního ureteroskopu a EHL sondy 1,9 F.
Fabrizio et al [35] publikovali zprávu o stovce pacientů, kteří podstoupili retrográdní endoskopii s použitím holmiového laseru nebo EHL sondy s okamžitou úspěšností 89 %.
Ačkoliv jsou tedy v současné době k dispozici již četné údaje o možnosti použití RIRS k léčbě nefrolitiázy, je otázkou, nakolik je tato skutečnost všeobecně známa a nakolik je tato modalita v běžné praxi zvažována a doporučována pacientům.
Gerber et al provedl rozsáhlý průzkum mezi členy Americké urologické asociace, kterým byly položeny 3 otázky týkající se řešení litiázy dolního kalichu ledviny [21]:
- jakou léčbu byste všeobecně doporučil u nekomplikovaného pacienta s konkrementem dolního kalichu ledviny < 1 cm?
- jakou léčbu byste všeobecně doporučil u nekomplikovaného pacienta s konkrementem dolního kalichu ledviny o velikosti 1–2 cm?
- jakou léčbu byste všeobecně doporučil u nekomplikovaného pacienta s konkrementem dolního kalichu ledviny > 2 cm?
Při volbě odpovědi mohli respondenti vybírat z následujících možností:
- flexibilní ureteroskopie s laserovou dezintegrací konkrementu
- ESWL
- PCNL
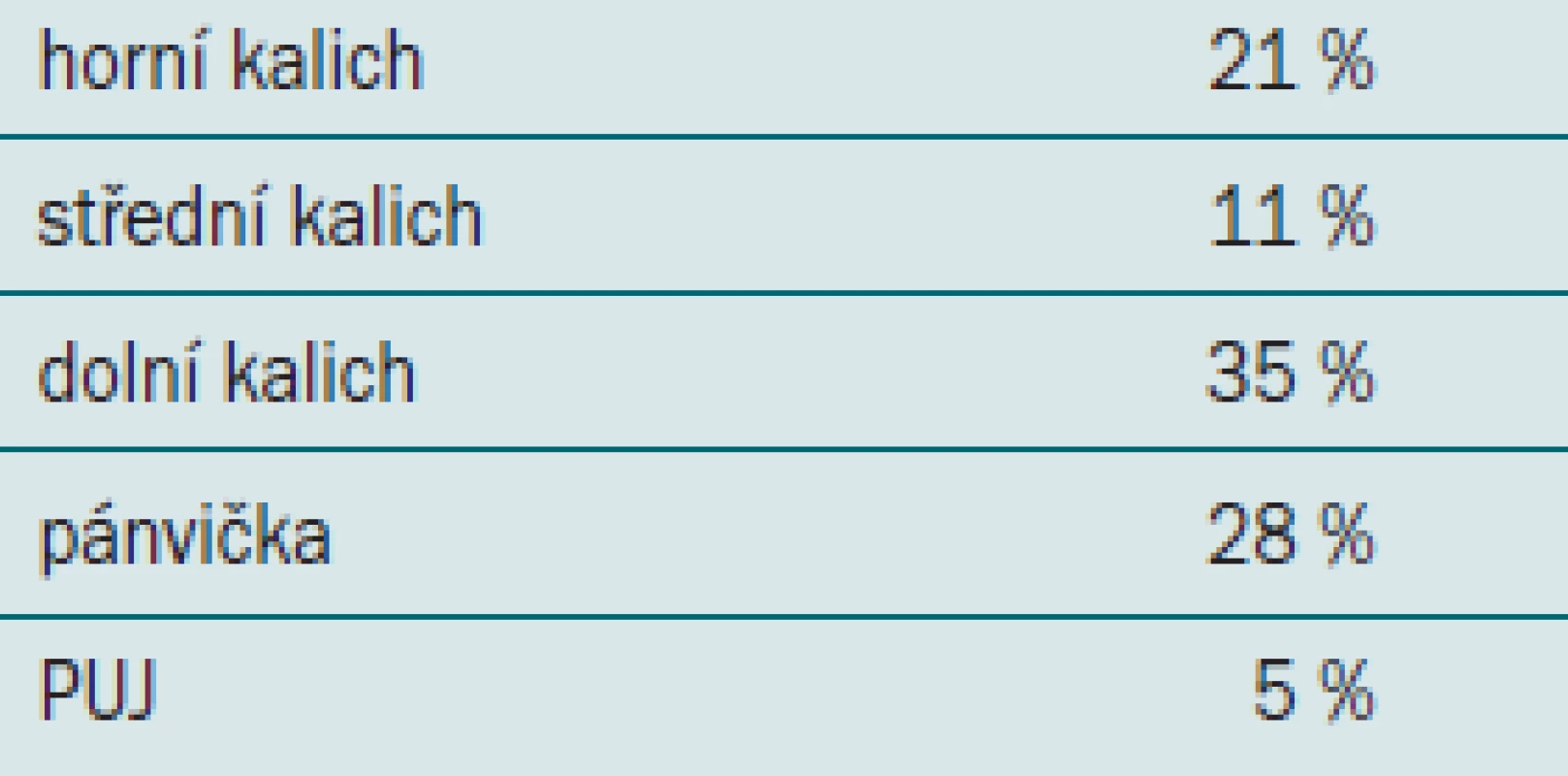
Jaké byly výsledky průzkumu, ukazuje tab. 1.
Tab. 1. Preferované řešení litiázy dolního kalichu (%). 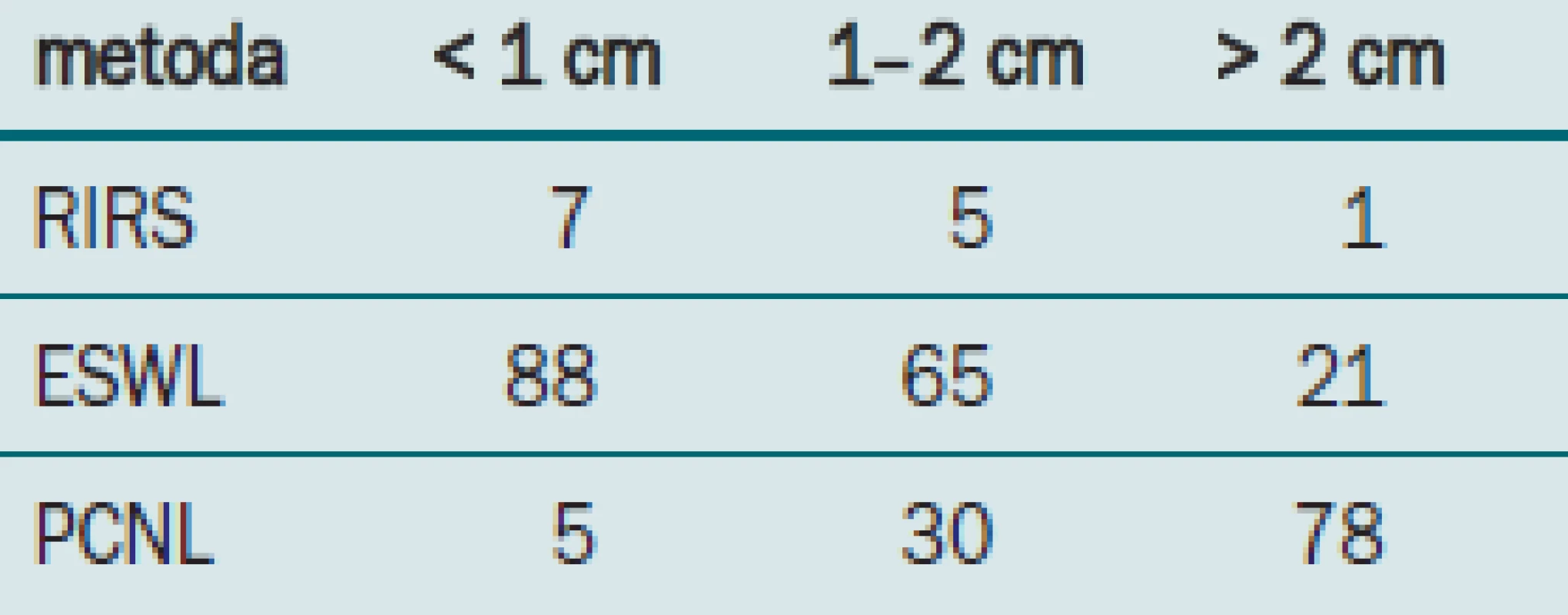
Je tedy zřejmé, že RIRS je metoda, která není zatím široce akceptovaná, možná i proto, že nejsou dostatečně známy výsledky této metody a chybí srovnání účinnosti a bezpečnosti jednotlivých modalit.
Proto předkládám výsledky několika prací, ve kterých se hodnotí výsledky RIRS a srovnávají možnosti léčby různých typů nefrolitiázy s použitím všech výše uvedených léčebných modalit včetně RIRS a ve kterých jsou popsány i konkrétní postupy při retrográdním řešení litiázy.
LÉČBA LITIÁZY DOLNÍHO KALICHU
Touto problematikou se ve své práci zabývá Preminger, který hodnotí výsledky randomizovaných a prospektivních studií a srovnává litotrypsi rázovými vlnami s perkutánní nefrolitotomií.
Kritéria pro začlenění pacienta: věk > 18 let, konkrement < 30 mm, solitární, v dolním kalichu.
Souhlas pacienta k náhodnému výběru pro 1 ze zákroků (ESWL, PCNL).
Vylučovací kritéria: obstrukce PUJ, konkrementy v divertiklu kalichu, stenóza infundibula, obezita, anatomická anomálie, poruchy krevní srážlivosti, renální nedostatečnost, cystinurie, transplantované ledviny, těhotenství.
Jednou z důležitých oblastí této studie bylo použití nefrotomogramů k zaznamenání stavu pacienta bez konkrementů. Předchozí studie příliš nadhodnocovaly stav pacienta bez konkrementů, když k vyhodnocení používaly pouze nativní nefrogram, pomocí něhož hodnotily, zda je pacient po výkonu bez konkrementů. Proto tato současná studie využívá nefrotomogramy, pomocí nichž lze spolehlivěji prokázat reziduální fragmenty konkrementů po ESWL anebo PCNL.
K dispozici jsou údaje týkající se 112 pacientů.
Velikost konkrementu v jednotlivých skupinách, jeho složení, předchozí léčba a renální anatomie byly obdobné při porovnávání pacientů obou skupin. Celkově pouze 35 % pacientů s konkrementem v dolním pólu léčených pomocí ESWL bylo bez konkrementů, zatímco perkutánní skupina dosahovala úspěšnosti 96 %.
Na druhou stranu hospitalizace u skupiny s PCNL byla výrazně delší než u pacientů léčených rázovou vlnou a množství komplikací u této perkutánní skupiny bylo také vyšší než v případě léčby rázovou vlnou.
Předběžné výsledky této randomizované, prospektivní, multi-institucionální studie naznačují, že ESWL je sice méně invazivní než PCNL, je však také v případě výskytu konkrementů v dolním pólu méně účinnou formou léčby, a to především v případě výskytu konkrementů větších než 1 cm v průměru.
Tab. 2. Četnost odstranění litiázy. 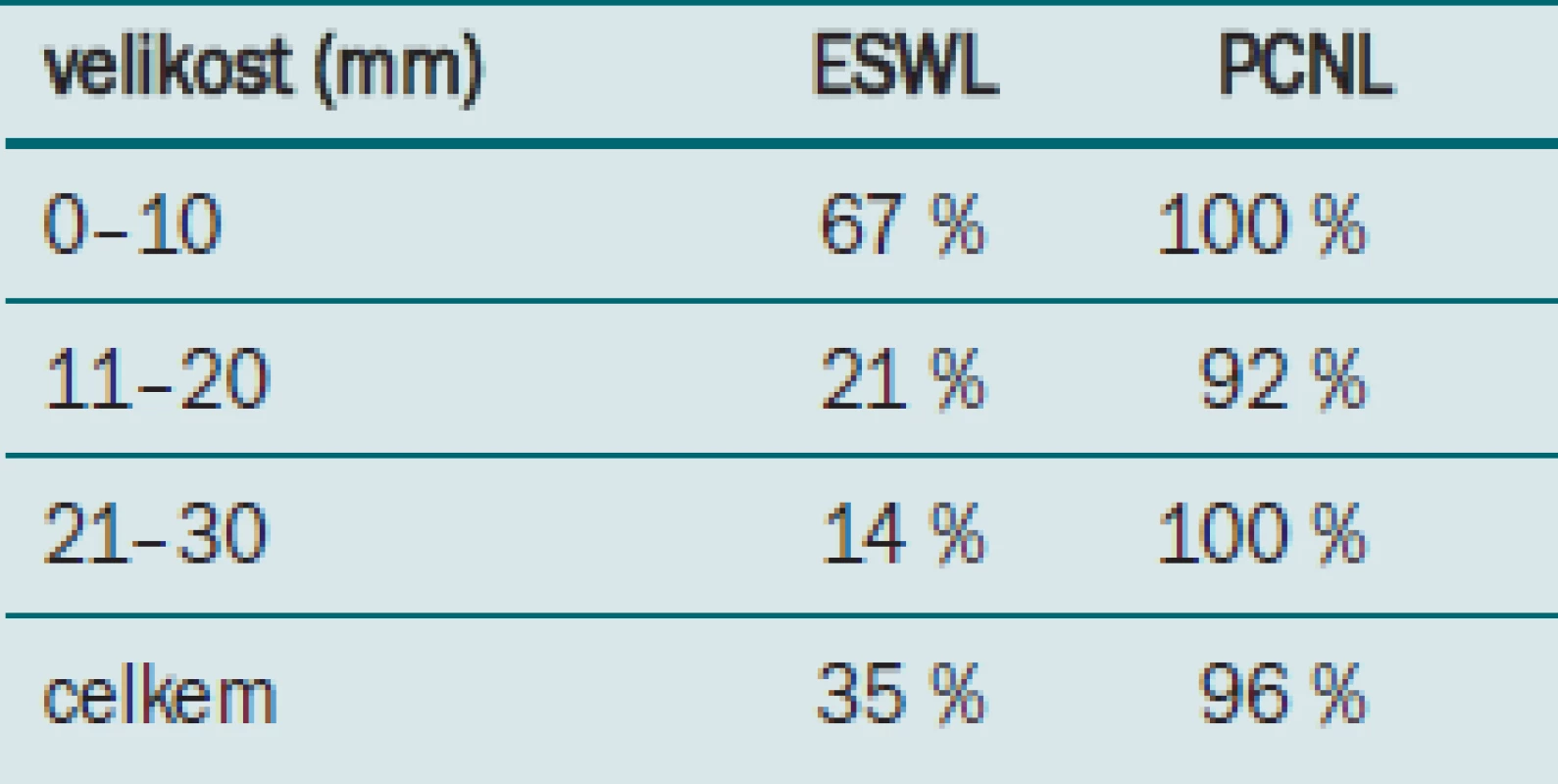
Úroveň stone-free uvedená v současné studii je nižší, než se uvádí v literatuře, nejspíše díky skutečnosti, že jako kritéria pro určení stavu stone-free byly použity nefrotomogramy [16].
Ve světle těchto údajů se u litiázy dolního kalichu jako výhodnější jeví PCNL, vzhledem k vyšší morbiditě této metody je však nutno zvažovat i jiné, především méně invazivní postupy.
Zilberman et al ve své práci shrnují své výsledky RIRS u nefrolitiázy v různých lokalizacích.
Hodnotili celkem 63 pacientů (30 mužů, 33 žen), průměrný věk 55,7 let (19–89). 25 pacientů mělo konkrementy ≥ 20 mm, přičemž 14 z nich mělo konkrementů více (kumulativní zátěž nejméně 20 mm).
Před výkonem byla vyšetřena kultivace moči se sanací eventuální uroinfekce. I při sterilní moči byla 1 hod před výkonem podána 1 dávka i. v. antibiotika.
Byl použit flexibilní ureteronefroskop (DUR-8, ACMI TM Corporation, Southborough, MA, USA) a dilatátor (10/12 F). Konkrementy byly dezintegrovány pomocí holmium:YAG laseru. Na konci výkonu byly zavedeny buï JJ stenty, nebo ureterální cévky.
Průměrná doba operace byla 74 min (13–180). Nebyly zaznamenány žádné intraoperační komplikace. Průměrná doba hospitalizace byla 5,2 dnů (nejméně 2 dny). Celkem 19 pacientů (30 %) mělo pooperační infekční komplikace, z nichž 15 (24 %) mělo minimálně symptomatickou močovou infekci (UTI), což prokázala pozitivní kultivace moči, a u 4 pacientů (6 %) došlo k urosepsi. Mezi další komplikace patřila plicní embolie (1krát), infarkt myokardu (1krát), pneumonie (1krát) a pseudomembranózní enterokolitida (1krát).
12 pacientů (19 %) nemělo okamžitě po zákroku žádné konkrementy, u 19 pacientů (30 %) zůstaly drobné fragmenty (£ 2 mm), což nevyžadovalo žádný další výkon. Efektivita RIRS byla tedy v tomto souboru 49 %. U 32 pacientů (51 %) byly ultrazvukem a pomocí nativního nefrogramu zjištěny zbytkové fragmenty a konkrementy, které byly převážně lokalizovány v dolních kališích (61 %). V souvislosti s tím byl u 25 pacientů proveden nejméně 1 dodatečný výkon: ESWL 17krát, RIRS 7krát, PCNL 2krát, URS 1krát [17].
Podobnou práci publikoval El-Anany et al, kteří hodnotili celkem 30 pacientů (22 mužů a 8 žen) s průměrným věkem 43 let (18–62), s celkem 40 konkrementy. Vyšetření před léčbou obsahovalo standardní RTG vyšetření, abdominální ultrasonografii, kultivaci moči se sanací eventuální uroinfekce tak, aby před výkonem byla moč sterilní.
Pacient byl v litotomické poloze, v celkové nebo lokální anestezii a do horního močového traktu mu byl zaveden vodič pomocí standardního pevného cytoskopu pod skiaskopickou kontrolou. Pro dilataci intramurálního močovodu a k možnosti provedení retrográdního ureteropyleogramu byl použit dvoukanálový katétr F10. Byl použit další vodič, přes který bylo možno zavést ureteroskop.
U všech pacientů s pelvilitiázou byl použit semirigidní ureteroskop 7,5–10 F. Pro kalikolitiázu byl použit aktivně flexibilní ureteroskop 7,5 F. U všech pacientů byla použita irigace sterilním fyziologickým roztokem. Při použití semirigidního ureteroskopu bylo použito laserové vlákno síly 550 µm a laserové vlákno síly 200 µm, pokud byl použit flexibilní ureteroskop. U pelvilitiázy byla dezintegrace zahájena zespodu na jedné straně kamenu a pokračovala směrem nahoru, až se v kameni vytvořil tunel umožňující průchod ureteroskopu k horní hranici kamene.
Fragmentace pak byla dokončena z horní části pohybem směrem dolů, aby se minimalizovala možnost úniku úlomků do kalichů. Všichni pacienti dostávali po dobu 3 dnů profylakticky parenterálně ATB, jež bylo poté nahrazeno perorálním bakteriostatickým preparátem po další 4 dny. Úspěch byl definován jako úplná dezintegrace konkrementu na fragmenty s průměrem menším než 2 mm nebo stav bez detekce litiázy při kontrolním vyšetření.
Pacienti, u nichž bylo potřebné doplňující ESWL, nebyli pokládáni za úspěšně léčené.
Celkem bylo provedeno 30 retrográdních ureteropyeloskopických výkonů k řešení celkem 40 konkrementů u 30 pacientů (tab. 4): postup byl úspěšný u 23 pacientů (77 %). Prokázal se úzký vztah mezi velikostí kamenů, trváním operace a úspěšností. Kámen o velikosti 2–3 cm u 23 pacientů vyžadoval střední dobu výkonu 70 min (55–85) a byl úspěšný u 20 pacientů (86,9 %). U 7 pacientů s litiázou nad 3 cm trvalo ošetření v průměru 135 min (75–160) a bylo úspěšné u 3 pacientů (42,9 %). čím menší byla velikost litiázy, tím větší byl efekt a tím méně času vyžadoval léčebný výkon.
Tab. 4. Úspěšnost RIRS vzhledem k počtu kamenů a lokalizaci litiázy. 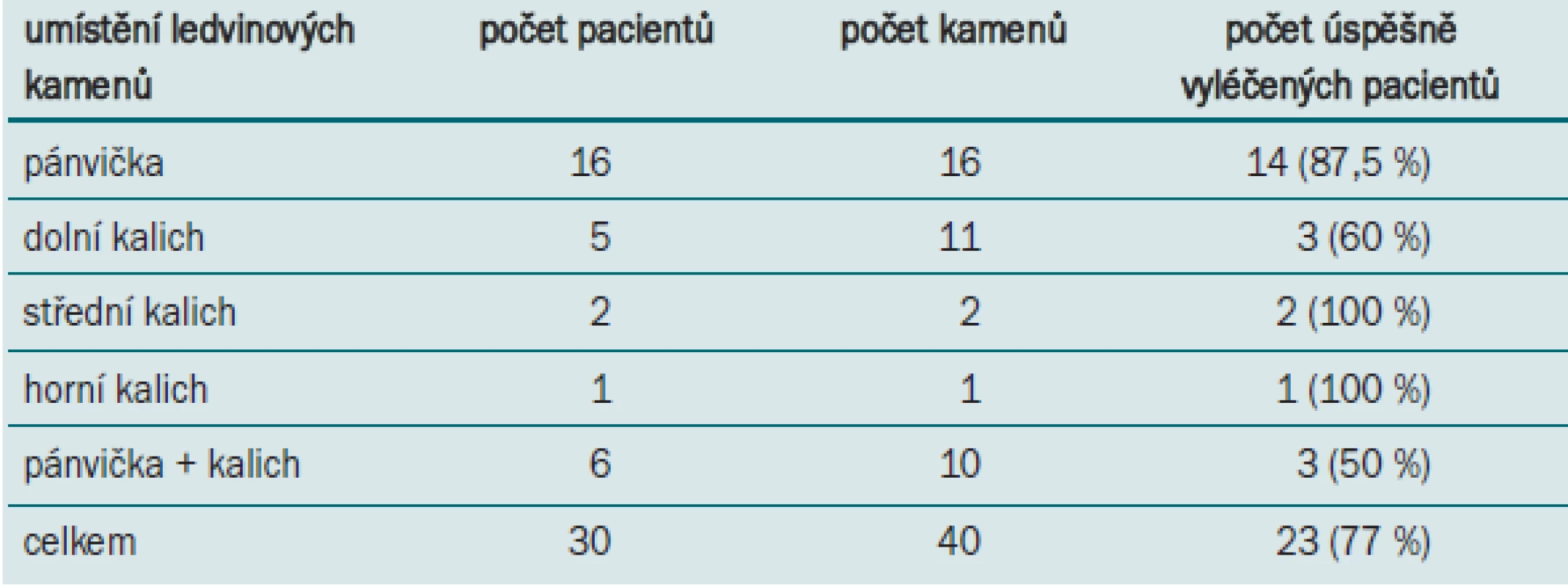
Příčinou neúspěchu u 2 pyelolitiáz byla migrace velkých úlomků kamene do nepřístupných kalichů v 1 případě a špatná vizualizace ve druhém. Oba nezdary při odstraňování konkrementů z dolního kalichu kamenů byly způsobeny nepřístupností kalichů. Zbývající 3 neúspěchy se týkaly pacientů s větším počtem konkrementů v pánvičce a v kališích, kdy byl indikován přechod k PCNL.
Nenastaly žádné větší peroperační komplikace, v pooperačním období nastala u 1 pacienta hematurie, která přetrvávala 2 dny, a febrilie u 2 pacientů. Všichni tito pacienti byli léčeni konzervativně. Nenastaly žádné dlouhodobé komplikace a především nedošlo k obstrukci horních močových cest [18].
Velmi zajímavá je práce, kterou v roce 2005 publikovali Hafron et al a ve které popisují možnost kombinace RIRS a ESWL v jedné době.
U 14 pacientů, u kterých by byla indikována PCNL, byly zjištěny medicínské kontraindikace, nebo PCNL odmítli (tab. 5).
Tab. 5. Důvod neprovedení PCNL. 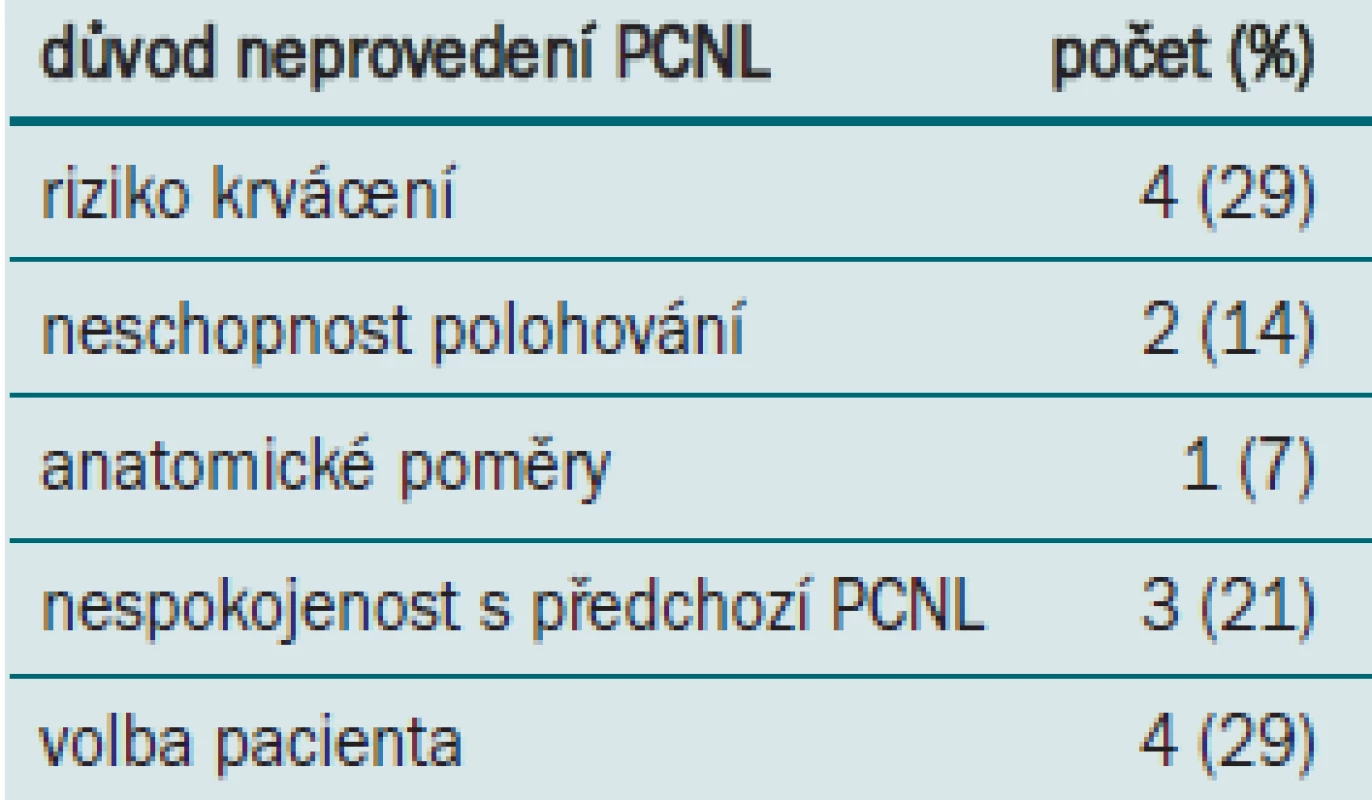
Těchto 14 pacientů bylo léčeno kombinací URS s laser litotrypsí a ESWL. Průměrný věk pacientů byl 52,7 roku (34–81), průměrný povrch litiázy byl dle CT vypočten na 847 mm2 (58–1 850).
U 12 pacientů byla přítomna unilaterální nefrolitiáza, 2 pacienti měli nefrolitiázu bilaterální.
Výkon byl proveden většinou v celkové anestézii (12krát), 1krát v i. v. analgosedaci a 1krát v lokální anestézii. Všichni pacienti dostali profylakticky parenterálně ATB a pooperačně následovala krátkodobá léčba p. o. ATB.
Pacienti byli ve standardní litotomické poloze na ESWL stole (Storz Modulith SL-X).
Byla provedena rigidní endoskopie a za skiaskopické kontroly byl zaveden vodič do DS ledviny. Dále byl zaveden 14F ureterální sheat, kterým byl potom zaveden 7,5F flexibilní ureteroskop do pánvičky ledviny. Endoskopická lito-trypse byla provedena s použitím buï 200µm, nebo 365µm holmium laseru. Ve všech případech byl pro ESWL použit Modulith SL-X, Storz. Průměrný počet aplikovaných rázových vln byl 2 800 (1 000–3 000).
Pacienti podstoupili laserovou dezintegraci litiázy na fragmenty < 5 mm. Reziduální fragmenty byly následně dezintegrovány pomocí ESWL. Konkrementy dolního kalichu byly řešeny jednak in situ, jednak – v závislosti na jejich velikosti – byly relokovány do polohy výhodnější jak pro laserovou dezintegraci, tak pro provedení ESWL.
Ureterální stent byl zaveden k zajištění adekvátní drenáže ledviny a k zajištění odchodu fragmentů. U většiny pacientů byla provedena další doba – URS, ESWL, nebo obojí.
14 % pacientů léčených kombinací URS a ESWL v jedné době bylo bez litiázy po jedné době léčby. Celkově – včetně následných dob – byl „stone-free rate“ 76,9 % a pokud jsou za úspěšně řešené považováni i pacienti s reziduálními fragmenty do 4 mm, potom byla efektivita této kombinované metody 84,6 %.
Průměrný operační čas byl 161 min (120–180), včetně 2 pacientů, u kterých byl proveden kombinovaný výkon v jedné době v obou ledvinách. 93 % pacientů bylo léčeno ambulantně [19].
Mariani v publikaci z roku 2007 popisuje možnost kombinované elektrohydraulické a holmium:YAG laserové ureteroskopické nefrolitotrypsie nefrolitiázy větší než 4 cm.
V jeho souboru bylo léčeno 16 pacientů se 17 ledvinnými konkrementy většími než 4 cm na délku pomocí ureteroskopické nefrolitotrypsie.
Všichni pacienti měli symptomatickou litiázu (bolest a/nebo hematurie a/nebo recidivující UTI). Obezita (BMI vyšší než 30) se vyskytovala u 13 z 16 (81 %) a 6 z 16 (38 %) bylo patologicky obézních (BMI vyšší než 40). Průměrná délka konkrementu byla 65 mm (41–97). Plocha konkrementu byla v průměru 1,169 mm2 (0,560–2,425). Pacienti s bakteriurií byli před výkonem léčeni po dobu 3 dnů perorálně podávanými antibiotiky podle kultivace moči.
Výkony byly prováděny v celkové anestézii a pacienti byli v modifikované litotomické poloze s nataženou ipsilaterální dolní končetinou, aby se omezilo vyklenutí bederního svalu, a v Trendelenburgově poloze, aby fragmenty konkrementů mohly unikat do lépe přístupných horních částí ledviny.
Za pomoci skiaskopie byl do ledvinové pánvičky zaveden hydrofilní vodič, podél kterého byl zaveden dvoukanálový ureterální stent 6/10 Fr, a druhý pojistný rigidní vodič, který sloužil i jako pomůcka k narovnání močovodu.
Po zavedení flexibilního ureteroskopu byl vodič nahrazen EHL sondou 1,9 Fr, která byla umístěna 5 mm od hrotu ureteroskopu, a 1 až 3 mm od konkrementu, aby se maximalizoval přenos kinetické energie na konkrement. Bylo použito nejnižší nastavení, které účinně fragmentovalo konkrement, aby se minimalizovalo riziko poranění měkkých tkání a prodloužila se životnost sondy. Pro zlepšení vizualizace byla použita manuální irigace a pro usnadnění práce personálu se během celého zákroku používalo video.
U tvrdých konkrementů (4 případy) rezistentních vůči EHL bylo použito 200mikronové Ho:YAG laserové vlákno pro vyvrtání otvorů do konkrementu. To konkrement dostatečně oslabilo, takže výboje EHL sondy do defektu způsobeného laserem („střílení do díry“) vedly k dobré úvodní fragmentaci.
Při dosažení fragmentace do cca 3 mm – podle skiaskopického zobrazení a porovnáním s naváděcím drátem (1 mm) a sondou EHL (0,7 mm) jako vizuálního měřiče velikosti – byla procedura ukončena. Byl zaveden dvojitý stent 7 Fr. Před vyjmutím cystoskopu po drenáži močovodu bylo intravezikálně injektováno 15 mg ketorolaku v 20 ccm fyziologického roztoku, aby se omezil pooperační dyskomfort. Pacienti byli pečlivě sledováni kvůli sepsi po dobu minimálně 6 hod po zákroku, pak byli propuštěni domů, pokud byli bez potíží a stabilizovaní. Pacienti byli propuštěni domů se 14denní zásobou 0,4 mg tamsulosinu pro podporu minimálně symptomatického průchodu fragmentů [30].
Během 2. nebo 3. dne po operaci byl odstraněn JJ stent. Pacienti s infikovanými konkrementy byli léčeni perorálně antibiotiky po dobu 5 až 7 dnů, následně přešli na subinhibiční dávky antibiotik až do odchodu konkrementu. Většina litiatické drtě odešla během 2 týdnů po výkonu. Po 10 až 14 dnech a 4 až 8 týdnech byly pořízeny snímky. Pokud byla zjištěna přítomnost „steinstrasse“, další doba léčby byla naplánována během 2 týdnů, v opačném případě do 6 týdnů. Konečného bodu bylo dosaženo za 6 týdnů po poslední době, kdy diagnostické zobrazení nebo ureteroskopie potvrdily přítomnost či absenci reziduálních konkrementů. Bylo provedeno průměrně 2,4 dob léčby na konkrement a průměrný operační čas byl 49 min na 1 dobu léčby při průměrném celkovém operačním čase 115 min na konkrement. Ze 40 zákroků proběhlo 36 (90 %) ambulantně. Úspěchu, definovaného jako odchod všech mobilních fragmentů konkrementů, bylo dosaženo u 15 ze 17 (88 %) konkrementů. V 1 případě zůstal v předním kalíšku 11 × 14mm fragment, který byl nedostupný pro ureteroskop a odolný vůči ESWL. V dalším případě byly na následném UTZ 2mm fragmenty ve spodním kalíšku. U tohoto pacienta se následně rychle rozvinul progresivní žaludeční karcinom, kvůli kterému nebyla další léčba vhodná.
Horečka a zimnice se projevily u 3 pacientů. Minimálně symptomatická „steinstrasse“ se rozvinula u 3 pacientů. U 1 pacienta si to vyžádalo dodatečný ureteroskopický výkon, zatímco u 2 pacientů se „steinstrasse“ uvolnila během další fáze nefrolitotrypsie.
Žádný z pacientů nepotřeboval krevní transfuzi. Nebyly signifikantní rozdíly v hladině kreatininu v séru před a po výkonech [20].
KOMPLIKACE RIRS
Největším problémem, který se týká operací RIRS, je vysoký tlak vzniklý v důsledku irigace uvnitř dutého systému, což může vést k intrarenálnímu refluxu. Tento vysoký tlak může způsobit porušení krevních cév a může dojít k průniku bakterií a endotoxinů do krevního oběhu. Jako ochrana před vysokým intrapelvickým tlakem, který vzniká při RIRS, slouží zavedený dilatátor, ale ten nemůže zcela zabránit pooperační bakteriální infekci, protože bakterie a/nebo endotoxiny v konkrementu anebo kolonizované na stentech a nefrostomických drenech se mohou v průběhu výkonu uvolnit a v důsledku toho dojde k urosepsi [26].
Lifshitz et al [27] hodnotili 65 pacientů se zavedenými uretrálními stenty a sterilní kultivací moči. Zjistili, že pravděpodobnost mikrobiální kolonizace stentů byla 36 %, a to i v případě sterilní kultivace moči. Tyto infikované stenty mohou sloužit jako ohnisko bakteriurie a možné bakteriemie po endoskopickém výkonu a manipulaci se stentem. Minsky et al [28] porovnávali výsledky ureteroskopie u pacientů s anebo bez stentů, přičemž detekovali daleko vyšší počet infekčních komplikací (15 % urosepsí) u pacientů, kteří měli v době výkonu zavedeny stenty.
Za špatnou prognózu je považována také pozitivní předoperační kultivace moči, a to i navzdory následné eradikaci díky příslušné antibiotické léčbě. S tím souvisí fakt, že 42 % pacientů s pozitivní předoperační kultivací moči, u kterých bylo ATB terapií dosaženo sterilní kultivace, mělo po operaci uroinfekci a u 75 % z nich byla bakterie v pooperačních kultivacích totožná s tou, která byla prokázána kultivačně před operací [27,28].
Další nevýhodou RIRS je omezený přístup k dolním kalichům, kde se mohou shromažïovat fragmenty litiázy. Pokud se flexibilním ureteronefroskopem zavede laserové vlákno, sníží se úhel deflexe i viditelnost, a proto je možnost dezintegrace konkrementů dolního kalichu omezená. Stav et al [29] označili tento fakt za jedno z největších omezení RIRS v porovnání s PCNL, především v případech, kdy se jedná o konkrementy > 20 mm.
Důležitou technikou v řešení litiázy dolního kalichu retrográdní endoskopickou cestou je relokace konkrementu pomocí flexibilního grasperu a košíčku.
Ukazuje se, že četnost úspěšného řešení je signifikantně lepší při relokaci konkrementu než při řešení in situ. Při užití relokačních metod je „stone-free rate“ 80–90% u pacientů s litiázou do 2 cm [32,33].
Další možností je širší využití EHL litotrypse eventuálně v kombinaci s Ho:Yag laserem. EHL fragmentuje mnohem větší objemy konkrementu za časovou jednotku než Ho:YAG laser, čímž se zkracuje operační čas. Další výhodou je flexibilita. EHL sonda 1,9 Fr umožňuje větší ohnutí ureteroskopu, čímž se zlepšuje přístup ke všem částem vývodného systému včetně dolního kalichu. Na rozdíl od laserového Ho:YAG vlákna se může EHL sonda 1,9 Fr zavést předem umístěným, ohnutým ureteroskopem s minimálním rizikem pro pracovní kanál, čímž se ještě zlepšuje přístup.
U konkrementů odolných vůči EHL může Ho:YAG laser vytvořit otvory, čímž se oslabí struktura tak, aby se mohla využít hlavní výhoda EHL – fragmentace velké masy na jednotku času.
ZÁVĚR
Z uvedených údajů je patrné, že retrográdní intrarenální operace je potenciálně možnou metodou volby při léčbě nefrolitiázy. Metoda je všeobecně minimálně invazivní a může dosáhnout signifikantní fragmentace konkrementů. Spojení ambulantního provedení RIRS a ESWL v jedné době může vést k signifikantní jednorázové fragmentaci i objemné nefrolitiázy, s eventuální nutností následné druhé doby (URS, ESWL nebo obojí) při minimální celkové morbiditě.
Ve srovnání s PCNL a „second look“ nefroskopií nabízí použití kombinace URS a ESWL v jedné době srovnatelné výsledky při nižší morbiditě.
I když je PCNL stále považována za zlatý standard při řešení velkých ledvinových kamenů, zdá se, že RIRS může být v některých případech výhodnější než PCNL, a to především proto, že nevyžaduje přístup do dutého systému přes renální parenchym. To zabraňuje možným komplikacím parenchymového traumatu, krvácení a hemo/pneumotoraxu spojenému s PCNL, což může být rozhodující obzvláště v případech zvýšené krvácivosti [22]. U pacientů s recidivujícími cystinovými konkrementy, u kterých může opakovaná PCNL způsobit poškození ledvin, je jako možná alternativa některými autory doporučována RIRS s laserovou litotrypsí [23]. Dále lze tento postup úspěšně použít u patologicky obézních pacientů [24,25]. Výhodou je též možnost provedení většiny výkonů ambulantně. Limitací této metody je všeobecně delší operační čas a ekonomická náročnost (vysoká pořizovací cena, nákladné opravy).
Podle řady publikovaných studií se RIRS považuje za bezpečný a účinný postup i při litiáze větší než 20 mm. Gould [36] dokonce navrhuje, aby se RIRS stal novým zlatým standardem při odstraňování kamenů do 30 mm.
I když pokroky v technologii (použití dilatátorů pro zlepšení viditelnosti a snížení intrapelvického tlaku, využití grasperů a různých typů košíčků k relokaci litiázy) rozšířily možnosti RIRS, kandidáti na operaci RIRS by přesto měli být vybíráni obezřetně.
Pacienti s konkrementy většími než 20 mm nebo mnohočetnou litiázou, s předoperačně zavedeným stentem nebo nefrostomií jsou skupinou pacientů, u kterých se vyskytuje vyšší riziko infekčních komplikací a kteří pravděpodobně budou mít po operaci RIRS méně uspokojivé výsledky týkající se „stone-free rates“.
MUDr. Vítězslav Vít
Urologická klinika FN Brno
Jihlavská 20, 625 00 Brno
vvit@fnbrno.cz
Zdroje
1. Albala DM, Assimos DG, Clayman RV et al. Lower pole I: A prospective randomized trial of extracorporeal shock wave lithotripsy and percutaneous nephrostolithotomy for lower pole nephrolithiasis: initial results. J Urol 2001; 166 : 2072–2080.
2. Sumino Y, Mimata H, Tasaki Y et al. Predictors of lower pole stane clearance after extracorporeal shock wave lithotripsy. J Urol 2002; 168 : 1344–1347.
3. Snyder JA, Smith AD. Staghorn calculi: Percutaneous extraction versus anatrophic nephrolithotomy. J UroI 1986; 136 : 351–354.
4. Kahnoski RJ, Lingeman JE, Coury TA et al. Combined percutaneous and extracorporeal shock wave lithotripsy for staghorn calculi: An alternative to anatrophic nephrolithotomy. J Urol 1986; 135 : 679–681.
5. Preminger GM, Assimos DG, Lingeman JE et al. Chapter 1: AUA Guideline on management of staghorn calculi: diagnosis and treatment recommendations. J Urol 2005; 173 : 1991–2000.
6. Chong TW, Bui MH, Fuchs GJ. Calyceal diverticula. Ureteroscopic manegement. Urol Clin North Am 2000; 27 : 647–654.
7. Grasso M, Conlin M. Bagley D. Retrograde ureteropyeloscopic treatment of 2 cm or greater upper urinary tract and minor staghorn calculi. J Urol 1998; 160 : 346–351.
8. Mariani AJ. Combined electrohydraulic and holmium:YAG laser ureteroscopic nephrolithotripsy for 20 to 40mm renal calculi. J Urol 2004; 172 : 170–174.
9. El-Anany FG, Hammouda HM, Maghraby HA, Elakkad MA. Retrograde ureteropyeloscopic holmium laser lithotripsy for large renal calculi. BJU Int 2001; 88 : 850–853.
10. Huffman JL, Bagley DH, Schoenberg HW, Lyon ES. Transurethral removal of large ureteral and renal pelvic calculi using ureteroscopic ultrasonic lithotripsy. J Urol 1983; 130 : 31–34.
11. Aso Y, Ohta N, Nakano M et al. Treatment of staghorn calculi by fiberoptic transurethral nephrolithotripsy. J Urol 1990; 144 : 9–17.
12. Dretler SP. Ureteroscopic fragmentation followed by extracorporeal shock wave lithotripsy: a treatment alternative for selected large or staghorn calculi. J Urol 1994; 151 : 842–846.
13. Patel A, Fuchs GJ. Expanding the horizons of SWL through adjunctive use or retrograde intrarenal surgery: New techniques and indications. J Endourol 1997; 11 : 33–36.
14. Grasso M. Experience with the holmium laser as an endoscopic lithotrite. Urology 1996; 48 : 199.
15. Matsuoka K, Iida S, Nakanami M et al. Holmium: yttrium-aluminum-garnet laser for endoscopic lithotripsy. Urology 1995; 45 : 947–952.
16. Preminger GM. Management of lower pole renal calculi: shock wave lithotripsy versus percutaneous nephrolithotomy versus flexible ureteroscopy. Urol Res 2006; 34 : 108–111.
17. Zilberman DE, Mor Y, Duvdevani M et al. Retrograde intra-renal surgery for stone extraction. Scand J Urol Nephrol 2007; 41 : 204–207.
18. El-Anany FG, Hammouda HM, Maghraby HA, Elakkad MA. Retrograde ureteropyeloscopic holmium laser lithotripsy for large renal calculi. BJU Int 2001; 88 : 850–853.
19. Hafron J, Fogarty JD, Boczko J, Hoenig DM. Combined Ureterorenoscopy and Shockwave Lithotripsy for Large Renal Stone Burden: An Alternative to Percutaneous Nephrolithotomy? J Endourol 2005; 19(4): 464–468.
20. Mariani AJ. Combined Electrohydraulic and Holmium:YAG Laser Ureteroscopy Nephrolithotripsy of Large (Greater Than 4 cm) Renal Calculi. J Urol 2007; 177 : 168–173.
21. Gerber GS. Management of Lower-Pole Caliceal Stones. J Endourol 2003; 17(7): 501–503.
22. Watterson JD, Girvan AR, Cook AJ et al. Safety and efficacy of holmium:YAG laser lithotripsy in patients with bleeding diatheses. J Urol 2002; 168 : 442–445.
23. Kourambas J, Munver R, Preminger GM. Ureteroscopic management of current renal cystine calculi. J Endourol 2000; 14 : 489–492.
24. Bagley DH. Expanding role of urethroscopy and laser lithotripsy for treatment of proximal ureteral and intrarenal calculi. Curr Opin Urol 2002; 12 : 277–280.
25. Dash A, Schuster BK, Hollenbeck GJ et al. Ureteroscopic treatment of renal calculi in morbidly obese patients: a stone match comparison. Urology 2002; 60 : 393–397.
26. Auge BK, Pietrow PK, Lallas CD et al. Ureteral access sheath provides protection against elevated renal pressures during routine ureteroscopic stone manipulation. J Endourol 2004; 18 : 33–36.
27. Lifshitz DA, Winkler HZ, Gross M et al. Predictive value of urinary cultures in assessment of microbial colonization of ureteral stents. J Endourol 1999; 13 : 735–738.
28. Minski Z, Dotan Z, Ramon J, Winkler H. Are patients with indwelling ureteral stents at a higher clinical risk while undergoing ureteroscopy? A prospective comparative clinical trial. J Urol 2002; 167 : 296A.
29. Stav K, Cooper A, Zisman A et al. Retrograde intrarenal lithotripsy outcome after failure of shock wave lithotripsy. J Urol 2003; 170 : 2198–2201.
30. Resim S, Eckerbicer HC, Cifti A. Role of tamsulosin in treatment of patients with steinstrasse developing after extracorporeal shock wave lithotripsy. Urology 2005; 66(5): 945–948.
31. Zhong P, Tong HL, Cocks H, Preminger GM. Transient oscillation of cavitation bubbles near stone surface during electrohydraulic lithotripsy. J Endourol 1997; 11 : 55–61.
32. Auge BK, Dahm P, Wu NZ, Preminger GM. Ureteroscopic management of lower-pole renal calculi: Technique of calculus displacement. J Endourol 2001; 15(8): 835–838.
33. Schuster TG, Hollenbeck BK, Faerber GJ, Wolf JS Jr. Ureterocopic treatment of lower pole calculi: Comparison of lithotripsy in situ and after displacement. J Urol 2002; 168 : 43–45.
34. Elashry OM, DiMeglio RB, Nakada SY. McDougall EM. Glayman RV. Intracorporeal electrohydraulic lithotripsy of ureteral and renal calculi using small caliber (1.9F) electrohydraulic lithotripsy probes. J Urol 1996; 156(5): 1581–1585.
35. Fabrizio MD, Behari A, Bagley DH. Ureteroscopic management of intrarenal calculi. J Uro1 1998; 159 : 1139–1143.
36. Gould DL. Retrograde flexible ureterorenoscopic holmium-YAG laser lithotripsy: the new gold standard. Tech Urol 1998; 4 : 22–24.
Štítky
Dětská urologie Urologie
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2008 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Infekce močových cest u dospělých – mezery v současných guidelines a doporučení pro klinickou praxi
-
Všechny články tohoto čísla
- Dnešní indikace extrakorporální litotrypse v léčbě urolitiázy – co se změnilo?
- Kvíz
- Aktualizace guidelines pro ureterální litiázu
- Dnešní možnosti ureteroskopie
- Objemná nefrolitiáza – perkutánní litotrypse, nebo retrográdní intrarenální operace?
- Terapeutická endourologie: obstrukce ureteropelvické junkce
- Úvodník
- Stenóza PUJ – antegrádní a retrográdní endopyelotomie, laparoskopická pyeloplastika. Správné indikace, pro a proti
- Terapeutická endourologie: karcinom z přechodných buněk lokalizovaný v horních cestách močových
- Ortotopická neovezika – současný stav
- Kombinovaná léčba BHP – aktuální stav
- Ze zahraničních periodik
-
Guidelines EAU pro karcinom močového měchýře (svalovinu invadujícího a metastazujícího)
verze 2007 - Guidelines EAU pro urolitiázu
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Stenóza PUJ – antegrádní a retrográdní endopyelotomie, laparoskopická pyeloplastika. Správné indikace, pro a proti
- Dnešní možnosti ureteroskopie
- Objemná nefrolitiáza – perkutánní litotrypse, nebo retrográdní intrarenální operace?
- Guidelines EAU pro urolitiázu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání