-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Prevence, diagnostika a léčba trombózy spojené se zhoubným nádorem
Autoři: P. Tesařová 1; D. Karetová 2; J. Hirmerová 3; R. Malý 4; S. Vokurka 5; T. Kvasnička 6; P. Kessler 7; P. Ďulíček 8; J. Gumulec 9; V. Maňásek 10; J. Cvek 11; J. Prausová 12; B. Melichar 13; J. Kopecký 14; J. Kleinová 15; P. Aulický 16; J. Blatný 17; M. Penka 18
Působiště autorů: Radioterapeutický ústav FNB a 1. LF UK, Onkologická klinika VFN v Praze 1; II. interní klinika – kardiologie a angiologie 1. LF UK, a VFN v Praze 2; 2. interní klinika LF UK a FN Plzeň 3; 1. interní klinika LF UK a FN Hradec Králové 4; Onkologická a radioterapeutická klinika FN Plzeň 5; Trombotické centrum, VFN Praha 6; Oddělení hematologie a transfuziologie, Nemocnice Pelhřimov 7; IV. interní hematologická klinika, FN Hradec Králové 8; Klinika hematoonkologie FN Ostrava 9; Onkologické oddělení Nemocnice Agel, Nový Jičín 10; Onkologická klinika LF OU a FN Ostrava 11; Onkologická klinika 2. LF UK a FN Motol, Praha 12; Onkologická klinika FN Olomouc 13; Onkologická klinika LF UK a FN Hradec Králové 14; Masarykův onkologický ústav – Interní oddělení Masarykova onkologického ústavu, Brno 15; ARO Nemocnice milosrdných bratří, Brno 16; Klinika dětské onkologie FN Brno 17; Oddělení klinické hematologie, FN Brno 18
Vyšlo v časopise: Transfuze Hematol. dnes,29, 2023, No. 1, p. 61-67.
Kategorie: Doporučené postupy
doi: https://doi.org/10.48095/cctahd202361Souhrn
Doporučení vychází současně jako samostatná kapitola Modré knihy České onkologické společnosti 2023
Česká kooperativní skupina pro prevenci, léčbu a diagnostiku CAT:
ÚVOD
Venózní tromboembolie (venous thrombembolic event – VTE) spojená se zhoubným nádorem (cancer associated thromboembolism – CAT) zahrnuje dvě klinické jednotky – hlubokou žilní trombózu (deep vein thrombosis – DVT), vyskytující se nejčastěji v oblasti dolních končetin, a plicní embolii (PE).
Incidence CAT u onkologických pacientů vzhledem ke zlepšení možností protinádorové léčby a prodloužení života pacientů stoupá. Zhoubný nádor je spojen s hyperkoagulačním stavem. U všech zhoubných nádorů je incidence CAT 3 %, u léčených systémovou terapií přes 5 %.
CAT u pacientů s malignitou způsobuje vyšší morbiditu, (3× zvyšuje nutnost hospitalizace, 3× ji prodlužuje), mortalitu (9,2 % úmrtí z důvodu CAT) a zhoršení kvality života. CAT vyžaduje léčbu antikoagulancii, oddaluje protinádorovou léčbu, zvyšuje náklady, ohrožuje nemocného recidivou, rizikem krvácení, návratem zhoubného nádoru.
Rizikovými pacienty jsou lidé vyššího věku, s interními komorbiditami, trombofilií nebo DVT a PE v anamnéze. S vyšším rizikem CAT jsou spojeny některé typy nádorů (mozkové nádory, karcinom žaludku, pankreatu, plic s translokacemi ALK/ROS1, hematologické malignity, aj.) a pokročilé nádory s vyšším grade, nejčastěji krátce po diagnóze. Další významné riziko CAT souvisí s onkologickou léčbou (chemoterapie, terapie hormony, anti-VEGF léčba, erytropoézu stimulující proteiny, imidy, centrální žilní katetr, krevní převody atd.) (tab. 1 a 2).
Tab. 1. Rizikové skóre vzniku CAT (dle Khorany [16]). ![Rizikové skóre vzniku CAT (dle Khorany [16]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/f2d50f234742a8d3ae2c240f1b7647e1.png)
CAT – trombóza spojená s malignitou Tab. 2. Hodnocení skóre rizika CAT dle Khorany [16]. ![Hodnocení skóre rizika CAT dle Khorany [16].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/040e5141600499f006a4261affb64c62.png)
CAT – trombóza spojená s malignitou U každého individuálního nemocného je třeba odhadnout riziko, uvážit vhodnou prevenci a v případě diagnózy zvolit správnou léčbu (typ přípravku a délku podávání). Vzhledem k přetrvávajícím rizikům u nemocných s aktivní onkologickou terapií je nutné uvážit i tzv. sekundární prevenci CAT pomocí udržovací antikoagulační terapie.
PREVENCE CAT
Hospitalizovaní pacienti
U hospitalizovaných pacientů s aktivní malignitou a akutním interním onemocněním nebo omezenou hybností je doporučena farmakologická tromboprofylaxe, pokud nekrvácí nebo nemají jiné kontraindikace. Dávkování viz tab. 3.
Tab. 3. Možnosti profylaxe CAT pro hospitalizované onkologicky nemocné. 
BMI – body mass index; C krea – clearance kreatininu; CAT – trombóza spojená s malignitou; s.c. – podkožně Ambulantní pacienti podstupující protinádorovou léčbu
Rutinní farmakologická profylaxe by neměla být podávána všem ambulantním nemocným s malignitou. Ambulantní pacienti s malignitou ve vysokém riziku (již při Khorana skóre ≥ 2) by před zahájením nové systémové onkologické léčby měli dostávat farmakologickou tromboprofylaxi s použitím nízkomolekulárního heparinu (low weight molecular heparin – LMWH) nebo přímá (nová) orální antikoagulancia (direct oral anticoagulants – DOAC) (apixaban nebo rivaroxaban), pokud nejsou signifikantní rizika krvácení a významné lékové interakce. Úvaha o konkrétním způsobu léčby by měla být doprovázena diskuzí s pacientem o relativních výhodách a rizicích, ceně léku a délce profylaxe. Dávkování viz tab. 4.
Tab. 4. Možnosti profylaxe CAT pro onkologicky nemocné, u kterých je zahájena systémová protinádorová léčba. 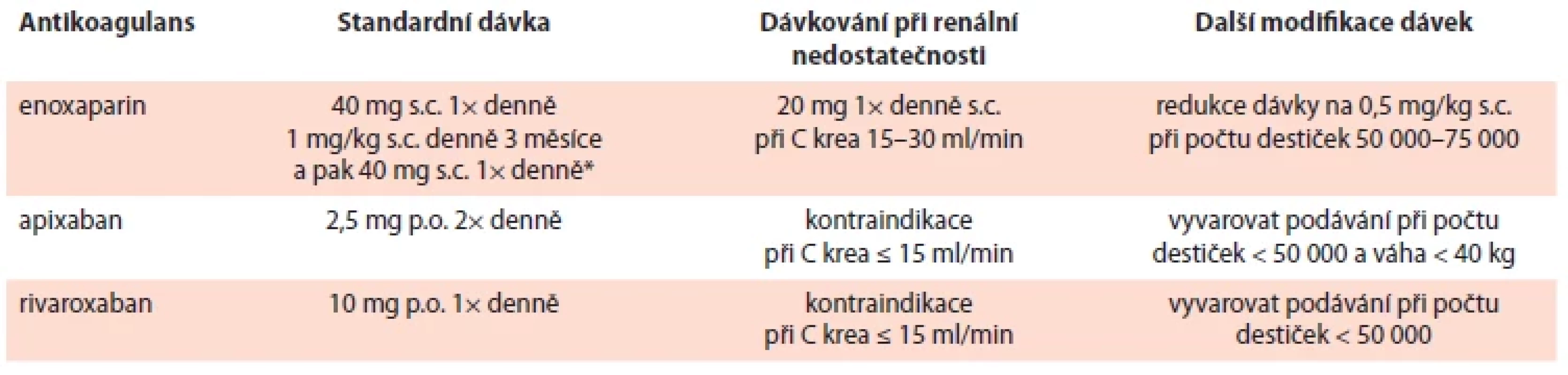
Profylaxe je pro vysoce rizikové nemocné s maligním onemocněním, kteří podstupují ambulantní chemoterapii (> 18 let, Khorane skóre ≥ 2, zahájení nové chemoterapie). Délka trvání profylaxe je půl roku nebo déle, pokud nadále rizika VTE trvají. *platí pro nemocné s pokročilým neoperabilním a metastazujícím karcinomem pankreatu
C krea – clearance kreatininu; CAT – trombóza spojená s malignitou; p.o. – orálně; s.c. – podkožněPacienti s malignitou podstupující chirurgický výkon
Všichni nemocní s maligním onemocněním podstupující chirurgickou intervenci by měli dostávat farmakologickou tromboprofylaxi s použitím LMWH (nebo UFH – nefrakciovaný heparin), pokud nejsou přítomné aktivní krvácení, vysoké riziko krvácení nebo další kontraindikace. Profylaxe by měla být zahájena před operací. Mechanické metody mohou být kombinovány s farmakologickou tromboprofylaxí, ale neměly by být použity jako monoterapie v prevenci CAT, pokud není kontraindikace jejich podání pro aktivní krvácení nebo vysoké riziko krvácení. Kombinace farmakologické a mechanické profylaxe může zvýšit její účinnost zejména u vysoce rizikových nemocných. Farmakologická tromboprofylaxe by u pacientů podstupujících vážnou operaci pro malignitu měla být podávána nejméně 7–10 dní, po rozsáhlé operaci pro zhoubný nádor je indikována prodloužená profylaxe po dobu 4 týdnů. Prolongovaná prevence (4 týdny) s využitím LMWH je indikována u pacientů s malignitou k prevenci CAT po laparoskopické chirurgii stejným způsobem jako po laparotomii.
Po operaci se pacientům s malignitou doporučuje podání LMWH jednou denně (pokud je clearance kreatininu ≥ 30 ml/min) nebo nízké dávky UFH 3× denně. Farmakologická profylaxe by měla být zahájena 2–12 h před operací. LMWH 1× denně je pohodlnější volbou oproti UFH (LMWH snižuje riziko hematomu v operační ráně oproti UFH). Neexistují žádná data o superioritě jednoho typu LMWH vůči druhému.
Při prevenci CAT je po operaci u pacientů s malignitou, kteří mají body mass index (BMI) ≥ 40, doporučeno užití vyšších profylaktických dávek LMWH. Dávkování viz tab. 5.
Tab. 5. Možnosti prolongované profylaxe CAT u pacientů s maligním onemocněním a nutností chirurgického výkonu. 
Pro nemocné s vysokým rizikem VTE v břišní a pánevní chirurgii (anamnéza VTE, imobilizace ≥ 4 dny, operační čas > 2 h, pokročilé stádium onemocnění, věk > 60 let. V ČR není schváleno použití DOAC (apixaban a rivaroxaban) v prevenci VTE.
*aplikováno pouze v gynekologii u nemocných s malignitou dle SPC
C krea – clearance kreatininu; CAT – trombóza spojená s malignitou; IU – jednotka; p.o. – orálně; s.c. – podkožně; SPC – Souhrn údajů o přípravku; VTE – venózní tromboembolieDalší doporučení pro profylaxi CAT
Zavedení filtru do dolní duté žíly není doporučováno v rámci rutinní profylaxe.
Není doporučena rutinní antikoagulační profylaxe katetrem asociované trombózy.
DIAGNOSTIKA CAT
Symptomy DVT jsou nespecifické (otok, bolestivost, barevné změny, zvýšená teplota kůže). Symptomy PE (dušnost, bolest na hrudi, hypotenze, tachykardie, synkopa, méně často kašel a hemoptýza) mohou být mylně považovány za příznaky nádorového onemocnění.
U onkologických pacientů (na rozdíl od neonkologických) nezahajujeme diagnostický algoritmus stanovením klinické pravděpodobnosti diagnózy (např. pomocí Wellsova skóre), neboť sama přítomnost nádoru znamená střední či vysokou pravděpodobnost. Rovněž není přínosné stanovení D-dimerů (negativní prediktivní hodnota se uplatní v diagnostice především u neonkologických pacientů).
U onkologických pacientů tedy provedeme rovnou příslušné zobrazovací vyšetření:
Při podezření na DVT žil dolních (event. horních) končetin – duplexní sonografii (DUSG) žil (indikuje praktický lékař, onkolog, internista či jiný ošetřující lékař; provádí angiolog či specialista oboru zobrazovacích metod).
Při podezření na PE spirální plicní CT angiografii – CTAG (indikuje internista, kardiolog, onkolog či jiný ošetřující lékař; provádí specialista oboru zobrazovacích metod). U hemodynamicky nestabilních pacientů, kdy není dostupná CT nebo pacient nemůže být transportován, je metodou volby echokardiografické vyšetření u lůžka (provádí kardiolog). Ventilačně-perfuzní (V/Q) plicní scintigrafie je metodou volby u pacientů s kontraindikací spirální plicní CTAG (provádí specialista oboru zobrazovacích metod).
Vzácněji, při nediagnostickém výsledku DUSG žil horních či dolních končetin či při podezření na trombózu splanchnických žil (nebo jiných žil trupu), použijeme CT venografii, případně MR venografii, eventuálně kontrastní venografii (indikuje internista, angiolog onkolog či jiný ošetřující lékař; provádí specialista oboru zobrazovacích metod).
LÉČBA CAT
Základem terapie je antikoagulační léčba
1) Iniciální léčba („akutní“)
- Zahájena bezprostředně po stanovení diagnózy CAT (případně již při vzniku silného podezření na akutní CAT – do provedení příslušného zobrazovacího vyšetření, které podezření potvrdí, či vyvrátí), obvykle tento pojem zahrnuje prvních 1–7 dní (případně 1–21 dní).
- Pro iniciální léčbu akutní CAT (u nemocných bez renální insuficience, tj. clearance kreatininu > 30 ml/min) je vhodný LMWH či DOAC, ale pro iniciační léčbu lze užít pouze apixaban či rivaroxaban. Při těžké renální insuficienci je možné volit nefrakcionovaný heparin, event. LMWH v redukované dávce s kontrolou hladiny antiXa a případnou adjustací dávky.
- U onkologických pacientů přichází v úvahu ambulantní léčba, a to zejména v případě nekomplikované DVT, za podmínky dobré spolupráce a absence zřejmého krvácivého rizika. Nemocní se symptomatickou PE bývají obvykle v iniciální fázi hospitalizováni.
- Léčbu může provádět internista, angiolog, kardiolog, hematolog nebo onkolog. Žádoucí je spolupráce mezi těmito obory k posouzení rozsahu a závažnosti CAT ze strany internisty, angiologa (či kardiologa) a také k odhadu rizika krvácení či rizika interakcí s protinádorovou léčbou ze strany onkologa.
- V případě DVT by měla být doporučena též kompresní punčocha či bandáž končetiny.
- V nejzávažnějších případech CAT přichází iniciálně v úvahu léčba trombolytická (systémová trombolýza u vysoce rizikové PE či katetrem řízená trombolýza u rozsáhlé ileofemorální DVT), případně endovaskulární trombektomie. Měl by být pečlivě zvážen poměr riziko/benefit, zejména s přihlédnutím k celkovému stavu a prognóze pacienta. Trombolytická léčba je kontraindikována při postižení centrálního nervového systému a při významných rizikových faktorech krvácení.
- Incidentální CAT, tj. PE či DVT oligosymptomatické či asymptomatické, náhodně diagnostikované (obvykle pomocí CT v rámci určení stadia onkologického onemocnění) mají být rovněž léčeny antikoagulačně. U dobře spolupracujícího pacienta s nízkým rizikem komplikací lze zvolit ambulantní léčbu.
2) Následná antikoagulační terapie („základní“)
- Lze podávat LMWH, apixaban, rivaroxaban či edoxaban (edoxaban je možné podávat až po úvodní minimálně pětidenní léčbě LMWH). Léčba by měla trvat minimálně 3, spíše však alespoň 6 měsíců.
- Léčbu může provádět internista, angiolog, kardiolog, hematolog nebo onkolog – optimálně za vzájemné spolupráce, s posouzením účinnosti a tolerance léčby a s případným provedením kontrolních zobrazovacích vyšetření (např. kontrolní duplexní žilní sonografie u DVT či kontrolní echokardiografie po rozsáhlé PE).
3) Léčba extendovaná (po dobu časově neohraničenou)
- Extenze antikoagulační terapie nad 6 měsíců je vhodná, trvá-li aktivita maligního onemocnění, či pokračuje-li protinádorová léčba (pokud nejsou kontraindikace antikoagulační léčby).
- Lze zvolit LMWH (enoxaparin, nadroparin, bemiparin) či DOAC (apixaban, rivaroxaban či edoxaban), některá doporučení připouštějí i warfarin za předpokladu dobré spolupráce nemocného, častých kontrol a pečlivé časté monitorace INR. (Dabigatran v současnosti nemá studii průkazu účinku a bezpečnosti u onkologických nemocných.)
- Léčbu může provádět internista, angiolog, kardiolog, hematolog nebo onkolog (případně praktický lékař).
- Zvolíme-li extendovanou terapii, je nutno v pravidelných intervalech přehodnocovat poměr riziko/benefit, nejlépe opět konzultací mezi výše uvedenými odborníky.
Volba typu antikoagulační léčby
Pro užití LMWH platí zásady:
- Preference u luminálních nádorů (či lézí) GIT, případně u nádorů (či lézí) urogenitálního traktu a při vysokém riziku krvácení.
- Preference při progresi malignity.
- Preference při závažnější trombocytopenii (< 50×109/l).
- Vhodný při emetogenní terapii, nauzee, zvracení a poruchách absorpce z GIT.
- Vhodný při riziku lékových interakcí protinádorové léčby s DOAC či warfarinem.
- Není vhodný při pokročilé renální insuficienci či kolísavé funkci ledvin. U renálního selhávání se upravují dávky LMWH podle hladiny anti-Xa. V případě renální insuficience spojené s trombózou dávku LMWH u pacientů s C krea > 30 není třeba upravovat; s C krea = 15–30 se doporučuje upravit dávku, a pokud je C krea < 15, pak pozastavit léčbu.
Pro DOAC platí:
- Preference u malignit mimo GIT a urogenitální trakt, pro ambulantní léčbu je vhodný apixaban či rivaroxaban (lze je užít již při zahájení léčby – nevyžadují „předléčení“ LMWH).
- Nevhodná v případě anamnézy krvácení z GIT, nepoužívat v případě vysokého rizika krvácení či závažné trombocytopenie.
- Nepoužívat při riziku lékových interakcí (na úrovni P-gp a CYP3A4).
- Nepoužívat při pokročilé renální insuficienci či při kolísavé funkci ledvin. (C krea < 15 ml/min)
- Nepoužívat u závažnější hepatopatie s koagulopatií.
- Důležitá je compliance k pravidelnému užívání, zejména při dávkování 2× denně (večerní dávka častěji zapomínána – apixaban), nicméně apixaban má současně data o nejvyšší bezpečnosti.
Pro případné užití warfarinu platí:
- Lze zvážit, je-li onkologické onemocnění stabilní, či v remisi.
- Volba v případě pokročilé renální insuficience a při extrémních odchylkách hmotnosti.
- Nepoužívat v případě projevů gastrointestinální toxicity protinádorové léčby, kachexie, jaterního selhávání.
- Zásadní význam má compliance pacienta a pravidelná monitorace účinnosti léčby.
Indikace filtru dolní duté žíly:
- Účelem zavedení kaválního filtru je zachytit uvolněné emboly a chránit tak pacienta před život ohrožující PE.
- Absolutní indikací kaválního filtru je vysoké krvácivé riziko znemožňující podání antikoagulační léčby při akutní PE a/nebo akutní proximální DVT (tj. postihující popliteální, femorální či zejména pánevní žíly) nebo selhání antikoagulační léčby (tj. recidivující PE i přes adekvátní antikoagulační léčbu).
- Preferovány jsou filtry „dočasné“/odstranitelné (tj. s možností následné volby odstranění filtru do určitého časového limitu, eventuelně jej lze i ponechat).
Selhání antikoagulační léčby – recidiva CAT
- V situaci léčby LMWH intermediální dávkou zvyšujeme na terapeutickou.
- Při léčbě terapeutickou dávkou LMWH kontrolujeme intenzitu další léčby pomocí vyšetření hodnoty antiXa, ev. lze dávku LMWH zvýšit na 120–130 % terapeutické dávky (případně zkusit převod na DOAC).
- Při léčbě DOAC (ev. warfarinem) převádíme na LMWH.
- Inzerce kaválního filtru při život ohrožující high risk PE a ileofemorální trombóze, nebo dokonce v přítomnosti trombu v dolní duté žíle.
- Složité situace recidivy CAT při antikoagulační léčbě je vhodné řešit v rámci multidisciplinárního týmu.
Speciální situace
Větší pozornost by měla být věnována vybraným populacím, z nichž některé jsou ohroženy nedostatečnou bezpečností nebo účinností antikoagulace.
U pacientů se zhoubným nádorem a trombózou viscerální/splanchnické žíly je doporučena léčba krátkodobou antikoagulací nebo sledování.
U pacientů s CAT související s centrálním venózním katetrem (CVC), kteří dostávají antikoagulační léčbu, se upřednostňuje ponechat CVC před jeho odstraněním.
U pacientů s CAT a trombocytopenií je doporučena plná antikoagulační léčba nad 50×109/l, pod 50×109/l je nutná redukce dávky.
U renálního selhávání se upravují dávky LMWH podle hladiny anti-Xa. V případě renální insuficience spojené s trombózou dávku LMWH u pacientů s C krea > 30 není třeba upravovat; s C krea = 15–30 se doporučuje upravit dávku, a pokud je C krea < 15, pak pozastavit léčbu,.
U obezity se preferuje LMWH před DOAC, a to i ve vyšších dávkách.
V těhotenství se doporučuje terapie LMWH.
Farmakologické vlastnosti a dávkování nízkomolekulárních heparinů, fondaparinuxu a přímých orálních antikoagulancií v tab. 6–8.
Tab. 6. Základní údaje o nízkomolekulárních heparinech a fondaparinuxu. 
Tab. 7. Dávkování nízkomolekulárních heparinů a fondaparinuxu v léčbě CAT. 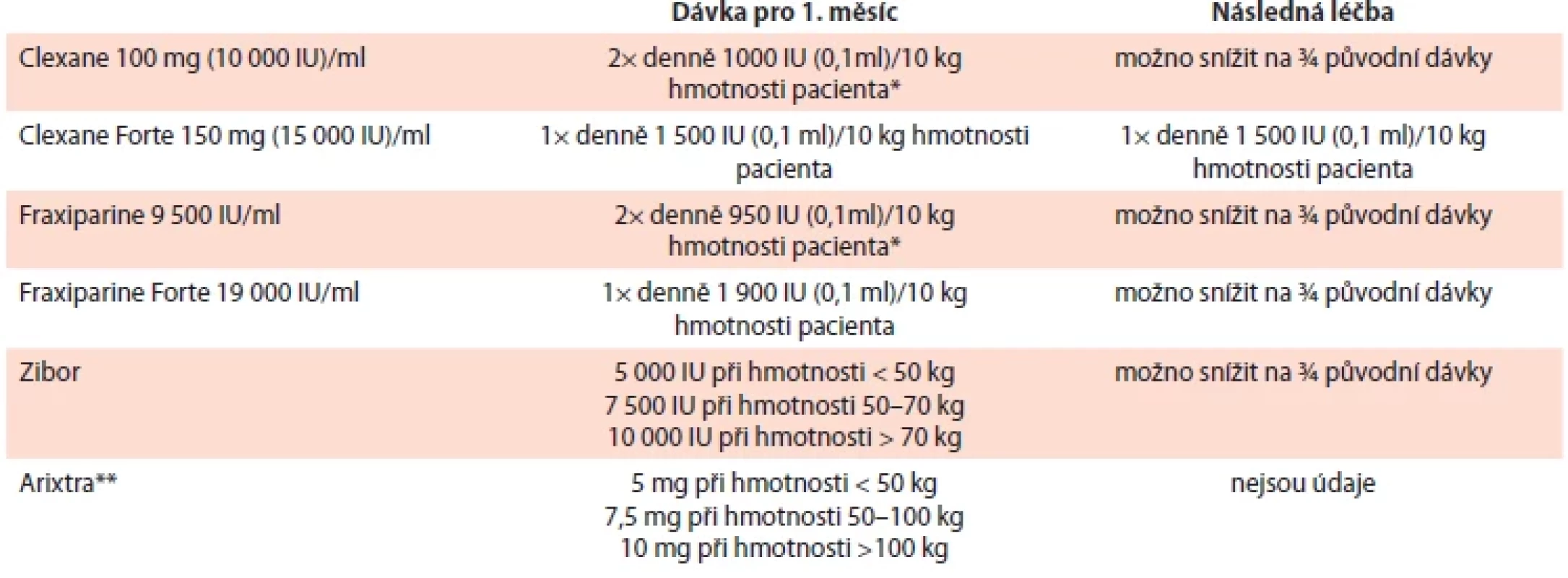
*iniciálně vhodnější dávkování 2× denně; **t.č. nedostupná v ČR, resp. dostupná jen 2,5 mg CAT – trombóza spojená s malignitou; IU – jednotka Tab. 8. Přehled přímých orálních antikoagulancií k léčbě CAT (A) a jejich dávkování (B). 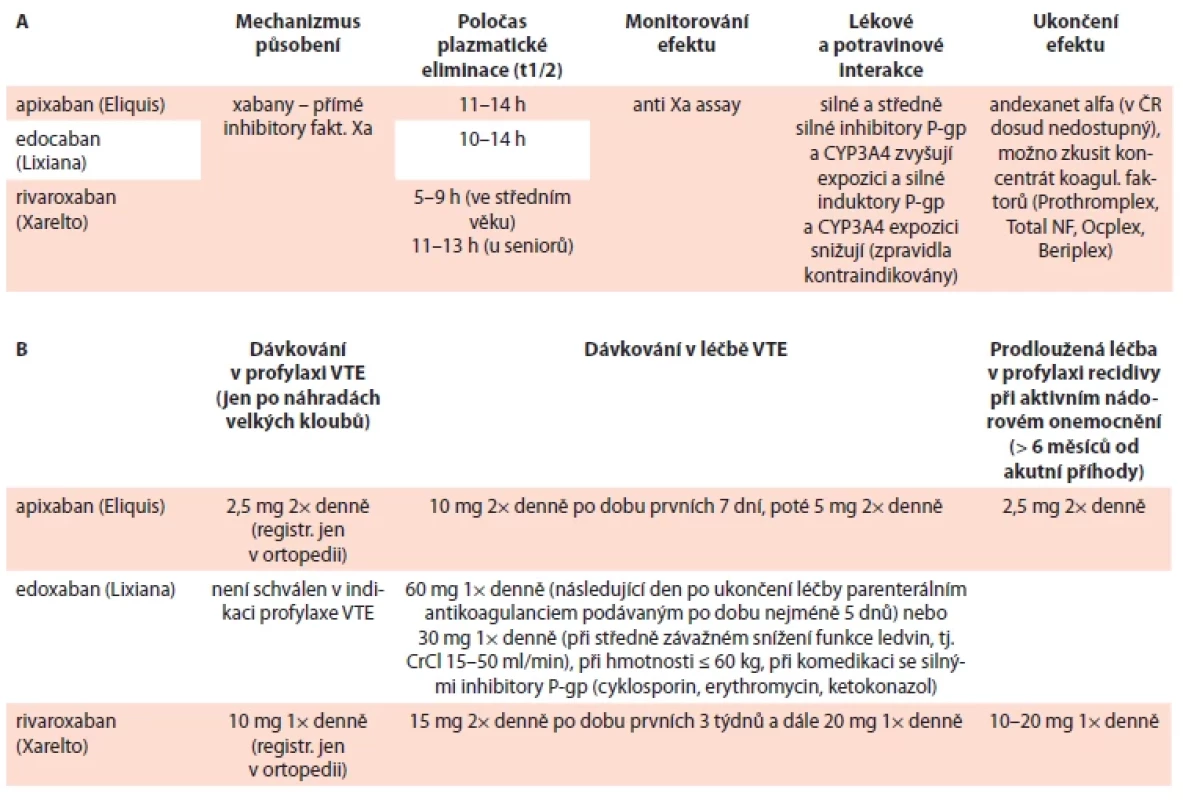
VTE – venózní tromboembolie Do redakce doručeno dne: 27. 11. 2022.
prof. MUDr. Petra Tesařová, CSc.
Onkologická klinika 1. LF UK a VFN
U nemocnice 2
128 08 Praha 2
e-mail: petra.tesarova@vfn.cz
Transfuze Hematol Dnes 2023; 29(1): 61 – 67
Zdroje
1. Xu X, Chlebowski RT, Shi J, Barac A, Haque R. Aromatase inhibitor and tamoxifen use and the risk of venous thromboembolism in breast cancer survivors. Breast Cancer Res Treat. 2019; 174 (3): 785–794.
2. Guo Z, Huang Y, Gong L, et al. Association of androgen deprivation therapy with thromboembolic events in patients with prostate cancer: a systematic review and meta-analysis. Prostate Cancer Prostatic Dis. 2018; 21 (4): 451–460.
3. Li LJ, Chen DF, Wu GF, et al. Incidence and risk of thromboembolism associated with bevacizumab in patients with non-small cell lung carcinoma. J Thorac Dis. 2018; 10 (8): 5010.
4. Khorana AA, Dalal M, Lin J, Connolly GC. Incidence and predictors of venous thromboembolism (VTE) among ambulatory high‐risk cancer patients undergoing chemotherapy in the United States. Cancer. 2013; 119 (3): 648–655.
5. Zhu VW, Zhao JJ, Gao Y, et al. Thromboembolism in ALK+ and ROS1+ NSCLC patients: A systematic review and meta-analysis. Lung Cancer. 2021; 157 : 147–155.
6. Ratib S, Walker AJ, Card TR, Grainge MJ. Risk of venous thromboembolism in hospitalised cancer patients in England – a cohort study. J Hematol Oncol. 2016; 9 (1): 1–9.
7. Masoud V, Pagès G. Targeted therapies in breast cancer: New challenges to fight against resistance. World J Clin Oncol. 2017; 8 (2): 120.
8. Guo Z, Huang Y, Gong L, et al. Association of androgen deprivation therapy with thromboembolic events in patients with prostate cancer: a systematic review and meta-analysis. Prostate Cancer Prostatic Dis. 2018; 21 (4): 451–460.
9. Semrad TJ, O‘Donnell R, Wun T, et al. Epidemiology of venous thromboembolism in 9489 patients with malignant glioma. J Neurosurg. 2007; 106 (4): 601–608.
10. Porfidia A, Giordano M, Sturiale CL, et al. Risk of intracranial bleeding in patients with primary brain cancer receiving therapeutic anticoagulation for venous thromboembolism: A meta‐analysis. Brain Behav. 2020; 10 (6): e01 638.
11. Peterson EA, Lee AYY. Update from the clinic: what‘s new in the diagnosis of cancer-associated thrombosis? Hematology Am Soc Hematol Educ Program. 2019; 2019 (1): 167–174.
12. Key NS, Khorana AA, Kuderer NM, et al. Venous thromboembolism prophylaxis and treatment in patients with cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2020; 38 (5): 496–520.
13. Lyman GH, Carrier M, Ay C, et al. American Society of Hematology 2021 guidelines for management of venous thromboembolism: prevention and treatment in patients with cancer. Blood Adv. 2021; 5 (4): 927–974.
14. Stevens SM, Woller SC, Kreuziger LB, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. Chest. 2021; 160 (6): e545–e608.
15. Farge D, Frere C, Connors JM, et al. 2022 international clinical practice guidelines for the treatment and prophylaxis of venous thromboembolism in patients with cancer, including patients with COVID-19. Lancet Oncol. 2022; 23 (7): e334–e347.
16. Khorana AA, DeSancho MT, Liebman H, Rosovsky R, Connors JM, Zwicker J. Prediction and prevention of cancer-associated thromboembolism. Oncologist. 2021; 26 (1): e2–e7.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2023 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Blastický zvrat chronické myeloidní leukemie
- Cévní nežádoucí účinky u pacientů s chronickou myeloidní leukemií při terapii inhibitory tyrozinkináz v každodenní klinické praxi – analýza z databáze INFINITY
- Editorial
- Nezvyklý a nepriaznivý priebeh chronickej myelocytovej leukémie – kazuistika a prehľad literatúry
- Doporučený postup stratifikace rizika trombózy a cílené tromboprofylaxe u žen podstupujících asistovanou reprodukci
- Prevence, diagnostika a léčba trombózy spojené se zhoubným nádorem
- Doporučení České hematologické společnosti pro diagnostiku a léčbu imunitní trombocytopenie dospělých
- Sympozium a workshop – aktuální výzvy a uplatnění nových technologií v léčbě chronické myeloidní leukemie
- Fixní délka léčby CLL – realita, nebo fikce?
- Jubileum primářky Lenky Walterové
- Povrchové markery leukemických kmenových buněk u chronické myeloidní leukemie
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Doporučení České hematologické společnosti pro diagnostiku a léčbu imunitní trombocytopenie dospělých
- Doporučený postup stratifikace rizika trombózy a cílené tromboprofylaxe u žen podstupujících asistovanou reprodukci
- Blastický zvrat chronické myeloidní leukemie
- Nezvyklý a nepriaznivý priebeh chronickej myelocytovej leukémie – kazuistika a prehľad literatúry
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



