-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Blastický zvrat chronické myeloidní leukemie
Blast phase of chronic myeloid leukaemia
Chronic myeloid leukaemia represents a model disease where the identification of driving molecular mechanisms and their targeted therapy has led to dramatic improvement in treatment outcomes. Nevertheless, a small proportion of patients still experience therapy failure followed by disease progression into a blast phase with poor outcomes even on intensive therapy. This review focuses on the current state of knowledge regarding the pathobiology of the blast phase and its fundamental characteristics, including blockade of cell differentiation, genetic instability, the occurrence of chromosomal aberrations and somatic mutations, and their impact on disease prognosis. The article also provides a brief overview of the current treatment options for the blast phase, its challenges, and possible perspectives.
Keywords:
chronic myeloid leukaemia – Chromosomal aberrations – somatic mutations – blast phase – blasts – blockade of differentiation
Autoři: N. Čuřík 1,2; A. Láznička 1,3
Působiště autorů: Ústav hematologie a krevní transfuze, Oddělení molekulární genetiky, Praha 1; Ústav patologické fyziologie, 1. LF UK, Praha 2; 2. LF UK, Praha 3
Vyšlo v časopise: Transfuze Hematol. dnes,29, 2023, No. 1, p. 16-26.
Kategorie: Souhrnné/edukační práce
doi: https://doi.org/10.48095/cctahd202316Souhrn
Chronická myeloidní leukemie představuje modelové onemocnění, kde identifikace molekulárních mechanizmů zodpovědných za její rozvoj a jejich terapeutické zacílení vedly k dramatickému zlepšení výsledků léčby. Přesto u malé části pacientů stále dochází při selhání léčby k progresi onemocnění do fáze blastického zvratu, vykazující neuspokojivé výsledky i při intenzivní terapii. Následující přehledový článek se zabývá současným stavem poznání molekulární podstaty blastického zvratu a jeho hlavními charakteristikami vč. blokády buněčné diferenciace, zvýšené genové nestability, výskytem chromozomálních aberací, somatických mutací a jejich vlivem na prognózu onemocnění. Přináší rovněž stručný náhled na současné možnosti řízení léčby blastického zvratu, jejich úskalí a možné perspektivy.
Klíčová slova:
chronická myeloidní leukemie – somatické mutace – chromozomální aberace – blastický zvrat – blasty – blokáda diferenciace
ÚVOD – KLINICKÁ A BIOLOGICKÁ CHARAKTERISTIKA BLASTICKÉHO ZVRATU
Chronická myeloidní leukemie (CML) tvoří 20–30 % leukemií v dospělém věku. Jejím patogenetickým podkladem je přítomnost fúzního onkogenu BCR:: ABL1. Incidence CML se pohybuje mezi 1 a 2 případy na 100 000 obyvatel s mediánem věku v diagnóze kolem 65 let. CML je u většiny pacientů diagnostikována v relativně indolentní chronické fázi, avšak může být zachycena nebo progredovat do fáze akcelerované a/nebo do blastického zvratu. V registru studie EUTOS s 2 904 pacienty s CML bylo 2 638 pacientů diagnostikováno v chronické fázi (90,8 %), 125 v akcelerované (4,3 %) a 63 v blastickém zvratu (2,2 %) a u 78 pacientů nebylo možné fázi choroby určit (2,7 %) [1]. V české studii s 699 pacienty s CML bylo v chronické fázi diagnostikováno 609 (92,1 %), v akcelerované 35 (5,5 %) a v blastickém zvratu 16 (2,4 %) pacientů [2].
Diagnostická kritéria blastického zvratu nejsou jednotná: definice Evropské leukemické sítě (European LeukemiaNet – ELN) a Mezinárodního transplantačního registru kostní dřeně (International Bone Marrow Transplantation – IBMTR) zahrnují přítomnost ≥ 30 % blastů v periferní krvi nebo kostní dřeni a extramedulární postižení s výjimkou sleziny. Definice blastického zvratu z aktuálního, pátého vydání klasifikace Světové zdravotnické organizace (World Health Organization – WHO) zahrnuje přítomnost ≥ 20 % myeloidních blastů v periferní krvi či kostní dřeni, nebo přítomnost extramedulární proliferace blastů, nebo zvýšené množství lymfoblastů v periferní krvi či kostní dřeni [3,4]. Nutno zmínit, že výrazná většina prací využívá kritéria ELN. Přesto je zejména u starších prací znalost použitých kritérií nezbytná ke správné interpretaci výsledků. Blastický zvrat může mít myeloidní, lymfoidní nebo – vzácně – smíšený buněčný fenotyp, přičemž myeloidní blastický zvrat je zhruba dvakrát až třikrát častější než lymfoidní blastický zvrat [5]. Blastický zvrat představuje agresivní terminální fázi CML. S nástupem inhibitorů tyrozinových kináz (TKI) cílících na BCR:: ABL1 kinázu došlo k výraznému snížení progrese onemocnění. Incidence blastického zvratu je při léčbě TKI mezi 0,7 a 4,5 % z nově diagnostikovaných pacientů s CML, při ročním riziku progrese 0,3–2,2 % [6,7]. Zavedení TKI 2. generace v první linii léčby CML vedlo k dalšímu snížení výskytu progrese do blastického zvratu [3]. Pokud však dojde k progresi do blastického zvratu, jsou výsledky další léčby samotným TKI při mediánu přežití pacientů necelý 1 rok velmi neuspokojivé [3,6].
Pro blastickou fázi je charakteristická expanze nezralých krevních buněk, blastů, které infiltrují kostní dřeň a vedou k jejímu selhání. Progenitorové leukemické buňky nabývají sebeobnovovacího potenciálu a zároveň u nich dochází k zablokování buněčné diferenciace. To se odehrává v kontextu rozsáhlého aberantního přeprogramování epigenetických struktur buněčné DNA a genové transkripce leukemických buněk během progrese do blastického zvratu. Jiným charakteristickým rysem blastického zvratu je rostoucí genetická nestabilita leukemických buněk, která se projevuje přítomností dalších chromozomálních aberací a akvizicí somatických mutací v kinázové doméně BCR:: ABL1 i v dalších genech u většiny pacientů [8]. Ačkoli s rostoucí genetickou nestabilitou dochází k postupnému pasivnímu hromadění různých genetických aberací, přinejmenším v případě některých rekurentních mutací a chromozomálních aberací se vysoce pravděpodobně jedná o leukemogenické řídicí mechanizmy, „druhé zásahy“ (jako 1. zásah se u CML chápe fúze BCR:: ABL1) měnící povahu onemocnění, a to obecně směrem ke snížené závislosti leukemických buněk na aktivitě BCR:: ABL1 a s tím spojené rezistenci na léčbu TKI. Přes řadu dílčích poznatků nejsou molekulární mechanizmy progrese CML do blastického zvratu a následného udržení tohoto vysoce agresivního fenotypu dosud plně objasněny. Důvodem bylo mimo jiné donedávna přetrvávající nedostatečné pochopení klonální hierarchie a evoluce CML.
LEUKEMICKÁ KMENOVÁ BUŇKA A IMUNOFENOTYP BLASTICKÉHO ZVRATU
CML v chronické fázi je charakterizována a zároveň i řízena expresí a deregulovanou aktivitou kinázy BCR:: ABL1. Přítomnost BCR:: ABL1 je nezbytná a zároveň dostačující pro vyvolání myeloproliferativního onemocnění se zvýšeným buněčným dělením a/nebo přežíváním myeloidních progenitorů bez výraznějšího postižení jejich konečné diferenciace. Tento fenotyp chronické fáze CML je podmíněn schopností BCR:: ABL1 proteinu mnohočetně interagovat a svoji kinázovou aktivitou deregulovat komplexní systém buněčných signalizačních drah, zejména dráhy STAT5, RAS/MEK/ERK nebo PI3K/AKT/ – mTOR -FOXO3, které jsou nezbytné pro iniciaci a udržení výše uvedeného fenotypu [9,10]. Leukemické kmenové buňky chronické fáze CML se vedle toho vyznačují aktivací dalších signalizačních drah (např. JAK2/SET/PP2A/GSK3b) závislých na expresi, ale nikoli už na kinázové aktivitě BCR:: ABL1 [11], umožňujících přežívání těchto kmenových buněk při jejich minimální proliferaci, rezistenci vůči TKI a aktivované prozánětlivé odpovědi [12,13]. Proteomickou a transkriptomickou analýzou leukemických kmenových buněk chronické fáze byla identifikována klíčová role proteinů TP53 a MYC jako regulačních center zodpovědných za přežívání a nediferencovaný stav leukemických kmenových buněk CML, které jsou nezávislé na kinázové aktivitě BCR:: ABL1 [14].
Na rozdíl od CML v chronické fázi, která vychází z leukemické transformace výhradně na úrovni hematopoetické kmenové buňky [15], případně podle některých autorů dokonce již na úrovni hemangioblastu [16], se blastický zvrat CML vyznačuje rozvolněným konceptem „kmenové“, resp. iniciační leukemické buňky. Pro blastický zvrat je typické, že různé typy krvetvorných progenitorových buněk získávají sebeobnovovací potenciál a jsou schopné opakovaně propagovat leukemii transplantací v imunodeficientních myších in vivo. Jako první kandidátní kmenová buňka blastického zvratu byla identifikována subpopulace CD34+CD38+Lin - granulocytárně-makrofágových progenitorů (GMP), která se vyznačovala vysokou hladinou BCR:: ABL1 a zvýšenou aktivací WNT/CTNNB1 (b-cateninové) dráhy [17]. Na základě single-cell RNA sekvenační analýzy bylo následně zjištěno, že kmenové buňky blastického zvratu CML se mohou vyskytovat také v subpopulacích fenotypicky charakterizovaných jako hematopoetické kmenové buňky (CD34+CD38-CD90+CD45A-Lin-) nebo lymfoidně-primované multipotentní progenitory (LMPP; CD34+CD38-CD90-CD45A+Lin-). Single cell RNA sekvenační analýza přitom od sebe neodlišila kmenové buňky lymfoidního a myeloidního blastického zvratu [12]. Také následná práce zaměřená konkrétně na myeloidní blastický zvrat potvrdila expanzi a sebeobnovovací potenciál GMP a LMPP frakce a zároveň prokázala, že rysy kmenových buněk získávají v myeloidním blastickém zvratu také další progenitorové subpopulace [18]. Metodou průtokové cytometrie byla již v době diagnózy CML v chronické fázi odhalena přítomnost populace buněk nesoucích povrchové znaky lymfoblastů, která predikovala pozdější progresi onemocnění do lymfoidního blastického zvratu [19]. Přítomnost kmenových buněk s potenciálem rozvoje blastického zvratu v době diagnózy byla potvrzena rovněž pomocí single-cell RNA sekvenování [13].
Imunofenotyp blastických buněk v zásadě odpovídá imunofenotypům B-buněčných (exprese znaků CD10, CD19, CD79a, ve výrazně menší míře CD20), resp. myeloidních progenitorů (exprese CD13, CD33, CD117 a myeloperoxidázy) s občasnou aberantní expresí povrchových znaků mimo dominantní fenotyp [20,21]. Leukemické kmenové buňky blastického zvratu pak stejně jako leukemické kmenové buňky chronické fáze CML nesou vedle obvyklých povrchových znaků krvetvorných kmenových buněk také specifické molekuly CD25, CD26 a IL1-RAP [22]. S progresí CML se v neposlední řadě postupně zvyšuje exprese imunosupresivní molekuly PD-1 na povrchu cytotoxických CD8 T-lymfocytů, což poukazuje na neopomenutelnou roli imunitního úniku a nádorového mikroprostředí v patogenezi blastického zvratu [23].
„DRUHÝ ZÁSAH“: AKTIVACE CTNNB1 (β-CATENINOVÉ) DRÁHY
Heterogenní původ kmenových buněk blastického zvratu CML klade otázku, jaký molekulární mechanizmus, „druhý zásah“, sehrává rozhodující úlohu v progresi onemocnění. V koncepci přechodu CML z chronické fáze do blastického zvratu byl dlouhou dobu kladen důraz na zvýšenou expresi BCR:: ABL1 proteinu, která byla detekována jak v leukocytech izolovaných z blastického zvratu [24], tak přímo v kmenových buňkách blastického zvratu (s GMP fenotypem) [17]. Transdukce samotného BCR:: ABL1 do granulocytárně-myeloidních a společných myeloidních progenitorů však není schopna navodit v těchto buňkách sebeobnovovací kapacitu a transformovat je do kmenových buněk blastického zvratu [25]. Některé signalizační dráhy BCR:: ABL1 mající zásadní roli v chronické fázi onemocnění jsou rovněž v blastickém zvratu buď expresně utlumeny, jako v případě RAS/MAPK dráhy [26], nebo – v případě STAT5 – jejich genomická inhibice nebrání progresi myeloproliferativního onemocnění do lymfoidního blastického zvratu [27]. V neposlední řadě pak obecně nízká citlivost buněk blastického zvratu k léčbě TKI pozorovaná v klinické praxi nasvědčuje závislost blastů na jiných řídicích mechanizmech.
Z tohoto důvodu se nyní pozornost upíná na další kandidátní mechanizmy transformace do blastického zvratu, mezi nimiž zaujímá přední místo WNT/CTNNB1 (b-catenin) signalizační dráha. Její role byla již popsána v leukemických kmenových buňkách chronické fáze CML, kde poskytovala těmto buňkám rezistenci před působením TKI [12,28]. Aktivace exprese CTNNB1 v těchto buňkách prostřednictvím JAK2/SET/PP2A/GSK3b signalizační dráhy se jeví být závislá na expresi, ale nikoli na aktivitě BCR:: ABL1, kdy BCR:: ABL1 protein slouží jako lešení pro tvorbu signalizačního komplexu JAK2 [11]. Zvýšená exprese molekul CTNNB1 dráhy byla zjištěna jak celkovou analýzou změn transkriptomu při progresi CML [26], tak přímo v kmenových buňkách blastického zvratu [17], u kterých bylo single-cell RNA sekvenační analýzou prokázáno signifikantní utlumení exprese negativního regulátoru CTNNB1 dráhy [13]. Prostřednictvím samotného CTNNB1 a jeho cílových genů dochází k epigenetickému utlumení exprese genů, které se podílejí na destabilizaci a degradaci CTNNB1, čímž je pozitivní zpětnou vazbou dále podporována deregulace této dráhy [29].
Aktivací CTNNB1 dráhy v blastickém zvratu dojde v kooperaci s jeho „spolupracujícími“ transkripčními faktory LEF1 a TCF4 k zapnutí expresního programu podporujícího sebeobnovu, proliferaci a potlačení buněčné diferenciace (Cyklin D, MYC). Při mutacích nebo snížené expresi TP53 aktivují CTNNB1/LEF1 expresi transkripčního faktoru EVI1, který patří mezi geny zásadní pro rozvoj blastického zvratu [30, 31]. Jednou z klíčových rolí EVI1 je udržování kmenového sebeobnovovacího fenotypu a blokáda myeloidní diferenciace inhibičními interakcemi s dalšími transkripčními faktory [32]. Vedle toho EVI1 vyřazuje z činnosti negativní regulátor CTNNB1 dráhy a přispívá tak k její deregulaci mechanizmem pozitivní zpětné vazby [33]. Transkripční faktor TCF4, jehož exprese na úrovni mRNA pozitivně koreluje s počtem blastů cirkulujících v periferní krvi pacientů v blastickém zvratu, pak kooperuje s transkripčním faktorem MYC při aktivaci genů transkripčních faktorů a epigenetických regulátorů zapojených do funkce kmenových buněk, embryonálního vývoje, ale i agresivních nediferencovaných nádorů. Pozitivní zpětnou vazbou zároveň opět dochází k nárůstu exprese CTNNB1 a MYC [34].
Výše zmíněný „dvouzásahový“ model progrese CML do blastického zvratu je ilustrován přiloženým schématem (obr. 1).
Obr. 1. Buněčně-molekulární model patogeneze chronické fáze a blastického zvratu CML. Jedná se o zjednodušené schéma zaměřené primárně na roli „zásahů“ – BCR::ABL1 onkoproteinu a deregulace exprese CTNNB1. Schéma tak nezahrnuje roli dalších genetických, epigenetických nebo chromozomálních aberací, které se podílí na rozvoji onemocnění. 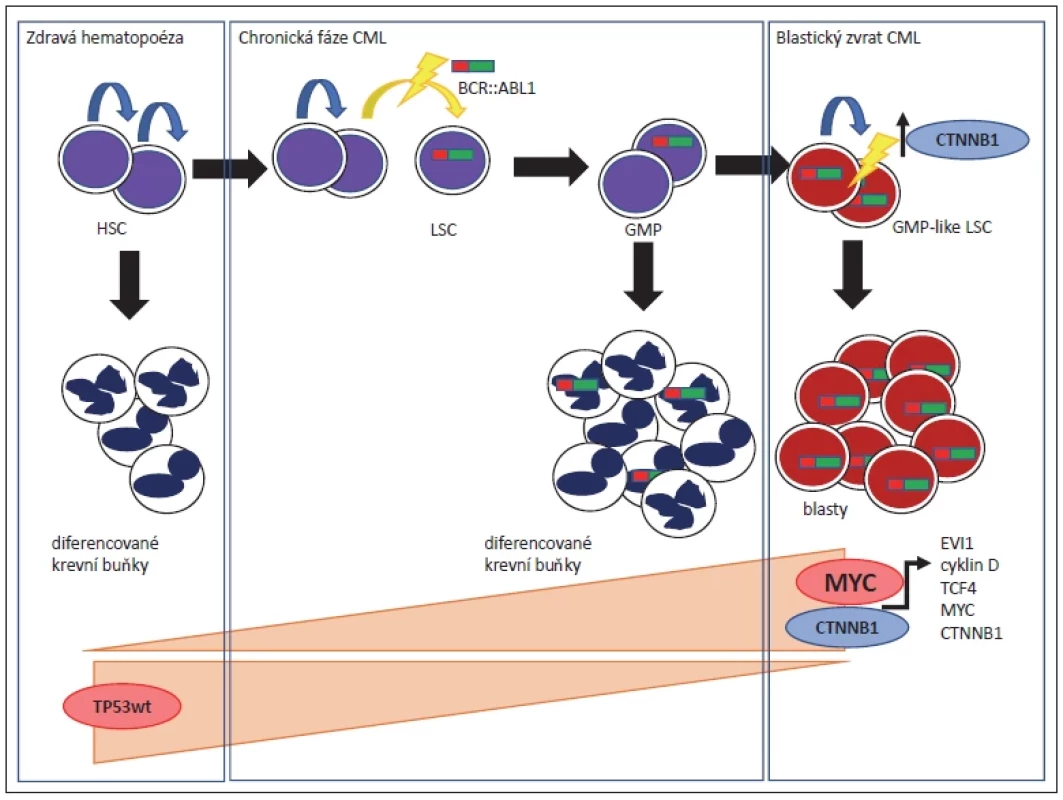
HSC – hematopoetická kmenová buňka; GMP – granulocytárně-makrofágový progenitor; LSC – leukemická kmenová buňky TRANSKRIPČNÍ A EPIGENETICKÉ PŘEPROGRAMOVÁNÍ CML BUNĚK PŘI PŘECHODU DO BLASTICKÉHO ZVRATU
Pro pochopení podstaty blastického zvratu CML je třeba brát v potaz, že se výše uvedená aktivace CTNNB1 dráhy a její důsledky v navození sebeobnovovacího potenciálu, blokádě buněčné diferenciace a rozvoji rezistence k TKI neodehrávají jako izolovaná událost, ale probíhají v kontextu globálních změn genové regulace a transkripce leukemické buňky. Přelomový význam v objasnění povahy těchto procesů měla studie Radich et al. z roku 2006, která popsala expresní změny asociované s progresí CML [26]. Především identifikovala, že k většině zásadních expresních změn dochází při přechodu z chronické do akcelerované fáze, zatímco mezi akcelerovanou fází a blastickým zvratem byly nalezeny spíše kvantitativní rozdíly, což by nasvědčovalo objektivně dvoufázovému průběhu CML. To je v určité diskrepanci s dosud používaným klinickým dělením CML na tři fáze, i když smysl vyčlenění akcelerované fáze byl novými klinickými studiemi zpochybněn a v novém vydání WHO klasifikace se již neobjevuje [4,35]. Během progrese do blastického zvratu byla identifikována deregulace 16 genů CTNNB1 dráhy a genu negativního regulátoru cytokinové signální transdukce SOCS2 a snížená exprese genů pro strukturální integritu a adhezi buněk. Důležitým zjištěním bylo, že většina pacientů v chronické fázi se špatnou odpovědí na léčbu TKI vykazovala podobný transkripční profil jako pacienti s pokročilými fázemi CML, a nikoli jako pacienti v chronické fázi s dobrou odpovědí na léčbu [26]. Rezistenci na TKI v chronické fázi lze tedy chápat jako biologicky pokročilou nemoc.
Změny na úrovni transkriptomu nejsou jediné, které doprovází progresi CML. Při přechodu z chronické fáze CML do pokročilých fází onemocnění dochází také k výraznému nárůstu metylace DNA v regulačních úsecích řady genů, která často bývá spojena s jejich transkripční represí. K zásadním změnám na úrovni metylace nedochází v časovém průběhu evoluce rezistentní nemoci v rámci chronické fáze, ale převážné až při progresi do blastického zvratu. Zvýšená metylace v blastickém zvratu byla asociována se snížením exprese některých genů s funkcí tumor supresorů nebo regulace buněčné proliferace a metabolizmu TKI [36]. Konzistentně s tím prokázala nedávná studie roli proteinů komplexů Polycomb PRC1 a PRC2 v regulaci genové exprese v blastickém zvratu. PRC1 a PRC2 inhibují genovou transkripci pomocí změn histonů organizujících architekturu DNA, a to obvykle v koordinaci s výše zmíněnou metylací samotné DNA. Ukázalo se, že PRC2 svojí vazbou specifikuje geny pro jejich následné metylační umlčení v blastickém zvratu, zatímco komplex PRC1 sehrává větší roli v udržení „kostry“ blastického transkriptomu, zejména pokud jde o blokádu buněčné diferenciace a přežívání leukemických buněk [37].
GENOMICKÁ NESTABILITA
Aktivita BCR:: ABL1 kinázy vystavuje leukemické buňky zvýšené genetické nestabilitě a náchylnosti ke vzniku poškození DNA v důsledku genomického a oxidačního stresu [38]. BCR:: ABL1 cestou signalizace přes dráhy STAT5 a PI3K/AKT zvyšuje v leukemických buňkách CML, a zejména v buňkách blastického zvratu, hladinu reaktivních forem kyslíku (ROS), které mají mutační účinek na DNA. Byla předpokládána jejich souvislost se vznikem mutací v kinázové doméně BCR:: ABL1 [39,40]. Vztah ROS k mutagenezi BCR:: ABL1 byl nicméně dalšími autory zpochybněn [41]. Chronická fáze CML totiž vykazuje specifický, odlišný mutační profil než CML v blastickém zvratu [42]. Ani v identifikaci konkrétních opravných drah poškození DNA, které jsou deregulovány BCR:: ABL1 způsobem vedoucím k vzniku mutací a chromozomálních aberací, nepanuje shoda. Vznik mutací byl asociován s nefunkčností opravné dráhy chybného párování DNA a interferencemi s jinak přesnými opravami dvouřetězcových zlomů DNA pomocí homologní rekombinace [43,44]. Řada prací rovněž uvádí, že BCR:: ABL1 inhibuje činnost kanonické dráhy nehomologního spojování konců, a naopak podporuje opravu poškození DNA alternativním nehomologním spojováním konců, které kvůli své nepřesnosti generuje rozsáhlé delece a chromozomální translokace [45], i když v posouzení role těchto drah v CML nepanuje konsenzus [46].
Vedle BCR:: ABL1 přispívá ke genetické nestabilitě CML také již několikrát zmíněný transkripční faktor MYC. MYC aktivuje expresi genů účastnících se alternativního nehomologního spojování konců [47]. Aktivace této chybující dráhy pomocí MYC je spojena také s aberantní aktivací chybující varianty dráhy vystřihování báze (BER) [48]. Důsledky genetické nestability BCR:: ABL1 pozitivních buněk CML jsou podrobněji probrány v následujících oddílech.
PŘÍDATNÉ CYTOGENETICKÉ ABERACE
Genetická nestabilita se projevuje jak akvizicí bodových mutací, tak vznikem rozsáhlejších numerických i strukturálních chromozomálních aberací. Cytogenetické analýzy odhalují zhruba u 5 % případů v chronické fázi a až u 75 % pacientů s blastickým zvratem vedle přítomnosti chromozomu Philadelphia také přítomnost dalších, přídatných chromozomálních aberací (ACA). Ty se ve většině případů vyskytují ve formě komplexních přestaveb a u menší části pacientů pak jako jednotlivé aberace [49]. Podle frekvence výskytu jsou tradičně rozeznávány přídatné chromozomální aberace, tzv. hlavní trasy (major route) s vyšší frekvencí výskytu (postupně stanovenou nad 10 % pacientů s CML v blastickém zvratu). Tam bývají řazeny trizomie chromozomu 8, přídatný Ph chromozom, izochromozom i17q a trizomie chromozomu 19 i přídatné chromozomální aberace tzv. minoritní trasy (minor route) s frekvencí výskytu pod 10 %, kam se také řadí např. ztráta chromozomu Y, ztráta chromozomu 7, trizomie chromozomu 21, různé přestavby spojené s úsekem 3q26.2, trizomie chromozomu 17 a další, méně obvyklé typy přestaveb [50,51]. Nedávná studie poukázala na to, že v éře využití TKI došlo k změnám v zastoupení jednotlivých detekovaných ACA, se zvýšenou zaznamenanou frekvencí výskytu 3q26.2 přestaveb a ztráty chromozomu 7 a sníženou frekvencí výskytu trizomie chromozomu 19, a rovněž ukázala selektivní preferenci určitých chromozomálních aberací pro rozvoj myeloidního (+8, i17q, +19, 3q26.2 přestavby) nebo lymfoidního (-7) blastického zvratu [49].
Několik dřívějších studií poukázalo na obecně horší prognózu pacientů s ACA hlavní trasy ve srovnání s pacienty bez ACA nebo pacienty s ACA minoritní trasy. Tyto závěry potvrzuje i analýza na pacientech s CML z databáze INFINITY v ČR [52]. Přítomnost ACA hlavní trasy v době diagnózy v Ph+ klonu byla v Doporučeních ELN z roku 2013 brána jako varovný znak a jejich vývoj během léčby za symptom akcelerované fáze CML [53]. Následně se však ukázalo, že negativní dopad na prognózu onemocnění má pravděpodobně i řada ACA minoritní trasy (+17, +21, 3q26.2, 11q23 a -7/7q), s tím, že detekce přítomnosti rizikových ACA v diagnóze i v průběhu léčby předznamenává progresi a fatální průběh onemocnění ještě v době nízkého počtu blastů [54]. V nových doporučeních ELN z roku 2020 jsou proto pacienti s ACA hlavní trasy a rizikovými aberacemi minoritní trasy v Ph+ klonu a komplexními přestavbami považováni za pacienty ve vysokém riziku [55]. Nedávné studie dále naznačují, že přítomnost ACA v Ph negativních (neleukemických) klonech má negativní prognostický význam [56]. Ve výčtu všech jednotlivých ACA spojených s vysokým rizikem v současnosti nepanuje úplná shoda, za prognosticky zvláště nepříznivé ACA jsou nicméně vedle komplexních chromozomálních abnormalit považovány 3q26.2 přestavby, -7/7q a i (17q) [54,57,58]. Tyto aberace přitom úzce souvisí s molekulárními faktory řídícími progresi CML do blastického zvratu uvedenými v předchozích oddílech. V oblasti 3q26.2 je lokalizován gen pro transkripční regulátor EVI1, v 7q oblasti je lokalizován gen pro klíčový enzym PRC2 komplexu EZH2, v oblasti 17q jsou zase lokalizovány mnohé geny komplexu PRC1, zatímco v oblasti 17p, která je ztracena při vzniku i (17q), se nalézá gen TP53. V případě trizomie chromozomu 8 se rovněž nabízí spojitost této početní chromozomální aberace se zvýšenou expresí genu MYC, který leží na tomto chromozomu. Pacienti s izolovanou trizomií chromozomu 8 mají nicméně lepší prognózu při léčbě s TKI ve srovnání s ostatními jednotlivými rizikovými ACA, byť stále horší než pacienti s ACA nízkého rizika [54].
ROLE SOMATICKÝCH MUTACÍ V GENECH ASOCIOVANÝCH S MALIGNITAMI
Vedle vzniku chromozomálních aberací se genomická nestabilita provázející blastický zvrat projevuje i v akumulaci bodových somatických mutací a mikrodelecí, z nichž některé jsou jasně asociovány s rezistencí na TKI a/nebo špatnou prognózou, zatímco prognostický význam řady dalších je dosud nejasný [59].
Dlouhou dobu převažující pohled na CML, a zejména pak na chronickou fázi CML, jako na geneticky uniformní onemocnění s jedinou řídicí lézí BCR:: ABL1 vedl k poněkud jednostrannému výzkumnému i klinickému důrazu na mutace v kinázové doméně BCR:: ABL1 spojené s rezistencí k TKI a k okrajovému zájmu o rekurentní mutace jiných genů a jejich roli v patogenezi onemocnění. S příchodem významné metody sekvenování nové generace ( – next generation sequencing – NGS) se nicméně ukázalo, že somatické mutace v dalších genech se vyskytují v době diagnózy v chronické fázi až u jedné třetiny pacientů [60,61]. Jde zejména o mutace v epigenetických regulátorech TET2, DNMT3A, TP53 a ASXL1, které jsou spojené s fenoménem tzv. klonální hematopoézy nejasného významu (CHIP), resp. s věkem související klonální hematopoézou (ARCH) a v případě ASXL1 a TP53 se špatnou prognózou a transformací do akutní leukemie u řady myeloidních hematologických malignit [62]. Vzorec výskytu těchto mutací u CML nicméně CHIP/ARCH příliš neodpovídá [61]. Jejich vztah k možné transformaci do blastického zvratu není dosud plně objasněn, ačkoli jejich přítomnost byla asociována se špatnou odpovědí na léčbu imatinibem či obecně TKI. V případě mutací TET2 existují indicie, že je spojena se zvýšeným rizikem progrese onemocnění [60,63,64]. Vedle těchto genů se v chronické fázi onemocnění uplatňují větší měrou ještě zmíněné mutace v kinázové doméně BCR:: ABL1 nesoucí rezistenci k TKI, jejichž možná přítomnost v době diagnózy chronické fáze CML nebyla spolehlivě prokázána. Leukemické buňky je preferenčně získávají de novo v průběhu léčby [49,63,65]. V současnosti se má za to, že zvýšená mutační zátěž v době diagnózy je obecně spojena s horší prognózou onemocnění [66].
Výskyt somatických mutací v kinázové doméně BCR:: ABL1 i v dalších genech v blastickém zvratu oproti chronické fázi obecně výrazně stoupá. Již jedna z prvních studií, která sledovala přítomnost somatických mutací v genech asociovaných s hematologickými malignitami, odhalila jejich přítomnost zhruba u 77 % pacientů v blastickém zvratu. Nejvíce zastoupeny byly – vedle mutací kinázové domény BCR:: ABL1 (45 %) – mutace v genech pro-diferenciačních a tumor-supresorových transkripčních faktorů RUNX1 (33 %) a IKZF1 (18 %) a chromatin modifikačního faktoru ASXL1 (20 %) [67]. Následné studie genetické variability využívající cílené sekvenování vybraných genů zapojených do myeloidních malignit, celogenomové sekvenování a/nebo RNA-seq odhalily zhruba 20 rekurentně mutovaných genů pokročilých fází CML, přičemž největší zastoupení měly vcelku konzistentně geny RUNX1, ASXL1, IKZF1, BCOR/BCORL, GATA2 a v některých studiích i TET2 a TP53 [59,61,68,69].
Analýza vztahů mezi dobou nálezu jednotlivých somatických mutací a klinickým průběhem onemocnění založená na cíleném sekvenování vybraných genů prokázala, že převážná část mutací spojených s rezistencí na TKI a/nebo progresí do blastického zvratu nebývá přítomná v době diagnózy, ale je leukemickými buňkami získána v průběhu léčby TKI [63]. Tento závěr byl potvrzen také celoexomovým sekvenováním párových vzorků z chronické fáze CML a blastického zvratu, kdy většina řídicích mutací byla leukemickými buňkami získána až v době progrese onemocnění [69]. Výjimku představují mutace ASXL1, které bývají přítomné již v chronické fázi CML a v době diagnózy, a oproti jiným mutacím je jejich frekvence výskytu v chronické fázi i blastickém zvratu podobná. Pacienti s mutacemi ASXL1 mají tendenci získávat v průběhu onemocnění mutace v dalších genech a výskyt mutací ASXL1 je spojen s negativní prognózou u pacientů v blastickém zvratu [69]. Stojí za zmínku, že ASXL1 interaguje jak s Polycomb komplexem PRC1, tak PRC2. Mutace v ASXL1 přitom narušují tyto interakce, což vede k aberantní derepresi genů podporujících myeloidní transformaci [70,71]. Není proto překvapivé, že frekvence mutací ASXL1 je mnohem vyšší v myeloidním než v lymfoidním blastickém zvratu [69].
Mutace RUNX1 jsou obecně spojeny s blokádou myeloidní diferenciace a jsou typické pro agresivní akutní myeloidní leukemii [72]. V CML jsou rovnoměrně zastoupeny jak v myeloidním, tak lymfoidním blastickém zvratu a podobně jako mutace ASXL1 také mutace RUNX1 obvykle asociují s mutacemi v dalších genech [69,73]. Analýzou jejich role v blastickém zvratu bylo zároveň nalezeno spojení se specifickým mutačním profilem vyvolaným aktivací mutační, resp. rekombinační AID/RAG dráhy, se zvýšenou aberantní expresí znaků typických pro kmenové buňky a B-lymfocyty, expresí transkripčního faktoru TCF4 (spojeného s CTNNB1 signalizační dráhou – viz výše) a prozánětlivými molekulami [73].
BCOR a BCORL jsou epigenetické regulátory a tumor supresorové geny, které se účastní činnosti PRC1 komplexu. Mutace BCOR a BCORL způsobují expanzi myeloidních progenitorů při narušení myeloidní diferenciace a podpoře transkripčního programu typického pro kmenové buňky. Tento efekt může být asociován se ztrátou schopnosti mutovaných proteinů interagovat s dalšími molekulami PRC1 komplexu a následnou aberantní regulací genové exprese [74,75]. BCORL mutace se přitom často vyskytují společně s mutacemi RUNX1 a kooperují i s aktivačními mutacemi v genu KRAS [74]. Také některé další, již delší dobu známé či naopak poměrně nedávno objevené rekurentně mutované geny v myeloidním blastickém zvratu CML, jako jsou GATA2 a UBE2A, interferují s myeloidní diferenciací [76,77].
Naopak jedny z nejčastějších mutací v lymfoidním blastickém zvratu jsou představovány mono - a bi-alelickými delecemi genu CDKN2A, který kóduje tumor-supresorové proteiny regulující buněčný cyklus v úzké vazbě na TP53 [78]. IKZF1 představuje transkripční faktor zapojený do diferenciace B lymfocytů, který je rovněž rekurentně mutovaný, resp. deletovaný v lymfoidním, ale poměrně zřídka v myeloidním blastickém zvratu CML a také v Ph+ akutní lymfoblastické leukemii [79]. Delece genu IKZF1 byly asociovány s aberantní aktivací výše zmíněné rekombinační AID/RAG dráhy v blastickém zvratu [80].
K dokreslení pohledu na roli genové nestability v blastickém zvratu CML je nutné zmínit také dosud poměrně krátce studované kryptické genové fúze, které mohou být celkově přítomny až už 40 % pacientů a jako jediné genetické poruchy u 15 % pacientů v blastickém zvratu. Mezi geny zapojenými do těchto fúzí nepřekvapivě figurují EVI1, RUNX1 a IKZF1 a také epigenetický enzym KMT2A [68].
Výše uvedený přehled poukazuje ve srovnání s jinými hematologickými malignitami a solidními tumory na existenci relativně omezeného repertoáru rekurentních mutací v blastickém zvratu CML. Výrazná většina těchto genetických poruch vede k ztrátě funkce transkripčních faktorů a epigenetických regulátorů genové exprese s tumor-supresorovou a pro-diferenciační funkcí. Z heterogenity zastoupení mutací u jednotlivých pacientů zároveň vyplývá, že snaha o identifikace „klíčové“ mutace zodpovědné za proces transformace do blastického zvratu by pravděpodobně byla iluzorní. Zůstává však otázkou, zda existuje určitý početní mutační práh nebo „správná“ kombinace jednotlivých mutací, které již činí leukemickou buňky náchylnou k progresi do blastického zvratu, nebo zda je pro tento proces rozhodující kooperace jednotlivých mutací s výše uvedenými deregulovanými signálními drahami, případně interakce s epigenetickými regulačními komplexy PRC1 a PRC2. Významnou úlohu v interpretaci dopadu zjištěných mutací pro progresi CML bude hrát to, zda se zjištěné mutace nacházejí v Ph – či Ph+ klonu, a identifikace klonálního vývoje v průběhu CML.
LÉČEBNÉ MOŽNOSTI BLASTICKÉHO ZVRATU
Jak již bylo zmíněno v Úvodu, současné výsledky léčby blastického zvratu jsou neuspokojivé a pro velkou většinu pacientů je tato diagnóza fatální. Za rizikové prognostické faktory pro celkové přežití se považují vyšší věk pacientů, myeloidní fenotyp a vyšší zastoupení, resp. počet blastů, trombocytopenie, anémie, nepodstoupení transplantace krvetvorných buněk, léčba TKI předcházející transformaci a progrese z chronické fáze (oproti de novo záchytům) [35,81]. Skórovací stratifikační systémy umožňující posouzení rizika pacientů v chronické fázi CML se nejeví jako užitečné nástroje odhadu prognózy pacientů v blastickém zvratu, s jistou výjimkou systému ELTS [35].
Přinejmenším pro některé pacienty je jedinou kurativní možností provedení alogenní transplantace krvetvorných buněk, pro jejíž úspěch je klíčové dostat nemoc na určitou dobu pod kontrolu [5,82]. Obecnou terapeutickou strategií je proto co nejrychlejší návrat onemocnění do druhé chronické fáze (CP2), pokud možno s dosažením kompletní, resp. velké hematologické/cytogenetické odpovědi (dosažení molekulárních odpovědí je ve většině případů nereálné), a alogenní transplantace kmenových buněk ve všech případech, kde je to možné [6,55,83] (obr. 2). V současnosti neexistují jasně preferované nebo doporučené algoritmy léčby blastického zvratu. U každého pacienta je nezbytné posoudit únosnost alogenní transplantace krvetvorných buněk a terapii tomu přizpůsobit. Postup se odvíjí zejména od předcházející léčby / de novo záchytu a fenotypu blastického zvratu. Při léčbě samotným TKI ve snaze o dosažení CP2 bylo v různých studiích dosahováno míry hematologických remisí 30–76 %, kompletních hematologických odpovědí 10–35 % a velkých cytogenetických odpovědí 12–40 %, ale tyto odpovědi byly krátkodobé a medián přežití dosahoval jen doby mezi 6 a 12 měsíci [3,5,6]. Pro rychlejší a účinnější navození CP2 se proto s přihlédnutím k toxicitě doporučuje využití kombinace TKI s intenzivními chemoterapeutickými režimy [55]. Obecným principem je použití TKI a vysokodávkované chemoterapie užívané jako záchranná léčba relapsu u daného imunofenotypu akutní leukemie, navození remise choroby s následnou konsolidací a transplantací. Je však nutné zmínit, že používané protokoly se napříč hematologickými centry liší. V případě lymfoidního blastického zvratu lze podávat TKI společně s režimem Hyper-CVAD [84], pro myeloidní blastický zvrat byly aplikovány kombinace s cytarabinovými režimy (tedy v indukci zejména FLAG-IDA, následované konsolidacemi HIDAC) [85]. Kombinace TKI s intenzivní chemoterapií zvyšuje míru odpovědi na léčbu, možnost podstoupení alogenní transplantace, a přestože medián přežití bez události a celkového přežití je v důsledku toxicity a komplikací podobný jako při léčbě samotnými TKI, pacienti léčení kombinací dosahují vyšší míry dlouhodobého přežívání (5leté přežití 30 % vs. 14 %) [82,86]. Podobné výsledky přinesla i kombinace TKI s hypometylační (epigenetickou) léčbou, která se oproti chemoterapii navíc vyznačuje nižší toxicitou [86]. U starších pacientů je doporučována kombinace TKI s redukovanou chemoterapií.
Obr. 2. Obecný algoritmus léčby blastického zvratu. Konkrétní léčebný postup je třeba přizpůsobit situaci a potřebám jednotlivých pacientů. Adaptováno z práce Saußele S, Silver RT, 2015 [6]. ![Obecný algoritmus léčby blastického zvratu. Konkrétní léčebný postup je třeba přizpůsobit situaci a potřebám
jednotlivých pacientů. Adaptováno z práce Saußele S, Silver RT, 2015 [6].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/6779409d8beff7e399763998655da5b7.png)
Studie rovněž konzistentně ukazují lepší výsledky léčby s TKI 2. a 3. generace oproti léčbě s imatinibem, a to nezávisle na využití v kombinaci s chemoterapií nebo na následné transplantaci krvetvorných buněk [3,81]. Na základě toho jsou diskutovány varianty léčby opírající se o nová, účinnější TKI a/nebo TKI působící na principu alosterické inhibice BCR:: ABL1 (asciminib) bez nutnosti kombinovat je s chemoterapií (koncept nově uplatňovaný při léčbě Ph+ akutní lymfoblastické leukemie), nebo dokonce bez nutnosti transplantovat, o čemž se vedou spory [3,82]. Podobně je diskutován význam udržovací léčby TKI po provedení transplantace, kde byl dosud publikován jen omezený počet studií týkajících se blastického zvratu, navíc limitovaných malým množství pacientů a okolnostmi jejich výběru. Studie Centra pro mezinárodní výzkum transplantace krve a kostní dřeně (Center for International Blood and Marrow Transplant Research) nenaznačila přínos v léčebných výsledcích pacientů s post-transplantační udržovací léčbou TKI 1. a 2. generace [87]. Post-transplantační udržovací léčba s ponatinibem se jeví jako tolerovatelná, ale na zhodnocení jejích výsledků bude ještě potřeba vyčkat [88].
Při léčbě blastického zvratu se zejména v případě nedosažení CP2 a relapsech při opakovaném selhání léčby s TKI dále testovala rozsáhlá paleta experimentálních léků a léčivých přípravků. Vedle již zmíněných hypometylačních látek jde také o další epigenetická léčiva (inhibitory HDAC), inhibitory kináz leukemických signalizačních drah (JAK2, Aurora, mTOR), inhibitory farnesyltransferázy nebo imunologickou léčbu, dosud však bez zásadního průlomu v klinické praxi [3,82,83]. Vedle přístupů cílících na epigenetické mechanizmy [37,86] se dnes jako nadějné jeví využití kombinací TKI s inhibitory antiapoptotických proteinů z řad BH3-mimetik, konkrétně inhibitoru proteinu BCL-2, venetoclax [89,90].
Přes dlouhodobou snahu o racionální zefektivnění léčby blastického zvratu jsou pokroky v léčbě terminální fáze CML např. ve srovnání s výsledky dosaženými v léčbě akutních leukemií skromné. Na druhou stranu se podařilo významně snížit jeho incidenci. Za „nejlepší léčbu“ blastického zvratu lze proto v současnosti považovat prevenci jeho vzniku opírající se o další zkvalitnění monitorování a řízení léčby chronické fáze CML.
ZÁVĚR A PERSPEKTIVY
V době, kdy medián dožití pacientů s CML v zemích Evropské unie prakticky dosáhl mediánu dožití běžné populace, blastický zvrat i přes svůj raritní výskyt představuje jeden z hlavních zbývajících problémů spojených s tímto onemocněním. Výsledky současné léčby blastického zvratu jsou neuspokojivé, na čemž má významný podíl dosud nedostatečné pochopení biologie tohoto agresivního stavu. Současný stav poznání naznačuje klíčovou roli „druhého zásahu“ (vedle BCR:: ABL1) v podobě aberantní aktivace CTNNB1 (b-cateninové) dráhy. CTNNB1 v kooperaci s dalšími transkripčními faktory (TCF4, EVI1, TP53, MYC) přeprogramuje progenitorové buňky (blasty) k rozvoji buněčné sebeobnovy a zablokování diferenciace. Manipulací opravných drah společně s BCR:: ABL1 přispívá k jejich rostoucí genomické nestabilitě. V jejím rámci pak dochází k akvizici rekurentních chromozomálních aberací a somatických mutací, které se podílejí na rozvoji onemocnění, dávají mu specifickou podobu a v řadě případů negativně ovlivňují prognózu pacientů.
Tím, že progrese CML do blastického zvratu není na rozdíl od chronické fáze asociována s jedinou nebo dobře charakterizovanou dominantní změnou na molekulární nebo buněčné úrovni, vystupuje do popředí nutnost personalizovat monitorování a léčbu pacientů v blastickém zvratu. S tím souvisí úkol blíže specifikovat roli konkrétních somatických mutací a chromozomálních aberací v progresi onemocnění, identifikovat další prognostické faktory a ideálně vytvořit skórovací stratifikační systém přímo k blastickému zvratu. Pro zlepšení managementu léčby bude potřebné definovat optimální léčebné odpovědi, kterých by pacienti měli dosahovat. V neposlední řadě je třeba individualizovat terapii na základě stanovení konkrétních genových a molekulárních aberací citlivými, vysoce-průtokovými vyšetřovacími metodami. Do popředí zájmu se rovněž dostává personalizované testování kombinace léků na základě lékového profilování in vitro [89].
Vzhledem k raritnímu výskytu blastického zvratu a s ním souvisejících problémů s koncipováním klinickým studií je řešení těchto úkolů obtížné. Významnou pomoc by v tomto směru mohl poskytnout nedávno spuštěný Evropský registr pro blastický zvrat (ClinicalTrials.gov identifikátor: NCT03869502).
PODÍL AUTORŮ NA PŘÍPRAVĚ RUKOPISU
NČ – hlavní autor
AL – revize a doplnění rukopisu
PODĚKOVÁNÍ
Rádi bychom poděkovali vedoucí Oddělení molekulární genetiky ÚHKT, doc. Kateřině Machové Polákové, Ph.D., za cenné připomínky ke koncepci a obsahu článku. Práce byla podpořena grantem GAUK 492222 a institucionální podporou Ministerstva zdravotnictví ČR IČO 00023736.
ČESTNÉ PROHLÁŠENÍ AUTORŮ
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyla podpořena žádnou farmaceutickou firmou.
Doručeno do redakce dne: 16. 9. 2022.
Přijato po recenzi dne: 3. 11. 2022.
RNDr. Nikola Čuřík, Ph.D.
Oddělení molekulární genetiky
Ústav hematologie a krevní transfuze
U Nemocnice 1
128 00 Praha
e-mail: nikola.curik@uhkt.cz
Transfuze Hematol Dnes 2023; 29(1): 16 – 26
Zdroje
1. Hoffmann VS, Baccarani M, Hasford J, et al. Treatment and outcome of 2904 CML patients from the EUTOS population-based registry. Leukemia. 2017; 31 : 593–601.
2. Faber E, Mužík J, Koza V, et al. Treatment of consecutive patients with chronic myeloid leukaemia in the cooperating centres from the Czech Republic and the whole of Slovakia after 2000 – a report from the population-based CAMELIA Registry. Eur J Haematol. 2011; 87 : 157–168.
3. Bonifacio M, Stagno F, Scaffidi L, Krampera M, Di Raimondo F. Management of chronic myeloid leukemia in advanced phase. Front Oncol. 2019; 9 : 1132.
4. Khoury JD, Solary E, Abla O, et al. The 5th edition of the World Health Organization classification of haematolymphoid tumours: myeloid and histiocytic/dendritic neoplasms. Leukemia. 2022; 36 : 1703–1719.
5. DeFilipp Z, Khoury HJ. Management of advanced-phase chronic myeloid leukemia. Curr Hematol Malig Rep. 2015; 10 : 173–181.
6. Saußele S, Silver RT. Management of chronic myeloid leukemia in blast crisis. Ann Hematol. 2015; 94 Suppl 2: S159–S165.
7. Hehlmann R, Lauseker M, Saußele S, et al. Assessment of imatinib as first-line treatment of chronic myeloid leukemia: 10-year survival results of the randomized CML study IV and impact of non-CML determinants. Leukemia. 2017; 31 : 2398–2406.
8. Bavaro L, Martelli M, Cavo M, Soverini S. Mechanisms of disease progression and resistance to tyrosine kinase inhibitor therapy in chronic myeloid leukemia: an update. Int J Mol Sci. 2019; 20 : 6141.
9. Radich JP. The biology of CML blast crisis. Hematology Am Soc Hematol Educ Program. 2007 : 384–391.
10. Chereda B, Melo JV. Natural course and biology of CML. Ann Hematol. 2015; 94 (Suppl 2): S107–S121.
11. Neviani P, Harb JG, Oaks JJ, et al. PP2A-activating drugs selectively eradicate TKI-resistant chronic myeloid leukemic stem cells. J Clin Invest. 2013; 123 : 4144–4157.
12. Giustacchini A, Thongjuea S, Barkas N, et al. Single-cell transcriptomics uncovers distinct molecular signatures of stem cells in chronic myeloid leukemia. Nat Med. 2017; 23 : 692–702.
13. Zhang W, Yang B, Weng L, et al. Single cell sequencing reveals cell populations that predict primary resistance to imatinib in chronic myeloid leukemia. Aging (Albany NY). 2020; 12 : 25337–25355.
14. Abraham SA, Hopcroft LE, Carrick E, et al. Dual targeting of p53 and c-MYC selectively eliminates leukaemic stem cells. Nature. 2016; 534 : 341–346.
15. Holyoake T, Jiang X, Eaves C, Eaves A. Isolation of a highly quiescent subpopulation of primitive leukemic cells in chronic myeloid leukemia. Blood 1999; 94 : 2056–2064.
16. Holyoake TL, Vetrie D. The chronic myeloid leukemia stem cell: stemming the tide of persistence. Blood. 2017; 129 : 1595–1606.
17. Jamieson CH, Ailles LE, Dylla SJ, et al. Granulocyte-macrophage progenitors as candidate leukemic stem cells in blast-crisis CML. N Engl J Med. 2004; 351 : 657–667.
18. Kinstrie R, Karamitros D, Goardon N, et al. Heterogeneous leukemia stem cells in myeloid blast phase chronic myeloid leukemia. Blood Adv. 2016; 1 : 160–169.
19. El Rassi F, Bergsagel JD, Arellano M, et al. Predicting early blast transformation in chronic-phase chronic myeloid leukemia: is immunophenotyping the missing link? Cancer. 2015; 121 : 872–875.
20. Khalidi HS, Brynes RK, Medeiros LJ, et al. The immunophenotype of blast transformation of chronic myelogenous leukemia: a high frequency of mixed lineage phenotype in „lymphoid“ blasts and A comparison of morphologic, immunophenotypic, and molecular findings. Mod Pathol. 1998; 11 : 1211–1221.
21. Reid AG, De Melo VA, Elderfield K, et al. Phenotype of blasts in chronic myeloid leukemia in blastic phase-Analysis of bone marrow trephine biopsies and correlation with cytogenetics. Leuk Res. 2009; 33 : 418–425.
22. Sadovnik I, Herrmann H, Eisenwort G, et al. Expression of CD25 on leukemic stem cells in BCR-ABL1+ CML: Potential diagnostic value and functional implications. Exp Hematol. 2017; 51 : 17–24.
23. Lee MY, Park CJ, Cho YU, et al. Differences in PD-1 expression on CD8+ T-cells in chronic myeloid leukemia patients according to disease phase and TKI medication. Cancer Immunol Immunother. 2020; 69 : 2223–2232.
24. Barnes DJ, Palaiologou D, Panousopoulou E, et al. Bcr-Abl expression levels determine the rate of development of resistance to imatinib mesylate in chronic myeloid leukemia. Cancer Res. 2005; 65 : 8912–8919.
25. Huntly BJ, Shigematsu H, Deguchi K, et al. MOZ-TIF2, but not BCR-ABL, confers properties of leukemic stem cells to committed murine hematopoietic progenitors. Cancer Cell. 2004; 6 : 587–596.
26. Radich JP, Dai H, Mao M, et al. Gene expression changes associated with progression and response in chronic myeloid leukemia. Proc Natl Acad Sci U S A. 2006; 103 : 2794–2799.
27. Walz C, Ahmed W, Lazarides K, et al. Essential role for Stat5a/b in myeloproliferative neoplasms induced by BCR-ABL1 and JAK2 (V617F) in mice. Blood. 2012; 119 : 3550–3560.
28. Heidel FH, Bullinger L, Feng Z, et al. Genetic and pharmacologic inhibition of b-catenin targets imatinib-resistant leukemia stem cells in CML. Cell Stem Cell. 2012; 10 : 412–424
29. Tomasello L, Vezzalini M, Boni C, et al. Regulative loop between b-catenin and protein tyrosine receptor type g in chronic myeloid leukemia. Int J Mol Sci. 2020; 21 : 2298.
30. Manachai N, Saito Y, Nakahata S, Bahirvani AG, Osato M, Morishita K. Activation of EVI1 transcription by the LEF1/b-catenin complex with p53-alteration in myeloid blast crisis of chronic myeloid leukemia. Biochem Biophys Res Commun. 2017; 482 : 994–1000.
31. Sato T, Goyama S, Kataoka K, Nasu R, et al. Evi1 defines leukemia-initiating capacity and tyrosine kinase inhibitor resistance in chronic myeloid leukemia. Oncogene. 2014; 33 : 5028–5038.
32. Laricchia-Robbio L, Premanand K, Rinaldi CR, Nucifora G. EVI1 Impairs myelopoiesis by deregulation of PU.1 function. Cancer Res. 2009; 69 : 1633–1642.
33. Yoshimi A, Goyama S, Watanabe-Okochi N, et al. Evi1 represses PTEN expression and activates PI3K/AKT/mTOR via interactions with polycomb proteins. Blood. 2011; 117 : 3617–3628.
34. Desterke C, Hugues P, Hwang JW, Bennaceur-Griscelli A, Turhan AG. Embryonic program activated during blast crisis of chronic myelogenous leukemia (CML) implicates a TCF7L2 and MYC cooperative chromatin binding. Int J Mol Sci. 2020; 21 : 4057.
35. Lauseker M, Bachl K, Turkina A, et al. Prognosis of patients with chronic myeloid leukemia presenting in advanced phase is defined mainly by blast count, but also by age, chromosomal aberrations and hemoglobin. Am J Hematol. 2019; 94 : 1236–1243
36. Heller G, Topakian T, Altenberger C, et al. Next-generation sequencing identifies major DNA methylation changes during progression of Ph+ chronic myeloid leukemia. Leukemia. 2016; 30 : 1861–1868.
37. Ko TK, Javed A, Lee KL, et al. An integrative model of pathway convergence in genetically heterogeneous blast crisis chronic myeloid leukemia. Blood. 2020; 135 : 2337–2353.
38. Koptyra M, Cramer K, Slupianek A, Richardson C, Skorski T. BCR/ABL promotes accumulation of chromosomal aberrations induced by oxidative and genotoxic stress. Leukemia. 2008; 22 : 1969–1972.
39. Warsch W, Grundschober E, Berger A, et al. STAT5 triggers BCR-ABL1 mutation by mediating ROS production in chronic myeloid leukaemia. Oncotarget. 2012; 3 : 1669–1687.
40. Nieborowska-Skorska M, Flis S, Skorski T. AKT-induced reactive oxygen species generate imatinib-resistant clones emerging from chronic myeloid leukemia progenitor cells. Leukemia. 2014; 28 : 2416–2418.
41. Yuan H, Wang Z, Gao C, et al. BCR-ABL gene expression is required for its mutations in a novel KCL-22 cell culture model for acquired resistance of chronic myelogenous leukemia. J Biol Chem. 2010; 285 : 5085–5096.
42. Grant H, Jiang X, Stebbing J, et al. Analysis of BCR-ABL1 tyrosine kinase domain mutational spectra in primitive chronic myeloid leukemia cells suggests a unique mutator phenotype. Leukemia. 2010; 24 : 1817–1821.
43. Stoklosa T, Poplawski T, Koptyra M, et al. BCR/ABL inhibits mismatch repair to protect from apoptosis and induce point mutations. Cancer Res. 2008; 68 : 2576–2580.
44. Dkhissi F, Aggoune D, Pontis J, et al. The downregulation of BAP1 expression by BCR-ABL reduces the stability of BRCA1 in chronic myeloid leukemia. Exp Hematol. 2015; 43 : 775–780.
45. Deutsch E, Dugray A, AbdulKarim B, et al. BCR-ABL down-regulates the DNA repair protein DNA-PKcs. Blood. 2001; 97 : 2084–2090.
46. Wang Z, Yuan H, Roth M, et al. SIRT1 deacetylase promotes acquisition of genetic mutations for drug resistance in CML cells. Oncogene. 2013; 32 : 589–598.
47. Muvarak N, Kelley S, Robert C, et al. c-MYC generates repair errors via increased transcription of alternative-NHEJ factors, LIG3 and PARP1, in tyrosine kinase-activated leukemias. Mol Cancer Res. 2015; 13 : 699–712
48. Curik N, Polivkova V, Burda P, et al. Somatic mutations in oncogenes are in chronic myeloid leukemia acquired de novo via deregulated base-excision repair and alternative non-homologous end joining. Front Oncol. 2021; 11 : 744373.
49. Chen Z, Shao C, Wang W, et al. Cytogenetic landscape and impact in blast phase of chronic myeloid leukemia in the era of tyrosine kinase inhibitor therapy. Leukemia. 2017; 31 : 585–592.
50. Mitelman F, Levan G, Nilsson PG, Brandt L. Non-random karyotypic evolution in chronic myeloid leukemia. Int J Cancer. 1976; 18 : 24–30.
51. Johansson B, Fioretos T, Mitelman F. Cytogenetic and molecular genetic evolution of chronic myeloid leukemia. Acta Haematol. 2002; 107 : 76–94.
52. Čičátková P, Jarošová M, Mazalová M, et al. Přídatné cytogenetické abnormality prokázané při diagnóze chronické myeloidní leukemie a jejich vliv na prognózu – analýza z databáze INFINITY. Transfuze Hematol Dnes. 2022; 28 (Suppl 2): 2S48.
53. Baccarani M, Deininger MW, Rosti G, et al. European LeukemiaNet recommendations for the management of chronic myeloid leukemia: 2013. Blood. 2013; 122 : 872–884.
54. Hehlmann R, Voskanyan A, Lauseker M, et al. High-risk additional chromosomal abnormalities at low blast counts herald death by CML. Leukemia. 2020; 34 : 2074–2086.
55. Hochhaus A, Baccarani M, Silver RT, et al. European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia. 2020; 34 : 966–984.
56. Issa GC, Kantarjian H, Nogueras Gonzalez G, et al. Clonal chromosomal abnormalities appearing in Philadelphia chromosome-negative metaphases during CML treatment. Blood. 2017; 130 : 2084–2091.
57. Wang W, Cortes JE, Tang G, et al. Risk stratification of chromosomal abnormalities in chronic myelogenous leukemia in the era of tyrosine kinase inhibitor therapy. Blood. 2016; 127 : 2742–2750.
58. Wang L, Li L, Chen R, Huang X, Ye X. Understanding and monitoring chronic myeloid leukemia blast crisis: how to better manage patients. Cancer Manag Res. 2021; 13 : 4987–5000.
59. Branford S, Kim DDH, Apperley JF, et al. Laying the foundation for genomically-based risk assessment in chronic myeloid leukemia. Leukemia. 2019; 33 : 1835–1850.
60. Nteliopoulos G, Bazeos A, Claudiani S, et al. Somatic variants in epigenetic modifiers can predict failure of response to imatinib but not to second-generation tyrosine kinase inhibitors. Haematologica. 2019; 104 : 2400–2409.
61. Adnan-Awad S, Kankainen M, Mustjoki S. Mutational landscape of chronic myeloid leukemia: more than a single oncogene leukemia. Leuk Lymphoma. 2021; 62 : 2064–2078.
62. Gelsi-Boyer V, Brecqueville M, Devillier R, Murati A, Mozziconacci MJ, Birnbaum D. Mutations in ASXL1 are associated with poor prognosis across the spectrum of malignant myeloid diseases. J Hematol Oncol. 2012; 5 : 12.
63. Kim T, Tyndel MS, Kim HJ, et al. Spectrum of somatic mutation dynamics in chronic myeloid leukemia following tyrosine kinase inhibitor therapy. Blood. 2017; 129 : 38–47.
64. Wu W, Xu N, Zhou X, et al. Integrative genomic analysis reveals cancer-associated gene mutations in chronic myeloid leukemia patients with resistance or intolerance to tyrosine kinase inhibitor. Onco Targets Ther. 2020; 13 : 8581–8591.
65. Schmitt MW, Pritchard JR, Leighow SM, et al. Single-molecule sequencing reveals patterns of preexisting drug resistance that suggest treatment strategies in Philadelphia-positive leukemias. Clin Cancer Res. 2018; 24 : 5321–5334.
66. Mologni L, Piazza R, Khandelwal P, Pirola A, Gambacorti-Passerini C. Somatic mutations identified at diagnosis by exome sequencing can predict response to imatinib in chronic phase chronic myeloid leukemia (CML) patients. Am J Hematol. 2017; 92: E623–E625.
67. Grossmann V, Kohlmann A, Zenger M, et al. A deep-sequencing study of chronic myeloid leukemia patients in blast crisis (BC-CML) detects mutations in 76.9% of cases. Leukemia. 2011; 25 : 557–560.
68. Branford S, Wang P, Yeung DT, et al. Integrative genomic analysis reveals cancer-associated mutations at diagnosis of CML in patients with high-risk disease. Blood. 2018; 132 : 948–961.
69. Ochi Y, Yoshida K, Huang YJ, et al. Clonal evolution and clinical implications of genetic abnormalities in blastic transformation of chronic myeloid leukaemia. Nat Commun. 2021; 12 : 2833.
70. Abdel-Wahab O, Adli M, LaFave LM, et al. ASXL1 mutations promote myeloid transformation through loss of PRC2-mediated gene repression. Cancer Cell. 2012; 22 : 180–193.
71. Uni M, Masamoto Y, Sato T, et al. Modeling ASXL1 mutation revealed impaired hematopoiesis caused by derepression of p16Ink4a through aberrant PRC1-mediated histone modification. Leukemia. 2019; 33 : 191–204.
72. Khan M, Cortes J, Kadia T, et al. Clinical outcomes and co-occurring mutations in patients with RUNX1-mutated acute myeloid leukemia. Int J Mol Sci. 2017; 18 : 1618.
73. Adnan Awad S, Dufva O, Ianevski A, et al. RUNX1 mutations in blast-phase chronic myeloid leukemia associate with distinct phenotypes, transcriptional profiles, and drug responses. Leukemia. 2021; 35 : 1087–1099.
74. Kelly MJ, So J, Rogers AJ, et al. Bcor loss perturbs myeloid differentiation and promotes leukaemogenesis. Nat Commun. 2019; 10 : 1347.
75. Schaefer EJ, Wang HC, Karp HQ, et al. BCOR and BCORL1 mutations drive epigenetic reprogramming and oncogenic signaling by unlinking PRC1.1 from target genes. Blood Cancer Discov. 2022; 3 : 116–135.
76. Zhang SJ, Ma LY, Huang QH, et al. Gain-of-function mutation of GATA-2 in acute myeloid transformation of chronic myeloid leukemia. Proc Natl Acad Sci U S A. 2008; 105 : 2076–2081.
77. Magistroni V, Mauri M, D‘Aliberti D, et al. De novo UBE2A mutations are recurrently acquired during chronic myeloid leukemia progression and interfere with myeloid differentiation pathways. Haematologica. 2019; 104 : 1789–1797.
78. Williams RT, Sherr CJ. BCR-ABL and CDKN2A: a dropped connection. Nat Rev Cancer. 2008; 8 : 563.
79. Nakayama H, Ishimaru F, Avitahl N, et al. Decreases in Ikaros activity correlate with blast crisis in patients with chronic myelogenous leukemia. Cancer Res. 1999; 59 : 3931–3934.
80. Thomson DW, Shahrin NH, Wang PPS, et al. Aberrant RAG-mediated recombination contributes to multiple structural rearrangements in lymphoid blast crisis of chronic myeloid leukemia. Leukemia. 2020; 34 : 2051–2063.
81. Jain P, Kantarjian HM, Ghorab A, et al. Prognostic factors and survival outcomes in patients with chronic myeloid leukemia in blast phase in the tyrosine kinase inhibitor era: Cohort study of 477 patients. Cancer. 2017; 123 : 4391–4402.
82. How J, Venkataraman V, Hobbs GS. Blast and accelerated phase CML: room for improvement. Hematology Am Soc Hematol Educ Program. 2021; 2021 : 122–128.
83. Hehlmann R. How I treat CML blast crisis. Blood. 2012; 120 : 737–747.
84. Strati P, Kantarjian H, Thomas D, et al. HCVAD plus imatinib or dasatinib in lymphoid blastic phase chronic myeloid leukemia. Cancer. 2014; 120 : 373–380.
85. Copland M, Slade D, McIlroy G, et al. Ponatinib with fludarabine, cytarabine, idarubicin, and granulocyte colony-stimulating factor chemotherapy for patients with blast-phase chronic myeloid leukaemia (MATCHPOINT): a single-arm, multicentre, phase 1/2 trial. Lancet Haematol. 2022; 9: e121–e132.
86. Saxena K, Jabbour E, Issa G, et al. Impact of frontline treatment approach on outcomes of myeloid blast phase CML. J Hematol Oncol. 2021; 14 : 94.
87. DeFilipp Z, Ancheta R, Liu Y, et al. Maintenance tyrosine kinase inhibitors following allogeneic hematopoietic stem cell transplantation for chronic myelogenous leukemia: A Center for International Blood and Marrow Transplant Research Study. Biol Blood Marrow Transplant. 2020; 26 : 472–479.
88. Kishida Y, Najima Y, Otsuka Y, et al. Post-transplant maintenance treatment with ponatinib for Philadelphia chromosome positive leukemia. Blood 2019; 134 (Suppl 1): 5694.
89. Pietarinen PO, Pemovska T, Kontro M, et al. Novel drug candidates for blast phase chronic myeloid leukemia from high-throughput drug sensitivity and resistance testing. Blood Cancer J. 2015; 5: e309.
90. Maiti A, Franquiz MJ, Ravandi F, et al. Venetoclax and BCR-ABL tyrosine kinase inhibitor combinations: outcome in patients with Philadelphia chromosome-positive advanced myeloid leukemias. Acta Haematol. 2020; 143 : 567–573.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2023 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Blastický zvrat chronické myeloidní leukemie
- Cévní nežádoucí účinky u pacientů s chronickou myeloidní leukemií při terapii inhibitory tyrozinkináz v každodenní klinické praxi – analýza z databáze INFINITY
- Editorial
- Nezvyklý a nepriaznivý priebeh chronickej myelocytovej leukémie – kazuistika a prehľad literatúry
- Doporučený postup stratifikace rizika trombózy a cílené tromboprofylaxe u žen podstupujících asistovanou reprodukci
- Prevence, diagnostika a léčba trombózy spojené se zhoubným nádorem
- Doporučení České hematologické společnosti pro diagnostiku a léčbu imunitní trombocytopenie dospělých
- Sympozium a workshop – aktuální výzvy a uplatnění nových technologií v léčbě chronické myeloidní leukemie
- Fixní délka léčby CLL – realita, nebo fikce?
- Jubileum primářky Lenky Walterové
- Povrchové markery leukemických kmenových buněk u chronické myeloidní leukemie
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Doporučení České hematologické společnosti pro diagnostiku a léčbu imunitní trombocytopenie dospělých
- Doporučený postup stratifikace rizika trombózy a cílené tromboprofylaxe u žen podstupujících asistovanou reprodukci
- Blastický zvrat chronické myeloidní leukemie
- Nezvyklý a nepriaznivý priebeh chronickej myelocytovej leukémie – kazuistika a prehľad literatúry
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



