-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Chronobiologické aspekty v hematológii
Chronobiological aspects in haematology
Man is exposed to the periodical processes of external environment practically with the synchronization of all his functions during the entire lifespan. The circadian rhythms (24 hour rhythms) are studied most frequently and they are demonstrated also in haematology. Detailed understanding of the circadian timing in fluctuation of some haematological functions in healthy man can have a clinical impact. In the present time, more and more information pass into foreground that changes, for example, in circadian oscillations of haemostatic system may lead to disturbance, resulting in either hypercoagulability and thrombosis or alternatively hypocoagulability and hemorrhage. Variables participating in haemostasis and thrombosis interact and their timing and phase relations may either contribute to maintaining the balance between procoagulant and anticoagulant factors or they may shift the balance in the direction of increased or decreased blood coagulation or thrombolysis. Therefore knowledge about circadian oscillations of haematological functions can serve for timing the more effective treatment of various blood diseases or can indicate that changes in timing of these functions can help to predict certain haematological disease. In the first part of the article we concentrated on elucidation of the basic terms, which are most frequently used in the chronobiological literature. The main objective of the article is to establish the existence of circadian variation in fundamental haematological processes, like haemopoesis, haemostasis and fibrinolysis in healthy persons.
Key words:
chronobiology, haematology
Autoři: P. Švorc; E. Švorcová 1
Působiště autorů: Ústav fyziológie, Lekárska fakulta UPJŠ, 1Klinika hematológie a onkohematológie, Univerzitná nemocnica L. Pasteura, tr. SNP 1, Košice
Vyšlo v časopise: Transfuze Hematol. dnes,17, 2011, No. 2, p. 98-104.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Človek je počas celého života vystavený periodicitám vonkajšieho prostredia, ku ktorým sa synchronizujú prakticky všetky jeho funkcie. Najviac sú skúmané cirkadiánne rytmy (24-hodinové rytmy) a boli dokázané aj v oblasti hematológie. Detailné porozumenie cirkadiánnemu časovaniu v kolísaní hematologických funkcií u zdravého človeka môže mať aj klinický dopad. V súčasnosti sa napríklad čoraz viac dostávajú do popredia informácie, že zmeny v cirkadiánnych osciláciach hemostatického systému môžu viesť k poruchám, ktoré majú za následok hyperkoaguláciu, alebo hypokoaguláciu. Premenné, ktoré sa zúčastňujú na hemostáze vzájomne na seba pôsobia. Ich časovanie a fázové vzťahy môžu prispievať k udržaniu rovnováhy medzi prokoagulačnými a antikoagulačnými faktormi. Môžu posunúť túto rovnováhu v smere zvýšenej alebo zníženej koagulácie krvi alebo trombolýzy. Preto poznanie cirkadiánnych oscilácii hematologických funkcií môže poslúžiť na časovanie efektívnejšej liečby rôznych krvných ochorení ale aj upozorniť, že zmeny v časovom priebehu týchto funkcií môžu pomôcť včas odhaliť určité hematologické ochorenia. V prvej časti článku sme sa zamerali na objasnenie základných pojmov, ktoré sa najčastejšie používajú v chronobiologickej literatúre. Hlavným zámerom článku je podanie informatívneho pohľadu na cirkadiánne kolísanie v základných hematologických procesoch u zdravých ľudí, ako je hemopoéza, hemostáza a fibrinolýza.
Kľúčové slová:
chronobiológia, hematológiaZákladné pojmy v chronobiológii
Pojmy v oblasti chronobiológie, ktoré boli prijaté a schválené The American Association of Medical Chronobiology and Chronotherapeutics, popisujú aspekty biologických rytmov, ktoré sa často používajú v chronobiologických textoch a pre ktoré nebola vhodná žiadna terminológia. Táto nomenklatúra bola prezentovaná na 4. postgraduálnom vzdelávacom kurze Medical Chronobiology And Its Applications v Nevsehire v Turecku roku 2006. Mnohé zo zavedených termínov z oblasti chronobiológie nie sú ešte známe vedeckým pracovníkom ani lekárom, ktorí môžu mať z aplikácie chronobiologických princípov prospech vo svojej práci.
Biologické rytmy môžeme rozdeliť do dvoch základných skupín:
- exogénne rytmy –rytmy, ktoré závisia na periodickom podnete z vonkajšieho prostredia a
- endogénne rytmy – rytmy, ktoré sú geneticky dané a pretrvávaju v prostredí bez vonkajších časových vplyvov. Sú to teda samostatne oscilujúce systémy, schopné udržať si svoju periódu i za konštantnych neperiodických podmienok. Endogénne rytmy podľa trvania periódy možu byť: cirkadiánne (perióda 24 plus/mínus 4 hodiny), ultradiánne (perióda menšia ako 20 hodín) a infradiánne (perióda vačšia ako 28 hodín), z ktorých sú najčastejšie študované cirkadianne rytmy.
Medzi základné charakteristiky cirkadiánnych rytmov patria: perióda – predstavuje časový úsek priebehu jedného kompletného cyklu, kde frekvencia je počet cyklov za časovú jednotku, amplitúda – polovica rozdielu medzi maximálnou a minimálnou hodnotou v priebehu jedného cyklu, mezor – stredná hodnota medzi najvyššou a najnižšou hodnotou kosinorovej funkcie interpolovanej nameranými údajmi, fáza – okamžitý stav oscilácie v perióde a akrofáza – čas, kedy meraný parameter dosahuje svoje maximum v rámci cirkadiánnej oscilácie.
Medzi najbežnejšie pojmy, ktoré sa používajú v chronobiologických prácach, patria: pacemaker – vnútorný mechanizmus, ktorý udáva periódu a fázu endogénneho rytmu, synchronizácia – stav systému, kedy dve alebo viacej premenných vykazujú periodicitu s rovnakou frekvenciou a akrofázou, vonkajšia desynchronizácia – desynchronizácia endogénneho biologického rytmu s cyklom prostredia, vnútorná desynchronizácia – stav, kedy dve, alebo viac predtým synchronizované premenné v tom istom organizme začínajú vykazovať rozdielne alebo meniace sa časové vzťahy a fázový posun (fázové oneskorenie alebo fázový postup) – neskorší alebo skorší výskyt akrofázy.
Biologické rytmy v hematológii
Základné hematologické procesy, ako hemopoéza, hemostáza, ale aj fibrinolýza sú známe so svojimi nápadnými rytmami v cirkadiánnom frekvenčnom rozsahu. Niektoré cirkadiánne rytmy hematologických funkcií sú vrodené (teda geneticky dané), ale na druhej strane, ich časový priebeh je často modulovaný faktormi prostredia, tzv. synchronizátormi. V cirkadiánnych rytmoch hematologických parametrov u zdravých ľudí sú prítomné taktiež fázové zmeny a to po manipulácii režimu aktivita-pokoj (jet lag syndróm, smenová práca) alebo režimu príjmu potravy. Ich časový priebeh sa bezprostredne nemení, ale sa adaptuje v priebehu niekoľkých prechodných cyklov na nové podmienky.
U každého zdravého človeka existujú cirkadiánne rytmy cirkulujúcich elementov v periférnej krvi. Nielen počet, ale taktiež aj reaktivita cirkulujúcich krvných buniek predpovedateľne kolíše v priebehu 24-hodinovej periódy (1–10).
Niektoré cirkadiánne rytmy, najmä v počte cirkulujúcich leukocytov vykazujú veľkú amplitúdu. Na túto skutočnosť poukázal prof. Haus na 4. Postagraduate Educational Course on Chronobiology and Chronomedicine (tab. 1). V tabuľke sú uvedené rozdiely medzi maximálnym a minimálnym počtom cirkulujúcich bielych krviniek zo 173 klinicky zdravých ľudí, ktorí boli aktívni počas dňa.
Tab. 1. Rozdiely medzi maximálnym a minimálnym počtom cirkulujúcich leukocytov, ktoré boli zistené u klinicky zdravých osôb s aktivitou počas dňa a s pokojom počas noci. Hodnoty sú uvádzane v absolútnych počtoch v μl (použité z prednášky prof. Hausa na 4. Postagraduate Educational Course on Chronobiology and Chronomedicine v Cappadocii, Turecko, 2006). 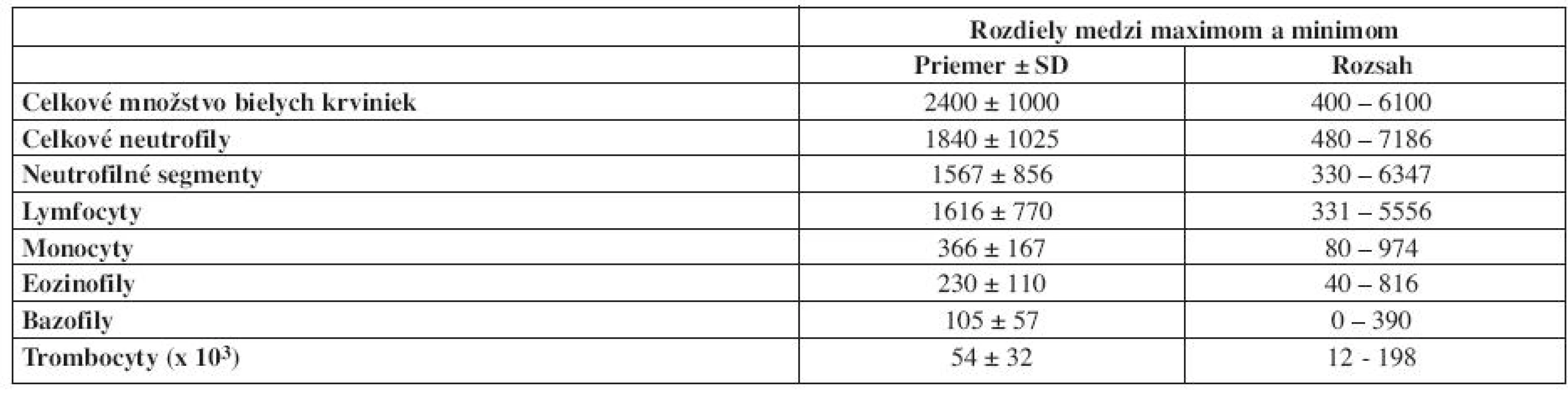
Cirkadiánna rytmicita cirkulujúcich krvných elementov sa nemení ani s vekom (4, 9). Existujú však niektoré rozdiely u starších osôb, napríklad zvýšenie 24-hodinového priemeru (mezoru) v počte červených krviniek (4), zrelých neutrofilov (9) alebo v skoršej akrofáze (fázový posun) cirkadiánnych rytmov cirkulujúcich neutrofilov a lymfocytov (9).
Cirkadiánne rytmy v hemopoéze
Hemopoéza (proces vzniku a vývoja krvných elementov) je v kostnej dreni pomerne pevne regulovaná mikroprostredím, faktormi z cirkulácie a autonómnym nervovým systémom. Na druhej strane, hemopoetické procesy významne kolíšu počas dňa. Pri hodnotení proliferačnej aktivity, zo vzoriek nefrakciovanej kostnej drene, sa však popisujú zdanlivo rozporné časy maximálnej a minimálnej proliferačnej aktivity počas dňa. Tieto disproporcie sú vysvetľované prítomnosťou heterogénnej populácie kmeňových buniek a rôznych hemopoetických progenitorov, ktorých proliferácia a diferenciácia zreteľne vykazujú odlišné cirkadiánne vzorce (11).
Cirkadiánna regulácia hemopoetických procesov v kostnej dreni nie je ešte detailne popísaná. Pripisuje sa regulačnému vplyvu sympatikového nervového systému (12), alebo cirkadiánnej organizácii bunkového cyklu (11), alebo poprípade môže byť zapríčinená bežnými regulačnými mechanizmami (13, 14).
Na úlohu sympatikového nervového systému v cirkadiánnej regulácii proliferácie a diferenciácie hemopoetických kmeňových buniek poukázal vo svojej štúdii Mendez-Ferrer a spol. (12). Môže sa jednať o priamy alebo nepriamy vplyv. Priamy vplyv je prostredníctvom cirkadiánnej informácie prenášanej sympatikovým nervovým systémom z centrálneho pacemakera v mozgu (zo suprachiazmatických jadier) do mikroprostredia kostnej drene a usmerňuje tak cirkadiánne oscilácie v hemopoéze a v migrácii hemopoetických kmeňových buniek. Nepriamy vplyv sa pripisuje podporným stromálnym bunkám (12).
Odlišný stupeň poškodenia kostnej drene, po podaní fixnej dávky cytotoxickej látky v odlišných časoch dňa, môže signalizovať ďalší z popísaných mechanizmov cirkadiánnej regulácie proliferácie a diferenciácie hemopoetických kmeňových buniek a to pravdepodobne prostredníctvom cirkadiánnej organizácie bunkového cyklu (11). Táto téza je podporená viacerými autormi (11, 13, 14), ktorí sledovali cirkadiánnu variáciu v proliferačnej aktivite (syntéza DNA v S-fáze bunkového cyklu) buniek kostnej drene na zdravých ľuďoch. V priemere, percento celkových buniek kostnej drene vo fáze syntézy DNA bolo najvyššie popoludní (akrofáza o 13 : 16 hodine) (13). Najnižšia aktivita bola zase zaznamenaná medzi 00 : 00 hodinou a 04 : 00 hodinou (14).
Časový vzájomný vzťah v cirkadiánnej variácii S-fázy a G2/M-fázy medzi myeloidnou (akrofáza o 08 : 40 hodine) a erytroidnou (akrofáza o 13 : 01 hodine) bunkovou líniou signalizuje, že cirkadiánna rytmicita hemopoézy môže byť regulovaná aj bežnými regulačnými mechanizmami (vlastné krvotvorné faktory, cytokíny, rastové faktory alebo faktory inhibujúce proliferáciu krvotvorných buniek). Štúdie ukazujú, že najvyššie frakcie buniek v S-fáze boli zistené v erytropoéze, zatiaľ čo najvyššia variácia závislá na cirkadiánnom rytme bola zistená v myelopoéze (13, 14).
Podobne aj počty multipotentných a nezrelých progenitorových kolónií vykazujú 24-hodinovú rytmicitu, s 3–5 vrcholmi za deň. Počty nezrelších progenitorových kolónií vykazujú zase 2 vrcholy, teda 12-hodinový rytmus. Podanie erytropoetínu zosilňuje denné rytmy v počte erytroidných kolónií zvyšujúc ich amplitúdy, zatiaľ čo cirkadiánny priebeh zostáva nezmenený (11).
Cirkadiánne rytmy v hemostatickom systéme
Hemostatický systém je multikomponentálny systém, ktorý poskytuje ochranu pred únikom krvi z ciev v prípade ich poškodenia. Ako náhle je cieva porušená, hemostáza je aktivovaná niekoľkými mechanizmami: vaskulárnym spazmom, formáciou doštičkovej zátky, hemokoaguláciou a rastom fibrínovej zátky pre definitívne utesnenie poškodenej cievy. Zahrňuje cievne funkcie, krvné doštičky, koagulačné faktory a fibrinolýzu.
Epidemiológia tromboembolického a hemorhagického fenoménu (15) je charakterizovaná značnou 24-hodinovou periodicitou, s hlavným vrcholom tromboembolických a hemorhagických príhod v raňajších hodinách a so sekundárnym, zvyčajne menším vrcholom, neskoro popoludní (15). Existujú nielen denné, ale aj týždenné a sezónne rytmy vo výskyte tromboembolických a hemorhagických príhod. Taktiež sa očakáva, že v týchto frekvenciách bude výrazná interakcia endogénnych rytmov a faktorov prostredia, ktoré môžu alebo nemôžu pôsobiť ako synchronizátor (16).
Vaskulárne faktory v hemostáze
Hemostáza je ovplyvňovaná mnohými cirkadiánnymi periodickými faktormi vaskulárneho systému. Medzi tieto faktory môžeme zahrnúť periférny odpor, prietok krvi, viskozitu krvi, tlak krvi a srdcovú frekvenciu. U ľudí, ktorí sú aktívni počas dňa, periférny vaskulárny odpor klesá počas poludnia s výsledným nárastom prietoku krvi v tomto čase. Vazomotorický tonus koronárnych a periférnych artérií a vazokonstrikčná odpoveď na adrenalín sú väčšie ráno ako na poludnie. Teda v ranných hodinách je väčšia tendencia redukcie priemeru ciev (16). V štúdii Amerisa a spol. (17) bola zaznamenaná znížená odpoveď cerebrálnych ciev na hyperkapniu najmä v ranných hodinách, predpokladajúc tak pokles vo vazodilatačnej rezerve počas rána. Môže to byť aj vo vzťahu k pozorovanému rannému zvýšenému riziku náhlych mozgových príhod. Hemodynamické premenné hemostatického systému oscilujú počas 24 hodín tak, že práve v ranných hodinách sú vytvorené najväčšie predpoklady pre výskyt tromboembolických komplikácii.
Variácie v počte doštičiek a ich aktivitách
Jedna z prvých odpovedí na poškodenie cievy je kumulácia doštičiek, ktoré hrajú v hemostáze nielen mechanickú, ale aj biochemickú úlohu. Cirkulujúce trombocyty vykazujú cirkadiánny rytmus s vrcholom popoludní (obr. 1) (18).
Obr. 1. Cirkadiánna variácia v počte cirkulujúcich krvných doštičiek u 64 klinicky zdravých, aktívnych cez deň, mladých dospelých ľudí. Každý stĺpec reprezentuje skupinovú akrofázu s 95% konfidenčným intervalom. Tmavé prúžky na osi x reprezentujú čas spánku a prázdne prúžky čas bdenia (prevzaté a modifikované z Haus, /18/). 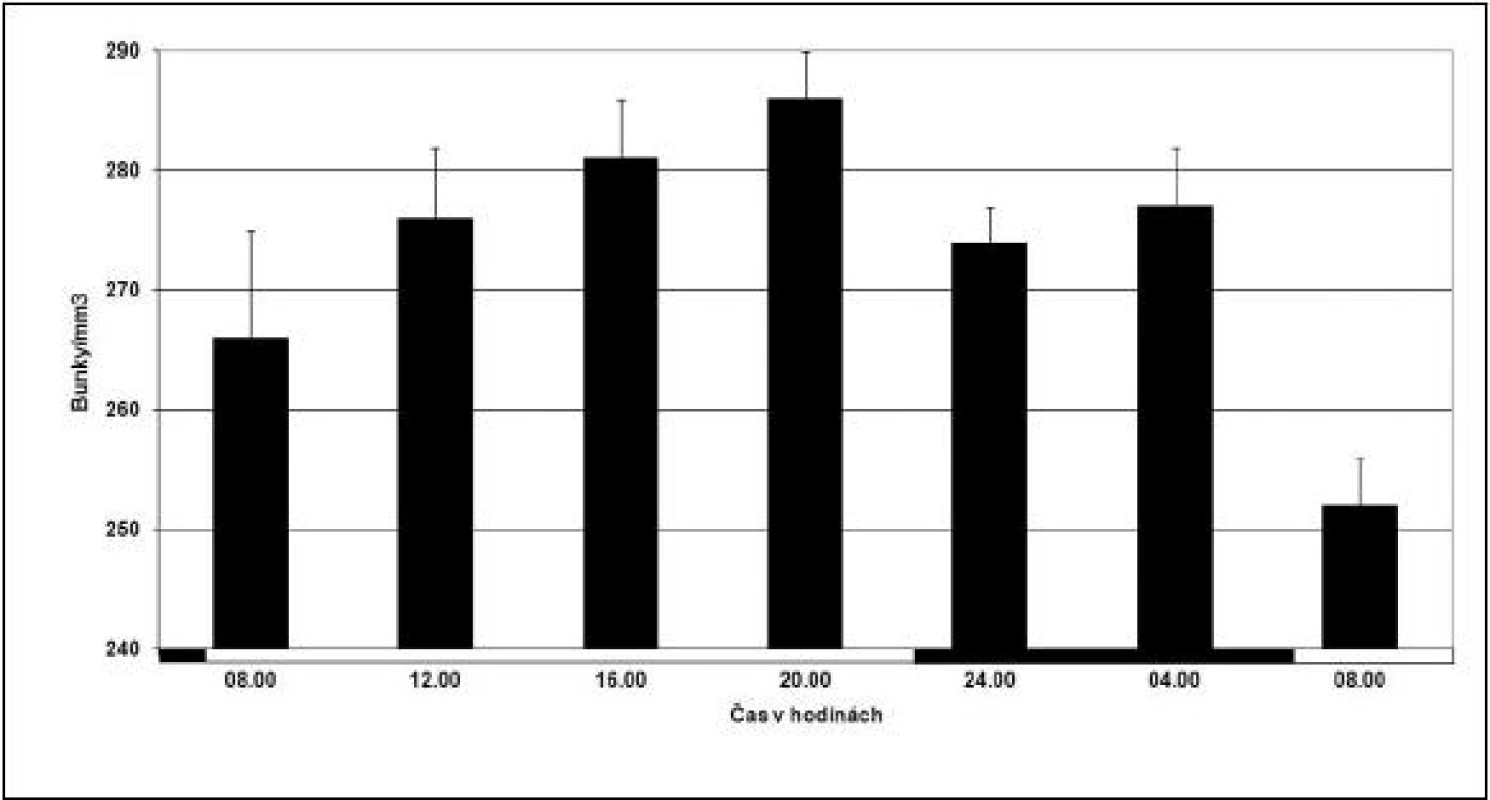
Zvýšená aktivita doštičiek teda signifikantne zvyšuje riziko tromboembólie ráno, medzi 05 : 00 a 09 : 00 hodinou (19). β-thromboglobulin, indikátor aktivity doštičiek, vykazuje cirkadiánny rytmus s maximálnou koncentráciou okolo 06 : 00 hodiny a s nízkymi hodnotami medzi poludním a polnocou. Tento rytmus je identický s cirkadiánnou variáciou proteínu S (PS), proteínu C (PC) a prozápalového cytokinínu IL-6 (20). Inhibícia funkcie doštičiek melatonínom je väčšia večer ako ráno (21). Hormón melatonín vylučovaný epifýzou primárne počas tmavej časti rozsahu dňa je hormónom, ktorý synchronizuje endogénne rytmy s rytmom striedania sa svetla a tmy, teda s rytmom vonkajšieho prostredia. Informácie o cirkadiánnej periodicite iných biochemických faktorov doštičiek, zahrňujúc serotonín, doštičkový faktor 4 a 11-dehydrotromboxan B2, sa rozchádzajú.
Cirkadiánny rytmus funkčnej reaktivity trombocytov je odlišný od rytmu v počte doštičiek nachádzajúcich sa v cirkulácii. U ľudí aktívnych počas dňa, sa maximálna aktivácia trombocytov nachádza medzi 06 : 00 a 09 : 00 hodinou (20). Podobne in vitro, adhezivita doštičiek meraná ich retrakciou na sklo, vykazuje maximálnu retrakciu počas ranných hodín (18).
In vitro, agregácia doštičiek v rôznych médiach (ADP, adrenalín a kolagén) je najväčšia v neskorých nočných hodinách (18), alebo skoro po prebudení sa (23), nezávisle na vzpriamenom postoji (24) alebo v spojení so značným nárastom plazmatickej koncentrácie katecholamínov (25). U klinicky zdravých ľudí, blokátory doštičkových α2-adrenoreceptorov rušia ranný nárast v aktivácii doštičiek. To poukazuje na skutočnosť, že existujú cirkadiánne a reaktívne zmeny v adrenergnej aktivite a že tieto zmeny sú pravdepodobne zodpovedné za cirkadiánne kolísanie vo funkciách doštičiek (25).
Agregácia bielych krviniek a zmeny v statuse voľných radikálov sú taktiež zahrnuté v patogenéze tromboembolických príhod (26). Napríklad, agregácia bielych krviniek vykazuje cirkadiánnu periodicitu s vyššími hodnotami agregácie medzi polnocou a 04 : 00 hodinou a najnižšou agregáciou o 09 : 00 hodine.Cirkadiánny rytmus v agregácii bielych krviniek u pacientov so stabilnou ischemickou chorobou srdca vykazuje najväčší nárast medzi 08 : 00 hodinou a poludním, čo môže byť predispozíciou mikrocirkulačnej oklúzie. Taktiež, koncentrácia voľných radikálov je v tomto čase vysoká. Najnižšie úrovne thiolu (plazmatického odstraňovača voľných radikálov) sú o 04 : 00 hodine. Tieto faktory, pôsobiace spolu alebo oddelene, môžu byť predpokladom pre vznik trombózy v ranných hodinách, teda na začiatku dennej aktivity (27).
Rytmy v koncentrácii a/alebo v aktivite koagulačných faktorov
Taktiež boli zistené cirkadiánne rytmy v niektorých faktoroch vnútorného a vonkajšieho systému koagulačnej kaskády. Koncentrácia antigénového faktora a aktivita faktora sú z cirkadiánneho pohľadu dva rôzne parametre, kde sa musí robiť rozdiel. Napríklad, aktivita faktora VII vykazuje značnú cirkadiánnu rytmicitu s najvyššími hodnotami medzi 08 : 00 hodinou a poludním, ale neplatí to pre koncentráciu antigénového faktora VII (28). Vrchol aktivity faktorov VIII a IX bol popísaný okolo 09 : 00 hodine (18, 29) (obr. 2).
Obr. 2. Cirkadiánna variácia v aktivite faktora VIII u 10 klinicky zdravých ľudí. Každý stĺpec reprezentuje skupinovú akrofázu s 95% konfidenčným intervalom. Tmavé prúžky na osi x reprezentujú čas spánku a prázdne prúžky čas bdenia. (prevzaté a modifikované z Haus, /22/). 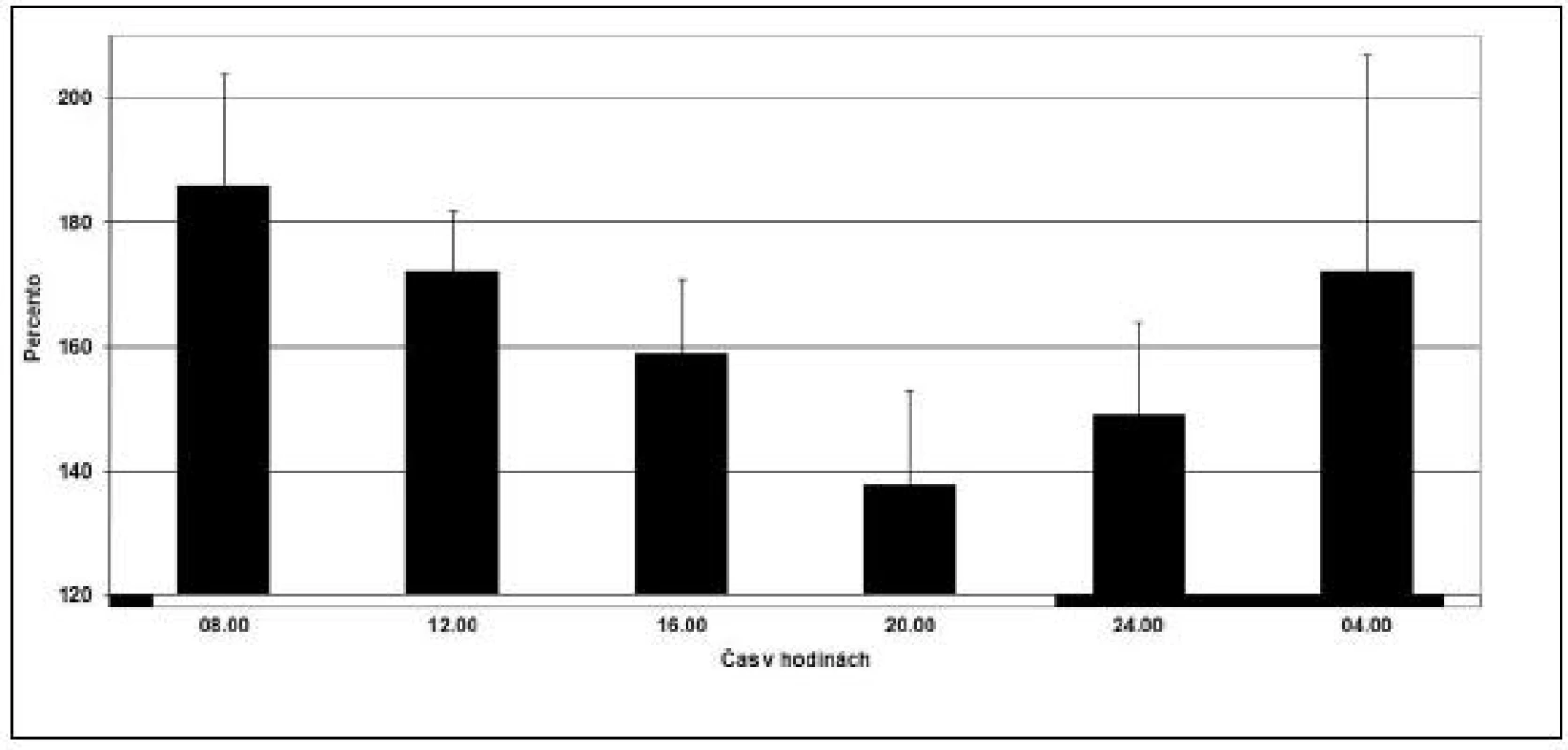
Protrombínový čas (PT), miera faktorov vonkajšieho a spoločného hemokoagulačného systému (faktory VII, X, V, II a I) a aktivovaný parciálny tromboplastínový čas (aPTT), miera vnútorného a spoločného systému koagulačnej kaskády (faktory XII, XI, IX, VIII, X, V, II a I) vykazujú svoje najnižšie hodnoty ráno. Hodnoty PT, aPTT a trombínového času (TT – miera premeny fibrinogénu na fibrín) dosahujú približne 10% rozdiel medzi 08 : 00 a 16 : 00 hodinou (18). Vyzerá to ako dôsledok vrcholu aktivity niektorých faktorov koagulačnej kaskády v tomto čase dňa.
Sezónna variácia v hemostatických parametroch je podľa niektorých autorov identická s incidenciou ischemických a hemorhagických príhod počas roka. Koncentrácia plazmatického fibrinogénu u zdravých starších ľudí s vysokým tlakom krvi, bola najvyššia počas zimy (30). Naopak, v štúdii na starších ľuďoch, bez ohľadu na tlak krvi, Kanabrocki a spol. (31) zistili najvyššiu koncentráciu fibrinogénu v máji a júni. Parametre globálnej fibrinolytickej koagulácie vykazujú nízko amplitúdovú sezónnu (cirkanuálnu) variáciu. Hoci to môže mať patofyziologický význam, nemá to žiadnu diagnostickú hodnotu (32).
Cirkadiánne rytmy vo fibrinolytickom systéme
U zdravých ľudí, aktivácia koagulačnej kaskády je doprevádzaná nárastom fibrinolytickej aktivity, ktorá určuje hranicu koagulačného procesu a zabraňuje vaskulárnej oklúzii. Fibrinolytický systém, zložený z plazmínu, aktivátorov a inhibítorov plazminogénu, reprezentuje dôležitý endogénny obranný mechanizmus na predchádzanie intravaskulárnej trombózy.
V klinickej praxi je cirkadiánny rytmus fibrinolýzy dlho známy a dokumentovaný.Rosing a spol.(33) popísali cirkadiánny rytmus v celkovej fibrinolytickej aktivite u denne aktívnych, klinicky zdravých osôb, s najvyššou fibrinolytickou aktivitou popoludní. Kofoed a spol. (34) zase poukazujú, že aktivácia fibrinolýzy síce kolíše v cirkadiánnej závislosti, no s maximálnym efektom v raňajších hodinách a minimálnym popoludní. Tento endogénny cirkadiánny rytmus môže byť maskovaný spolupôsobiacimi vonkajšími faktormi, ktoré aktivujú fibrinolýzu.
Plazminogén, prekurzor molekuly fibrinolytického enzýmu plazmínu, je aktivovaný prednostne tkaninovým aktivátorom plazminogénu (tPA), ktorý je spätne inhibovaný špecifickými a rýchlo pôsobiacimi inhibítormi aktivátora plazminogénu (obr. 3).
Obr. 3. Cirkadiánna variácia aktivity tkanivového aktivátora plazminogénu. Tmavé prúžky na osi x reprezentujú čas spánku. (prevzaté a modifikované z Andreotti a Kluft /38/). 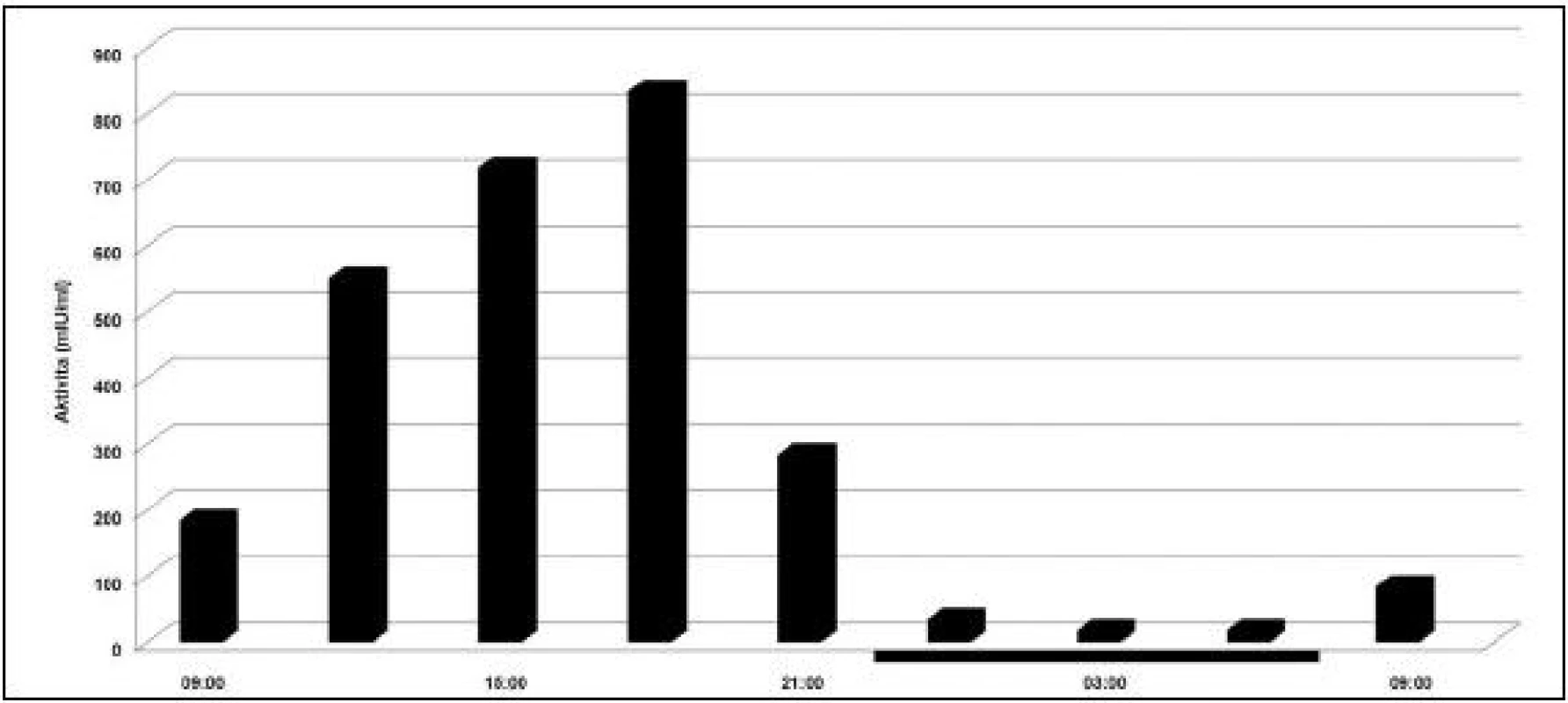
Najdôležitejším inhibítorom je inhibítor typu I (PAI-I) aktivátora plazminogénu, ktorý je produkovaný endotelovými bunkami cievy, pečeňou, tukovým tkanivom (35), doštičkami (36) a ktorý je prítomný v cirkulácii (37).
Cirkadiánny rytmus cirkulujúceho plazmatického PAI-1 a jeho aktivity je charakteristický veľkou opakovateľnosťou a vysokou amplitúdou (obr. 4). Tento cirkadiánny rytmus určuje 24-hodinovú variáciu v celkovej fibrinolytickej aktivite, pričom nezávisí od cirkadiánnej variácie v aktivite cirkulujúceho tPA (38). Periférný cirkadiánny oscilátor nachádzajúci sa v endotelových bunkách je citlivý na regulačné zásahy nadradených centier v hypotalame (39). Naviac podlieha internej a externej desynchronizácii, ako napríklad pri smenovej práci alebo po prelete cez viaceré časové zóny.
Obr. 4. Cirkadiánna variácia aktivity inhibítora typu I (PAI-I) aktivátora plazminogénu. Tmavé prúžky na osi x reprezentujú čas spánku. (prevzaté a modifikované z Andreotti a Kluft /38/). 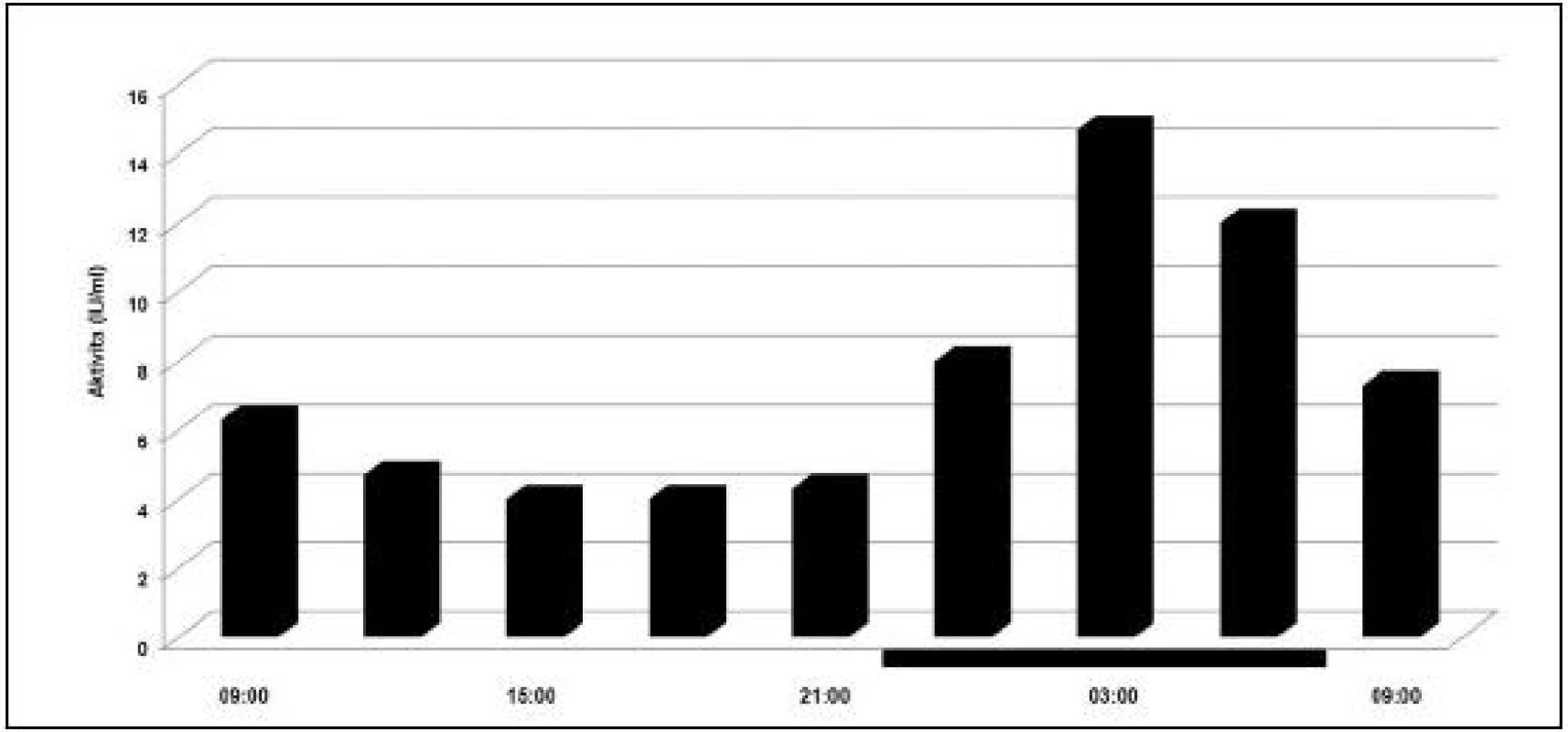
Existuje veľká interindividuálna variácia v rozsahu cirkadiánnej variácie v PAI-1 antigéne a jeho aktivite. To môže viesť k rozdielnemu riziku vo vývoji tromboembolických príhod najmä v ranných hodinách. Experimentálne a klinické štúdie predpokladajú, že polymorfizmus génu pre PAI-1 (4G/5G) môže priamo ovplyvňovať cirkadiánnu expresiu PAI-1 génu. Cirkadiánna variácia v aktivite PAI-1 je prednostne vo vzťahu k alele 4G PAI-1 génu. Homozygotnosť 4G PAI-1 génu je vo vzťahu k najvyššiemu vrcholu v PAI-1 aktivite v ranných hodinách. U heterozygotov je najvyššia koncentrácia PAI-1 (alebo jeho aktivita) v ranných hodinách sprostredkovaná 4G/5G a najnižšia u homozygótnych osôb pre 5G (40). Tieto rozdiely môžeme vidieť akrofázach cirkadiánnych rytmov len ráno, no strácajú sa na popoludnie (41). Rozdiely v zygozite génu PAI-1 môžu byť príčinou relatívneho rizika vývoja tromboembolických príhod počas časového vrcholu cirkadiánneho rytmu v PAI-1 aktivite. Zvýšená aktivita sympatikového systému a zvýšená aktivita systému hypotalamus-epifýza-dreň nadobličiek zvyšujú koncentráciu PAI-1, indikujúc tak pokles fibrinolýzy (42).
Fibrinolýza taktiež vykázala cirkaseptálne (okolo 7 dní) variácie s minimom v pondelok a s maximom medzi utorkom a štvrtkom (43) so zrkadlovou incidenciou tromboembolických príhod počas týždňa (44). Riziko tromboembolických príhod v pondelok môže byť posilnené predpokladaným endogénnym cirkaseptálnym rytmom v plazmatickej koncentrácii fibrinogénu, s najvyššími hodnotami počas víkendu (31).
Závery
Záverom môžeme povedať, že akýkoľvek analytický prehľad o úlohe rytmov v hematológii, pochopenie jeho časovej štruktúry ako aj dôsledkov, ktoré môžu vzniknúť zo zmeny rovnováhy spôsobenej periodicitou jednej alebo viacerých premenných, či dôsledkov spôsobenými patológiou alebo liečbou, musí jednoznačne viesť k syntéze chronobiologických poznatkov najmä o procesoch ako je hemopoéza, hemostáza a fibrinolýza.
Bunky kostnej drene sú citlivejšie v určitom čase na hemopoetické rastové faktory a špecifické cytotoxické lieky pôsobiace na bunkový cyklus. Preto poznanie cirkadiánneho rytmu bunkovej proliferácie v kostnej dreni cicavcov môže viesť k výraznejším liečebným efektom na kostnú dreň. Cyklické variácie v ich frekvenciách budú potom pravdepodobne smerovať k vývoju chronofarmakológie hemopoetického a imunitného systému. Teda čas podania fyzikálnych, chemických alebo biologických látok, ktorých bioaktivita v dreňových prekurzoroch závisí na fáze bunkového cyklu, je významný a predpovedateľný.
Výskum časovej organizácie hemostatického systému môže podať dôležitú informáciu o fyziológii a patológii hemostatického systému. Zhodnosť v raňajších vrcholoch cirkadiánnych rytmov vaskulárnych faktorov spúšťajúcich trombózu, funkcií doštičiek, úrovne katecholamínov, niektorých koagulačných faktorov a minimálnou aktivitou fibrinolýzy, vedie k opakovaniu sa prechodného rizikového stavu pre tromboembolické príhody. Ide o akútny infarkt myokardu, hlboká venózna trombóza a ataky, ktoré sa najčastejšie vyskytujú počas úvodných hodín dennej aktivity. Veľmi dôležitá je skutočnosť, že časovanie prechodného rizikového stavu závisí na synchronizácii pacienta a nie na hodine. Komplexnosť cirkadiánnej časovej organizácie naznačuje požiadavky na dizajn protokolu, zahrňujúc frekvenciu odberu krvi na získanie plnovýznamových výsledkov v štúdii cirkadiánneho rytmického chovania hemostatického systému.
Taktiež by mala byť braná do úvahy interakcia endogénnych rytmov s faktormi prostredia. Porozumenie medzihry medzi prostredím, centrálnymi a periférnymi oscilátormi a pochopenie komplexnosti rytmických interakcií v hemostatickom systéme, nie len u zdravých ľudí, ale aj pri hemostatických poruchách, môže pomôcť vhodnému doporučeniu lieku a farmakoterapie.
Doc. RNDr. Pavol Švorc, CSc.
Ústav fyziológie, Lekárska fakulta UPJŠ
Tr. SNP 1
040 01 Košice
Slovenská republikaDoručeno do redakce: 8. 10. 2011
Přijato po recenzi: 21. 3. 2011
Zdroje
1. Steinbach G, Hilfenhaus M, Von Mayersbach H, et al. Circadian influences in clinical values in man. Arch Toxicol 1976; 36 : 317-325.
2. Boning D, Schweigart U, Kunze M. Diurnal variations of protein and electrolyte concentrations and of acid base status in plasma and red cells of normal man. Eur J Appl Physiol Occup Physiol 1974; 32 : 239-250.
3. Jones AR, Twedt D, Swaim W, et al. Diurnal change of blood count analytes in normal subjects. Amer J Clin Pathol 1996; 106 : 723-727.
4. Touitou Y, Bogdan A, Haus E, et al. Modifications of circadian and circannual rhythms with aging. Exp Gerontol 1997; 32 : 603-614.
5. McKee LC, Johnson LE, Lange RD. Circadian variation in reticulocyte counts and immuno detectable erythropoietin titers. Proc Soc Exp Biol Med 1974; 145 : 1284-1287.
6. Gunga HC, Kirsch KA, Roecker L, et al. Erythropoietin regulations in humans under different environmental and experimental conditions. Respir Physiol Neurobiol 2007; 158 : 287-297.
7. De Nicola P, Casale G, Riccotti MP, et al. Circadian rhythms of blood components in dementia senilis. Folia Haematologica: Internationales Magazin fur klinische und morphologische Blutforschung 1984; 111 : 782-787.
8. Melchart D, Martin P, Hallek M, et al. Circadian variation of the phagocytic activity of polymorphonuclear leukocytes and of various other parameters in 13 healthy male adults. Chronobiol Int 1992; 9 : 35-45.
9. Swoyer J, Irvine P, Sackett-Lundeen L, et al. Circadian hematologic time structure in the elderly. Chronobiol Int 1989; 6 : 131-137.
10. Barkova EN, Nazarenko EV. Circadian dynamics of monocyte phagocytic activity in women during lactation complicated by iron deficiency. Bull Exp Biol Med 2005; 140 : 29-32.
11. Wood PA, Hrushesky WJM, Klevecz R. Distinct circadian time structures characterize myeloid and erythroid progenitor and multipotential cell clonogenicity as well as marrow precursor proliferation dynamics. Exp Hematol 1998; 26 : 523-533.
12. Mendez-Ferrer S, Chow A, Merad M, et al. Circadian rhythms influence hematopoietic stem cells. Curr Opinion Hematol 2009; 16 : 235-242.
13. Smaaland R, Sothern RB, Laerum OD, et al. Rhythms in human bone marrow and blood cells. Chronobiol Int 2002; 19 : 101-127.
14. Abrahamsen JF, Sothern RB, Sandberg S, et al. Circadian variations in human peripheral blood on days with and without bone marrow sampling and relation to bone marrow cell proliferation. Biol Rhythm Res 1999; 30 : 29-53.
15. Manfredini R, Boari B, Smolensky MH, et al. Review: Circadian variation in stroke onset: Identical temporal pattern in ischemic and hemorrhagic events. Chronobiol Int 2005; 22 : 417-453.
16. Anderson N, Feigin V, Bennett D, et al. Diurnal, weekly, and seasonal variations in stroke occurrence in a population-based study in Auckland, New Zealand. N Z Med J 2004; 117: U1078.
17. Ameriso SF, Mohler JG, Suarez M, et al. Morning reduction of cerebral vasomotor reactivity, Neurology 1994; 44 : 1907-1909.
18. Haus E, Cusulos M, Sackett-Lundeen L, Swoyer J. Circadian variations in blood coagulation parameters, alpha-antitrypsin antigen and platelet aggregation and retention in clinically healthy subjects. Chronobiol Int 1990; 7 : 203-216.
19. Dalby MC, Davidson SJ, Burman JF, Davies SW. Diurnal variation in platelet aggregation with the PFA-100 platelet function analysis. Platelets 2000; 11 : 320-324.
20. Ündar L, Ertugrul C, Altunbas H, et at. Circadian variations in natural coagulation inhibitors protein C, protein S and antithrombin in healthy men: a possible association with interleukin-6. Thromb Haemost 1999; 81 : 571-575.
21. Del Zar MM, Martinuzzo M, Falcon C, et al. Inhibition of human platelet aggregation and thromboxane-B2, production by melatonin evidence for a diurnal variation. J Clin Endocrinol Metab 1990; 70 : 246-251.
22. Haus E. Chronobiology of hemostasis and inferences for the chronotherapy of coagulation disorders and thrombosis prevention. Adv Drug Deliv Rev 2007; 59 : 966-984.
23. Jafri SM, VanRollins M, Ozawa T, et al. Circadian variation in platelet function in healthy volunteers. Amer J Cardiol 1992; 69 : 951-954.
24. Jovicic A, Mandic S. Circadian variations of platelet aggregability and fibrinolytic activity in healthy subjects. Thromb Res 1991; 62 : 65-74.
25. Andrews NP, Goldstein DS, Quyyumi AA. Effect of systemic alpha-2 adrenergic blockade on the morning increase in platelet aggregation in normal subjects. Am J Cardiol 1999; 84 : 316-320.
26. Belch JJF. The role of the white blood cell in arterial disease. Blood Coagul Fibrinolysis 1990; 1 : 183-192.
27. Bridges AB, Fisher TC, Scott N, et al. Circadian rhythm of white blood cell aggregation and free radical status in healthy volunteers. Free Radic Res Commun 1992; 16 : 89-97.
28. Kapiotis S, Jilma B, Quehenberger P, et al. Morning hypercoagulability and hypofibrinolysis. Circulation 1997; 96 : 19-21.
29. Iversen PO, Groot PDE, Hyeltnes N, et al. Impaired circadian variations of haemostatic and fibrinolytic parameters in tetraplegia. Br J Haematol 2002; 119 : 1011-1016.
30. Hermida RC, Calvo C, Ayala DE, et al. Seasonal variation in plasma fibrinogen in dipper and non-dipper patients with mild-moderate essential hypertension. Med Clin (Barc) 2003; 121 : 6-11.
31. Kanabrocki EL, Sothern RB, Bremner WF, et al. Weekly and yearly rhythms in plasma fibrinogen in hospitalized male military veterans. Am J Cardiol 1995; 76 : 628-631.
32. Hodoglugil U, Gunaydin B, Yardim S, et al. Seasonal variation in the effect of a fixed dose of heparin on activated clotting time in patients prepared for open-heart surgery. Chronobiol Int 2001; 18 : 865-873.
33. Rosing DR, Brakman P, Redwood DR, et al. Blood fibrinolytic activity in man: diurnal variation and the response to varying intensities of exercise. Circ Res 1970; 27 : 171-184.
34. Kofoed KF, Gleerup G, Hedman C, et al. The circadian variation in fibrinolytic activity is not related to posture. Thromb Res 1994; 73 : 447-450.
35. Chomiki N, Henry M, Alessi MC, et al. Plasminogen activator inhibitor-1 expression in human liver and healthy or atherosclerotic vessel walls. Thromb Haemost 1994; 72 : 44-53.
36. Brogren H, Karlsson L, Andersson M, et al. Platelets synthesize large amounts of active plasminogen activator inhibitor 1. Blood 2004; 104 : 3943-3948.
37. Sprengers ED, Kluft C. Plasminogen activator inhibitors. Blood 1987; 69 : 381-387.
38. Andreotti F, Kluft C. Circadian variation of fibrinolytic activity in blood. Chronobiol Int 1991; 8 : 336-351.
39. McNamara P, Seo SP, Rudic RD, et al. Regulation of CLOCK and MOP4 by nuclear hormone receptors in the vasculature: a humoral mechanism to reset a peripheral clock. Cell 2001; 105 : 877-889.
40. Hoekstra T, Geleijnse JM, Schouten EG, et al. Diurnal variation in PAI-1 activity predominantly confirned to the 4G-allele of the PAI-1 gene. Thromb Haemost 2002; 88 : 794-798.
41. Van der Bom JG, Bots ML, Haverkate F, et al. The 4G5G polymorphism in the gene for PAI-1 and the circadian oscillation of plasma PAI-1. Blood 2003; 101 : 1841-1844.
42. Von Kanel R, Jain S, Mills PJ, et al. Relation of nocturnal blood pressure dipping to cellular adhesion, inflammation and hemostasis. J Hypertens 2004; 22 : 2087-2093.
43. Imeson JD, Meade TW, Steward GM. Day by day variation in fibrinolytic activity and in mortality from ischemic heart disease. Int J Epidemiol 1987; 16 : 626-627.
44. Nicolau GY, Haus E, Popescu M, et al. Circadian, weekly, and seasonal variations in cardiac mortality, blood pressure, and catecholamine excretion. Chronobiol Int 1991; 8 : 149-159.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2011 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
-
Chronická myeloidní leukemie
Doporučení pro diagnostiku, monitorování a léčbu CML u dospělých, aktualizovaná verze 2011 (střed časopisu) - Životní jubileum MUDr. Vladimír Kulich
- Iron chelation therapy with deferasirox in patiens with aplastic anemia: a subgroup analysis of 116 patients from the EPIC trial
- Pharmacokinetic, pharmacodynamic and pharmacogenetic determinants of osteonecrosis in children with acute lymphoblastic leukemia
- Randomized, double-blind trial of fluconazole versus variconazole for prevention of invasive fungal infection after allogeneic hematopoietic cell transplantation
- Kdy vyšetřovat vrozená trombofilní rizika u dětí?
- Klinický význam génových mutácií u akútnych myeloidných leukémií s normálnym karyotypom
- Kazuistika: sekundární trombocytopenie a diseminovaná intravaskulární koagulace u pacienta s generalizovaným adenokarcinomem colon descendens
- Markery buněčného poškození trombocytů u směsných trombocytových transfuzních přípravků v aditivních roztocích
- „Stanovení rezistence na clopidogrel pomocí vícenásobné impedanční a optické transmisní agregometrie“
- Does microgranular variant morphology of acute promyelocytic leukemia independently predict a less favorable outcome compared with classical M3 APL? A joint study of the North American Intergroup and the PETHEMA Group
- Chronobiologické aspekty v hematológii
-
Chronická myeloidní leukemie
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle-
Chronická myeloidní leukemie
Doporučení pro diagnostiku, monitorování a léčbu CML u dospělých, aktualizovaná verze 2011 (střed časopisu) - Klinický význam génových mutácií u akútnych myeloidných leukémií s normálnym karyotypom
- Kazuistika: sekundární trombocytopenie a diseminovaná intravaskulární koagulace u pacienta s generalizovaným adenokarcinomem colon descendens
- „Stanovení rezistence na clopidogrel pomocí vícenásobné impedanční a optické transmisní agregometrie“
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



