-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Rezistence na imatinib a možnosti využití vyššího dávkování léku u pacientů s chronickou myeloidní leukemií
Resistance to imatinib and the possibilities of use of the dose escalation of the drug in patients with chronic myeloid leukemia
The introduction of imatinib into the treatment of chronic myeloid leukemia represents a revolutionary therapeutic approach. Together with its excellent results, the issue of imatinib resistance – the significant cause of therapeutic failure – has emerged. The authors pay attention to the relation of the mechanism of action, pharmacokinetics and pharmacodynamics to the imatinib treatment results in the scale ranging from the BCR-ABL transcript reduction to the overall survival. In addition, the most frequent mechanisms of imatinib resistance, particularly the data about the BCR-ABL kinase domain mutations are summarized and the possibilities of the management of this problem are discussed. Besides the dose escalation of imatinib the new promising agents, particularly dasatinib and nilotinib are presented and discussed.
Key words:
chronic myeloid leukemia, imatinib, resistance to imatinib, BCR-ABL, BCR-ABL kinase domain mutations, dasatinib, nilotinib
Autoři: J. Mayer 1; H. Klamová 1; D. Žáčková 1; M. Doubek 1; P. Cetkovský 1; M. Krejčí 1; D. Dvořáková 1
Působiště autorů: za organizaci Česká leukemická skupina - pro život, The CzEch Leukemia Study Group – for Life, CELL ; Interní hematoonkologická klinika FN Brno, 2Ústav hematologie a krevní transfuze, Praha 1
Vyšlo v časopise: Transfuze Hematol. dnes,13, 2007, No. 3, p. 133-141.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Zavedení imatinibu do terapie chronické myeloidní leukemie představuje revoluci v léčbě tohoto onemocnění. Spolu s výbornými výsledky, které jsou jím dosahovány, se však do popředí zájmu dostává problematika rezistence na imatinib, zodpovědná za významnou část terapeutických selhání. Autoři si v následujícím sdělení všímají vztahů mezi poznanými fakty o mechanismu účinku léku, jeho farmakokinetice a farmakodynamice a dosaženými léčebnými výsledky ve škále od molekulárně biologického efektu na redukci BCR-ABL transkriptů až po data o celkovém přežití pacientů. Současně jsou shrnuta data o nejčastějších mechanismech rezistence na imatinib, zejména o mutacích v kinázové doméně BCR-ABL, a probrány možnosti terapeutického zvládnutí tohoto problému. Kromě navýšení dávky imatinibu jsou především představeny a diskutovány nové slibné léky, zejména dasatinib a nilotinib.
Klíčová slova:
chronická myeloidní leukemie, imatinib, rezistence na imatinib, BCR-ABL, mutace BCR-ABL kinázové domény, dasatinib, nilotinibÚvod
The findings suggest a causal relationship between the chromosome abnormality observed and chronic granulocytic leukemia. Těmito slovy zakončili svůj příspěvek do časopisu Science v roce 1960 autoři Nowell a Hungerford (1). Záměrně píšeme příspěvek, ne článek. Tvořily jej totiž pouze dva odstavečky nezabírající ani třetinu stránky. Tato práce přitom otevřela cestu k prvnímu skutečně modernímu léku pro terapii chronické myeloidní leukemie (CML). Po téměř 40 letech se objevil zcela nový preparát, imatinib, jehož mechanismus účinku je založen na hlubokých znalostech molekulární patogeneze této choroby. O vývoji tohoto léku jsme již na stránkách českého písemnictví referovali již záhy poté, co se imatinib dostal do klinické praxe (2). Za krátkou dobu se ale nashromáždilo tolik nových poznatků, že považujeme za užitečné na toto sdělení navázat. Pokusíme se přiblížit některá data o účinnosti tohoto léku, zejména pak data představující nové obzory v poznání a léčbě CML a dramatický a rychlý pokrok ve velmi nedávné době. Článek je pojat jako edukační hlavně pro širší hematologickou obec, která se bezprostředně s touto problematikou nesetkává. Proto se omezíme jen na základní citace.
Vazba imatinibu na BCR-ABL protein
Imatinib funguje jako kompetitivní inhibitor vazby ATP na ABL kinázu BCR-ABL proteinu. Schematicky je mechanismus účinku této malé molekuly prezentován na obrázku 1. Díky krystalografickým studiím je precizně znám i prostorový vztah imatinibu k BCR-ABL proteinu. Ten má naprosto zásadní význam pro pochopení rezistence na tento lék a také pro navrhování jiných, účinnějších preparátů. Imatinib je ve velmi intimním vztahu právě s kinázovou doménou, s jejími ne více než 21 aminokyselinovými zbytky.
Obr. 1. Mechanismus působení imatinibu. BCR-ABL tyrozinkináza váže ATP a transferuje fosfát z ATP na tyrozinová rezidua různých substrátů, čímž mění jejich konformaci, a tím i funkci. Blokování místa pro navázání ATP blokuje i tyrozinkinázovou aktivitu. Upraveno podle O’Dwyer a Druker (3). 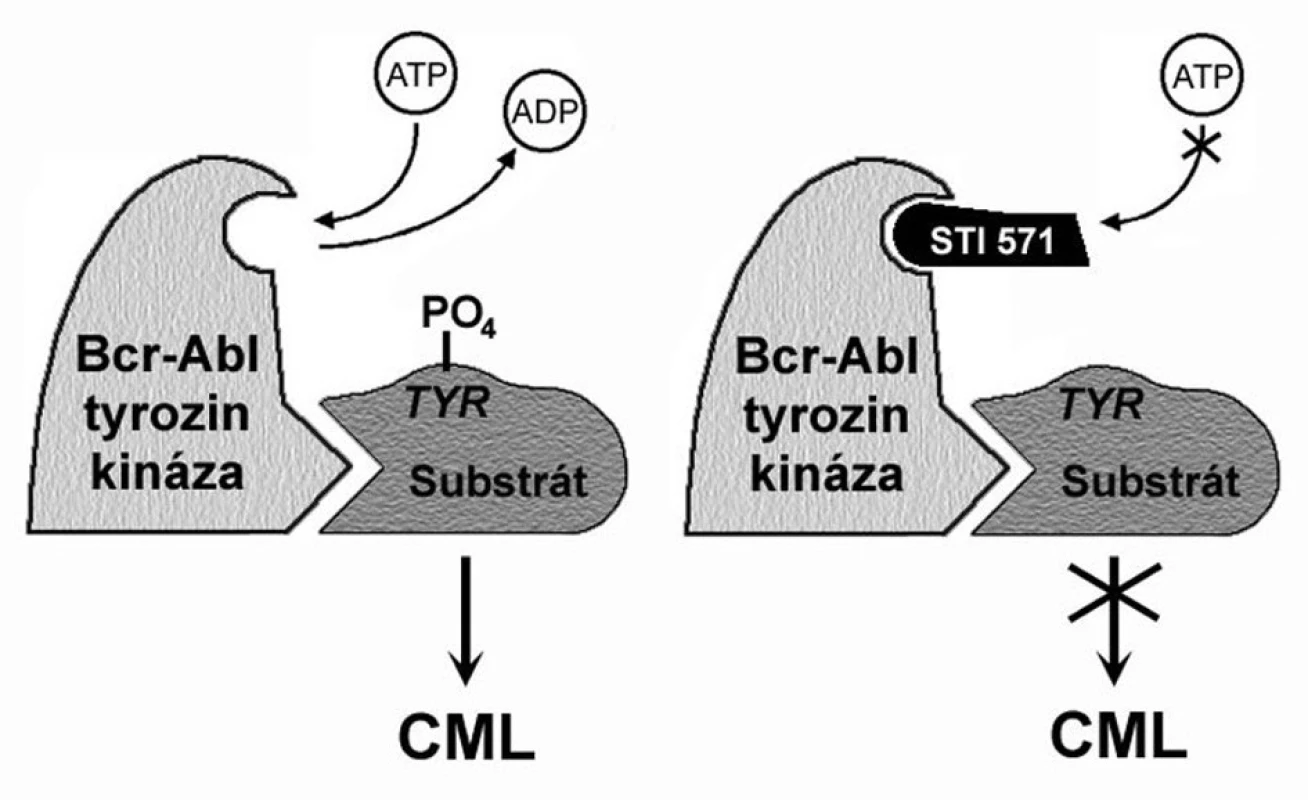
Na obrázku 2 je stuhová prostorová struktura ABL domény s imatinibem (4). Obrázek 3 potom zobrazuje celou situaci ještě podrobněji (5).
Obr. 2. Stuhová prostorová struktura ABL (modrá barva) s imatinibem (oranžová barva) a pro srovnání s jiným inhibitorem (PD 180970, červená barva, ABL zelená barva). A smyčka (fialová) v uzavřené poloze v případě imatinibu (část A obrázku), pro srovnání v otevřené poloze s jiným inhibitorem (část B obrázku). P smyčka (žlutá barva) je pohnuta inhibitorem v obou případech (viz také tab. 3). Upraveno dle Deininger et al. (4). 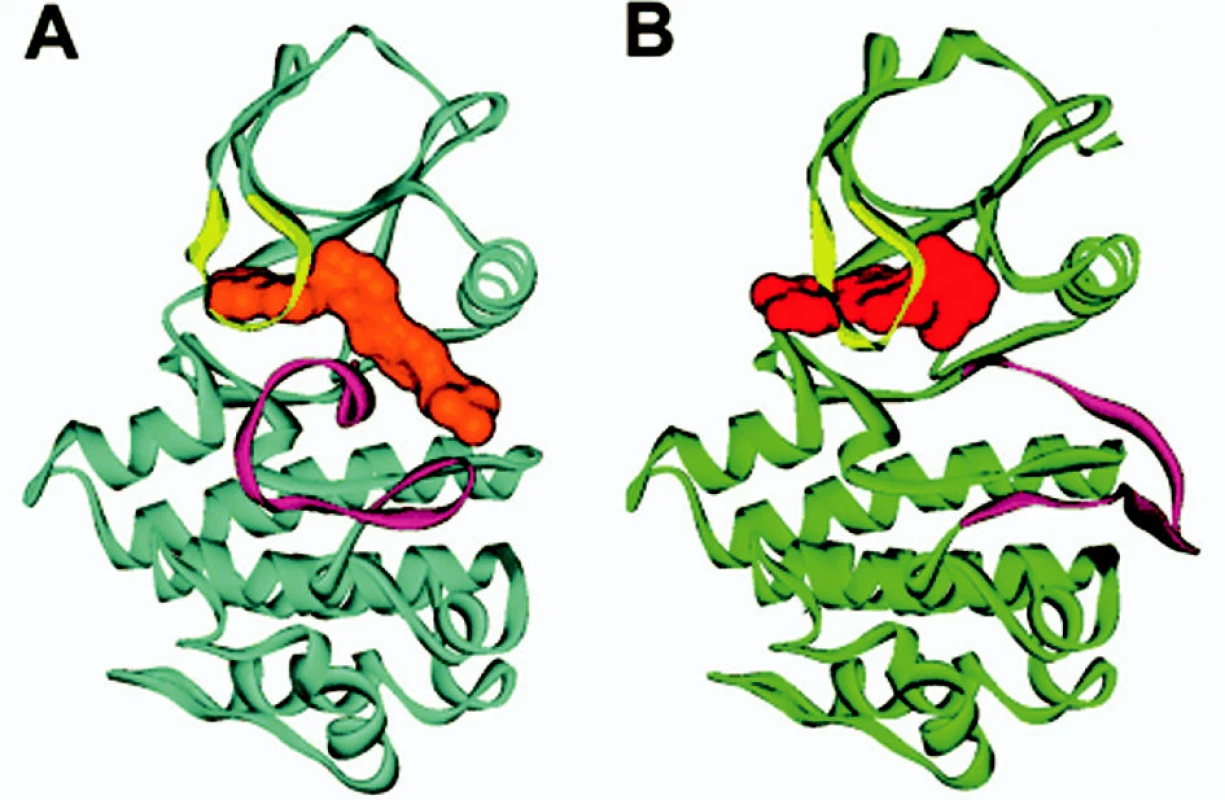
Obr. 3. Vazba imatinibu (mírně chemicky upraveného pro účely komplikovaných krystalografických studií) na ABL kinázu. Prostorový obrázek. Upraveno dle Schindler et al. (5). 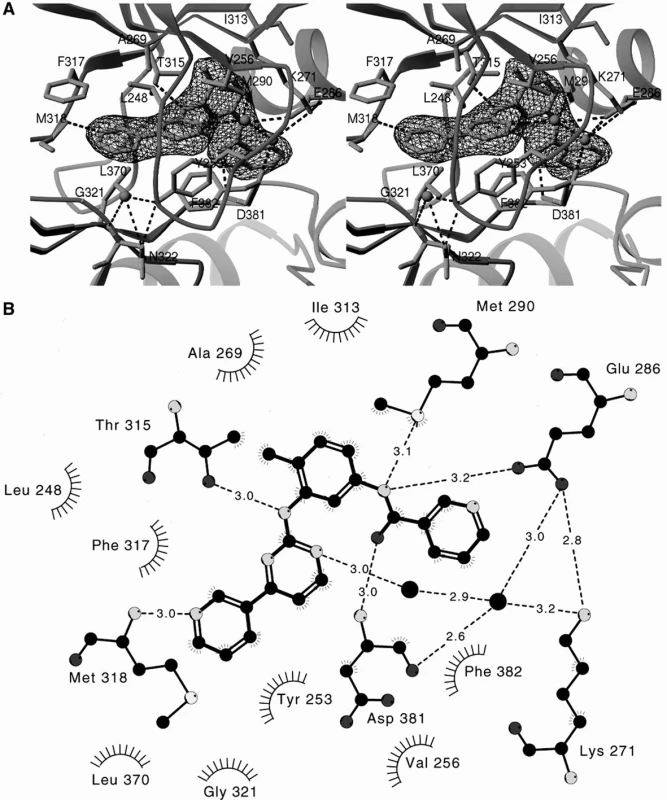
Z těchto podrobných poznatků na molekulární úrovni (4, 5) vyplývají některé zásadní informace, umožňující alespoň částečné vysvětlení rezistence na imatinib. P smyčka (ATP vázací smyčka) s aminokyselinovými zbytky 144 – 255 je extrémně flexibilní a normálně objímá fosfát ATP. Po vazbě imatinibu se její struktura změní a připojuje se vodíkovými můstky na tyrosin (Y) 253 a asparagin (N) 322. Pro správnou vazbu imatinibu je klíčový threonin (T) 315. Nejdůležitějším poznáním je, že imatinib se váže na ABL kinázu v její neaktivní konformaci, při níž A smyčka (activation loop), regulatorní element, není fosforylována a uzavírá katalytické centrum kinázy. V otevřené aktivní podobě smyčky se imatinib vázat nemůže. To je také zásadní pro velmi specifickou a selektivní vazbu imatinibu na ABL kinázu. V otevřené podobě mají totiž různé tyrozinkinázy podobnou strukturu. A smyčka obsahuje aminokyselinové zbytky 381–402 a její fosforylace pro aktivaci nastává na (Y) 393. Pro stabilizaci BCR-ABL v autoinhibované pozici, v níž se imatinib může navázat, je klíčová pozice methioninu 351.
Většina BCR-ABL pozitivních lidských buněčných linií je senzitivních na imatinib v koncentracích menších než 0,5 μmol/l (4).
Farmakokinetika imatinibu
Ve studii fáze I se testovala dávka imatinibu 25 mg až 1000 mg na den (6). Maximální tolerovatelné dávky nebylo dosaženo, což se dalo předpokládat, neboť nejde o klasickou neselektivní cytostatickou látku. Ze studie ale vyplynula zásadní farmakokinetická data (7). Maximální koncentrace imatinibu je dosaženo za 2-4 hodiny po perorálním požití. Poločas léku v plazmě je asi 15 hodin. Při opakovaném podávání se dosáhne při denní dávce nad 350 mg toho, že koncentrace léku v krvi neklesá pod 0,57 μg/ml (1,1 μmol/l). Toto je velmi důležité, neboť při léčbě by koncentrace léku neměla klesnout pod účinnou hladinu. Vztah mezi dávkou léku a hladinou v krvi je patrný z grafu 1.
Graf 1. Vztah mezi dávkou imatinibu a jeho hladinou v krvi při opakovaném podávání. Cílová koncentrace by měla být okolo 1 mmol/l (493,6 ng/ml). Upraveno dle Peng et al. (7). 
Vyjasněn je též vztah mezi dávkou léku a léčebnou odpovědí (graf 2).
Graf 2. Závislost mezi denní dávkou imatinibu a koncentrací bílých krvinek ve 28. dni léčby. Upraveno dle Peng et al. (7). 
Odpověď na imatinib v různých stadiích choroby
Již ze studií fáze I jednoznačně vyplynulo, že imatinib je daleko účinnější u méně pokročilých stadií choroby. Ze 38 pacientů s myeloidní blastickou krizíse jen u 4 dosáhlo kompletní hematologické remise a u dalších 17 došlo pouze k poklesu blastů v krvi. U 9 z těchto 21 nemocných s léčebnou odpovědí došlo posléze k relapsu choroby (8). Kantarjian a spol. (9) uvádějí přežití 22 % v prvním roce po diagnóze (graf 3).
Graf 3. Přežití nemocných v blastické krizi CML léčených imatinibem. Upraveno dle Kantarjian et al. (9). 
V jiné studii fáze I byl imatinib podáván u nemocných v chronické fázi po selhání terapie interferonem (6). Kompletní hematologické odpovědi bylo dosaženo u 53 z 54 pacientů, léčených dávkou vyšší než 300 mg. Cytogenetické odpovědi bylo dosaženo u 29 nemocných, včetně 17 s velkou cytogenetickou odpovědí (0–35 % Ph+ buněk), z nichž u 7 bylo dokonce dosaženo kompletní cytogenetické odpovědi.
Imatinib byl také testován v rozsáhlé randomizované studii IRIS (International Randomized Study of Interferon and STI 571) oproti kombinaci interferon alfa + cytosin-arabinosid u nově diagnostikovaných nemocných s CML v chronické fázi (celkem 1106 nemocných) (10). Většina pacientů, léčených kombinovanou terapií (89 %), nakonec celou studii nedokončila buď pro intoleranci léčby, nebo z důvodu odmítnutí dále ve studii pokračovat. Imatinib se ukázal jako daleko účinnější – viz tabulka 1. Imatinib byl také lépe tolerován. Pravděpodobnost přežívání bez progrese nemoci po 18 měsících léčby imatinibem byla 96,7 %, při kombinované terapii interferonem a cytarabinem 91,5 %.
Tab. 1. Srovnání léčebných odpovědí po terapii imatinibem a kombinované léčbě interferon alfa + cytosin-arabinosid podle výsledků IRIS studie. 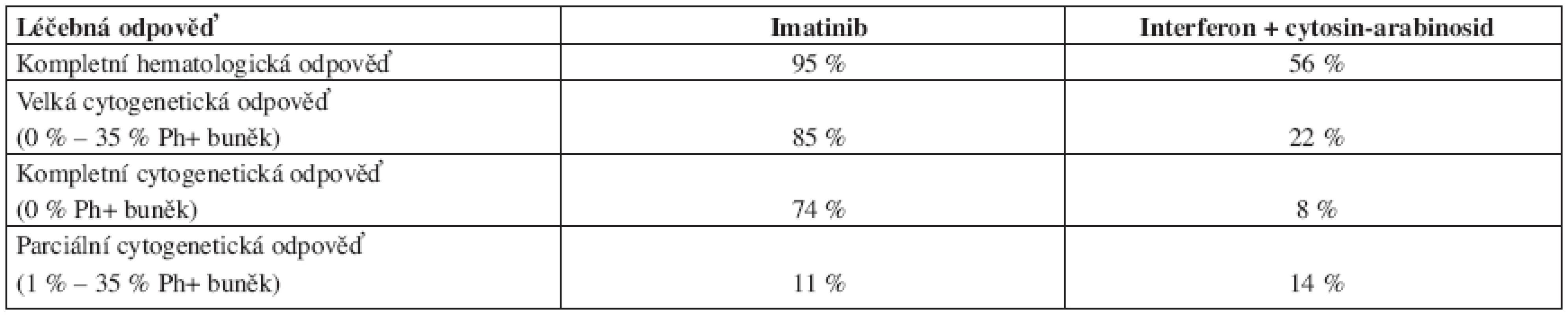
Další analýza dat této studie ukázala zásadní význam dosažení co nejlepší léčebné odpovědi (11, 12). Chimerický gen BCR-ABL byl kvantifikován jako poměr BCR-ABL/BCR. Hodnotil se pokles jeho kvantity po léčbě oproti výchozí hodnotě. Výsledky kvantitativního měření transkriptů BCR-ABL v periferní krvi byly vyjadřovány jako logaritmická (log) redukce oproti standardizovaným výchozím hodnotám neléčených pacientů. Při dosažení kompletní cytogenetické odpovědi bylo redukce BCR-ABL/BCR nejméně o 3 log dosaženo u 57 % nemocných léčených imatinibem, ale jen u 24 % nemocných na kombinované terapii. Vzhledem k tomu, že u pacientů na kombinované terapii se kompletní cytogenetické odpovědi dosahovalo méně často, byly výsledky této redukce BCR-ABL/BCR pro všechny nemocné daleko rozdílnější: 39 % pro imatinib a 2 % pro kombinovanou terapii. Pro nemocné, kteří dosáhli po 18 měsících terapie kompletní cytogenetické odpovědi a redukce BCR-ABL/BCR alespoň o 3 log, byla pravděpodobnost přežití bez progrese po 60 měsících 100 %. Nemocní, kteří sice dosáhli kompletní cytogenetické remise, ale ne tak hluboké redukce BCR-ABL/BCR, měli pravděpodobnost přežití bez progrese 98 % a pacienti bez kompletní cytogenetické remise jen 87 %. Kompletního vymizení transkriptu BCR-ABL bylo ale dosaženo jen u 4 % nemocných. Znamená to, že imatinib sice chorobu výrazně brzdí, ale nedokáže ji zcela eliminovat. Lepší léčebné odpovědi bylo dosaženo u nemocných s nižším skóre choroby podle Sokala (13). Význam dosažení kvalitní cytogenetické a velké molekulární odpovědi pro prognózu nemocných je patrný z grafu 4.
Graf 4. Význam dosažení velké molekulární odpovědi pro prognózu nemocných. Upraveno dle Druker et al. (12). 
Na výše uvedených výsledcích studie IRIS byly vidět vynikající výsledky v případě, že se imatinib použil u nově diagnostikovaných nemocných v chronické fázi – celkové přežití všech nemocných v 5 letech bylo vynikající – 89 %. Ale i u těchto pacientů byla léčebná odpověď velmi heterogenní. Je tedy jasné, že musí existovat nějaké mechanismy, které vedou k rezistenci na imatinib. Přehledně je situace ukázána na grafu 5.
Graf 5. Léčebná odpověď vyjádřená jako kompletní hematologická odpověď (CHR), kompletní cytogenetická odpověď (CCyR) a molekulární remise (MoR) u nemocných léčených imatinibem v monoterapii v různých stádiích CML. Upraveno dle Deininger et al. (4). Vysvětlivky: M-BC = myeloidní blastická krize, AP = akcelerovaná fáze, late CP = pozdní chronická fáze, CP = chronická fáze. 
Rezistence na imatinib
Tato problematika je v současnosti středem velkého zájmu. Podobných léků jako je imatinib bude přibývat a poznání molekulárních mechanismů rezistence na imatinib je tedy mimořádně důležité. Povede to také k novým léčebným strategiím směřujícím k zábraně rozvoje rezistence.
Rezistence na imatinib je komplexním fenoménem. Některé její mechanismy jsou nyní již prozkoumány a mají i klinický dopad. Ty budou probrány v následujícím textu. Existuje primární rezistence, neboli refrakterita, a sekundární rezistence (relaps), která se vyvíjí po předchozí příznivé léčebné odpovědi. Rezistence může být dále rozdělena na hematologickou, cytogenetickou a molekulární (14). Zvláště závažné je vysoké procento primárních molekulárních rezistencí charakterizované minimálním procentem nemocných, kteří dosáhnou negativity při molekulárně genetickém vyšetření BCR-ABL (PCR negativita).
U různých linií rezistentních buněk nebo na zvířecích modelech byly popsány různé mechanismy primárních molekulárních rezistencí, např.:
- mutace v kinázové doméně BCR-ABL
- větší exprese BCR-ABL proteinu pro amplifikaci BCR-ABLgenu
- zvýšená exprese MDR1 (multidrug resistance gene) a zvýšený export imatinibu z buněk
- zvýšené koncentrace AAG v plazmě (α-1-acid glyco-protein, bílkovina, která může vázat imatinib)
- aktivace BCR-ABL nezávislých signálních drah, např. příslušníky rodiny Src kináz (4, 15).
Klinicky významná rezistence má několik hlavních příčin, ale ty zdaleka nevysvětlují všechny rezistentní případy. Klinicky je pravděpodobně nejvýznamnější mutace v kinázové doméně BCR-ABL. Hochhaus et al. (14) nalezli u 7 z 55 pacientů nárůst exprese BCR-ABL (pomocí PCR), u 2 ze 32 pacientů genomickou amplifikaci BCR-ABL pomocí FISH, další přídavné chromozomální abnormality u 19 ze 36 pacientů a mutace v kinázové doméně BCR-ABL pak u 23 ze 66 pacientů. Možnosti vyšetřování rezistence na imatinib u nás shrnuli nedávno Naušová et al. (16).
V poslední době se také hodně hovoří o poslední možnosti ve výše zmíněném výčtu, o aktivaci BCR-ABL nezávislých signálních drah, např. příslušníky rodiny Src kináz. Tyto kinázy mají zřejmě rozhodující vliv v pozdějších stadiích choroby, fungují „nad“ a „pod“ dráhami BCR-ABL a jsou na BCR-ABL kináze nezávislé. Velmi zjednodušené schéma komplexních procesů odehrávajících se v nádorové buňce je na obrázku 4.
Obr. 4. Velmi zjednodušené schéma komplexních procesů odehrávajících se v nádorové CML buňce. Přenos onkogenních signálů BCRABL a rodinou Src kináz. Inhibiční efekt je vyznačen obráceným T. FAK = focal adhesion kinase; Grb-2 = growth factor receptor–bound protein 2; HcK = hematopoietic cell kinase; JNK = Jun amino-terminal kinase; P = phosphate group; PI3K = phosphatidylinositol- 3–kinase; SFK = Src family kinases; Stat5 = signal transducer and activator of transcription 5. Upraveno dle Kantarjian et al. (15). Vysvětlivky: FAK = focal adhesion kinase; Grb-2 = growth factor receptor–bound protein 2; HcK = hematopoietic cell kinase; JNK = Jun amino-terminal kinase; P = phosphate group; PI3K = phosphatidylinositol- 3–kinase; SFK = Src family kinases; Stat5 = signal transducer and activator of transcription 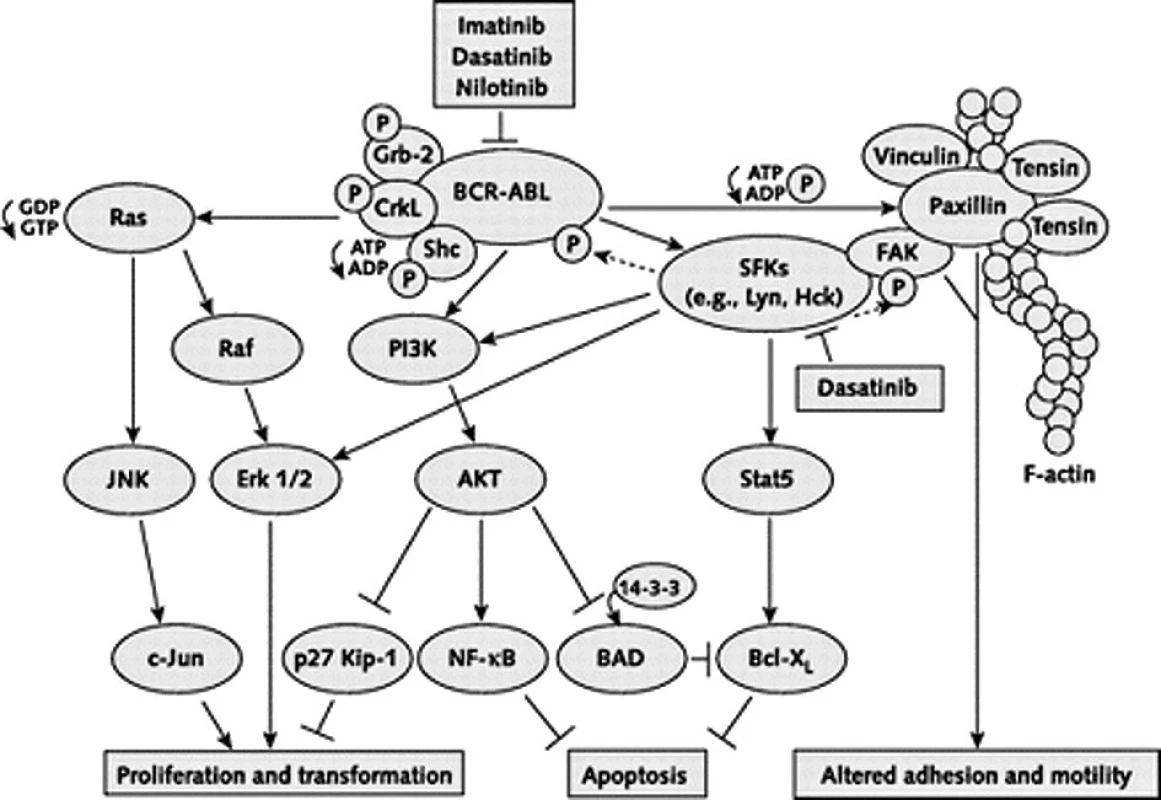
Mutace v kinázové doméně BCR-ABL
Jsou poměrně časté a nacházejí se u 50–90 % nemocných se sekundární rezistencí na imatinib. Mutace byly nalezeny ve více sekvencích kódujících různé aminokyseliny, ale schematicky se dají shrnout do 5 skupin:
- mutace v P smyčce
- mutace T315
- mutace M351
- mutace v A smyčce
- další mutace
Různé typy mutací mají různý vliv na vazbu imatinibu a na další interakce a tudíž různý klinický význam. Závažné bývají mutace v P smyčce(17). Zásadní jsou také mutace T315 a M351.
Mutací byla popsána celá řada (4, 14, 18, 19). Pro ilustraci některé uvedeme. Údaje A a N v závorce značí, zda v případě existence této mutace má (A, ano) nebo nemá (N, Ne) smysl navýšení dávky imatinibu. Tučně jsou vyznačeny frekventně se vyskytující mutace:
M244V (A), M244I (A), L248V (N), G250E (N), G250R, Q252R (N), Q252H (N), Y253H (N), Y253F (N), E255K (N), E255V (N), D276G, T277A, V289A, P296H, F311L (A), F311I, T315I (N), T315S (N), F317L (N), M343T, M351I (A), M351T (A), E355G (A), E355D, F359V (A), F359V (A), F359I, V379I (A), F382L, L387M (A), L387F, H396P (N), H396R (N), A397P, A417Y, E459K, F486S.
Tyto informace nelze brát jako zcela absolutní, neboť mutace je jen jedním z faktorů, ovlivňujících rezistenci. Ukazuje se, že u různých pacientů se stejnou mutací (M244V) může být rozdílná odpověď na imatinib (20). Na mutaci může upozornit vzrůstající hladina transkriptu BCR-ABL. Celá tato oblast je stále v prudkém vývoji.
Problematika rezistence na imatinib čeká na odhalení dalších mechanismů a principů. Například s využitím analýzy genové exprese je možné rozlišit nemocné podle cytogenetické odpovědi (21). Ukazuje se také, že problémem při terapii imatinibem může být to, že CML vzniká z kmenové buňky krvetvorby. Tato kmenová buňka je rezistentní na imatinib, zvláště ve stadiu klidu (22, 23). V CD34+ kmenových buňkách také bylo nalezeno množství mutací, které mohou přispívat k perzistenci této rezistentní populace (24). Mutace také mohou být detekovatelné ještě před zahájením terapie imatinibem(25). Otázka významu tohoto zjištění pro kliniku ale není ještě zcela zodpovězena, nemusí vést vždy ke klinické rezistenci na terapii.
Možnosti ovlivnění rezistence na imatinib
Koncentrace léku v krvi
V prvé řadě je potřeba zjistit, zdali se jedná o skutečnou rezistenci na imatinib. Již v odstavci „Farmakokinetika imatinibu” a na grafech 1 a 2 jsme uvedli důležitá fakta, týkající se koncentrace imatinibu v krvi. Pokud si tuto informaci spojíme s významem leukemické kmenové buňky (viz výše), je evidentní, že terapie imatinibem bude pravděpodobně muset být trvalá, přinejmenším velmi dlouhodobá, a v dostatečných dávkách. Existují některé zprávy o tom, co se stane, jestliže nemocní, byť v tzv. molekulární remisi, s nedetekovatelným transkriptem BCR-ABL, imatinib vysadí. Z jedné takové studie u 12 nemocných dlouhodobě BCR-ABL negativních vyplynulo, že u poloviny z nich došlo k molekulárnímu relapsu a u některých dokonce již za 1 měsíc (26). Poukazujeme na důležitost zásadního faktu: než začneme hovořit o nedostatečné léčebné odpovědi, musíme se přesvědčit, zdali nemocný lék skutečně bere a ve správném dávkování! Imatinib není prost některých vedlejších účinků a nemocní si mohou svoji léčbu sami „modifikovat“. Měření koncentrací imatinibu se dokonce doporučuje u nemocných s nedostatečnou léčebnou odpovědí, neboť byl zjištěn vztah mezi koncentrací léku v krvi a léčebným efektem (27). Tento postup však zatím není běžný a navíc, léčebná odpověď je dána nejenom koncentrací léku v krvi, ale také aktivitou buněčného transportéru OCT-1 (organic cationt transporter), pumpujícího imatinib do buněk (28). V některých případech velké hematologické toxicity imatinibu bylo dokonce popsáno jako užitečné jeho intermitentní dávkování (29).
Vyšší dávka imatinibu
Z podstaty mechanismu účinku imatinibu vyplývá, že buňky s BCR-ABL jsou inhibovány jen v přítomnosti dostatečné koncentrace léku. Bylo již také ukázáno, že se zvyšováním dávky se zvyšuje koncentrace v krvi, že také existuje vazba mezi dávkou a účinkem a že ve studii fáze I vlastně nebylo dosaženo klasického dávkovacího stropu. Ukázali jsme také, že některé mutantní varianty si zachovávají alespoň částečnou citlivost na imatinib. To vše jsou předpoklady pro možnost využití vyššího dávkovacího schématu, než je klasických 400 mg/den.
Imatinib 600 mg versus 400 mg ve studiích fáze II u pacientů s pokročilejší chorobou. Ve dvou velkých studiích u nemocných v akcelerované fázi (30) a blastické krizi (31) bylo ukázáno, že vyšší dávka má lepší výsledky. Stručně je to shrnuto v tabulce 2 a v grafu 6.
Tab. 2. Imatinib 400 nebo 600 mg/den u nemocných s CML v pokročilejší fázi choroby (25, 26). 
Graf 6. Přežívání nemocných v akcelerované fázi CML v závislosti na dávce imatinibu. Upraveno dle Talpaz et al. (30). 
Navýšení imatinibu v případě nedostatečné léčebné odpovědi nebo relapsu. Kantarjian a spol. (32) studovali tento přístup u pacientů, kteří nedosáhli hematologické nebo cytogenetické odpovědi nebo relabovali po standardní dávce 400 mg/den. Ze 20 pacientů bez hematologické odpovědi nebo s relapsem dosáhlo 13 kompletní nebo parciální remise. Ze 34 nemocných bez cytogenetické odpovědi nebo s relapsem dosáhlo 19 kompletní nebo parciální odpovědi. Zdá se tedy, že tento přístup je v praxi aplikovatelný. Je ale potřeba delšího sledování nemocných a podrobnější analýzy mechanismů rezistence a jejich dalšího vývoje v těchto případech, jak ukazují další práce (33, 34). U takových nemocných bude ale dnes výhodnější použít spíše jiný preparát, např. dasatinib (viz dále).
Některé velké pracovní skupiny zabývající se CML také testují vyšší dávku imatinibu u nově diagnostikovaných nemocných. Léčba je extrémně drahá a zatím není jisté, zdali se určitá lepší a rychlejší léčebná odpověď, tímto postupem dosažená, skutečně promítne do lepší celkové prognózy těchto nemocných. Studie pokračují.
Transplantace krvetvorných buněk
V případě rezistence na imatinib je stále možné sáhnout ke dnes již klasické terapii – transplantaci krvetvorných buněk (35).
Dasatinib a nilotinib
V tomto prakticky a edukačně orientovaném přehledu se zaměříme hlavně na ty nové léky, které již jsou nebo velmi brzy budou k dispozici pro klinické užití k léčbě nemocných po selhání imatinibu. Na prvním místě je nutné zmínit dasatinib a nilotinib. Je podivuhodné, jakým obrovským tempem se výzkum a vývoj nových léků v oblasti CML odehrává. Dasatinib produkuje firma Bristol-Myers Squibb a nilotinib stejná firma jako imatinib, Novartis. Jejich chemické struktury jsou pro informaci na obrázku 5 (a, b).
Obr. 5. Porovnání chemické struktury imatinibu, dasatinibu a nilotinibu. 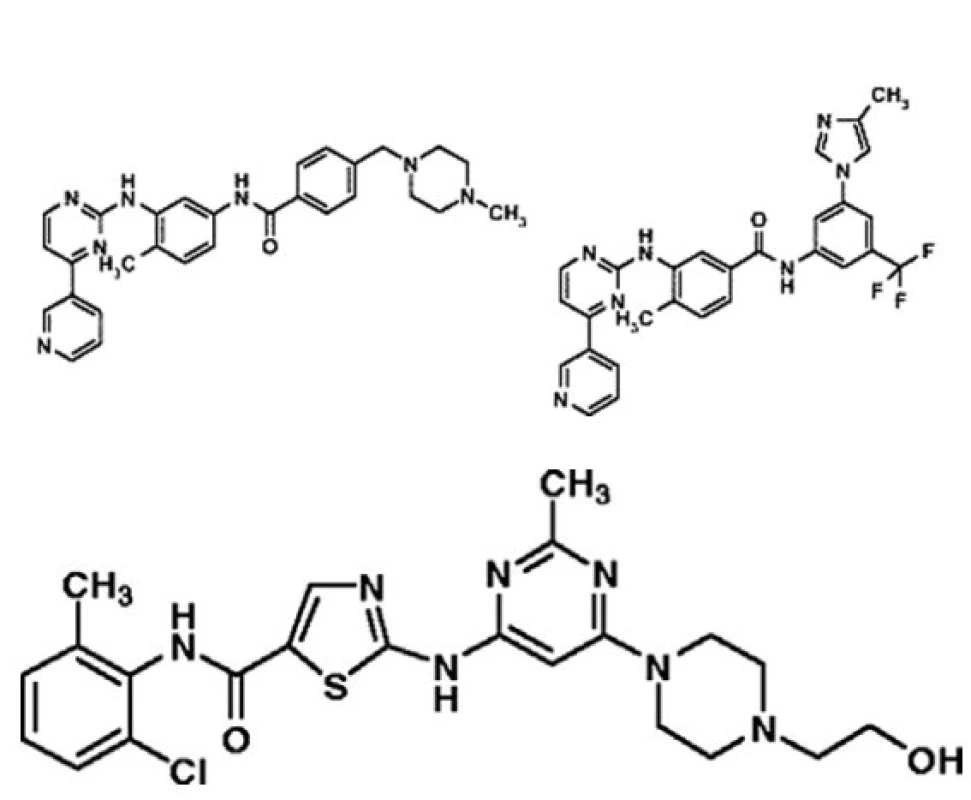
Dasatinib. Dasatinib (BMS-354825) je látka poněkud jiné struktury než imatinib. Název dostala po významném pracovníkovi, podílejícím se na jejím objevu (J. Das) (36). Dasatinib inhibuje Src kinázy a o významu Src kináz pro progresi CML jsme již stručně pojednali (viz výše a obr. 4). Vzhledem ke strukturální podobě Src kináz a ABL kinázy se dasatinib také váže na BCR-ABL. Patří tedy mezi duální Src/abl kinázové inhibitory. Čím se také podstatně odlišuje od imatinibu je to, že se může vázat na BCR-ABL i v aktivní konformaci (viz obr. 5 a pro srovnání také obr. 2) (37). Jiná vazba dasatinibu také umožňuje inaktivovat i mnohé mutantní formy BCR-ABL, na něž imatinib nepůsobí. Není také ovlivněn MDR1. Z in vitro testů vyplynulo, že dasatinib je 325krát potentnější než imatinib (38). Dnes jsou již k dispozici dokonalá strukturální data, ukazující na molekulární úrovni vazbu dasatinibu na BCR-ABL kinázu, rozdíly ve vazbě dasatinibu a imatinibu a vysvětlující, proč dokáže dasatinib inhibovat i většinu mutantů (39). Hlavní přínos dasatinibu oproti imatinibu by tedy měl spočívat právě v možnosti ovlivnit mutantní formy BCR-ABL a velmi pravděpodobně také v blokaci Src kináz. Z in vitro testů vyplynulo, že jedinou zásadní mutací, která brání účinku dasatinibu, je T315I (38). Klinicky se ale ukazuje, že jsou to mutace na pozici 315 a 317, takže ani dasatinib není prost rezistencí v důsledku mutací. Celá problematika se rychle vyvíjí (40). Pro ilustraci jsou rozdíly mezi vazbou imatinibu a dasatinibu ukázány na obrázku 6.
Obr. 6. Srovnání vazby dasatinibu a imatinibu na BCR-ABL kinázu. Protein a dasatinib jsou zeleně, zároveň je ukázána struktura imatinibu s odpovídající proteinovou částí ve fialové barvě. Speciálně označeny jsou aktivační smyčky. Za pozornost stojí rozdílné polohy těchto smyček při vazbě obou molekul a také to, že obě molekuly sice částečně okupují stejné místo, jinak ale míří na opačné strany. Speciálně je zvýrazněn Phe382 aktivační smyčky a je vidět, že imatinib (na rozdíl od dasatinibu) se nemůže vázat na smyčku v aktivované poloze, neboť tam pro něj není místo. Upraveno dle Tokarski et al. (39). 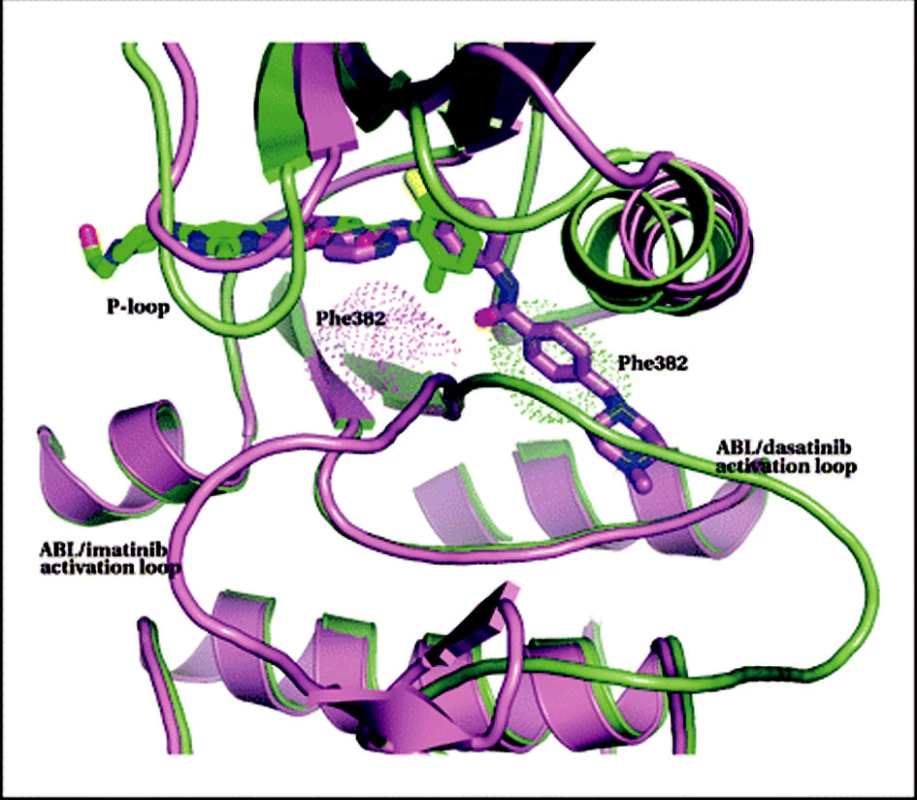
Dasatinib byl již testován v řadě studií fáze I a II. Výsledky některých z nich byly publikovány in extenso (41), jiné zatím jen ve formě abstrakt (42), nejčerstvěji na posledním sjezdu The American Society of Hematology 2006. Další in extenso publikace by se měly objevit v roce 2007 v časopise Blood. Základní bylo hodnocení účinnosti a tolerance u pokročilých fází CML a studium dávkování. Pět studií nazvaných START (Src/ABL tyrosine kinase inhibitor activity: research trials of dasatinib) se věnovalo nemocným s akcelerovanou chorobou (START-A), blastickou fází (START-B), Ph+ akutní lymfoblastickou leukemií (START-L), chronickou fází (START-C) a rezistentní chorobou (START-R). V poslední zmíněné studii byli nemocní randomizováni mezi navýšení imatinibu na 800 mg a podávání dasatinibu. Výsledky studie START-R ukazují lepší cytogenetickou odpověď a přežití bez progrese po dasatinibu (43). Dosavadní vedlejší efekty léčby se částečně podobají vedlejším efektům u imatinibu, dominuje myelosuprese, překvapením je relativně vysoká frekvence retence tekutin a pohrudničních výpotků. Nedá se ale říci, že nemocní, kteří mají určité vedlejší efekty po imatinibu, budou mít analogické po dasatinibu.
Dasatinib se ukázal účinným dokonce i po selhání imatinibu i nilotinibu a je již také testován u nově diagnostikovaných nemocných, ale i v dalších indikacích, viz např. www.clinicaltrials.gov. Účelem tohoto přehledu je podat vysvětlující informace a ukázat určité souvislosti. Proto si dovolíme odkázat na adresu: www.sprycel.cz, kde jsou velmi podrobná data ohledně vedlejších účinků a kompletní příbalový leták. Dasatinib je dostupný v ČR pod názvem Sprycel. Základní indikací je CML nebo Ph+ ALL rezistentní k předchozí terapii nebo s její netolerancí, včetně imatinibu.
Nilotinib (AMN107) byl vyvinut strukturální modifikací imatinibu (44), viz také obrázek 5 (a). Také se váže na neaktivní konformaci BCR-ABL kinázy, má ale 20krát větší vazebnou kapacitu než imatinib a působí na i většinu mutantních forem, rezistentní je ale opět T315I (38). Není asi ovlivněn transportérem OCT-1 a nepůsobí na Src kinázy. Má jinou afinitu k dalším kinázám blokovaným imatinibem; imatinib: PDGFR>Kit>BCR/ABL, nilotinib: BCR/ABL>PDGFR>Kit (45). Recentně byla publikována studie fáze I u nemocných po selhání léčby imatinibem (46). Nilotinib byl relativně dobře tolerován, ve vyšších dávkách se objevovala hepatotoxicita a myelotoxicita, a vykazoval léčebnou odpověď. Nilotinib, preparát Tasigna, je v současné době testován v řadě studií a participují na nich i některá pracoviště v ČR (viz např. www.clini caltrials.gov). Začíná již být zkoušen jako lék první linie a ve studiích se jevil účinným i po selhání dasatinibu.
Další možnosti
S rozvojem poznání molekulárních aspektů CML a s rozvojem technik moderní chemie a molekulární biologie se oblast další cílené terapie CML nesmírně dynamicky rozvíjí. Ve vývoji je celá řada dalších molekul. Vzhledem ke spíše praktickému charakteru tohoto sdělení, s cílem informovat o záležitostech, se kterými je možné se bezprostředně setkat, se zde omezíme na velmi jednoduchý přehled některých typů těchto látek (tab. 3).
Tab. 3. Přehled některých dalších preparátů ve vývoji pro možnou terapii CML a Ph+ hematologických chorob. 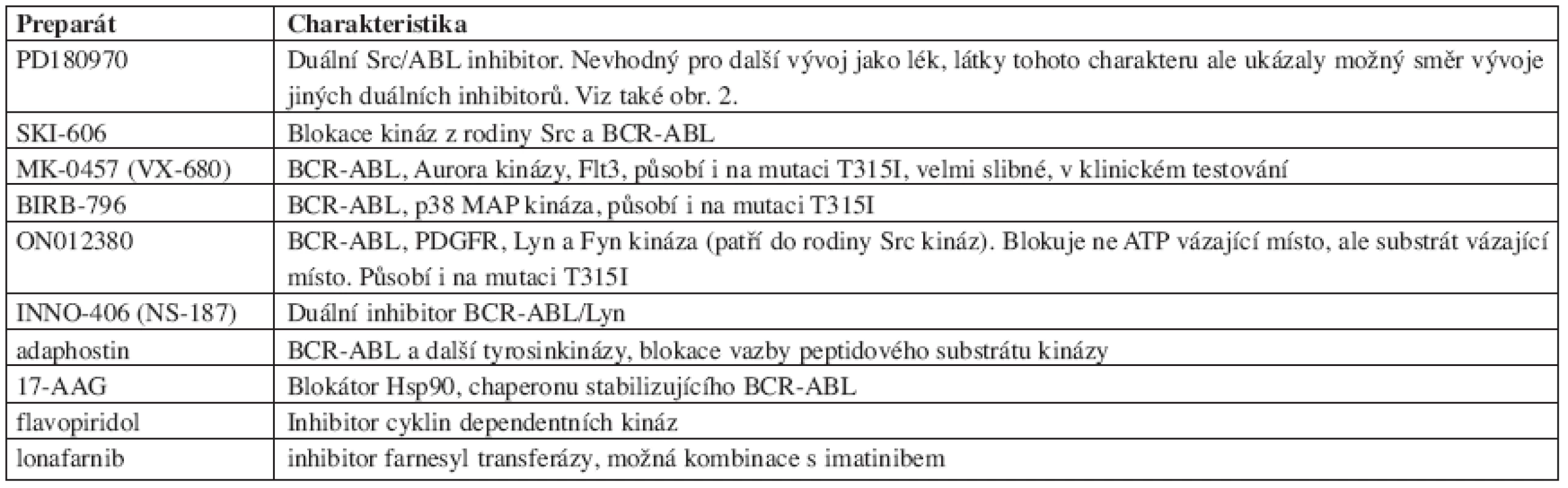
Závěr
Tato práce se zabývala některými aspekty rezistence na imatinib. Chtěla ozřejmit a vysvětlit některé základní principy a ukázat možnosti, jak tento problém řešit. Je ale řada dalších důležitých oblastí, které jsme záměrně nepokryli, neboť by se tím rozsah práce neúměrně rozšířil. Můžeme ale odkázat např. na dvě mimořádně zdařilé práce z poslední doby, které řeší hlavně otázku laboratorního monitorování nemocných (47, 48).
Jakým směrem se bude ubírat terapie CML? Těžko zatím jednoznačně říci. Překvapivé a potěšující je, že s postupující dobou sledování prvních nemocných v chronické fázi léčených imatinibem dramaticky neubývá léčebných odpovědí. Na druhou stanu, jak již bylo ukázáno, po vysazení léku má choroba tendenci se vracet. Studují se možnosti, jak eliminovat leukemickou kmenovou buňku, např. imunoterapií nebo vakcinací. Choroba v pokročilém stadiu je stále velký problém. Uvažuje se o kombinované terapii více molekulami, aby se zvýšila účinnost léčby a zmenšila možnost mutací. Imatinib je bezesporu obrovským přínosem pro terapii CML. Je přínosem i z obecného hlediska. Je synonymem zcela nového úspěšného terapeutického přístupu. Nepochybně budeme mít brzy imatinibu podobných léků více. Problematika imatinibu také otevřela nové obzory hematologického výzkumu a znovu prokázala i rafinovanost přírody, pokud jde o vznik rezistence na rozmanité léky. Právě řešení nově vzniklých problémů je dalším stimulem k prohloubení poznatků v oblasti molekulární patogeneze nádorových chorob. Je nepochybné, že onkologie 21. století bude onkologií mimořádně sofistikovaných léků navržených na podkladě fascinujících detailních poznatků molekulárních dějů uvnitř buněk.
Tato práce vznikla v rámci organizace Česká leukemická skupina - pro život, The CzEch Leukemia Study Group – for Life, CELL
Prof. MUDr. Jiří Mayer, CSc.
Interní hematoonkologická klinika
Fakultní nemocnice Brno
Jihlavská 20
625 00 Brno
e-mail: jmayer@fnbrno.cz
Dodáno do redakce: 27. 5. 2006
Přijato: 13. 7. 2007
Zdroje
1. Nowel PC, Hungerford DA. A minute chromosome in human granulocytic leukemia. Science 1960; 132 : 1497.
2. Mayer J. Chronická myeloidní leukemie jako model moderní necytostatické léčby maligních chorob. Od Virchowa po STI 571. Vnitřní lék 2002; 48 : 45-49.
3. O’Dwyer ME, Druker BJ. Chronic myelogenous leukaemia – new therapeutic principles. J Int Med 2001; 250 : 3-9.
4. Deininger M, Buchdunger E, Druker BJ. The development of imatinib as a therapeutic agent for chronic myeloid leukemia. Blood 2005; 105 : 2640-2653.
5. Schindler T, Bornmann W, Pellicena P, et al. Structural mechanism for STI-571 inhibition of abelson tyrosine kinase. Science 2000; 289 : 1938-1942.
6. Druker BJ, Talpaz M, Resta DJ, et al. Efficacy and safety of a specific inhibitor of the BCR-ABL tyrosine kinase in chronic myeloid leukemia. N Engl J Med 2001; 344 : 1031-1037.
7. Peng B, Hayes M, Resta D, et al. Pharmakokinetics and pharmacodynamics of imatinib in a phase I trial with chronic myeloid leukemia patients. J Clin Oncol 2004; 22 : 935-942.
8. Druker BJ, Sawyers CL, Kantarjian H, et al. Activity of a specific inhibitor of the BCR-ABL tyrosine kinase in the blast crisis of chronic myeloid leukemia and acute lymphoblastic leukemia with the Philadelphia chromosome. N Engl J Med 2001; 344 : 1038-1042.
9. Kantarjian HM, Cortes J, O’Brien S, et al. Imatinib mesylate (STI 571) therapy for Philadelphia chromosome – positive chronic myelogenous leukemia in blast phase. Blood 2002; 99 : 3547-3553.
10. O’Brien S, Guilhot F, Larson RA, et al. Imatinib compared with interferon and low-dose cytarabine for newly diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med 2003; 348 : 994-1004.
11. Hughes TP, Kaeda J, Branford S, et al. Frequency of major molecular response to imatinib of interferon alfa plus cytarabine in newly diagnosed chronic myeloid leukemia. N Engl J Med 2003; 349 : 1423-1432.
12. Druker BJ, Guilhot F, O’Brien SG, et al. Five-year follow-up of patients receiving imatinib for chronic myeloid leukemia. N Engl J Med 2006; 355 : 2408-2417.
13. Sokal JE, Cox EB, Baccarani M, et al. Prognostic discrimination in “good risk” chronic granulocytic leukaemia. Blood 1984; 63 : 789-799.
14. Hochhaus A, La Rosée P. Imatinib therapy in chronic myelogenous leukemia: strategies to avoid and overcome resistance. Leukemia 2004; 18 : 1321-1313.
15. Kantarjian HM, Talpaz M, Giles F, et al. New insights into the pathophysiology of chronic myeloid leukemia and imatinib resistance. Ann Intern Med 2006; 145 : 913-923.
16. Naušová J, Priwitzerová M, Jarošová M, et al. Chronická myeloidní leukemie - rezistence na imatinib mesylát (Glivec) - přehled literatury a vlastní zkušenosti. Čas Lék čes 2006; 145 : 377-382.
17. Branford S, Rudzki Z, Walsh S, et al. Detection of BCR-ABL mutation in patients with CML treated with imatinib is virtually always accompanied by clinical resistance, and mutation in the ATB phosphate-binding loop (P-loop) are associated with a poor prognosis. Blood 2003; 102 : 276-283.
18. Martinelli G, Soverini S, Rosti G, et al. New tyrosine kinase inhibitors in chronic myeloid leukemia. Haematologica 2005; 90 : 534-541.
19. Martinelli G, Soverini S, Rosti G, Baccarani M. Dual tyrosine kinase inhibitors in chronic myeloid leukemia. Leukemia 2005; 19 : 1872-1879.
20. Anand M, Khorashad J, Marin D, et al. Varying response to escalating dose of imatinib in patients with CML who “acquire” a BCR-ABLM244V mutant alele. Blood 2006; 108 : 2881-2882.
21. McLean LA, Gathmann I, Capdeville R, et al. Pharmacogenomic analysis of cytogenetic response in chronic myeloid leukemia patients treated with imatinib. Clin Cancer Res 2004; 10 : 155-165.
22. Graham SM, Jorgensen HG, Allan E, et al. Primitive, quiescent, Philadelphia-positive stem cells from patients with chronic myeloid leukemia are insensitive to STI 571 in vitro. Blood 2002; 99 : 319-325.
23. Bhatia R, Holtz M, Niu N, et al. Persistence of malignant hematopoietic progenitors in chronic myelogenous leukemia patients in complete cytogenetic remission following imatinib mesylate treatment. Blood 2003; 101 : 4701-4707.
24. Chu S, Xu H, Shah NP, et al. Detection of BCR-ABL kinase mutations in CD34+ cells from chronic myelogenous leukemia patients in complete cytogenetic remission in imatinib mesylate treatment. Blood 2005; 105 : 2093-2098.
25. Willis SG, Lange T, Demehri S, et al. High-sensitivity detection of BCR-ABL kinase domain mutations in imatinib-naive patients: correlation with clonal cytogenetic evolution but not response to therapy. Blood 2005; 106 : 2128-2137.
26. Rousselot P, Huguet F, Rea D, et al. Imatinib mesylate discontinuation in patients with chronic myelogenous leukemia in complete molecular remission for more than 2 years. Blood 2007; 109 : 58-60.
27. Picard S, Titier K, Etienne G, et al. Trough plasma imatinib concentrations are associated with both cytogenetic and molecular responses to standard-dose imatinib in chronic myeloid leukemia. Blood 2006; 108: abstract No 2141.
28. White D, Saunders V, Dang P, et al. Molecular response to imatinib is dependent on dose in CML patients with low OCT-1 influx activity. Patients with high activity may respond equally well to standard or increased dose imatinib. Blood 2006; 108: abstract No 738.
29. Faber E, Naušová J, Jarošová M, et al. Intermitent dosage of imatinib mesylate in CML patients with a history of significant hematology toxicity after standard dosing. Leukemia lymphoma 2006; 47 : 1082-1090.
30. Talpaz M, Silver RT, Druker BJ, et al. Imatinib induces durable hematologic and cytogenetic responses in patients with accelerated phase chronic myeloid leukemia: results of phase 2 study. Blood 2002; 99 : 1928-1937.
31. Sawyers CL, Hochhaus A, Feldman E, et al. Imatinib induces hematologic and cytogenetic responses in patients with chronic myelogenous leukemia in myeloid blast crisis: results of a phase II study. Blood 2000; 99 : 3530-3539.
32. Kantarjian HM, Talpaz M, O’Brien S, et al. Dose escalation of imatinib mesylate can overcome resistance to standard-dose therapy in patients with chronic myelogenous leukemia. Blood 2003; 101 : 473-475.
33. Zonder JA, Pemberton P, Brandt H, et al. The effect of dose increase of imatinib mesylate in patients with chronic of accelerated phase chronic myelogenous leukemia with inadequate hematologic or cytogenetic response to initial treatment. Clin Cancer Res 2003; 9 : 2092-2097.
34. Piazza RG, Magistroni V, Andreoni F, et al. Imatinib dose increase up to 1200 mg daily can induce new complete cytogenetic remission in relapsed Ph+ chronic myeloid leukemia patients. Leukemia 2005; 19 : 1985-1987.
35. Jabbour E, Cortes J, Kantarjian HM, et al. Allogeneic stem cell transplantation for patients with chronic myeloid leukemia and acute lymphoblastic leukemia after Bcr-Abl kinase mutation-related imatinib failure. Blood 2006; 108 : 1421-1423.
36. Das J, Chen P, Norris D, et al. 2-aminothiazole as a novel kinase inhibitor template. Structure-activity relationship studies toward the discovery of N-(2-chloro-6-methylphenyl)-2-[6-[4-(2-hydroxyphenyl)-1-piperazinyl)]-2-methyl-4-pyrimidinylamino)]-1,3-thiazole-5-carboxamide (dasatinib, BMS-354825) as a potent pan-Src kinase inhibitor. J Med Chem 2006; 49 : 6819-6832.
37. Shah NP, Tran C, Lee FY, et al. Overriding imatinib resistance with a novel ABL kinase inhibitor. Science 2004; 305 : 399-401.
38. O’Hare T, Walters DK, Stoffregen EP, et al. In vitro activity of Bcr-Abl inhibitors AMN107 and BMS-354828 against clinically relevant imatinib-resistant Abl kinase domain mutants. Cancer Res 2005; 65 : 4500-4506.
39. Tokarski JS, Newitt JA, Chang CYJ, et al. The structure of dasatinib (BMS-354825) bound to activated ABL kinase domain elucidates its inhibitory activity against imatinib-resistant ABL mutants. Cancer Res 2006; 66 : 5790-5797.
40. Soverini S, Martineli G, Colarossi S, et al. Mutations at residues 315 and 317 in the ABL kinase domain are the main cause of resistance to dasatinib in Ph+ leukemia patients. Blood 2006; 108: abstract No 836.
41. Talpaz M, Shah NP, Kantarjian H, et al. Dasatinib in imatinib-resistant Philadelphia chromosome-positive leukemias. N Engl J Med 2006; 354 : 2531-2541.
42. Cortes J, Kim DW, Guilhot F, et al. Dasatinib (SPRYCEL) in patients with chronic myelogenous leukemia in accelerated phase that is imatinib-resistant or intolerant: updated results of the CA 180-005 ’START-A’ phase II study. Blood 2006; 180: abstract No 2160.
43. Shah N, Pasquini R, Rousselot P, et al. Dasatinib (Sprycel) vs. escalated dose of imatinib in patients with chronic phase chronic myeloid leukemia resistant to imatinib : results of the CA180-017 START-R randomized study. Blood 2006; 108: abstract No 167.
44. Weisberg E, Manley PW, Breitenstein W, et al. Characterization of AMN107, a selective inhibitor of naive and mutant Bcr-Abl. Cancer Cell 2005; 7 : 129-141.
45. O’Hare T, Walters DK, Deininger MWN, Druker BJ. AMN107: tightening the grip or imatinib. Cancer Cell 2005; 7 : 117-119.
46. Kantarjian H, Giles F, Wunderle L, et al. Nilotinib in imatinib-resistant CML and Philadelphia chromosome-positive ALL. N Engl J Med 2006; 354 : 2542-2541.
47. Bacarani M, Saglio G, Goldman J, et al. Evolving concepts in the management of chronic myeloid leukemia: recommendations from an expert panel on behalf of the European Leukemia Net. Blood 2006; 108 : 1809-1820.
48. Hughes T, Deininger M, Hochhaus A, et al. Monitoring CML patients responding to treatment with tyrosine kinase inhibitors: review and recommendations for harmonizing current methodology for detecting BCR-ABL transcripts and kinase domain mutations and expressing results. Blood 2006; 108 : 28-37.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2007 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Chronická B-lymfocytární leukemie Část V. Transplantace krvetvorných buněk
- Co nám v každodenní praxi skutečně říkají tzv. moderní prognostické faktory u chronické lymfatické leukemie?
- Zprávy o knihách
- Klinický význam 18F-FDG-pozitronové emisní tomografie u folikulárního lymfomu
- Zprávy o knihách
- Režim CTD (cyklofosfamid, thalidomid, dexametazon) v léčbě relabujících a refrakterních forem mnohočetného myelomu
- Rezistence na imatinib a možnosti využití vyššího dávkování léku u pacientů s chronickou myeloidní leukemií
- Výsledky konfirmačních HLA typizací dárců jako indikátor kvality HLA typizace dárců Českého národního registru dárců dřeně (ČNRDD)
- Zprávy o knihách
- G-CSF u zdravých dárců. Bezpečný nebo škodlivý?
- Návrh populační registrace hematoonkologických diagnóz vycházející z WHO klasifikace nádorových chorob z roku 1999, z hodnocení základních léčebných přístupů a z požadavků Národního onkologického registru ČR
- Produkce a spotřeba transfuzních přípravků v České republice v roce 2006
- K šedesátinám prof. MUDr. Karla Indráka, DrSc.
- XXI. Olomoucké hematologické dny s mezinárodní účastí, Olomouc 16. 6. – 19. 6. 2007
- Autotransfuze v České republice v roce 2006
- Možnosti kryokonzervace erytrocytů - použití a postup zajištění u potřeby autologních odběrů a dovezených přípravků
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- G-CSF u zdravých dárců. Bezpečný nebo škodlivý?
- Režim CTD (cyklofosfamid, thalidomid, dexametazon) v léčbě relabujících a refrakterních forem mnohočetného myelomu
- Klinický význam 18F-FDG-pozitronové emisní tomografie u folikulárního lymfomu
- Produkce a spotřeba transfuzních přípravků v České republice v roce 2006
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



