-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
První retransplantace plic s „ECMO bridge“ v České republice − kazuistika
The first lung retransplantation with “ECMO bridge” in the Czech Republic – case report
During the last 23 years of the National Lung Transplant Program in the Czech Republic, more than 500 lung transplantations, 4 retransplantations and one lobar retransplantation have been performed. We present the case report of a female patient with cystic fibrosis who underwent her first bilateral lung transplantation in January 2020. Due to a chronic lung allograft dysfunction, the patient required ECMO support and retransplantation. For the first time in the Czech Republic, a lung retransplantation with “ECMO bridge to (re)transplantation” preoperative support was performed in April 2021. The patient was discharged 39 days after retransplantation in a stable condition. At the day 90 follow-up visit, the patient was in a generally good condition with satisfying spirometric functions.
Keywords:
Pulmonology – Cystic fibrosis – rejection – lung retransplantation – ECMO bridge – chronic lung allograft dysfunction
Autoři: R. Novysedlák 1; J. Vachtenheim Jr. 1; Z. Střížová 2; J. Šimonek 1; M. Švorcová 1; J. Havlín 1; J. Pozniak 1; J. Kolařík 1; R. Lischke 1
Působiště autorů: Národní program transplantace plic pro Českou a Slovenskou republiku, III. chirurgická klinika 1. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice v Motole, Praha 1; Ústav imunologie 2. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice v Motole, Praha 2
Vyšlo v časopise: Rozhl. Chir., 2022, roč. 101, č. 5, s. 239-243.
Kategorie: Kazuistika
doi: https://doi.org/10.33699/PIS.2022.101.5.239–243Souhrn
Za 23 let trvání národního programu transplantace plic v České republice se uskutečnilo již přes 500 plicních transplantací, 4 retransplantace a jedna lobární retransplantace. Předmětem tohoto článku je kazuistika pacientky s cystickou fibrózou, která podstoupila první bilaterální transplantaci plic v lednu 2020. Z důvodu rozvoje chronické rejekce transplantovaného orgánu vyžadoval stav pacientky ECMO podporu a retransplantaci. Retransplantace proběhla v dubnu 2021 a vůbec poprvé tak byla v České republice provedena plicní retransplantace s „ECMO bridge to (re) transplantation“ podporou preoperačně z důvodu chronické dysfunkce plicního štěpu. Pacientka byla po 39 dnech od retransplantace ve stabilizovaném stavu dimitována. Při kontrole po 90 dnech od operace byla pacientka v celkově dobrém stavu a s uspokojivou funkcí plicního štěpu.
Klíčová slova:
cystická fibróza – rejekce – retransplantace plic – ECMO bridge – pneumologie – chronická dysfunkce plicního štěpu
ÚVOD
Transplantace plic jako poslední možnost terapie terminálního stadia plicních onemocnění byla poprvé provedena v červnu 1963 [1]. Hrudní chirurg James Hardy na Mississippské univerzitě provedl levostrannou plicní transplantaci u 58letého pacienta s respiračním selháním, které bylo způsobeno tumorem obturujícím levý hlavní bronchus [2]. První transplantace jedné plíce, po níž bylo zaznamenáno přežití delší než jeden rok, byla provedena na Torontské univerzitě v roce 1983 [3].
V České republice byla první transplantace plic provedena 22. 12. 1997. Tým pod vedením profesora Pavla Pafka na III. chirurgické klinice 1. LF UK a FN Motol provedl levostrannou transplantaci u 41letého pacienta s exogenní alergickou alveolitidou [4]. K dnešnímu dni bylo v České republice provedeno přes 500 transplantací plic, přičemž III. chirurgická klinika 1. LF UK a FN Motol je jediným pracovištěm v České republice a na Slovensku, kde se transplantace plic provádějí. První retransplantace plic byla u nás provedena 1. 8. 2012 u pacienta z důvodu chronické rejekce typu obliterující bronchiolitidy po 12 letech od první transplantace [5].
Jako většina hrudních a kardiochirurgických reoperací, i retransplantace plic je zpravidla rizikovějším výkonem než primární transplantace [6]. Vyznačuje se delším časem potřebným k provedení výkonu z důvodu preparace a rozrušování adhezí. S retransplantací plic se také pojí větší krevní ztráta nezřídka přesahující objem 5000 ml (s použitím cell saver). Doposud byly v České republice provedeny 4 retransplantace plic a jedna lobární retransplantace. Věkový rozptyl příjemců byl 22−62 let.
KAZUISTIKA
Pacientka narozená v roce 1998 s cystickou fibrózou s progredujícím poklesem plicních funkcí byla poprvé zařazena na čekací listinu v září 2019. V lednu 2020 byla pacientka převedena do urgentního režimu pro progresi plicního postižení. Předtransplantační spirometrie vykazovala pokles FEV1 (forced expiratory volume in 1 second) na hodnotu 26 % náležitých hodnot (viz Graf 1). Mimo plicní postižení vyplývaly další komorbidity především ze základního onemocnění: diabetes na inzulinoterapii (cystic fibrosis-related diabetes, CFRD), malnutrice s nutností domácí parenterální výživy, osteopenie na substituci, gastroezofageální reflux, difuzní hepatopatie bez ložiskových změn, srdeční síňový ektopický rytmus střídající se se sinusovým rytmem, zvýšené riziko tromboembolické nemoci při Leidenské mutaci a deficitu proteinu C a S, anamnestické migrény a nosní polypóza.
Graf 1. Vývoj FEV1 v čase, údaj v procentech předpokládané hodnoty, svislé tečkované čáry představují den transplantace a retransplantace. Dle očekávání došlo k výraznému zlepšení po obou výkonech.
Graph 1: Changes in FEV1 over time, percentage of predicted value, vertical dotted lines represent day of transplantation and retransplantation. As expected, there was a significant improvement after both surgeries.
První bilaterální transplantaci plic s podporou venoarteriální extrakorporální membránové oxygenace (venoarterial extracorporeal membrane oxygenation, VA-ECMO) pacientka podstoupila v lednu 2020, 9 dní po převedení do urgentního režimu. Orgán byl alokován od dárce s prokázanou smrtí mozku s dobrými a stabilními plicními funkcemi.
Pro velikostní nepoměr byla nutná resekce části středního plicního laloku pravé plíce a části linguly. (RTG viz Obr. 1) Pacientka byla extubována za 18 hodin od operace bez rozvoje komplikací. Protokolární transbronchiální biopsie měsíc po transplantaci prokázala jen minimální akutní celulární rejekci, která nevyžadovala antirejekční terapii. Pacientka byla dimitována 22. den po výkonu. Parametr FEV1 byl před propuštěním na úrovni 64 % náležitých hodnot. (viz Graf 1) Protokolární transbronchiální biopsie ve 3. a 6. měsíci od transplantace neprokázaly známky akutní rejekce.
Obr. 1. RTG snímky hrudníku, předozadní, odshora dolů: po primotransplantaci, po překladu do FN Motol před retransplantací, po retransplantaci. Na prvním a posledním snímku lze vidět zavedené hrudní drény.
Fig. 1: Chest X-rays, anteroposterior view, from top to bottom: after 1st lung transplantation, after patient admission to University Hospital Motol before retransplantation, after retransplantation. Chest drains can be seen un the first and last scans.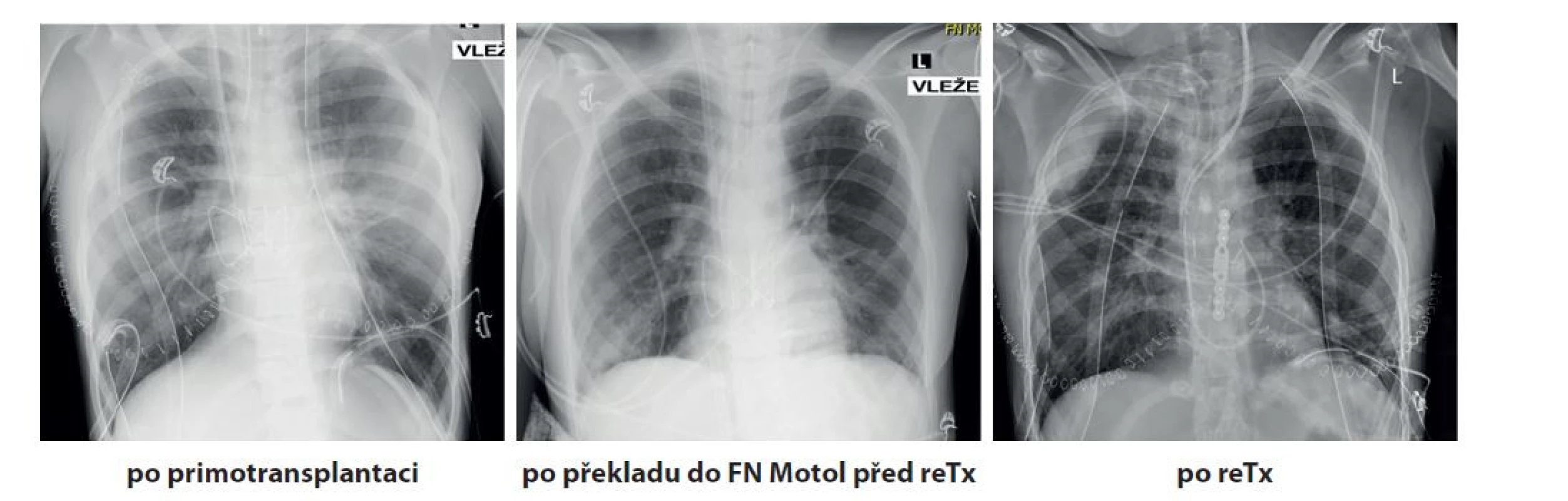
Jedenáct měsíců po výkonu byla pacientce diagnostikována nespecifická intersticiální pneumonitida nejasné etiologie s nutností umělé plicní ventilace (UPV). Léčba vyžadovala podání kortikosteroidů, kterými byla léčena následně i ve 13. měsíci po transplantaci při klinicky stanovené diagnóze rejekce. Transbronchiální biopsie 13 měsíců po transplantaci potvrdila mírnou akutní celulární rejekci A2BxCx s endotelitidou v terénu fibrotizace plicního parenchymu. Vzhledem k předchozímu nedostatečnému efektu léčby kortikoidů byla aplikována depleční antirejekční léčba thymoglobulinem. Pomocí technologie Luminex, která je založena na průtokové cytometrii s dvojitým laserem, opakovaně nebyly detekované donor-specifické anti-HLA protilátky [7]. Dle pacientky došlo subjektivně ke zlepšení stavu, nicméně kontrolní spirometrie prokázala další pokles funkce štěpu. Jako diagnóza per exclusionem tak byla stanovena chronická dysfunkce plicního štěpu (chronic lung allograft dysfunction, CLAD) čtvrtého stupně, nedefinovaného fenotypu. Vzhledem k epidemiologické situaci byla zvažována též varianta superinfekce koronavirem SARS-CoV-2, PCR test na covid-19 ovšem tuto diagnózu nepotvrdil.
V po 15 měsících od primotransplantace byla pacientka hospitalizována na jiném pracovišti, kde pro rychle progredující dysfunkci štěpu bylo nutné zahájení UPV a následně zavedení venovenózní ECMO (VV-ECMO) podpory. Pacientka byla časně přeložena na Kliniku anesteziologie, resuscitace a intenzivní medicíny 2. LF UK a FN Motol. Krátce po příjmu došlo ke zlepšení plicní poddajnosti a následně extubaci s ponechaním VV-ECMO (awake ECMO). Při postupné stabilizaci plicních funkcí bylo možno po 5 dnech odpojit ECMO podporu. Po 14 hodinách od dekanylace došlo k rozvoji akutní dyspnoe s desaturací a hypertenzí. Tento stav vyžadoval reintubaci. Při následné bronchoskopii se podařilo odsát hlenovou zátku kompletně obliterující levý hlavní bronchus. Přes obtížnou ventilaci při nízkých dechových objemech došlo k postupné úpravě stavu. Vzhledem k předpokladu nutnosti dlouhodobé UPV a k usnadnění rehabilitace a mobilizace byla pacientce provedena tracheostomie s následným probuzením a převedením na CPAP (continuous positive airway pressure).
Po doplnění potřebných předtransplantačních vyšetření byla pacientka multioborovým konziliem zařazena na čekací listinu k retransplantaci plic v urgentním režimu. Bilaterální retransplantace plic byla provedena 27. dubna 2021. Věk pacientky v tento den byl 22 let a 9 měsíců. Mezi primární transplantací a retransplantací uběhlo 15 měsíců. ECMO podpora (bridge to retransplantation) trvala 5 dní a UPV 20 dní. Operační výkon proběhl s centrální VA-ECMO podporou. Krevní ztráta dosáhla až 5000 ml. Po reperfuzi obou plic nebyla zaznamenána oběhová ani respirační nestabilita a pacientka byla úspěšně odpojena od ECMO podpory. Byla podána standardní indukční imunosuprese basiliximabem (anti-CD25 monoklonální protilátka) a methyprednisolonem. Korekce koagulační poruchy probíhala již peroperačně a v dalších dnech podáním mražených plazem, fibrinogenu, rekombinantního koagulačního faktoru VII, koagulačního faktoru VIII a von Willebrandova faktoru trombocytů a fibrogaminu. Pooperačně došlo do 24 hodin k rozvoji apikálního hemothoraxu vpravo s nutností operační revize, při které bylo odsáto 200 ml krve a zhruba 250 ml koagul. Jasný zdroj krvácení nebyl nalezen. Histologické vyšetření explantovaných plic potvrdilo diagnózu CLAD se současnými známkami akutní celulární rejekce A2B2R a disperzní karnifikace levé plíce. Čtvrtý pooperační den byla pacientka vigilizována do plného kontaktu s postupným snižováním ventilační podpory. Následovala intenzivní rehabilitace a obnovení perorálního příjmu. Postupný pokles odpadů do hrudních drénů umožnil jejich odstranění sedmý den po retransplantaci, kdy byla pacientka zároveň dekanylována a schopna spontánní ventilace s intermitentní oxygenoterapií, stoje u lůžka a plného perorálního příjmu. Transbronchiální biopsie po 2 týdnech od retransplantace rejekci neprokázala. Vzhledem k nutnosti zlepšení fyzické kondice pacientky byla pacientka přeložena na rehabilitační kliniku. Při důsledné rehabilitaci byla pacientka schopna chůze na kratší vzdálenost bez pomůcek a schopna překonání dvou pater schodů bez potřeby oxygenoterapie 39. den po retransplantaci. V téže době byla pacientka propuštěna do domácího ošetřování s uspokojivými saturacemi. (přehledně viz Schema 1) Dále byla v ambulantní potransplantační péči naší kliniky. Tři měsíce po retransplantaci byla pacientka v celkově dobrém stavu s FEV1 59 % náležitých hodnot. Protokolární transbronchiální kryobiopsie provedena ve 3. měsíci od retransplantace prokázala minimální akutní celulární rejekci, grade A1B1RC0, pro kterou byla přechodně navýšena dávka prednisonu s následnou deeskalací.
Schema 1: Časová osa ilustrující klinický průběh naší pacientky. Zkratky: DLTx – bilaterální transplantace plic; TBB – transbronchiální biopsie plic; NSIP – nespecifická intersticiální pneumonitida; VV-ECMO – venovenózní extrakorporální membránová oxygenace; UPV – umělá plicní ventilace. Vytvořeno pomocí BioRender.com
Diagram 1: Timeline illustrating the clinical course of our patient. Abbreviations: DLTx – double lung transplant; TBB – transbronchial lung biopsy; NSIP – nonspecific interstitial pneumonia; VV-ECMO – venovenous extracorporeal membrane oxygenation; UPV – artificial lung ventilation. Created with BioRender.com
DISKUZE
Extrakorporální membránová oxygenace je metoda založená na principu mimotělního krevního oběhu. Krevní pumpa kontinuálně nasává odkysličenou krev, kterou vhání do oxygenátoru, kde probíhá výměna plynů, a okysličená krev se vrací do krevního oběhu pacienta [8]. Venovenózní konfigurace ECMO dokáže nahradit čistě funkci plic, zatímco venoarteriální konfigurace se využívá při postižení srdce nebo srdce a plic. Jde o metodu dočasné podpory oběhu [8].
U naší pacientky byla použita i metoda „awake“ VV-ECMO. Pacientka byla extubována, při vědomí s ECMO podporou. Dle Langer, et al. tato modalita ECMO podpory pomáhá předcházet nežádoucím účinkům analgosedace, intubace a mechanické ventilace [9]. Nevýhodou tohoto postupu jsou vyšší nároky kladené na ošetřující personál, jelikož pacient musí být pečlivě monitorován a poučován, aby se předešlo extrakci ECMO kanyl [9].
Plicní retransplantace tvoří přibližně 5 % všech transplantací, jde tedy o poměrně vzácný výkon [10]. Současně je jen minimum pacientů s ECMO podporou indikováno k retransplantaci. V předložené kazuistice je popsán první operační výkon tohoto typu v České republice.
Tato skupina pacientů má na čekacích listinách nejvyšší prioritu. U tak invazivní podpory, jakou ECMO zcela jistě je, by se dala očekávat vysoká mortalita pacientů na čekací listině související s častými komplikacemi spojenými s ECMO podporou [11]. Jelikož je v takové situaci orgán alokován přednostně, mortalita na čekací listině dosahuje u této skupiny „pouze“ 14 % [12]. Jak dále uvádí Collaud, et al. ve svém článku, délka preoperativního ECMO bridge neovlivňuje negativně přežívání těchto pacientů [12].
Doba mezi transplantací a retransplantací (tzv. intertransplant interval) byla u naší pacientky 15 měsíců. Collaud, et al. ve své práci uvádí, že výsledky a přežívaní pacientů po retransplantaci jsou lepší, pokud je interval mezi primotransplantací a retransplantací delší než 24 měsíců [12].
Přežívání po dobu 90 dní po primární transplantaci pacientů s ECMO bridge je 77−88 %, zatímco u pacientů po retransplantaci s ECMO bridge je 72 % [12]. Tento údaj není překvapivý zejména vzhledem ke složitosti retransplantace dané srůsty po předchozí operaci a s tím spojenou větší krevní ztrátou a komorbiditám asociovaným s dlouhodobým užíváním imunosupresivní terapie [12]. Přežívání po dobu 1 roku po primární transplantaci s ECMO bridge se pohybuje mezi 50 % a 93 %. Velký rozptyl hodnot je daný zejména rozdílnou strategií jednotlivých transplantačních center, charakteristikou kohort a potransplantační péčí [12]. Nicméně 1leté přežívání pacientů po plicní retransplantaci s ECMO bridge je 48 % [12]. Dle práce Abdelnour-Berchtold pacienti vyžadující ECMO bridge k retransplantaci přežívají kratší dobu než ti, u kterých byla retransplantace provedena bez předchozího ECMO bridge [13]. Dle Collaud, et al. je 1leté přežívání pacientů po retransplantaci s awake ECMO bridge a dobou mezi primární transplantací a retransplantací větší než 2 roky až 67 % [12].
U pacientů s ECMO bridge je vhodné individuálně zvážit redukci imunosuprese pro snížení rizika infekce [12].
ECMO podpora u již jednou transplantovaného pacienta automaticky neznamená bridge k retransplantaci a znovuzařazení na čekací listinu. Současně v akutních situacích nelze rozhodovat o zavedení ECMO podpory u tohoto typu pacientů jen na základě šance na retransplantaci. Je jí potřeba chápat jako metodu léčby respirační insuficience nezvládnutelné na UPV [14]. Cíl ECMO podpory se může v průběhu léčby měnit. Rozhodnutí a indikace k retransplantaci jsou vždy dány rozhodnutím multidisciplinárního týmu v rámci centra, které má zkušenosti s vysoce rizikovými transplantacemi plic.
Retransplantace plic se pojí s etickou otázkou, zda má pacient po první transplantaci nárok na orgán, kterého je nedostatek. Jak uvádí Pozniak, et al. ve své práci, pokud se řídíme názorem, že je vhodné nabídnout orgán k transplantaci přednostně těm, u kterých bude největší šance na co nejdelší přežití a transplantace přinese výrazné zlepšení kvality života, je retransplantace legitimní postup [5,15].
ZÁVĚR
Retransplantace plic je jedinou léčebnou metodou pro pacienty v terminálním stadiu chronické dysfunkce plicního štěpu. V České republice byla v dubnu 2021 provedena první retransplantace s ECMO bridge. U pacientů po transplantaci plic se selháním štěpu by měla být zvažovaná případná retransplantace, i pokud jejich stav vyžaduje ECMO podporu.
Poděkování
Autoři článku děkují týmu lékařů Kliniky plicních nemocí a tuberkulózy FN Olomouc pod vedením MUDr. Petra Jakubce, Ph.D., týmu lékařů KARIM 2. LF UK a FN Motol a Pneumologické kliniky 2. LF UK a FN Motol, prim. MUDr. Janu Burkertovi, Ph.D. a všem, kteří se podíleli a podílejí na péči o pacienty po transplantaci plic.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. René Novysedlák
Národní program transplantace plic pro Českou a Slovenskou republiku
III. chirurgická klinika 1. lékařské fakulty UK a FN v Motole
e-mail: rene.novysedlak@fnmotol.cz
ORCID: 0000-0002-2660-6815
Zdroje
1 Hardy JD, Webb WR, Dalton ML, et al. Lung homotransplantation in man. JAMA 1963;186(12). doi:10.1001/ jama.1963.63710120001010.
2 Venuta F, Van Raemdonck D. History of lung transplantation. Journal of Thoracic Disease 2017;9(12):5458−5471. doi:10.21037/jtd.2017.11.84.
3 Toronto Lung Transplant Group. Unilateral lung transplantation for pulmonary fibrosis. New England Journal of Medicine 1986;314(18):1140−1145. doi:10.1056/ NEJM198605013141802.
4 Pafko P, Kabát J, Schützner J. První transplantace plic v České republice. Rozhledy v chirurgii 1999;78 : 148−149.
5 Pozniak J, Kolařík J, Myšíková D, et al. První retransplantace plic v České republice. Rozhledy v chirurgii 2015;95(3):135−138.
6 Shigemura N, Bermudez C, Bhama J, et al. Successful lung retransplantation after extended use of extracorporeal membrane oxygenation as a bridge. Transplantation Proceedings 2011;43(5):2063−2065. doi:10.1016/j. transproceed.2011.02.008.
7 Tait BD, Hudson F, Cantwell L, et al. Review article: Luminex technology for HLA antibody detection in organ transplantation. Nephrology 2009;14(2):247−254. doi:10.1111/j.1440-1797.2008.01074.x.
8 Lafçı G, Budak AB, Yener AÜ, et al. Use of extracorporeal membrane oxygenation in adults. Heart, Lung and Circulation 2014;23(1):10−23. doi:10.1016/j. hlc.2013.08.009.
9 Langer T, Santini A, Bottino N, et al. “Awake” extracorporeal membrane oxygenation (ECMO): pathophysiology, technical considerations, and clinical pioneering. Critical Care 2016;20(1). doi:10.1186/ s13054-016-1329-y.
10 Yusen RD, Edwards LB, Kucheryavaya AY, et al. The Registry of the International Society for Heart and Lung Transplantation: Thirty-first adult lung and heart – lung transplant report—2014; focus theme. The Journal of Heart and Lung Transplantation 2014;33(10):1009−1024. doi:10.1016/j.healun.2014.08.004.
11 Patel B, Arcaro M, Chatterjee S. Bedside troubleshooting during venovenous extracorporeal membrane oxygenation (ECMO). Journal of Thoracic Disease 2019;11(S14):S1698−S1707. doi:10.21037/jtd.2019.04.81.
12 Collaud S, Benden C, Ganter C, et al. Extracorporeal life support as bridge to lung retransplantation: A multicenter pooled data analysis. The Annals of Thoracic Surgery 2016;102(5):1680-1686. doi:10.1016/j.athoracsur.2016.05.014.
13 Abdelnour-Berchtold E, Federici S, Wurlod D-A, et al. Outcome after extracorporeal membrane oxygenation-bridged lung retransplants: a single-centre experience. Interactive CardioVascular and Thoracic Surgery 2019;28(6):922-928. doi:10.1093/icvts/ivz013.
14 Paolone S. Extracorporeal membrane oxygenation (ECMO) for lung injury in severe acute respiratory distress syndrome (ARDS): Review of the literature. Clinical Nursing Research 2017;26(6):747−762. doi:10.1177/1054773816677808.
15 Tong A, Howard K, Jan S, et al. Community preferences for the allocation of solid organs for transplantation: A Systematic Review. Transplantation 2010;89(7):796−805. doi:10.1097/TP. 0b013e3181cf1ee1.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2022 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Od diagnostiky a léčby ke zdraví, chirurg by neměl stát opodál
- Endovenózní ablace křečových žil – současný stav a přehled metod
- Poranění m. pectoralis major
- Redukce průtoku arteriovenózní fistule u pacientů po transplantaci ledviny
- Předoperační neselektivní podávání orálních nutričních doplňků pacientům podstupujícím elektivní kolorektální resekci – standard perioperační péče?
- První retransplantace plic s „ECMO bridge“ v České republice − kazuistika
- Transversus abdominis release v řešení rozsáhlého chronického defektu střední čáry stěny břišní
- Transversus abdominis release v řešení rozsáhlého chronického defektu střední čáry stěny břišní
- Apendikolit ako príčina neskorých komplikácií po apendektómii − kazuistika a prehľad literatúry
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Poranění m. pectoralis major
- Endovenózní ablace křečových žil – současný stav a přehled metod
- Transversus abdominis release v řešení rozsáhlého chronického defektu střední čáry stěny břišní
- Apendikolit ako príčina neskorých komplikácií po apendektómii − kazuistika a prehľad literatúry
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



