-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Cholangiocelulární karcinom z pohledu patologa
Cholangiocarcinoma: a pathologist’s point of view
Cholangiocarcinoma is a relatively rare malignant tumor arising from the biliary epithelium of the intra - and extrahepatic bile ducts, the gallbladder, and the ampulla of Vater. This review article presents cholangiocarcinoma from the routine histopathological point of view. In addition to an overview of basic morphological, immunohistochemical, and molecular genetic characteristics of cholangiocarcinoma subtypes and precancerous lesions, the article is focused on intraoperative biopsies and on changes in the 8th edition of the TNM classification. Macroscopic and microscopic photo documentation and a review of recent literature are included.
Keywords:
cholangiocarcinoma – cholangiocellular carcinoma – intrahepatic – extrahepatic – perihilar
Autoři: J. Hrudka; E. Sticová
Působiště autorů: Ústav patologie 3. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Královské Vinohrady v Praze
Vyšlo v časopise: Rozhl. Chir., 2022, roč. 101, č. 10, s. 478-487.
Kategorie: Souhrnné sdělení
doi: https://doi.org/10.33699/PIS.2022.101.10.478–487Souhrn
Cholangiocelulární karcinom je relativně vzácný maligní nádor vycházející z biliárních epitelií, který může vznikat v intra - i extrahepatálních žlučovodech, ve žlučníku a ve Vaterské ampule. Tento přehledový článek se věnuje problematice cholangiocelulárního karcinomu z pohledu histopatologa. Kromě shrnutí základních morfologických, imunohistochemických a molekulárně genetických charakteristik jednotlivých typů cholangiokarcinomu a prekancerózních lézí se zaměřuje na problematiku peroperačních biopsií a na změny v aktuálním 8. vydání TNM klasifikace. Součástí sdělení je makroskopická i mikroskopická obrazová dokumentace z naší praxe a přehled recentní literatury.
ÚVOD
Cholangiocelulární karcinom (CCC) neboli cholangiokarcinom je relativně vzácný maligní epitelový nádor vycházející z biliárních epitelií (cholangiocytů).
Recentní WHO klasifikace z roku 2019 rozděluje CCC na typ vyrůstající z intrahepatálních žlučovodů (intrahepatální CCC jater, dále klasifikovaný na small duct type z malých žlučovodů, a large duct type neboli perihilární z velkých žlučovodů proximálně od hilu, vč. Klatskinova tumoru vyrůstajícího z oblasti junkce pravého a levého ductus hepaticus) a na typ z extrahepatálních žlučovodů (extrahepatální neboli distální CCC) [1–3]. Dále se adenokarcinom s cholangiocelulárním fenotypem může vyskytovat ve stěně žlučníku a rovněž ve Vaterské ampule, kde je diferenciálně diagnostickou alternativou adenokarcinomu intestinálního typu [1,3].
Mezi významné rizikové faktory vzniku CCC patří kromě různých hereditárních nádorových syndromů zejména žlučové kameny, cysty a vrozené malformace žlučových cest (Caroliho nemoc) a dále primární sklerózující cholangoitis (PSC). V jihovýchodní Asii se uplatňují rovněž motolice postihující žlučovody (Clonorchis sinensis a Opisthorchis viverrini). Rizikovými faktory asociovanými s výskytem CCC jsou rovněž idiopatické záněty střeva, chronické virové hepatitidy a jaterní cirhóza, diabetes, obezita, kouření a alkohol [4,5].
Základem diagnostiky cholangiokarcinomu je podrobná anamnéza a klinické vyšetření, dále zobrazovací metody zaměřené na žlučový strom a detailní histomorfologické hodnocení materiálu získaného probatorní punkcí či endoskopickou biopsií, případně excizí či chirurgickou resekcí.
Tento přehledový článek je zaměřen na problematiku intra - a extrahepatálního cholangiokarcinomu a prekancerózních lézí žlučového stromu z pohledu patologa, s důrazem na morfologické a diferenciálně diagnostické aspekty relevantní zejména pro chirurgické obory specializované na hepato-biliární problematiku.
Morfologická diagnostika cholangiokarcinomu
Role patologa v diagnostickém procesu biliárních lézí zahrnuje zejména stanovení primární diagnózy z punkčních či cholangioskopických biopsií, případně z cytologického materiálu (kartáčková cytologie a laváž žlučového stromu) a dále stanovení či potvrzení diagnózy v materiálu z resekátu zpracovaného rutinními histologickými technikami.
Součástí morfologické diagnostiky je posouzení histologického subtypu nádorové léze, zhodnocení stupně diferenciace maligního tumoru (nádorový grade) a rovněž stanovení patologického stadia (nádorový stage, pTNM).
Nedílnou součástí diagnostického procesu se v současné době stává i vyšetření imunohistochemických a molekulárně genetických biomarkerů, důležitých pro nastavení optimálního terapeutického postupu a monitorování léčebné odpovědi a průběhu nádorového onemocnění.
Zásadní roli v diagnostickém procesu hraje, zejména v případě komplexních resekátů, detailní makroskopické zhodnocení materiálu. Součástí makroskopického popisu bývá posouzení počtu a velikosti nádorových ložisek, jejich vztah k okolním strukturám včetně velkých cév a k okrajům operačního výkonu. U intrahepatálního cholangiokarcinomu má rovněž význam posouzení způsobu nádorového růstu, zejména jedná-li se o lézi tvořící ohraničený nádorový uzel či o tumor s periduktální infiltrací. Vlastní nádor se makroskopicky jeví většinou jako jedno či více tuhých bělavých ložisek kulovitého či cípatého tvaru, které má centrum buď na periferii, či v oblasti v hilu jater, případně v extrahepatálních žlučovodech (Obr. 1 a 2). Posouzení prostým okem často neumožňuje jednoznačné odlišení primárního nádoru od metastázy z jiného zdroje, což je v případě zejména metastáz karcinomu pankreatu svízelné i pod mikroskopem (viz níže).
Obr. 1. Pitevní makrofotografie zobrazující bělavý tuhý cípatý nádor uložený v periferii jater pod viscerálním peritoneem
Fig. 1: Autopsy photograph showing a whitish, firm serrated tumor found in the liver periphery, beneath the visceral peritoneum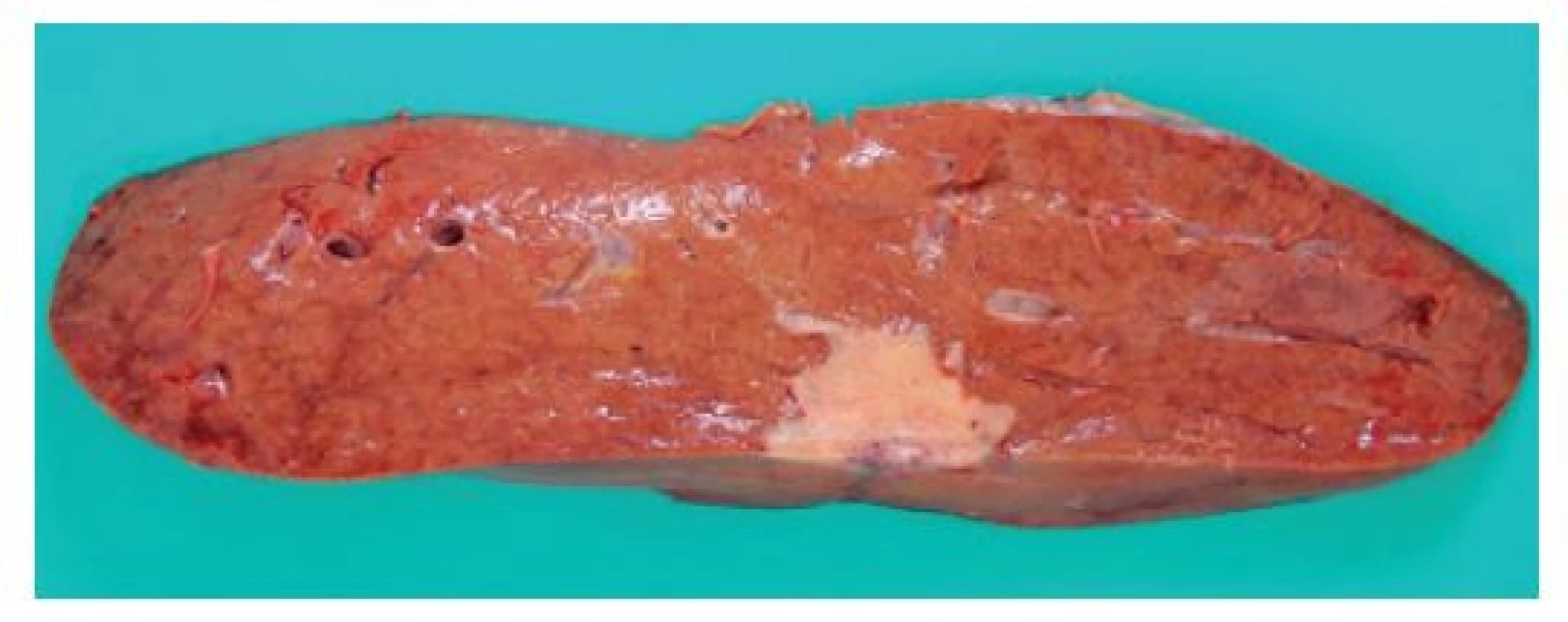
Obr. 2. Pitevní makrofotografie zobrazující bělavý nodulární nádor vycházející z hilu jater široce infiltrující parenchym
Zelené zbarvení parenchymu svědčí pro akutní cholestázu.
Fig. 2: Autopsy photograph showing a whitish nodular tumor infiltrating hilar structures and adjacent liver parenchyma
Green color of the parenchyma indicates acute cholestasis.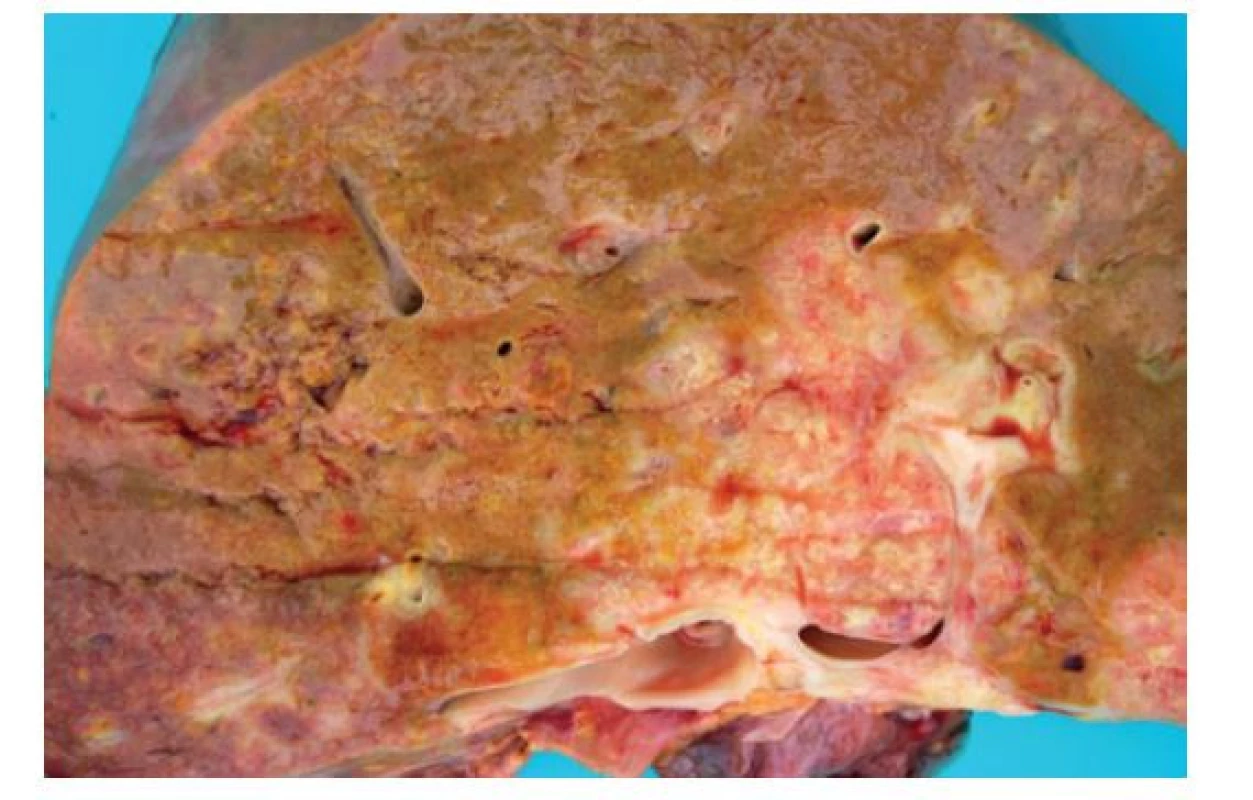
Mikroskopicky odpovídá cholangiocelulární karcinom v převážné většině případů adenokarcinomu tzv. biliárního či pankreatobiliárního typu, vzácněji, zejména jedná-li se o tumory vycházející z větších žlučovodů hilu či extrahepatálně, se může jednat o adenokarcinom s diferenciací připomínající intestinální či žaludeční epitel, mucinózní a světlobuněčný adenokarcinom, adenokarcinom z prsténčitých buněk, případně o karcinom dlaždicobuněčný či adenoskvamózní (Tab. 1) [1,3].
V rutinním barvení hematoxylinem-eosinem (HE) nacházíme v typickém případě zhoubný nádor tubulární či komplexní tubulopapilární úpravy (Obr. 3) s přítomností nepravidelně angulovaných žlazových struktur, které postrádají charakteristické lobulární „stromečkovité“ uspořádání fyziologických peribiliárních žlázek. Méně diferencované nádory sestávají z navzájem anastomozujících neluminizovaných solidních trámců (Obr. 4), často s disociativním růstem nádorových epitelií v denzním desmoplastickém stromatu. Na cytologické úrovni vykazují nádorové elementy jaderné atypie s nepravidelným „bramborovitým“ tvarem jádra, zhrubělým chromatinem a hyperchromazií (silné tmavé barvení jádra hematoxylinem). Častá je i variabilita velikosti jader (pleomorfismus) s přítomností jadérek a mitotických figur včetně atypických mitóz (Obr. 5). Poměrně často nacházíme u CCC intraneurální či perineurální šíření (Obr. 6), případně nádorovou angioinvazi.
Obr. 3. Histologie cholangiocelulárního adenokarcinomu jater tubulární stavby s denzně nahloučenými žlázkami s hlenotvorbou a jadernými atypiemi, HE, 200×
Fig. 3: Histology of liver cholangiocellular adenocarcinoma characterized by tubular arrangement, with closely packed mucinous glands with nuclear atypia, HE, 200×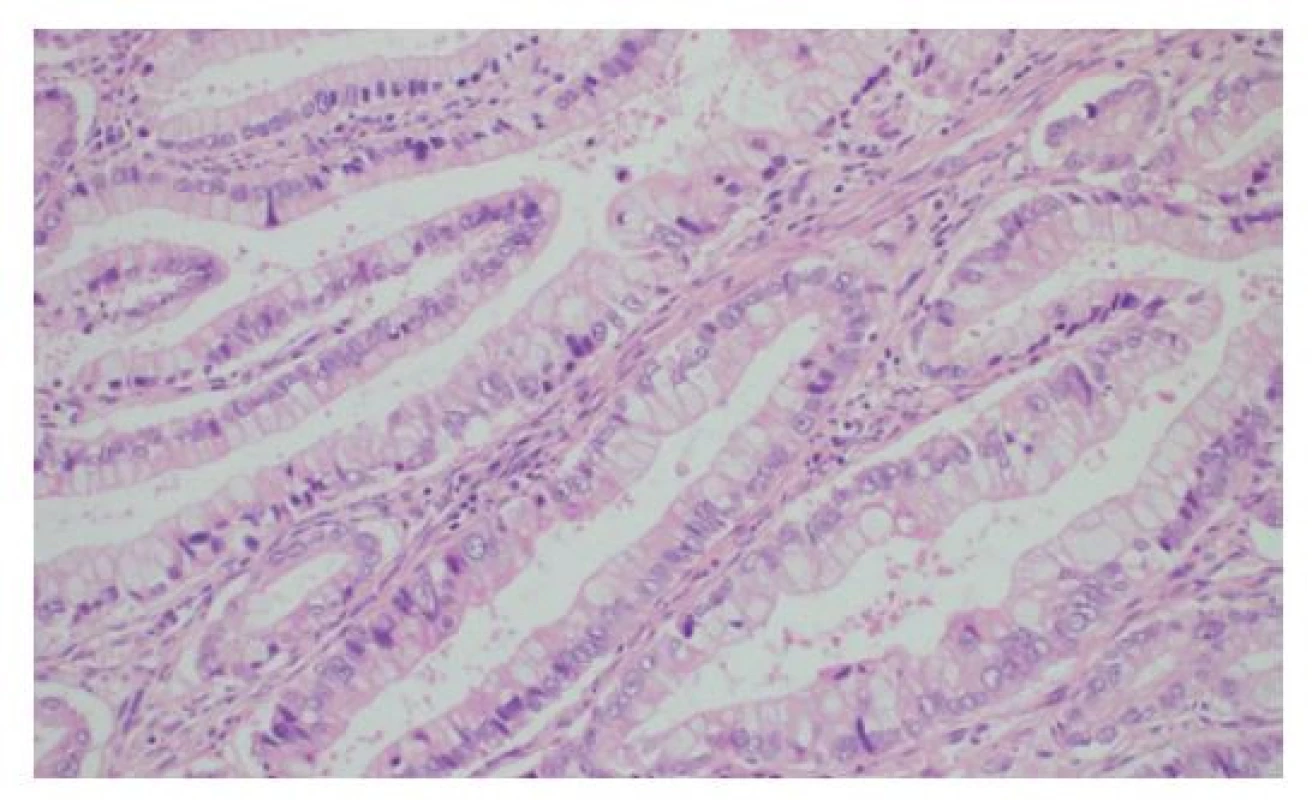
Obr. 4. Histologie cholangiocelulárního adenokarcinomu jater solidně-trabekulární stavby s anastomozujícími trámci nádorových buněk, fokálně s rudimentárními žlázovými luminy
Šipka označuje žlučový trombus při akutní cholestáze v přilehlém nenádorovém parenchymu jater, HE, 200×
Fig. 4: Histology of liver cholangiocellular adenocarcinoma characterized by solid trabecular-anastomosing arrangement with occasional glandular lumina
The arrow shows bile accumulation in adjacent liver parenchyma due to acute cholestasis, HE, 200×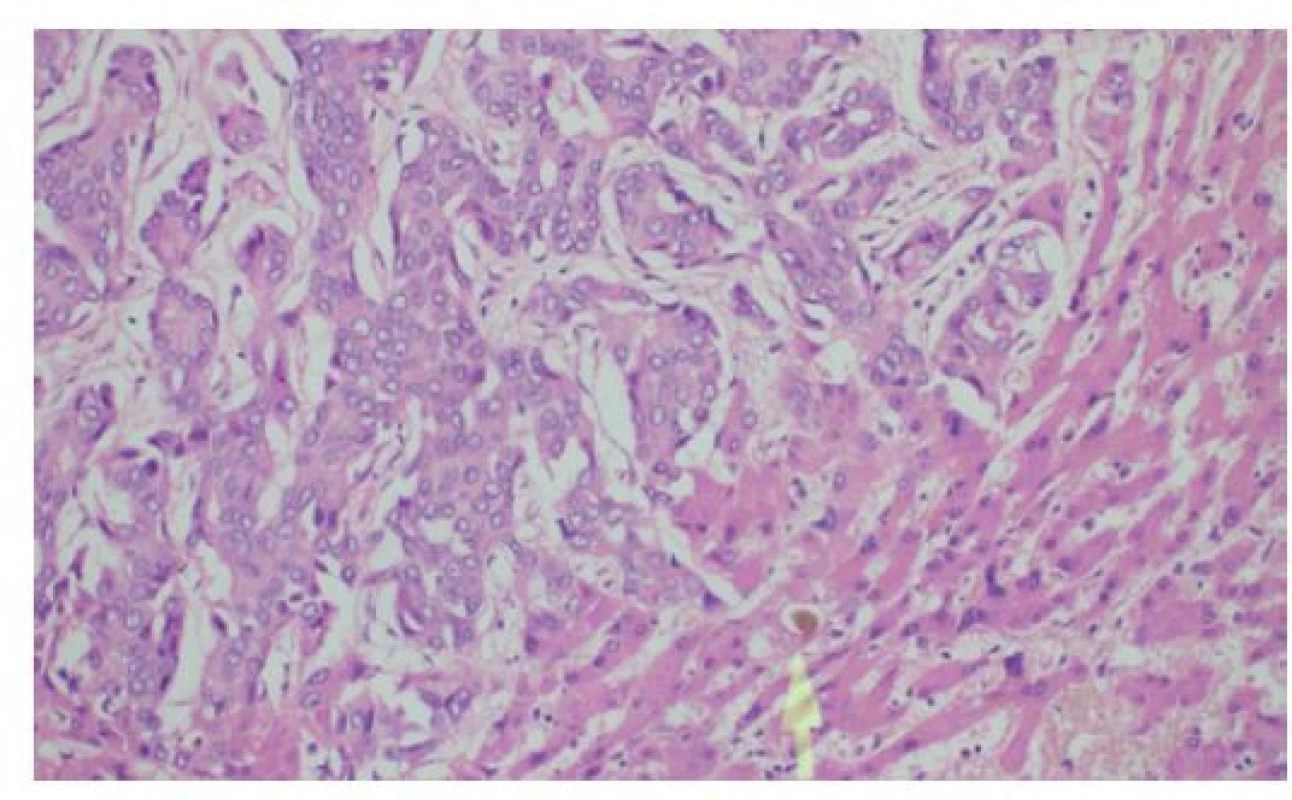
Obr. 5. Detail histologie cholangiocelulárního adenokarcinomu žlučovodu sestávajícího z anastomózujících tubulárních žlázek
Šipka označuje mitózu, HE, 600×
Fig. 5: Histology of bile duct cholangiocellular adenocarcinoma consisting of anastomosing tubular glands
The arrow shows the mitotic figure, HE, 600×.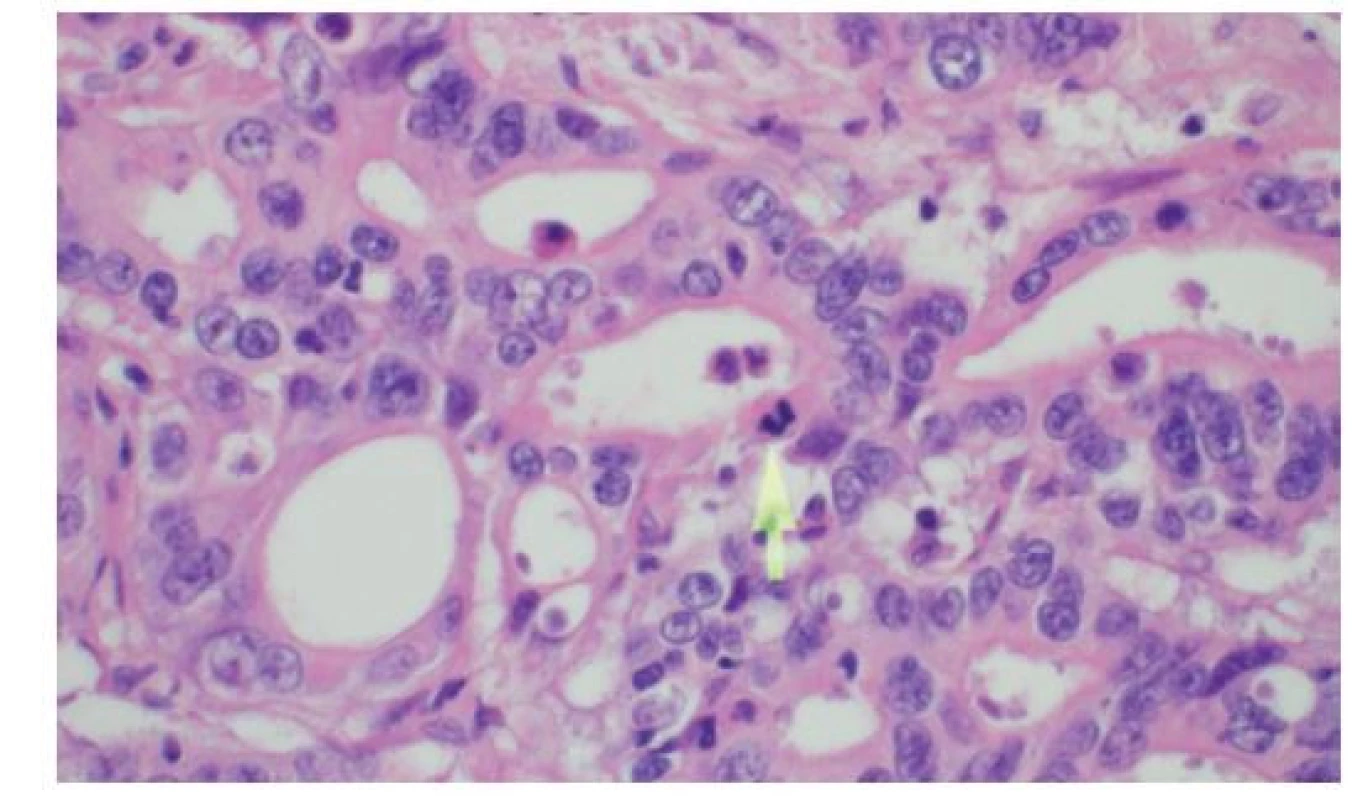
Obr. 6. Histologie cholangiocelulárního adenokarcinomu tubulární stavby, který infiltruje okolo nemyelinizovaného periferního nervu v hilu jater, HE, 200×
Fig. 6: Histology of cholangiocellular adenocarcinoma characterized by tubular arrangement, infiltrating a nonmyelinated peripheral nerve in the liver hilum, HE, 200×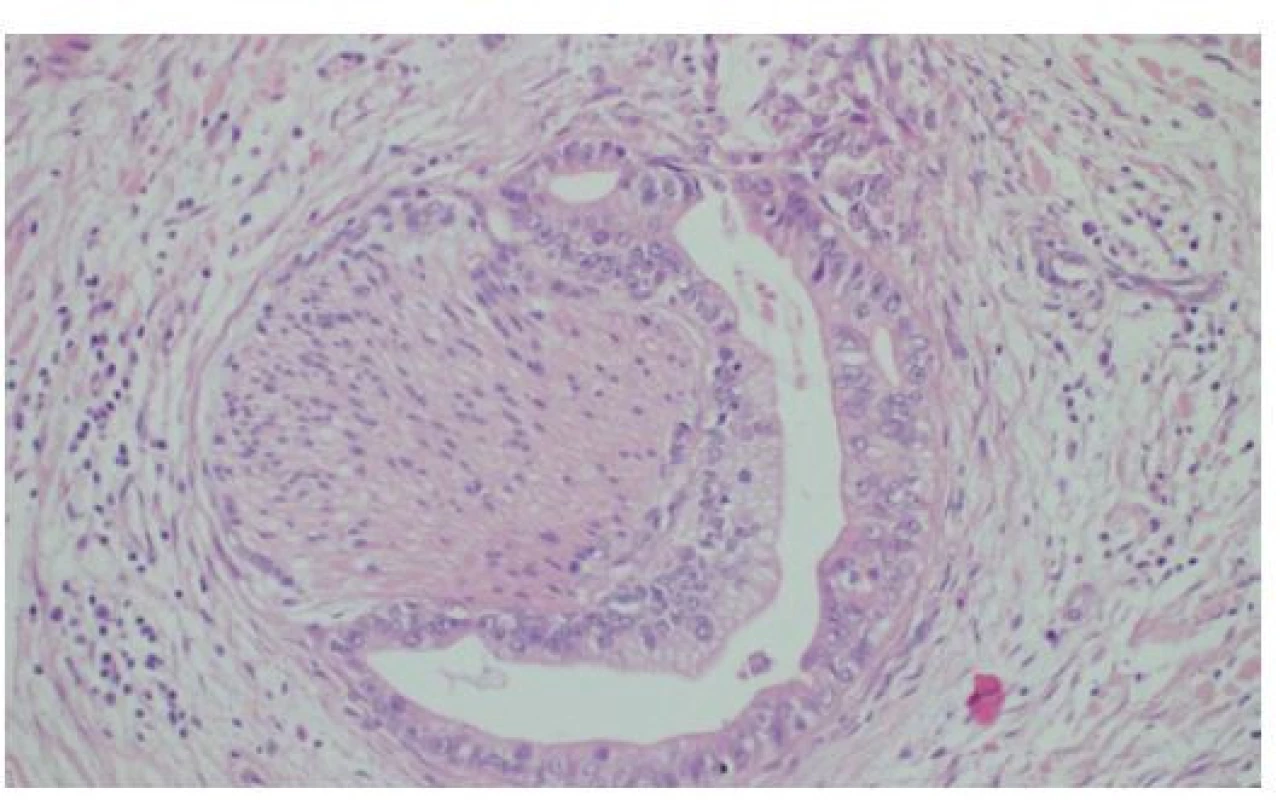
Imunohistochemické vyšetření založené na specifické reakci známé primární protilátky s antigenem přítomným ve vyšetřované tkáni má v biliární patologii význam pouze doplňkový a pro diagnostiku biliárních lézí zůstává rozhodující morfologie na úrovni základního barvení HE. Při rozlišování vystupňovaných reaktivních změn od skutečného nádorového procesu může pomoci imunohistochemické vyšetření jaderného proteinu p53, jehož aberantní exprese je přítomna u cca dvou třetin cholangiokarcinomů. V našem bioptickém provozu se osvědčilo rovněž imunohistochemické vyšetření na insulin-like growth factor II mRNA binding protein 3 (IMP3), který má pro těžké dysplazie a adenokarcinomy 80% senzitivitu a 92% specificitu (Obr. 7) [6].
Obr. 7. Imunohistochemická pozitivita insulin-like messenger RNA binding protein 3 (IMP3) v těžké biliární dysplazii (vpravo), normální epitel (vlevo) je negativní, imunohistochemie, 400×
Fig. 7: Positive finding of the insulin-like messenger RNA binding protein 3 (IMP3) based on immunohistochemistry in a high-grade biliary dysplasia (on the right); negative finding in the non-neoplastic epithelium (on the left); immunohistochemistry, 400×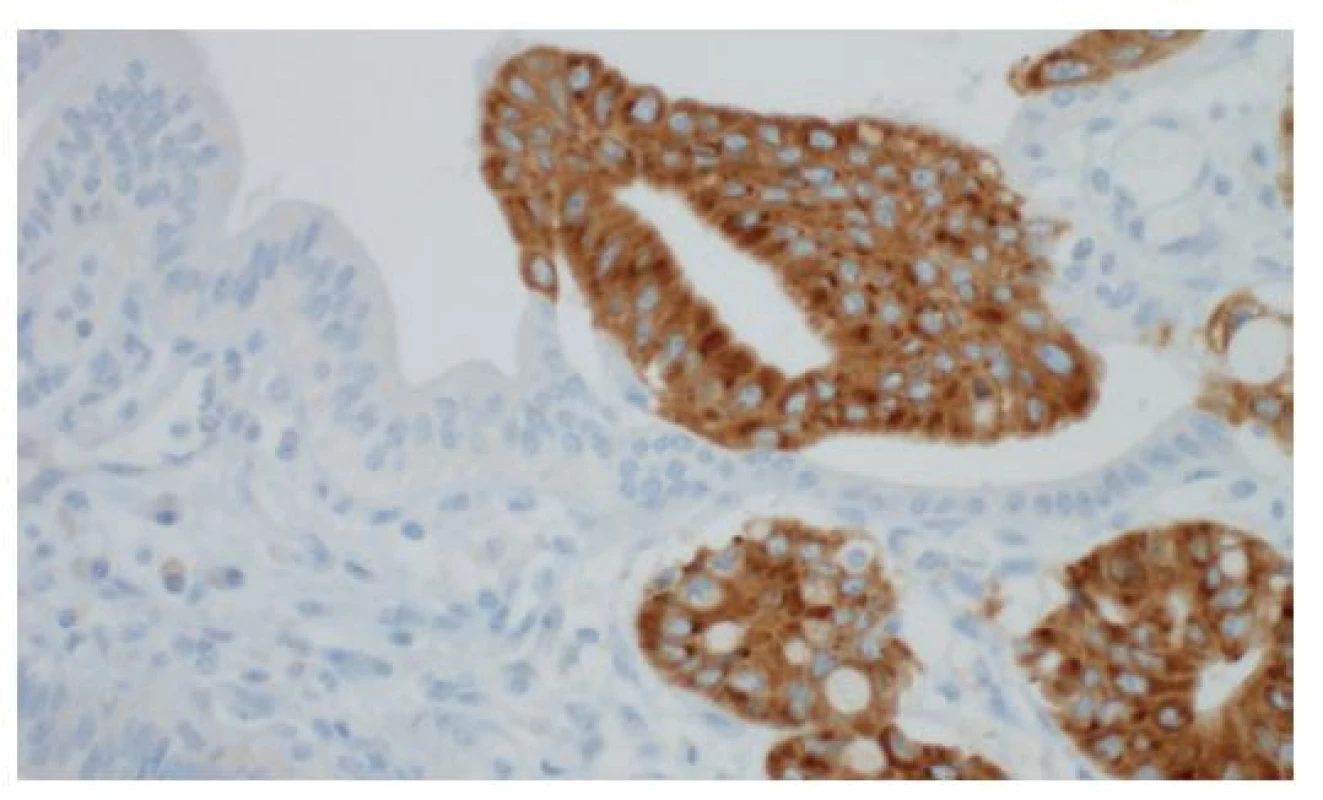
Své uplatnění našly imunohistochemické metody i při odlišení primárního nádoru vycházejícího ze žlučovodů od metastázy z jiného zdroje. Nenádorový epitel i adenokarcinomy žlučovodů a pankreatických vývodů jsou konstantně pozitivní v průkazu „žlázových“ cytokeratinů (CK) 7 a 19 (Obr. 8).
Obr. 8. Imunohistochemická pozitivita žlázového cytokeratinu 19 v disociovaném a rudimentárně glandulárním adenokarcinomu v cholangioskopické biopsii, je patrný budding („pučení“) jednotlivých nádorových buněk a drobných shluků v desmoplastickém stromatu, imunohistochemie, 200×
Fig. 8: Positivity of glandular cytokeratin 19 based on immunohistochemistry in the dissociated and essentially glandular adenocarcinoma from a cholangioscopy biopsy; budding of individual cancer cells and small clusters along with stromal desmoplasia, immunohistochemistry, 200×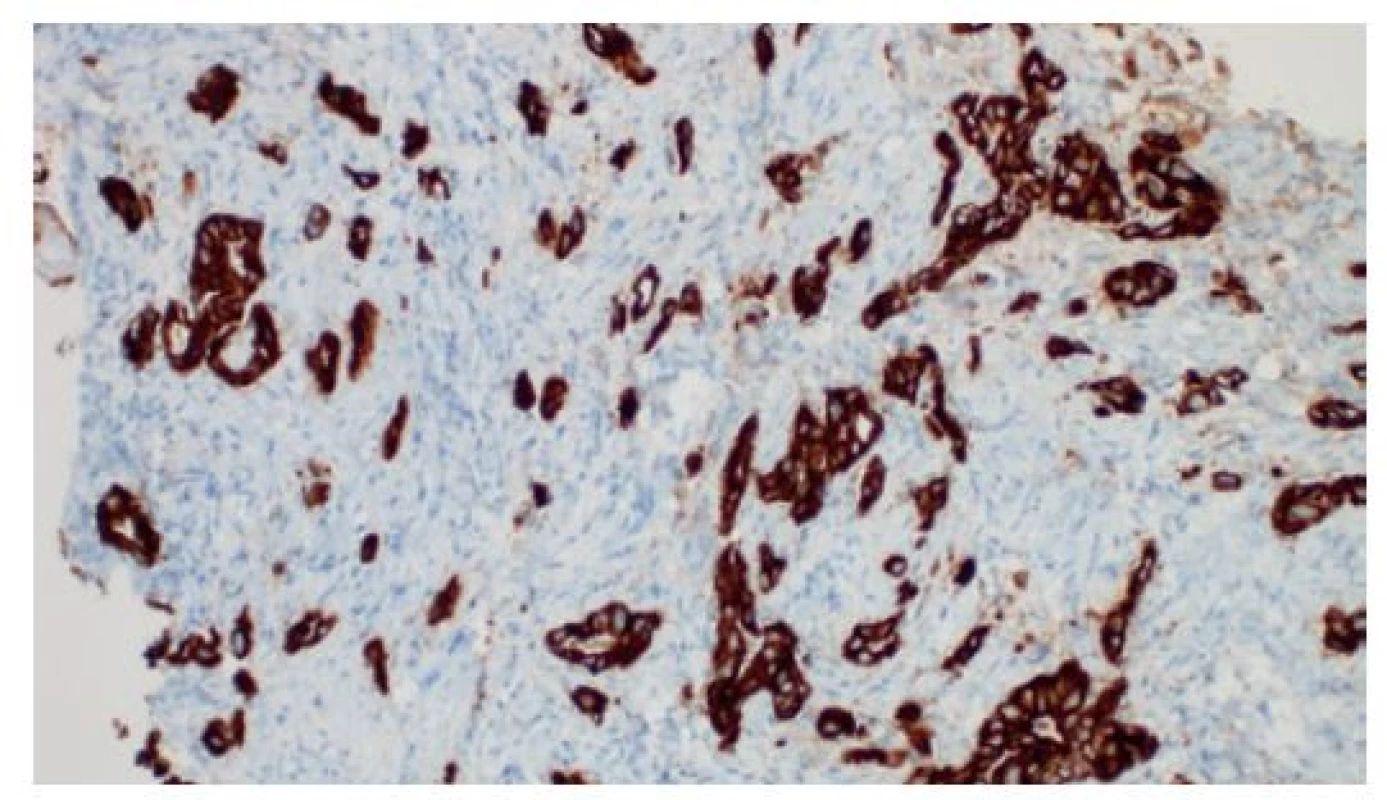
Molekulární markery karcinomu žlučových cest
Současná WHO klasifikace rozděluje cholangiokarcinom na intrahepatální typ (dále se dělí na small duct type neboli periferní a large duct type neboli perihilární situovaný proximálně od hilu) v rámci tumorů jater a na extrahepatální (neboli distální) CCC z extrahepatálních žlučovodů (více Tab. 1) [1,7].
Tab. 1. Vybrané kapitoly z WHO klasifikace 2019 tumorů gastrointestinálního traktu
Tab. 1: Selected chapters of the 2019 WHO classification of tumors of the gastrointestinal tract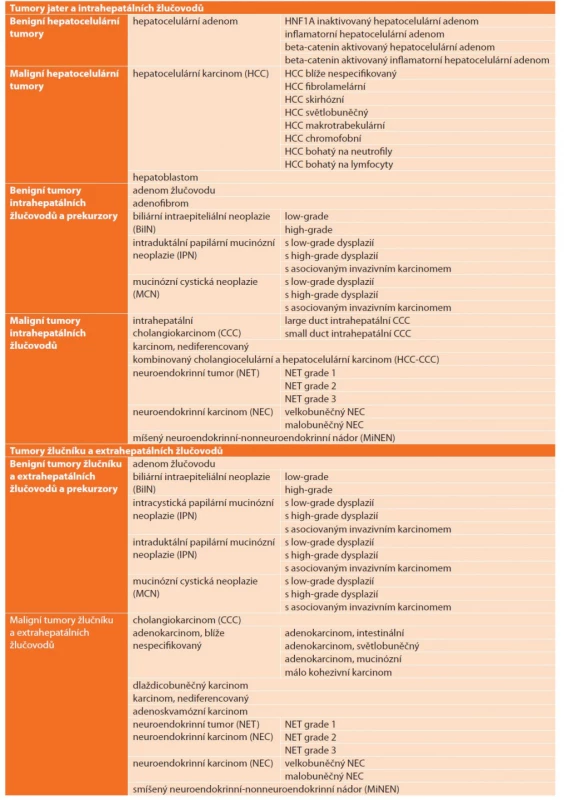
Intrahepatální/small duct type CCC se od perihilárního/ large duct type a extrahepatálního CCC odlišuje nejen lokalizací, ale i expresí některých proteinů, molekulární biologií na úrovni driver onkogenních mutací (v intrahepatálním/small duct type CCC často prokážeme FGFR2 fúzi, IDH1/2 a BAP1 mutace) [8,9] a rovněž prognózou, která je u intrahepatálního/small duct typu cholangiokarcinomu relativně příznivější. Intrahepatální/ small duct type CCC má některé společné znaky se vzácným kombinovaným cholangiocelulárním - hepatocelulárním karcinomem, například expresi c-reaktivního proteinu (CRP) nebo mRNA pro albumin v nádorových buňkách [10–14]. Perihilární/large duct type a extrahepatální CCC pak sdílí epidemiologické, proteomické, genomické a prognostické charakteristiky s duktálním adenokarcinomem pankreatu [12]. Perihilární/extrahepatální CCC se ve srovnání s intrahepatálním CCC vyskytuje častěji u starších nemocných, bývá diagnostikován v pokročilém inoperabilním či generalizovaném stadiu s horší prognózou, vykazuje často driver mutace TP53, KRAS, SMAD4, CDKN2A, ELF3, ARID1B či PRKACA/PRKACB fúzi [8,9] a imunohistochemickou pozitivitu S100P, AGR2 [12,15,16] a FOXF1 [10]. Existují práce popisující na histologické úrovni častější tubulární a tubulopapilární stavbu u perihilárního/extrahepatálního/ large duct type CCC a adenokarcinomu pankreatu a naopak solidně-trabekulární a anastomózující stavbu u intrahepatálního/small duct type CCC [12], výsledky naší studie v tomto směru svědčí spíše pro nespolehlivost samotné mikroskopické morfologie v rozlišení mezi oběma typy CCC, případně jaterní metastázou adenokarcinomu pankreatu [10]. Rozdíly v morfologii, molekulárních vlastnostech a prognóze těchto skupin nádorů lze vysvětlit v pravděpodobném odlišném původu kmenových buněk, ze kterých nádory vznikají [17,18]. Velké žlučovody a pankreatické vývody mají jiný embryonální původ než malé intrahepatální žlučovody: velké žlučovody a pankreas jsou si embryologicky blízce příbuzné, peribiliární žlázky obsahují kmenové buňky schopné diferencovat se v cholangiocyty i v pankreatické aciny [18]. Naopak intrahepatální/ small duct type CCC (a kombinované CCC - HCC) pravděpodobně vznikají – podobně jako malé intrahepatální žlučovody – z jaterních progenitorových buněk přítomných na distálním konci Heringových kanálků [19,20].
Praktickým dopadem popsaného rozlišování mezi jednotlivými typy CCC pak může být možnost predikce prognózy či lepší operability intrahepatálního/small duct type CCC v případě nejasného nálezu na zobrazovacích vyšetřeních, případě častější výskyt terapeuticky ovlivnitelných mutací u intrahepatálního/small duct type CCC (např. IDH1/2). Velký význam by mohl mít případný histologický, imunohistochemický či molekulární znak odlišující primární CCC jater od metastázy adenokarcinomu pankreatu, takový marker však nebyl dosud objeven. Dobré zkušenosti jsou v tomto směru s imunohistochemií CRP [13], potvrzené i v naší studii [10], týká se ovšem pouze intrahepatálního/small duct type CCC, zatímco perihilární/large duct type CCC zůstává od metastázy adenokarcinomu pankreatu histologicky a histochemicky prakticky neodlišitelný.
Prekancerózní léze žlučových cest
Koncept intraepitelové neoplazie poprvé zavedl Ralph Richart v 60. letech 20. století za účelem popisu dysplastických změn děložního čípku a později se toto pojetí rozšířilo i na jiné orgány a systémy. Termín intraepitelová neoplazie odráží naše chápání vzniku zhoubného epitelového nádoru: nádorové buňky vznikají a proliferují nejprve v epitelu nad bazální membránou jako in-situ léze, teprve s postupem času pronikají skrze bazální membránu do stromatu a vzniká invazivní karcinom.
Dysplastické/prekancerózní změny žlučových cest mají obdobnou molekulární biologii a morfologii jako dysplazie ve vývodech pankreatu. Z biologického hlediska se jedná o postupnou akumulaci mutací zejména v terénu chronického zánětu, s častým výskytem mutace KRAS a pozdních mutací genu TP53 [21], spojených s rizikem vzniku invazivního karcinomu.
Plošné dysplastické změny výstelky biliárního stromu označujeme jako biliární intraepiteliální neoplazii (BiIIN), kterou lze dále klasifikovat jako lehkou (BiIIN1a a BiIIN1b), střední (BiIIN2) a těžkou (BiIIN3). Recentní WHO klasifikace pak doporučuje jednodušší dvoustupňový grading na low-grade dysplazii odpovídající původní BiIIN1 a BiIIN2 a na high-grade dysplastické změny, odpovídající BiIIN3 (Obr. 9, 10) [21]. Odlišení low-grade a high-grade dysplazie má význam zejména při histologickém vyšetření resekčních okrajů: high-grade dysplazie přítomná v resekčním okraji je podle některých prací nepříznivým prognostickým faktorem u pacientů po resekci CCC bez uzlinových metastáz [22].
Obr. 9. Histologie těžké dysplazie žlučovodu BiIN3 s pseudostratifikací, ztrátou polarity epitelu a nápadnými jadernými atypiemi (vlevo) na hranici s normálním biliárním epitelem s bazálně situovanými monotónními jádry (vpravo), HE, 400×
Fig. 9: Histology of a high-grade bile duct dysplasia (BiIN3) with pseudostratification, loss of epithelium polarity and marked nuclear atypia (on the left); normal biliary epithelium with monotonous basal situated nuclei (on the right); HE, 400×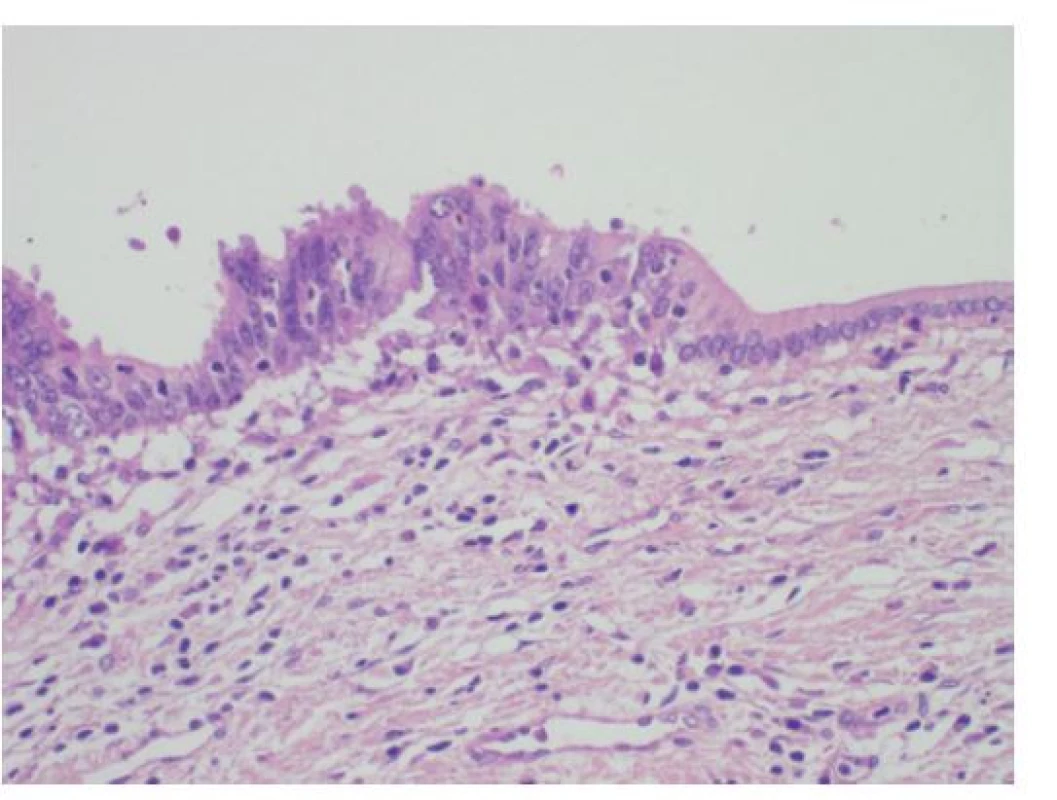
Obr. 10. Histologie lehké dysplazie žlučovodu BiIN1b s papilárně utvářeným vysokým mucinózním cylindrickým epitelem s bazálně uloženými jádry (vlevo) a těžké dysplazie BiIN3 s nápadnými jadernými atypiemi a ztrátou polarity epitelu (vpravo), HE, 400×
Fig. 10: Histology of a low-grade bile duct dysplasia BiIN1b with polarized papillary tall columnar mucin-producing epithelium (on the left); high-grade dysplasia BiIN3 with marked cytonuclear atypia and loss of epithelium polarity (on the right); HE, 400×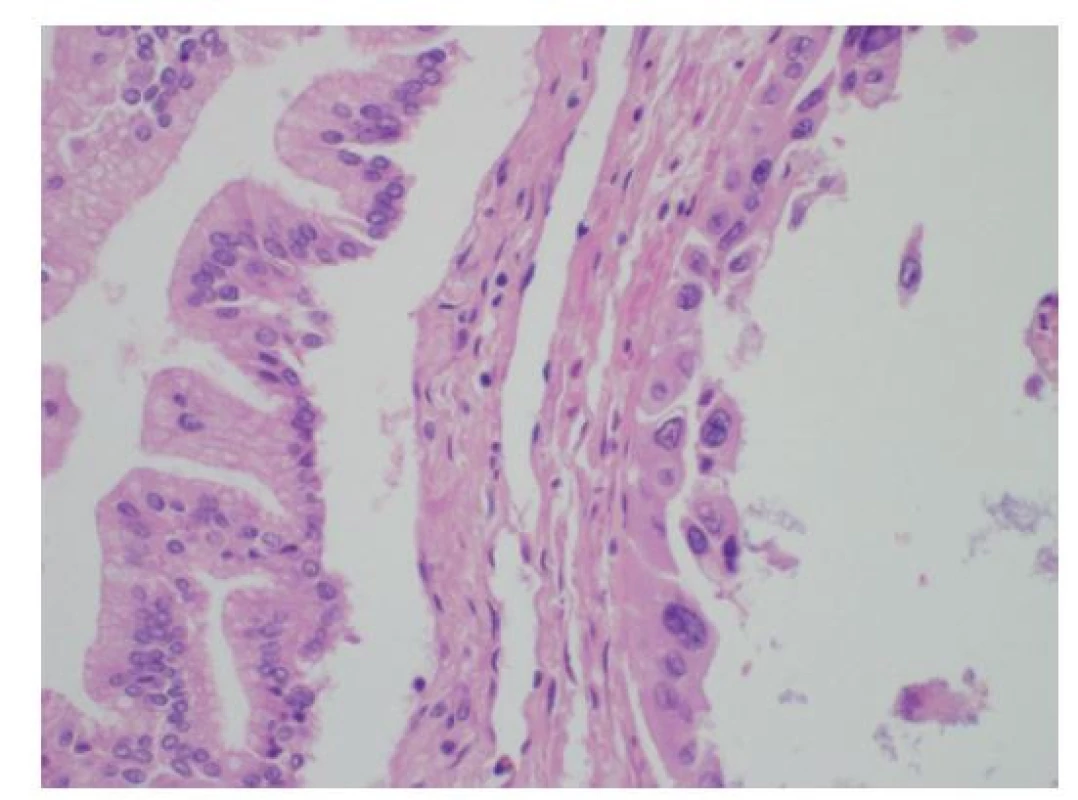
Dysplastické změny s prakticky identickou histomorfologií jako BilIN nacházíme rovněž v papilárních či cystických nádorech vycházejících ze žlučových cest či vývodů pankreatu. Jedná se zejména o intraduktální papilární neoplazii (IPN) žlučovodu a intracholecystickou papilární neoplazii (ICPN) žlučníku, kterou při mnohočetném výskytu označujeme jako papilomatózu žlučovodů nebo žlučníku [23,24], a dále o mucinózní cystickou neoplazii (MCN) s typickou přítomností vřetenobuněčného stromatu připomínající stroma ovariální [25], která častěji než ve žlučových cestách nacházíme v kaudě pankreatu. IPN, ICPN i MCN s low-grade dysplazií chápeme jako benigní nádory s nižším prekancerózním potenciálem, tumory s high-grade dysplazií pak odpovídají karcinomu in situ. Dysplastické změny mohou být v papilárních i cystických tumorech navíc asociovány s invazivním adenokarcinomem. Nádorový staging se v těchto případech řídí parametry invazivní komponenty.
Morfologická diferenciální diagnostika cholangiokarcinomu
V rutinní diagnostické praxi se patolog často setkává s problémem stanovení primárního původu karcinomu zastiženého v punkční biopsii či resekátu. V hepatobiliární patologii je zásadní zejména odlišení primárního CCC od metastázy adenokarcinomu jiného origa, což může být v některých případech, např. u metastázy duktálního karcinomu pankreatu či adenokarcinomu žaludku, krajně obtížné i při využití širokého spektra imunohistochemických metod.
Příznivější je z pohledu diagnostiky možnost odlišení CCC od jaterní metastázy kolorektálního karcinomu (CRC), který má kromě relativně typické morfologie na úrovni základního barvení hematoxylinem a eosinem i charakteristický imunofenotyp. Charakteristická je pro metastázy CRC pozitivita CK20, který je v CCC a metastázách adenokarcinomů pankreatobiliárního typu obvykle negativní; CK20 má v této indikaci limitovanou senzitivitu i specificitu. Vysokou specificitu a poměrně vysokou senzitivitu má u metastáz CRC imunohistochemie transkripčních faktorů caudal homeobox 2 (CDX2) a Special AT-rich sequence-binding protein 2 (SATB2). CDX2 je pozitivní v 86 % případů CRC [26]. Podstatná část případů CCC vykazuje rovněž expresi CDX2 (29 % u karcinomů žlučníku, 22 % u karcinomů extrahepatálních žlučovodů a 5 % u intrahepatálních CCC), ale ne tak často a intenzivně jako kolorektální karcinom [27]. Lepší senzitivitu a specificitu pro metastázu CRC vykazuje imunohistochemie SATB2, která je pozitivní v 92–96 % CRC [28,29], ale jen ve 2 % CCC [30]. Pro CCC je typická již zmíněná pozitivita CK7 a negativita CK20, přičemž opačný profil (CK20+CK7-) je přítomen v 85 % jaterních metastáz CRC [31]. Naopak CK20 je pozitivní až v 70 % CCC, častěji v hilových a extrahepatálních v porovnání s periferními CCC [32]; pouhá pozitivita CK20 zejména s pozitivitou CK7 a bez charakteristické morfologie pro kolorektální origo příliš nesvědčí. V praxi patologa je pak v případě nejasné kliniky, endoskopie, zobrazovacích metod a morfologie vhodné užití kombinace vyšetření CK20, CK7, CDX2 a SATB2. Exprese CK7, vyskytující se v 96 % CCC [32], je popisována u cca 10 % kolorektálních karcinomů, u nichž je asociována s horší prognózou [33]. CK19, který je konstantně exprimován v CCC, je pravidelně pozitivní i v CRC. V praxi se můžeme setkat s nutností odlišit zejména periferní intrahepatální CCC od hepatocelulárního karcinomu (HCC), což lze poměrně snadno pomocí pozitivní imunohistochemie hepatocyte paraffin 1 (HepPar1) v HCC. V játrech se mohou vyskytovat i metastázy extragastrointestinálních adenokarcinomů. Plicní adenokarcinom lze s 80% senzitivitou diagnostikovat pomocí „orgánově specifických“ markerů thyroidního transkripčního faktoru 1 (TTF-1) a napsinu-A. Metastázu karcinomu mammy lze poměrně spolehlivě odhalit pomocí imunohistochemické detekce GATA3, která je pozitivní v 95 % karcinomů mammy a jen v 3 % CCC [34]. Méně senzitivními, avšak hodně specifickými markery karcinomu mammy jsou estrogenový receptor, progesteronový receptor a mammaglobin. Při suspekci na málo obvyklou jaterní metastázu adenokarcinomu prostaty je na místě imunohistochemie transkripčního faktoru NKX3.1, který má 99% senzitivitu a 100% specificitu, tedy ještě lepší než prostatický superficiální antigen (PSA), který má senzitivitu „jen“ 94 % [35].
Patologická TNM klasifikace
V současné době vstoupilo v platnost 8. vydání klasifikace TNM [36] (Tab. 2).
Tab. 2. Shrnutí aktuální patologické TNM klasifikace maligních nádorů intrahepatálních žlučovodů, žlučníku, mimojaterních perihilárních a distálních žlučovodů a Vaterské papily
Tab. 2: Recent pathological TNM classification of malignant tumors of intrahepatic, perihilar, and extrahepatic bile ducts, gallbladder, and ampulla of Vater
U nádorů intrahepatálních žlučových cest je hlavní novinkou v 8. vydání subklasifikace původní kategorie T1 na podkategorie T1a a T1b podle velikosti největšího nádorového ložiska (hranice 5 cm) a dále rozdělení T2 na T2a a T2b podle toho, zda je nádor solitární, či vícečetný.
U nádorů žlučníku je novinkou rozdělení T2 (postižení perimuskulární pojivové tkáně) na T2a a T2b podle toho, zda se jedná o postižení subserózy (T2a), nebo postižení na jaterní straně (T2b), ovšem bez prorůstání do jater či na serózu. Nová je též kategorie N2 při metastatickém postižení 4 a více regionálních mízních uzlin.
Klasifikace nádorů perihilárních žlučových cest zůstává v kategorii T beze změny, obdobně jako u žlučníku přibývá kategorie N2 pro stadium nádorového postižení ≥4 mízních uzlin.
Největší změny se týkají nádorů distálních žlučovodů (ductus choledochus), přičemž ve starším, 7. vydání se kategorie T1–4 řídila anatomickou vrstvou, do níž vrůstá nádor, zatímco v aktuálním, 8. vydání se T řídí hloubkou nádorové invaze ve stěně žlučovodu v milimetrech. T1 odpovídá hloubce <5 mm, T2 mezi 5 a 12 mm a T3 >12 mm. Stadium T4 je stejně jako v 7. vydání definováno postižením truncus coeliacus, a. mesenterica superior nebo a. hepatica communis. Podobně jako u předchozích skupin přibyla nová kategorie N2 pro nádory postihující ≥4 mízní uzliny. U nádorů mimojaterních žlučovodů se řídí zejména kategorie T3 a T4 pohledem onkochirurga z hlediska možné resekability nádoru.
Peroperační histologické vyšetření ve zmraženém řezu
Peroperační histologická diagnostika lézí žlučových cest patří mezi obtížné oblasti i pro zkušeného rutinního patologa.
Jednou z indikací peroperační histologie je klinická suspekce na malignitu jater či žlučových cest, kdy z různých důvodů není možné provedení probatorní biopsie před operací [37].
Častým a důležitým důvodem peroperačního histologického vyšetření je také posouzení resekčních okrajů žlučovodů. Různé práce udávají shodu mezi intraoperativní diagnózou ve zmraženém řezu a definitivní diagnózou v parafinových řezech „jen“ v 56–91 % případů [38–41], přičemž nejčastější diskordance je v případech nejasného či hraničního peroperačního závěru, který je pak definitivně uzavřen jako onkologicky negativní [39]. Neshodu a nejasnosti v peroperační histologii lze přičítat zejména mechanickému zhmoždění nefixovaného epitelu a rovněž zmrazovacím artefaktům, kdy příliš rychlá změna teploty může vést k arteficiálnímu „nabobtnání“ jader epitelových buněk a velká jádra mohou imponovat jako dysplazie [39]. Dalším problémem je častý výskyt zánětu při zavedeném stentu indukující regenerativní jaderné atypie biliárního epitelu [42]. V několika studiích bylo ukázáno, že signifikantním prediktorem horší prognózy a lokální recidivy karcinomu žlučovodů či žlučníku po operaci je průkaz invazivního karcinomu v resekčním okraji, zatímco dysplazie včetně těžké významný vliv na lokální rekurence ani na přežití pacientů po resekci nemá [40,41,43,44]. Recentní metaanalýza 11 předchozích prací popisuje vyšší míru lokální rekurence u pacientů s těžkou dysplazií/carcinoma in situ v resekčním okraji, nejedná se však o faktor zhoršující prognózu nezávisle na TNM stadiu [45].
Výtěžnost histologie resekčních okrajů ve zmraženém řezu lze zvýšit užitím otiskové cytologie [46]. Konishi et al. popisují u resekcí extrahepatálního CCC vyšší míru lokálních rekurencí a horší přežití u případů s onkologicky pozitivním proximálním resekčním okrajem, zatímco postižení distálního okraje u vysoko uložených nádorů nepříznivý vliv nemělo [47]. Kromě pozitivního axiálního resekčního okraje žlučovodu je nepříznivým prognostickým faktorem i postižení obvodového/radiálního resekčního okraje, který je však zřídka zastižen v peroperační histologii [48].
Dalším možným využitím metody peroperační histologie v biliární patologii je diagnostika ložiskových procesů, zejména identifikace metastatického rozsevu cholangiokarcinomu. Pozitivní nález bývá zpravidla důvodem k ukončení operačního výkonu. Problematika diferenciální diagnostiky CCC a metastatických adenokarcinomů již byla probrána. Peroperační diagnostika je limitována relativně omezenou dostupností imunohistochemického vyšetření zmražených řezů.
Jaterní metastázy adenokarcinomu mohou imitovat také benigní cholangiocelulární léze, zejména biliární adenom (bile duct adenoma), vzácný adenofibrom nebo biliární hamartom/von Meyenburgův komplex. Biliární hamartomy podle současného názoru nevyžadují léčbu, podle novějších poznatků se však patrně jedná o prekurzorovou lézi intrahepatálního CCC [49]. Peroperační histologické vyšetření v rukách zkušeného patologa odliší benigní lézi jater od maligní s 97% senzitivitou a 99% specificitou [50].
Shrnutí
Podrobné histomorfologické vyšetření hraje v diagnostice biliárních lézí nezastupitelnou roli, a to nejen z hlediska přesného určení povahy a rozsahu vlastního patologického procesu, ale rovněž ve stanovení imunohistochemických a molekulárně genetických parametrů rozhodujících pro správné nastavení a monitorování účinnosti terapeutických postupů.
Sezam zkratek:
BiIN – biliární intraepiteliální neoplazie
CCC – cholangiocelulární karcinom
CCC-HCC – cholangiocelulární karcinom-hepatocelulární karcinom
CDX2 – caudal homeobox 2
CRC – kolorektální karcinom
CRP – C-reaktivní protein
CK – cytokeratin
HCC – hepatocelulární karcinom
HE – hematoxylin-eosin
HepPar1 – hepatocyte paraffin 1
IMP3 – insulin-like growth factor II mRNA binding protein 3
IPN – intraduktální papilární neoplazie
ICPN – intracholecystická papilární neoplazie
MCN – mucinózní cystická neoplazie
PSA – prostatický superficiální antigen
PSC – primární sklerózující cholangoitis
SATB2 – special AT-rich sequence-binding protein 2
TTF1 – thyroidní transkripční faktor 1
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Jan Hrudka, Ph.D.
Ústav patologie 3. LF UK a FNKV
Šrobárova 1150/50 Praha 10
e-mail: jan.hrudka@lf3.cuni.cz
Zdroje
1. Nakanuma Y, Klimstra DS, Komuta M, et al. Intrahepatic cholangiocarcinoma. In: WHO classification of tumours editorial board: Digestive system tumours. Lyon (France) International Agency for Research on Cancer 2019 : 254–259.
2. Roa JC, Adsay NV, Arola J, et al. Carcinoma of the gallbladder. In: WHO classification of tumours editorial board: Digestive system tumours. Lyon (France): International Agency for Research on Cancer 2019 : 283–288.
3. Roa JC, Adsay NV, Arola J, et al. Carcinoma of the extrahepatic bile ducts. In: WHO classification of tumours editorial board. Digestive system tumours. Lyon (France): International Agency for Research on Cancer 2019 : 289–291.
4. Tyson GL, El-Serag HB. Risk factors for cholangiocarcinoma. Hepatology 2011;54(1):173–184. doi:10.1002/ hep.24351.
5. Honsová E. Patologie jater a žlučových cest. In: Zámečník J. Patologie. LD, s.r.o. Prager publishing, 2019 : 550.
6. Kawashima H, Itoh A, Ohno E, et al. Diagnostic and prognostic value of immunohistochemical expression of S100P and IMP3 in transpapillary biliary forceps biopsy samples of extrahepatic bile duct carcinoma. J Hepatobiliary Pancreat Sci. 2013;20(4):441–447. doi:10.1007/s00534 - 012-0581-z.
7. Oliverius M, Havlůj L, Hajer J, et al. Chirurgická léčba cholangiocelulárního karcinomu. Cas Lek Cesk. 2019;158(2):73–77.
8. Lowery MA, Ptashkin R, Jordan E, et al. Comprehensive molecular profiling of intrahepatic and extrahepatic cholangiocarcinomas: Potential targets for intervention. Clin Cancer Res. 2018;24(17):4154 – 4161. doi:10.1158/1078-0432.CCR-18 - 0078.
9. Kendall T, Verheij J, Gaudio E, et al. Anatomical, histomorphological and molecular classification of cholangiocarcinoma. Liver Int. 2019;39 Suppl 1 : 7–18. doi:10.1111/liv.14093.
10. Hrudka J, Prouzová Z, Mydlíková K, et al. FOXF1 as an immunohistochemical marker of hilar cholangiocarcinoma or metastatic pancreatic ductal adenocarcinoma. Single institution experience. Pathol Oncol Res. 2021;27 : 1609756. doi:10.3389/pore.2021.1609756.
11. Sempoux C, Kakar S, Kondo F, et al. Combined hepatocellular-cholangiocarcinoma and undifferentiated primary liver carcinoma. In: WHO classification of tumors editorial board: Digestive system tumors. 5th ed. Vol. 1. Lyon, France: International Agency for Research on Cancer 2019 : 60–262.
12. Nakanuma Y, Sato Y. Hilar cholangiocarcinoma is pathologically similar to pancreatic duct adenocarcinoma: suggestions of similar background and development. J Hepatobiliary Pancreat Sci. 2014;21(7):441–447. doi:10.1002/ jhbp.70.
13. Yeh YC, Lei HJ, Chen MH, et al. C-reactive protein (CRP) is a promising diagnostic immunohistochemical marker for intrahepatic cholangiocarcinoma and is associated with better prognosis. Am J Surg Pathol. 2017;41(12):1630–1641. doi:10.1097/PAS.0000000000000957.
14. Shahid M, Mubeen A, Tse J, et al. Branched chain in situ hybridization for albumin as a marker of hepatocellular differentiation: evaluation of manual and automated in situ hybridization platforms. Am J Surg Pathol. 2015; 9(1):25–34. doi:10.1097/ PAS.0000000000000343.
15. Gandou C, Harada K, Sato Y, et al. Hilar cholangiocarcinoma and pancreatic ductal adenocarcinoma share similar histopathologies, immunophenotypes, and development-related molecules. Hum Pathol. 2013;44(5):811–821. doi:10.1016/j.humpath.2012.08.004.
16. Lepreux S, Bioulac-Sage P, Chevet E. Differential expression of the anterior gradient protein-2 is a conserved feature during morphogenesis and carcinogenesis of the biliary tree. Liver Int. 2011;31(3):322–328. doi:10.1111/j.1478 - 3231.2010.02438.x.
17. Nakanuma Y, Sato Y, Harada K, et al. Pathological classification of intrahepatic cholangiocarcinoma based on a new concept. World J Hepatol. 2010;2(12):419 – 427. doi:10.4254/wjh.v2.i12.419.
18. Hrudka J, Oliverius M, Gürlich R. Patologie cholangiocelulárního karcinomu. Cas Lek Cesk. 2019;158(2):57–63.
19. Carpino G, Cardinale V, Onori P, et al. Biliary tree stem/progenitor cells in glands of extrahepatic and intrahepatic bile ducts: an anatomical in situ study yielding evidence of maturational lineages. J Anat. 2012;220(2):186–199. doi:10.1111/ j.1469-7580.2011.01462.x.
20. Komuta M, Govaere O, Vandecaveye V, et al. Histological diversity in cholangiocellular carcinoma reflects the different cholangiocyte phenotypes. Hepatology 2012;55(6):18761888. doi:10.1002/ hep.25595.
21. Basturk O, Aishima S, Esposito I. Biliary intraepithelial neoplasia. In: WHO classification of tumours editorial board. Digestive system tumours. Lyon (France): International Agency for Research on Cancer 2019 : 273–275.
22. Higuchi R, Yazawa T, Uemura S, et al. Highgrade dysplasia/carcinoma in situ of the bile duct margin in patients with surgically resected node-negative perihilar cholangiocarcinoma is associated with poor survival: a retrospective study. J Hepatobiliary Pancreat Sci. 2017;4(8):456–465. doi:10.1002/jhbp.481.
23. Nakanuma Y, Basturk O, Esposito I, et al. Intraductal papillary neoplasm of the bile ducts. In: WHO classification of tumours editorial board. Digestive system tumours. Lyon (France): International Agency for Research on Cancer 2019 : 279–282.
24. Basturk O, Aishima S, Esposito I. Intracholecystic papillary neoplasm. In: WHO classification of tumours editorial board. Digestive system tumours. Lyon (France): International Agency for Research on Cancer 2019 : 276–278.
25. Devaney K, Goodman ZD, Ishak KG. Hepatobiliary cystadenoma and cystadenocarcinoma. A light microscopic and immunohistochemical study of 70 patients. Am J Surg Pathol. 1994;18(11):1078–1091.
26. Kaimaktchiev V, Terracciano L, Tornillo L, et al. The homeobox intestinal differentiation factor CDX2 is selectively expressed in gastrointestinal adenocarcinomas. Mod Pathol. 2004;17(11):1392–1399. doi:10.1038/modpathol.3800205.
27. Suzuki S, Sakaguchi T, Yokoi Y, et al. Clinicopathological prognostic factors and impact of surgical treatment of mass-forming intrahepatic cholangiocarcinoma. World J Surg. 2002;26(6):687 – 693. doi:10.1007/s00268-001-0291-1.
28. Cígerová V, Adamkov M, Drahošová S, et al. Immunohistochemical expression and significance of SATB2 protein in colorectal cancer. Ann Diagn Pathol. 2021;52 : 151731. doi:10.1016/j.anndiagpath. 2021.151731.
29. Zhang YJ, Chen JW, He XS, et al. SATB2 is a promising biomarker for identifying a colorectal origin for liver metastatic adenocarcinomas. EBioMedicine 2018;28 : 62–69. doi:10.1016/j.ebiom. 2018.01.001.
30. De Michele S, Remotti HE, Del Portillo A, et al. SATB2 in neoplasms of lung, pancreatobiliary, and gastrointestinal origins. Am J Clin Pathol. 2021;155(1):124–132. doi:10.1093/ajcp/aqaa118.
31. Tot T, Samii S. The clinical relevance of cytokeratin phenotyping in needle biopsy of liver metastasis. APMIS. 2003;111(12):1075-82. doi:10.1111/j. 1600-0463.2003.apm1111201.x.
32. Rullier A, Le Bail B, Fawaz R, et al. Cytokeratin 7 and 20 expression in cholangiocarcinomas varies along the biliary tract but still differs from that in colorectal carcinoma metastasis. Am J Surg Pathol. 2000;24(6):870–876. doi:10.1097/00000478-200006000 - 00014.
33. Hrudka J, Fišerová H, Jelínková K, et al. Cytokeratin 7 expression as a predictor of an unfavorable prognosis in colorectal carcinoma. Sci Rep. 2021;11(1):17863. doi:10.1038/s41598-021-97480-4.
34. Clark BZ, Beriwal S, Dabbs DJ, et al. Semiquantitative GATA-3 immunoreactivity in breast, bladder, gynecologic tract, and other cytokeratin 7-positive carcinomas. Am J Clin Pathol. 2014;142(1):64–71. doi:10.1309/AJCP8H2VBDSCIOBF.
35. Gurel B, Ali TZ, Montgomery EA, et al. NKX3.1 as a marker of prostatic origin in metastatic tumors. Am J Surg Pathol. 2010;34(8):1097 – 1105. doi:10.1097/PAS.0b013e3181e6cbf3.
36. Brierley JD, Gospodarowitz MK, Wittekind C. TNM klasifikace zhoubných novotvarů, osmé vydání. ÚZIS, Praha, 2018 : 97–104.
37. Švajdler P, Daum O, Dubová M, et al. Peroperačné vyšetrenie pankreasu, žlčníka, extrahepatálnych žlčových ciest, pečene a gastrointestinálneho traktu. Cesk Patol. 2018; 54(2):63–71.
38. Okazaki Y, Horimi T, Kotaka M, et al. Study of the intrahepatic surgical margin of hilar bile duct carcinoma. Hepatogastroenterology 2002;49(45):625–627.
39. Shiraki T, Kuroda H, Takada A, et al. Intraoperative frozen section diagnosis of bile duct margin for extrahepatic cholangiocarcinoma. World J Gastroenterol. 2018;24(12):1332–1342. doi:10.3748/wjg. v24.i12.1332.
40. Yamaguchi K, Shirahane K, Nakamura M, et al. Frozen section and permanent diagnoses of the bile duct margin in gallbladder and bile duct cancer. HPB (Oxford) 2005;7(2):135–138. doi:10.1080/13651820510028873.
41. Endo I, House MG, Klimstra DS, et al. Clinical significance of intraoperative bile duct margin assessment for hilar cholangiocarcinoma. Ann Surg Oncol. 2008;15(8):2104–2112. doi:10.1245/ s10434-008-0003-2.
42. Furukawa T, Higuchi R, Yamamoto M. Clinical relevance of frozen diagnosis of ductal margins in surgery of bile duct cancer. J Hepatobiliary Pancreat Sci. 2014;21(7):459–462. doi:10.1002/ jhbp.73.
43. Igami T, Nagino M, Oda K, et al. Clinicopathologic study of cholangiocarcinoma with superficial spread. Ann Surg. 2009;249(2):296–302. doi:10.1097/SLA. 0b013e318190a647.
44. Matthaei H, Lingohr P, Strässer A, et al. Biliary intraepithelial neoplasia (BilIN) is frequently found in surgical margins of biliary tract cancer resection specimens but has no clinical implications. Virchows Arch. 2015; 466(2):133–141. doi:10.1007/ s00428-014-1689-0.
45. Ke Q, Wang B, Lin N, et al. Does highgrade dysplasia/carcinoma in situ of the biliary duct margin affect the prognosis of extrahepatic cholangiocarcinoma? A meta-analysis. World J Surg Oncol. 2019;17(1):211. doi:10.1186/s12957-019 - 1749-7.
46. Tone K, Kojima K, Hoshiai K, et al. Utility of intraoperative cytology of resection margins in biliary tract and pancreas tumors. Diagn Cytopathol. 2015;43(5):366–373. doi:10.1002/dc.23240.
47. Konishi M, Iwasaki M, Ochiai A, et al. Clinical impact of intraoperative histological examination of the ductal resection margin in extrahepatic cholangiocarcinoma. Br J Surg. 2010;97(9):1363–1368. doi:10.1002/bjs.7122. PMID: 20632323.
48. Sakamoto Y, Kosuge T, Shimada K, et al. Prognostic factors of surgical resection in middle and distal bile duct cancer: an analysis of 55 patients concerning the significance of ductal and radial margins. Surgery 2005;137(4):396–402. doi:10.1016/j.surg.2004.10.008.
49. Bhalla A, Mann SA, Chen S, et al. Histopathological evidence of neoplastic progression of von Meyenburg complex to intrahepatic cholangiocarcinoma. Hum Pathol. 2017;67 : 217–224. doi:10.1016/j. humpath.2017.08.004.
50. Rakha E, Ramaiah S, McGregor A. Accuracy of frozen section in the diagnosis of liver mass lesions. J Clin Pathol. 2006;59(4):352–354. doi:10.1136/jcp. 2005.029538.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína Gastroenterologie a hepatologie
Článek Defenzivní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2022 Číslo 10- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Doktorský studijní program v biomedicíně − obor Experimentální chirurgie
- Prognostické faktory renálního karcinomu
- Cholangiocelulární karcinom z pohledu patologa
- Analýza pooperačních komplikací po otevřených hernioplastikách kýly v jizvě – retrospektivní analýza kohorty pacientů
- Prínos peroperačného histologického vyšetrenia lymfatických uzlín centrálneho kompartmentu v manažmente nízkorizikového diferencovaného karcinómu štítnej žľazy
- Inflamatorní kloakogenní polyp u adolescenta – kazuistika a přehled literatury
- Akutní apendicitida v supraumbilikální hernii
- Brániční kýla po radiofrekvenční ablaci jaterního nádoru, kazuistika a literární přehled
- Defenzivní medicína
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Cholangiocelulární karcinom z pohledu patologa
- Akutní apendicitida v supraumbilikální hernii
- Prognostické faktory renálního karcinomu
- Inflamatorní kloakogenní polyp u adolescenta – kazuistika a přehled literatury
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



