-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hledání ztraceného ráje – alternativní místa pro transplantaci izolovaných Langerhansových ostrůvků
Finding Eden – alternative transplantation sites for pancreatic islets
Pancreatic islets transplantation is an established treatment method for type 1 diabetic patients with the hypoglycemia unawareness syndrome in whom a therapy with modern technologies fails. Islet transplantation is most commonly done using an interventional radiology method: a tissue suspension of pancreatic islets is applied into a branch of the portal vein through a percutaneously installed catheter. Although being minimally invasive unlike pancreas organ transplant, this method is associated with many technical difficulties. Possible complications of the procedure include hemorrhage and portal vein thrombosis. Unlike their natural dispersed localization in exocrine pancreas, isolated pancreatic islets are exposed to hypoxia, toxins and immunosuppressive drugs in the liver parenchyma. Direct contact with the recipient’s blood causes an instant blood mediated inflammatory reaction (IBMIR) resulting in the death of more than half of the pancreatic islets shortly after their application. Therefore the size of the islet graft is often insufficient and a number of transplanted patients require administration of exogenous insulin. All of these are reasons for seeking an alternative transplantation site with more hospitable conditions for long-term islet survival. Various transplantation sites have been tested in experimental and clinical research. The advantages and disadvantages of some of them are summarized in this paper. Currently, transplantation into the greater omentum seems most promising, which has already been used in clinical practice at several institutions.
Keywords:
Transplantation – type 1 diabetes mellitus – pancreatic islets – hypoglycemia unawareness syndrome – omentum
Autoři: Z. Hladíková 1,2; Z. Berková 3; A. Pátíková 2,3; B. Hagerf 1,2; I. Leontovyč 3; J. Kříž 1,2; T. Marada 4; J. Froněk 4; F. Saudek 1,2
Působiště autorů: Centrum diabetologie, Institut klinické a experimentální medicíny, Praha 1; 1. lékařská fakulta, Univerzita Karlova, Praha 2; Laboratoř Langerhansových ostrůvků, Centrum experimentální medicíny, Institut klinické a experimentální medicíny, Praha 3; Klinika transplantační chirurgie, Transplantcentrum, Institut klinické a experimentální medicíny, Praha 4
Vyšlo v časopise: Rozhl. Chir., 2022, roč. 101, č. 1, s. 14-21.
Kategorie: Souhrnné sdělení
doi: https://doi.org/10.33699/PIS.2022.101.1.14–21Souhrn
Transplantace Langerhansových ostrůvků představuje zavedenou metodu léčby pacientů s diabetem 1. typu se syndromem porušeného vnímání hypoglykemie, u kterých selhává použití moderních technologických postupů. Nejčastěji se jedná o radiointervenční metodu, při které se suspenze pankreatických ostrůvků podává perkutánně zavedeným katétrem do větve portální žíly. Ačkoliv se na rozdíl od orgánové transplantace pankreatu jedná o výkon jen minimálně invazivní, řada technických problémů zůstává nevyřešena. Mezi možné komplikace patří zejména krvácení a trombóza portální žíly. Na rozdíl od svého přirozeného umístění disperzně ve tkáni exokrinního pankreatu jsou izolované transplantované ostrůvky v jaterním parenchymu vystaveny bezprostřední hypoxii, přímému působení toxinů a imunosupresivních léčiv. Přímý kontakt s krví příjemce vyvolává bezprostřední zánětlivou reakci, tzv. IBMIR (instant blood mediated inflammatory reaction), díky které i více než polovina transplantovaných buněk po aplikaci zaniká. Velikost ostrůvkového štěpu je proto často nedostatečná a řada pacientů potřebuje po výkonu určité množství exogenního inzulinu. To všechno jsou důvody, proč hledáme pro ostrůvkový štěp jiné místo transplantace s příznivějšími podmínkami pro dlouhodobé přežívání. V experimentálním i klinickém výzkumu byla zkoušena různá aplikační místa, jejichž výhody a nevýhody shrneme v tomto sdělení. Jako nejnadějnější se v současné době jeví transplantace do velkého omenta, která již byla na několika pracovištích klinicky použita.
Klíčová slova:
syndrom porušeného vnímání hypoglykemie – diabetes mellitus 1. typu – transplantace – Langerhansovy ostrůvky – omentum
ÚVOD
Transplantace Langerhansových ostrůvků představuje dnes již zavedenou metodu léčby pro vybrané pacienty s diabetem 1. typu se syndromem porušeného vnímání hypoglykemie. Ve střednědobém horizontu se v některých centrech výsledky již začínají blížit výsledkům po orgánové transplantaci pankreatu [1]. K dosažení úplné nezávislosti na inzulinu je však často potřeba transplantaci jednou či dvakrát opakovat [2]. Langerhansovy ostrůvky se získávají procesem izolace z dárcovského pankreatu digescí pomocí enzymu kolagenázy a následně jsou od exokrinní tkáně odděleny v hustotním gradientu. Samotná transplantace tkáňové suspenze pankreatických ostrůvků se provádí nejčastěji radiointervenčně aplikací do větve portální žíly perkutánně zavedeným katétrem. Ostrůvky se následně usadí v jaterních sinusoidách.
Pankreas – přirozené prostředí pro Langerhansovy ostrůvky
Ačkoliv tvoří ostrůvky pouze 1–2 % celkové tkáně pankreatu, jejich krevní zásobení zahrnuje až z 20 % všech terminálních arteriol pankreatu. Průtok krve ostrůvky je přibližně desetkrát vyšší než v exokrinním pankreatu, a proto jeho narušení vede snadno k hypoxickému poškození [3]. Uspořádání jejich cévního řečiště usnadňuje parakrinní signalizaci mezi buňkami ostrůvků a exokrinního pankreatu [4]. Pro správnou funkci β-buněk ostrůvků jsou zásadní složení a mikroarchitektonika okolního prostředí, kontakty s proteiny extracelulární matrix a autonomní nervové zásobení. β-buňky komunikují s ECM přes integrinové receptory, tento kontakt je důležitý zejména pro přežívání a glukózou regulovanou sekreci inzulínu [5]. Při procesu izolace z exokrinního prostředí s použitím enzymatických a hrubých mechanických prostředků se vazby mezi ostrůvky, exokrinními buňkami a proteiny extracelulární matrix kompletně přeruší. Ostrůvky tak ztrácejí svůj ráj a jejich další osud značně závisí na tom, jak se nám při transplantačním procesu podaří jej napodobit.
Transplantace ostrůvků do jater
Implantace izolovaných ostrůvků cestou vena portae je zatím dlouhodobě nejúspěšnější metodou využívanou v klinické praxi. Jedná se o miniinvazivní výkon, který nevyžaduje celkovou anestezii. Rekonvalescence je krátká v řádu dní a výskyt komplikací je ve srovnání s orgánovou transplantací malý. Jedním z rizik po aplikaci tkáňové suspenze je zvýšení portálního tlaku. Čím méně je výsledný produkt zbavený exokrinní tkáně, a tím tedy objemnější, tím více může tlak ve vena portae během transplantace stoupnout. Dalšími riziky výkonu jsou žilní trombóza nebo naopak krvácení. Funkce jater po transplantaci sice nebývá alterována, ale v okolí ostrůvků se mohou tvořit okrsky steatózy a amyloidu [6]. Alotransplantace dále vyžaduje chronickou imunosupresivní léčbu.
Jaterní parenchym není pro ostrůvky metabolicky ani imunologicky příznivým prostředím. V jaterních sinusoidách si mísí arteriální a portální žilní krev. Ostrůvkový štěp je zde vystaven nízké tenzi kyslíku, což je významné zejména v období, než se obnoví kapilární zásobení. Díky kombinaci nepříznivých faktorů zaniká časně po transplantaci významná část štěpu [7].
Indikace k transplantaci
Nejčastější indikací k transplantaci Langerhansových ostrůvků je syndrom porušeného vnímání hypoglykemie při léčbě inzulinem. Diabetes je u takových pacientů velmi nestabilní a provázený život ohrožujícími hypoglykemiemi. Z hlediska jeho léčby jsou výsledky transplantace ostrůvků velmi dobré [11]. Přežívání štěpů je však v dlouhodobém měřítku stále nižší než při orgánové transplantaci pankreatu [12]. Kromě zlepšování stávající intraportální metody se výzkum zaměřuje na hledání nových výhodnějších míst pro aplikaci ostrůvkového štěpu.
Pro pacienty s diabetem 1. typu a chronickým onemocněním ledvin je možná kombinovaná transplantace ledviny a pankreatických ostrůvků. Operační zákrok je kratší a pro pacienta méně zatěžující, proto se k této variantě může přiklonit u pacientů starších s pokročilými komplikacemi [13].
Autotransplantace Langerhansových ostrůvků se provádí u pacientů s chronickou pankreatitidou, kteří jsou indikováni k totální pankreatektomii.
Alternativní místa transplantace
Nové místo transplantace by mělo lépe vyhovět nárokům ostrůvků na přísun kyslíku. Mělo by být jednoduše dostupné, transplantace by měla být pro příjemce co nejméně zatěžující a výhodou by byly také přístup k biopsii štěpu či možnost graftektomie, což může být důležité zejména u vyvíjejících se metod s použitím biologicky modifikované ostrůvkové tkáně. Některá místa by rovněž mohla poskytovat imunologickou ochranu, což by umožnilo redukování či vysazení imunosupresivní léčby. Na zvířecích modelech i v klinických experimentech bylo vyzkoušeno několik alternativních míst, žádné však zatím nedosahuje výsledků jako při transplantaci do portálního řečiště [14].
Příznivě se vyvíjí technika implantace do velkého omenta, která se v experimentu i v klinické praxi provádí i v našem centru. Vyžaduje ale laparoskopickou operaci, a je tudíž technicky rovněž náročná. Splňuje však požadavky pro případně větší objem štěpu, který se v omentu nedostane do přímého kontaktu s krví příjemce [15]. Přehled klinicky či experimentálně používaných míst pro implantaci shrnuje (Tab. 1).
Tab. 1. Srovnání alternativních míst k transplantaci Langerhansových ostrůvků
Tab. 1: Comparison of alternative transplantation sites for pancreatic islets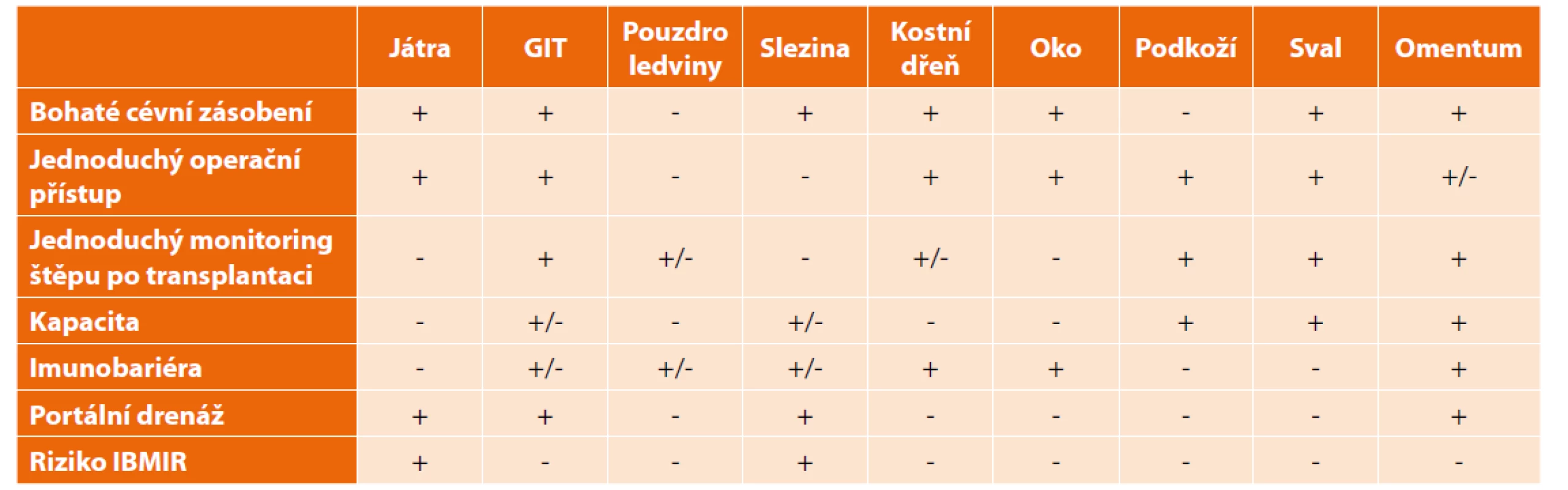
Kapacita – možnost transplantace velkých objemů tkáně
IBMIR – bezprostřední nespecifická zánětlivá odpověď (instant blood-mediated inflammatory reaction)Pankreas, stěna gastrointestinálního traktu
Jako přirozené prostředí ostrůvků k transplantaci se nabízí pankreas. Transplantace do pankreatu je však technicky invazivní s rizikem pankreatitidy. Nevýhodou je též riziko návratu autoimunitní reakce ve štěpu, která byla příčinou vzniku samotného diabetu 1. typu. Implantace ostrůvků pod kapsulu pankreatu jako alternativa k transplantaci do portálního řečiště byla zkoušena pouze na malých hlodavcích a na psech při autotransplantaci po parciální pankreatektomii. I přes uspokojivé výsledky v experimentu u hlodavců nebyl tento přístup pro svou invazivitu a rizika dále použit u primátů ani jiných větších zvířat [16].
Jako další možné místo k transplantaci se nabízí stěna žaludku či duodena. Submukóza žaludku i duodena má denzní vaskulární síť, která by zajistila dostatečné zásobení ostrůvků kyslíkem a živinami. Střevní submukózní matrix poskytuje v buněčných kulturách beta buňkám příznivé prostředí [17]. Výhodou je možnost laparoskopické či endoskopické transplantace do stěny zažívacího traktu, snadný přístup k biopsii, a tím k následnému sledování přežívání štěpu. Tento přístup k transplantaci byl v experimentu zkoušen na drobných hlodavcích, psech a prasatech [18]; na syngenním modelu došlo k nastolení normoglykemie a po explantaci štěpu byla prokázána regenerace beta buněk s minimálními zánětlivými infiltráty [19]. Autologní transplantace ostrůvků do sliznice žaludku u lidí byla provedena u 2 pacientů, alogenní transplantace u 1 pacienta s poklesem potřeby inzulinu na méně než 50 % původní dávky [20,21].
Renální kapsula
Implantace Langerhansových ostrůvků pod pouzdro ledviny je již dlouhodobě využívána k transplantačním experimentům a studiu metabolismu štěpu. Ten se dá po výkonu bioptovat či jednoduše explantovat k histologickému hodnocení. I přes systémovou žilní drenáž štěpu jsou výsledky experimentálních transplantací uspokojivé, štěp pod renální kapsulou rychle nastolí normoglykemii na malých i velkých zvířecích modelech, má nejkratší operační čas a nejnižší mortalitu [22]. Pod pouzdro ledviny se dá transplantovat pouze omezený objem štěpu. Nevýhodou je nízká tenze kyslíku a relativní invazivita výkonu. Lidské pouzdro ledviny je málo elastické a nepojme velké objemy. Proto se k lidským transplantacím jako léčebné metodě nepřistupuje [23].
Slezina
Výhodou transplantace do sleziny jsou: příznivé cévní zásobení s portální žilní drenáží, relativně snadný operační přístup a tolerance větších objemů nepurifikovaných štěpů. Ostrůvky mohou být transplantovány přes splenickou žílu či přímo do dřeně sleziny [24,25]. Při transplantaci do žíly je stále přítomno riziko rozvoje nespecifické zánětlivé reakce při kontaktu štěpu s krví příjemce. Autotransplantace ostrůvků do sleziny u psů mají obdobné výsledky jako transplantace do jater [26]. Přestože je slezina metabolicky příhodné místo k transplantaci, neskýtá proti játrům žádné jasné výhody. Aplikace ostrůvků do sleziny je riziková stran krvácení nebo vzniku infarktu sleziny. Při totální pankreatektomii je slezina často odstraňována, což limituje toto potenciální místo při použití u autotransplantací.
Kostní dřeň
Kostní dřeň má výborné cévní zásobení a pro transplantované ostrůvky dostatečnou tenzi kyslíku. Při aplikaci ostrůvků nedochází k rozvinutí IBMIR. Kostní dřeň je jednoduše přístupná k transplantaci i následnému sledování štěpu. Po transplantaci nebyly pozorovány nežádoucí účinky na hematopoézu. Imunoprotektivita je sice sporná, v literatuře se objevují doklady o toleranci ostrůvkových antigenů a hyporesponzitivitě, stejně tak i o nedostatečné odpovědi na T-depleční imunosupresi a o zvýšeném riziku rejekce [27,28]. Jako příhodné místo se nabízejí femur, tibie či lopata kosti kyčelní. Metabolické výsledky na zvířecích modelech mají nadějné výsledky [29], k posouzení efektu u lidí je třeba více klinických studií [30].
Přední komora oka, thymus a ostatní imunopriviligovaná místa
Transplantace malého objemu tkáně, jako je purifikovaný štěp Langerhansových ostrůvků, dává možnost využití tzv. imunoprivilegovaných míst – thymu, mozkových komor, varlete či přední oční komory. Mechanismy imunologické bariéry jsou komplexní, zahrnují např. Th2-like odpověď, snížení počtu paměťových CD8+ T buněk a zvýšení počtu alospecifických CD4+CD25+ regulačních T buněk. Cílem transplantace do těchto míst je snížení dávek či úplné vysazení imunosupresivní léčby, což se ale zatím ani na zvířecích modelech nedaří [31]. Klinická studie transplantace ostrůvků do přední komory oka u nevidomých pacientů s diabetem 1. typu probíhá v Miami (NCT02846571) [32].
Podkoží
Transplantace Langerhansových ostrůvků do podkoží patří v současnosti mezi nejstudovanější alternativy. Nespornou výhodou je minimálně invazivní přístup, jednoduché zobrazování a v případě potřeby snadná biopsie nebo graftektomie. První studie na zvířatech prokázaly, že pouhá aplikace ostrůvků do podkoží není dostatečná, nejspíš díky nedostatečné vaskularizaci, nízké tenzi kyslíku a mechanickému stresu [33]. Proto se výzkum v posledních letech zaměřil na modifikaci subkutánního prostoru, zejména prevaskularizaci s použitím různých komůrek a insertů, nebo lokální aplikaci vaskulárních růstových faktorů. Cílem je připravit komůrku – makroskelet, který by bylo možné implantovat do podkoží a do něj aplikovat izolované dárcovské Langerhansovy ostrůvky nebo v laboratoři připravené inzulinprodukující buňky. Materiál makroskeletu musí zajistit ochranu štěpu před buňkami imunitního systému, ale zároveň musí být dostatečně porézní pro obousměrnou difuzi kyslíku a metabolitů.
V Laboratoři Langerhansových ostrůvků IKEM využíváme v experimentu makroporézní komůrky vyrobené ze silonu (Obr. 1), k jejichž prevaskularizaci vede přirozené hojení podkožní tkáně po implantaci do abdominální krajiny. Při optimálním načasování transplantace Langerhansových ostrůvků od vložení komůrky do podkoží jsme schopni navodit normoglykemii u diabetických potkanů i pomocí hraniční velikosti štěpu ostrůvků [34].
Obr. 1. Silonová komůrka používaná k transplantaci Langerhansových ostrůvků do podkoží a do omenta na zvířecím modelu [34]
Fig. 1: Silon pouch used for pancreatic islet transplantion in the subcutaneous space and in the omentum in an animal model [34]![Silonová komůrka používaná k transplantaci Langerhansových ostrůvků do podkoží a do omenta na zvířecím
modelu [34]<br>
Fig. 1: Silon pouch used for pancreatic islet transplantion in the subcutaneous space and in the omentum in an
animal model [34]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/712afef40c42c3d7d59ddb35882e5f27.png)
Několik implantabilních zařízení již prochází klinickými zkouškami. Jedná se většinou o tubulární nebo planární selektivně permeabilní makroskelety. Mohou být implantovány do peritoneální dutiny, do velkého omenta nebo do podkoží [35]. Doposud prokazují dobrou bezpečnost, avšak nadále se čeká na výsledky jejich účinnosti. Nejvýznamnějšími jsou βAir (Beta O2Technologies, Rosh-Haayin, Israel) [36], ViaCyte (San Diego, USA) [37], Cell pouch (Sernova) [38] a MailPan (CEED, Defymed) [39].
Sval
Intramuskulární transplantace má výhodu jednoduchého přístupu, jedná se o příznivé místo pro implantaci např. příštítných tělísek [40]. Snadné jsou taktéž zobrazování, biopsie či explantace štěpu [41]. Štěp umístěný do svalu bohužel čelí časné hypoxii z nedostatečné neovaskularizace, která vede k apoptóze buněk, infiltraci štěpu makrofágy a fibrotizaci [42]. Lepší výsledky při aplikaci do svalu mají studie, kdy byl ostrůvkový štěp do svalu aplikován v několika menších injekcích [43]. Dokumentován je případ úspěšné autotransplantace ostrůvků u pacienta po totální pankreatektomii do m. brachioradialis [44].
Omentum
Velké omentum je dobře vaskularizovaná duplikatura peritonea, která je jako možné místo transplantace Langerhansových ostrůvků studována již od 80. let minulého století [45]. Omentum pojme velké objemy tkáně i nepurifikovaných ostrůvků. Štěp je možné laparoskopicky či z laparotomie aplikovat mezi listy omenta [46] anebo celý do omenta zabalit. To skýtá výhodu oproti transplantaci do portální žíly, kdy při infuzi velkých objemů vzniká riziko portální hypertenze či trombózy portální žíly. Ostrůvkový štěp v omentu není přímo vystaven krvi příjemce, proto je zde nižší riziko spuštění nespecifické zánětlivé reakce. Rizikem výkonu je, kromě jiných, vznik adhezí a střevní obstrukce.
Metabolická funkce samotného štěpu v omentu však v experimentu nikdy nedosahovala uspokojivých dlouhodobých výsledků. Dalším krokem je proto příprava matrix, která by ostrůvky v omentu udržela na místě, byla by dobře prostupná pro kyslík a živiny a podpořila by neovaskularizaci štěpu. Jedním ze směrů výzkumu je příprava prevaskularizovaných makroskeletů, komůrek z umělých materiálů. V experimentech na diabetických potkanech dochází po transplantaci ostrůvků do makroskeletu v omentu úspěšně k nastolení normoglykemie [47].
Další možností, jak zlepšit přežívání ostrůvků v omentu, je úprava média, ve kterém jsou ostrůvky transplantovány. V Diabetes Research Institute (DRI) v Miami vznikl projekt biodegradabilního fibrinového lepidla – ostrůvky jsou transplantovány na omentum resuspendované v plazmě příjemce a překryty rekombinantním thrombinem [48]. Tímto se spustí koagulační kaskáda a tvorba fibrinového gelu, omentum je přeloženo přes sebe a v gelu aplikované ostrůvky zůstávají na místě bez nutnosti další sutury. Fibrinový gel umožňuje difuzi kyslíku v časných fázích přihojení štěpu a nebrání prorůstání nových cév. Tato metoda byla úspěšně vyzkoušena v Miami na zvířecím modelu [49] a na základě výsledků byla použita u 3 pacientů s diabetem 1. typu se syndromem porušeného vnímání hypoglykemie. Došlo u nich k redukci dávek inzulinu a zlepšení vnímání hypoglykemií [50]. V Čechách byla tato metoda zkoušena od roku 2017 s použitím humánního thrombinu v experimentu (Obr. 2) [51], v roce 2019 byla transplantace laparoskopicky provedena u první pacientky (Obr. 3). Další pacient tento výkon podstoupil z laparotomie v roce 2020 (Obr. 4). Během 9 měsíců po transplantaci přetrvávala obnovená produkce C-peptidu, nevyskytovaly se závažné ani středně těžké hypoglykemie, výrazně klesla potřeba inzulinu a zlepšilo se vyrovnání diabetu [52].
Obr. 2. Transplantace Langerhansových ostrůvků do velkého omenta za použití biodegradabilního fibrinového lepidla
A – schéma transplantačního postupu, B – experiment na zvířecím modelu, šipka ukazuje na štěp.
Fig. 2: Pancreatic islets transplantation into the greater omentum using a biodegradable fibrin matrix
A – transplantation process scheme; B – experiment in an animal model with the graft indicated by the arrow.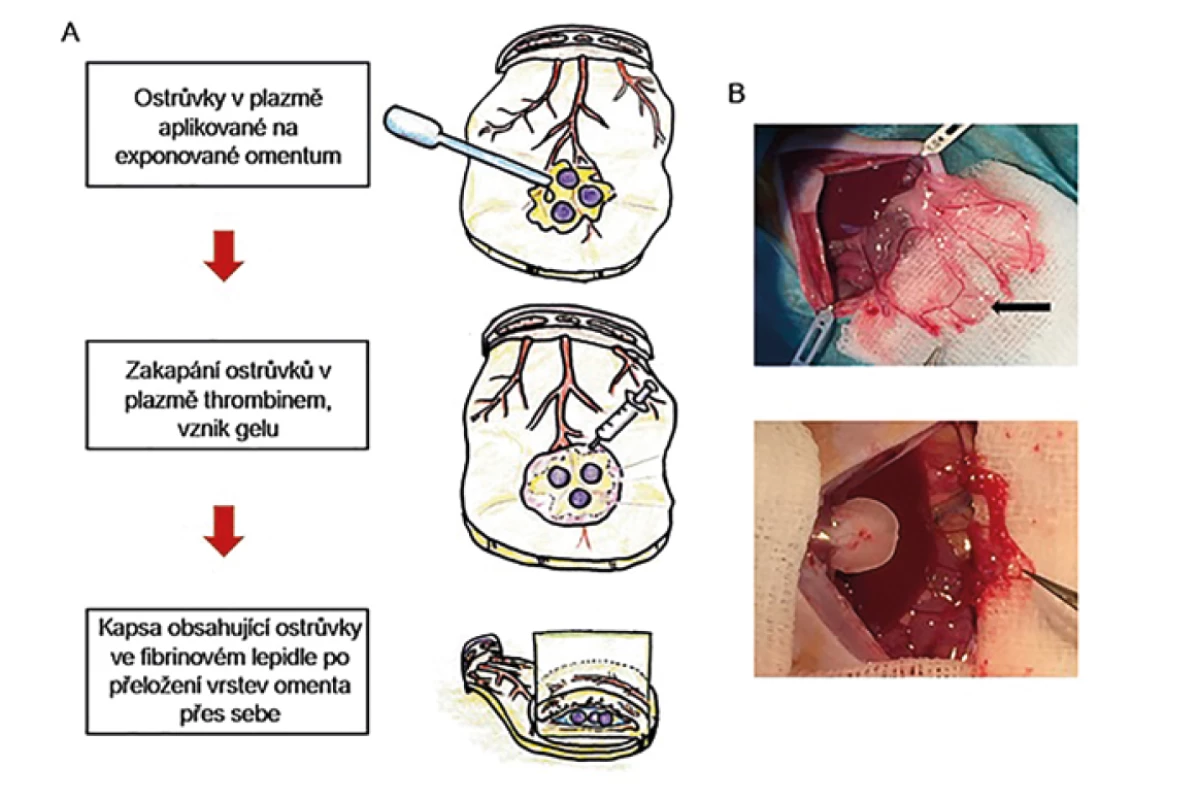
Obr. 3. Laparoskopická aplikace Langerhansových ostrůvků v plazmě na velké omentum – ostrůvky jsou převrstveny lidským thrombinem a vzniká fibrinový gel.
Fig. 3: Laparoscopic application of pancreatic islets in plasma into the greater omentum – the islets are covered with human thrombin, resulting in the formation of fibrin gel.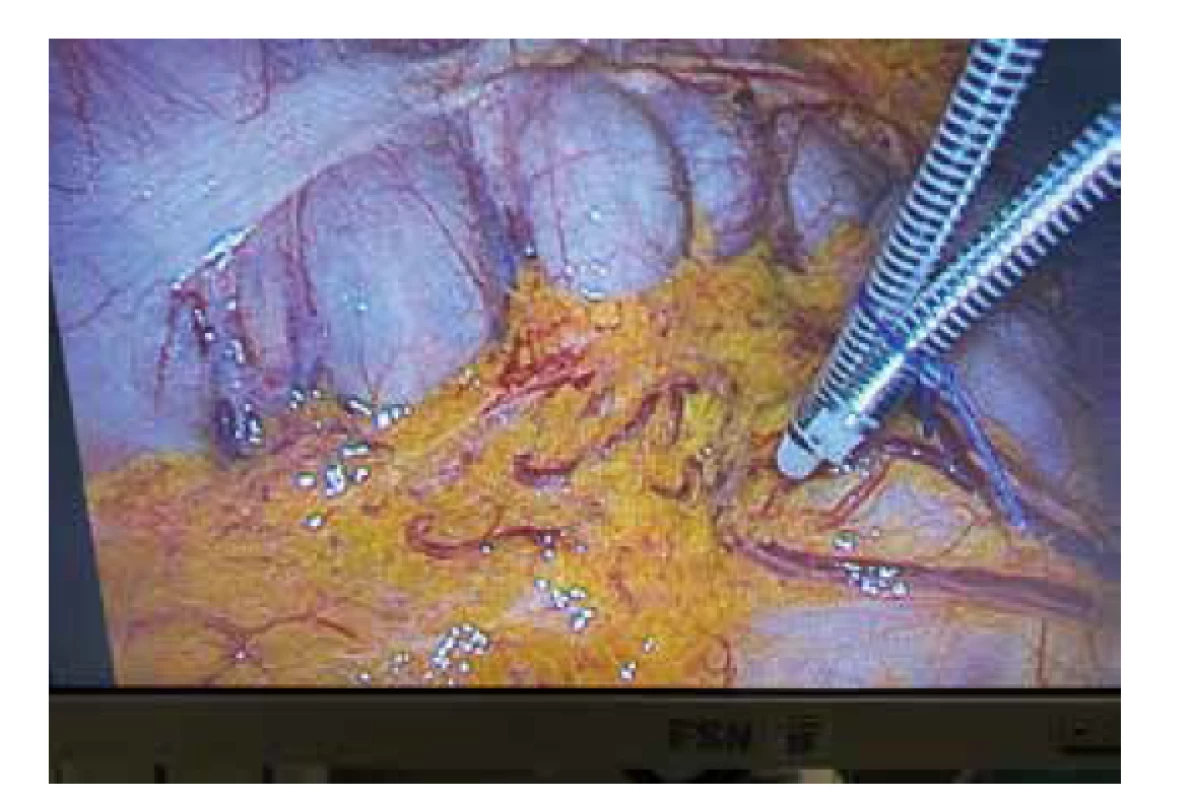
Obr. 4. Laparotomický výkon, Langerhansovy ostrůvky v plazmě příjemce jsou aplikovány na velké omentum a překryty lidským trombinem
Fig. 4: Laparotomic procedure; pancreatic islets resuspended in recipient‘ s plasma are applied onto the greater omentum and covered with human thrombin.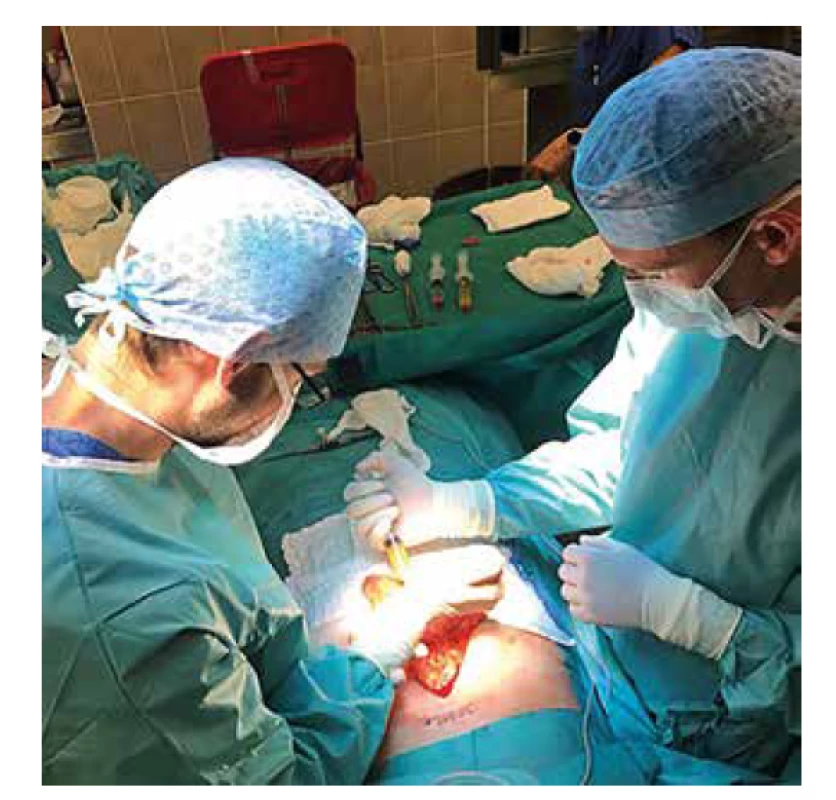
„Bioarteficiální“ pankreas
Žádné z dosud studovaných míst k transplantaci zatím nedokáže plně nahradit mikroprostředí ostrůvků v pankreatu. Proto se výzkum obrací k metodám tkáňového inženýrství, regenerativní medicíny a přípravě tzv. „bioarteficiálního“ pankreatu. Cílem těchto metod je transplantovat ostrůvky či experimentálně připravené inzulin produkující buňky v ochranném prostředí ve formě umělých komůrek, proteinových lešení nebo hydrogelů. Tyto konstrukty lze obohatit o růstové faktory k podpoře lokální angiogeneze a spolu s inzulin produkujícími buňkami je do nich možné aplikovat směsi mezenchymálních a endoteliálních kmenových buněk [53]. Použití kmenových buněk v experimentu podporuje neovaskularizaci štěpu a buněčné produkty ukotvují štěp v prostoru [54].
Z přirozených materiálů pro makroenkapsulaci štěpu jsou vyvíjeny decelularizované skelety celých pankreatů, jež obsahují strukturální proteiny extracelulární matrix bez buněčného materiálu. Tyto proteiny buňkám zprostředkovávají signály k diferenciaci, proliferaci, migraci a podporují jejich funkce [55]. Vytvořená bezbuněčná nativní proteinová lešení mohou být kromě ostrůvků znovu osídlena i podpůrnými typy buněk. Celý konstrukt je poté připraven k transplantaci [56].
Komůrky a membrány, do kterých se implantuje celý ostrůvkový štěp, musejí být dostatečně porézní, aby nedocházelo k hypoxii ostrůvků, ale zároveň musejí buňky ochránit před imunitním systémem. Používány jsou např. prevaskularizované komůrky z umělých materiálů obsahující proangiogenní růstový faktor VEGF [57]. Na zvířecím modelu diabetických potkanů dochází po transplantaci ostrůvků do komůrky v omentu k nastolení normoglykemie [47].
Vzhledem k velmi omezenému množství dárcovských pankreatů je snahou připravit jiný zdroj inzulin produkujících buněk. Jednou z možností je využití reprogramovaných non-beta buněk (např. endokrinních alfa buněk a exokrinních acinárních buněk) vytvořených technologií transdiferenciace, tzn. vnášením specifické skupiny regulačních transkripčních faktorů do buněk [58]. Dalším zkoumaným zdrojem jsou lidské indukované pluripotentní kmenové buňky nebo embryonální kmenové buňky, které však mají rizikový mutagenní potenciál a zatím limitovanou životnost [54].
Transplantace inzulin produkujících buněk v implantabilních zařízeních ve formě „bioarteficiálního“ pankreatu (komůrky, decelularizované skelety) u lidských pacientů je jistě nadějným řešením, ale zatím nemá svoje jasné klinické ukotvení.
ZÁVĚR
Ráj pro transplantované Langerhansovy ostrůvky zatím nalezen nebyl. Nejlepší výsledky má i přes své nedostatky transplantace ostrůvků do jater [14]. Transplantace do omenta může být vhodným pacientům nabízena jako alternativa intraportální transplantace nebo se dá využít u pacientů s jaterním onemocněním či s anomáliemi cévního zásobení jater. Metoda je dále vhodná pro transplantaci větších objemů, např. při autotransplantacích, kdy by následkem transplantace hrozil rozvoj portální hypertenze. Transplantace do omenta sice vyžaduje celkovou anestezii, ale komplikace po výkonu jsou minimální. Ostatní alternativní transplantace jsou nadále více či méně úspěšně předmětem výzkumu.
Transplantační léčba diabetu jde ruku v ruce s moderními technologiemi a vývojem „arteficiálního“ pankreatu, tzv. uzavřené smyčky systému kontinuální monitorace glukózy a inzulinové pumpy. Od loňského roku jsou pro naše pacienty dostupné dvě poloautomatické smyčky dodávání inzulinu hrazené ze zdravotního pojištění. Inzulinová pumpa na podkladě dat o hladině glukózy přicházejících ze senzoru dokáže upravit dávku bazálního inzulinu anebo i poslat malý korekční bolus. Léčba diabetu za pomoci senzorů hladiny glukózy, případně ve spojení senzoru s inzulinovou pumpou s možností prediktivního zastavení dodávky inzulinu, by měla vždy předcházet indikaci transplantace [59].
Tento projekt byl podpořen grantem Ministerstva zdravotnictví České republiky č. 17-29009A a grantem Univerzity Karlovy, 1. lékařské fakulty č. 119.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Zuzana Hladíková
Centrum diabetologie
Institut klinické a experimentální medicíny,
Praha
e-mail: zuzana.hladikova@ikem.cz
ORCID: 0000-0002-6545-3911
Zdroje
1. Rickels MR, Robertson RP. Pancreatic islet transplantation in humans: Recent progress and future directions. Endocr Rev. 2019 Apr 1;40(2):631−668. doi:10.1210/ er.2018-00154.
2. Barton FB, Rickels MR, Alejandro R, et al. Improvement in outcomes of clinical islet transplantation: 1999−2010. Diabetes Care 2012 Jul;35(7):1436−1445. doi:10.2337/dc12-0063.
3. Carlsson PO, Palm F, Andersson A, et al. Markedly decreased oxygen tension in transplanted rat pancreatic islets irrespective of the implantation site. Diabetes 2001 Mar;50(3):489−495. doi:10.2337/ diabetes.50.3.489.
4. Bonner-Weir S, Orci L. New perspectives on the microvasculature of the islets of Langerhans in the rat. Diabetes 1982;31 : 883−889. doi:10.2337/ diab.31.10.883.
5. Smink AM, de Vos P. Therapeutic strategies for modulating the extracellular matrix to improve pancreatic islet function and survival after transplantation. Curr Diab Rep. 2018 May 19;18(7):39. doi:10.1007/s11892-018-1014-4.
6. Westermark GT, Westermark P, Berne C, et al. Widespread amyloid deposition in transplanted human pancreatic islets. N Engl J Med. 2008 Aug 28;359(9):977−979. doi:10.1056/NEJMc0802893.
7. Shapiro AM, Gallant HL, Hao EG, et al. The portal immunosuppressive storm: relevance to islet transplantation? Ther Drug Monit. 2005 Feb;27(1):35−37. doi:10.1097/00007691-200502000 - 00008.
8. Johansson H, Lukinius A, Moberg L, et al. Tissue factor produced by the endocrine cells of the islets of Langerhans is associated with a negative outcome of clinical islet transplantation. Diabetes 2005 Jun;54(6):1755−1762. doi:10.2337/ diabetes.54.6.1755.
9. Eich T, Eriksson O, Lundgren T. Visualization of early engraftment in clinical islet transplantation by positron-emission tomography. New England Journal of Medicine 2007;356(26):2754−2755. doi:10.1056/NEJMc070201.
10. Delaune V, Berney T, Lacotte S, et al. Intraportal islet transplantation: the impact of the liver microenvironment. Transpl Int. 2017 Mar;30(3):227−238. doi:10.1111/ tri.12919.
11. Foster ED, Bridges ND, Feurer ID, et al. Improved health-related quality of life in a phase 3 islet transplantation trial in type 1 diabetes complicated by severe hypoglycemia. Diabetes Care 2018 May;41(5):1001−1008. doi:10.2337/dc17 - 1779.
12. Bottino R, Knoll MF, Knoll CA, et al. The future of islet transplantation is now. Front Med. (Lausanne) 2018 Jul 13;5 : 202. doi:10.3389/fmed.2018.00202.
13. Vantyghem MC, Chetboun M, Gmyr V, et al. Ten-year outcome of islet alone or islet after kidney transplantation in type 1 diabetes: A prospective parallel-arm cohort study [published correction appears in Diabetes Care 2020 May;43(5):1164]. Diabetes Care 2019;42(11):2042−2049. doi:10.2337/dc19-0401.
14. Liljebäck H, Espes D, Carlsson PO. Unsurpassed intrahepatic islet engraftment – the quest for new sites for beta cell replacement. Cell Med. 2019 Jun 24;11. doi:10.1177/2155179019857662.
15. Ao Z, Matayoshi K, Lakey JR, et al. Survival and function of purified islets in the omental pouch site of outbred dogs. Transplantation 1993 Sep;56(3):524−529. doi:10.1097/00007890-199309000 - 00007.
16. Stagner J, Ahren B, Sundler F, et al. Reconstructing the pancreas: restoration of normoglycemia, exocrine function, and islet innervation by islet transplantation to the pancreas. Transplant Proc. 2008 Mar;40(2):452−454. doi:10.1016/j. transproceed.2008.01.031.
17. Tian XH, Xue WJ, Ding XM, et al. Small intestinal submucosa improves islet survival and function during in vitro culture. World J Gastroenterol. 2005 Dec 14;11(46):7378−83. doi:10.3748/wjg.v11. i46.7378.
18. Echeverri GJ, McGrath K, Bottino R, et al. Endoscopic gastric submucosal transplantation of islets (ENDO-STI): technique and initial results in diabetic pigs. Am J Transplant. 2009 Nov;9(11):2485−2496. doi:10.1111/j.1600-6143.2009.02815.x.
19. Tchervenivanov N, Yuan S, Lipsett M, et al. Morphological and functional studies on submucosal islet transplants in normal and diabetic hamsters. Cell Transplant. 2002;11(6):529−537. PMID: 12428742.
20. Wszola M, Berman A, Gorski L, et al. Endoscopic islet autotransplantation into gastric submucosa − 1000 - day follow-up of patients. Transplant Proc. 2018;50 : 2119–2123. doi:10.1016/j. transproceed.2018.02.138
21. Wszola M, Berman A, Ostaszewska A, et al. Islets allotransplantation into gastric submucosa in a patient with portal hypertension: 4-year follow-up. Transplant Proc. 2018 Jul-Aug;50(6):1910−1913. doi:10.1016/j.transproceed.2018.02.170.
22. Kim HI, Yu JE, Park CG, et al. Comparison of four pancreatic islet implantation sites. J Korean Med Sci. 2010 Feb;25(2):203−210. doi:10.3346/jkms.2010.25.2.203.
23. Jindal RM, Sidner RA, McDaniel HB, et al. Intraportal vs kidney subcapsular site for human pancreatic islet transplantation. Transplant Proc. 1998 Mar;30(2):398−399. doi:10.1016/s0041-1345(97)01327-4.
24. Itoh T, Nishinakamura H, Kumano K, et al. The spleen is an ideal site for inducing transplanted islet graft expansion in mice. PLoS One 2017 Jan 30;12(1):e0170899. doi:10.1371/journal.pone.0170899.
25. Ansara MF, Saudek F, Newton M, et al. Pancreatic islet transplantation prevents defective glucose counter-regulation in diabetic dogs. Transplant Proc. 1994 Apr;26(2):664−665. PMID: 8171600.
26. Kaufman DB, Morel P, Field MJ, et al. Purified canine islet autografts. Functional outcome as influenced by islet number and implantation site. Transplantation 1990 Sep;50(3):385−391. PMID: 2169662.
27. Cantarelli E, Melzi R, Mercalli A, et al. Bone marrow as an alternative site for islet transplantation. Blood 2009 Nov 12;114(20):4566−45674. doi:10.1182/ blood-2009-03-209973.
28. Salazar-Bañuelos A, Wright JR Jr, Sigalet D, et al. Pancreatic islet transplantation into the bone marrow of the rat. Am J Surg. 2008 May;195(5):674−678; discussion 678. doi: 10.1016/j.amjsurg. 2007.12.040. Erratum in: Am J Surg. 2008 Aug;196(2):313.
29. Cantarelli E, Citro A, Pellegrini S, et al. Transplant site influences the immune response after islet transplantation: Bone marrow versus liver. Transplantation 2017 May;101(5):1046−1055. doi:10.1097/ TP.0000000000001462.
30. Maffi P, Nano R, Monti P, et al. Islet allotransplantation in the bone marrow of patients with type 1 diabetes: A pilot randomized trial. Transplantation 2019 Apr;103(4):839−851. doi:10.1097/ TP.0000000000002416.
31. Kaur G, Mital P, Dufour JM. Testisimmune privilege − assumptions versus facts. Anim Reprod. 2013 Jan;10(1):3−15. PMID: 25309630.
32. Shishido A, Caicedo A, Rodriguez-Diaz R, et al. Clinical intraocular islet transplantation is not a number issue. CellR4 Repair Replace Regen Reprogram. 2016;4(4):e2120. PMID: 29497631.
33. Wang W, Gu Y, Tabata Y, et al. Reversal of diabetes in mice by xenotransplantation of a bioartificial pancreas in a prevascularized subcutaneous site. Transplantation 2002 Jan 15;73(1):122−129. doi: 10.1097/00007890-200201150-00023.
34. Patikova A, Vojtiskova A, Fabryova E, et al. The optimal maturation of subcutaneous pouch can improve pancreatic islets engraftment in rat model. Transplantation 2021 Jun 4. doi:10.1097/ TP.0000000000003844.
35. Scharp DW, Marchetti P. Encapsulated islets for diabetes therapy: history, current progress, and critical issues requiring solution. Adv Drug Deliv Rev. 2014 Apr;67-68 : 35−73. doi:10.1016/j. addr.2013.07.018.
36. Barkai U, Weir GC, Colton CK, et al. Enhanced oxygen supply improves islet viability in a new bioartificial pancreas. Cell Transplant. 2013;22(8):1463−1476. doi:10.3727/096368912X657341.
37. One-year follow-up safety study in subjects previously implanted with VC-01™(ClinicalTrials.gov Identifier: NCT02939118)
38. A safety, tolerability and efficacy study of Sernova‘s Cell Pouch™ for clinical islet transplantation. ClinicalTrials.gov Identifier: NCT03513939)
39. Thomas M, Moriyama K, Ledebo I. AN69: Evolution of the world‘s first high permeability membrane. Contrib Nephrol. 2011;173 : 119−129. doi:10.1159/000328961.
40. Lo CY. Parathyroid autotransplantation during thyroidectomy. ANZ J Surg. 2002 Dec;72(12):902−907. doi:10.1046/j.1445 - 2197.2002.02580.x.
41. Stegall MD. Monitoring human islet allografts using a forearm biopsy site. Ann Transplant. 1997;2(3):8−11. PMID: 9869858.
42. Stegall MD, Lafferty KJ, Kam I, et al. Evidence of recurrent autoimmunity in human allogeneic islet transplantation. Transplantation 1996 Apr 27;61(8):1272-4. doi:10.1097/00007890-199604270-00027.
43. Christoffersson G, Henriksnäs J, Johansson L, et al. Clinical and experimental pancreatic islet transplantation to striated muscle: Establishment of a vascular system similar to that in native islets. Diabetes 2010;59 : 2569–2578. doi:10.2337/ db10-0205.
44. Rafael E, Tibell A, Rydén M, et al. Intramuscular autotransplantation of pancreatic islets in a 7-year-old child: a 2-year follow-up. Am J Transplant. 2008 Feb;8(2):458−462. doi:10.1111/j.1600 - 6143.2007.02060.x.
45. Yasunami Y, Lacy PE, Finke EH. A new site for islet transplantation − a peritoneal - omental pouch. Transplantation 1983 Aug;36(2):181−182. doi:10.1097/00007890-198308000 - 00014.
46. Schaschkow A, Mura C, Pinget M, et al. Intra-omental islet transplantation using h-omental matrix islet filliNG (hOMING). J Vis Exp. 2019 Mar 14;(145). doi:10.3791/58898.
47. Kriz J, Vilk G, Mazzuca DM, et al. A novel technique for the transplantation of pancreatic islets within a vascularized device into the greater omentum to achieve insulin independence. Am J Surg. 2012 Jun;203(6):793−797. doi:10.1016/j.amjsurg. 2011.02.009.
48. Berman DM, Molano RD, Fotino C, et al. Bioengineering the endocrine pancreas: Intraomental islet transplantation within a biologic resorbable scaffold. Diabetes 2016 May;65(5):1350−1361. doi:10.2337/ db15-1525.
49. Berman DM, O‘Neil JJ, Coffey LC, et al. Long-term survival of nonhuman primate islets implanted in an omental pouch on a biodegradable scaffold. Am J Transplant. 2009 Jan;9(1):91−104. doi:10.1111/j.1600-6143.2008.02489.x.
50. Baidal D, Berman DM, Ricordi C, et al. Stable graft function and glycemic control after clinical islet transplantation on the omentum. Diabetes 2019 Jun; 68 (Supplement 1) 259−LB; doi:10.2337/db19 - 259-LB.
51. Hladíková Z, Voglová B, Pátíková A, et al. Bioluminescence imaging in vivo confirms the viability of pancreatic islets transplanted into the greater omentum. Mol Imaging Biol. 2021 Feb 18. doi:10.1007/s11307-021-01588-y.
52. Saudek F, Hladíková Z, Hagerf B, et al. Islet transplantation into the omentum using a biocompatible plasma-thrombin gel: experience at the Institute for Clinical and Experimental Medicine in Prague. IPITA, Virtual, October 20−23, 2021. P.105. https://app.ipita2021.org/virtual/lecture/ 200.
53. Guo Y, Wu C, Xu L, et al. Vascularization of pancreatic decellularized scaffold with endothelial progenitor cells. J Artif Organs 2018 Jun;21(2):230−237. doi:10.1007/s10047-018-1017-6.
54. Cito M, Pellegrini S, Piemonti L, et al. The potential and challenges of alternative sources of β cells for the cure of type 1 diabetes. Endocr Connect. 2018 Mar;7(3):R114−R125. doi:10.1530/EC-18 - 0012.
55. Parnaud G, Hammar E, Ribaux P, et al. Signaling pathways implicated in the stimulation of beta-cell proliferation by extracellular matrix. Mol Endocrinol. 2009 Aug;23(8):1264−1271. doi:10.1210/ me.2009-0008.
56. Napierala H, Hillebrandt KH, Haep N, et al. Engineering an endocrine neo-pancreas by repopulation of a decellularized rat pancreas with islets of Langerhans. Sci Rep. 2017 Feb 2;7 : 41777. doi:10.1038/ srep41777.
57. Kasoju N, Pátíková A, Wawrzynska E, et al. Bioengineering a pre-vascularized pouch for subsequent islet transplantation using VEGF-loaded polylactide capsules. Biomater Sci. 2020 Jan 21;8(2):631−647. doi: 10.1039/c9bm01280j. Erratum in: Biomater Sci. 2019 Dec 12.
58. Koblas T, Leontovyč I, Zacharovová K, et al. Activation of the Jak/Stat signalling pathway by leukaemia inhibitory factor stimulates trans-differentiation of human non-endocrine pancreatic cells into insulin - producing cells. Folia Biol. (Praha) 2012;58(3):98−105. PMID: 22849859.
59. Othonos N, Choudhary P. Who should be considered for islet transplantation alone? Curr Diab Rep. 2017 Apr;17(4):23. doi: 10.1007/s11892-017-0847-6. Erratum in: Curr Diab Rep. 2017 Apr;17 (4):29.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2022 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Hledání ztraceného ráje – alternativní místa pro transplantaci izolovaných Langerhansových ostrůvků
- Laparoskopicky asistovaná perkutánna endoskopická cekostomia (LAPEC) v liečbe ťažkej zápchy u dospelých – vlastné skúsenosti
- Anorektální manometrie s vysokým rozlišením u pacientů s anorektální dysfunkcí a terapeutické konsekvence
- Endoskopie a chirurgie
- Úspěšná opakovaná endoskopická pyloromyotomie (re-G-POEM) v léčbě postchirurgické gastroparézy
- Endoskopická léčba motilitních onemocnění trávicího traktu
- Laparoskopické ošetření cholecystoduodenální píštěle po spontánní úpravě střevní obstrukce při biliárním ileu – kazuistika a přehled literatury
- Inkarcerovaná levostranná paraduodenální kýla − kazuistika a přehled literatury
- Komentář k původní práci Akutní apendicitida v době jarní pandemie covid-19 v roce 2020 – srovnávací retrospektivní studie
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Anorektální manometrie s vysokým rozlišením u pacientů s anorektální dysfunkcí a terapeutické konsekvence
- Endoskopická léčba motilitních onemocnění trávicího traktu
- Inkarcerovaná levostranná paraduodenální kýla − kazuistika a přehled literatury
- Úspěšná opakovaná endoskopická pyloromyotomie (re-G-POEM) v léčbě postchirurgické gastroparézy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



