-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaLaparoskopicky asistovaná perkutánna endoskopická cekostomia (LAPEC) v liečbe ťažkej zápchy u dospelých – vlastné skúsenosti
Laparoscopic-asisted percutaneus endoscopic cecostomy (LAPEC) in the treatment of severe constipation of adults – single center study
Introduction: Effective treatment for chronic constipation is a real clinical challenge, especially in patients with severe symptoms. If conservative measures do not help, usually subtotal colectomy with ileorectal anastomosis has been used as the treatment of choice for refractory slow-transit constipation, but consequences may unfavorably affect quality of life. Percutaneous endoscopic caecostomy (PEC) with antegrade colonic enema (ACE) is a minimally invasive alternative to avoid radical surgery in order to improve bowel movement. Recently, of various catheter placement techniques, a laparoscopic-assisted percutaneous endoscopic cecostomy has been applied in clinical praxis.
Methods: We performed retrospective analysis of 5 patients with Chait Trapdoor catheter placed for purpose of ACE by LAPEC. Main outcome was to assess clinical success of PEC defined by an improvement of at least 50% of baseline KESS at 6M. Secondary outcomes were: procedural parameters and safety of procedure.
Results: Since may 2019 to march 2021, LAPEC was performed in 5 patients. Median follow-up was 14 months (7V12). All PECs were placed successfully in cecum. Treatment success reached 60% (3/5) of patients. Postoperative complication occurred in three patients.
Conclusion: LAPEC provides both endoscopic and laparoscopic visualization, thereby, significantly decreasing potential risks by ensuring precise and safe access to the cecum. Antegrade colonic enema through PEC provides improvement of bowel movement in highly selected patient with severe symptoms.
Keywords:
Constipation – laparoscopy – cecostomy – antegrade colonic enema – defecography
Autoři: R. Husťak 1,2,4; R. Škuta 1; A. Dobrovodský 1; M. Habiňák 1; D. Kudlová 1; A. Janegová 1; E. Plavčanová 1,3; J. Rajec 1,2; J. Martínek 1,4
Působiště autorů: Fakultná nemocnica v Trnave, Trnava 1; Trnavská univerzita v Trnave, Trnava 2; Vysoká škola zdravotníctva a sociálnej práce sv. Alžbety, Bratislava 3; Inštitút klinickej a experimentálnej medicíny, Praha 4
Vyšlo v časopise: Rozhl. Chir., 2022, roč. 101, č. 1, s. 22-27.
Kategorie: Původní práce
doi: https://doi.org/10.33699/PIS.2022.101.1.22–27Souhrn
Úvod: Účinná liečba chronickej zápchy je skutočnou klinickou výzvou najmä u pacientov so závažnými príznakmi. Ak sú konzervatívne opatrenia neefektívne, obvykle sa metódou voľby pri refraktérnej zápche s pomalým tranzitom preferovala subtotálna kolektómia s ileorektálnou anastomózou, pričom konsekvencie môžu nepriaznivo ovplyvniť kvalitu života. Perkutánna endoskopická cékostómia (PEC) s antegrádnou klyzmou hrubého čreva (ACE) je minimálne invazívnou alternatívou, ktorá zlepšuje defekáciu. Z rôznych metód zavádzania perkutánneho katétra, bola v klinickej praxi len nedávno použitá laparoskopicky-asistovaná perkutánna endoskopická (LAPEC) technika.
Metódy: Vykonali sme retrospektívnu analýzu 5 pacientov s Chait Trapdoor katétrom k podávaniu ACE zavedeným LAPEC. Hlavným cieľom bolo posúdenie klinickej efektivity PEC, definovanej >50 % poklesom vstupného KESS v 6M. Sekundárne ciele boli: procedurálne parametre a bezpečnosť procedúry.
Výsledky: Od mája 2019 do marca 2021 sa LAPEC realizovala u 5 pacientov. Priemerná doba sledovania bola 14 mesiacov (7–12). Všetky PEC boli úspešne zavedené do céka. Efektívna bola u 60 % (3/5) pacientov. U troch pacient ov sa vyskytli komplikácie.
Záver: LAPEC umožňuje endoskopickú aj laparoskopickú vizualizáciu, čím významne znižuje potenciálne riziká z presného a bezpečného prístupu k céku. Antegrádna klyzma prostredníctvom PEC poskytuje zlepšenie defekácii u vysoko selektovaných pacientov so závažnými príznakmi zápchy.
Klíčová slova:
laparoskopia – cékostomia – zápcha – antegrádna kolonická klyzma – defekografia
ÚVOD
Chronická zápcha (syndróm lenivého čreva) predstavuje častý problém dospelých s prevalenciou až 27 % [1]. Podľa Rímskych kritérií IV je definovaná absenciou luminálnej črevnej patológie a prítomnosťou ≥2 príznakov, ako <3 stolice/týždeň alebo >25 % defekácii spojených častokrát s úsilnou a občasne aj manuálnou evakuáciou hrudkovitej stolice z konečníka, či pocitom neúplného vyprázdnenia, apod. [2]. Účinná liečba je klinickou výzvou najmä u pacientov so závažnými príznakmi, kde diétne opatrenia (vláknina), ale i bežné laxatíva, ako aj rektálne klyzmy majú obmedzenú účinnosť. U týchto pacientov nie sú výnimkou ani opakované subileózne stavy. Ak konzervatívne metódy zlyhajú, je vhodné zvážiť chirurgické postupy. Subtotálna kolektómia s ileorektálnou anastomózou bola a stále aj je metódou voľby u pacientov s refraktérnou slow-tranzit zápchou. Resekčné výkony (subtotálna kolektómia či segmentálna resekcia hrubého čreva, a iné) sú však zaťažené nemalým rizikom pooperačných komplikácií [3,4]. Po segmentálnej resekcii čreva môže zápcha perzistovať až u 30 % a prípadné hnačky s event. inkontinenciou sa objavujú až u 40 % po subtotálnej kolektómii [5]. V klinickej praxi sa etablovalo niekoľko skórovacích dotazníkov k zhodnoteniu závažnosti zápchy. Ako v chirurgickej, tak aj gastroenterologickej obci je najčastejším Knowles-Eccersley-Scott-Symptom skóre (KESS) [6].
V 1990 roku bola prvý krát v literatúre popisovaná realizácia apendikostómie ako chirurgická alterácia k podávaniu antegrádnej klyzmy (ACE) u detí so závažnou obstipáciou (napr. pri spina bifida, neurogénným črevom apod) [7]. Malonem modifikovaná ACE technika (MACE) predstavovala trvalú stómiu, ktorá vznikla implantáciou hrotu apendixu antirefluxným spôsobom do céka a jeho bazálna časť bola vyvedená do brušného lisu. Tento prístup umožňoval podávať osmotické laxatívum do čreva cez apendikostómiu a v podstate tak obísť potrebu perorálneho podávania makrogolu. Z dlhodobého hľadiska sa u polovice pacientov s MACE objavili stenózy ústia, respektíve presakovanie črevného obsahu v okolí apendikostómie [8].
Technologickým vývojom bol vyvinutý špeciálny silikónový katéter s uzatvárateľnou zátkou, ktorý sa inzeroval perkutánne napríklad do oblasti céka (PEC – perkutánna cekostómia) a slúžil k podávaniu antegrádnej klyzmy, čím sa v praxi adaptoval pôvodný zmysel MACE. V súčasnosti existuje niekoľko typov katétrov (najpoužívanejším je Chait Trapdoor - Cook, Bloomington, Ind) a viacero techník inzercie samotného katétra. Ten je možné zavádzať čisto pri endoskopickej alebo fluoroskopickej (RTG) asistencii, resp. otvorenou chirurgickou či laparoskopicky-asistovanou cestou [9,10]. Laparoskopicky-asistovaná perkutánna endoskopická cékostómia (LAPEC) je v hybridná, endoskopicko-laparoskopická metóda, ktorá umožňuje presné a bezpečné zavedenie katétra do céka, čím sa znižuje riziko komplikácii spojených so zavádzaním katétra pri čisto endoskopickej alebo RTG technike.
V súčasnosti existuje len niekoľko retrospektívnych štúdií hodnotiacich účinnosť LAPEC, ktorá dosahuje 70 % až 89 % [11]. Neexistujú ale žiadne randomizované štúdie porovnávajúce efektivitu MACE vs LAPEC vs iné chirurgické resekcie. Len recentne boli publikované odporúčania Európskej spoločnosti pre gastrointestinálnu endoskopiu (ESGE) k využívaniu laparoskopicky asistovanej perkutánnej endoskopickej cekostómie v manažmente závažnej obstipácie [12]. Cieľom tohto článku je poskytnú naše prvotné skúsenosti s LAPEC v manažmente závažnej obstipácie.
Predmetom predkladaného článku bolo zhodnotiť efektivitu a bezpečnosť LAPEC v našom súbore pacientov.
METÓDY
Realizovali sme retrospektívnu analýzu prípadov riešených na prokto-gastroenterologickom pracovisku v Trnave v období medzi májom 2019 až marcom 2021. Do analýzy boli zaradení všetci pacienti starší ako 18 rokov, ktorí splnili inklúzne, resp. nemali exklúzne kritéria, podpísali informovaný súhlas a prejavili ochotu spolupracujúce k podávaniu antegrádnej klyzmy. Protokol procedúry bol schválený etickou komisiou FN Trnava. Inklúznymi kritériami bola refraktérna (>6 mesiacov trvajúca) a závažná (KESS skóre >11 bodov) zápcha nereagujúca na bežné medikácie (slow tranzit predstavoval retenciu >20 % markerov na 5. deň pri RTG kontrole), anorektálna dysfunkcia resp. kombinácia oboch etiológii. Vylučujúcimi kritériami bola preexistujúca závažná elektrolytová nerovnováha z dôvodu chronického užívania laxatív, chronický hypertonus anu, preexistujúca operácia pravého kolónu, ktorá by vylučovala možnosť zavedenia PEC (napr. pravostranná hemikolektómia), tehotenstvo, pokročilý kolorektálny karcinóm či cirhóza pečene (Child Pugh B/C). Pri analýze súboru sa využilo jednoduché deskriptívne spracovanie dát. Primárnym cieľom bol počet pacientov s poklesom KESS o >50 % v 6 mesiacoch oproti vstupným hodnotám. Sekundárne sme analyzovali: a) výskyt komplikácii, b) technické parametre výkonu (jeho dĺžku, úspešnosť zavedenia PEC) a c) množstvo pacientov, ktorí po 6 a 12 mesiacoch sledovania ešte aktívne užívali PEC a objem podávaného makrogolu.
Periprocedurálny manažment
Všetci pacienti pred LAPEC podstúpili podrobnú anamnézu (overenie správnosti užívania všetkých bežne dostupných laxatív vrátane prukalopridu) a komplexné proktologické vyšetrenie, vyplnili KESS skóre a dotazník vizuálnej analógovej stupnice bolesti (VAS, 0 – bez bolesti, 10 – neznesiteľná bolesť), realizovala sa kolonoskopia k vylúčeniu štrukturálnych slizničných abnormalít a odobrali sa hlboké biopsie rekta k vylúčeniu hypo/agangliózy. Následne sa realizovalo meranie transit-time pomocou RTG kontrastných značiek a defekografia. Všetci pacienti boli prijatí do nemocnice deň pred výkonom, už týždeň pred prijatím mali bezzvyškovú diétu s fortifikáciou dávky makrogolu deň pred procedúrou.
Všetky LAPEC výkony boli realizované na operačnej sále v intubačnej anestézii. Intravenózne antibiotiká (penicilín a metronidazol) boli podané 1 hodinu pred zákrokom. Samotný postup zavedenia PEC pozostával z krokov znázornených v Obr. 1. Pri LAPEC boli nutné 3 porty (kamerový a dva pracovné z dôvodu realizácie seroperitoneálnych stehov).
Obr. 1. LAPEC procedúra:
A) laparoskopická verifikácia céka s kolonoskopickou diafanoskopiou pred inserciou katétra, B) insercia katétra do tenia libera, C) plikácia steny céka so zavedeným katétrom k brušnej stene, D) endoskopický obraz. pigtail katétra v lumene céka, E) pooperačný nález so stómickým vakom, F) knoflík cekálneho katétra na brušnej stene druhý pooperačný deň.
Fig. 1: LAPEC procedure:
A) laparoscopic view of colonic diaphanoscopy prior to catheter insertion; B) catheter insertion into tenia libera; C) cecal wall plication with inserted catheter to abdominal wall; D) endoscopic view of pigtail catheter in caecum; E) postoperative finding with stoma bag, F) catheter button on abdominal wall on POD2.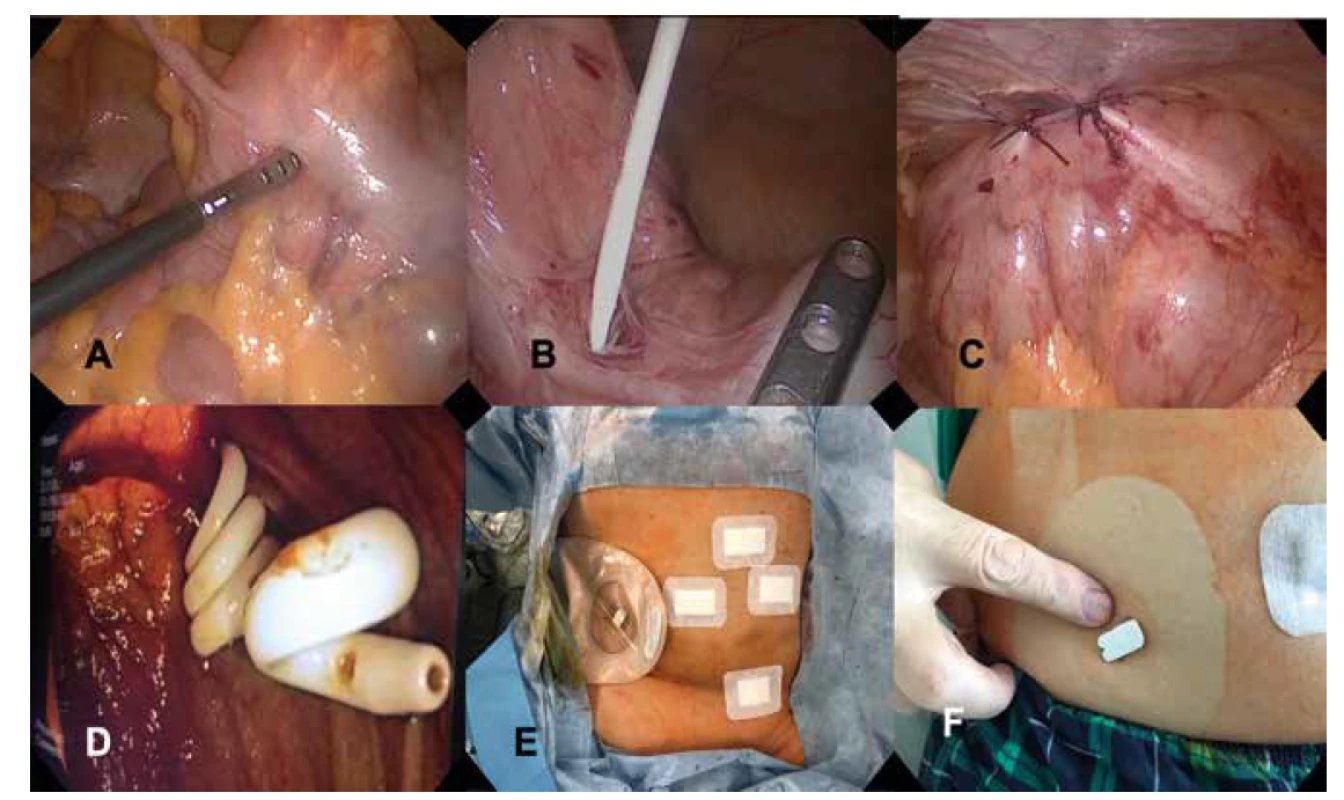
Po výkone boli pacienti vylúčení z perorálneho príjmu prvých 24 hodín z dôvodu eliminácie vytekania črevného obsahu a plynov cez pootvorený silikónový katéter, na okolie ktorého bol prilepený stómický vak (Obr. 1 E), ktorého cieľom bolo zabrániť riziku pericekálnej dehiscencie. Na druhý pooperačný deň sa prešlo na tabletovú formu ATB a pokračovalo sa v ich užívaní 3–5 dní. V prípade, že sa nevyskytli komplikácie (teplota, neprimerané bolesti v mieste PEC a iné), bol pacient v daný deň prepustený domov. Katéter bol prvých 7 dní od zavedenia lavažovaný malým množstvom fyziologického roztoku pacientom doma. Po týždni sa začalo s ACE pomocou Golytelyho roztoku (predpis magistraliter o objeme 4l). Frekvencia aplikácie a objem makrogolu bol prispôsobený potrebám pacienta. V priemere bolo odporúčané podanie od 250–400 ml/ deň, buď ako bolus alebo frakcionovane. Následne pacienti podstúpili kontroly v 3, 6 a 12 mesiaci od za vedenia a potom v polročných intervaloch.
VÝSLEDKY
Od mája 2019 do októbra 2020 podstúpilo LAPEC 5 pacientov (4 ženy, 80 %). Všetky PEC sa podarilo zaviesť do céka. Základne demografické a periprocedurálne údaje sú zhrnuté v Tab. 1. Vývoj KESS a VAS skóre je sumarizovaný v Tab. 2. Celkovo u 3 žien bola nutná extrakcia PEC: u dvoch z dôvodu straty odpovede, u tretej pacientky došlo po stabilizácii základného ochorenia (sklerózy multiplex) k extrakcii PEC po 13 mesiacoch od jeho zavedenia z dôvodu absencie potreby podávania ACE. Dvaja pacienti užívajú PEC naďalej s efektom.
Tab. 1. Periprocedurálne charakteristiky
Tab. 1: Periprocedural characteristics
Vysvětlivky: ASA – Americká spoločnosť anesteziológov; KESS – Knowles-Eccersley-Scott-Symptom Scoring-System skóre; VAS – vizuálna analógová stupnica; POD – post operačný deň. Tab. 2. Vývoj KESS a VAS skóre pri refraktérnej slow-tranzit zápche
Tab. 2: KESS and VAS score evolution in the refractory slow-transit constipation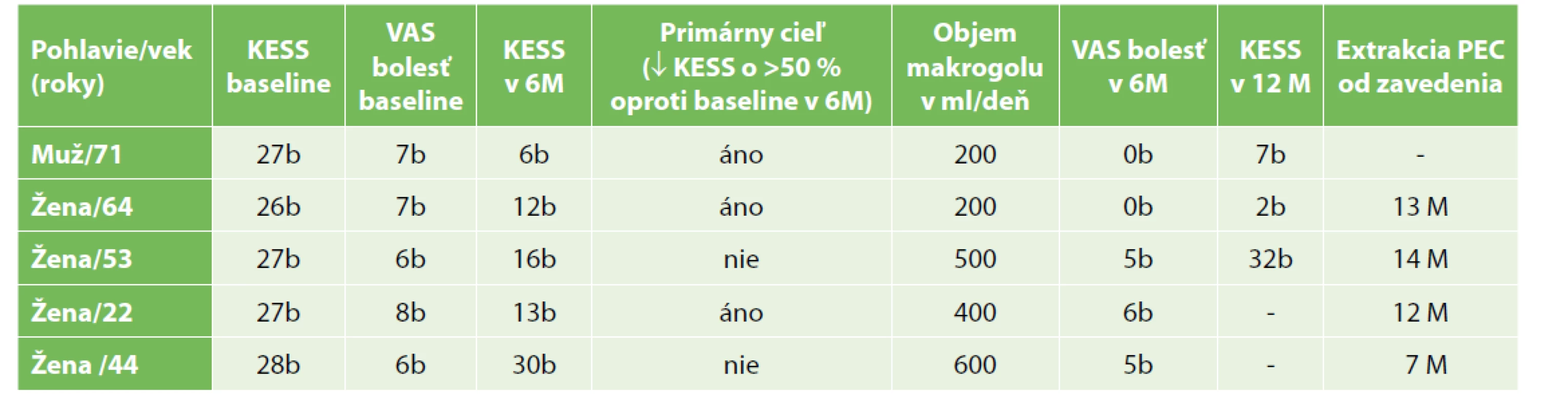
Bezprostredne po výkone neboli registrované žiadne komplikácie. U pacientky so sklerózou multiplex sa po 7 dňoch od zavedenia PEC objavila nekomplikovaná infekcia kože v oblasti katétra zvládnutá bez ATB (Clavien-Dindo I). U dvoch žien z dôvodu neefektivity ACE (do 12 mesiacov od inzercie PEC) a vznikom abscesu brušnej steny (bez peritonitídy) bola potrebná extrakcia katétra (Clavien-Dindo IIIa). Jedna pacientka už podstúpila subtotálnu kolektómiu, u druhej je v pláne. U muža po 15 mesiacoch užívania PEC došlo k jeho dysfunkcii (malrotácii a zauzleniu intraluminálneho pigtailu, pravdepod. nesprávnou manipuláciou) s lokálnou flegmónou brušnej steny a potrebou reinzercie nového PEC do c. ascendens znova pri LAPEC (Obr. 2).
Obr. 2. A) zauzlenie cekálneho katétra (na RTG), B) reinzerovaný Chait Trapdoor do c. ascedens
Fig. 2: A) tangled pigtail of cecal catheter (on X-ray); B) reinsertion of Chait Trapdoor in c. ascedens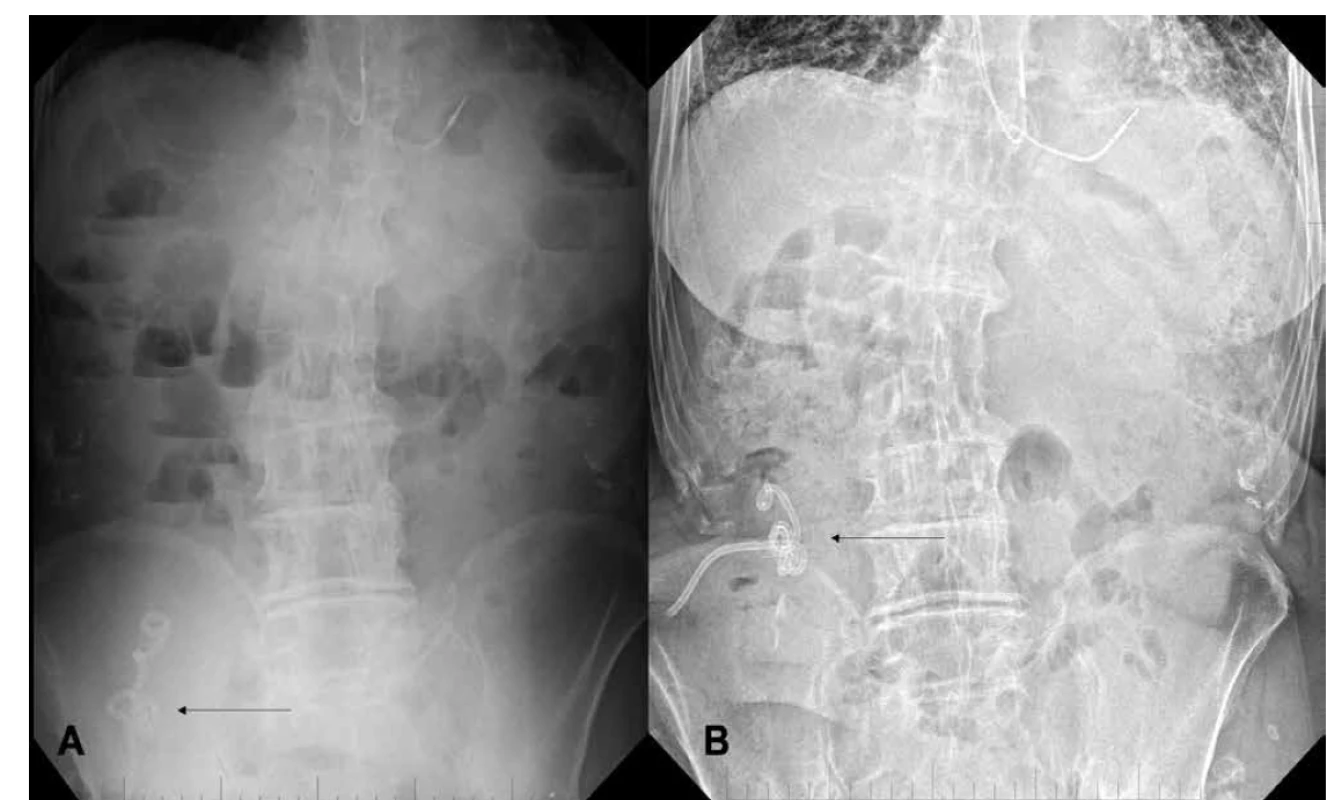
DISKUSIA
V osobitých situáciách, ak konzervatívne možnosti liečby sú neefektívne, chirurgické postupy boli a stále sú záchrannou možnosťou ako zlepšiť kvalitu života u pacientov so závažnou slow-transit zápchou, i keď nie bez nezávažných konsekvencií [13]. Mini-invazívny Maloneho postup a sľubné výsledky antegrádnej klyzmy viedli k inovatívnym metódam využitia PEC v klinickej praxi. Čisto endoskopická alebo RTG navigovaná metóda zavádzania PEC pri lokálnej anestézii vykazovali v retrospektívnych analýzach vysokú efektivitu, ale boli asociované s vyšším rizikom infekčných komplikácii najmä peritonitíd [14]. Na druhej strane, laparoskopický prístup je široko etablovanou technikou v súčasnej modernej chirurgii a prezentovaná hybridná laparoskopicky-asistovaná perkutánna endoskopická technika zavádzania PEC, by (teoreticky) mala znížiť najmä riziko závažných infekčných komplikácii. LAPEC vo svojej podstate ponúka hneď niekoľko výhod. Prvou je priama laparoskopická a endoskopická vizualizácia céka k bezpečnému zavedeniu katétra pri vizuálnej kontrole. Druhou je identifikácia miesta v oblasti céka (ténia libera) tak, aby nedošlo k jeho lokálnej ischémii navodenej silikónovým katétrom, respektíve vzniku netesnosti a následného leaku črevného obsahu medzi brušnou a priľahlou stenou céka, ktorá sa rieši plikáciou steny céka okolo katétra o brušnú stenu. PEC je možné inzerovať i čisto endoskopickou technikou, pri ktorej je nevyhnutná kolonoskopická diafanoskopia brušnej steny z oblasti céka a perkutánna fixácia céka pomocou špeciálnej ihly. Po naložení 2–3 kožných fixačných stehov je perkutánny katéter „push-through“ technikou v analgosedácii zavedený do céka. Inzercia katétra nemusí byť jednoduchá, nakoľko stena céka je tenšia oproti napr. stene žalúdka, kde je možné perkutánnu gastrostómiu zaviesť podobnou technikou a nehrozí tak prípadná dislokácia stehov. Avšak štúdie porovnávajúce LAPEC vs endoskopicky asistovanú PEC nie sú.
Do pilotného projektu bolo zaradených 5 pacientov so závažnou slow-tranzit zápchou. Po zavedení PEC bol dostatočný, resp. zlepšený efekt antegrádnej klyzmy dosiahnutý u 4 (80 %) pacientov po 6 mesiacoch sledovania. Podobné výsledky dokumentovali aj iné štúdie [9,15]. U všetkých pacientov bol katéter úspešne implantovaný do céka na rozdiel od Riveru et al, ktorí uvádzali zlyhanie v 8 % [16]. Priemerná dĺžka výkonu a doba hospitalizácie sa výraznejšie nelíšila od výsledkov iných autorov (100 vs 93min) respektíve 2 (2–3) vs 3,8 (2–8) dní [10]. Popisovaná celková dĺžka výkonu reflektuje aj perioperačnou kolonoskopiou. V našom súbore sa bezprostredne počas alebo hneď po LAPEC nevyskytla žiadna závažná komplikácia.
V klinickej praxi je využívaných viacero skórovacích systémov hodnotenia zápchy, ale KESS ako jediné ponúka možnosť predikcie slow-tranzit obstipácie alebo evakuačnej dysfunkcie rekta [1,6]. Samotný KESS ale nezahŕňa hodnotenie bolesti, ktorá je častá u týchto pacientov. V našej analýze došlo k zmierneniu bolesti a zníženiu potreby užívania analgetík u 4 (80 %) pacientov v 6 mesiaci sledovania. Patofyziologický podklad zodpovedný za slow-tranzit čreva pri idiopatickej obstipácii má multifaktoriálny podklad. Určité alterácie počtu či funkcii buniek enterálneho nervového systému boli už dokumentované. Okrem Hirschsprungovej choroby, kde vzťah hypo/agangliózy a hypomotility hrubého čreva je dlhodobo známy, pri idiopatickej obstipácii ich vzťah nie je detailne objasnený [17]. V našej štúdii sme do pre-procedurálnej prípravy etablovali preukazovanie gangliových buniek enterického nervového systému v hlbokých biopsiach rekta.
Zavedenie PEC je spojené s rizikom menej-závažných i závažných komplikácií. Najčastejšie je uvádzaná tvorba granulómov či lokálne infekcie kože v oblasti inzercie katétra, bolesť brucha spojená s podávaním ACE či skôr náhodné poškodenie katétra alebo jeho upchatie. Najčastejšou komplikáciou v našom súbore bola infekcia kože a podkožia u 3 pacientiek, u dvoch z nich si vyžiadali extrakciu katétra. Nevýhodou PEC je občasná potreba výmeny silikónových katétrov (niekedy po 12–15 mesiacoch jeho užívania respektíve pri ich dysfunkcii). Hlavným dôvodom dysfunkcie je impaktácia lumenu katétra, ktorý nemá ochranný spätný ventil a umožňuje tak návrat črevného obsahu do jeho lumenu. V našom prípade jeden pacient (20 %) vyžadoval výmenu katétra po 15 mesiacoch užívania.
Naše pilotné výsledky, hoc s veľmi limitovaným počtom pacientov, sú povzbudivé. U väčšiny pacientov došlo po inzercii PEC k signifikantnému zlepšeniu symptómov asociovaných so zápchou, k zmierneniu intenzity bolesti a k zlepšeniu kvality ich života. Vyskytli sa i infekčné komplikácie, ktoré ale neviedli k trvalým následkom. S ohľadom na primárne zlyhanie PEC u jednej pacientky, ostáva otvorená otázka selekcie pacientov k PEC. Zastávame názor, že vzhľadom i na konsekvencie radikálnych chirurgických výkonov, i po vlastných skúsenostiach, je k zváženiu uprednostniť antegrádnu klyzmu pred radikálnou chirurgiou. Zásadným elementom by mala byť motivácia pacienta podávať si ACE. Samozrejme, pri nesebestačnosti, by sa malo priamo uvažovať o chirurgickom výkone.
Naša analýza má niekoľko limitácii. V prvom rade počet pacientov a retrospektívny charakter analýzy. Ovplyvnila nás epidémia COVID 19, z dôvodu ktorej sa výrazne obmedzila elektívna operatíva na našom pracovisku. Ďalšou limitáciou je krátky čas sledovania (približne jeden rok), a preto tieto závery sa nedajú aplikovať v širšom kontexte a len ďalšie štúdie s väčším počtom pacientov sú nevyhnutné k posúdeniu efektivity LAPEC hlavne u dospelých. Na čakacom liste ostali ďalší 3 pacienti, ktorým plánujeme LAPEC. Unikátom našej práce sú prvé pilotné výsledky zo Slovenska, ktoré doteraz neboli publikované.
ZÁVER
Perkutánnu cékostómiu s antegrádnou klyzmou je vhodne zvážiť u pozitívne motivovaných pacientov s refraktérnou slow-tranzit zápchou (ešte pred subtotálnou kolektómiou) a laparoskopicky-asistovaná technika inzercie katétra je vhodnou metódou k jej prevedeniu.
Zoznam skratiek:
ACE – antegrádna kolonická klyzma
ASA – Americká spoločnosť anesteziológov
ATB – antibiotiká
ESGE – Európska spoločnosť pre gastrointestinálnu endoskopiu
KESS – Knowles-Eccersley-Scott-Symptom skóre
LAPEC – laparoskopicky asistovaná perkutánna cekostómia
MACE – Maloneho antegrádna kolonická klyzma
PEC – perkutánna cekostómia
POD – post operačný deň
VAS – vizuálna analógová stupnica
Konflikt záujmov
Autori článku vyhlasujú, že nie sú v súvislosti so vznikom tohto článku v konflikte záujmov a že tento článok nebol publikovaný v žiadnom inom časopise, s výnimkou kongresových abstrakt a klinických odporúčaných postupov.
MUDr. Rastislav Husťak
Gastroenterologické pracovisko
interná klinika FN Trnava
Žarnova 11
917 17 Trnava
e-mail: rastislav.hustak@fntt.sk
ORID 0000-0001-8669-9024
Zdroje
1. McCrea GL, Miaskowski C, Stotts NA, et al. Review article: Self-report measures to evaluate constipation. Alimentary Pharmacology and Therapeutics. Aliment Pharmacol Ther. 2008 Apr;27(8):638−648.. doi: 10.1111/j.1365-2036.2008.03626.x.
2. Lacy BE, Mearin F, Chang L, et al. Bowel disorders. Gastroenterology 2016 Feb 18;S0016-5085(16)00222−5. doi: 10.1053/j.gastro.2016.02.031.
3. Knowles CH, Scott M, Lunniss PJ. Outcome of colectomy for slow transit constipation. Annals of Surgery 1999;627–638. doi: 10.1097/00000658-199911000-00004.
4. Ripetti V, Caputo D, Greco S, et al. Is total colectomy the right choice in intractable slow-transit constipation? Surgery 2006;140 : 435–440. doi: 10.1016/j. surg.2006.02.009.
5. Kamm MA, Hawley PR, Lennard-Jones JE. Outcome of colectomy for severe idiopathic constipation. Gut 1988;29 : 969 – 973. doi: 10.1136/gut.29.7.969.
6. Knowles CH, Eccersley AJ, Scott SM, et al. Linear discriminant analysis of symptoms in patients with chronic constipation: validation of a new scoring system (KESS). Dis Colon Rectum 2000;43 : 1419-26. doi: 10.1007/BF02236639.
7. Malone PS, Ransley PG, Kiely EM. Preliminary report: the antegrade continence enema. The Lancet 1990;336 : 1217–1218. doi: 10.1016/0140-6736(90)92834-5
8. Dey R, Ferguson C, Kenny SE, et al. After the honeymoon-medium-term outcome of antegrade continence enema procedure. J Pediatr Surg. 2003;38 : 65–68. doi: 10.1053/jpsu.2003.50012.
9. Halleran DR, Vilanova-Sanchez A, Rentea RM, et al. A comparison of Malone appendicostomy and cecostomy for antegrade access as adjuncts to a bowel management program for patients with functional constipation or fecal incontinence. Journal of Pediatric Surgery 2019;54 : 123 – 128. doi: 10.1016/j.jpedsurg.2018.10.008. Epub 2018 Oct 5.
10. Ricard J, Rhun M Le, Chabrun E, et al. 1019 Percutaneous endoscopic caecostomy: feasibility, efficacy and complication rates in refractory colorectal disorders. Gastroenterology 2015;148:S-191. doi: 10.1016/S0016-5085(15)30636-3
11. Rodriguez L, Flores A, Gilchrist BF, et al. Laparoscopic-assisted percutaneous endoscopic cecostomy in children with defecation disorders (with video). Gastrointestinal Endoscopy 2011;73 : 98–102. doi: 10.1016/j.gie.2010.09.011.
12. Weusten BLAM, Barret M, Bredenoord AJ, et al. Endoscopic management of gastrointestinal motility disorders - part 1: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2020;52 : 498–515. doi: 10.1055/a-1160 - 5549.
13. Pfeifer J. Surgical options to treat constipation: A brief overview. Rozhledy v chirurgii 2015;94 : 349–61.
14. Marker DR, Perosi N, Ul Haq F, et al. Percutaneous cecostomy in adult patients: Safety and quality-of-life results. J Vasc Interv Radiol. 2015 Oct;26(10):1526−1532.e1. doi: 10.1016/ j.jvir.2015.06.014.
15. Poirier M, Abcarian H, Nelson R. Malone antegrade continent enema: An alternative to resection in severe defecation disorders. Dis Colon Rectum. 2007 Jan;50(1):22−28. doi: 10.1007/s10350 - 006-0732-x.
16. Rivera MT, Kugathasan S, Berger W, et al. Percutaneous colonoscopic cecostomy for management of chronic constipation in children. Gastrointestinal endoscopy. 2001;53 : 225–228. doi: 10.1067/ mge.2001.112182.
17. Wedel T, Roblick UJ, Ott V, et al. Oligoneuronal hypoganglionosis in patients with idiopathic slow-transit constipation. Diseases of the Colon & Rectum 2002;45 : 54–62. doi: 10.1007/s10350 - 004-6114-3.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2022 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
- Cinitaprid – v Česku nová účinná látka nejen pro léčbu dysmotilitní dyspepsie
-
Všechny články tohoto čísla
- Hledání ztraceného ráje – alternativní místa pro transplantaci izolovaných Langerhansových ostrůvků
- Laparoskopicky asistovaná perkutánna endoskopická cekostomia (LAPEC) v liečbe ťažkej zápchy u dospelých – vlastné skúsenosti
- Anorektální manometrie s vysokým rozlišením u pacientů s anorektální dysfunkcí a terapeutické konsekvence
- Endoskopie a chirurgie
- Úspěšná opakovaná endoskopická pyloromyotomie (re-G-POEM) v léčbě postchirurgické gastroparézy
- Endoskopická léčba motilitních onemocnění trávicího traktu
- Laparoskopické ošetření cholecystoduodenální píštěle po spontánní úpravě střevní obstrukce při biliárním ileu – kazuistika a přehled literatury
- Inkarcerovaná levostranná paraduodenální kýla − kazuistika a přehled literatury
- Komentář k původní práci Akutní apendicitida v době jarní pandemie covid-19 v roce 2020 – srovnávací retrospektivní studie
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Anorektální manometrie s vysokým rozlišením u pacientů s anorektální dysfunkcí a terapeutické konsekvence
- Endoskopická léčba motilitních onemocnění trávicího traktu
- Inkarcerovaná levostranná paraduodenální kýla − kazuistika a přehled literatury
- Úspěšná opakovaná endoskopická pyloromyotomie (re-G-POEM) v léčbě postchirurgické gastroparézy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



