-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Sakrální neuromodulace v léčbě fekální inkontinence – 10leté zkušenosti a dlouhodobé výsledky specializovaného centra
Sacral neuromodulation for faecal incontinence – 10 years experience and long-term outcomes of a specialized centre
Introduction: Sacral neuromodulation/sacral nerve stimulation (SNM/SNS) has become the most successful method for treatment of faecal incontinence (FI) in the last 10 years. The high efficiency of SNM is based on the electrical stimulation of the external anal sphincter and moreover the mechanism of action of SNS can be explained by the modulation of somatovisceral reflexes and perceptions of afferent information. Therefore the mechanism of action is more complex in contrast to other methods of treatment. In the Czech Republic, the SNM was implemented for the first time in 2010 with the financial support of the IGA grant of the Ministry of Health of the Czech Republic. Since 2018, two specialized centres for the treatment of FI using the SNM method have been established in the Czech Republic.
Methods: In the years 2010−2020, 35 patients were indicated for SNM. The ratio of women to men was 34 : 1. The mean age at implantation was 62 years (range 46−75). Most patients were in the 6th and 7th decade. Two diagnostic procedures were performed in all patients, percutaneous evaluation of the S2−S4 sacral nerves, implantation of the Medtronic 3889 28cm stimulation tined lead electrode and its connection to an external stimulator and subsequent subchronic stimulation for 2−4 weeks. The criteria for permanent neurostimulator implantation were a minimum 50% reduction in the number of FI episodes per week or a 50% reduction in incontinence score. Patients were then implanted with a Medtronic InterStim II 3058 permanent neurostimulator.
Results: A permanent neurostimulator was implanted in 33 of 35 patients (94%). No patient died. The complication rate was 11.4%. In 2 patients it was an infectious complication. In one patient malposition of the stimulator occurred after falling down and in one patient we observed lead breakage with subsequent malfunction of the stimulator after falling down. All complications were successfully resolved by reoperation. The longterm effect of SNM was evaluated in the group of the first 15 implanted patients from 2010−2011. Of these, 9 patients were available, in whom a new neurostimulator was reimplanted due to loss of battery power in 2018−2020. The mean length of follow-up was 112 months (99−124). The mean number of FI episodes per week was 1.9 (0−13) after neurostimulator implantation compared to 13.6 (3−25) before implantation. The Cleveland Clinic Incontinence Score (CCIS) was 8.3 (3−16) after neurostimulator implantation compared to CCIS 18.8 (15−20) before implantation. Both FI episode counts and CCIS scores were significantly lower (p<0.05). According to PP (per protocol) analysis, in 64.3% of patients at least 50% improvement of continence or reduction of FI episodes persists after 8−10 years in comparison with the condition before primary implantation; full continence was achieved in 4 patients (28.6%).
Conclusion: Sacral neuromodulation is an effective and safe minimally invasive method for the treatment of severe faecal incontinence. A beneficial long-term effect is observed in more than half of the patients. Successful outcomes of SNM depend on careful selection of patients, precise electrode placement technique and experience of the specialized centre. Key words: faecal incontinence – sacral neuromodulation – sacral nerve stimulation – long-term outcomes
Keywords:
faecal incontinence – sacral neuromodulation – sacral nerve stimulation – long-term outcomes
Autoři: P. Šlauf; R. Vobořil
Působiště autorů: Chirurgická klinika 1. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Bulovka, Praha
Vyšlo v časopise: Rozhl. Chir., 2021, roč. 100, č. 10, s. 475-483.
Kategorie: Původní práce
doi: https://doi.org/10.33699/PIS.2021.100.10.475–483Souhrn
Úvod: Sakrální neuromodulace/stimulace sakrálního nervu (SNM/SNS) se stala v posledních 10 letech nejúspěšnější metodou léčby fekální inkontinence (FI). Vysoká efektivita SNM spočívá v elektrické stimulaci zevního análního svěrače a mechanismus účinku je vysvětlován i modulací somatoviscerálních reflexů a percepce aferentních informací. Účinek je proto komplexní na rozdíl od ostatních metod. V České republice byla SNM poprvé provedena 2010 za podpory grantu IGA MZ ČR. Od 2018 byla v ČR ustanovena dvě specializovaná centra pro léčbu FI metodou SNM.
Metoda: V letech 2010–2020 bylo k SNM indikováno 35 pacientů, z toho 34 žen a jediný muž. Průměrný věk byl 62 let (v rozmezí 46–75). Převažovali pacienti v pokročilejším věku s maximem v 6. a 7. deceniu. U všech pacientů byly provedeny obě diagnostické fáze, tj. perkutánní vyšetření sakrálních nervů S2−S4 s implantací stimulační elektrody Medtronic 3889-28 cm a jejím napojením na zevní stimulátor a následná subchronická stimulace po dobu 14–28 dní. Kritériem pro indikaci k implantaci permanentního neurostimulátoru bylo minimálně 50% snížení epizod FI týdně nebo 50% snížení skóre inkontinence. Pacientům byl poté implantován permanentní neurostimulátor Medtronic InterStim II 3058.
Výsledky: Permanentní neurostimulátor byl implantován u 33 z 35 pacientů (94 %). Letalita byla nulová. Morbidita byla 11,4 %. U 2 pacientů šlo o pooperační lokální infekci, jednou o malpozici stimulátoru po pádu a jednou o zalomení elektrody po pádu s malfunkcí stimulátoru. Všechny komplikace byly úspěšně vyřešeny reoperací. Dlouhodobý efekt SNM byl hodnocen u skupiny prvních 15 pacientů z let 2010–2011. Z nich bylo k dispozici 9 pacientů, u nichž byla 2018–2020 z důvodu vybití baterie provedena reimplantace nového neurostimulátoru. Průměrná délka sledování byla 112 měsíců (99–124). Průměrný počet epizod FI za týden činil 1,9 (0−13) ve srovnání s počtem epizod FI 13,6 (3–25) před stimulací a Cleveland Clinic Incontinence Score (CCIS) bylo 8,3 (3−16) ve srovnání s CCIS 18,8 (15−20) před stimulací. Hodnoty počtu epizod FI i CCIS byly signifikantně nižší než před stimulací (p<0,05). Podle PP (per protocol) analýzy u všech 9 pacientů (64,3 %) přetrvává i po 8–10 letech minimálně 50% zlepšení kontinence, resp. snížení epizod FI ve srovnání se stavem před primoimplantací a plné kontinence bylo dosaženo u 4 pacientů (28,6 %).
Závěr: Sakrální neuromodulace je efektivní a bezpečná minimálně invazivní metoda léčby těžké fekální inkontinence. U více než poloviny pacientů je pozorován i příznivý dlouhodobý efekt. Úspěšnost SNM spočívá v pečlivém výběru pacientů, technickém provedení i zkušenostech specializovaného pracoviště.
Klíčová slova:
dlouhodobé výsledky – fekální inkontinence – sakrální neuromodulace – stimulace sakrálního nervu
ÚVOD
Fekální inkontinence (FI) je samovolný a nekontrolovatelný únik stolice buď bez vědomí postižené osoby (pasivní inkontinence), nebo s jejím vědomím, ale bez schopnosti tomu i přes maximální úsilí zabránit (urgentní inkontinence). Jedná se o velmi stresující a diskvalifikující funkční poruchu, která má signifikantně negativní dopad na kvalitu života pacienta. Podle různých studií se prevalence FI pohybuje mezi 7–15 % u všeobecné populace [1−3]. Prevalence se zvyšuje až na 46 % ve starší populaci, především u osob v domovech pro seniory či léčebnách pro dlouhodobě nemocné [3]. Z hlediska pohlaví FI postihuje především ženy. Ve skutečnosti je však prevalence ještě podhodnocena vzhledem k tomu, že značná část postižených osob se odmítá se svými problémy svěřovat členům rodiny i svému ošetřujícímu lékaři. Za primární příčinu fekální inkontinence se považuje dysfunkce análních svěračů. Ta je často přičítána poranění v souvislosti s porodem. Za jiné potenciální příčiny FI jsou považovány spinální trauma, cévní příhoda mozková, roztroušená skleróza, dlouhodobý diabetes mellitus, rektální prolaps, ztráta rekta po resekci, radioterapie nebo se příčina označuje jako idiopatická [4].
Léčba FI začíná použitím konzervativních neinvazivních metod, jakými jsou fyzioterapie pánevního dna, biofeedback a jednoduchá farmakoterapie [5]. Při jejich selhání připadá do úvahy invazivnější léčba. Ta zahrnuje neuromodulaci, umělé svěrače, lokální aplikaci silikonových materiálů a v selektivních případech sfinkteroplastiku [6−7]. Nejpoužívanější a nejefektivnější metodou neuromodulace je stimulace sakrálního nervu (SNS). Poprvé publikovali její použití pro močovou dysfunkci v roce 1988 Tanagho, et al. [8] a pro FI v roce 1995 Matzel [9]. V literatuře bylo dosud publikováno poměrně široké spektrum prací podporujících užití SNS z hlediska krátkodobých a střednědobých výsledků [10−13]. Nicméně dosud bylo publikováno jen málo prací zabývajících se jeho účinností v dlouhodobém horizontu [14−16].
Na Chirurgické klinice 1. LF UK a Fakultní nemocnice Bulovka (FNB) jsou léčeni pacienti s FI metodou SNS od roku 2010, kdy byla sakrální neuromodulace provedena jako první v České republice (ČR) u 15 pacientů s FI za podpory grantu IgA MZ ČR [13]. Od roku 2012 se SNS v ČR neprováděla pro vysoké finanční náklady, které odmítaly zdravotní pojišťovny (ZP) hradit, a byla poskytnuta jen ojediněle některým pacientům po osobním vyjednání se ZP. Od roku 2018 byla v ČR ustanovena dvě specializovaná centra pro léčbu FI metodou SNS, z nichž jedním je FNB.
METODY
V letech 2010–2020 bylo na Chirurgické klinice 1. LF UK a Fakultní nemocnice Bulovka ke stimulaci sakrálního nervu (SNS) indikováno 35 pacientů. Indikační kritéria a požadovaná specifická vyšetření před SNS byla podrobně popsána v naší předchozí publikaci [13].
U všech 35 pacientů byly provedeny obě diagnostické fáze. Nejprve bylo provedeno v celkové anestezii perkutánní vyšetření sakrálních nervů v rozsahu S2−S4 bilaterálně s cílem nalézt optimální odpověď análních svěračů na jejich elektrickou stimulaci (Obr. 1). Pokud byl tento test úspěšný, byla v jedné době pacientovi do vybraného místa implantována stimulační elektroda s trny (tined lead) Medtronic 3889-28 cm (Obr. 2). Elektroda byla napojena na spojovací drát vyvedený zevně a připojený k dočasnému zevnímu stimulátoru (Obr. 3). V další diagnostické tzv. subchronické fázi probíhala dočasná zevní stimulace ambulantně po dobu 14–28 dní a pacient si denně zapisoval případně epizody FI. Kritériem pro indikaci k implantaci permanentního neurostimulátoru bylo minimálně 50% snížení epizod FI a snížení skóre inkontinence alespoň o 50 %. Jako inkontinenční skóre jsme používali Wexnerovou skóre ve stupnici 0−20 (CCIS – Cleveland Clinic Incontinence Score), kdy 0 znamenala dokonalou kontinenci a 20 totální inkontinenci. Pokud byla po subchronické stimulaci výše uvedená kritéria splněna, pacientům byl v lokální anestezii implantován permanentní neurostimulátor Medtronic InterStim II 3058 (Obr. 4).
Obr. 1. Stimulační elektrody zavedené do foramen sacrale dorsale a zahájení stimulace
Fig. 1: Sacral foramen needle positioning and initiation of stimulation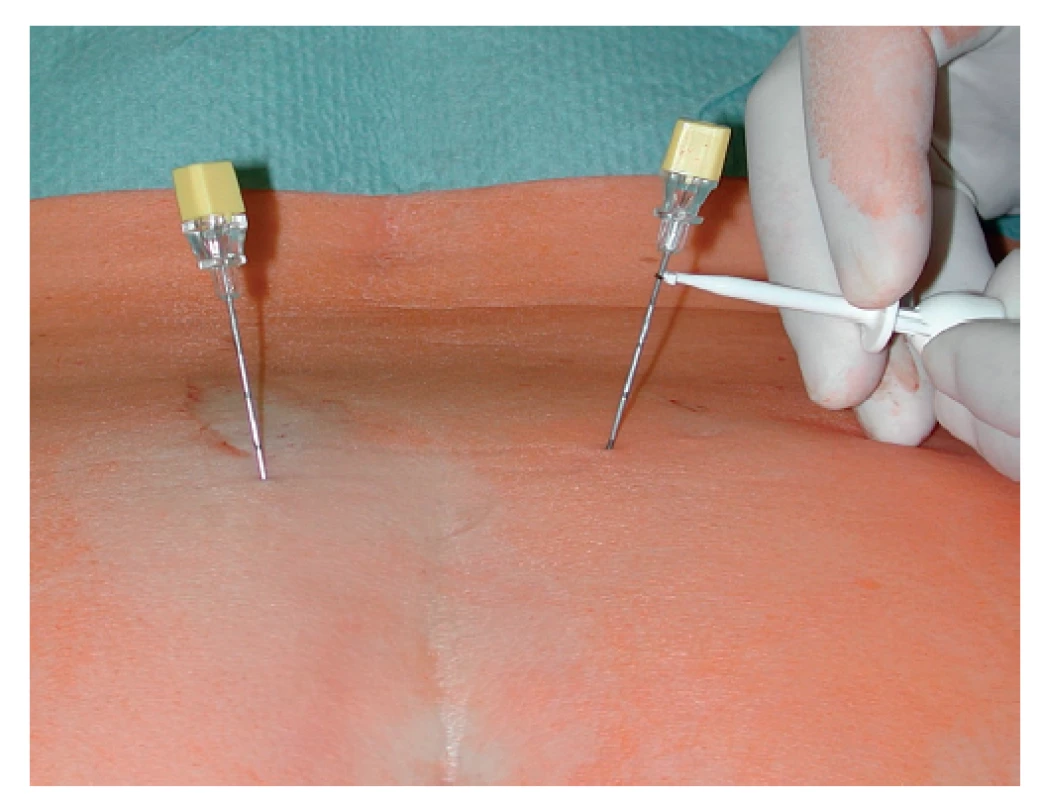
Obr. 2. Zavedená „tined lead„ elektroda
Fig. 2: Implanted “tined lead“ electrode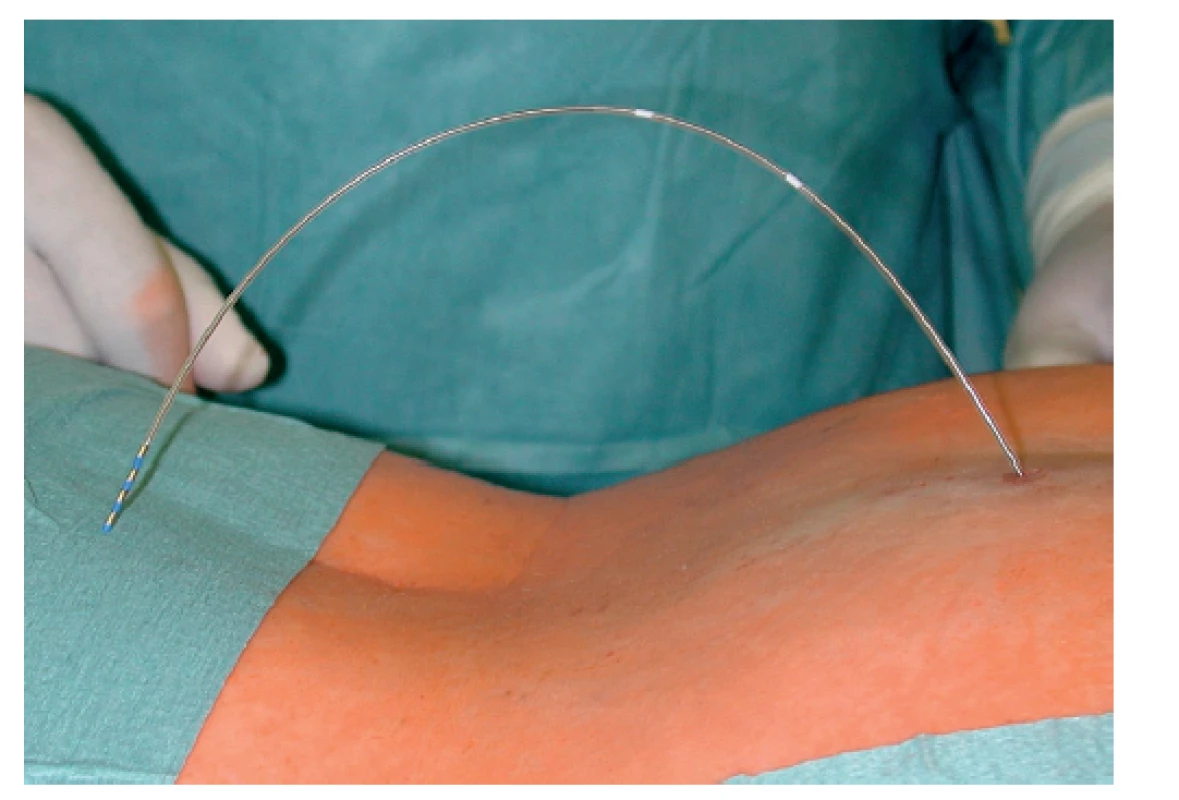
Obr. 3. Drát napojený na elektrodu v podkožní kapse a vyvedený zevně pro spojení s dočasným zevním neurostimulátorem
Fig. 3: Extension lead connected to the electrode in the subcutaneous pocket and withdrawn to be connected to temporary external neurostimulator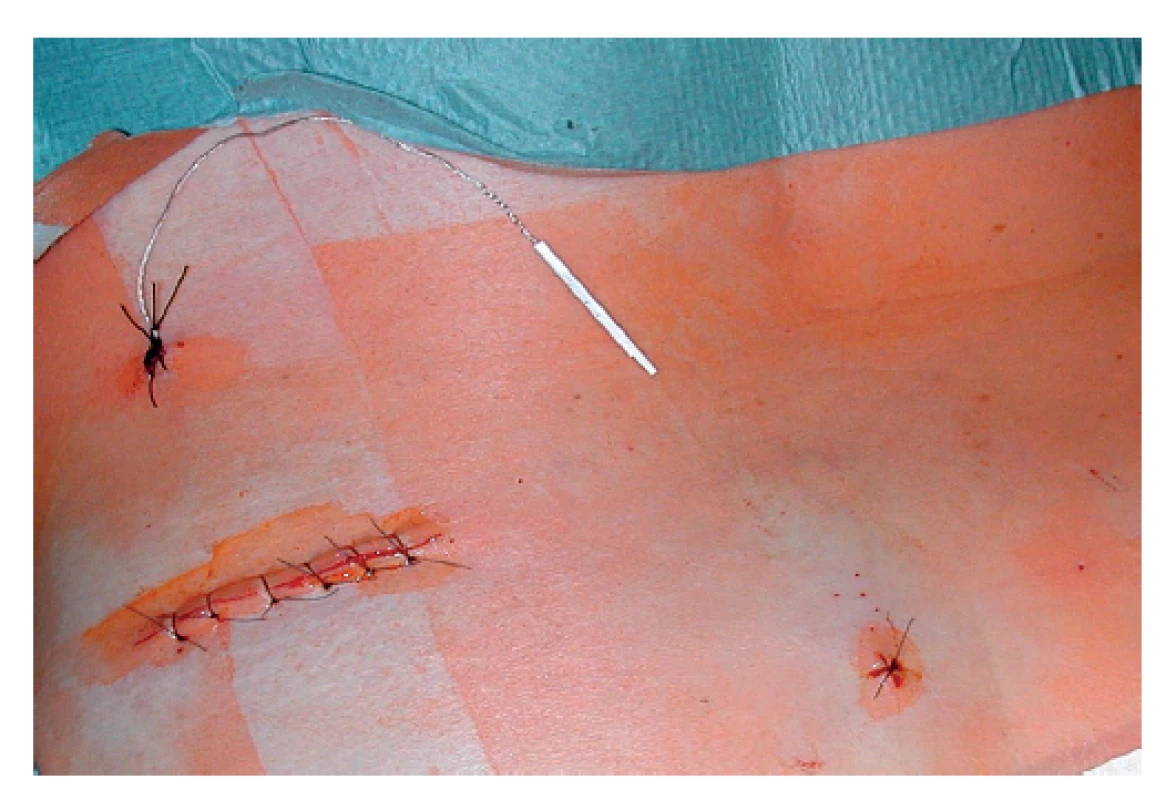
Obr. 4. Připojení elektrody k neurostimulátoru Medtronic InterStim II 3058
Fig. 4: Connection of the electrode to the Medtronic Inter- Stim II 3058 neurostimulator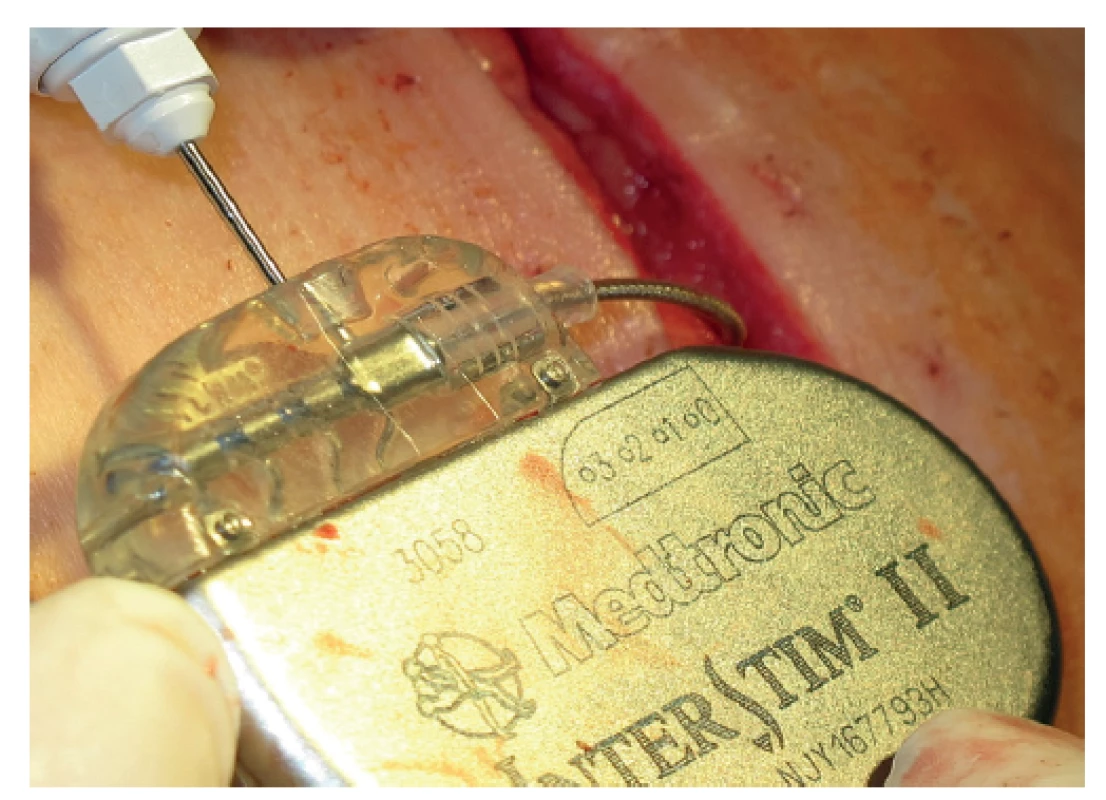
U všech pacientů jsme hodnotili procento úspěšnosti primoimplantace, mortalitu a morbiditu a úspěšnost řešení jednotlivých komplikací. Hodnocení dlouhodobých výsledků jsme mohli provést jen u první skupiny 15 pacientů, operovaných v letech 2010–2011 za podpory grantu IgA MZ ČR, s odstupem 8–10 let po primoimplantaci. Z původního počtu zůstalo po 8–10 letech k dispozici 9 pacientů, všem byla provedena výměna vybitého neurostimulátoru za nový. K hodnocení dlouhodobých výsledků jsme použili ITT analýzu (intention - to treat) a PP analýzu (per protocol). ITT analýza hodnotí procento dlouhodobě úspěšných výsledků SNS z celkového počtu po sobě jdoucích pacientů, kteří podstoupili testovací fázi s dočasnou neurostimulací bez ohledu na výsledky testování. PP analýza hodnotí jen ty pacienty, kteří měli úspěšný dočasný neurostimulační test a byl jim implantován permanentní neurostimulátor. V ITT i PP analýze byli pacienti, kteří nebyli k dispozici pro dlouhodobé sledování, hodnoceni jako selhání léčby. Kritériem pro úspěšný dlouhodobý efekt bylo nejméně 50% snížení epizod FI a minimálně 50% snížení CCIS v době poslední kontroly srovnávané s FI před zahájením stimulace. Počty epizod inkontinence a skóre inkontinence (Cleveland Clinic Incontinence Score) u pacientů před zavedením stimulace a s odstupem 8–10 let jsou uváděny v průměrných hodnotách se směrodatnou odchylkou. Ke statistickému hodnocení byl použit program Statistica (StatSoft ČR). K porovnání statistické významnosti byl použit neparametrický Wilcoxonův test. Za statisticky významný byl považován rozdíl, kdy na hladině p je nižší než 0,05.
VÝSLEDKY
Permanentní neurostimulátor byl implantován u 33 z celkového počtu 35 pacientů (94 %). Jednoznačně převažovaly ženy nad muži v poměru 34 : 1. Průměrný věk pacientů byl 62 let (v rozmezí 46–75). Největší zastoupení bylo v šestém a sedmém deceniu (51−70 let), což představovalo 28 pacientů (80 %).
Etiologie fekální inkontinence byla idiopatická u 19 pacientů, neurogenní u 4 pacientů, po resekční rektopexi pro kompletní prolaps rekta u 4 pacientů, po rekonstrukci svěračů u 6 pacientů (z toho 3x po poporodním a 3x po iatrogenním poranění) a u 2 pacientů šlo o FI po nízké resekci rekta, z toho jednou po aktinoterapii malé pánve. Inkontinence podle typu byla urgentní u 23 pacientů, pasivní u jednoho pacienta a smíšená u 11 pacientů.
Letalita byla nulová. Morbidita činila 11,4 %. U dvou pacientů jsme zaznamenali pooperační lokální infekci. Poprvé se jednalo o serom v operační ráně u obézní pacientky po implantaci stimulační elektrody, který jsme však objevili až během následující operace druhé fáze SNS. Nepovažovali jsme jej však za důvod odložení implantace stimulátoru. Serom byl evakuován, provedena toaleta rány, pacientka měla antibiotickou profylaxi a permanentní neurostimulátor jsme ještě zabalili do garamycinové pěny. Operační rána se zhojila bez dalších komplikací. U druhé pacientky došlo k lokální infekci po implantaci neurostimulátoru i přes antibiotickou profylaxi. Nejprve vznikl serom, který byl opakovaně evakuován za přísně sterilních kautel, ale bez efektu, byla nasazena širokospektrá antibiotika podle citlivosti, ale opět bez efektu. Postupně došlo ke vzniku abscesu operační rány. Nezbývalo než provést operační revizi v celkové anestezii v cloně antibiotik nasazených opět podle citlivosti s vysokým rizikem nutnosti explantace neurostimulátoru. Reoperace byla provedena 5 týdnů po implantaci stimulátoru. Peroperačně jsme nalezli zkalený výpotek v oblasti podkožní kapsy s implantovaným stimulátorem, který byl obklopen jakýmsi fibrózním pouzdrem. Stimulátor jsme odpojili od elektrody, vyjmuli z operační rány a naložili do dezinfekčního roztoku tak, aby se tekutina nedostala do místa spojení s elektrodou. Poté jsme exstirpovali fibrózní pouzdro in toto a exstirpovali ještě i kůži a podkoží v celém rozsahu rány. Po dezinfekci operačního pole neředěným roztokem betadine následovalo opětovné spojení elektrody s neurostimulátorem, který jsme navíc zabalili do garamycinové pěny. Protože byla již před operací prokázána stafylokoková infekce (stafyl. aureus), ponechali jsme antibiotika po dobu 7 dní. Operační rána se nyní zhojila per primam a neurostimulátor byl plně funkční. U třetí pacientky došlo po dvou po sobě jdoucích pádech asi 6 měsíců po implantaci neurostimulátoru k postupné malpozici stimulátoru v podkoží tak, že se stimulátor otočil o 90° a svou hranou tlačil na kůži. To způsobovalo iritaci a otok kůže a pacientce silnou omezující bolest, i když funkce stimulátoru nebyla porušena. Při reoperaci v lokální anestezii jsme nenašli známky lokální infekce, upravili jsme polohu stimulátoru v podkožní kapse do původního stavu a poněkud volnější podkožní prostor jsme zmenšili jednotlivými stehy. Operační rána se zhojila bez komplikací, pacientka je bez obtíží a neurostimulátor je funkční. A konečně u čtvrté pacientky s komplikací došlo po pádu na stranu implantovaného stimulátoru asi 6 měsíců po implantaci k úplnému vymizení jeho funkce a obnovení totální inkontinence. Pacientka vůbec nevnímala stimulaci v oblasti anu, jen občas propagaci do levé dolní končetiny i při minimální stimulační intenzitě. Při kontrolním vyšetření byla zjištěna vysoká impedance přes 4000 ohmů, což svědčilo pro pravděpodobnost disrupce či zalomení stimulační elektrody. Toto podezření bylo potvrzeno na nativním rtg pánve, kde v boční projekci bylo patrné postavení elektrody hlouběji presakrálně a v předozadní projekci bylo patrno ohnutí elektrody na 60° v místě těsně nad čtyřmi koncovými aktivními elektrodami a v místě nad proximální radiokontrastní značkou elektrody v úrovni sakrální fascie jakási smyčka (Obr. 5 a, b). Při reoperaci byla poškozená elektroda explantována a po úspěšném perkutánním testu byla implantována nová elektroda na kontralaterální stranu a zde napojena na původní neurostimulátor transponovaný zleva doprava. Operace se zhojila bez komplikací a došlo k plnému obnovení funkce neurostimulátoru.
Obr. 5. a, b: Dislokovaná elektroda v předozadní a boční projekci
Fig. 5 a, b: Displacement of electrode in X-ray sacrum AP and lateral view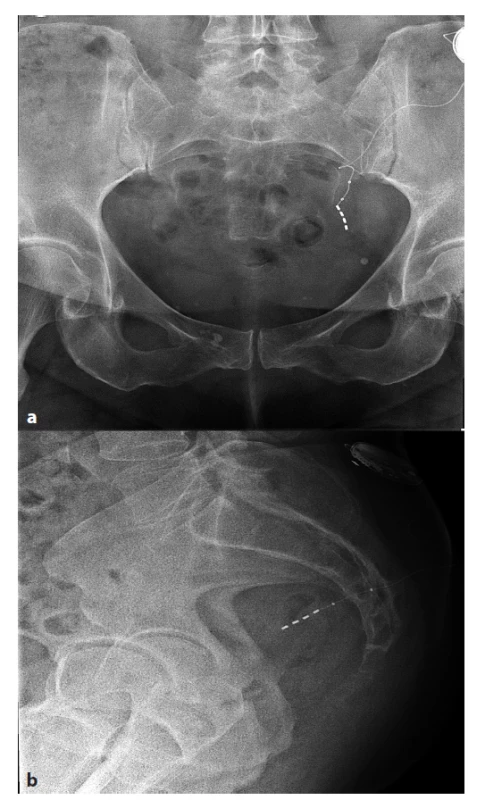
Dlouhodobý efekt SNS byl hodnocen u skupiny prvních 15 pacientů z let 2010–2011. Z nich byl 14 pacientům (93 %) implantován permanentní neurostimulátor. Nicméně pro hodnocení dlouhodobých výsledků zůstalo k dispozici jen 9 pacientů, u nichž byla v letech 2018–2020 z důvodu vybití baterie provedena reimplantace nového neurostimulátoru. Z pacientů vyřazených ze sledování jedna pacientka s krátkodobou plnou kontinencí se ztratila z dispenzarizace po dvou letech a později jsme zjistili, že byla operována pro zhoubný nádor mozku a onemocnění podlehla. U další pacientky s nevýrazným hraničním krátkodobým efektem kolem 50 % asi jeden rok po implantaci došlo k postupnému zhoršování stimulačního efektu a pacientka nebyla ani schopna docházet na další dispenzární kontroly pro progredující svalovou dystrofii. Zbývající tři pacientky si vyžádaly explantaci neurostimulátoru. U dvou z nich byla důvodem lumbalgie na podkladě diskopatie, která nereagovala na konzervativní léčbu, bylo plánováno operační řešení a neurochirurg vyžadoval magnetickou rezonanci, která je u SNS kontraindikací. A jedna pacientka byla akutně operována, provedena resekce sigmatu podle Hartmanna pro perforovanou divertikulitidu. Tato pacientka měla již asi 1 rok vybitý neurostimulátor a termín výměny vzhledem k negativními stanovisku ZP byl v nedohlednu. Na stomii si zvykla a rozhodla se další operace již nepodstoupit. U všech tří pacientek byla provedena explantace stimulátoru i elektrody bez komplikací.
Dlouhodobé funkční výsledky jsme proto mohli hodnotit jen u zbývajících 9 pacientů po primoimplantaci v letech 2010–2011 a reimplantaci pro vybitý původní stimulátor v letech 2018–2020. Průměrná délka sledování činila 112 měsíců (v rozmezí 99–124 měsíců). Sledovali jsme počet epizod FI za týden, kdy pacienti vyplňovali deník inkontinence za 14 dní před poslední kontrolou, a hodnotili jsme Wexnerovo skóre inkontinence CCIS (Cleveland Clinic Incontinence Score) od 0–20. Kritériem pro dlouhodobý úspěšný efekt stimulace bylo přetrvávající minimálně 50% snížení epizod FI a minimálně 50% snížení CCIS v porovnání s FI a CCIS před zahájením stimulace. Zjistili jsme u těchto 9 pacientů průměrný počet epizod FI za týden 1,9 (0−13) ve srovnání s počtem epizod FI 13,6 (3−25) před stimulací a CCIS 8,3 (3−16) ve srovnání s CCIS 18,8 (15−20) před stimulací. Statistické zhodnocení pomocí Wilcoxonova testu prokázalo statisticky významný pokles v obou parametrech, tj. u FI (Graf 1) i u CCIS (Graf 2) po zavedení stimulace sakrálního nervu (p<0,05). Podle ITT a PP analýzy přetrvává úspěšný efekt stimulace sakrálního nervu i po dlouhodobém sledování s odstupem 112 měsíců (99−124) od primoimplantace. Podle ITT (intention-to-treat) analýzy, kdy se hodnotí úspěšnost z celkového počtu pacientů, kteří podstoupili aspoň testovací fázi bez ohledu na výsledek, je dlouhodobá úspěšnost SNS 60 % (9 z 15 pacientů) a plné kontinence dosaženo u 4 pacientů (26,6). Podle PP (per protocol) analýzy, kdy se hodnotí úspěšnost SNS u pacientů, kterým byl implantován permanentní neurostimulátor, jsme zaznamenali úspěšný dlouhodobý efekt u 9 ze 14 pacientů (64,3 %) a plné kontinence bylo dosaženo u 4 pacientů (28,6 %).
Graf 1. Počet epizod FI před stimulací a po stimulaci
Graph 1: Number of FI episodes before and after stimulation
Graf 2. CCIS před stimulací a po stimulaci
Graph 2: CCIS before and after stimulation
DISKUZE
Sakrální neuromodulace se zdá být efektivní, minimálně invazivní léčebnou modalitou pro FI. Navzdory stoupajícímu počtu SNM v posledních 10 letech a rozšíření indikací zůstává v pochopení přesného mechanismu účinku stimulace sakrálního nervu u pacientů s FI ještě mnoho nezodpovězených otázek. Efekt SNM téměř jistě závisí na modulaci spinálních a (nebo) supraspinálních nervových drah a nové hypotézy ukazují, že aferentní signály k mozku jsou zcela zásadní pro úspěšnou terapii [18]. Nicméně účinek SNS na autonomní a somatické eferentní nervové dráhy zůstává nejistý, protože interpretace výsledků u lidských studií je obtížná pro multifaktoriální příčiny FI. Efekt SNM na trávicí systém tak pravděpodobně není stejný u pacientů s centrálními neurologickými chorobami, periferními neuropatiemi, anatomickými lézemi svěračů nebo viscerální hypersenzitivitou. A navíc je pravděpodobné, že SNM působí různými mechanismy jako inhibicí aferentních senzorických drah, snížením parasympatické aktivity, zvýšením sympatické aktivity a somatickou aktivitou na spinální a supraspinální úrovni [19]. Různé mechanismy účinku SNM tak způsobují, že stimulační efekt je komplexnější. Ovlivňuje příznivě funkci svěračů a svalstva pánevního dna pravděpodobně přeměnou rychle se kontrahujících a snadno unavitelných vláken příčně pruhovaného svalu (typ II) na svalová vlákna (typ I), která jsou pomalu unavitelná a jsou schopna dlouhodobé kontrakce, resp. tonu. SNM působí i snížení kolorektální motility, ovlivňuje práh senzitivity, zvyšuje rektální kapacitu a compliance [20]. Proto je SNM jednoznačně úspěšnější v léčbě FI než všechny ostatní léčebné alternativy. Komplexní účinek umožnil i rozšíření indikací SNM. Některé publikované kazuistiky prokázaly, že SNS dává šanci na zlepšení příznaků FI i u pacientů se syndromem dráždivého tračníku, anální bolestí, se systémovou sklerózou, svalovovou dystrofií, idiopatickými střevními záněty, po resekci rekta s nebo bez radioterapie, s ileo-pouchanální anastomózou nebo s prolapsem rekta [21]. V sestavě našich pacientů jsme SNS provedli u 4 pacientů po resekční rektopexi pro kompletní prolaps rekta. I když se doporučuje provést SNS minimálně za 1 rok po rektopexi, u jedné pacientky jsme SNS provedli již po 3 měsících s efektem, který přetrvává i v dlouhodobém horizontu. SNS může být úspěšná i u pacientů s defektem svěrače do 120°, což můžeme potvrdit z vlastní zkušenosti u dvou pacientek s defektem po rekonstrukci. A konečně u dvou pacientů byla provedena SNS pro FI po resekci rekta, jednou s neoadjuvantní radioterapií zatím s velmi dobrým krátkodobým efektem. FI po nízké resekci rekta pro karcinom se vyskytuje v rámci tzv. LARS (low anterior resection syndrom). Příznaky zahrnují inkontinenci pro plyny a stolici, urgence, evakuační obtíže a časté frekvence stolic a těžší forma LARS výrazně snižuje kvalitu života pacientů. Její prevalence se pohybuje mezi 17,8–56 % (22). Etiologie FI po resekci rekta je multifaktoriální a zahrnuje přímé poškození svěračového aparátu během chirurgického výkonu, ztrátu kapacity neorektálního reservoiru, poškození způsobené neoadjuvantní radioterapií a poškození autonomních pánevních nervů [23]. Dřívější studie prokázaly signifikantní prevalenci FI u pacientů s anastomózou do 6–8 cm od análního okraje a to, že incidence a závažnost příznaků FI jsou přímo úměrné rozsahu resekovaného rekta [24−25]. Při selhání konzervativní terapie FI může sakrální neuromodulace zlepšit příznaky FI až o 50 % až u 80 % pacientů. Nicméně dosud publikované údaje o klinické efektivitě SNM po resekci rekta jsou limitovány malým počtem pacientů. Prospektivní studie z Cleveland Clinic Florida ukázala nižší účinnost SNM u pacientů po nízké resekci pro karcinom rekta s neoadjuvantní radioterapií a po resekcích pro benigní onemocnění ve srovnání se SNM u pacientů bez resekce rekta [26]. I když po resekcích rekta může dojít k poranění koncových vláken pánevních splanchnických parasympatických nervů, které jsou zodpovědné za vnímání distenze rekta i schopnost rozlišit formovanou i řídkou stolici a plyny, má sakrální neuromodulace potenciál korigovat toto neurogenní poškození.
V našem souboru bylo indikováno k SNS 80 % pacientů v šestém a sedmém deceniu. To potvrzuje údaje známých studií zabývajících se epidemiologií fekální inkontinence, že tato funkční porucha postihuje preferenčně starší populaci a zhoršuje se s postupujícím věkem [1−3]. Počet pacientů v nejvyšším 8. deceniu (71–80 let) byl sice malý, jen 4 (11 %), ale zde to lze přisoudit tomu, že jsme si stanovili jako maximální věkovou hranici 75 let. Navíc je poměrně obtížné určit přesně maximální věk pacienta s FI vhodného pro SNS, neboť rozhodování u pacientů v pokročilém věku ovlivňují četné komorbidity i očekávaná délka života, stejně jako i fyzická a duševní aktivita jednotlivých osob.
Komplikace se vztahem k SNS se pohybují v rozmezí 15–35 % [15] a zahrnují komplikace v podkožní kapse s implantovaným neurostimulátorem, komplikace stimulační elektrody, infekci, bolest a snížení nebo úplnou ztrátu účinnosti stimulace. Infekce je udávána v rozmezí 2–8 % [17,27]. V naší sestavě jsme infekci zaznamenali u dvou pacientů (5,7 %). V případě, že konzervativní léčba antibiotiky je neúčinná, doporučuje se explantace elektrody i stimulátoru, resp. jejich transpozice [28]. U jedné ze dvou našich pacientek, u které se vytvořil absces přes cílenou antibiotickou léčbu, jsme totálně excidovali zánětlivé ložisko a neurostimulátor obalený garamycinovou pěnou jsme uložili do původní podkožní kapsy. K tomuto postupu jsme místo transpozice na kontralaterální stranu přistoupili z obavy o zničení elektrody při její extrakci, kde jsme předpokládali v okolí zavedení těžké fibrotické změny, jaké byly i kolem stimulátoru, a také proto, že jsme předpokládali možné problémy při jednání se zdravotní pojišťovnou při žádosti o zaplacení nové elektrody u stejného pacienta. Naštěstí se rána zhojila bez dalších komplikací a bez ztráty účinnosti stimulace. Komplikace elektrody spočívají v dislokaci nebo migraci, zlomení nebo ve ztrátě její izolace postupem času. Prvním krokem pro zjištění malfunkce elektrody je provedení rtg v předozadní a boční projekci ke zjištění, zda je elektroda ještě ve správné poloze v sakrálním foraminu. Dokonce i minimální dislokace do 2 mm může mít dramatický efekt na účinnost stimulace. Pokud naměříme normální impedanci, ale pacient udává ztrátu stimulace či výrazné snížení i při vysokých stimulačních amplitudách, je indikováno operační řešení, kdy je nutno provést transpozici elektrody. Abnormální impedance (menší než 50 ohmů nebo vyšší než 4000 ohmů) naznačuje možnost poškození elektrody. Nízká impedance ukazuje na přerušený elektrický obvod, který vzniká nejpravděpodobněji poškozením izolace. Vysoká impedance vzniká na podkladě zalomení elektrody nebo disrupcí připojení na stimulátor. Dochází ke ztrátě účinnosti stimulace, která může být doprovázena bolestmi. U naší pacientky po pádu na pánev jsme zjistili ostré zalomení drátu a posunutí elektrody více presakrálně a vytvoření jakési smyčky elektrody proximálně. Elektrodu i stimulátor jsme transponovali na kontralaterální stranu s plným obnovením stimulačního efektu. U jedné pacientky došlo po dvou pádech za sebou k postupnému otočení stimulátoru na hranu s tlakem na kůži a bolestmi, bez snížení stimulace. Bylo to zřejmě způsobeno příliš velkou podkožní kapsou a tato komplikace byla korigována reoperací s úpravou stimulátoru do správné polohy a zmenšením prostoru v podkoží s efektem.
V současné době má více než 300 000 pacientů na celém světě implantovaný neurostimulátor pro SNM v léčbě fekální inkontinence, refrakterního hyperaktivního močového měchýře a neobstruktivní močové retence. Životnost baterie u současného systému InterStim II je asi 5–7 let. Zcela nedávno byly představeny v USA a Evropě nové typy stimulátorů, které jsou až o 50 % menší než ty současné, dají se dobíjet a jsou kompatibilní s bezpečným provedením celotělové magnetické rezonance přístroji 1,5 Tesla a 3 Tesla za dodržení stanovených podmínek (Axonics r-SNM System (tm), Irvine, CA). Požadavek na neurostimulátory a elektrody umožňující bezpečnou celotělovou NMR je evidentní, neboť nejméně polovina pacientů s neurostimulátory či pacemakery bude mít pravděpodobně potřebu vyšetření NMR během svého života a v současné době je až 23 % explantací neurostimulátorů z důvodu nutnosti NMR [29]. To můžeme potvrdit i u našich dvou pacientů, kteří si pro progredující vertebrogenní algický syndrom (VAS) doslova vynutili explantaci dobře fungujícího neurostimulátoru. Existují heterogenní skupiny pacientů, u kterých je inkompatibilita s NMR relativní kontraindikací pro SNM, ačkoliv by z ní mohli profitovat, jako jsou pacienti s roztroušenou sklerózou, pacienti s inkontinencí v souvislosti se syndromem cauda equina či po resekci rekta a aktinoterapii [30]. Co se týče neurostimulátorů menších rozměrů a s dobíjecí baterií, mohou být mnohem komfortnější pro hubené pacienty s minimálním množstvím podkožního tuku, když velikost současného systému InterStim II je 14 cm3, zatímco Axonics systému jen 5,5 cm3. Nejnověji je vyvíjena InterStim Micro technologie (2,8 cm3), která redukuje původní velikosti současných stimulátorů až o 80 %. Nicméně pro pacienty s vysokým BMI je výhodnější spíše současná velikost, neboť u menšího stimulátoru u těchto osob hrozí riziko migrace, rotace a porucha funkce. Životnost baterie u dobíjecího systému je až 15 let. To sníží četnost operací při výměně stimulátoru. Na druhou stranu dobíjení je nutné 1–2× týdně, což může být pro pacienty dyskomfortní a může to mít i psychologický dopad s tím, že pacienti si častěji uvědomují svou nemoc. Navíc to může být problémem u starší populace v důsledku zhoršení kognitivních funkcí. Použití novějšího menšího neurostimulátoru s možností dobíjení se tak zdá být vhodnější u pacientů s nízkým BMI, technicky zdatných, s předpokladem rychlejšího vybití baterie při vyšší stimulační amplitudě, pacientů s bolestí a signifikantním rizikem infekce při výměnách stimulátoru, jako je imunosupresivní léčba atd. [31].
Navzdory vysoké efektivitě léčby FI sakrální neuromodulací (stimulací sakrálního nervu) je u části pacientů léčba jen suboptimální nebo selhává. To může být částečně způsobeno nepřesným umístěním stimulační elektrody, a tedy suboptimálním kontaktem elektrody a nervu [16]. Pro přesné umístění elektrody jsou klíčové radiokontrastní značky, užití zakřiveného vodiče (curved stylet), přesné místo vstupu elektrody do sakrálního foramina při horním a mediálním okraji a její posun přes foramen a její umístění za rtg navigace (fluoroskopie) při dosažení adekvátní motorické/senzorické odpověci na stimulaci. V současné době se používají kvadripolární elektrody a při optimální lokalizaci reagují na stimulaci všechny čtyři. Tím je možné dosáhnout nižší stimulační intenzity a prodloužit životnost baterie, získat více stimulačních možností/programů, pokud je více kontaktů elektrody blízko nervu, snížit riziko vedlejších efektů a dosáhnout tak potenciálně lepších výsledků [32]. Na našem pracovišti jsme byli vyškoleni zahraničním expertem v zavádění elektrody na podkladě dostatečné odpovědi/kontrakce svěračů na elektrickou stimulaci. V pozdější době jsme zavádění prováděli i s pomocí rtg, ale ne vždy přesné rtg umístění elektrody v předozadní a boční projekci korelovalo s kontrakcí svěračů zřejmě i na podkladě určitých anatomických deformit, úzkého foramen sacrale dorsale nebo atypickém průběhu sakrálních nervů. V každém případě rtg navigace/fluoroskopie umožní lepší orientaci o přesném umístění elektrody s možností změnit polohu za optické kontroly. Proto byla popsána standardizovaná technika umístění elektrody (Matzel, et al. 2017).
Úspěšnost dlouhodobých výsledků SNM/SNS se hodnotí četností epizod FI a skóre inkontinence, když nejběžněji užívané jsou Cleveland Clinic Incontinence Score 0−20 (Wexner) a St. Mark´s score 0−24 (Vaizey). Kritériem je minimálně 50% snížení epizod FI či 50% snížení skóre inkontinence [33−34]. Další poměrně často užívané skóre jako Fecal Incontinence Severity Index (FISI) udává kromě inkontinence pro plyny, řídkou a formovanou stolici i únik hlenu, což je však pacientem obtížně identifikovatelné, neboť to může hodnotit často jako řídkou stolici a falešně navýšit skóre. Navíc FISI nezohledňuje alteraci životního stylu [35]. Srovnávací studie výše uvedených skórovacích systémů prokázala jako nejvhodnější a nejpřesnější Wexnerovo skóre, které je jednoduché, pacienty snadno pochopitelné a poskytuje úzkou korelaci mezi subjektivním vnímáním příznaků FI pacientem a objektivním měřením [36]. Někteří pacienti však mohou profitovat i z výrazného snížení frekvencí stolic. Jedna naše pacientka měla při dlouhodobém hodnocení 13 epizod FI za týden a skóre inkontinence CCIS 16, což je možno hodnotit jako selhání, nicméně při vysoké frekvenci stolic ještě 50 % stolic udržela na rozdíl od stavu před stimulací, kdy byla inkontinentní ve 100 %. Proto byly elektroda i stimulátor zatím ponechány. Navíc se u této pacientky objevila recidiva prolapsu rekta, která zcela určitě nepříznivě ovlivnila dlouhodobý efekt. Vysoké skóre inkontinence, kde se hodnotí i četnost používání plen/vložek či alterace životního stylu, může být negativně ovlivněno současnou močovou inkontinencí, pro niž pacient nosí inkontinenční pomůcky, zatímco při samostatné FI by je nepotřeboval. To může zvyšovat inkontinenční skóre, jako tomu bylo i u našich 4 pacientů.
ZÁVĚR
Sakrální neuromodulace je efektivní a bezpečná minimálně invazivní metoda léčby fekální inkontinence. U většiny pacientů je pozorován i příznivý dlouhodobý efekt. Úspěšnost SNM spočívá v pečlivém výběru pacientů, technickém provedení i zkušenostech pracoviště. Proto patří do specializovaných center.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Petr Šlauf
Chirurgická klinika 1. LF UK a FN Bulovka
Budínova 67/2
180 81 Praha 8
e-mail: petr.slauf@bulovka.cz
Zdroje
1. Ng KS, Sivakumaran Y, Nassar N, et al. Fecal incontinence: community prevalence and associated factors – a systematic review. Dis Colon Rectum 2015;1194−1209. doi:10.1097/DCR.0000000000000514.
2. Ditah I, Devaki P, Luma HN, et al. Prevalence, trends, and risk factors for fecal incontinence in United States adults 2005–2010. Clin Gastroenterol Hepatol. 2014;12 : 636–643. doi:10.1016/j. cgh.2013.07.020.
3. Nelson R, Furner S, Norton N, et al. Community‐based prevalence of anal incontinence. JAMA J Am Med Assoc. 1995;274 : 559–561. doi:10.1001/ jama.1995.03530070057030.
4. Rao SSC. Diagnosis and management of fecal incontinence. Am J Gastroenterol. 2004;99 : 1585–604. doi:10.1111/j.1572 - 0241.2004.40105.x.
5. Norton C. Behavioral management of fecal incontinence in adults. Gastroenterol. 2004;126:S64–S70. doi:10.1053/j. gastro.2003.10.058.
6. Jarrett MED, Mowatt G, Glazener CMA, et al. Systematic review of sacral nerve stimulation for faecal incontinence and constipation. Br J Surg. 2004;91 : 1559–1569. doi:10.1002/bjs.4796.
7. Wexner SD, Bleier J. Current surgical strategies to treat fecal incontinence. Expert Rev Gastroenterol Hepatol. 2015;9 : 1577 – 1589. doi:10.1586/17474124.2015.1093 417.
8. Thanago E. Neural stimulation for bladder control. Semin Neurol. 1988;8 : 170 – 173. doi:10.1055/s-2008-1041373.
9. Matzel KE, Stadelmaie U, Gall FP, Hohenfellner M. Electrical stimulation of sacral spinal nerves for treatment of faecal incontinence. Lancet 1995;346 : 1124–1127. doi:10.1016/s0140-6736(95)91799-3.
10. Maeda Y, Lundby L, Buntzen S, et al. Outcome of sacral nerve stimulation for fecal incontinence at 5 years. Ann Surg. 2014;259 : 1126–1131. doi:10.1097/ SLA.0b013e31829d3969.
11. Thomas GP, Bradshaw E, Vaizey CJ. A review of sacral nerve stimulation for faecal incontinence following rectal surgery and radiotherapy. Colorectal Dis. 2015;17 : 939–942. doi:10.1111/ codi.13069.
12. Vaizey CJ, Kamm MA, Turner IC, et al. Effects of short term sacral nerve stimulation on anal and rectal function in patients with anal incontinence. Gut 1999;44 : 407–412. doi:10.1136/ gut.44.3.407.
13. Šlauf P, Antoš F, Dytrych P, et al. Stimulace sakrálního nervu v léčbě fekální inkontinence − první zkušenosti v České republice a hodnocení funkčních výsledků. Rozhl Chir. 2011;90 : 674−681.
14. Leo CA, Thomas GP, Bradshaw E, et al. Long-term outcome of sacral nerve stimulation for faecal incontinence. Colorectal Dis. 2020;22 : 2191−2198. doi:10.1111/ codi.15369.
15. Matzel KE, Lux P, Heuer S, et al. Sacral nerve stimulation for faecal incontinence: long‐term outcome. Colorectal Dis. 2009;11 : 636–641. doi:10.1111/ j.1463-1318.2008.01673.x.
16. Altomare DF, Giuratrabocchetta S, Knowles CH, et al. Long‐term outcomes of sacral nerve stimulation for faecal incontinence. Br J Surg. 2015;102 : 407−415. doi:org/10.1002/bjs.9740.
17. Wexner SD, Hull T, Edden Y, et al. Infection rates in a large investigational trial of sacral nerve stimulation for fecal incontinence. J Gastrointest Surg. 2010;14 : 1081–1089. doi:10.1007/ s11605-010-1177-z.
18. Janssen PTJ, Komen N, Melenhorst J, et al. Sacral neuromodulation for faecal incontinence, A review of the central mechanisms of action. Journal of Clinical Gastroenterology 2017;51 : 669−676. doi:10.1016/j.surg.2016.10.038.
19. Gourcerol G, Vitton V, Leroi AM, et al. How sacral nerve stimulation works in patients with faecal incontinence. Colorectal Dis. 2011;13:e203−e211. doi:10.1111/j.1463 - 1318.2011.02623.x.
20. Campanati RG, da Silva RG, Rodrigues FG, et al. Mechanisms of action of sacral neuromodulation for faecal incontinence. EC Gastroenterology and Digestive System 2019;6.8 : 719−724.
21. Maeda Y, O´Connel PR, Lehur PA, et al. Sacral nerve stimulation for faecal incontinence and constipation: A European consensus statement. Colorectal Dis. 2015;17 : 074−087. doi:10.1111/ codi.12905.
22. Pieniowski EHA, Nordenvall, C, Palmer G, et al. Prevalence of low anterior resection syndrom and impact on quality of life after rectal cancer surgery. BJS Open 2020;4 : 935−942. doi:10. 1002/bjs5. 50312.
23. Ramage L, Qiu S, Kontovounisios C, et al. A systematic review of sacral nerve stimulation for low anterior resection syndrome. Colorectal Dis. 2015;17 : 762–771. doi:10.1111/codi.12968.
24. Matzel KE, Bittorf B, Günther K, et al. Rectal resection with low anastomosis: functional outcome. Colorectal Dis. 2003;5 : 458 – 464. doi:10.1046/j.1463-1318.2003.t01 - 1-00503.x.
25. Matzel KE, Stadelmaier U, Muehldorfer S, et al. Continence after colorectal reconstruction following resection: impact of level of anastomosis. Int J Colorectal Dis. 1997;12 : 82–87. doi:10.1007/ s003840050086.
26. Mizrahi I, Chadi SA, Haim N, et al. Sacral neuromodulation for the treatment of faecal incontinence following proctectomy. Colorectal Dis. 2017;19 : 0145-0152. doi:10.1111/codi.13570.
27. Hull T, Giese C, Wexner SD, et al. Longterm durability of sacral nerve stimulation therapy for chronic fecal incontinence. Dis Colon Rectum 2013;56 : 235−245. doi:10.1097/DCR.0b013e318276b24c.
28. Force L, da Silva G. Management of complications of sacral neuromodulation. Seminars in Colon and Rectal Surgery 2017;28 : 173−176. doi:10.1053/j. scrs.2017.07.006.
29. Guzman-Negron JM, Pizzaro-Berdichewsky J, Gill BC, et al. Can lumbosacral magnetic resonance be performed safely in patients with a sacral neuromodulation device ? An in vivo prospective study. J Urol. 2018;200 : 1088−1092. doi:10.1016/j. juro.2018.05.095.
30. Goldman HB, Loyd BC, Noblet KL, et al. International Continence Society best practice statement for use of sacral neuromodulation. Neurourol Urodyn. 2018;37 : 1823−1848. doi:10.1002/ nau.23515.
31. de Wachter S, Knowles CHH, Elterman DS, et al. New technologies and applications in sacral neuromodulation: An update. Advances in Therapy 2020;37 : 637−643. doi:10.1007/s12325-019-01205-z.
32. Matzel KE, Chartier-Kastler E, Knowles CHH, et al. Sacral neuromodulation: standardized elecrode placement technique. Neuromodulation 2017;20 : 816−24. doi:10.1111/ner.12695.
33. Jorge JM, Wexner SD. Etiology and management of fecal incontinence. Dis Colon Rectum. 1993;36 : 77–97. doi: 10.1007/ BF02050307.
34. Vaizey CJ, Carapeti E, Cahill JA, et al. Prospective comparison of faecal incontinence grading systems. Gut. 1999;44 : 77 – 80. doi:10.1136/gut.44.1.77.
35. Rockwood TH, Church JM, Fleshman JW, et al. Patient and surgeon ranking of the severity of symptoms associated with fecal incontinence: the fecal incontinence severity index. Dis Colon Rectum 1999;42 : 1525−1532. doi:10.1007/BF02236199.
36. Seong MK, Jung SI, Kim TW, et al. Comparative analyses of summary scoring systems in measuring fecal incontinence. J Korean Surg Soc. 2011;81 : 326−331. doi:10.4174/jkss.2011.81.5.326.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2021 Číslo 10- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Stárnutí populace z pohledu chirurga
- Rozsev peritoneálních malignit − reoperace po cytoreduktivní chirurgii + HIPEC
- Sakrální neuromodulace v léčbě fekální inkontinence – 10leté zkušenosti a dlouhodobé výsledky specializovaného centra
- Je vysoký věk kontraindikací plicní resekce?
- Peritoneální karcinomatóza (PK) kolorektálního původu a její léčba cytoreduktivní chirurgií (CRS) a intraperitoneální peroperační chemoterapií (HIPEC) na pracovišti FN Bulovka
- Delirantní stavy na chirurgické JIP – kazuistika
- Postpneumonektomický MRSA empyém řešený podtlakovou terapií – kazuistika a přehled literatury
- Bronchogenní cysta kardie – kazuistika a přehled literatury
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Sakrální neuromodulace v léčbě fekální inkontinence – 10leté zkušenosti a dlouhodobé výsledky specializovaného centra
- Bronchogenní cysta kardie – kazuistika a přehled literatury
- Delirantní stavy na chirurgické JIP – kazuistika
- Rozsev peritoneálních malignit − reoperace po cytoreduktivní chirurgii + HIPEC
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



