-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Postpneumonektomický MRSA empyém řešený podtlakovou terapií – kazuistika a přehled literatury
Postpneumonectomy MRSA empyema treated with vacuum therapy – case report and literature review
Introduction: Postpneumonectomy empyema is one of serious complications with high mortality and lethality. In this paper, the authors describe the treatment of methicillin-resistant Staphylococcus aureus-induced postpneumonectomy empyema by vacuum therapy in a patient operated on for malignant pleural mesothelioma.
Case report: A 64-year-old patient was operated on at our clinic for epithelioid mesothelioma of the right pleural cavity. We performed extrapleural pneumonectomy with intraoperative hyperthermic intrathoracic chemotherapy. Seven weeks after surgery the patient was readmitted for right pleural cavity empyema caused by methicillin-resistant Staphylococcus aureus (MRSA). Following pleural cavity debridement and mesh explantation we applied vacuum therapy. In total, we performed 4 dressing changes with final application of an antibiotic solution into the pleural cavity and wound closure. The patient showed no evidence of recurrent empyema during subsequent 12-month follow-up and underwent chemotherapy.
Conclusion: Vacuum therapy is an effective treatment of postpneumonectomy empyema in patients without a bronchopleural fistula; nevertheless, specific postpneumonectomy patient care is required.
Keywords:
vacuum therapy – Methicillin-resistant Staphylococcus aureus – malignant pleural mesothelioma – pneumonectomy – empyema
Autoři: P. Horák; K. Jágrová; J. Fulík; A. Erbenová; J. Fanta
Působiště autorů: Chirurgická klinika 1. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Bulovka, Praha
Vyšlo v časopise: Rozhl. Chir., 2021, roč. 100, č. 10, s. 502-506.
Kategorie: Kazuistika
doi: https://doi.org/10.33699/PIS.2021.100.10.502–506Souhrn
Úvod: Postpneumonektomický empyém patří k závažným komplikacím s vysokou morbiditou a letalitou. V tomto sdělení autoři popisují řešení postpneumonektomického empyému vyvolaného methicilin rezistentním Staphylococcus aureus pomocí podtlakové terapie u nemocného operovaného pro maligní pleurální mezoteliom.
Kazuistika: 64letý pacient byl na našem pracovišti operován pro epiteloidní mezoteliom pravé pleurální dutiny. Provedli jsme extrapleurální pneumonektomii s peroperační hypertermickou nitrohrudní chemoterapií. 7 týdnů po operaci byl pacient rehospitalizován pro empyém pravé pleurální dutiny s průkazem methicilin rezistentního Staphylococcus aureus. Po debridementu pleurální dutiny a explantaci sítěk jsme aplikovali podtlakovou terapii. Celkově jsme provedli 4 převazy se závěrečnou aplikací roztoku antibiotik k vyplnění pleurální dutiny a uzávěrem rány. V následujících 12 měsících byl nemocný bez známek recidivy empyému a podstoupil chemoterapii.
Závěr: Podtlaková terapie je účinným způsobem léčby postpneumonektomického empyému u pacientů bez bronchopleurální píštěle. Je však třeba dodržet specifika péče o pacienty po pneumonektomii.
Klíčová slova:
podtlaková terapie – maligní pleurální mezoteliom – pneumonektomie – empyém – methicilin rezistentní Staphylococcus aureus
ÚVOD
Cílem naší práce je přinést sdělení o řešení postpneumonektomického empyému pomocí podtlakové terapie formou kazuistiky a přehledu literatury. Případ je specifický tím, že se jednalo o nemocného, který podstoupil operační léčbu pro maligní pleurální mezoteliom včetně hypertermické intraoperační chemoterapie.
KAZUISTIKA
64letý muž, 3 týdny po operaci na jiném pracovišti, se dostavil ke konzultaci ohledně dalších léčebných možností. Operační revize, kterou nedávno podstoupil, byla původně indikována pro suspektní empyém pravé pleurální dutiny. Proto byla provedena torakotomie a dekortikace pravé plíce. Ve vzorcích odeslaných k histologickému vyšetření však byl nalezen bifázický mezoteliom pleury. Kultivační nález neprokázal bakteriální infekci. Při prvním vyšetření na našem pracovišti byl pacient klinicky bez větších obtíží kromě běžné pooperační bolesti. Nemocný byl léčen pro arteriální hypertenzi, hyperlipidemii, sníženou koncentrační schopnost ledvin při jejich cystickém onemocnění. Provedli jsme staging onemocnění. Jednalo se o onemocnění lokalizované v pravé pleurální dutině s uzly na pleuře vpravo i v interlobiu, bez ložiskových změn v plicním parenchymu a bez patrné lymfadenopatie (stadium I). Z funkčního hlediska byla únosná pravostranná pneumonektomie.
27. 11. 2019 jsme provedli pravostrannou extrapleurální pneumonektomii s resekcí části perikardu a bránice a systematickou mediastinální lymfadenektomii. Menší výkon ve smyslu dekortikace/pleurektomie se nám s ohledem na masivní postižení viscerální pleury a prorůstání tumoru do plicní tkáně nezdál proveditelný. Do defektů v perikardu a bránici jsme implantovali nesmáčivé nevstřebatelné síťky. Na závěr výkonu byla provedena hypertermická intratorakální chemoterapie (HITHOC) lavážním roztokem s 300 mg cisplatiny o teplotě 42 °C po dobu 60 minut. Pooperační průběh byl kromě paroxysmu fibrilace síní bez komplikací. Nemocný byl dimitován 7. pooperační den. Dle výsledku histologického vyšetření vzhled a imunoprofil tumoru svědčily pro diagnózu epiteloidního maligního mezoteliomu s desmoplazií stromatu. Všechny vyšetřené lymfatické uzliny byly bez nádorových struktur.
Nemocný byl 7 týdnů po operaci hospitalizován pro flegmónu hrudní stěny. Provedené CT hrudníku ukázalo dutinu po pneumonektomii vyplněnou tekutinou s bublinami plynu. V místě torakotomie byla komunikace hrudní dutiny s mezisvalovým prostorem, kde se nacházela další tekutinová kolekce, v okolí kolekce pak prosáknutí podkoží. Provedli jsme nejprve punkci výpotku a následně zavedli hrudní drén a evakuovali hnisavý výpotek. Byl vykultivován methicilin rezistentní Staphylococcus aureus (MRSA).
Bronchoskopicky jsme neprokázali bronchopleurální píštěl. Upravili jsme antibiotickou terapii na kombinaci linezolid + klindamycin, hrudní dutinu jsme vyplachovali 2x denně ředěným roztokem povidonjodu. Po uvedené terapii došlo k poklesu zánětlivých parametrů a zlepšení celkového stavu, avšak přetrvával kultivační nález MRSA v tekutině odváděné drénem.
Proto jsme přistoupili 31. 1. 2020 k revizi dutiny po pneumonektomii. Nalezli jsme malé množství výpotku a fibrinové nálety. Síťky byly uvolněné, neadherovaly ke spodině, proto jsme je explantovali. Plochy, které měly síťky zakrývat, byly vygranulované a v perikardu ani bránici nebyly defekty. Zkouškou pod vodní hladinou jsme vyloučili bronchopleurální píštěl. Po nekrektomii a laváži antiseptickými roztoky s účinností na MRSA jsme aplikovali garamycinovou pěnu (Garamycin Schwamm 130 mg) (Obr. 1) k ochránění pahýlů cév a bronchu a dutinu jsme vyplnili po stěnách polyuretanovou houbou a plombáží rouškami s ředěným povidonjodem (Obr. 2). Plombáž rouškami má za úkol zabránit přesunu mediastina. Do torakotomie a do kanálu po drénu jsme vložili další pěnu. Rána byla překryta fólií a napojena na podtlak -15 cm H2O (Obr. 3).
Obr. 1. Překrytí pahýlů cév a bronchu garamycinovou pěnou.
Fig. 1: Blood vessel and bronchial stumps covered with garamycin foam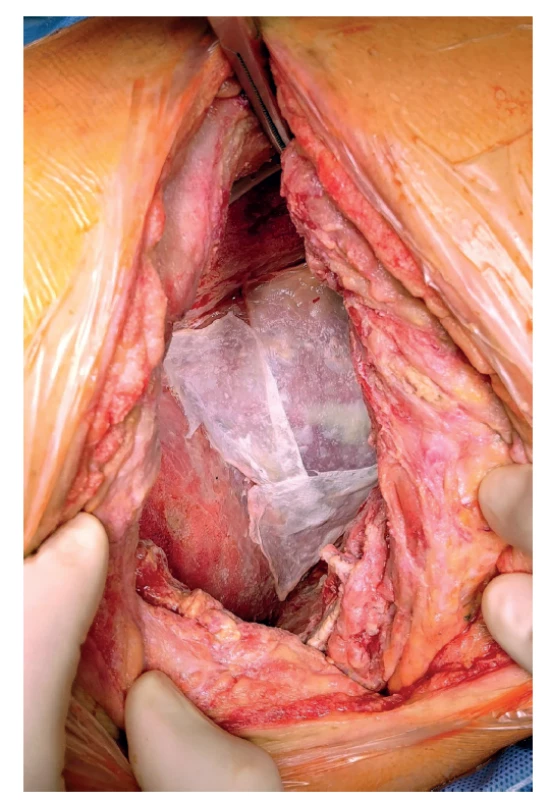
Obr. 2. Vyplnění pleurální dutiny polyuretanovou houbou po stěnách a plombáží rouškami uprostřed.
Fig. 2: Pleural cavity filled with polyurethane sponge along the walls and surgical drapes in the middle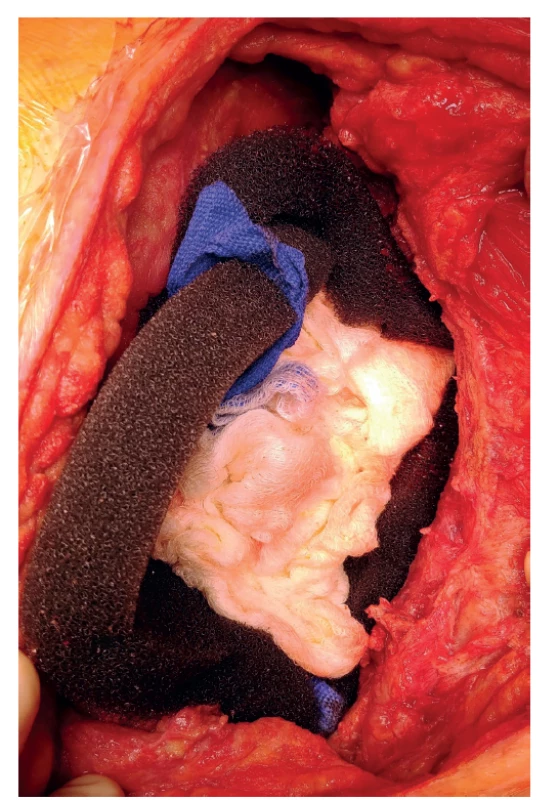
Obr. 3. Systém po dokončení převazu a napojení podtlaku.
Fig. 3: Dressing system and vacuum therapy administration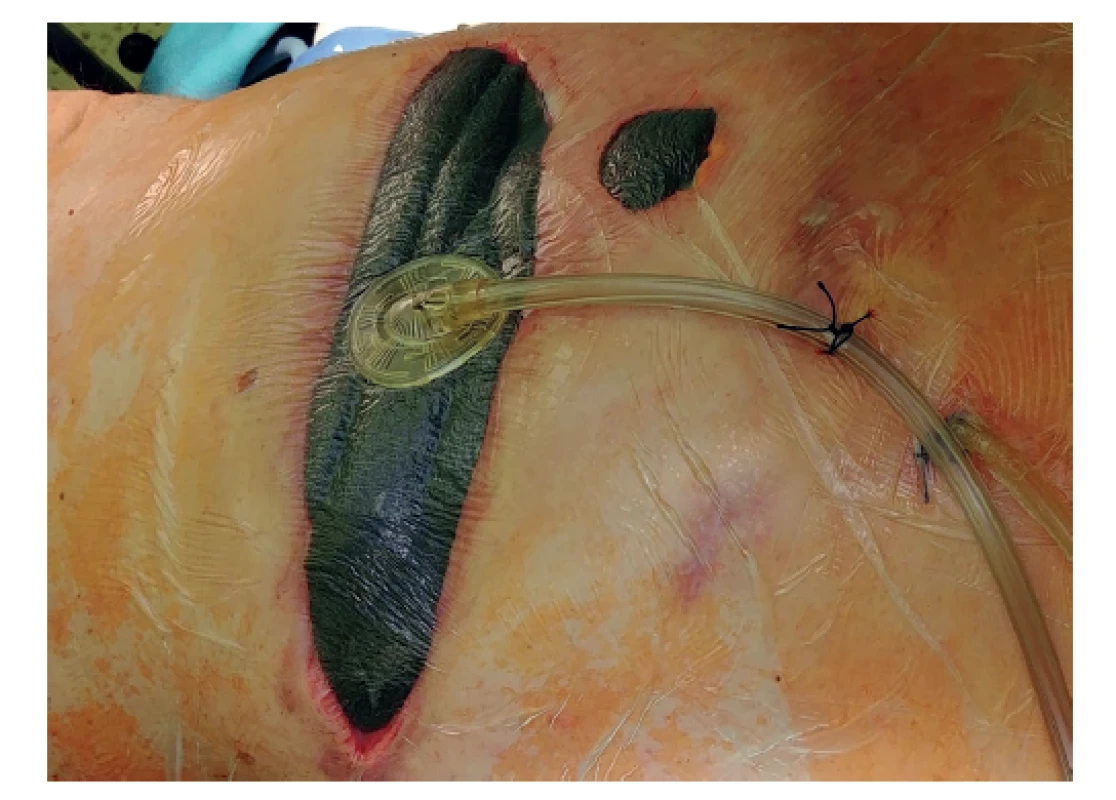
Posléze byl celý systém 2x vyměněn (4. 2. a 2. 4. 2020) a nakonec 7. 2. 2020 extrahován. Součástí výkonu byl vždy debridement zbytkových nekróz (Obr. 4). Do dutiny po pneumonektomii bylo při poslední operaci aplikováno 1,5 litru antibiotického roztoku dle kultivace a citlivosti (1 g vankomycinu a 80 mg gentamicinu na 1 litr fyziologického roztoku) a dutina uzavřena. Pacient byl nadále bez obtíží, s občasným užitím analgetika. Rána se zhojila bez komplikací.
Obr. 4. Stav stěn pleurální dutiny při převazu 4. 2. 2020.
Fig. 4: Condition of pleural cavity walls during dressing change on February 4, 2020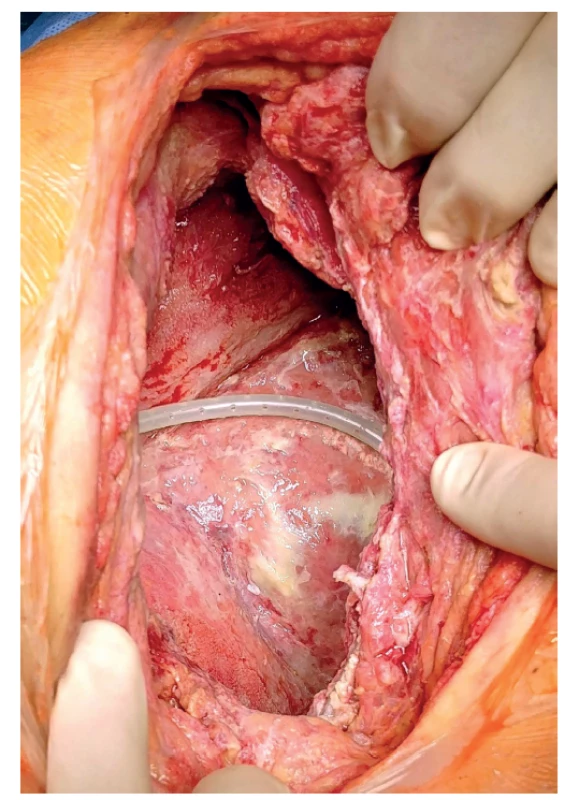
Kontrolní skiagram hrudníku 3 týdny po operaci odpovídal provedenému operačnímu výkonu.
Pacient byl předán do péče spádové onkologie. Absolvoval 6 sérií paliativní chemoterapie cDDP/Pemetrexed. S odstupem 1 roku od primární operace je v dobrém celkovém stavu, performance status 1. Dle CT došlo k progresi onemocnění a je suspekce na tumorózní postižení hrudní stěny a retroperitonea (stadium IV). Od února 2021 je podávána další chemoterapie.
DISKUZE
Pooperační empyém pleurální dutiny vzniká po pneumonektomiích ve 2−12 % [1]. Zatímco mortalita po pneumonektomii je udávána kolem 7 %, v případě výskytu postpneumonektomického empyému stoupá na 25 % a nejvyšších hodnot (až 40 %) dosahuje u pacientů s brochopleurální píštělí [2,3]. Výskyt empyému po pneumonektomii a HITHOC v literatuře dosud nebyl uveden.
K rozvoji empyému přispívají jak systémové faktory, např. anemie, diabetes mellitus, pooperační respirační insuficience s nutností umělé plicní ventilace, tak faktory lokální, a to především bronchopleurální píštěl.
Po pneumonektomii vzniká bronchopleurální píštěl v 1−6,6 %, častěji vpravo [3]. Časné píštěle vznikající nejčastěji v prvních dvou týdnech po operaci jsou nejčastěji způsobeny operační chybou, ponecháním dlouhého pahýlu bronchu, nadměrnou preparací a tím devaskularizací ponechaného bronchiálního pahýlu, případně selháním sutury včetně staplerové. Pozdní píštěle mohou vzniknout na podkladě lokální recidivy tumoru či následkem chemoterapie a radioterapie. Dle literatury je pooperační empyém doprovázen bronchopleurální píštělí ve 30 až 80 % případů [2].
U pacientů s postpneumonektomickým empyémem bez píštěle stoupá riziko vytvoření píštěle s délkou trvání empyému [4].
Nejčastějšími bakteriologickými nálezy u postpneumonického empyému jsou Staphylococcus aureus a Pseudomonas aeruginosa [5]. Výskyt MRSA je v literatuře popsán u pooperačních empyémů sporadicky.
U našeho pacienta jsme jasnou příčinu empyému nezjistili. Bronchopleurální píštěl jsme opakovaně neprokázali. Zdali se jednalo primárně o infekt v ráně, o infekci na síťkách či např. infikovaný hematom, jsme nezjistili. Známý kontakt s MRSA neměl. Na druhou stranu prodělal 2 hospitalizace v různých zdravotnických zařízeních, měl antibiotickou léčbu a intrapleurální chemoterapii. Jistě u něj tedy bylo riziko vzniku empyému vyšší.
Obecné principy řešení pooperačního empyému hrudní dutiny jsou shodné s principy léčby abscesového ložiska. Základem je důsledný debridement dutiny, dlouhodobá léčba širokospektrými antibiotiky, aktivní vyhledávání a ošetření případné bronchopleurální píštěle. Pacient s bronchopleurální píštělí je ohrožen aspirací do kontralaterální plíce, sepsí a respirační insuficiencí [2,5]. Pokud se objeví typické klinické příznaky postresekčního empyému – zhoršení celkového stavu, febrilie, případně známky bronchopleurální píštěle (charakteristické je vykašlání většího množství tekutiny s poklesem hladiny tekutiny ve zbytkové dutině na skiagramu hrudníku), doprovázené vzestupem zánětlivých parametrů a charakteristickými nálezy na skiagramu hrudníku a CT, je nutno provést diagnostickou punkci k získání vzorku na mikrobiologické vyšetření, případně rovnou drenáž pleurální dutiny.
Drénujeme silnými drény. Doporučovány jsou drény s minimálním průměrem 36 F. Pokud nelze zavést drén retrahovaným mezižebřím, doporučuje se resekce malé části přilehlého žebra. Na našem pracovišti jsme tento postup museli použít zcela ojediněle. V případech, kdy není jasná poloha bránice, je vhodná CT či sonografická navigace.
U případů bez bronchopleurální píštěle je vhodná lokální aplikace fyziologického roztoku s povidonjodem 2y denně nebo kontinuální proplach. Pokud se během proplachu objeví dráždivý kašel, objevila se téměř jistě bronchopleurální píštěl a proplach je nutno okamžitě zastavit.
Klasickým přístupem při selhání drenáže je založení pleurostomie při dolním okraji zbytkové dutiny, sanace pleurální dutiny a lokální aplikace antiseptik. U pacientů, kteří jsou ve špatném biologickém stavu, je pleurostomie trvalým řešením. U ostatních, zvláště u pacientů s bronchopleurální píštělí, lze postupovat tak, že po sanaci pleurální dutiny vyplníme zbytkovou dutinu transpozicí svalových laloků, omentem či kombinací obou metod. Literární zdroje uvádějí úspěšnost této metody 80–85 % [2,3].
Bronchopleurální píštěl po pneumonektomii často nelze vyřešit reoperací se zkrácením pahýlu bronchu či suturou píštěle. Malé píštěle se lze pokusit vyřešit endoskopicky s aplikací tkáňového lepidla a/nebo zavedením stentu [6,7,8].
Pro pacienty bez bronchopleurální píštěle je další možností sanace zbytkové dutiny dle Clageta. Opakované převazy dutiny s antiseptiky vedou k vygranulování dutiny, do které je při závěrečné proceduře aplikován roztok s neomycinem a dutina je uzavřena. Dle literatury má i tato metoda vysokou, 84 % úspěšnost [2,3]. V našem případě jsme použili modifikaci roztoku s antibiotiky dle aktuálního mikrobiologického nálezu a po dohodě s mikrobiology a klinickým farmaceutem.
Modifikací této metody je využití podtlakové terapie k sanaci infekce v pleurální dutině. Podtlaková terapie redukuje množství extracelulární tekutiny, zvyšuje vaskularizaci tkání a tím také oxygenaci, což hraje úlohu v likvidaci anaerobní infekce a urychluje uzávěr rány. V hrudní chirurgii a kardiochirurgii je často využívána k sanaci osteomyelitidy sterna včetně poradiačních nekrotických komplikací [3,9].
Technické provedení podtlakové terapie po pneumonektomii se v literárních pramenech liší.
Po založení pleurostomie či po retorakotomii a debridementu pleurální dutiny je vkládána pěna. Někteří autoři doporučují vyplnit empyémovou dutinu kompletně pěnou podtlakového systému. Vkládání jiného materiálu mezi pěnu a hrudní stěnu snižuje dle zkušeností některých autorů efektivitu celé metody [10,11,12]. Jiní doporučují vložit na stěny pleurální dutiny pěnu a dutinu vyplnit rouškami či podobným materiálem tak, aby nedošlo k nepřiměřenému podtlaku na mediastinum [13]. My jsme s ohledem na první případ, který jsme takto léčili, postupovali tímto způsobem, tedy vložením plombáže do dutiny. A to i s vědomím skutečnosti, že mediastinum by mělo být 2 týdny po pneumonektomii již fixováno. K ochraně pahýlů cév a bronchu se doporučuje vložení gázy mezi pěnu a zmíněné struktury. My jsme použili garamycinovou pěnu (Garamycin Schwamm 130 mg), která by měla být účinná i na MRSA infekci.
Použitá výše podtlaku také není v jednotlivých pracích jednotná. V literatuře jsou udávány výšky použitého podtlaku od 15 cm H2O až po použité rozmezí 110 – 190 cm H2O [4,9]. Podtlak lze také kombinovat s instilací antiseptického roztoku [9,13]. My jsme zvolili nízký podtlak a pozorovali jsme výtečnou tendenci k čištění tkáně a tvorbě granulací.
Délka léčby empyému podtlakovou terapií trvá dle literárních údajů 1−4 týdny. Četnost převazů je 1−3x týdně. Některá pracoviště provádějí převazy v celkové anestezii, jiná po úvodním ošetření v celkové anestezii provádějí další převazy už jen v analgosedaci [11,12].
Rozdíl je i v přístupu k hospitalizaci. Některá pracoviště pacienty léčené podtlakovou terapií dimitují až po definitivním sekundárním uzávěru rány. Převazy probíhají každé 2–5 dní. Jiní volí ambulantní postup s výměnou systému po 7−10 dnech [5,14]. Před uzávěrem rány je aplikován roztok s antibiotiky dle kultivačních nálezů. Rána je uzavřena po vrstvách, bez drénu. My jsme složení roztoku konzultovali s antibiotickým střediskem a klinickým farmaceutem.
Většina autorů udává nekomplikovaný průběh. Mezi ojediněle dokumentované komplikace patří bolest, u jednoho pacienta s insuficientním uzávěrem bronchopleurální píštěle došlo k hypotenzi a hemodynamické nestabilitě s nutností extrakce podtlakového systému [10]. Další ojedinělou komplikací byl vznik srdeční arytmie [5]. U našeho pacienta jsme komplikace spojené s podtlakovou terapií nepozorovali.
Nevýhodou metody je fakt, že ponechaná zbytková dutina je ohrožena recidivou empyému více než dutina vyplněná svalem a/nebo omentem.
ZÁVĚR
Postpneumonektomický empyém je obávanou komplikací v hrudní chirurgii. Často je provázen bronchopleurální píštělí. Podtlaková terapie je účinnou a bezpečnou metodou ke zvládnutí pooperačního pleurálního empyému u pacientů bez bronchopleurální píštěle. Komplikace metody jsou minimální. Metodika není s ohledem na malé množství případů jednotná a jistě se bude dále vyvíjet s narůstajícími zkušenostmi chirurgů a vývojem systémů podtlakové terapie.
Seznam zkratek:
HITHOC – hypertermická intratorakální chemoterapie
MRSA – methicilin rezistentní Staphylococcus aureus
CT – výpočetní tomografie
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Pavel Horák
Příčná 189
250 83 Škvorec
e-mail: pavel.horak@bulovka.cz
Zdroje
1. Miller Jr. JI. Postsurgical empyema. In: Shields TW, Locicero J, Ponn RB, et al. General thoracic surgery. 6. ed. vol. 2. Lippincott, Williams & Wilkins 2000 : 833−839.
2. Stolz A, Pafko P. Postpneumonický empyém a bronchopleurální píštěl In: Komplikace v hrudní chirurgii 1. vydání. Praha, Grada Publishing, a.s. 2010 : 191–202.
3. Deschamps C, Pairolero PC, Allen MS, et al. Management of postpneumonectomy empyema and bronchopleural fistula. Chest Surg Clin N Am. 1996 Aug;6(3):519−327.
4. Celik A, Yekeler E, Aydin E, et al. Treatment of persistent postpneumonectomy empyema by vacuum-assisted management: An analysis of nine patients. Thorac Cardiovasc Surg. 2013 Oct;61(7):631−635. doi: 10.1055/s-0032-1331263.
5. Al Muffarej F, Margolis M, Tempesta B, et al. Outpatient management of post-pneumonectomy and post-lobectomy empyema using the vacuum-assisted closure system. Surgery Today 2010 Aug;40(8):711−718. doi: 10.1007/s00595 - 008-4096-9.
6. Han X, Yin M, Li L, et al. Customized airway stenting for bronchopleural fistula after pulmonary resection by interventional technique: single center study of 148 consecutive patients. Surgical Endoscopy 2018;32 : 4116−4124. https:// doi.org/10.1007/s00464-018-6152-x.
7. Chawla RK, Madan A, Bhardwaj PK, et al. Bronchoscopic management of bronchopleural fistula with intrabronchial instillation of glue (N-butyl cyanoacrylate). Lung India 2012 Jan - Mar;29(1):11–14.doi: 10.4103/0970 - 2113.92350.
8. Battistoni P, Caterino U, Batzella S, et al. The use of polyvinyl alcohol sponge and cyanoacrylate glue in the treatment of large and chronic bronchopleural fistulae following lung cancer resection. Respiration 2017;94 : 58−61. doi: 10.1159/000477350.
9. Schreiner W, Oster O, Stapel P, et al. V.A.C.-INSTILL-Therapie – Neue Wege in der septichsen Thoraxchirurgie. Zentrallblatt für Chirurgie 2013 Feb;138(1):117−120. doi: 10.1055/s - 0032-1315201.
10. Rocco G, Cecere C, La Rocca A, et al. Caveats in using vacuum-assisted closure for post-pneumonectomy empyema. European Journal of Cardio-Thoracic Surgery 2012 May;41(5):1069−1071. doi: 10.1093/ ejcts/ezr196.
11. Laperuta P, Napolitano F, Vatrella A, et al. Post-pneumonectomy broncho-pleural fistula successfully closed by open-window thoracostomy associated with V.A.C. therapy. International Journal of Surgery 2014; 12 Suppl 2:S17−S19. doi: 10.1016/j. ijsu.2014.08.390.
12. Kim AW. Delayed gratification is better than no gratification. The Journal of Thoracic and Cardiovascular Surgery 2015 Mar;149(3):751. doi: 10.1016/j. jtcvs.2014.11.065.
13. Schneiter D, Weder W. Accelerated treatment of post-pneumonectomy empyema. In: Kuzdzal J, Asamura H, Detterbeck F, et al. ESTS Textbook of thoracic surgery. Cracow, Medycyna Praktyczna 2014 : 271−275.
14. Karapiner K, Saydam Ö, Metin M, et al. Experience with vacuum-assisted closure in the management of postpneumonectomy empyema: An analysis of eight cases. Thorac Cardiovasc Surg. 2016 Apr;64(3):258−262. doi: 10.1055/s-0034 - 1390505.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2021 Číslo 10- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Stárnutí populace z pohledu chirurga
- Rozsev peritoneálních malignit − reoperace po cytoreduktivní chirurgii + HIPEC
- Sakrální neuromodulace v léčbě fekální inkontinence – 10leté zkušenosti a dlouhodobé výsledky specializovaného centra
- Je vysoký věk kontraindikací plicní resekce?
- Peritoneální karcinomatóza (PK) kolorektálního původu a její léčba cytoreduktivní chirurgií (CRS) a intraperitoneální peroperační chemoterapií (HIPEC) na pracovišti FN Bulovka
- Delirantní stavy na chirurgické JIP – kazuistika
- Postpneumonektomický MRSA empyém řešený podtlakovou terapií – kazuistika a přehled literatury
- Bronchogenní cysta kardie – kazuistika a přehled literatury
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Sakrální neuromodulace v léčbě fekální inkontinence – 10leté zkušenosti a dlouhodobé výsledky specializovaného centra
- Bronchogenní cysta kardie – kazuistika a přehled literatury
- Delirantní stavy na chirurgické JIP – kazuistika
- Rozsev peritoneálních malignit − reoperace po cytoreduktivní chirurgii + HIPEC
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



