-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPeritoneální karcinomatóza (PK) kolorektálního původu a její léčba cytoreduktivní chirurgií (CRS) a intraperitoneální peroperační chemoterapií (HIPEC) na pracovišti FN Bulovka
Peritoneal carcinomatosis of colorectal origin treated by cytoreductive surgery and hyperthermic intraoperative peritoneal chemotherapy at the Bulovka University Hospital
Introduction: Peritoneal carcinomatosis (PK) of colorectal origin is a malignant tumour of the peritoneum caused by spreading of colorectal carcinoma (KRK) over the peritoneal surface of the abdominal cavity and its organs. PK occurs as a synchronous tumour in 15−20% of patients, and as metachronous disease in 25−50% of patients.
Methods: A group of 66 patients operated on for PK was retrospectively evaluated; 18 patients were excluded due to insufficient data. We evaluated 48 patients in total (22 men and 26 women) with mean age of 58 and 53 years, respectively; 12 patients (25%) were aged over 65 years. The patients were operated on between 2000 and 2019 using the Sugarbaker´s method of maximal cytoreduction (CRS) + HIPEC (Hyperthermic Intraoperative Peritoneal Chemotherapy). We evaluated the length, median survival, the incidence of complications and lethality in relation to the Peritoneal Carcinoma Index (PCI) and the Completeness of Cytoreduction (CC) score. The patients were divided into two subgroups according to the PCI score (0−12 and >12, respectively) and the CC score (CC 0−1 and CC 2−3, respectively).
Results: The mean survival was 26.3 months in the group with PCI up to 12 and 21.4 months in patients with PCI above 12 (p=0.02). In the group with CC 0−1 the mean survival was 27.1 months, while in the patients with the CC 2−3 it reached 12.6 months (p=0.06). The morbidity rate requiring an intervention was 18.7% and the lethality rate was 6.25% in the entire group. The median survival of the entire group was 22 months (13−34 months).
Conclusion: Literary references and our results are comparable, confirming the high efficiency of this method both in our country and worldwide. The use of CRS and HIPEC, associated with acceptable mortality and morbidity in selected patients with PK of colorectal origin, results in a significant extension of overall survival (OS).
Keywords:
peritoneal carcinomatosis − peritoneal carcinoma index − cytoreductive surgery − hyperthermic intraperitoneal chemotherapy − HIPEC
Autoři: P. Bartoška 1; F. Antoš 1; R. Vobořil 1; P. Vítek 2; J. Marx 1; P. Holečková 3; M. Novotný 1; M. Kengbaeva 1
Působiště autorů: Chirurgická klinika 1. lékařské fakulty Univerzity Karlovy a Nemocnice Na Bulovce, Praha, subkatedra koloproktologie IPVZ Praha 1; Proton Therapy Center Czech, Praha 2; Ústav radiační onkologie, Nemocnice Na Bulovce a 1. lékařské fakulty Univerzity Karlovy, Praha 3
Vyšlo v časopise: Rozhl. Chir., 2021, roč. 100, č. 10, s. 490-496.
Kategorie: Původní práce
doi: https://doi.org/10.33699/PIS.2021.100.10.490–496Souhrn
Úvod: Peritoneální karcinomatóza (PK) kolorektálního původu je maligní nádorové postižení pobřišnice způsobené šířením kolorektálního karcinomu (KRK) po peritoneálním povrchu dutiny břišní a jeho orgánech. Vyskytuje se u 5−20 % pacientů synchronně, dalších 20−50 % pacientů metachronně.
Metody: Retrospektivně byla hodnocena skupina 66 pacientů, 18 bylo z důvodu neúplné dokumentace vyřazeno. Hodnotili jsme celkem 48 pacientů (22 mužů a 26 žen) průměrného věku 58, resp. 53 let, 12 pacientů (25 %) bylo ve věku nad 65 let. Pacienti byli operováni v letech 2000 až 2019 Sugarbakerovou metodou maximální cytoredukce (CRS) + HIPEC (Hyperthermic Intraoperative Peritoneal Chemotherapy). V souboru jsme hodnotili délku, medián přežití, výskyt komplikací a letalitu ve vztahu k PCI (Peritoneal Carcinoma Index) a CC skóre (Completness Cytoreductive Score). Operovaní byli rozděleni do dvou skupin dle PCI skóre (0−12, resp. >12) a dle CC skóre (CCO-1, resp. CC2-3).
Výsledky: Ve skupině operovaných s PCI do 12 bylo průměrné přežití 26,3 měsíce, u pacientů s PCI skóre nad 12 jen 21,4 měsíce (p=0,002). U pacientů rozdělených podle kompletnosti provedené cytoreduktivní chirurgie jsme zaznamenali ve skupině s CC0-CC1 průměrné přežití 27,1 měsíce, skupina s CC2-CC3 měla průměrné přežití 12,6 měsíce (p=0,06). Morbidita vyžadující intervenci v celém souboru činila 18,7 %, letalita pak 6,25 %. Medián přežití v celé skupině operovaných byl 22 měsíců (13−34).
Závěr: Literární a naše výsledky jsou srovnatelné, potvrzují efektivitu této metody u nás i ve světě. Užití metody CRS a HIPEC s akceptabilní mortalitou i morbiditou u vybraných pacientů s PK kolorektálního původu významně prodlužuje OS.
Klíčová slova:
peritoneální karcinomatóza − peritoneal carcinoma index − cytoreduktivní chirurgie − hypertermická intraperitoneální chemoterapie − HIPEC
ÚVOD
Peritoneální karcinomatóza (PK) kolorektálního původu je maligní nádorové postižení pobřišnice, způsobené šířením kolorektálního karcinomu (KRK) po peritoneálním povrchu dutiny břišní a jeho orgánech, které je charakterizované různým stupněm postižení, od drobného miliárního rozsevu až po tvorbu velkých nádorových hmot.
Příčinou vzniku tohoto onemocnění je pokročilý agresivní kolorektální, často hlenotvorný karcinom tlustého střeva a konečníku.
Peritoneální karcinomatóza (PK) se vyskytuje u 5−20 % pacientů synchronně, u dalších 20−50 % pacientů se pak vyvíjí metachronně [1−3].
Metoda CRS a HIPEC v léčbě PK kolorektálního původu ukázala ve srovnání se samotnou systémovou chemoterapií zlepšení celkového přežití (OS) z 10−12 měsíců na 33−45 měsíců [4−6].
Rozsah postižení peritonea se obvykle určuje pomocí PCI skórovacího systému (Peritoneal Carcinoma Index), objevují se i další možnosti – Peritoneal Surface Disease Severity Score (PSDSS) [7] nebo Colorectal Peritoneal Metastases Prognostic Surgical Score (COMPASS) [8].
Diagnostika spočívá ve stanovení charakteru nádoru a předoperačního PCI pomocí zobrazovacích metod, zejména pak CT. Klinický obraz je různý v závislosti na rozsahu onemocnění. Drobné postižení obvykle vyvolává jen nevýrazný břišní diskomfort, pro masivní nález svědčí poruchy pasáže, hmatné tumorózní masy a ascites.
METODY
Retrospektivně jsme hodnotili skupinu 66 operovaných pacientů s PK peritonea kolorektálního původu, z nichž muselo být 18 vyřazeno z důvodu neúplné, nedostatečné dokumentace. Hodnocená skupina 48 pacientů, 22 mužů a 26 žen, byla průměrného věku u mužů 58 let, u žen 53 let. U našich nemocných operovaných v letech 2000 až 2019 jsme hodnotili délku a medián přežití, výskyt komplikací dle Clavien-Dindo klasifikace, letalitu ve vztahu k PCI a CC skóre.
V léčení peritoneální karcinomatózy kolorektálního původu bylo použito Sugarbakerovy metody maximální cytoredukce (CRS) + HIPEC (Hyperthermic Intraoperative Peritoneal Chemotherapy) [7]. Lavážní roztok aplikovaný peroperačně obsahoval Oxaliplatinu v dávce 400 mg. Vlastní HIPEC probíhal po dobu 60 min. pomocí lavážního přístroje firmy Skala, který udržoval po celou dobu laváže teplotu roztoku 41−42°C. Množství, koncentraci, složení, teplotu lavážního roztoku a dobu laváže určuje klinický onkolog. Střevní anastomózy, ev. i stomie konstruujeme až po provedení HIPEC.
Všichni pacienti indikovaní k chirurgické intervenci byli posouzeni multidisciplinárním týmem – MDT na základě provedených předoperačních vyšetření (interní vyšetření se stanovením personal status – PS, histologické vyšetření a CT vyšetření břicha a malé pánve).
Statisticky byly křivky přežívání hodnoceny podle Kaplan-Meiera, pro srovnání dat přežívání byl použit log-rank test).
VÝSLEDKY
V letech 2000−2019 byla provedena pro PK kolorektálního původu na našem pracovišti cytoreduktivní chirurgie a HIPEC u 66 pacientů ve věku od 33 let do 74 let. Do sledované skupiny bylo zařazeno 48 pacientů, zbylí museli být vyloučeni z důvodu neúplné nebo chybějící dokumentace. Do této analýzy také nebyli zahrnuti nemocní se synchronním výskytem metastatického onemocnění jater či jiných orgánů uložených mimo dutinu břišní. Ve sledované skupině jsme zaznamenali 12 pacientů (25 %) ve věku nad 65 let, z toho 6 (12,5 %) žen a 6 (12,5 %) mužů. U všech nemocných bylo během operace stanoveno PCI (které v celé skupině činilo průměrně 14,85) a CC skóre.
Ve skupině operovaných s PCI do 12 dosud žije 10 pacientů (33,3 %), u zbylých (66,7 %) bylo zjištěno průměrné přežití 26,3 měsíce. U pacientů s PCI skóre nad 12 je situace horší, v současné době nežije nikdo a průměrné přežití v této skupině činilo 21,4 měsíce (p=0,002), Tab. 1, Graf 1.
Tab. 1. Přežití pacientů dle PCI
Tab. 1: Patients survival according to PCI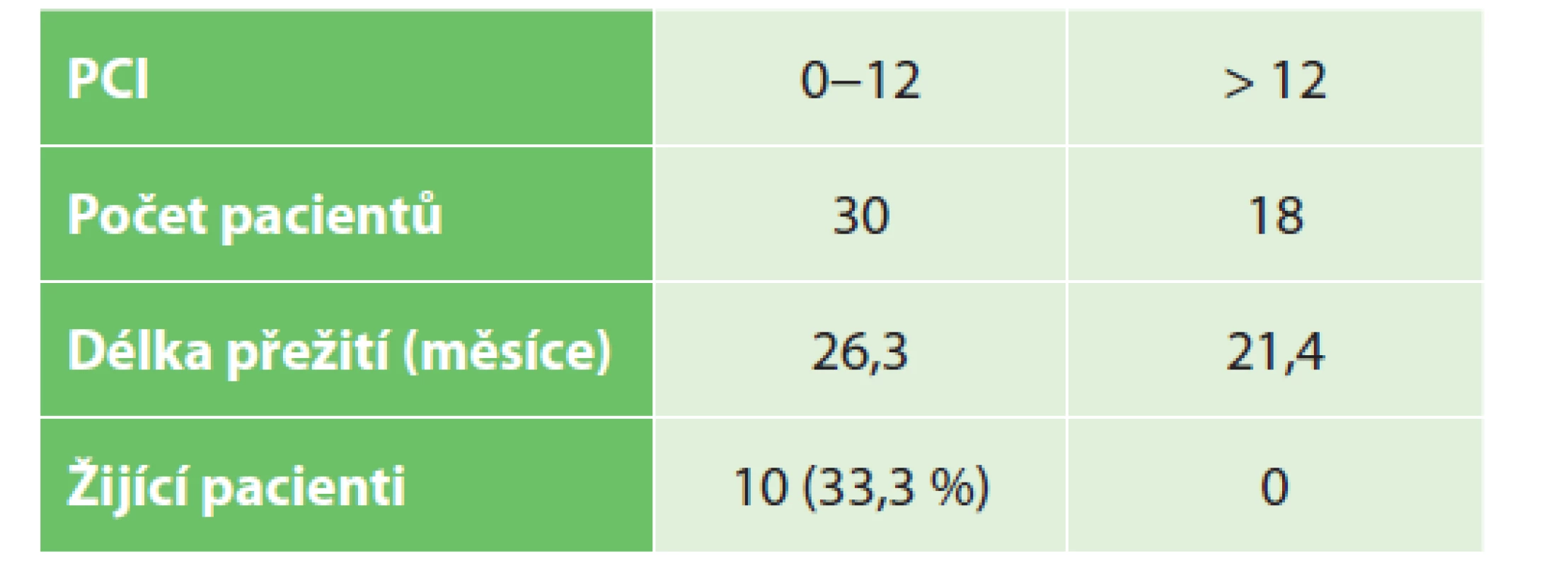
Graf 1. Srovnání přežití dle PCI
Graph 1: Comparison of survival according to PCI
Podobné výsledky nacházíme i u pacientů rozdělených do dvou skupin podle kompletnosti provedené cytoreduktivní chirurgie. Ve skupině s resekcí CC - 0-CC1 − 34 pacientů – 70,8 % (16 mužů a 18 žen) dosahuje průměrné přežití 27 měsíců, skupina s CC2-CC3 resekcí o 14 pacientech − 29,2 % (8 mužů a 6 žen) bylo registrováno průměrné přežití (12,6 měsíce (p=0,06), Tab. 2, Graf 2.
Tab. 2. Přežití pacientů dle typu provedené CRS (CC skóre)
Tab. 2: Patients survival according to CRS surgery (CC score)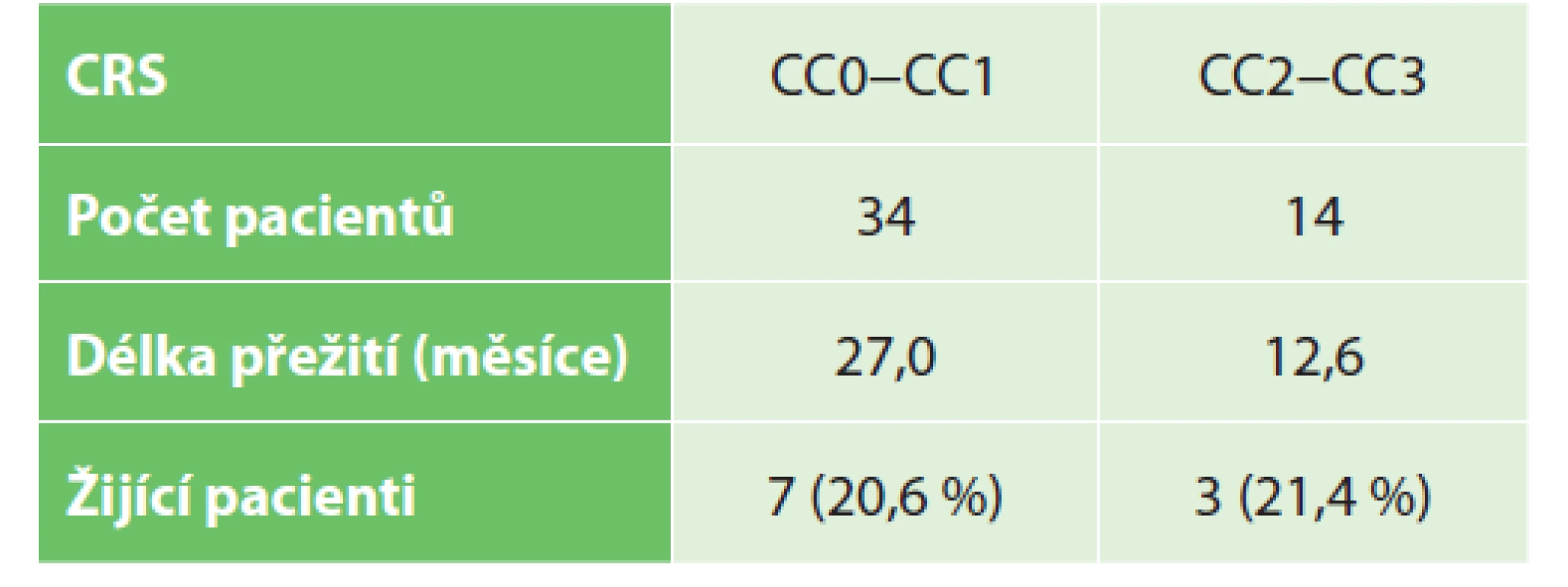
Graf 2. Srovnání přežití dle CC resekce
Graph 2: Comparison of survival according to CC resection
U pacientů v celé skupině byl medián přežití 22 měsíců (13−34 měsíců), Graf 3.
Graf 3. Přežití u pacientů s PK kolorektálního původu po CRS a HIPEC (medián přežití)
Graph 3: Median survival after CRS and HIPEC in patients with PK of colorectal origin
Morbidita vyžadující chirurgickou či jinou intervenci (Clavien-Dindo III–IV) v celém souboru činila 18,7 %, mortalita pak 6,25 %.
Tab. 3. Výskyt komplikací dle klasifikace Clavien-Dindo
Tab. 3: Complications according to Clavien-Dindo classification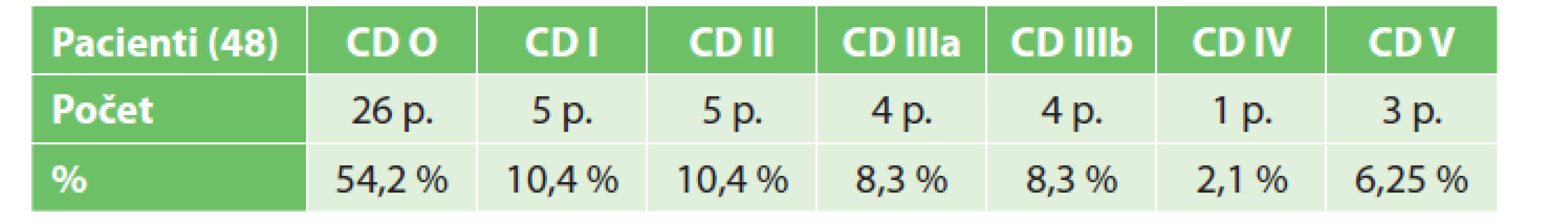
Komplikace v celé skupině operovaných (48 pacientů) jsme zaznamenali u 22 pacientů (45,8 %), z toho CD I a II (Clavien-Dindo klasifikace) u 10 pacientů (20,8 %) a CD III a IV u 9 pacientů (18,7 %), 3 nemocní (6,25 %) zemřeli. Většina (26 pacientů − 54,2 %) neměla komplikace žádné. (Clavien-Dindo klasifikace) – 48 pacientů.
Mortalita byla způsobena u 1 pacienta těžkým dřeňovým útlumem, na úmrtí dalšího pacienta se pak podílelo multiorgánové selhání způsobené vysokou peroperační zátěží organismu. Třetí operovaný zemřel na následky sepse způsobené insuficiencí jedné z provedených anastomóz.
DISKUZE
Metoda léčby PK na naší klinice vychází z principů prof. Sugarbakera spočívajících v maximální možné cytoredukci, která je doplněna peroperační hypertermickou aplikací cytostatika dle rozpisu klinického onkologa [7].
Cílem diagnostiky je verifikace procesu, stanovení rozsahu onemocnění ve vztahu k další možné léčbě, provedení odhadu prognózy, ev. délky přežití. Je založena na zjištění anamnézy, klinickém nálezu, provedení histologického vyšetření a předoperačního stanovení rozsahu onemocnění pomocí široce užívaného tzv. PCI (Peritoneal Cancer Index), který se určuje pomocí zobrazovacích metod i peroperačně. K dalším dnes používaným skórovacím systémům patří Peritoneal Surface Disease Severity Score (PSDSS) [8,9] nebo Colorectal Peritoneal Metastases Prognostic Surgical Score, prognostický nomogram předpovídající přežívání pacientů po CRS a HIPEC v léčbě PK kolorektálního původu (COMPASS) [10]. Mezi nejvíce užívané skórovací systémy mimo PCI patří SPCI (simplified peritoneal cancer index), který dělí dutinu břišní na 7 oblastí. Postižení 2−3 oblastí v tomto systému je srovnáváno s postižením cca 4–5 oblastí PCI klasifikace. Při zasažení více než 5 oblastí nádorovým procesem není výkon u PK kolorektálního původu doporučován. Extrapolací tomu odpovídá PCI okolo 15−20 [11] − Obr. 1.
Obr. 1. Simplified peritoneal cancer index (SPCI) − součet velikostí nádorových lézí pro všechny oblasti je 21
Fig. 1: Simplified peritoneal cancer index (SPCI) − the sum of sizes of the tumour lesions for all areas is 21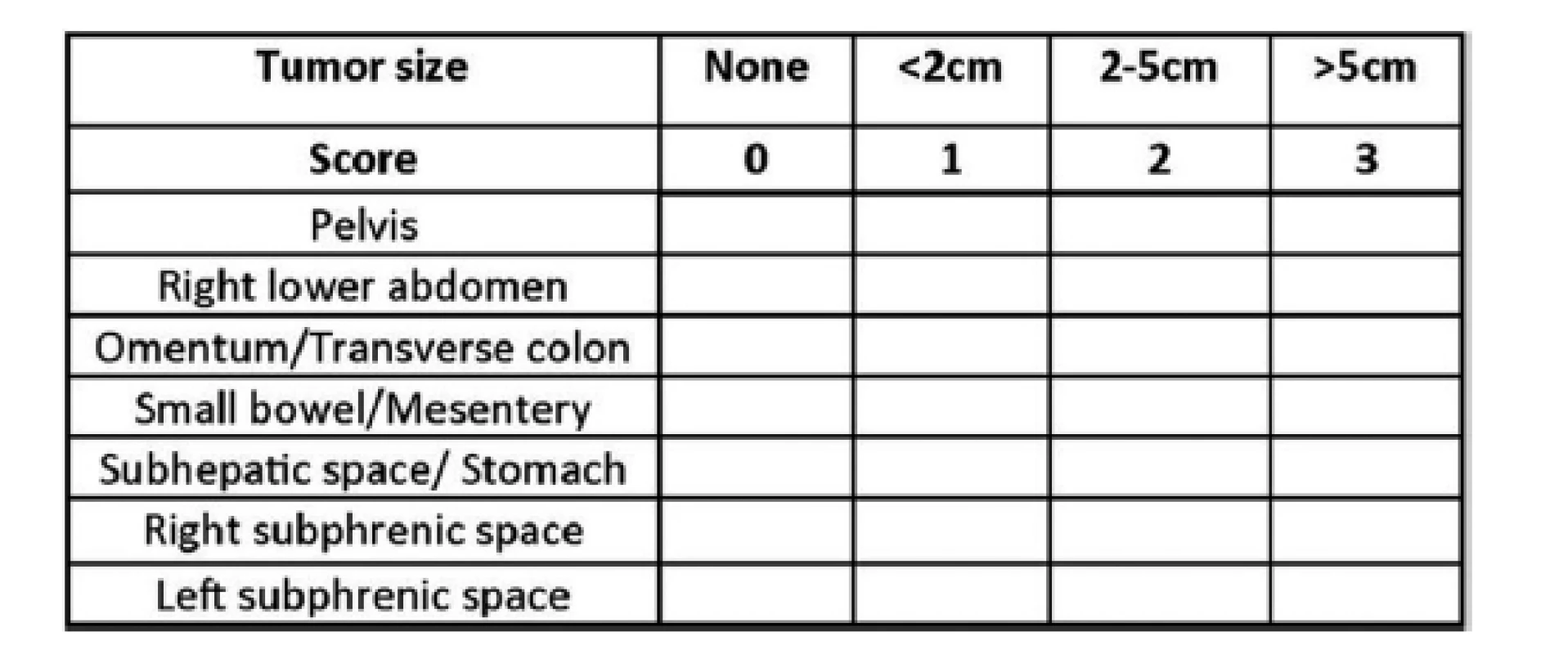
Mezi základní metody stanovování předoperačního PCI patří multidetektorové CT s multiplanární rekonstrukcí nebo 3dimenzionální CT s vysokým rozlišením.
Ostatní vyšetření (PET CT, MRI…) jsou prováděna při diagnostických rozpacích či k vyloučení extraabdominálních metastáz.
Pozitivní prediktivní hodnota radiologických metod ve srovnání s chirurgickými metodami se pohybuje okolo 85 %, negativní prediktivní hodnota je pak udávána cca 56 % [12,13].
Kromě běžných laboratorních vyšetření nutných k posouzení stavu pacienta (PS) a únosnosti rozsáhlého chirurgického zákroku je doporučováno provádět odběry CEA, CA 19.9, CA 125 před i po operaci. Hladina těchto onkologických markerů může být dalším faktorem predikce rozsahu postižení dutiny břišní PK, dlouhodobého přežití (OS) i progrese onemocnění (PFS) [14,15].
K posouzení rozsahu onemocnění v dutině břišní během operace se u nás i ve světě stanovuje tzv. peroperační PCI (Peritoneal Cancer Index) [16] − Obr. 2.
Obr. 2. Peritoneal cancer index (PCI)
Pro každou vyznačenou oblast se určuje „lesion size“ (LS)
Fig. 2: Peritoneal cancer index (PCI)
Lesion size (LS) is specified for each designated area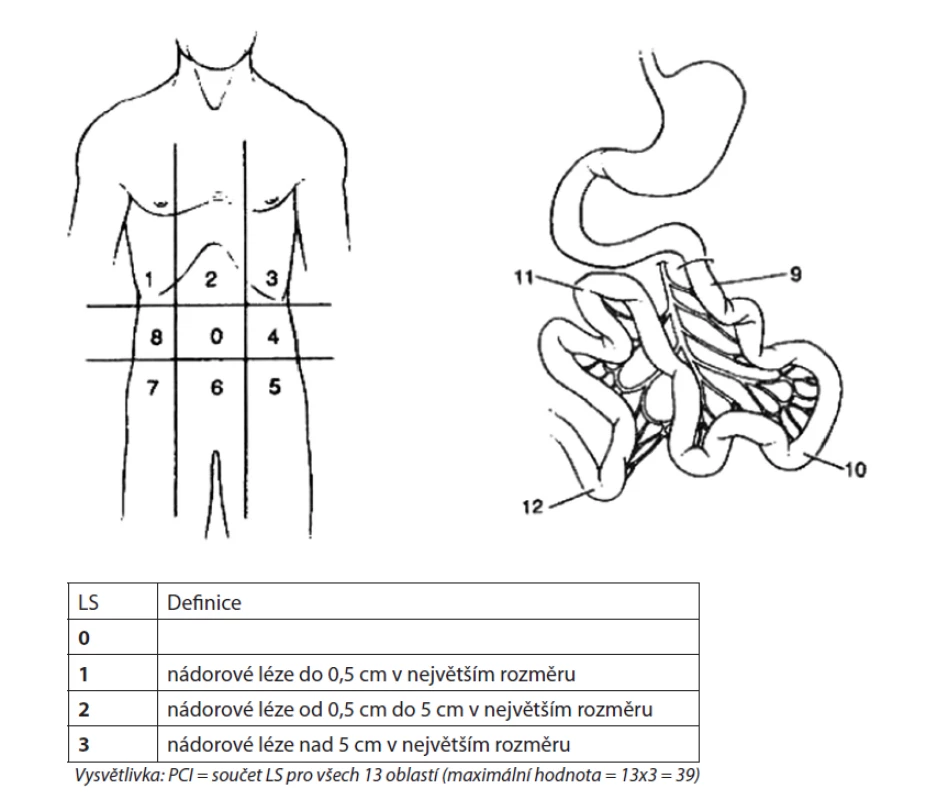
PCI hodnotí rozsah onemocnění v dutině břišní, spoluurčuje prognózu, přežití a výskyt komplikací. Nález hodnoty PCI nad 19 (p=0,004) u peritoneální karcinomatózy má velmi špatnou prognózu (i přes ev. provedení CRS a HIPEC), proto by se u těchto pacientů výkon provádět neměl.
K dalším negativním prognostickým faktorům se zařazují agresivní histologický typ nádoru (p=0,022), přítomnost extraperitoneálního onemocnění (p=0,019), postižení lymfatických uzlin (p<0,001) a postižení konečníku (p<0,001) a pravé poloviny tlustého střeva (p=0,018). Vyšší věk (nad 65 let) byl shledán negativním faktorem jen v 7 studiích, v dalších 27 studiích vliv věku na přežití (OS) po CRS a HIPEC prokázán nebyl (p=0,36).
Obvykle sledované faktory ovlivňující negativně morbiditu operovaných pacientů (diabetes mellitus, vyšší BMI, ztráta hmotnosti, přítomnost klinických příznaků onemocnění a ascitu) ve spojitosti s CRS a HIPEC u PK kolorektálního původu nejsou uváděny jako negativní z důvodu neúplnosti získaných dat [17,18].
Efektivita CRS je posuzována pomocí CC-skóre − Completness Of Cytoreduction After Surgery. CC-skóre hodnotí úplnost cytoredukce po chirurgickém výkonu posouzením nuceně ponechaných zbytků nádoru v dutině břišní. Dle velikosti ponechaných reziduálních nádorových hmot se pacienti dělí do 4 skupin (Obr. 3).
Obr. 3. CC skóre
Fig. 3: CC score
Za radikální, léčebný, výkon je považována nejen redukce typu CC-O, ale i typu CC-1 (p=0,02).
Důvodem jsou zjištění, že nádorová rezidua do 0,25 cm (2,5 mm) jsou spolehlivě ničena metodou HIPEC [19,20].
Vzhledem k tomu, že po provedení HIPEC bývá stěna střevní změněná, silně edematózní, anastomózu zakládáme pouze jednu, a to až po ukončení laváže. Při nutnosti konstrukce další anastomózy (na tlustém střevě, konečníku) zakládáme protektivní střevní vývod. Tento postup považujeme za racionální, neboť při obnovování kontinuity lze provést second look, který umožní CRS, ev. HIPEC opakovat.
Výsledky metody (CRS a HIPEC) v léčbě PK kolorektálního původu udávané v literatuře jsou relativně povzbudivé.
5leté přežití se pohybuje mezi 26−58 %, medián přežití 22−47 měsíců po kompletní CRS a HIPEC, které jsou ve specializovaných centrech dosahovány až v 84 %. Výsledky v léčbě PK kolorektálního původu uváděné v literatuře jsou srovnatelné s výsledky chirurgických resekcí jaterních metastáz.
Na druhé straně výsledky studie COLOPEC prováděné u pacientů s pokročilým kolorektálním karcinomem T4, u pacientů s perforovaným tumorem, neprokázalo vyšší efektivitu HIPEC oproti adjuvantní systémové chemoterapii [21]. Studie Prodigy 7 pak neprokázala vyšší účinnost kombinace CRS a HIPEC ve srovnání s CRS provedenou samostatně. Naše pozorování, i když na malém souboru pacientů, však těmto závěrům neodpovídá [22].
Komplikace uváděné jednotlivými CRS centry dosahují až 64 %, mortalita se pohybuje mezi 1−10 %.
Některé literární zdroje uvádějí i vyšší výskyt komplikací a úmrtnosti (12,9 %) ve věkové skupině pacientů nad 65 let [23,24,25,26,27,28].
Nejčastěji se objevují ranné infekce (do 26 %), plicní a kardiologické komplikace se pohybují okolo 5−15 %, hematologické komplikace po HIPEC (4−39 %).
Pooperační krvácení a septický šok se vyskytují přibližně v 17 %, resp. v 16 %, insuficience anastomózy (leak) je popisována v rozmezí od 4,5−19 % [29,30].
Ze strany pacientů je CRS a HIPEC chirurgie hodnocena pozitivně, 80 % pacientů, kteří podstoupili CRS a HIPEC, bylo spokojeno a uvádělo, že zmíněná léčba neměla žádný negativní dopad na kvalitu jejich následného života. Negativními faktory ovlivňující sociální a emocionální stav pacientů v pooperačním období jsou přítomnost stomie a recidiva onemocnění vniklá do 3 měsíců od operace [31,32]. Námi získané výsledky, počty úmrtí i frekvence komplikací výše uvedené statistiky z velkých center plně potvrzují.
ZÁVĚR
Naše zkušenosti i výsledky s léčbou PK kolorektálního původu jsou srovnatelné s výsledky renomovaných světových center prezentovaných ve světové literatuře.
CRS a HIPEC jsou i u PK kolorektálního původu účinnou metodou volby u vybraných pacientů.
Vhodní kandidáti pro použití této léčebné metody by měli být diskutováni ve specializovaných multidisciplinárních týmech peritonektomických center.
Vzhledem k vyšší morbiditě, náročnosti operace a pooperační péči by tato metoda měla být aplikována výhradně a jen v těchto centrech. V léčbě PK kolorektálního původu je CRS a HIPEC oproti systémové chemoterapii vysoce efektivní. Nízká mortalita, přijatelný výskyt komplikací a prodloužení OS ukazují metodu jako efektivní alternativní léčbu tohoto smrtícího onemocnění.
Seznam zkratek:
PK − peritoneální karcinomatóza
KRK − kolorektální karcinom
CRS − cytoreduktivní chirurgie
HIPEC − hypertermická intraperitoneální chemoterapie
PCI − Peritoneal Carcinoma Index – skórovací systém určující rozsah onemocnění
CC-skóre − skórovací systém – úplnost chirurgické cytoredukce (completness of cytoreduction after surgery)
OS − celkové přežití
PFS − interval do progrese onemocnění
MDT − multidisciplinární tým
PS − personal status (osobní stav)
CT − počítačová tomografie
PET CT − pozitronová emisní tomografie
MRI − magnetická rezonance
CEA − karcino-embryonální antigen
CA 19-9 − nádorově specifický nádorový marker (GIT, slinivka), tzv. antigen karcinomu
CA 125 − nádorově specifický nádorový marker (ovarium)
PSOGI − Peritoneal Surface Oncology International
Podpořeno MZ-ČR – RVO (NNB 00064211)
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Petr Bartoška
Chirurgická klinika 1. LF UK a FN Bulovka
Budínova 67/2
180 81 Praha 8
e-mail: petr.bartoska@bulovka.cz
Zdroje
1. Lemmens VE, Klaver YL, Verwaal VJ, et al. Predictors and survival of synchronous peritoneal carcinomatosis of colorectal origin: population-based study. Int. J Cancer 2011 Jun1;128(11):2717−2725. doi: 10.1002/ijc.25596.
2. Van Gestel YRBM, de Hingh IHJT, van Herk-Sukel MPP, et al. Patterns of metachronous metastases after curative treatment of colorectal cancer. Cancer Epidemiol. 2014 Aug 38(4):448−454. doi: 10.1016/j.canep.2014.04.004.
3. Verwall VJ, van Ruth S, de Bree E, et al. Randomized trial of cytoreduction and hyperthermic intraperitoneal chemotherapy versus systemic chemotherapy and palliative surgery in patients with peritoneal carcinomatosis of colorectal cancer. J Clin. Oncol. 2003 Oct 15;21(20):3737−3743. doi:10.1200/ JCO.2003.04.187.
4. Bloemendal AL,van Ruth S, de Bree E, et al. Conventional surgery and systemic chemotherapy for peritoneal carcinomatosis of colorectal origin: a prospective study. Eur. J Surg. Oncol. 2005;31(10):1145−1151. doi: 10.1016/j. ejso.2005.06.002.
5. Franko J, Ibrahim Z, Gusani NJ, et al. Cytoreductive surgery and hyperthermic intraperitoneal chemoperfusion versus systemic chemotherapy alone for colorectal peritoneal carcinomatosis. Cancer 2010 Aug; 116(16):3756−3762. doi: 10.1002/cncr.25116.
6. Sadeghi B, Arvieux C, Glehen O, et al. Peritonal carcinomatosis from non-gynecologic malignancies: results of the EVOCAPE 1 multicentric prospective study. Cancer 2000 Nov; 88 : 358−363. doi:10.1002/(SICI)1097 - 0142(20000115).
7. Sugarbaker PH. Peritonectomy procedure. Ann Surg. 1995;221 : 29−42. doi: 10.1097/00000658-199501000-00004.
8. Yoon W, Alame A, Berrim R, et al. Peritoneal Surface Diesease Severity Score as a predictor od resectability in the treatment of peritoneal surface malignancies. Am Journal of Surg. 2014 March;207(3):403−407 doi: 10.1016/j.amjsurg. 2013.09.021.
9. Simkens GA, van Oudheusden T, Nierboer D, et al. Development of a prognostic nomogram for patients with peritoneally metastasized colorectal cancer treated with cytoreductive surgery and HIPEC. Ann Surg Oncol. 2016;23 : 4214−4221 doi:10.1245/s10434-016-5211-6.
10. Endblad M, Ghanipour L, Cashin PH, et al. Prognostic scores for colorectal cancer with peritoneal metastases treated with cytoreductice surgery and chemotherapy. Int J Hyperthermia 2018 Dec;34(8):1390−1395 doi: 10.1080/02656736.2018.146466.
11. Harmon RL, Sugarbaker PH. Prognostic indicators in peritoneal carcinomatosis from gastrointestinal cancer. International Seminars in Surgical Oncology 2005 Feb;2(3):1−10 doi:10.1186/1477-7800-2 - 3.
12. Dineen SP, Royal RE, Hughes MS, et al. A simplified preoperative assessment predicts complete cytoreduction and outcomes in patients with low-grade mutinous adenocarcinoma of the appendix. Annals of Surgical Oncology (2015);22 : 3640−3646. doi: 10.1245/ s10434-015-4446-y.
13. Flicek K, Ashfaq A, Johnson CD, et al. Correlation of radiologic with surgical peritoneal cancer index scores in patients with pseudomyxoma peritonei and peritoneal carcinomatosis: How well can we predict resectability? J Gastrointest Surg 2016; 20 : 307−312.doi: 10.1007/s11605-015 - 2880-6.
14. Canbay E, Ishibashi H, Sako S, et al. Preoperative carcinoembryonic antigen level predicts prognosis in patients with pseudomyxoma peritonei treated with cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. World Journal of Surgery 2013;37 : 1271−1276. doi: 10.1007/s00268-013-1988-7.
15. Kusamura S, Baratti D, Hutanu I, et al. The role of baseline inflammatory - based scores and serum tumor markers to risk stratify pseudomyxoma peritonei patients treated with cytoreduction (CRS) and hyperthermic intraperitoneal chemotherapy (HIPEC). EJSO 2015;41 : 1097−1105. doi: 10.1016/j. ejso.2015.04.005.
16. Carr NJ, Cecil TD, Mohamed F, et al. Consensus for classification and pathologic reporting of pseudomyxoma peritonei and associated appendiceal neoplasia: The results of the Peritoneal Surface Oncology Group International (PSOGI) modified delphi process. Am J Surg Pathol. 2016 Jan;40(1):14−26. doi:10.1097/ PAS.0000000000000535.
17. Kwakman R, Schrama AM, van Olmen, et al. Clinicopathological parameters in patients selection for cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for colorectal cancer metastases: a meta-analysis. Ann Surg. 2016 Jun;263(6):1102−111. doi:10.1097/ SLA0000000000001593.
18. Barrati D, Kusamura S, Iusco D, et al. Should a history of extraperitoneal disease be a contraindication to cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for colorectal cancer peritoneal metastases? Dis. Colon Rectum 2018;61 : 1026−1034. doi: 10.1097/DCR.0000000000001156.
19. Yan Li, Yun-Feng Zhou, Han Liang, et al. Chinese expert consensus on cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for peritoneal malignancies. World Journal of Gastroenterology 2016;22(30):6906−6916. doi: 10.3748/wjg. v 22. i30.6906.
20. Antoš F, Vítek P, Kopic J, et al. Cytoreduktivní chirurgie a hypertermická peroperativní chemoterapie (HIPEC) v léčbě malignit peritoneálních povrchů. Onkologická revue 2018;5(2):62−67, ISSN 2464-7195.
21. Klaver ChEL, Wisselink DD, Punt CJA, et al. Adjuvant hyperthermic intraperitoneal chemotherapy in patients with locally advanced colon cancer (COLOPEC): a multicentre, open-label, randomised trial. The Lancet 2019 Jul;4(10):761−770 doi: 10.1016/S2468-1253(19)30239-0.
22. Quénet F, Elias D, Roca L, et al. Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy versus cytoreductice surgery alone for colorectal peritoneal metastases (PRODIGE 7): a multicentre, randomised, open-label, phase 3 trial. The Lancet 2021 Feb;22(2):256−266 doi: 10.1016/S1470 - 2045(20)30599-4.
23. Lin EK, Hsieh MCh, Chen ChH, et al. Outcomes of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for colorectal cancer with peritoneal metastasis. Medicine 2016 Nov.;95 : 52(e5522). doi: 10.1097/ MD.0000000000005522.
24. Arslan NC, Bisgin T, Altay C, et al. Is advanced age a hesitation for cytoreductive surgery and hyperthermic intraperitoneal chemotherapy in colorectal cancer? JBUON 2018;23(suppl 1):77−83. ISSN:1107-0625.
25. Elias D, Gilly F, Boutitie F, et al. Peritoneal colorectal carcinomatosis treated with surgery and perioperative intraperitoneal chemotherapy: Retrospective Analysis of 523 patients from a multicentric French study. Journal of Clinical Oncology 2009 Nov;28(1):63−68 doi: 10.1200/ JCO.2009.23.9285.
26. Moran B, Cecil T, Chandrakumaran K, et al. The results of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy in 1200 patients with peritoneal malignancy. Colorectal Disease 2015. doi: 10.1111/codi.12975.
27. Morano WF, Khalili M, Chi DS, et al. Clinical studies in CRS and HIPEC: Trials, tribulations, and future directions – a systematic review. J Surg Oncol. 2018 Feb;117(2):245−259. doi:10.1002/ jso.24813.
28. Ludwigs K, Breimer ME, Brorson F, et al. Cytoreductive surgery and intraperitoneal chemotherapy (HIPEC or EPIC) in patients with colorectal adenocarcinoma and peritoneal carcinomatosis. Health Technology Assessment Database 2013;4. Record ID 32013000623.
29. Mehta SS, Gelli M, Agarwal D, et al. Complications of cytoreductive surgery and HIPEC in the treatment of peritoneal metastasis. Indian J Surg Oncol. 2016;7(2):225−229. doi: 10.1007/s13193 - 016-0504-6.
30. Saxena A, Yan TD, Morris DL. Critical assessment of risk factors for complications after cytoreductive surgery and perioperative intraperitoneal chemotherapy for pseudomyxoma peritonei. Ann Surg Oncol. 2010;17(5)1291−1301. doi: 10.1245/ s10434-009-0875-9.
31. Chia CS, Tan GHCh, Lim C, et al. Prospective quality of life for colorectal cancer patients with peritoneal carcinomatosis undergoing cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. Ann Surg Oncol. 2016;23 : 2905−2913. doi: 10.1245/s10434-016-5203-6.
32. Cashin PH, Mahteme H, Syk I, et al. Quality of life and cost effectivness in a randomized trial of patients with colorectal cancer and peritoneal metastases. European Journal of Surgical Oncology 2018 Feb;44 : 983−990. doi: 10.1016/j. ejso.2018.02.012.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2021 Číslo 10- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Stárnutí populace z pohledu chirurga
- Rozsev peritoneálních malignit − reoperace po cytoreduktivní chirurgii + HIPEC
- Sakrální neuromodulace v léčbě fekální inkontinence – 10leté zkušenosti a dlouhodobé výsledky specializovaného centra
- Je vysoký věk kontraindikací plicní resekce?
- Peritoneální karcinomatóza (PK) kolorektálního původu a její léčba cytoreduktivní chirurgií (CRS) a intraperitoneální peroperační chemoterapií (HIPEC) na pracovišti FN Bulovka
- Delirantní stavy na chirurgické JIP – kazuistika
- Postpneumonektomický MRSA empyém řešený podtlakovou terapií – kazuistika a přehled literatury
- Bronchogenní cysta kardie – kazuistika a přehled literatury
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Sakrální neuromodulace v léčbě fekální inkontinence – 10leté zkušenosti a dlouhodobé výsledky specializovaného centra
- Bronchogenní cysta kardie – kazuistika a přehled literatury
- Delirantní stavy na chirurgické JIP – kazuistika
- Rozsev peritoneálních malignit − reoperace po cytoreduktivní chirurgii + HIPEC
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



