-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaProximální gastrektomie u selektovaných pacientů s adenokarcinomem gastroezofageální junkce, bezprostřední a dlouhodobé výsledky operační terapie
Proximal gastrectomy for adenocarcinoma of the gastroesophageal junction in a selected set of patients − immediate and long-term results
Introduction:
The authors present the results of surgical resection in the form of proximal gastrectomy in a selected set of patients with adenocarcinoma of the gastroesophageal junction. The selection criteria included: ASA III–IV, internal comorbidities and elderly patients.Methods:
Between 2007 and 2015, 28 patients with adenocarcinoma of the gastroesophageal junction underwent proximal gastrectomy at the 1st Department of Surgery. The patient set consisted of 19 (67.8%) men and 9 (32.3%) women aged 52−89 years with the median age of 72.5 years. Endoscopic examination revealed a tumour of the gastroesophageal junction, which was evaluated according to the Siewert classification: type I was present in 4 (16.7%) cases, type II in 12 (42.3%), and type III in 12 (42.3%). Histological analysis revealed adenocarcinoma in all cases. Proximal gastrectomy with lymphadenectomy was performed in all patients. Splenectomy was performed in eleven patients. The continuity of the gastrointestinal tract was ensured by esophagogastroanastomosis, and pyloromyotomy was performed as a standard procedure. Cryostatic examination revealed positive resection margins in the esophagus in five patients, which led to the resection of the distal esophagus from the right-sided thoracotomy.Results:
Injury to the biliary tract was observed in one case in the perioperative period, which was treated by hepaticojejunoanastomosis onto an excluded jejunal loop. The following complications were observed postoperatively: bleeding, respiratory complications, anastomotic dehiscence, laparotomy wound dehiscence, and inflammatory infiltration in the abdominal cavity. Thirty-day mortality was 10.7% in our patient set.Conclusion:
Proximal gastrectomy with lymphadenectomy is an appropriate alternative for polymorbid patients with adenocarcinoma of the gastroesophageal junction and provides good short - and long-term results.Key words:
cancer of gastroesophageal junction − proximal gastrectomy − complications of therapy
Autoři: R. Vrba 1; R. Aujeský 1; Č. Neoral 1; M. Stašek 1; M. Loveček 1; J. Tesaříková 1; K. Vomáčková 1; M. Horáková 2; J. Zapletalová 3
Působiště autorů: Chirurgická klinika FN Olomouc přednosta: prof. MUDr. Č. Neoral, CSc. 1; Oddělení IPCHO FN Olomouc přednosta: MUDr. L. Blahut 2; Katedra biofyziky LF Univerzity Palackého v Olomouci přednosta: prof. RNDr. H. Kolářová, CSc. 3
Vyšlo v časopise: Rozhl. Chir., 2016, roč. 95, č. 12, s. 439-443.
Kategorie: Původní práce
Souhrn
Úvod:
Autoři prezentují výsledky chirurgické resekční léčby v podobě proximální gastrektomie na selektovaném souboru pacientů u adenokarcinomu gastroezofageální junkce. Selekčními kritérii zařazení do sestavy bylo ASA III.–IV., přidružené komorbidity, vyšší věk nemocných.Metody:
Na I. chirurgické klinice byla od roku 2007 do 2015 provedena proximální gastrektomie pro karcinom gastroezofageální junkce celkem u 28 nemocných. V souboru bylo zastoupeno 19 (67,8 %) mužů a 9 (32,2 %) žen s věkovým rozmezím od 52−89 let, medián 72,5 roku. Endoskopickým vyšetřením byl popsán tumor GEJ, který byl hodnocen dle Siewertovy klasifikace: I. typ ve 4 (14,4 %) případech, II. typ v 12 (42,3 %), III. typ v 12 (42,3 %). Histologickým vyšetřením byl u všech nemocných popsán adenokarcinom. U všech nemocných byla provedena proximální gastrektomie s lymfadenektomií. V patnácti případech byla provedena splenektomie. Pasáž zažívacího traktu byla obnovena ezofagogastroanastomózou, standardně byla provedena pyloromyotomie. V pěti případech pro pozitivní resekční linii na jícnu při vyšetření na zmrzlo byla provedena resekce distálního jícnu z pravostranné torakotomie.Výsledky:
Perioperačně jsme v jednom případě zaznamenali poranění žlučových cest, které byly ošetřeny hepatikojejunoanastomózou na exkludovanou jejunální kličku. V pooperačním období jsme zaznamenali tyto komplikace: krvácení, respirační komplikace, dehiscence anastomóz, dehiscence laparotomie, zánětlivý infiltrát v dutině břišní. Třicetidenní mortalita našeho souboru byla 10,7 %.Závěr:
Proximální gastrektomie s lymfadenektomií je vhodnou terapeutickou alternativou pro polymorbidní nemocné s karcinomem GE junkce s příznivými krátkodobými i dlouhodobými výsledky.Klíčová slova:
karcinom GEJ − proximální gastrektomie − komplikace terapieÚvod
Jedinou kurativní terapií karcinomu gastroezofageální junkce je radikální chirurgický výkon. V případě postižení distálního jícnu je indikována ezofagektomie, pokud je nádorovým procesem infiltrována kardie nebo subkardiální oblast žaludku, je provedena totální gastrektomie. V našem sdělení referujeme o alternativní chirurgické terapii karcinomu gastroezofageální junkce, proximální gastrektomii. Tento typ méně extenzivního a pro pacienty méně náročného výkonu jsme indikovali u vybrané skupiny nemocných s karcinomem v této lokalitě za přísně selektivních kritérií (ASA III–IV., přidružené interní komorbidity, vyšší věk nemocných). Cílem našeho sdělení bylo zhodnocení krátkodobých a dlouhodobých výsledků proximální gastrektomie u vybrané skupiny nemocných s adenokarcinomem GEJ, kteří by vzhledem ke svému celkovému stavu nezvládli náročný chirurgický výkon ezofagektomii nebo totální gastrektomii.
Metody
Na I. chirurgické klinice byla od roku 2007 do 2015 provedena proximální gastrektomie pro karcinom gastroezofageální junkce celkem u 28 nemocných. Za uvedené období byla na našem pracovišti provedena transhiatální ezofagektomie pro adenokarcinom distálního jícnu u 125 nemocných a totální gastrektomie pro adenokarcinom kardie a subkardie u 213 pacientů. V souboru nemocných s proximální gastrektomií bylo zastoupeno 19 (67,8 %) mužů a 9 (32,2 %) žen s věkovým rozmezím od 52−89 let s mediánem 72,5 roku. Dominantním symptomem onemocnění byly dysfagické potíže, které se vyskytovaly celkem u 14 (50 %) nemocných. Z dalších specifických symptomů pro onemocnění GEJ byly popsány bolesti v epigastriu u 4 (14,3 %), meléna u 3 (10,7 %), hemateméza u 1 (3,5 %), anemie u 2 (7,1 %) pacientů. U zbylých pacientů bylo endoskopické vyšetření provedeno pro dyspeptické potíže 2 (7,1 %), nechutenství 1 (3,5 %) a v jednom případě se jednalo o náhodný nález 1 (3,5 %). Endoskopickým vyšetřením byl popsán tumor GEJ, který byl hodnocen dle Siewertovy klasifikace: I. typ ve 4 (14,4 %) případech, II. typ v 12 (42,3 %), III. typ v 12 (42,3 %). Histologickým vyšetřením byl u všech nemocných popsán adenokarcinom. V ASA klasifikaci před operací bylo 22 (78,5 %) nemocných klasifikováno jako ASA lll. a 6 (21,5 %) nemocných ASA lV. U nemocných bylo standardně provedeno endoskopické vyšetření s biopsií z tumoru, endosonografické vyšetření k popisu TN stadia onemocnění a PET/CT vyšetření k vyloučení metastatického procesu v játrech, plicích a vzdálených orgánech. Kromě základního interního předoperačního vyšetření bylo u všech nemocných provedeno spirometrické vyšetření pro případ, že by bylo nutné provést výkon z torakotomie a u pacientů s kardiologickou anamnézou bylo provedeno kardiologické vyšetření. Operace byla provedena v celkové endotracheální anestezii. Z příčné nebo horní střední laparotomie byla provedena proximální gastrektomie s resekcí distálního jícnu. Resekční linie na jícnu byla ve vzdálenosti nejméně 5 cm nad tumorem, ve všech případech bylo provedeno kryostatické vyšetření resekční linie k vyloučení nádorové infiltrace. V případě pozitivní resekční linie byla provedena pravostranná torakotomie a při potvrzené negativní resekční linii byla anastomóza na jícen našita ručně pokračujícím stehem. Distální resekční linie byla provedena staplerově minimálně v 10cm vzdálenosti pod hranicí tumoru. Ve všech případech byla součástí výkonu lymfadenektomie. Pasáž zažívacího traktu byla u nemocných obnovena gastroezofageální anastomózou, která byla konstruována s využitím kruhových staplerů o průměru 21 a 25 mm. Pro opakované dehiscence po konstrukci anastomózy staplerem o průměru 21 mm jsme při malém průměru lumen jícnu anastomózu konstruovali ručně. Součástí výkonu byla ve všech případech pyloroplastika dle Holla. Do dutiny břišní byly standardně založeny dva drény. Jeden k bráničnímu hiátu, druhý do levého hypochondria, v případě operace z hrudní dutiny byl vložen do pohrudniční dutiny jeden drén. V pooperačním období byla zajištěna nutrice nemocných kombinací parenterální a enterální výživy zavedenou nutritivní nazojejunální biluminální sondou. U všech nemocných bylo 7. pooperační den provedeno RTG vyšetření pasáže horní etáže zažívacího traktu vodnou kontrastní látkou k ověření suficience anastomózy.
Výsledky
Proximální gastrektomie pro karcinom GEJ byla v období 2007−2015 provedena celkem u 28 nemocných, kteří splňovali vstupní kritéria zařazení do sestavy nemocných. Výsledky souboru byly vyhodnoceny retrospektivní analýzou. Proximální gastrektomie byla provedena u všech nemocných, ve 24 případech byl výkon proveden z laparotomie, ve čtyřech bylo nutno pro pozitivní orální resekční linii dokončit operaci z pravostranné torakotomie. Splenektomie byla provedena v 15 (53,6 %) případech. Průměrná operační doba byla 157 minut. K operačnímu výkonu proximální gastrektomii byla u jednoho nemocného pro empyém žlučníku přidružena cholecystektomie. Pro nepřehledný terén byla po cholecystektomii provedena biligrafie, která potvrdila přerušení hepatocholedochu. Poraněné žlučové cesty byly ošetřeny hepatikojejunoanastomózou na exkludovanou Roux-Y jejunální kličku. V bezprostředním pooperačním období jsme u jednoho nemocného zaznamenali závažné krvácení z lienální tepny po poranění tepny harmonickým skalpelem. Krvácení bylo chirurgicky ošetřeno, v dalším průběhu hospitalizace byl nemocný bez komplikací. U 4 nemocných jsme zaznamenali dehiscenci anastomózy. Ve dvou případech při klinicky dobrém stavu nemocných jsme postupovali konzervativně (ATB, parenterální terapie), postupně došlo ke zhojení píštěle. U jednoho nemocného byla recidivující píštěl úspěšně ošetřena implantací biodegradabilního stentu. Jedna nemocná s masivní dehiscencí anastomózy a následující peritonitidou byla ošetřena chirurgicky drenáží a laváží dutiny břišní. Na následky těžkého septického šoku nemocná exitovala. Ve dvou případech došlo k exitu nemocných na následky respirační insuficience s rozvojem ARDS syndromu. Respirační insuficienci s nutností UPV a založením tracheostomie jsme zaznamenali ve dvou případech. Méně závažné respirační komplikace jsme celkově zaznamenali u 5 nemocných (pneumonie 3x, fluidotorax 2x). Dehiscenci laparotomie jsme u jednoho nemocného ošetřili její resuturou a v jednom případě byl zánětlivý infiltrát v dutině břišní přeléčen antibiotiky. Třicetidenní mortalita našeho souboru byla 10,7 %. Medián doby hospitalizace byl 16 dnů v rozmezí od 10 do 80 dnů. Stadia a grading onemocnění dle definitivního histologického vyšetření resekátu byly klasifikovány na základě TNM klasifikace z roku 2009 (Tab. 1). V souboru operovaných nemocných byla zastoupena tato stadia onemocnění: I.A.: 2 (7,1 %) I.B.: 4 (14,3 %), II.A.: 6 (21,5 %), II.B.: 6 (21,5 %), III.A.: 7 (25 %), III.B.: 2 (7,1 %), III.C.: 1 (3,5 %). Všichni nemocní byli nadále dispenzarizováni na I. chirurgické klinice. První 3 roky po operaci byli klinicky kontrolováni každé 3 měsíce, 2x ročně bylo provedeno ultrasonografické vyšetření jater a RTG plic, 1x ročně endoskopické vyšetření. Dle klinického stavu bylo individuálně provedeno PET/CT vyšetření. Na generalizaci základního onemocnění zemřelo 6 nemocných, na centrální mozkovou příhodu 2 nemocní, na kardiální etiologii 1 nemocný a 1 nemocný na bronchopneumonii. Statisticky byly zhodnoceny výsledky dlouhodobého přežívání našich nemocných po proximální gastrektomii pomocí Kaplan-Meierovy křivky (Graf 1). Signifikantně kratší přežívání bylo zjištěno u pacientů s recidivou (průměrné přežívání 16 měsíců) než u pacientů bez recidivy (průměr 73 měsíců), p=0,001 Log-rank test (Graf 2). Výskyt recidivy zvyšuje riziko exitu 15x (RR=15,1, 95% CI 1,77−128; p=0,013).
Tab. 1. Sestava pacientů s proximální gastrektomií operovaných pro adenokarcinom GEJ (n=28 pacientů) Tab. 1: Set of patients with adenocarcinoma of the GEJ undergoing proximal gastrectomy (n=28 patients) 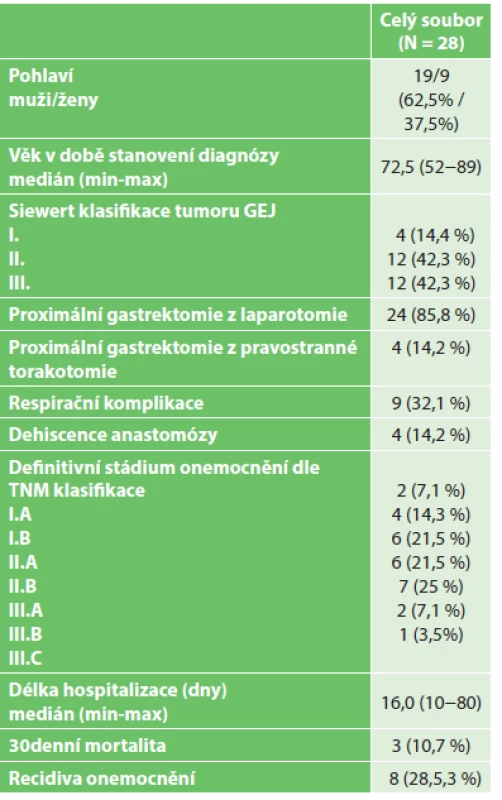
Graf 1. Kaplan-Meierova křivka přežívání souboru nemocný s adenokarcinomem GEJ, u kterých byla provedena proximální gastrektomie Graph 1: Kaplan-Meier curve showing the survival of patients with adenocarcinoma of the GEJ undergoing proximal gastrectomy 
Graf 2. Statistické zhodnocení přežívání nemocných po proximální gastrektomii. Signifikantně kratší přežívání bylo zjištěno u pacientů s recidivou (průměrné přežívání 16 měsíců) než u pacientů bez recidivy (průměr 73 měsíců), p=0,001 Log-rank test. Graph 2: Statistical evaluation of patient survival after proximal gastrectomy. Significantly shorter survival times were seen in patients with recurrence (mean survival of 16 months) compared to patients without recurrence (mean survival of 73 months); p=0.001; Log-rank test. 
Diskuze
Karcinom gastroezofageální junkce patří mezi skupinu nádorových onemocnění, která zejména v západní populaci zaznamenávají v posledních dekádách vzrůstající incidenci [1,2]. Mezinárodní organizace pro onemocnění jícnu (ISDE) klasifikuje 3 typy adenokarcinomu GEJ: typ I. adenokarcinom distálního jícnu (30−35 %), typ II. adenokarcinom kardie (20−25 %), typ III. subkardiální adenokarcinom žaludku (40−45 %) [3,4]. Tato klasifikace nádorů GEJ se nazývá Siewertova nebo Mnichovská klasifikace. U prvního typu byla jednoznačně potvrzena souvislost adenokarcinomu s refluxní nemocí jícnu a následným rozvojem Barrettova jícnu [5,6]. Karcinomy II. a III. typu jsou dávány do souvislosti s karcinomem žaludku. Metastazování těchto karcinomů je převážně lymfatickou cestou podél a. gastrica sinistra do oblasti truncus coeliacus s následným postižením paraaortální oblasti. Zhruba jedna třetina pacientů má metastázy v mediastinálních lymfatických uzlinách [1]. Mine et al. popisuje u karcinomů GEJ dominantní metastazování do abdominálních lymfatických uzlin, postižení mediastinálních lymfatických uzlin metastatickým procesem udává pouze v rozsahu 15−30 % [7]. U pacientů I. a II. typu se onemocnění klinicky manifestuje dysfagickými potížemi s váhovým úbytkem, u pacientů III. typu bez rozvoje stenózy zažívacího traktu odpovídá symptomatologie onemocnění nespecifickým dyspeptickým symptomům charakteristickým pro karcinom žaludku [8]. U pacientů ve stadiu onemocnění T1a je považovaná za dostatečnou radikální terapii endoskopická mukosektomie s kompletním histologickým vyšetřením resekčních linií resekované sliznice [9]. Tyto pacienty je nezbytné pravidelně endoskopicky dispenzarizovat první rok každé 3 měsíce, druhý rok co 6 měsíců a následující roky 1x ročně. U nemocných ve stadiu T1b je v literatuře popisován 20% výskyt metastatického procesu v lymfatických uzlinách a z tohoto důvodu je endoskopická mukosektomie kontraindikována a terapií je chirurgický resekční výkon. [10]. Základním pilířem léčby tumorů této lokality je kompletní resekce tumoru se systematickou lymfadenektomií v počtu odstraněných minimálně 15 lymfatických uzlin [11]. Cílem resekčního výkonu je dosáhnout R0 resekce, která umožňuje nemocným dosáhnout nejlepších výsledků dlouhodobého přežívání [12,13]. Za nejdůležitější prognostický faktor rekurence onemocnění je považována lokalita nádoru, infiltrace stěny nádorem a postižení lokoregionálních uzlin metastatickým rozsevem [14]. Operační léčba zahrnuje široké spektrum operačních výkonů v rozsahu od extenyivní ezofagogastrektomie k limitované resekci GE junkce. U tumorů typu I. se většina autorů (Siewert, Rahden) přiklání k ezofagektomii, která je u nemocných v pokročilejším stadiu onemocnění (T3, 4) většinou kombinována s neoadjuvantní onkologickou radiochemoterapií [8,15]. Na našem pracovišti jsou nemocní s I. typem tumoru v iniciálních stadiích onemocnění indikováni k transhiatální ezofagektomii, u pokročilejších stadií je primárně provedena neoadjuvantní terapie a následuje transhiatální ezofagektomie. U typu II. a III. je provedena totální gastrektomie s lymfadenektomií v rozsahu D2, dle výsledků histologického vyšetření je indikována adjuvantní onkologická terapie [16]. Horní resekční linie je popisována v bezpečné vzdálenosti od tumoru ve vzdálenosti 5−8 cm, za nepříznivý prognostický faktor je považováno provedení splenektomie nebo levostranné pankreatektomie [17,18]. Rahden popisuje morbiditu gastrektomie ve srovnání s ezofagektomií 1,9 % vs. 5,6 % [4]. U tumorů II. a III. je onkologická léčba součástí komplexní terapie karcinomů GEJ, dle literárních zdrojů však není jednoznačný konsenzus mezi neoadjuvantní nebo adjuvantní léčbou [15,19]. V literatuře bylo pro tyto případy rovněž diskutováno provedení ezofagogastrektomie, která však pro výraznou morbiditu a mortalitu nepřináší nemocným výrazný benefit [1,7]. V portfoliu chirurgických výkonů u II. a III. typu karcinomů GEJ je proximální gastrektomie s ezofagogastroanastomózou nebo s ezofagojejunoanastomózou s využitím jejunální interpozice [7,20]. Tento typ výkonu, jak uvádějí Siewert, Furukawa a další, je indikován pouze u časných tumorů s postižením sliznice nebo podslizničního vaziva bez přítomnosti metastatického procesu v lymfatických uzlinách [11]. Po proximální gastrektomii je ve srovnání s totální nebo subtotální gastrektomií častěji popisován výskyt refluxních potíží a stenózy anastomózy [20,21]. U nemocných s karcinomem GEJ s předpokladem vysokého rizika, že by vzhledem ke své polymorbiditě nezvládli náročný chirurgický výkon, je indikována pouze paliativní terapie (implantace stentu, paliativní onkologická léčba). Proximální gastrektomie je ve srovnání zejména s ezofagektomií méně extenzivní výkon, kdy ale lze zachovat principy onkologické radikality. Proximální gastrektomii jsme indikovali u selektovaného souboru nemocných s cílem provedení kurativního onkochirurgického výkonu. I přes relativně malý soubor polymorbidních starších nemocných jsme statisticky prokázali příznivé krátkodobé a dlouhodobé výsledky při provedení proximální gastrektomie pro karcinom GEJ u těchto nemocných [22]. V naší sestavě jsme ve vyšším procentu zaznamenali výskyt píštěle po použití kruhového stapleru průměru 21 mm, ke konstrukci anastomózy proto v případě malého průměru lumen jícnu tento typ stapleru nepoužíváme a anastomóza je konstruována ručně. Na základě vlastních zkušeností je nutné počítat s alternativou pozitivní resekční linie na jícnu při vyšetření na zmrzlo a dokončení výkonu z torakotomie.
Závěr
Chirurgická terapie u karcinomu GEJ je modifikována na základě Siewertovy klasifikace nádorů GEJ. U I. typu je výkonem transhiatální ezofagektomie s lokoregionální lymfadenektomií u II. a III. typu nádoru totální gastrektomie s lymfadenektomií v rozsahu D2. Proximální gastrektomie s regionální lymfadenektomií a obnovením pasáže s využitím ezofagogastroanastomózy s připojenou pyloroplastikou je vhodnou alternativou chirurgické léčby adenokarcinomů GEJ u selektovaných nemocných. Správně indikovaný výkon má příznivý vliv na krátkodobé i dlouhodobé výsledky operovaných nemocných.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
Doc. MUDr. Radek Vrba, Ph.D.
I. chirurgická klinika LF UP a FN
I. P. Pavlova 6
775 20 Olomouc
e-mail: radek.vrba@fnol.cz
Zdroje
1. Stein HJ, Feith M, Siewert JR. Cancer of the esophagogastric junction. Surgical Oncology 2000;9 : 35−41.
2. Devesa SS, Blot WJ, Fraumeni JF, Jr. Changing patterns in the incidence of esophageal and gastric carcinoma in the United States. Cancer 1998;83 : 2049−53.
3. Lagergren J, Bergstrom R, Lindgren A, et al. Symptomatic gastroesophageal reflux as a risk factor for esophageal adenocarcinoma. N Engl J Med 1999;340 : 825−31.
4. Rahden BH, Stein HJ, Siewert JR. Surgical management of esophagogastric junction tumors. World J Gastroenterol 2006;12 : 6608−13.
5. Mariette C, Castel B, Balon JM, et al. Extend of esophageal resection for adenocarcinoma of the esophagogastric junction. Eur J Surg Oncol 2003;29 : 588−93.
6. Feith M, Stein HJ, Siewert JR. Pattern of lymphatic spred of Barretts cancer. World J Surg 2003;27 : 1052−57.
7. Mine S, Sano T, Hiki N, et al. Thoracic lymph node involment in adenocarcinoma of the esophagogastric junction and lower esophageal squamous cell carcinoma relative to location of the proximal end of the tumor. Ann Surg Oncol 2014;21 : 1596−601.
8. Graham AJ, Finley RJ, Clifton JC, et al. Surgical management of adenocarcinoma of the cardia. Am J Surg 1998;175 : 418−21.
9. Soetikno R, Kaltenbach T, Yeh R, et al. Endoscopic mucosal resection for early cancer of the upper gastrointestinal tract. J Clin Oncol 2005;23 : 4490−8.
10. Sanomur Y, Oka S, Tanaka S, et al. Clinical validity of endoscopic submucosal dissection for submucosal invasive gastric cancer: a single-center study. Gastric cancer 2012;15 : 97−105.
11. Furukawa H, Hiratsuka M, Imaoka S, et al. Limited surgery for early gastric cancer in cardia. Annals of Surgical Oncology 1998;5 : 338−41.
12. Allum WH, Blazeby JM, Griffin SM, et al. Guidelines for management of esophageal and gastric cancer. Gut 2011;60 : 1449−72.
13. Ajani JA, Bentrem DJ, Besh S, et al. Gastric cancer, version2.2013: featured updates to NCCN guidelines. J Natl Compr Canc Netw 2013;11 : 531−46.
14. Lorenzen S, Blank S, Lordick F, et al. Prediction of response and prognosis by a score including only pretheraupeutic parameters in 410 neoadjuvant treated gastric cancer patiens. Ann Surg Oncol 2012;19 : 2119−27.
15. Walsh T, et al. A comparison of multimodal therapy and surgery for esophageal adenocarcinoma. N Eng J Med 1996;335 : 462−7.
16. Huang L, Xu AM. Adenocarcinoma of esophagogastric junction: controversial classification, surgical management, and clinicopathology, Chin J Cancer 2014;26 : 226−30.
17. Bonenkamp JJ, Hermans J, Sasako M, et al. Extended lyphm-node dissection for gastric cancer. N Engl J Med 1999;340 : 908−14.
18. Cuschieri A. Weeden S, Fielding J, et al. Patient survival after D1 and D2 resections for gastric cancer: long-term results of the MRC randomized surgical trial. Surgical Co-operative Group. Br J Cancer 1999;79 : 1522−30.
19. Tepper J, Krasna MJ, Niedzwiecki D, et al. Phase III trial of trimodality therapy with cisplatin, florouracil, radiotherapy, and surgery compared with surgery alone for esophagel cancer: CALGB 9781. J Clin Oncol 2008;26 : 236−44.
20. Jung do H, Ahn SH, Park do J, et al. Proximal gastrectomy for gastric cancer. J Gastric Cancer 2015;15 : 77−86.
21. Nai C, Liu Z, Lian X, et al. [Survival rate of proximal and total gastrectomy in treatment of esophagogastric junction adenocarcinoma (SiewertII( Types)] [Chinese] Zhonghua Wei Chang Wai Ke Za Zhi 2016;19 : 195−9.
22. Harwick RH, Williams GT. Staging of esophageal adenocarcinoma. Br J Surg 2002;89 : 1076−77.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2016 Číslo 12- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Jak dál se vzděláváním ve všeobecné chirurgii
- 10 let sleeve gastrectomy – tubulizace žaludku v České republice z hlediska operačního výkonu
- Princípy chirurgie IV
- Transfer nádorových buněk mezi pacientem a laboratorním zvířetem jako základní metodický přístup ke studiu kancerogeneze a identifikace biomarkerů
- Proximální gastrektomie u selektovaných pacientů s adenokarcinomem gastroezofageální junkce, bezprostřední a dlouhodobé výsledky operační terapie
- Dekompresivní kraniektomie
- Kvalita života u pacientů s Crohnovou chorobou po střevní resekci – první výsledky
- Purtscher-like retinopatia ako komplikácia akútnej pankreatitídy
- Raritní případ obrovského adenomu příštítného tělíska
- Castlemanova choroba - chirurgická léčba, kazuistiky
-
Zpráva z 10. mezinárodního kongresu malignit peritoneálního povrchu ve Washingtonu DC.,
17.–19. listopadu 2016 - Současné požadavky na trénink robotické chirurgie − zpráva z robotického kurzu
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Raritní případ obrovského adenomu příštítného tělíska
- 10 let sleeve gastrectomy – tubulizace žaludku v České republice z hlediska operačního výkonu
- Purtscher-like retinopatia ako komplikácia akútnej pankreatitídy
- Proximální gastrektomie u selektovaných pacientů s adenokarcinomem gastroezofageální junkce, bezprostřední a dlouhodobé výsledky operační terapie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



